Method Article
长期和短期造血干细胞的分离方法
摘要
我们提出了使用Hoxb5报告系统分离长期造血干细胞(LT-HSC)和短期造血干细胞(ST-HSC)的分步方案。
摘要
自我更新能力和多谱系分化潜力通常被认为是造血干细胞(HSCs)的决定性特征。然而,大量研究表明,HSC隔室中存在功能异质性。最近的单细胞分析报告了HSC区室内具有不同细胞命运的HSC克隆,这被称为偏倚HSC克隆。异质性或可重复性差的结果背后的机制知之甚少,特别是关于通过常规免疫染色移植纯化的HSC级分时的自我更新时间。因此,建立一种可重复的长期HSC(LT-HSC)和短期HSC(ST-HSC)的分离方法,由其自我更新的长度定义,对于克服这个问题至关重要。使用无偏的多步骤筛选,我们鉴定了一种转录因子 Hoxb5,它可能是小鼠造血系统中LT-HSC的独家标志物。基于这一发现,我们建立了 Hoxb5 报告小鼠系,并成功分离出LT-HSC和ST-HSC。在这里,我们描述了使用 Hoxb5 报告系统分离LT-HSC和ST-HSC的详细协议。这种分离方法将有助于研究人员更好地了解自我更新的机制以及HSC隔室中这种异质性的生物学基础。
引言
造血干细胞(HSCs)具有自我更新能力和多能性,位于造血层次结构的顶点1,2。1988年,Weissman及其同事首次证明可以使用流式细胞术3实现小鼠HSC的分离。随后,据报道,由细胞表面标志物组合定义的部分Lineage-c-Kit+Sca-1 + CD150 + CD34 / loFlk2−含有小鼠4,5,6,7,8中的所有HSC。
免疫表型定义的(谱系−c-Kit+Sca-1+CD150+CD34−/loFlk2−)HSC(以下简称pHSC)以前被认为是功能同质的。然而,最近的单细胞分析显示,pHSCs在其自我更新能力9,10和多能性11,12方面仍表现出异质性。具体而言,pHSC分数中似乎存在两个自我更新能力的人群:具有持续自我更新能力的长期造血干细胞(LT-HSCs)和具有短暂自我更新能力的短期造血干细胞(ST-HSCs)9,10。
迄今为止,区分LT-HSC和ST-HSC的自我更新能力的分子机制仍然知之甚少。根据细胞的自我更新能力分离两个细胞群并发现潜在的分子机制至关重要。还引入了几种报告系统来纯化LT-HSC13,14,15;然而,每个报告系统定义的LT-HSC纯度是可变的,迄今为止尚未实现独家LT-HSC纯化。
因此,开发LT-HSC和ST-HSC的分离系统将加速pHSC部分自我更新能力的研究。在分离LT-HSC和ST-HSCs时,一项使用多步骤,无偏倚筛选的研究确定了单个基因Hoxb5,该基因在pHSC部分16中异质表达。此外,对Hoxb5报告小鼠的骨髓分析显示,大约20%-25%的pHSC部分由Hoxb5 pos细胞组成。使用Hoxb5 pos pHSC和Hoxb5阴性pHSC的竞争性移植测定显示,只有Hoxb5pos pHSC具有长期自我更新能力,而Hoxb5阴性pHSC在短时间内失去其自我更新能力,表明Hoxb5在pHSC部分16中识别LT-HSC。
在这里,我们演示了使用 Hoxb5 报告系统分离LT-HSC和ST-HSC的分步协议。此外,我们提出了一种竞争性移植测定法来评估Hoxb5pos / neg pHSC的自我更新能力(图1)。该 Hoxb5 报告系统使我们能够前瞻性地分离LT-HSC和ST-HSC,并有助于了解LT-HSC特异性特征。
研究方案
所有描述的动物实验都得到了RIKEN生物系统动力学研究中心的批准。
1.受体小鼠的预处理
- 准备8-10周龄的雄性C57BL / 6同源小鼠作为受体小鼠。受体小鼠的数量取决于实验方案。我们通常为每种情况准备10-20只小鼠。
- 用补充有恩诺沙星(170mg / L)的灭菌水喂养小鼠。由于受辐照的受体小鼠极易感染,因此请保持笼子尽可能清洁。
注意:在照射前24小时开始补充抗生素,并在移植后持续3周以避免感染。
- 用补充有恩诺沙星(170mg / L)的灭菌水喂养小鼠。由于受辐照的受体小鼠极易感染,因此请保持笼子尽可能清洁。
- 全身照射
- 全身照射会破坏受体骨髓细胞,以确保供体细胞的植入。将受体小鼠转移到照射笼中。在移植前12-16小时以8.7Gy的单剂量照射受体小鼠。
注意:辐射剂量和时间可能因设备而异。致死辐射剂量应通过研究人员的辐照器和小鼠品系确认。 - 全身照射后将它们放回笼子。
- 全身照射会破坏受体骨髓细胞,以确保供体细胞的植入。将受体小鼠转移到照射笼中。在移植前12-16小时以8.7Gy的单剂量照射受体小鼠。
2. 采集供体骨髓细胞
- 准备一只12周大的雄性 Hoxb5-tri-mCherry小鼠,并通过CO2 暴露后颈椎脱位或使用当地动物伦理委员会批准的方法对小鼠实施安乐死。
注意:以下步骤描述了每只小鼠的试剂体积。 - 在无菌条件下,去除皮肤,露出骨骼(股骨,胫骨,骨盆,肱骨)。切开主要肌肉,并从小鼠身上取出骨头(股骨,胫骨,骨盆,肱骨)。将它们放入不含Ca 2+-和Mg2+的冰冷PBS的无菌细胞培养皿中。
- 使用镊子、小剪刀和湿巾修剪骨骼上的肌肉和纤维组织,以防止污染。在此步骤中注意不要折断骨头。丢弃任何骨折以保持无菌。
- 用70%乙醇(EtOH)对研钵和研杵进行消毒,并让它们完全干燥。用细胞染色缓冲液(补充有 2% 热灭活 FBS、2 mM EDTA、100 U/mL 青霉素和 100 μg/mL 链霉素)平衡 Ca 2+- 和 Mg2+ 的 PBS)。
- 将骨头放入研钵中,加入 3 mL 细胞染色缓冲液。用杵将骨头碾碎。通过轻柔移液分解细胞团块,并通过 100 μm 细胞过滤器将细胞悬液转移到 50 mL 管中。
- 重复步骤2.5,直到解决方案变得清晰。通常,三次就足够了。
3. 通过磁选分离c-kit+ 细胞
- 用于磁性分选的抗体染色
- 将样品在400× g 和4°C下离心5分钟。吸出上清液,并将沉淀重悬于1 mL细胞染色缓冲液中。加入 10 μL 大鼠 IgG (5 mg/mL) 以减少非特异性抗体结合,并使用 P1,000 移液器轻轻上下移液。在冰上孵育15分钟。
- 加入浓度为 4 μg/mL 的 c-Kit 抗体(克隆 2B8),并与 P1,000 移液器混合。在冰上孵育15分钟。
- 加入 5 mL 细胞染色缓冲液,并充分混合。将样品在400× g,4°C下离心5分钟。吸出上清液,并将沉淀重悬于500μL细胞染色缓冲液中。
- 加入 35 μL 抗 APC 微珠以富集 c-Kit+ 细胞,并与 P1,000 移液器混合。在冰上孵育15分钟。
- 加入 4-5 mL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟。吸出上清液,并将沉淀重悬于1 mL细胞染色缓冲液中。
- 对c-Kit+ 细胞进行磁性分选
- 按照制造商的说明对细胞进行分类。简而言之,用 3 mL 细胞染色缓冲液灌注磁性分选柱。通过 40 μm 细胞过滤器过滤样品 (1 mL),并将样品加载到磁性分选柱上。
- 通过加入 3 mL 细胞染色缓冲液洗涤 3 次。仅当色谱柱储液槽为空时添加细胞染色缓冲液。
- 将磁性分选柱放在冰冷的 15 mL 管顶部,并加入 5 mL 细胞染色缓冲液。通过将柱塞牢固地推入色谱柱中来冲洗细胞。将流出物保持在冰上。
注意:如果样品意外丢失,我们会保持流通直到实验结束。
4. 造血干细胞染色
- 将步骤3.2.3中制备的样品在400× g 和4°C下离心5分钟。吸出上清液。
- 将浓度为50μg/ mL的CD34抗体(克隆RAM34)加入沉淀中,并在冰上孵育60分钟。
注意:建议在用CD34孵育的第一个小时内制备支持细胞,以缩短处理时间。 - 根据 表1制备抗体预混液。向样品中加入 100 μL 预混液,并在冰上孵育 30 分钟。CD34抗原抗体(克隆;RAM34)需要90分钟才能充分染色。
- 加入 4-5 mL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟。吸出上清液。向沉淀中加入浓度为3μg/ mL的链霉亲和素-BUV737,并在冰上孵育30分钟。
- 加入 4-5 mL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟。吸出上清液,并将沉淀重悬于 400 μL 细胞染色缓冲液中。将样品放在冰上。
5. 支持细胞制备
- 准备12周龄的CD45.1 + CD45.2 +同源小鼠;理想情况下,这应该与供体小鼠的年龄相同。通过CO2暴露对小鼠实施安乐死,然后颈椎脱位或使用当地动物伦理委员会批准的方法。
注意:在提供的示例中,CD45.1 + CD45.2 +同源小鼠通过杂交B6在内部繁殖。CD45.1同源小鼠与C57BL / 6J小鼠16。 - 在无菌条件下,取股骨和胫骨,并将它们放入不含Ca 2+和Mg2+的冰冷PBS的无菌细胞培养皿中。用镊子和小剪刀修剪骨骼上的肌肉和纤维组织。
- 用锋利的无菌剪刀剪断骨头的两端。使用 23 G 针头和装有冰冷细胞悬浮缓冲液(不含Ca 2+ 和 Mg2+ 的 PBS,补充有 2% 热灭活 FBS、100 U/mL 青霉素和 100 μg/mL 链霉素)的 5 mL 注射器将骨髓冲洗到带有细胞悬浮缓冲液的无菌细胞培养皿中。通过轻柔移液分解细胞团块。
- 使用P1,000移液器通过40μm细胞过滤器过滤细胞悬液。使用血细胞计数器计数细胞悬液的细胞数,并制备含有1 x 106 细胞/ mL的骨髓细胞悬液。
- 将 200 μL 骨髓细胞悬液(2 x 105 个细胞)转移到 96 孔圆底板上。在冰上保持使用。
注意:建议使用圆底板,以便于细胞收集。
6. Hoxb5pos 或 Hoxb5负 pHSC 排序
- 浇口设置
- 将步骤 4.5 中制备的 400 μL 样品转移到带有 35 μm 细胞过滤器卡扣帽的圆底聚苯乙烯试管中。准备死细胞染色试剂,并根据制造商的说明在分析前将其添加到样品中。
- 打开流式细胞仪,根据制造商的说明启动分析软件。然后,按 加载并获取数据。
注意:建议使用配备五个激光器和一个70 μm喷嘴的流式细胞仪,以提高分选细胞的纯度。 - 排除双联体、死细胞和谱系阳性细胞后,门控谱系-c-Kit+Sca-1+级分。接下来,将 Flk2+ 部分排除在外。然后,在CD150 + CD34−/低级分中门控Hoxb5pos或Hoxb5阴性pHSC(图2)。对第一个实验中的光谱重叠进行补偿。
注意:Hoxb5阳性细胞预计占谱系-c-Kit+Sca-1 + CD150 + CD34 - /低Flk2−部分的20%-25%。
- Hoxb5pos 或 Hoxb5负 pHSC 排序
- 制备 1.5 mL 低蛋白结合管,其中含有 600 μL 不含Ca 2+ 和 Mg2+ 的 PBS,并补充有 10% 热灭活 FBS。
- 将 1.5 mL 低蛋白结合管放在分选收集装置上,并使用步骤 6.1.3 中设置的门控策略将 Hoxb5pos 或 Hoxb5阴性 pHSC 分选到 1.5 mL 管中。在第一次排序中,使用排序精度模式的产量。
- 将96孔板与步骤5.5中制备的支持细胞放在自动细胞沉积单元(ACDU)台上。将步骤6.2.2中制备的1.5 mL低蛋白结合管置于流式细胞仪的上样口。
- 使用步骤6.1.3中设置的门控策略将Hoxb5pos 或Hoxb5阴性 pHSC分类到具有支持细胞的96孔板中。对10个Hoxb5pos 或Hoxb5阴性 pHSC进行分类,以测试它们的自我更新能力。
注意:建议进行双重分选以提高纯度。在第二次分拣中,使用纯度作为推荐的分拣精度模式。 - 通常,在双重分选后收获500-1,000个Hoxb5pos pHSC和1,500-4,000个Hoxb5阴性 pHSC。在HSC分选后尽快进行移植程序,以提高细胞活力(理想情况下在1-2小时内)。
7. 移植
- 将步骤6.2.4中制备的HSC分类的96孔板放在冰上。在无菌条件下处理HSC分选的96孔板,最好在细胞罩中。
- 在气体麻醉诱导室中用2%异氟醚麻醉受体小鼠。动物完全麻醉后,将其取出,并将其侧放。为确保充分麻醉,请确认无运动以响应有害刺激。
- 确认适当麻醉后,尽快进行眶后注射,以防止小鼠恢复意识。眶后注射需要不到30秒。
注意:由于注射时间短,我们完成手术时无需在眼睛中使用眼药膏。但是,如果手术时间较长,我们建议使用眼药膏。 - 轻轻移液HSC分选的96孔板中的细胞以混合它们。使用30G胰岛素注射器收集分选板中的供体细胞,并将它们注射到受体小鼠的眶后静脉丛中。推荐的进样体积为 ≤200 μL。
- 观察直到小鼠有意识并在干净的笼子里移动。确认康复后,将它们放回笼子里。
8. 外周血分析
- 从尾静脉收集 50 μL 外周血,并用 100 μL 不含Ca 2+- 和 Mg2+ 的 PBS 和 2 mM EDTA 重悬。将所有样品转移到96孔板中。在400× g 和4°C下离心5分钟,弃去上清液。
- 加入 200 μL 红细胞裂解缓冲液,在冰上孵育 3 分钟。将样品在400× g 和4°C下离心5分钟,弃去上清液。再重复一次。
- 加入 200 μL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟,弃去上清液。
- 根据 表2制备抗体预混液。加入 50 μL 抗体预混液,在冰上孵育 30 分钟。
- 加入 150 μL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟,弃去上清液。
- 加入 200 μL 细胞染色缓冲液。将样品在400× g 和4°C下离心5分钟,弃去上清液。重悬于200 μL细胞染色缓冲液中,并根据制造商的说明在分析前加入死细胞染色试剂。
- 如前所述,使用流式细胞仪分析外周血嵌合体16.在移植后 4 周、8 周、12 周和 16 周采集血液,以遵循多系重建。代表性流式细胞术图如图 3所示。
结果
以前,已经使用竞争性移植测定法测量了自我更新能力,其中供体HSC被认为只有在观察到受体外周血中的多谱系供体细胞时才保持其自我更新能力17。此外,一些报告将LT-HSC定义为在第二次骨髓移植几个月后继续产生外周血细胞的细胞10,18。因此,为了比较它们的自我更新能力,将从Hoxb5报告小鼠中分离出的10只Hoxb5pos或Hoxb5阴性pHSC移植到具有2 x 105全骨髓细胞的致死照射原受者小鼠中。然后,在初次移植后16周,将从主要受体小鼠中分离的1 x 107骨髓细胞移植到致命照射的二级受体小鼠中,以评估长期自我更新能力(图1)。图2显示了Hoxb5-tri-mCherry小鼠骨髓分析的代表性流式细胞术图。由Lineage-c-Kit+Sca-1+CD150+CD34−/lo Flk2−定义的pHSC部分中约有20%-25%的细胞是Hoxb5pos pHSC,仅占小鼠骨髓的0.001%-0.00125%。图3显示了受体小鼠外周血分析的代表性流式细胞术图。分别制备CD45.2供体小鼠(Hoxb5-tri-mCherry小鼠)、CD45.1/CD45.2支持细胞和CD45.1受体小鼠,分别分析供体细胞、支持细胞和受体细胞。
图4显示了移植后4周,8周,12周和16周的受体小鼠的外周血分析,以确认供体嵌合体。这些分析表明,尽管Hoxb5 pos和Hoxb5阴性pHSC在移植后4周表现出相似的供体嵌合体,但仅在Hoxb5pos pHSC受者中观察到连续造血(图4A,B)。另一方面,Hoxb5阴性HSC在移植后8周开始失去产生造血细胞的能力(图4A,B)。在二次移植分析中,只有Hoxb5pos pHSC受者表现出强大的造血功能(图5A,B)。相比之下,在Hoxb5阴性pHSC受体小鼠中几乎没有观察到供体细胞,这表明Hoxb5阴性pHSC在原代受体小鼠移植后16周内失去自我更新能力。这些数据表明,Hoxb5表达可作为LT-HSC的特异性标志物。

图1:长期造血重建测定的实验示意图。 对受体小鼠进行致命照射并用10个HSC和2 x 105 个全骨髓细胞(支持细胞)竞争性移植。对于二次移植,从主要受体小鼠转移1 x 107 个全骨髓细胞。缩写:PB = 外周血;WBM = 整个骨髓。这个数字是从Chen等人16修改而来的。 请点击此处查看此图的大图。
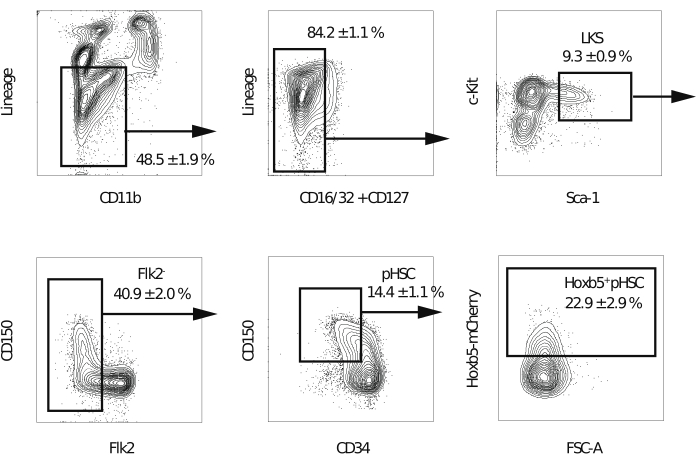
图 2:用于分拣 Hoxb5pos 和 Hoxb5阴性 pHSC 的门控策略。 代表性流式细胞术门控,用于在排除双联体和死细胞后分离 LKS、Flk2−、pHSC、Hoxb5pos 和 Hoxb5阴性 pHSC。这些值表示每个分数的百分比± s.d. (n = 3)。谱系包括B220,CD3ε,CD4,CD8a,Gr-1和Ter-119。这个数字是从Chen等人16修改而来的。 请点击此处查看此图的大图。
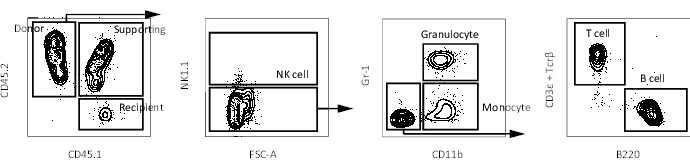
图3:受体小鼠外周血的代表性FACS图。门控方案用于在排除双联细胞和死细胞后鉴定受体小鼠中的外周血细胞(NK细胞、粒细胞、单核细胞、T细胞和B细胞)。请点击此处查看此图的大图。

图4:初次移植后受体小鼠的嵌合体。 (A)接受10个Hoxb5阴性(n = 9),Hoxb5lo(n = 13)或Hoxb5hi(n = 18)pHSC的主要受体在4周,8周,12周和16周时的嵌合体百分比。每列代表一个单独的鼠标。Hoxb5hi 分数被定义为 Hoxb5 表达的前 5%,其他定义为 Hoxb5lo 分数。(B)10例细胞原发性移植的平均供体谱系贡献。误差线表示 s.d。这个数字是从Chen等人16修改而来的。请点击此处查看此图的大图。

图5:二次移植后受体小鼠的嵌合 。 (A)全骨髓二次移植后4周,8周,12周和16周的嵌合体百分比。(B)全骨髓二级受体中按谱系划分的个体供体嵌合体。每行代表一个单独的鼠标。这个数字是从Chen等人16修改而来的。 请点击此处查看此图的大图。
| 抗体 | 克隆 | 浓度 | 荧光染料 |
| Flk-2 | A2-F10 | 4微克/毫升 | 全氟乙烯/电子面粉710 |
| CD150 | TC15-12F12.2 | 4微克/毫升 | BV421 |
| CD11b | M1/70 | 4微克/毫升 | BV711 |
| 铐-1 | D7 | 4微克/毫升 | BUV395 |
| CD16/32 | 93 | 4微克/毫升 | A-700 |
| CD127 | A7R34 | 4微克/毫升 | A-700 |
| CD3ε | 145-2C11 | 10微克/毫升 | 生物素 |
| CD4 | GK1.5 | 10微克/毫升 | 生物素 |
| CD8a | 53-6.7 | 10微克/毫升 | 生物素 |
| Gr-1 | RB6-8C5 | 10微克/毫升 | 生物素 |
| B220型 | RA3-6B2 | 10微克/毫升 | 生物素 |
| 三119 | TER119 | 10微克/毫升 | 生物素 |
表1:用于造血干细胞染色的抗体预混液。
| 抗体 | 克隆 | 浓度 | 荧光染料 |
| CD45.1 | 答20 | 1微克/毫升 | FITC |
| CD45.2 | 104 | 1微克/毫升 | 体育 |
| Gr-1 | RB6-8C5 | 2.5微克/毫升 | A700 |
| NK1.1 | PK136 | 1微克/毫升 | 全氯乙烯花青5.5 |
| CD11b | M1/70 | 1微克/毫升 | BUV395 |
| CD3ε | 145-2C11 | 1微克/毫升 | BV421 |
| TCRβ | H57-597 | 1微克/毫升 | BV421 |
| B220型 | RA3-6B2 | 1微克/毫升 | BV786 |
表 2:用于外周血细胞染色的抗体预混液。
讨论
传统上,已经制备了细胞表面标记定义的HSCs来研究HSC的功能,例如自我更新能力和多效性19,20,21。然而,免疫表型定义的(谱系−c-Kit+Sca-1+CD150+CD34−/loFlk2−)HSC部分包含两个离散的HSC群体:LT-HSC和ST-HSC9,10。因此,对真正的HSC,LT-HSCs的具体分析尚未实现。因此,使用Hoxb5报告系统分离LT-HSCs的方法将大大有利于寻找自我更新能力的分子机制。
在这里,我们将讨论该协议中的关键步骤。首先,步骤 1 到步骤 7 需要不间断地完成。这些步骤通常需要9-12小时,并且在整个过程中尽可能将样品保持在4°C以保持样品活力非常重要。接下来,从小鼠中收获大约1 x 108 个骨髓细胞。因此,我们需要使用足够体积的抗体来重现染色性能。此外,针对CD34抗原的抗体(克隆;RAM34)需要90分钟才能进行足够的染色,而对于其他抗体,30分钟就足够了。其次,照射通常会导致受体小鼠出现全血细胞减少症。如果受体来源的中性粒细胞在许多受体小鼠中持续存在,这表明辐射剂量不足。在这种情况下,建议优化辐射剂量。第三,如果大多数小鼠在移植后不久死亡,有两种可能的解释:支持细胞数量不足或眶后注射不成功。
几十年来,真正的HSC部分是均匀的还是异质的22,23,24一直存在争议。在这项研究中,接受Hoxb5pos pHSC移植的受体小鼠表现出不同的供体嵌合体和分化模式(图4A),表明该部分可能是异质的。然而,这些波动可能是由于使用未纯化的骨髓细胞作为支持细胞和个体小鼠的不同放射敏感性引起的25。
总之,我们已经展示了使用Hoxb5报告系统分离LT-HSC和ST-HSC的分步协议。迄今为止,LT-HSC的检测依赖于竞争性移植测定,这需要8个多月的时间。相比之下,Hoxb5报告系统使我们能够前瞻性地识别LT-HSC和ST-HSC,并将其用于各种功能分析。图4和图5还显示,Hoxb5表达水平似乎与第二受体小鼠的供体嵌合程度相关。此外,利用Hoxb5报告系统,我们之前发现LT-HSC和ST-HSCs以互补的方式工作,用于造血干细胞移植后的连续造血重建26。此外,我们证明了外源性Hoxb5表达可以部分逆转ST-HSCs的细胞命运到LT-HSCs的命运,这表明Hoxb5的存在与否解释了细胞表面标记定义的HSC部分27中自我更新能力的异质性。
除了这些发现之外,LT-HSCs的前瞻性分离使我们能够分析各种生理条件下的LT-HSC,例如衰老,炎症等。这些分析将极大地促进对LT-HSCs功能的理解。
披露声明
作者声明与本研究没有利益冲突。
致谢
我们非常感谢Hiroshi Kioninari在RIKEN BDR提供的动物护理和提供受体小鼠,以及神户大学实验室管理的小贺瞳,长坂加代子和宫桥正树。作者也非常感谢对这项工作的持续支持。Masanori Miyanishi得到了日本科学促进会(JSPS)KAKENHI资助号JP17K07407和JP20H03268,Mochida医学和药物研究纪念基金会,日本生命科学基金会,武田科学基金会,安斯泰来代谢紊乱研究基金会和AMED-PRIME,AMED的支持,资助号JP18gm6110020。 坂卷太郎由JSPS KAKENHI授权号JP21K20669和JP22K16334支持,并得到以下机构的支持JSPS核心到核心计划和RIKEN初级研究助理计划。Katsuyuki Nishi得到了JSPS授权号KAKENHI JP18J13408的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
参考文献
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。