Method Article
Metodo di isolamento per cellule staminali ematopoietiche a lungo e breve termine
In questo articolo
Riepilogo
Presentiamo un protocollo passo-passo per l'isolamento di cellule staminali ematopoietiche a lungo termine (LT-HSCs) e HSCs a breve termine (ST-HSCs) utilizzando il sistema reporter Hoxb5.
Abstract
La capacità di auto-rinnovamento e il potenziale di differenziazione multi-lineage sono generalmente considerati come le caratteristiche distintive delle cellule staminali ematopoietiche (HSC). Tuttavia, numerosi studi hanno suggerito che esiste eterogeneità funzionale nel compartimento HSC. Recenti analisi a singola cellula hanno riportato cloni HSC con diversi destini cellulari all'interno del compartimento HSC, che sono indicati come cloni HSC distorti. I meccanismi alla base di risultati eterogenei o scarsamente riproducibili sono poco compresi, soprattutto per quanto riguarda la durata dell'auto-rinnovamento quando le frazioni HSC purificate vengono trapiantate mediante immunocolorazione convenzionale. Pertanto, stabilire un metodo di isolamento riproducibile per le HSC a lungo termine (LT-HSC) e le HSC a breve termine (ST-HSC), definite dalla durata del loro auto-rinnovamento, è fondamentale per superare questo problema. Utilizzando uno screening imparziale multi-step, abbiamo identificato un fattore di trascrizione, Hoxb5, che potrebbe essere un marker esclusivo di LT-HSC nel sistema ematopoietico del topo. Sulla base di questa scoperta, abbiamo stabilito una linea di topi reporter Hoxb5 e isolato con successo LT-HSC e ST-HSC. Qui descriviamo un protocollo dettagliato per l'isolamento di LT-HSC e ST-HSC utilizzando il sistema di reporter Hoxb5 . Questo metodo di isolamento aiuterà i ricercatori a comprendere meglio i meccanismi di auto-rinnovamento e le basi biologiche di tale eterogeneità nel compartimento HSC.
Introduzione
Le cellule staminali ematopoietiche (HSC), che possiedono capacità di auto-rinnovamento e multipotenza, risiedono all'apice della gerarchia ematopoietica 1,2. Nel 1988, Weissman e colleghi hanno dimostrato per la prima volta che l'isolamento delle HSC di topo potrebbe essere ottenuto utilizzando la citometria a flusso3. Successivamente, una frazione definita da una combinazione di marcatori di superficie cellulare, Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−, è stata riportata per contenere tutte le HSC nei topi 4,5,6,7,8.
Le HSCs immunofenotipicamente definite (Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−) (di seguito, pHSCs) sono state precedentemente considerate funzionalmente omogenee. Tuttavia, recenti analisi monocellulari hanno rivelato che le pHSC mostrano ancora eterogeneità rispetto alla loro capacità di auto-rinnovamento9,10 e multipotenza11,12. In particolare, nella frazione pHSC sembrano esistere due popolazioni per quanto riguarda la loro capacità di auto-rinnovamento: le cellule staminali ematopoietiche a lungo termine (LT-HSCs), che hanno una capacità di auto-rinnovamento continuo, e le cellule staminali ematopoietiche a breve termine (ST-HSCs), che hanno capacità transitorie di auto-rinnovamento 9,10.
Ad oggi, i meccanismi molecolari della capacità di auto-rinnovamento che distinguono LT-HSCs e ST-HSCs rimangono poco conosciuti. È fondamentale isolare entrambe le popolazioni cellulari in base alle loro capacità di auto-rinnovamento e scoprire i meccanismi molecolari sottostanti. Sono stati inoltre introdotti diversi sistemi di segnalazione per purificare LT-HSC13,14,15; tuttavia, la purezza LT-HSC definita da ciascun sistema reporter è variabile e la purificazione LT-HSC esclusiva non è stata raggiunta fino ad oggi.
Pertanto, lo sviluppo di un sistema di isolamento per LT-HSC e ST-HSC accelererà la ricerca sulla capacità di auto-rinnovamento nella frazione pHSC. Nell'isolamento di LT-HSCs e ST-HSCs, uno studio che utilizza uno screening multi-step e imparziale ha identificato un singolo gene, Hoxb5, che è eterogeneamente espresso nella frazione pHSC16. Inoltre, l'analisi del midollo osseo dei topi reporter Hoxb5 ha rivelato che circa il 20% -25% della frazione pHSC è costituita da cellule Hoxb5 pos. Un test competitivo di trapianto utilizzando le pHSC Hoxb5 pos e le pHSC Hoxb5 neg ha rivelato che solo le pHSC Hoxb5pos possiedono una capacità di auto-rinnovamento a lungo termine, mentre le pHSC Hoxb5neg perdono la loro capacità di auto-rinnovamento entro un breve periodo, indicando che Hoxb5 identifica LT-HSC nella frazione pHSC16.
Qui, dimostriamo un protocollo passo-passo per isolare LT-HSC e ST-HSC utilizzando il sistema di reporter Hoxb5 . Inoltre, presentiamo un saggio di trapianto competitivo per valutare la capacità di auto-rinnovamento delle pHSC Hoxb5pos/neg (Figura 1). Questo sistema di reporter Hoxb5 ci consente di isolare prospetticamente LT-HSC e ST-HSC e contribuisce alla comprensione delle caratteristiche specifiche di LT-HSC.
Protocollo
Tutti gli esperimenti sugli animali descritti sono stati approvati dal RIKEN Center for Biosystems Dynamics Research.
1. Precondizionamento dei topi riceventi
- Preparare topi congeniti maschi C57BL / 6 di età compresa tra 8 e 10 settimane come topi riceventi. Il numero di topi riceventi dipende dal protocollo sperimentale. In genere prepariamo 10-20 topi per ogni condizione.
- Nutrire i topi con acqua sterilizzata integrata con enrofloxacina (170 mg / L). Poiché i topi riceventi irradiati sono altamente suscettibili alle infezioni, mantenere le gabbie il più pulite possibile.
NOTA: L'integrazione con antibiotici inizia 24 ore prima dell'irradiazione e continua per 3 settimane dopo il trapianto per evitare infezioni.
- Nutrire i topi con acqua sterilizzata integrata con enrofloxacina (170 mg / L). Poiché i topi riceventi irradiati sono altamente suscettibili alle infezioni, mantenere le gabbie il più pulite possibile.
- Irraggiamento totale del corpo
- L'irradiazione totale del corpo distrugge le cellule del midollo osseo ricevente per garantire l'attecchimento delle cellule donatrici. Trasferire i topi riceventi in una gabbia di irradiazione. Irradiare letalmente i topi riceventi con una singola dose di 8,7 Gy a 12-16 ore prima del trapianto.
NOTA: La dose e il tempo di radiazione possono variare a seconda dell'apparecchiatura. La dose letale di radiazioni deve essere confermata con l'irradiatore del ricercatore e il ceppo murino. - Riportarli nelle loro gabbie dopo l'irradiazione totale del corpo.
- L'irradiazione totale del corpo distrugge le cellule del midollo osseo ricevente per garantire l'attecchimento delle cellule donatrici. Trasferire i topi riceventi in una gabbia di irradiazione. Irradiare letalmente i topi riceventi con una singola dose di 8,7 Gy a 12-16 ore prima del trapianto.
2. Raccolta delle cellule del midollo osseo del donatore
- Preparare un topo Hoxb5-tri-mCherry maschio di 12 settimane e eutanasia il topo mediante esposizione a CO2 seguita da dislocazione cervicale o utilizzando metodi approvati dal comitato etico animale locale.
NOTA: il volume del reagente per mouse è descritto nei seguenti passaggi. - In condizioni sterili, rimuovere la pelle ed esporre le ossa (femore, tibia, bacino, omero). Taglia i muscoli principali e prendi le ossa (femore, tibia, bacino, omero) dal topo. Metterli in piatti di coltura cellulare sterile con PBS ghiacciato privo di Ca 2+ e Mg2+.
- Tagliare i muscoli e i tessuti fibrosi dalle ossa usando pinzette, piccole forbici e salviette per prevenire la contaminazione. Fare attenzione a non rompere le ossa durante questo passaggio. Scartare eventuali ossa rotte per mantenere la sterilità.
- Sterilizzare un mortaio e un pestello con etanolo al 70% (EtOH) e lasciarli asciugare completamente. Equilibrare con tampone colorante cellulare (PBS privo di Ca 2+ e Mg2+ integrato con FBS inattivato dal calore al 2%, 2 mM EDTA, 100 U / mL di penicillina e 100 μg / mL di streptomicina).
- Metti le ossa nella malta e aggiungi 3 ml di tampone colorante cellulare. Schiacciare le ossa aperte con il pestello. Disaggregare i grumi cellulari mediante pipettaggio delicato e trasferire la sospensione cellulare attraverso un filtro cellulare da 100 μm in un tubo da 50 ml.
- Ripetere il passaggio 2.5 fino a quando la soluzione diventa chiara. Di solito, tre volte sono sufficienti.
3. Separazione delle celle c-kit+ mediante ordinamento magnetico
- Colorazione anticorpale per la selezione magnetica
- Centrifugare i campioni a 400 x g e 4 °C per 5 minuti. Aspirare il surnatante e risospendere il pellet in 1 ml di tampone colorante cellulare. Aggiungere 10 μL di IgG di ratto (5 mg/ml) per ridurre il legame anticorpale non specifico e pipettare delicatamente su e giù usando una pipetta P1.000. Incubare su ghiaccio per 15 min.
- Aggiungere l'anticorpo c-Kit (clone 2B8) ad una concentrazione di 4 μg/ml e mescolare con una pipetta P1.000. Incubare su ghiaccio per 15 min.
- Aggiungere 5 ml di tampone colorante cellulare e mescolare bene. Centrifugare i campioni a 400 x g, 4 °C, 5 min. Aspirare il surnatante e risospendere il pellet in 500 μL di tampone colorante cellulare.
- Aggiungere 35 μL di microsfere anti-APC per arricchire le celle c-Kit+ e mescolare con una pipetta P1.000. Incubare su ghiaccio per 15 min.
- Aggiungere 4-5 ml di tampone colorante cellulare. Centrifugare i campioni a 400 x g e 4 °C per 5 minuti. Aspirare il surnatante e risospendere il pellet in 1 ml di tampone colorante cellulare.
- Ordinamento magnetico delle celle c-Kit+
- Seguire le istruzioni del produttore per ordinare le celle. In breve, innescare una colonna di selezione magnetica con 3 ml di tampone di colorazione cellulare. Filtrare il campione (1 ml) attraverso un filtro cellulare da 40 μm e caricare il campione sulla colonna di selezione magnetica.
- Lavare aggiungendo tre volte 3 ml di tampone colorante cellulare. Aggiungere il buffer di colorazione delle celle solo quando il serbatoio della colonna è vuoto.
- Posizionare la colonna di selezione magnetica sopra un tubo ghiacciato da 15 ml e aggiungere 5 ml di tampone colorante cellulare. Lavare le celle spingendo saldamente lo stantuffo nella colonna. Mantenere il flusso sul ghiaccio.
NOTA: In caso di perdita accidentale del campione, manteniamo il flusso fino alla fine dell'esperimento.
4. Colorazione delle cellule staminali ematopoietiche
- Centrifugare il campione preparato al punto 3.2.3 a 400 x g e 4 °C per 5 minuti. Aspira il surnatante.
- Aggiungere l'anticorpo CD34 (clone RAM34) ad una concentrazione di 50 μg/mL al pellet e incubare su ghiaccio per 60 minuti.
NOTA: Si raccomanda la preparazione delle cellule di supporto durante la prima ora di incubazione con CD34 per ridurre il tempo di elaborazione. - Preparare la miscela principale di anticorpi secondo la Tabella 1. Aggiungere 100 μL della miscela madre al campione e incubare su ghiaccio per 30 minuti. L'anticorpo per l'antigene CD34 (clone; RAM34) richiede 90 minuti per una colorazione sufficiente.
- Aggiungere 4-5 ml di tampone colorante cellulare. Centrifugare il campione a 400 x g e 4 °C per 5 min. Aspira il surnatante. Aggiungere streptavidina-BUV737 ad una concentrazione di 3 μg/mL al pellet e incubare su ghiaccio per 30 minuti.
- Aggiungere 4-5 ml di tampone colorante cellulare. Centrifugare il campione a 400 x g e 4 °C per 5 min. Aspirare il surnatante e risospendere il pellet in 400 μL di tampone colorante cellulare. Conservare il campione in ghiaccio.
5. Supporto alla preparazione cellulare
- Preparare un topo congenito CD45.1+ CD45.2+ di 12 settimane; Idealmente, questo dovrebbe avere la stessa età del topo donatore. Eutanasia del topo mediante esposizione a CO2 seguita da dislocazione cervicale o utilizzando metodi approvati dal comitato etico animale locale.
NOTA: Nell'esempio fornito, i topi congeniti CD45.1+ CD45.2+ sono stati allevati internamente incrociando B6. Topi congeniti CD45.1 con topi C57BL/6J16. - In condizioni sterili, prendere sia i femori che le tibie e metterli in piatti di coltura cellulare sterili con PBS ghiacciato privo di Ca 2 + e Mg2 +. Tagliare i muscoli e i tessuti fibrosi dalle ossa usando pinzette e piccole forbici.
- Tagliare entrambe le estremità delle ossa con forbici affilate e sterili. Utilizzare un ago da 23 G e una siringa da 5 ml riempita con tampone di sospensione cellulare ghiacciato (PBS privo di Ca 2+ e Mg2+ integrato con FBS inattivato dal calore al 2%, penicillina 100 U / mL e streptomicina 100 μg / ml) per lavare il midollo osseo in un piatto di coltura cellulare sterile con tampone di sospensione cellulare. Disaggregare i grumi cellulari mediante pipettaggio delicato.
- Filtrare la sospensione cellulare attraverso un filtro cellulare da 40 μm utilizzando una pipetta P1.000. Contare il numero di cellule della sospensione cellulare utilizzando un emocitometro e preparare una sospensione di cellule del midollo osseo contenente 1 x 106 cellule / ml.
- Trasferire 200 μL della sospensione di cellule del midollo osseo (2 x 105 cellule) su una piastra a fondo rotondo a 96 pozzetti. Conservare in ghiaccio fino all'uso.
NOTA: Le piastre a fondo arrotondato sono consigliate per una facile raccolta delle celle.
6. Hoxb5pos o Hoxb5neg pHSC ordinamento
- Configurazione del gating
- Trasferire 400 μL del campione preparato nella fase 4.5 in una provetta di polistirene a fondo tondo con un tappo a scatto con filtro cellulare da 35 μm. Preparare il reagente colorante a cellule morte e aggiungerlo al campione prima dell'analisi secondo le istruzioni del produttore.
- Accendere un citometro a flusso e avviare il software di analisi secondo le istruzioni del produttore. Quindi, premere Carica e acquisire i dati.
NOTA: Si consiglia un citometro a flusso dotato di cinque laser e un ugello da 70 μm per migliorare la purezza delle celle selezionate. - Dopo aver escluso doppietti, cellule morte e cellule positive al lignaggio, gate la frazione Lineage−c-Kit+Sca-1+. Quindi, elimina la frazione Flk2+. Quindi, gate Hoxb5pos o Hoxb5neg pHSCs nella frazione CD150+CD34−/low (Figura 2). Eseguire la compensazione per la sovrapposizione spettrale nel primo esperimento.
NOTA: Si prevede che le cellule Hoxb5 positive rappresentino il 20%-25% della frazione Lineage−c-Kit+Sca-1+CD150+CD34−/bassaFlk2−.
- Hoxb5pos o Hoxb5neg pHSC sorting
- Preparare un tubo legante a basso contenuto proteico da 1,5 ml con 600 μL di PBS privo di Ca 2+ e Mg2+ integrato con FBS inattivato dal calore al 10%.
- Impostare il tubo legante a basso contenuto proteico da 1,5 mL su un dispositivo di raccolta di smistamento e ordinare le pHSC Hoxb5pos o Hoxb5neg nella provetta da 1,5 mL utilizzando la strategia di gating impostata nel passaggio 6.1.3. Nel primo ordinamento, utilizzate la resa della modalità di precisione di ordinamento.
- Impostare la piastra a 96 pozzetti con le celle di supporto preparate al punto 5.5 sullo stadio dell'unità di deposizione automatica delle celle (ACDU). Impostare il tubo legante a basso contenuto proteico da 1,5 mL preparato al punto 6.2.2 sulla porta di carico di un citometro a flusso.
- Ordinare le pHSC Hoxb5pos o Hoxb5neg in una piastra a 96 pozzetti con le celle di supporto utilizzando la strategia di gating impostata nel passaggio 6.1.3. Ordina 10 hoxb5pos o Hoxb5neg pHSC per testare le loro capacità di auto-rinnovamento.
NOTA: si consiglia la doppia selezione per migliorare la purezza. Nel secondo ordinamento, utilizzare la purezza come modalità di precisione di ordinamento consigliata. - Tipicamente, 500-1.000 pHSC Hoxb5pos e 1.500-4.000 Hoxb5neg pHSC vengono raccolti dopo la doppia selezione. Procedere con le procedure di trapianto il più presto possibile dopo la selezione HSC per migliorare la vitalità cellulare (idealmente entro 1-2 ore).
7. Trapianto
- Posizionare sul ghiaccio la piastra a 96 pozzetti selezionata HSC preparata al punto 6.2.4. Maneggiare la piastra a 96 pozzetti selezionata HSC in condizioni sterili, idealmente in una cappa cellulare.
- Anestetizzare un topo ricevente con isoflurano al 2% in una camera di induzione per anestesia gassosa. Una volta che l'animale è completamente anestetizzato, rimuoverlo e posizionarlo su un fianco. Per garantire un'anestesia sufficiente, confermare nessun movimento in risposta a uno stimolo nocivo.
- Dopo la conferma della corretta anestesia, eseguire un'iniezione retroorbitale il prima possibile per evitare che il topo riprenda conoscenza. L'iniezione retroorbitale richiede meno di 30 s.
NOTA: Poiché il tempo di iniezione è breve, terminiamo la procedura senza applicare unguento oftalmico negli occhi. Tuttavia, se la procedura richiede più tempo, si consiglia l'uso di unguento oftalmico. - Pipettare delicatamente le celle nella piastra a 96 pozzetti selezionata HSC per mescolarle. Raccogliere le cellule donatrici nella piastra di selezione utilizzando una siringa da insulina da 30 G e iniettarle nel plesso venoso retroorbitale dei topi riceventi. Il volume iniettabile raccomandato è ≤200 μL.
- Osserva fino a quando i topi sono coscienti e si muovono in una gabbia pulita. Riportarli nelle loro gabbie dopo aver confermato il loro recupero.
8. Analisi del sangue periferico
- Raccogliere 50 μL di sangue periferico dalla vena caudale e risospenderlo con 100 μL di PBS privo di Ca 2+ e Mg2+ con 2 mM EDTA. Trasferire tutti i campioni in una piastra da 96 pozzetti. Centrifugare a 400 x g e 4 °C per 5 minuti ed eliminare il surnatante .
- Aggiungere 200 μL di tampone di lisi dei globuli rossi e incubare sul ghiaccio per 3 minuti. Centrifugare i campioni a 400 x g e 4 °C per 5 minuti ed eliminare il surnatante. Ripeti ancora una volta.
- Aggiungere 200 μL di tampone colorante cellulare. Centrifugare i campioni a 400 x g e 4 °C per 5 minuti ed eliminare il surnatante.
- Preparare la miscela principale di anticorpi secondo la Tabella 2. Aggiungere 50 μL di master mix anticorpale e incubare su ghiaccio per 30 minuti.
- Aggiungere 150 μL di tampone colorante cellulare. Centrifugare i campioni a 400 x g e 4 °C per 5 minuti ed eliminare il surnatante.
- Aggiungere 200 μL di tampone colorante cellulare. Centrifugare i campioni a 400 x g e 4 °C per 5 minuti ed eliminare il surnatante. Risospendere in 200 μL di tampone colorante cellulare e aggiungere il reagente colorante delle cellule morte prima dell'analisi secondo le istruzioni del produttore.
- Analizzare il chimerismo del sangue periferico utilizzando un citometro a flusso come descritto in precedenza16. Raccogliere il sangue a 4 settimane, 8 settimane, 12 settimane e 16 settimane dopo il trapianto per seguire la ricostituzione multi-linea. I grafici rappresentativi della citometria a flusso sono forniti nella Figura 3.
Risultati
In precedenza, la capacità di auto-rinnovamento è stata misurata utilizzando saggi di trapianto competitivi, in cui si ritiene che le HSC del donatore mantengano la loro capacità di auto-rinnovamento solo se si osservano cellule donatrici multi-laudio nel sangue periferico ricevente17. Inoltre, diversi rapporti definiscono le LT-HSC come cellule che continuano a produrre cellule del sangue periferico diversi mesi dopo il secondo trapianto di midollo osseo10,18. Pertanto, al fine di confrontare le loro capacità di auto-rinnovamento, 10 Hoxb5pos o Hoxb5neg pHSC isolati da topi reporter Hoxb5 sono stati trapiantati in topi riceventi primari irradiati letalmente con 2 x 105 cellule intere del midollo osseo. Quindi, 16 settimane dopo il trapianto primario, 1 x 107 cellule del midollo osseo isolate dai topi riceventi primari sono state trapiantate in topi riceventi secondari irradiati letalmente per valutare la capacità di auto-rinnovamento a lungo termine (Figura 1). La Figura 2 mostra i grafici rappresentativi della citometria a flusso dell'analisi del midollo osseo dei topi Hoxb5-tri-mCherry. Circa il 20%-25% delle cellule nella frazione pHSC definita da Lineage−c-Kit+Sca-1+CD150+CD34−/lo Flk2− eranopHSC Hoxb5pos, che rappresentano solo lo 0,001%-0,00125% del midollo osseo di topo. La Figura 3 mostra i grafici rappresentativi della citometria a flusso dell'analisi del sangue periferico nei topi riceventi. I topi donatori CD45.2 (topi Hoxb5-tri-mCherry), le cellule di supporto CD45.1 / CD45.2 e i topi riceventi CD45.1 sono stati preparati, rispettivamente, per analizzare separatamente le cellule donatrici, di supporto e riceventi.
La figura 4 mostra le analisi del sangue periferico nei topi riceventi a 4 settimane, 8 settimane, 12 settimane e 16 settimane dopo il trapianto per confermare il chimerismo del donatore. Queste analisi hanno rivelato che, sebbene Hoxb5 pos e Hoxb5neg pHSCs presentino chimerismo donatore simile 4 settimane dopo il trapianto, l'ematopoiesi continua è stata osservata solo nei riceventi di Hoxb5pos pHSC (Figura 4A,B). D'altra parte, le HSC Hoxb5neg hanno iniziato a perdere la capacità di produrre cellule ematopoietiche 8 settimane dopo il trapianto (Figura 4A,B). Nell'analisi del trapianto secondario, solo i riceventi di Hoxb5pos pHSC presentavano una robusta emopoiesi (Figura 5A,B). Al contrario, le cellule donatrici sono state difficilmente osservate nei topi riceventi di Hoxb5 neg pHSC, suggerendo che le pHSC Hoxb5neg perdono la loro capacità di auto-rinnovamento entro 16 settimane dal trapianto nei topi riceventi primari. Questi dati dimostrano che l'espressione di Hoxb5 può essere utilizzata come marcatore specifico per LT-HSCs.

Figura 1: Schema sperimentale per saggi di ricostituzione ematopoietica a lungo termine. I topi riceventi sono stati irradiati letalmente e trapiantati in modo competitivo con 10 HSC e 2 x 105 cellule intere del midollo osseo (cellule di supporto). Per i trapianti secondari, 1 x 107 cellule intere del midollo osseo sono state trasferite dai topi riceventi primari. Abbreviazioni: PB = sangue periferico; WBM = midollo osseo intero. Questa cifra è stata modificata da Chen et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
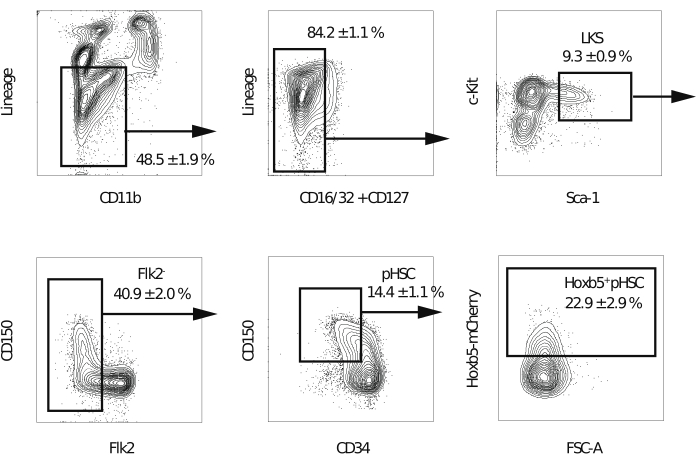
Figura 2: Strategia di gating per l'ordinamento di hoxb5pos e Hoxb5neg pHSC. Gating rappresentativo della citometria a flusso per isolare LKS, Flk2−, pHSC, Hoxb5pos e Hoxb5neg pHSCs dopo l'esclusione di doppietti e cellule morte. I valori indicano la percentuale di ogni frazione ± s.d. (n = 3). I lignaggi includono B220, CD3ε, CD4, CD8a, Gr-1 e Ter-119. Questa cifra è stata modificata da Chen et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
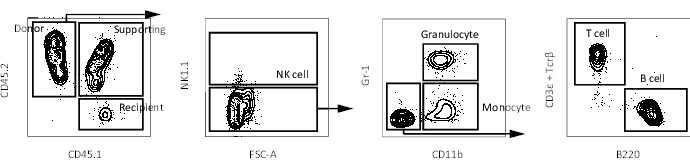
Figura 3: Grafici rappresentativi FACS di sangue periferico in un topo ricevente. Schema di gating per identificare le cellule del sangue periferico (cellule NK, granulociti, monociti, cellule T e cellule B) in un topo ricevente dopo l'esclusione di doppiette e cellule morte. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Chimerismo nei topi riceventi dopo trapianto primario. (A) Chimerismo percentuale a 4 settimane, 8 settimane, 12 settimane e 16 settimane nei riceventi primari che hanno ricevuto 10 Hoxb5neg (n = 9), Hoxb5lo (n = 13) o Hoxb5hi (n = 18) pHSC. Ogni colonna rappresenta un singolo mouse. La frazione Hoxb5hi è stata definita come il 5% superiore dell'espressione di Hoxb5 e altre come la frazione Hoxb5lo. (B) Il contributo medio della linea donatrice in 10 trapianti primari di cellule. Le barre di errore indicano il s.d. Questa cifra è stata modificata da Chen et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Chimerismo nei topi riceventi dopo il trapianto secondario. (A) Chimerismo percentuale a 4 settimane, 8 settimane, 12 settimane e 16 settimane dopo il trapianto secondario di midollo osseo intero. (B) Chimerismo individuale del donatore per lignaggio nei riceventi secondari del midollo osseo intero. Ogni linea rappresenta un singolo mouse. Questa cifra è stata modificata da Chen et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Anticorpo | Clone | Concentrazione | Fluorocromi |
| Flk-2 · | A2-F10 | 4 μg/mL | PerCP/eFlour710 |
| CD150 | TC15-12F12.2 | 4 μg/mL | BV421 |
| CD11b | M1/70 | 4 μg/mL | BV711 |
| SCA-1 | D7 | 4 μg/mL | BUV395 |
| CD16/32 | 93 | 4 μg/mL | A-700 · |
| CD127 | A7R34 | 4 μg/mL | A-700 · |
| CD3ε | 145-2C11 | 10 μg/mL | Biotina |
| CD4 | GK1,5 | 10 μg/mL | Biotina |
| CD8a | 53-6.7 | 10 μg/mL | Biotina |
| Gr-1 · | RB6-8C5 | 10 μg/mL | Biotina |
| B220 | RA3-6B2 | 10 μg/mL | Biotina |
| Ter119 | TER119 | 10 μg/mL | Biotina |
Tabella 1: Master mix di anticorpi per la colorazione delle cellule staminali ematopoietiche.
| Anticorpo | Clone | Concentrazione | Fluorocromi |
| CD45.1 | A20 | 1 μg/mL | FITC |
| CD45.2 | 104 | 1 μg/mL | PE |
| Gr-1 · | RB6-8C5 | 2,5 μg/mL | A700 |
| NK1.1 | PK136 | 1 μg/mL | PerCP-Cianina5.5 |
| CD11b | M1/70 | 1 μg/mL | BUV395 |
| CD3ε | 145-2C11 | 1 μg/mL | BV421 |
| TCRβ | H57-597 | 1 μg/mL | BV421 |
| B220 | RA3-6B2 | 1 μg/mL | BV786 |
Tabella 2: Master mix di anticorpi per la colorazione delle cellule del sangue periferico.
Discussione
Tradizionalmente, le HSC definite dai marcatori di superficie cellulare sono state preparate per studiare le funzioni delle HSC, come la capacità di auto-rinnovamento e la multi-potenza 19,20,21. Tuttavia, la frazione HSC immunofenotipicamente definita (Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−) contiene due popolazioni HSC discrete: LT-HSCs e ST-HSCs 9,10. Pertanto, l'analisi specifica delle HSC bonafide, LT-HSCs, non è stata ancora raggiunta. Di conseguenza, un metodo di isolamento per LT-HSCs che utilizza il sistema reporter Hoxb5 sarà significativamente vantaggioso per la ricerca dei meccanismi molecolari della capacità di auto-rinnovamento.
Qui, discuteremo i passaggi critici in questo protocollo. Innanzitutto, i passaggi da 1 a 7 devono essere completati senza interruzioni. Questi passaggi di solito richiedono 9-12 ore ed è importante mantenere i campioni a 4 °C durante queste procedure, per quanto possibile, al fine di mantenere la vitalità del campione. Successivamente, circa 1 x 108 cellule del midollo osseo vengono raccolte da un topo. Pertanto, è necessario utilizzare un volume sufficiente di anticorpi per riprodurre le prestazioni di colorazione. Inoltre, l'anticorpo per l'antigene CD34 (clone; RAM34) richiede 90 minuti per una colorazione sufficiente, mentre 30 minuti sono sufficienti per altri anticorpi. In secondo luogo, l'irradiazione di solito causa pancitopenia nei topi riceventi. Se i neutrofili derivati dal ricevente persistono in molti topi riceventi, ciò indica che la dose di radiazioni era insufficiente. In tal caso, si raccomanda l'ottimizzazione della dose di radiazioni. In terzo luogo, se la maggior parte dei topi muore subito dopo il trapianto, ci sono due possibili spiegazioni: un numero inadeguato di cellule di supporto o un'iniezione retroorbitale non riuscita.
Per decenni, è stato controverso se la frazione HSC in buona fede fosse omogenea o eterogenea22,23,24. In questo studio, i topi riceventi che hanno ricevuto il trapianto di Hoxb5pos pHSC hanno presentato diverse chimere del donatore e modelli di differenziazione (Figura 4A), indicando che questa frazione potrebbe essere eterogenea. Tuttavia, queste fluttuazioni potrebbero essere causate sia dall'uso di cellule del midollo osseo non purificate come cellule di supporto sia dalle diverse radiosensibilità dei singoli topi25.
In sintesi, abbiamo dimostrato un protocollo passo-passo per l'isolamento di LT-HSC e ST-HSC utilizzando il sistema di reporter Hoxb5. Ad oggi, la rilevazione delle LT-HSC è dipesa dal test competitivo del trapianto, che richiede più di 8 mesi. Al contrario, il sistema di reporter Hoxb5 ci consente di identificare prospetticamente sia LT-HSC che ST-HSC e utilizzarli per varie analisi funzionali. La Figura 4 e la Figura 5 mostrano anche che il livello di espressione di Hoxb5 sembra essere correlato con il grado di chimerismo del donatore nei secondi topi riceventi. Inoltre, sfruttando il sistema di segnalazione Hoxb5, abbiamo precedentemente rivelato che LT-HSCs e ST-HSCs lavorano in modo complementare per la ricostituzione ematopoietica continua dopo trapianto di cellule staminali ematopoietiche26. Inoltre, abbiamo dimostrato che l'espressione esogena di Hoxb5 potrebbe parzialmente invertire il destino cellulare delle ST-HSCs in quello delle LT-HSCs, indicando che la presenza o l'assenza di Hoxb5 spiega l'eterogeneità della capacità di auto-rinnovamento nella frazione27 definita dai marcatori di superficie cellulare.
Oltre a questi risultati, l'isolamento prospettico delle LT-HSC ci consente di analizzare le LT-HSC in varie condizioni fisiologiche, come l'invecchiamento, l'infiammazione e così via. Queste analisi faciliteranno notevolmente la comprensione delle funzioni delle LT-HSC.
Divulgazioni
Gli autori non dichiarano conflitti di interesse associati a questo studio.
Riconoscimenti
Riconosciamo con gratitudine Hiroshi Kiyonari per la cura degli animali e per aver fornito topi riceventi a RIKEN BDR, così come Hitomi Oga, Kayoko Nagasaka e Masaki Miyahashi per la gestione del laboratorio presso l'Università di Kobe. Gli autori apprezzano molto anche il continuo supporto per questo lavoro. Masanori Miyanishi è stato supportato dalla Japan Society for the Promotion of Science (JSPS) KAKENHI Grant Numbers JP17K07407 e JP20H03268, dalla Mochida Memorial Foundation for Medical and Pharmaceutical Research, dalla Life Science Foundation of Japan, dalla Takeda Science Foundation, dalla Astellas Foundation for Research on Metabolic Disorders e da AMED-PRIME, AMED con il numero di sovvenzione JP18gm6110020. Taro Sakamaki è supportato dai numeri di sovvenzione JSPS KAKENHI JP21K20669 e JP22K16334 ed è stato supportato da il programma JSPS Core-to-Core e il programma RIKEN Junior Research Associate. Katsuyuki Nishi è stato supportato da JSPS Grant Number KAKENHI JP18J13408.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
Riferimenti
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon