Method Article
طريقة العزل للخلايا الجذعية المكونة للدم على المدى الطويل والقصير
In This Article
Summary
نقدم بروتوكولا خطوة بخطوة لعزل الخلايا الجذعية المكونة للدم على المدى الطويل (LT-HSCs) والخلايا الجذعية المكونة للدم على المدى القصير (ST-HSCs) باستخدام نظام مراسل Hoxb5.
Abstract
تعتبر قدرة التجديد الذاتي وإمكانية التمايز متعدد السلالات بشكل عام من الخصائص المميزة للخلايا الجذعية المكونة للدم (HSCs). ومع ذلك ، فقد اقترحت العديد من الدراسات أن عدم التجانس الوظيفي موجود في حجرة HSC. أبلغت التحليلات الحديثة أحادية الخلية عن استنساخ HSC مع مصائر خلايا مختلفة داخل حجرة HSC ، والتي يشار إليها باسم استنساخ HSC المتحيز. الآليات الكامنة وراء النتائج غير المتجانسة أو غير القابلة للتكرار بشكل سيئ غير مفهومة ، خاصة فيما يتعلق بطول التجديد الذاتي عندما يتم زرع أجزاء HSC المنقاة بواسطة التلوين المناعي التقليدي. لذلك ، فإن إنشاء طريقة عزل قابلة للتكرار ل HSCs طويلة الأجل (LT-HSCs) و HSCs قصيرة الأجل (ST-HSCs) ، والتي تحددها مدة تجديدها الذاتي ، أمر بالغ الأهمية للتغلب على هذه المشكلة. باستخدام فحص متعدد الخطوات غير متحيز ، حددنا عامل النسخ ، Hoxb5 ، والذي قد يكون علامة حصرية ل LT-HSCs في نظام المكونة للدم في الفأر. بناء على هذه النتيجة ، أنشأنا خط ماوس مراسل Hoxb5 ونجحنا في عزل LT-HSCs و ST-HSCs. هنا نصف بروتوكولا مفصلا لعزل LT-HSCs و ST-HSCs باستخدام نظام مراسل Hoxb5 . ستساعد طريقة العزل هذه الباحثين على فهم آليات التجديد الذاتي والأساس البيولوجي لمثل هذا التباين في حجرة HSC بشكل أفضل.
Introduction
الخلايا الجذعية المكونة للدم (HSCs) ، التي تمتلك قدرة التجديد الذاتي وتعدد القدرات ، تقع في قمة التسلسل الهرمي المكونة للدم 1,2. في عام 1988 ، أظهر وايزمان وزملاؤه لأول مرة أنه يمكن تحقيق عزل HSCs للفأر باستخدام قياس التدفقالخلوي 3. بعد ذلك ، تم الإبلاغ عن جزء محدد بواسطة مجموعة من علامات سطح الخلية ، Lineage−c-Kit + Sca-1 + CD150 + CD34− / loFlk2− ، يحتوي على جميع HSCs في الفئران4،5،6،7،8.
تم اعتبار HSCs المعرفة المناعية (Lineage−c-Kit + Sca-1 + CD150 + CD34− / loFlk2−) HSCs (المشار إليها فيما يلي ، pHSCs) متجانسة وظيفيا. ومع ذلك ، فقد كشفت التحليلات الحديثة أحادية الخلية أن pHSCs لا تزال تظهر عدم تجانس فيما يتعلق بقدرتها على التجديد الذاتي9,10 وتعدد القدرات11,12. على وجه التحديد ، يبدو أن هناك مجموعتين سكانيتين في جزء pHSC فيما يتعلق بقدرتها على التجديد الذاتي: الخلايا الجذعية المكونة للدم على المدى الطويل (LT-HSCs) ، والتي تتمتع بقدرة التجديد الذاتي المستمر ، والخلايا الجذعية المكونة للدم على المدى القصير (ST-HSCs) ، والتي لديها قدرة تجديد ذاتي عابرة 9,10.
حتى الآن ، لا تزال الآليات الجزيئية لقدرة التجديد الذاتي التي تميز LT-HSCs و ST-HSCs غير مفهومة بشكل جيد. من الأهمية بمكان عزل كل من مجموعات الخلايا بناء على قدراتها على التجديد الذاتي واكتشاف الآليات الجزيئية الأساسية. كما تم إدخال العديد من أنظمة المراسلين لتنقية LT-HSCs13،14،15 ؛ ومع ذلك ، فإن نقاء LT-HSC المحدد من قبل كل نظام مراسل متغير ، ولم يتم تحقيق تنقية LT-HSC الحصرية حتى الآن.
لذلك ، فإن تطوير نظام عزل ل LT-HSCs و ST-HSCs سيسرع البحث فيما يتعلق بقدرة التجديد الذاتي في جزء pHSC. في عزل LT-HSCs و ST-HSCs ، حددت دراسة تستخدم فحصا متعدد الخطوات وغير متحيز جينا واحدا ، Hoxb5 ، يتم التعبير عنه بشكل غير متجانس في جزء pHSC16. بالإضافة إلى ذلك ، كشف تحليل نخاع العظم للفئران مراسل Hoxb5 أن ما يقرب من 20٪ -25٪ من جزء pHSC يتكون من خلايانقاط البيع Hoxb5. كشف فحص زرع تنافسي باستخدام Hoxb5pos pHSCs و Hoxb5 neg pHSCs أن Hoxb5 pos pHSCs فقط تمتلك قدرة تجديد ذاتي طويلة الأجل ، بينما تفقد Hoxb5neg pHSCs قدرتها على التجديد الذاتي في غضون فترة قصيرة ، مما يشير إلى أن Hoxb5 يحدد LT-HSCs فيجزء pHSC 16.
هنا ، نوضح بروتوكولا خطوة بخطوة لعزل LT-HSCs و ST-HSCs باستخدام نظام مراسل Hoxb5 . بالإضافة إلى ذلك ، نقدم مقايسة زرع تنافسية لتقييم قدرة التجديد الذاتي ل Hoxb5pos / neg pHSCs (الشكل 1). يسمح لنا نظام مراسل Hoxb5 هذا بعزل LT-HSCs و ST-HSCs بشكل مستقبلي ويساهم في فهم الخصائص الخاصة ب LT-HSC.
Protocol
تمت الموافقة على جميع التجارب على الحيوانات الموصوفة من قبل مركز RIKEN لأبحاث ديناميكيات النظم الحيوية.
1. التهيئة المسبقة للفئران المتلقية
- تحضير ذكور الفئران المتجانسة C57BL / 6 التي تتراوح أعمارها بين 8-10 أسابيع كفئران متلقية. يعتمد عدد الفئران المتلقية على البروتوكول التجريبي. نقوم عادة بإعداد 10-20 فئران لكل حالة.
- إطعام الفئران بالماء المعقم المكمل بإنروفلوكساسين (170 مجم / لتر). نظرا لأن الفئران المتلقية للإشعاع معرضة بشدة للإصابة بالعدوى ، حافظ على نظافة الأقفاص قدر الإمكان.
ملاحظة: تبدأ مكملات المضادات الحيوية قبل 24 ساعة من التشعيع وتستمر لمدة 3 أسابيع بعد الزرع لتجنب العدوى.
- إطعام الفئران بالماء المعقم المكمل بإنروفلوكساسين (170 مجم / لتر). نظرا لأن الفئران المتلقية للإشعاع معرضة بشدة للإصابة بالعدوى ، حافظ على نظافة الأقفاص قدر الإمكان.
- تشعيع الجسم بالكامل
- يؤدي تشعيع الجسم الكلي إلى تدمير خلايا نخاع العظم المتلقية لضمان تطعيم الخلايا المانحة. نقل الفئران المتلقية إلى قفص التشعيع. تشعيع الفئران المتلقية بشكل مميت بجرعة واحدة من 8.7 جراي في 12-16 ساعة قبل الزرع.
ملاحظة: قد تختلف جرعة الإشعاع والوقت حسب الجهاز. يجب تأكيد جرعة الإشعاع المميتة باستخدام إجهاد الباحث وسلالة الفأر. - إعادتهم إلى أقفاصهم بعد تشعيع الجسم الكلي.
- يؤدي تشعيع الجسم الكلي إلى تدمير خلايا نخاع العظم المتلقية لضمان تطعيم الخلايا المانحة. نقل الفئران المتلقية إلى قفص التشعيع. تشعيع الفئران المتلقية بشكل مميت بجرعة واحدة من 8.7 جراي في 12-16 ساعة قبل الزرع.
2. جمع خلايا نخاع العظم المانحة
- قم بإعداد ذكر فأر Hoxb5-tri-mCherry يبلغ من العمر 12 أسبوعا ، والقتل الرحيم للفأر عن طريق التعرض لثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم أو باستخدام طرق معتمدة من قبل لجنة أخلاقيات الحيوان المحلية.
ملاحظة: يتم وصف وحدة تخزين الكاشف لكل ماوس في الخطوات التالية. - في ظل ظروف معقمة ، قم بإزالة الجلد وفضح العظام (عظم الفخذ ، الساق ، الحوض ، عظم العضد). قطع العضلات الرئيسية ، وأخذ العظام (عظم الفخذ ، الساق ، الحوض ، العضد) من الفأر. ضعها في أطباق زراعة الخلايا المعقمة مع برنامج تلفزيوني خال من Ca 2+ و Mg2+ وبارد مثلج.
- قم بقص العضلات والأنسجة الليفية من العظام باستخدام الملقط والمقص الصغير والمناديل لمنع التلوث. احرص على عدم كسر العظام خلال هذه الخطوة. تخلص من أي عظام مكسورة من أجل الحفاظ على العقم.
- تعقيم هاون ومدقة مع 70 ٪ من الإيثانول (EtOH) ، والسماح لهم يجف تماما. يتوازن مع المخزن المؤقت لتلطيخ الخلايا (Ca 2+- و Mg2+ - PBS الخالي من CBS المكمل ب 2٪ FBS المعطل بالحرارة ، 2 مللي مول EDTA ، 100 وحدة / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين).
- ضع العظام في الهاون ، وأضف 3 مل من المخزن المؤقت لتلطيخ الخلايا. سحق العظام مفتوحة مع المدقة. قم بتقسيم كتل الخلية عن طريق السحب اللطيف ، وانقل تعليق الخلية من خلال مصفاة خلية 100 ميكرومتر إلى أنبوب سعة 50 مل.
- كرر الخطوة 2.5 حتى يصبح الحل واضحا. عادة ، ثلاث مرات كافية.
3. فصل خلايا c-kit + عن طريق الفرز المغناطيسي
- تلطيخ الأجسام المضادة للفرز المغناطيسي
- أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق. نضح الطاف، وإعادة تعليق بيليه في 1 مل من العازلة تلطيخ الخلايا. أضف 10 ميكرولتر من الجرذ IgG (5 مجم / مل) لتقليل ارتباط الأجسام المضادة غير المحددة ، وقم بالسحب برفق لأعلى ولأسفل باستخدام ماصة P1,000. احتضان على الجليد لمدة 15 دقيقة.
- أضف الجسم المضاد c-Kit (استنساخ 2B8) بتركيز 4 ميكروغرام / مل ، واخلطه مع ماصة P1,000. احتضان على الجليد لمدة 15 دقيقة.
- أضف 5 مل من المخزن المؤقت لتلطيخ الخلايا ، واخلطه جيدا. أجهزة الطرد المركزي العينات في 400 × ز ، 4 °C ، 5 دقائق. نضح المادة الطافية ، وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا.
- أضف 35 ميكرولتر من الميكروبيدات المضادة ل APC لإثراء خلايا c-Kit + ، واخلطها مع ماصة P1,000. احتضان على الجليد لمدة 15 دقيقة.
- أضف 4-5 مل من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق. نضح الطاف، وإعادة تعليق بيليه في 1 مل من العازلة تلطيخ الخلايا.
- فرز خلايا c-Kit + مغناطيسيا
- اتبع إرشادات الشركة المصنعة لفرز الخلايا. باختصار ، قم بإعداد عمود فرز مغناطيسي ب 3 مل من المخزن المؤقت لتلطيخ الخلايا. قم بتصفية العينة (1 مل) من خلال مصفاة خلية 40 ميكرومتر وقم بتحميل العينة على عمود الفرز المغناطيسي.
- يغسل بإضافة 3 مل من المخزن المؤقت لتلطيخ الخلايا ثلاث مرات. أضف المخزن المؤقت لتلطيخ الخلية فقط عندما يكون خزان العمود فارغا.
- ضع عمود الفرز المغناطيسي فوق أنبوب ثلجي بارد سعة 15 مل وأضف 5 مل من المخزن المؤقت لتلطيخ الخلايا. اغسل الخلايا عن طريق دفع المكبس بقوة في العمود. حافظ على التدفق على الجليد.
ملاحظة: في حالة فقدان العينة العرضي ، نحافظ على التدفق حتى نهاية التجربة.
4. تلطيخ الخلايا الجذعية المكونة للدم
- جهاز طرد مركزي العينة المحضرة في الخطوة 3.2.3 عند 400 × جم و 4 درجات مئوية لمدة 5 دقائق. نضح طاف.
- أضف الجسم المضاد CD34 (استنساخ RAM34) بتركيز 50 ميكروغرام / مل إلى الحبيبات ، واحتضانها على الجليد لمدة 60 دقيقة.
ملاحظة: يوصى بإعداد الخلايا الداعمة خلال الساعة الأولى من الحضانة باستخدام CD34 لتقصير وقت المعالجة. - تحضير مزيج الجسم المضاد الرئيسي وفقا للجدول 1. أضف 100 ميكرولتر من المزيج الرئيسي إلى العينة ، واحتضانها على الثلج لمدة 30 دقيقة. الجسم المضاد لمستضد CD34 (استنساخ; RAM34) يتطلب 90 دقيقة لتلطيخ كاف.
- أضف 4-5 مل من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينة عند 400 × جم و 4 درجات مئوية لمدة 5 دقائق. نضح طاف. أضف streptavidin-BUV737 بتركيز 3 ميكروغرام / مل إلى الحبيبات ، واحتضانها على الثلج لمدة 30 دقيقة.
- أضف 4-5 مل من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينة عند 400 × جم و 4 درجات مئوية لمدة 5 دقائق. نضح المادة الطافية ، وأعد تعليق الحبيبات في 400 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا. احتفظ بالعينة على الجليد.
5. دعم إعداد الخلية
- تحضير فأر متجانس CD45.1+ CD45.2+ يبلغ من العمر 12 أسبوعا ؛ من الناحية المثالية ، يجب أن يكون هذا هو نفس عمر الماوس المانح. القتل الرحيم للفأر عن طريق التعرض CO2 متبوعا بخلع عنق الرحم أو باستخدام طرق معتمدة من قبل لجنة أخلاقيات الحيوان المحلية.
ملاحظة: في المثال المقدم ، تم تربية الفئران المتجانسة CD45.1 + CD45.2 + في المنزل عن طريق عبور B6. CD45.1 الفئران المتجانسة مع الفئران C57BL / 6J16. - في ظل ظروف معقمة ، خذ كل من عظم الفخذ والساق ، وضعها في أطباق زراعة الخلايا المعقمة مع برنامج تلفزيوني خال من Ca 2 + و Mg2 + ، بارد مثلج. تقليم العضلات والأنسجة الليفية من العظام باستخدام ملاقط ومقص صغير.
- قطع طرفي العظام بمقص حاد ومعقم. استخدم إبرة 23 جم ومحقنة سعة 5 مل مملوءة بمحلول معلق للخلايا باردة الثلج (برنامج تلفزيوني خال من Ca 2+- و Mg2+ مكمل ب 2٪ FBS معطل بالحرارة بنسبة 2٪ ، و 100 وحدة / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين) لطرد نخاع العظم إلى طبق زراعة الخلايا المعقم مع مخزن مؤقت لتعليق الخلية. قم بتقسيم كتل الخلية عن طريق السحب اللطيف.
- قم بتصفية تعليق الخلية من خلال مصفاة خلية 40 ميكرومتر باستخدام ماصة P1,000. عد رقم خلية معلق الخلية باستخدام مقياس الدم وقم بإعداد معلق خلية نخاع العظم الذي يحتوي على 1 × 106 خلايا / مل.
- نقل 200 ميكرولتر من معلق خلايا نخاع العظم (2 × 105 خلايا) إلى صفيحة مستديرة القاع ذات 96 بئرا. الحفاظ على الجليد حتى الاستخدام.
ملاحظة: يوصى باستخدام الألواح ذات القاع المستدير لسهولة جمع الخلايا.
6. Hoxb5pos أو Hoxb5neg pHSC الفرز
- إعداد البوابات
- انقل 400 ميكرولتر من العينة المحضرة في الخطوة 4.5 إلى أنبوب اختبار بوليسترين مستدير القاع مع غطاء مصفاة خلية 35 ميكرومتر. تحضير كاشف تلطيخ الخلايا الميتة ، وإضافته إلى العينة قبل التحليل وفقا لتعليمات الشركة الصانعة.
- قم بتشغيل مقياس التدفق الخلوي ، وابدأ برنامج التحليل وفقا لتعليمات الشركة المصنعة. ثم اضغط على تحميل، واحصل على البيانات.
ملاحظة: يوصى باستخدام مقياس التدفق الخلوي المجهز بخمسة ليزر وفوهة 70 ميكرومتر لتعزيز نقاء الخلايا التي تم فرزها. - بعد استبعاد الثنائيات والخلايا الميتة والخلايا الإيجابية للنسب ، بوابة جزء Lineage−c-Kit + Sca-1+. بعد ذلك ، قم بإخراج جزء Flk2 +. بعد ذلك ، بوابة Hoxb5pos أو Hoxb5neg pHSCs في CD150 + CD34− / الكسر المنخفض (الشكل 2). إجراء تعويض عن التداخل الطيفي في التجربة الأولى.
ملاحظة: من المتوقع أن تمثل الخلايا الإيجابية Hoxb5 20٪ -25٪ من جزء Lineage −c-Kit + Sca-1 + CD150 + CD34 − / منخفضFlk2−.
- Hoxb5pos أو Hoxb5neg pHSC الفرز
- قم بإعداد أنبوب ربط منخفض البروتين سعة 1.5 مل مع 600 ميكرولتر من برنامج تلفزيوني خال من Ca 2+ و Mg2+ مكمل ب FBS معطل حراريا بنسبة 10٪.
- اضبط أنبوب ربط البروتين المنخفض 1.5 مل على جهاز جمع الفرز ، وقم بفرزHoxb5 pos أو Hoxb5neg pHSCs في أنبوب 1.5 مل باستخدام استراتيجية البوابة المحددة في الخطوة 6.1.3. في الفرز الأول ، استخدم العائد من وضع دقة الفرز.
- اضبط لوحة 96 بئرا مع الخلايا الداعمة المعدة في الخطوة 5.5 على مرحلة وحدة ترسيب الخلايا الآلية (ACDU). اضبط أنبوب الربط منخفض البروتين سعة 1.5 مل المحضر في الخطوة 6.2.2 على منفذ التحميل لمقياس التدفق الخلوي.
- قم بفرزHoxb5 pos أو Hoxb5neg pHSCs في لوحة 96 بئرا مع الخلايا الداعمة باستخدام استراتيجية البوابة المحددة في الخطوة 6.1.3. فرز 10 Hoxb5pos أو Hoxb5neg pHSCs لاختبار قدراتها على التجديد الذاتي.
ملاحظة: يوصى بالفرز المزدوج لتعزيز النقاء. في الفرز الثاني ، استخدم النقاء كوضع دقة الفرز الموصى به. - عادة ، يتم حصاد 500-1,000Hoxb5 pos pHSCs و 1,500-4,000 Hoxb5neg pHSCs بعد الفرز المزدوج. تابع إجراءات الزرع في أقرب وقت ممكن بعد فرز HSC لتعزيز صلاحية الخلية (من الناحية المثالية في غضون 1-2 ساعة).
7. زرع
- ضع الصفيحة المصنفة من قبل HSC والمكونة من 96 بئرا والمحضرة في الخطوة 6.2.4 على الثلج. تعامل مع اللوحة المصنفة من قبل HSC والمكونة من 96 بئرا في ظروف معقمة ، من الناحية المثالية في غطاء الخلية.
- تخدير الفأر المتلقي بنسبة 2٪ إيزوفلوران في غرفة تحريض التخدير بالغاز. بمجرد تخدير الحيوان بالكامل ، قم بإزالته ووضعه على جانبه. لضمان التخدير الكافي ، تأكد من عدم وجود حركة استجابة لمحفز ضار.
- بعد تأكيد التخدير المناسب ، قم بإجراء حقن مداري رجعي في أقرب وقت ممكن لمنع الماوس من استعادة وعيه. يستغرق الحقن المداري الخلفي أقل من 30 ثانية.
ملاحظة: نظرا لأن وقت الحقن قصير ، فإننا ننهي الإجراء دون وضع مرهم عيني في العينين. ومع ذلك ، إذا استغرق الإجراء وقتا أطول ، فإننا نوصي باستخدام مرهم العيون. - ماصة بلطف الخلايا في لوحة 96 بئر مرتبة HSC لخلطها. اجمع الخلايا المانحة في لوحة الفرز باستخدام حقنة أنسولين 30 جيجا ، وحقنها في الضفيرة الوريدية خلف الحجاج للفئران المتلقية. الحجم الموصى به عن طريق الحقن هو ≤200 ميكرولتر.
- راقب حتى تكون الفئران واعية وتتحرك في قفص نظيف. إعادتهم إلى أقفاصهم بعد التأكد من شفائهم.
8. تحليل الدم المحيطي
- اجمع 50 ميكرولتر من الدم المحيطي من الوريد الذيلي ، وأعد تعليقه ب 100 ميكرولتر من Ca 2 + - و Mg 2+ - PBS الخالي مع2 mM EDTA. نقل جميع العينات إلى لوحة 96 بئر. أجهزة الطرد المركزي عند 400 × جم و 4 درجات مئوية لمدة 5 دقائق ، وتخلص من المادة الطافية.
- أضف 200 ميكرولتر من محلول تحلل خلايا الدم الحمراء ، واحتضانها على الثلج لمدة 3 دقائق. أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق ، وتجاهل الطاف. كرر مرة أخرى.
- أضف 200 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق ، وتجاهل الطاف.
- تحضير مزيج الجسم المضاد الرئيسي وفقا للجدول 2. أضف 50 ميكرولتر من مزيج الأجسام المضادة الرئيسي ، واحتضانه على الثلج لمدة 30 دقيقة.
- أضف 150 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق ، وتجاهل الطاف.
- أضف 200 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا. أجهزة الطرد المركزي العينات في 400 × غرام و 4 درجة مئوية لمدة 5 دقائق ، وتجاهل الطاف. أعد التعليق في 200 ميكرولتر من المخزن المؤقت لتلطيخ الخلايا ، وأضف كاشف تلطيخ الخلايا الميتة قبل التحليل وفقا لتعليمات الشركة المصنعة.
- تحليل كيمرية الدم المحيطية باستخدام مقياس التدفق الخلوي كما هو موضح سابقا16. اجمع الدم في 4 أسابيع و 8 أسابيع و 12 أسبوعا و 16 أسبوعا بعد الزرع لمتابعة إعادة تكوين السلالات المتعددة. يتم توفير مخططات قياس التدفق الخلوي التمثيلي في الشكل 3.
النتائج
في السابق ، تم قياس قدرة التجديد الذاتي باستخدام مقايسات زرع تنافسية ، حيث يعتقد أن HSCs المانحة تحتفظ بقدرتها على التجديد الذاتي فقط إذا لوحظت خلايا متبرع متعددة السلالات في الدم المحيطي المتلقي17. بالإضافة إلى ذلك ، تحدد العديد من التقارير LT-HSCs على أنها خلايا تستمر في إنتاج خلايا الدم المحيطية بعد عدة أشهر من عملية زرع نخاع العظم الثانية10,18. لذلك ، من أجل مقارنة قدراتهم على التجديد الذاتي ، تم زرع 10 Hoxb5pos أو Hoxb5neg pHSCs المعزولة من الفئران المراسلة Hoxb5 في الفئران المتلقية الأولية المشععة بشكل مميت مع 2 × 105 خلايا نخاع العظم الكاملة. بعد ذلك ، بعد 16 أسبوعا من الزرع الأولي ، تم زرع 1 × 107 خلايا نخاع عظمي معزولة من الفئران المتلقية الأولية في الفئران المتلقية الثانوية المشععة بشكل مميت لتقييم قدرة التجديد الذاتي على المدى الطويل (الشكل 1). يوضح الشكل 2 مخططات قياس التدفق الخلوي التمثيلية لتحليل نخاع العظم للفئران Hoxb5-tri-mCherry . ما يقرب من 20٪ -25٪ من الخلايا في جزء pHSC المحدد بواسطة Lineage−c-Kit + Sca-1 + CD150 + CD34− / loFlk2− كانت Hoxb5pos pHSCs ، والتي تمثل 0.001٪ -0.00125٪ فقط من نخاع عظم الفأر. يعرض الشكل 3 مخططات قياس التدفق الخلوي التمثيلية لتحليل الدم المحيطي في الفئران المتلقية. تم إعداد الفئران المانحة CD45.2 (الفئران Hoxb5-tri-mCherry ) والخلايا الداعمة CD45.1 / CD45.2 والفئران المتلقية CD45.1 ، على التوالي ، لتحليل الخلايا المانحة والداعمة والمتلقية بشكل منفصل.
يوضح الشكل 4 تحليلات الدم المحيطية في الفئران المتلقية في 4 أسابيع و 8 أسابيع و 12 أسبوعا و 16 أسبوعا بعد الزرع لتأكيد الخيمرية المانحة. كشفت هذه التحليلات أنه على الرغم من أن Hoxb5pos و Hoxb5neg pHSCs يقدمان خيالية مماثلة للمتبرعين بعد 4 أسابيع من الزرع ، فقد لوحظ تكون الدم المستمر فقط في متلقي Hoxb5pos pHSC (الشكل 4A ، B). من ناحية أخرى ، بدأت Hoxb5neg HSCs تفقد القدرة على إنتاج خلايا المكونة للدم بعد 8 أسابيع من الزرع (الشكل 4A ، B). في تحليل الزرع الثانوي ، قدم متلقو Hoxb5pos pHSC فقط تكون الدم القوي (الشكل 5 أ ، ب). في المقابل ، بالكاد لوحظت الخلايا المانحة في الفئران المتلقية Hoxb5 neg pHSC ، مما يشير إلى أن Hoxb5neg pHSCs تفقد قدرتها على التجديد الذاتي في غضون 16 أسبوعا بعد الزرع في الفئران المتلقية الأولية. توضح هذه البيانات أنه يمكن استخدام تعبير Hoxb5 كعلامة محددة ل LT-HSCs.

الشكل 1: مخطط تجريبي لمقايسات إعادة تكوين المكونة للدم على المدى الطويل. تم تشعيع الفئران المتلقية بشكل مميت وزرعها بشكل تنافسي مع 10 HSCs و 2 × 105 خلايا نخاع العظم الكاملة (الخلايا الداعمة). بالنسبة لعمليات الزرع الثانوية ، تم نقل 1 × 107 خلايا نخاع عظمي كاملة من الفئران المتلقية الأولية. الاختصارات: PB = الدم المحيطي. WBM = نخاع العظم الكامل. تم تعديل هذا الرقم من Chen et al.16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
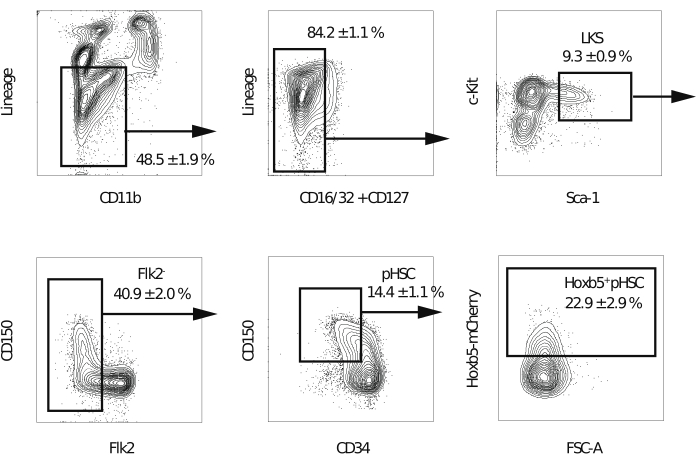
الشكل 2: استراتيجية البوابات لفرز Hoxb5pos و Hoxb5neg pHSCs. بوابة قياس التدفق الخلوي التمثيلي لعزل LKS و Flk2− و pHSC و Hoxb5pos و Hoxb5neg pHSCs بعد استبعاد الثنائيات والخلايا الميتة. تشير القيم إلى النسبة المئوية لكل كسر ± s.d. (n = 3). تشمل الأنساب B220 و CD3ε و CD4 و CD8a و Gr-1 و Ter-119. تم تعديل هذا الرقم من Chen et al.16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
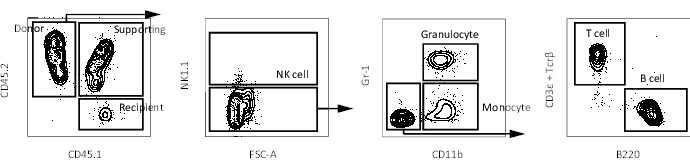
الشكل 3: مخططات FACS التمثيلية للدم المحيطي في فأر متلقي. مخطط بوابة لتحديد خلايا الدم المحيطية (الخلايا القاتلة الطبيعية ، المحببة ، الوحيدات ، الخلية التائية ، والخلية البائية) في الفأر المتلقي بعد استبعاد الخلايا المزدوجة والميتة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الخيمرية في الفئران المتلقية بعد الزرع الأولي. (أ) النسبة المئوية للخيمرية في 4 أسابيع و 8 أسابيع و 12 أسبوعا و 16 أسبوعا في المتلقين الأساسيين الذين يتلقون 10 Hoxb5neg (n = 9) أو Hoxb5lo (n = 13) أو Hoxb5hi (n = 18) pHSCs. يمثل كل عمود ماوس فردي. تمتعريف جزء Hi Hoxb5 على أنه أعلى 5٪ من تعبير Hoxb5 والبعض الآخر على أنه كسر Hoxb5lo. (ب) متوسط مساهمة نسب المتبرع في 10 عمليات زرع أولية للخلايا. تشير أشرطة الخطأ إلى s.d. تم تعديل هذا الرقم من Chen et al.16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: الخيمرية في الفئران المتلقية بعد الزرع الثانوي. أ: النسبة المئوية للخيمرية في 4 أسابيع و8 أسابيع و12 أسبوعا و16 أسبوعا بعد الزرع الثانوي لنخاع العظم بالكامل. (ب) الوهم الفردي للمتبرع حسب النسب في المتلقين الثانويين لنخاع العظم الكامل. يمثل كل سطر ماوس فردي. تم تعديل هذا الرقم من Chen et al.16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| جسم | استنساخ | تركيز | الفلوروكرومات |
| فلك-2 | A2-F10 | 4 ميكروغرام / مل | بيرسي بي/إيفلور710 |
| سي دي 150 | TC15-12F12.2 | 4 ميكروغرام / مل | BV421 |
| CD11b | م1/70 | 4 ميكروغرام / مل | BV711 |
| سكا-1 | د7 | 4 ميكروغرام / مل | بوف 395 |
| CD16/32 | 93 | 4 ميكروغرام / مل | أ -700 |
| سي دي 127 | أ 7 ر34 | 4 ميكروغرام / مل | أ -700 |
| CD3ε | 145-2 ج11 | 10 ميكروغرام / مل | البيوتين |
| سي دي 4 | جي كي 1.5 | 10 ميكروغرام / مل | البيوتين |
| CD8a | 53-6.7 | 10 ميكروغرام / مل | البيوتين |
| غرام -1 | RB6-8C5 | 10 ميكروغرام / مل | البيوتين |
| ب 220 | RA3-6B2 | 10 ميكروغرام / مل | البيوتين |
| تير 119 | تير 119 | 10 ميكروغرام / مل | البيوتين |
الجدول 1: مزيج الجسم المضاد الرئيسي لتلطيخ الخلايا الجذعية المكونة للدم.
| جسم | استنساخ | تركيز | الفلوروكرومات |
| CD45.1 | أ 20 | 1 ميكروغرام / مل | فيتك |
| CD45.2 | 104 | 1 ميكروغرام / مل | بى |
| غرام -1 | RB6-8C5 | 2.5 ميكروغرام / مل | أ 700 |
| NK1.1 | PK136 | 1 ميكروغرام / مل | بيركب-سيانين5.5 |
| CD11b | م1/70 | 1 ميكروغرام / مل | بوف 395 |
| CD3ε | 145-2 ج11 | 1 ميكروغرام / مل | BV421 |
| TCRβ | ح57-597 | 1 ميكروغرام / مل | BV421 |
| ب 220 | RA3-6B2 | 1 ميكروغرام / مل | BV786 |
الجدول 2: مزيج الأجسام المضادة الرئيسي لتلطيخ خلايا الدم المحيطية.
Discussion
تقليديا ، تم إعداد HSCs المحددة بعلامات سطح الخلية لدراسة وظائف HSCs ، مثل قدرة التجديد الذاتي ومتعددة الإمكانات19،20،21. ومع ذلك ، فإن جزء HSC المحدد بشكل مناعي (Lineage −c-Kit + Sca-1 + CD150 + CD34− / loFlk2−) يحتوي على مجموعتين منفصلتين من HSC: LT-HSCs و ST-HSCs 9,10. لذلك ، لم يتم بعد إجراء تحليل محدد ل HSCs الحسنة النية ، LT-HSCs. وفقا لذلك ، فإن طريقة عزل LT-HSCs باستخدام نظام مراسل Hoxb5 ستفيد بشكل كبير في البحث عن الآليات الجزيئية لقدرة التجديد الذاتي.
هنا ، سنناقش الخطوات الحاسمة في هذا البروتوكول. أولا ، يجب إكمال الخطوة من 1 إلى الخطوة 7 دون انقطاع. تستغرق هذه الخطوات عادة من 9 إلى 12 ساعة ، ومن المهم الاحتفاظ بالعينات عند 4 درجات مئوية طوال هذه الإجراءات ، قدر الإمكان ، من أجل الحفاظ على صلاحية العينة. بعد ذلك ، يتم حصاد ما يقرب من 1 × 108 خلايا نخاع العظم من الفأر. وبالتالي ، نحتاج إلى استخدام كمية كافية من الأجسام المضادة من أجل إعادة إنتاج أداء التلطيخ. بالإضافة إلى ذلك ، فإن الجسم المضاد لمستضد CD34 (استنساخ ؛ RAM34) يتطلب 90 دقيقة لتلطيخ كاف ، في حين أن 30 دقيقة كافية للأجسام المضادة الأخرى. ثانيا ، عادة ما يسبب التشعيع قلة الكريات الشاملة في الفئران المتلقية. إذا استمرت العدلات المشتقة من المتلقي في العديد من الفئران المتلقية ، فهذا يشير إلى أن جرعة الإشعاع لم تكن كافية. في مثل هذه الحالة ، يوصى بتحسين جرعة الإشعاع. ثالثا ، إذا ماتت معظم الفئران بعد فترة وجيزة من عملية الزرع ، فهناك تفسيران محتملان: عدد غير كاف من الخلايا الداعمة أو الحقن الحجاجي غير الناجح.
لعقود من الزمان ، كان من المثير للجدل ما إذا كان جزء HSC الحسن النية متجانسا أو غير متجانس22،23،24. في هذه الدراسة ، قدمت الفئران المتلقية التي تلقت زرع Hoxb5pos pHSC وهما مختلفا للمتبرعين وأنماط تمايز (الشكل 4 أ) ، مما يشير إلى أن هذا الجزء يمكن أن يكون غير متجانس. ومع ذلك ، يمكن أن تحدث هذه التقلبات بسبب استخدام خلايا نخاع العظم غير المنقاة كخلايا داعمة والحساسيات الإشعاعية المختلفة للفئران الفردية25.
باختصار ، لقد أظهرنا بروتوكولا خطوة بخطوة لعزل LT-HSCs و ST-HSCs باستخدام نظام مراسل Hoxb5. حتى الآن ، يعتمد اكتشاف LT-HSCs على مقايسة الزرع التنافسية ، والتي تتطلب أكثر من 8 أشهر. في المقابل ، يمكننا نظام مراسل Hoxb5 من تحديد كل من LT-HSCs و ST-HSCs بشكل مستقبلي واستخدامها في التحليلات الوظيفية المختلفة. يوضح الشكل 4 والشكل 5 أيضا أن مستوى تعبير Hoxb5 يبدو مرتبطا بدرجة الخيمرية المانحة في الفئران المتلقية الثانية. بالإضافة إلى ذلك ، بالاستفادة من نظام مراسل Hoxb5 ، كشفنا سابقا أن LT-HSCs و ST-HSCs يعملان بطريقة تكميلية لإعادة تكوين المكونة للدم المستمر بعد زرع الخلايا الجذعية المكونة للدم26. علاوة على ذلك ، أثبتنا أن تعبير Hoxb5 الخارجي يمكن أن يعكس جزئيا مصير الخلية ل ST-HSCs إلى مصير LT-HSCs ، مما يشير إلى أن وجود أو عدم وجود Hoxb5 يفسر عدم تجانس قدرة التجديد الذاتي في جزء HSC المحدد بعلامة سطح الخلية27.
بالإضافة إلى هذه النتائج ، فإن العزل المحتمل ل LT-HSCs يسمح لنا بتحليل LT-HSCs في ظل ظروف فسيولوجية مختلفة ، مثل الشيخوخة والالتهاب وما إلى ذلك. ستسهل هذه التحليلات إلى حد كبير فهم وظائف LT-HSCs.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح مرتبط بهذه الدراسة.
Acknowledgements
نحن نعترف بامتنان هيروشي كيوناري لرعاية الحيوانات ولتوفير الفئران المتلقية في RIKEN BDR ، وكذلك هيتومي أوغا وكايوكو ناغازاكا وماساكي مياهاشي لإدارة المختبرات في جامعة كوبي. كما يقدر المؤلفون تقديرا كبيرا الدعم المستمر لهذا العمل. تم دعم Masanori Miyanishi من قبل الجمعية اليابانية لتعزيز العلوم (JSPS) أرقام منحة KAKENHI JP17K07407 و JP20H03268 ، ومؤسسة Mochida التذكارية للبحوث الطبية والصيدلانية ، ومؤسسة علوم الحياة في اليابان ، ومؤسسة Takeda للعلوم ، ومؤسسة Astellas لأبحاث الاضطرابات الأيضية ، و AMED-PRIME ، AMED بموجب رقم المنحة JP18gm6110020. تارو ساكاماكي مدعوم من قبل أرقام منحة JSPS KAKENHI JP21K20669 و JP22K16334 وتم دعمه من قبل برنامج JSPS من النواة إلى النواة وبرنامج RIKEN للباحثين الصغار. تم دعم كاتسويوكي نيشي من قبل رقم منحة JSPS KAKENHI JP18J13408.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
References
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved