Method Article
Isolationsmethode für lang- und kurzfristige hämatopoetische Stammzellen
In diesem Artikel
Zusammenfassung
Wir stellen ein Schritt-für-Schritt-Protokoll für die Isolierung von langfristigen hämatopoetischen Stammzellen (LT-HSCs) und Kurzzeit-HSCs (ST-HSCs) mit dem Hoxb5-Reportersystem vor.
Zusammenfassung
Die Fähigkeit zur Selbsterneuerung und das Differenzierungspotenzial mehrerer Linien gelten allgemein als die bestimmenden Merkmale hämatopoetischer Stammzellen (HSCs). Zahlreiche Studien deuten jedoch darauf hin, dass im HSC-Kompartiment funktionelle Heterogenität besteht. Neuere Einzelzellanalysen haben über HSC-Klone mit unterschiedlichen Zellschicksalen innerhalb des HSC-Kompartiments berichtet, die als biased HSC-Klone bezeichnet werden. Die Mechanismen, die heterogenen oder schlecht reproduzierbaren Ergebnissen zugrunde liegen, sind wenig verstanden, insbesondere im Hinblick auf die Dauer der Selbsterneuerung, wenn gereinigte HSZ-Fraktionen durch konventionelle Immunfärbung transplantiert werden. Daher ist die Etablierung einer reproduzierbaren Isolationsmethode für Langzeit-HSZ (LT-HSCs) und Kurzzeit-HSZ (ST-HSCs), definiert durch die Dauer ihrer Selbsterneuerung, entscheidend für die Überwindung dieses Problems. Mit Hilfe eines unverzerrten mehrstufigen Screenings konnten wir einen Transkriptionsfaktor, Hoxb5, identifizieren, der ein exklusiver Marker für LT-HSCs im hämatopoetischen System der Maus sein könnte. Basierend auf diesen Erkenntnissen etablierten wir eine Hoxb5-Reportermauslinie und isolierten erfolgreich LT-HSCs und ST-HSCs. Hier beschreiben wir ein detailliertes Protokoll für die Isolierung von LT-HSCs und ST-HSCs unter Verwendung des Hoxb5-Reportersystems . Diese Isolationsmethode wird den Forschern helfen, die Mechanismen der Selbsterneuerung und die biologischen Grundlagen für diese Heterogenität im HSZ-Kompartiment besser zu verstehen.
Einleitung
Hämatopoetische Stammzellen (HSZ), die über Selbsterneuerungsfähigkeit und Multipotenz verfügen, befinden sich an der Spitze der hämatopoetischen Hierarchie 1,2. 1988 zeigten Weissman und Kollegen erstmals, dass die Isolierung von HSZ bei Mäusen mit Hilfe der Durchflusszytometrie erreicht werden kann3. Anschließend wurde berichtet, dass eine Fraktion, die durch eine Kombination von Zelloberflächenmarkern definiert wurde, Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−, alle HSCs in Mäusen 4,5,6,7,8 enthält.
Immunphänotypisch definierte (Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−) HSZ (im Folgenden pHSCs) galten bisher als funktionell homogen. Neuere Einzelzellanalysen haben jedoch gezeigt, dass pHSCs immer noch Heterogenität in Bezug auf ihre Selbsterneuerungskapazität9,10 und Multipotenz 11,12 aufweisen. Konkret scheinen in der pHSC-Fraktion zwei Populationen hinsichtlich ihrer Selbsterneuerungskapazität zu existieren: langfristige hämatopoetische Stammzellen (LT-HSCs), die eine kontinuierliche Selbsterneuerungskapazität aufweisen, und kurzzeitige hämatopoetische Stammzellen (ST-HSCs), die eine transiente Selbsterneuerungskapazität aufweisen 9,10.
Die molekularen Mechanismen der Selbsterneuerungsfähigkeit, die LT-HSZ und ST-HSZ unterscheiden, sind bisher nur unzureichend verstanden. Es ist von entscheidender Bedeutung, beide Zellpopulationen anhand ihrer Selbsterneuerungsfähigkeit zu isolieren und die zugrunde liegenden molekularen Mechanismen zu entdecken. Es wurden auch mehrere Reportersysteme eingeführt, um LT-HSCs13,14,15 zu reinigen; Die von jedem Reportersystem definierte LT-HSC-Reinheit ist jedoch variabel, und eine ausschließliche LT-HSC-Reinigung wurde bisher nicht erreicht.
Daher wird die Entwicklung eines Isolationssystems für LT-HSCs und ST-HSCs die Erforschung der Selbsterneuerungsfähigkeit in der pHSC-Fraktion beschleunigen. Bei der Isolierung von LT-HSCs und ST-HSCs wurde in einer Studie mit mehrstufigem, unverzerrtem Screening ein einzelnes Gen, Hoxb5, identifiziert, das heterogen in der pHSC-Fraktion16 exprimiert wird. Darüber hinaus ergab die Knochenmarkanalyse der Hoxb5-Reportermäuse, dass etwa 20%-25% der pHSC-Fraktion aus Hoxb5-pos-Zellen besteht. Ein kompetitiver Transplantationsassay mit Hoxb5 pos pHSCs und Hoxb5 neg pHSCs zeigte, dass nur Hoxb5pos pHSCs eine langfristige Selbsterneuerungskapazität besitzen, während Hoxb5neg pHSCs ihre Selbsterneuerungskapazität innerhalb kurzer Zeit verlieren, was darauf hindeutet, dass Hoxb5 LT-HSCs in der pHSC-Fraktion16 identifiziert.
Hier demonstrieren wir ein Schritt-für-Schritt-Protokoll zur Isolierung von LT-HSCs und ST-HSCs mit dem Hoxb5-Reportersystem . Darüber hinaus präsentieren wir einen kompetitiven Transplantationsassay zur Beurteilung der Selbsterneuerungskapazität von Hoxb5pos/neg pHSCs (Abbildung 1). Dieses Hoxb5-Reportersystem ermöglicht es uns, LT-HSCs und ST-HSCs prospektiv zu isolieren und trägt zum Verständnis von LT-HSC-spezifischen Eigenschaften bei.
Protokoll
Alle beschriebenen Tierversuche wurden vom RIKEN Center for Biosystems Dynamics Research genehmigt.
1. Vorkonditionierung der Empfängermäuse
- Männliche C57BL/6 kongene Mäuse im Alter von 8-10 Wochen werden als Empfängermäuse vorbereitet. Die Anzahl der Empfängermäuse hängt vom Versuchsprotokoll ab. Wir bereiten in der Regel 10-20 Mäuse für jede Erkrankung vor.
- Füttern Sie die Mäuse mit sterilisiertem Wasser, das mit Enrofloxacin (170 mg/l) ergänzt ist. Da bestrahlte Empfängermäuse sehr anfällig für Infektionen sind, sollten die Käfige so sauber wie möglich gehalten werden.
HINWEIS: Die Supplementierung mit Antibiotika beginnt 24 Stunden vor der Bestrahlung und wird 3 Wochen nach der Transplantation fortgesetzt, um Infektionen zu vermeiden.
- Füttern Sie die Mäuse mit sterilisiertem Wasser, das mit Enrofloxacin (170 mg/l) ergänzt ist. Da bestrahlte Empfängermäuse sehr anfällig für Infektionen sind, sollten die Käfige so sauber wie möglich gehalten werden.
- Ganzkörperbestrahlung
- Bei der Ganzkörperbestrahlung werden die Knochenmarkzellen des Empfängers zerstört, um die Transplantation der Spenderzellen zu gewährleisten. Übertragen Sie die Empfängermäuse in einen Bestrahlungskäfig. Die Empfängermäuse werden 12-16 h vor der Transplantation mit einer Einzeldosis von 8,7 Gy bestrahlt.
Anmerkungen: Die Strahlendosis und -zeit können je nach Gerät variieren. Die tödliche Strahlendosis sollte mit dem Bestrahlungs- und Mausstamm des Forschers bestätigt werden. - Bringen Sie sie nach der Ganzkörperbestrahlung in ihre Käfige zurück.
- Bei der Ganzkörperbestrahlung werden die Knochenmarkzellen des Empfängers zerstört, um die Transplantation der Spenderzellen zu gewährleisten. Übertragen Sie die Empfängermäuse in einen Bestrahlungskäfig. Die Empfängermäuse werden 12-16 h vor der Transplantation mit einer Einzeldosis von 8,7 Gy bestrahlt.
2. Entnahme der gespendeten Knochenmarkszellen
- Bereiten Sie eine männliche Hoxb5-tri-mCherry-Maus im Alter von 12 Wochen vor und euthanasieren Sie die Maus durch CO2 -Exposition, gefolgt von einer Zervixluxation oder mit Methoden, die von der örtlichen Tierethikkommission genehmigt wurden.
HINWEIS: Das Reagenzvolumen pro Maus wird in den folgenden Schritten beschrieben. - Entfernen Sie unter sterilen Bedingungen die Haut und legen Sie die Knochen (Oberschenkelknochen, Schienbein, Becken, Oberarmknochen) frei. Schneiden Sie die Hauptmuskeln ab und nehmen Sie die Knochen (Oberschenkelknochen, Schienbein, Becken, Oberarmknochen) von der Maus. Legen Sie sie in sterile Zellkulturschalen mit Ca2+- undMg2+-freiem, eiskaltem PBS.
- Schneiden Sie die Muskeln und das Fasergewebe mit einer Pinzette, einer kleinen Schere und Tüchern von den Knochen ab, um eine Kontamination zu vermeiden. Achten Sie darauf, dass Sie sich bei diesem Schritt nicht die Knochen brechen. Entsorgen Sie alle gebrochenen Knochen, um die Sterilität zu erhalten.
- Sterilisieren Sie einen Mörser und Stößel mit 70%igem Ethanol (EtOH) und lassen Sie sie vollständig trocknen. Äquilibrat mit Zellfärbepuffer (Ca2+- undMg2+-freies PBS, ergänzt mit 2 % hitzeinaktiviertem FBS, 2 mM EDTA, 100 U/ml Penicillin und 100 μg/ml Streptomycin).
- Legen Sie die Knochen in den Mörser und fügen Sie 3 ml Zellfärbepuffer hinzu. Die Knochen mit dem Stößel aufdrücken. Disaggregieren Sie die Zellklumpen durch vorsichtiges Pipettieren und übertragen Sie die Zellsuspension durch ein 100-μm-Zellsieb in ein 50-ml-Röhrchen.
- Wiederholen Sie Schritt 2.5, bis die Lösung klar ist. In der Regel reicht dreimal aus.
3. Trennung der c-kit+ Zellen durch magnetische Sortierung
- Antikörperfärbung für die magnetische Sortierung
- Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min. Saugen Sie den Überstand ab und resuspendieren Sie das Pellet in 1 ml Zellfärbepuffer. Fügen Sie 10 μl Ratten-IgG (5 mg/ml) hinzu, um die unspezifische Antikörperbindung zu reduzieren, und pipetieren Sie vorsichtig mit einer P1.000-Pipette auf und ab. 15 Minuten auf Eis inkubieren.
- Fügen Sie den c-Kit-Antikörper (Klon 2B8) in einer Konzentration von 4 μg/ml hinzu und mischen Sie ihn mit einer P1.000-Pipette. 15 Minuten auf Eis inkubieren.
- Fügen Sie 5 ml Zellfärbepuffer hinzu und mischen Sie gut. Zentrifugieren Sie die Proben bei 400 x g, 4 °C, 5 min. Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in 500 μl Zellfärbepuffer.
- Fügen Sie 35 μl Anti-APC-Mikrokügelchen hinzu, um die c-Kit+ -Zellen anzureichern, und mischen Sie sie mit einer P1.000-Pipette. 15 Minuten auf Eis inkubieren.
- Fügen Sie 4-5 ml Zellfärbepuffer hinzu. Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min. Saugen Sie den Überstand ab und resuspendieren Sie das Pellet in 1 ml Zellfärbepuffer.
- Die c-Kit+ Zellen magnetisch sortieren
- Befolgen Sie die Anweisungen des Herstellers, um die Zellen zu sortieren. Kurz gesagt, bereiten Sie eine magnetische Sortiersäule mit 3 ml Zellfärbepuffer vor. Filtrieren Sie die Probe (1 ml) durch ein 40-μm-Zellsieb und laden Sie die Probe in die magnetische Sortiersäule.
- Waschen Sie, indem Sie dreimal 3 ml Zellfärbepuffer hinzufügen. Fügen Sie den Zellenfärbepuffer nur hinzu, wenn das Säulenreservoir leer ist.
- Setzen Sie die magnetische Sortiersäule auf ein eiskaltes 15-ml-Röhrchen und fügen Sie 5 ml Zellfärbepuffer hinzu. Spülen Sie die Zellen aus, indem Sie den Kolben fest in die Säule drücken. Halten Sie den Durchfluss auf Eis.
HINWEIS: Im Falle eines versehentlichen Probenverlusts behalten wir den Durchfluss bis zum Ende des Experiments bei.
4. Hämatopoetische Stammzellfärbung
- Die in Schritt 3.2.3 vorbereitete Probe wird bei 400 x g und 4 °C für 5 min zentrifugiert. Saugen Sie den Überstand ab.
- Den CD34-Antikörper (Klon RAM34) in einer Konzentration von 50 μg/ml in das Pellet geben und 60 Minuten auf Eis inkubieren.
HINWEIS: Es wird empfohlen, die Stützzellen während der ersten Stunde der Inkubation mit CD34 vorzubereiten, um die Verarbeitungszeit zu verkürzen. - Bereiten Sie die Antikörper-Mastermischung gemäß Tabelle 1 vor. Geben Sie 100 μl der Mastermischung in die Probe und inkubieren Sie sie 30 Minuten lang auf Eis. Der Antikörper für das CD34-Antigen (Klon; RAM34) benötigt 90 min für eine ausreichende Färbung.
- Fügen Sie 4-5 ml Zellfärbepuffer hinzu. Zentrifugieren Sie die Probe bei 400 x g und 4 °C für 5 min. Saugen Sie den Überstand ab. Streptavidin-BUV737 in einer Konzentration von 3 μg/ml zum Pellet geben und 30 Minuten auf Eis inkubieren.
- Fügen Sie 4-5 ml Zellfärbepuffer hinzu. Zentrifugieren Sie die Probe bei 400 x g und 4 °C für 5 min. Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in 400 μl Zellfärbepuffer. Bewahren Sie die Probe auf Eis auf.
5. Unterstützung der Zellvorbereitung
- Bereiten Sie eine CD45.1+ CD45.2+ kongene Maus im Alter von 12 Wochen vor; Idealerweise sollte diese im gleichen Alter wie die Spendermaus sein. Euthanasieren Sie die Maus durch CO2 -Exposition mit anschließender Zervixluxation oder mit Methoden, die von der örtlichen Tierethikkommission genehmigt wurden.
HINWEIS: Im angegebenen Beispiel wurden CD45.1+ CD45.2+ kongene Mäuse intern durch Kreuzung von B6 gezüchtet. CD45.1 kongene Mäuse mit C57BL/6J Mäusen16. - Unter sterilen Bedingungen werden sowohl Oberschenkelknochen als auch Tibiae entnommen und in sterile Zellkulturschalen mit Ca 2+- und Mg2+-freiem, eiskaltem PBS gelegt. Schneiden Sie die Muskeln und das Fasergewebe mit einer Pinzette und einer kleinen Schere von den Knochen ab.
- Schneiden Sie beide Enden der Knochen mit einer scharfen, sterilen Schere ab. Verwenden Sie eine 23-g-Nadel und eine 5-ml-Spritze, die mit eiskaltem Zellsuspensionspuffer gefüllt ist (Ca 2+- und Mg2+-freies PBS, ergänzt mit 2 % hitzeinaktiviertem FBS, 100 U/ml Penicillin und 100 μg/ml Streptomycin), um das Knochenmark in eine sterile Zellkulturschale mit Zellsuspensionspuffer zu spülen. Disaggregieren Sie die Zellklumpen durch sanftes Pipettieren.
- Filtrieren Sie die Zellsuspension mit einer P1.000-Pipette durch ein 40-μm-Zellsieb. Zählen Sie die Zellzahl der Zellsuspension mit einem Hämozytometer und bereiten Sie eine Knochenmarkzellsuspension mit 1 x 106 Zellen/ml vor.
- Übertragen Sie 200 μl der Knochenmarkzellsuspension (2 x 105 Zellen) auf eine 96-Well-Platte mit rundem Boden. Bis zur Verwendung auf Eis aufbewahren.
Anmerkungen: Für eine einfache Zellentnahme werden Platten mit rundem Boden empfohlen.
6. Hoxb5pos oder Hoxb5neg pHSC-Sortierung
- Einrichten des Gates
- Übertragen Sie 400 μl der in Schritt 4.5 vorbereiteten Probe in ein Polystyrol-Reagenzglas mit rundem Boden und einer 35-μm-Zellsieb-Schnappkappe. Bereiten Sie das Reagenz für die Totzellfärbung vor und fügen Sie es der Probe vor der Analyse gemäß den Anweisungen des Herstellers hinzu.
- Schalten Sie ein Durchflusszytometer ein und starten Sie die Analysesoftware gemäß den Anweisungen des Herstellers. Drücken Sie dann auf Laden, und rufen Sie die Daten ab.
HINWEIS: Ein Durchflusszytometer, das mit fünf Lasern und einer 70-μm-Düse ausgestattet ist, wird empfohlen, um die Reinheit der sortierten Zellen zu verbessern. - Nach dem Ausschluss von Dubletten, toten Zellen und linienpositiven Zellen wird die Fraktion Lineage−c-Kit+Sca-1+ gegatet. Als nächstes wird die Flk2+-Fraktion herausgeklappt. Dann wird das Gatter Hoxb5pos oder Hoxb5neg pHSCs in der CD150+CD34−/niedrigen Fraktion negieren (Abbildung 2). Führen Sie im ersten Experiment eine Kompensation der spektralen Überlappung durch.
HINWEIS: Es wird erwartet, dass Hoxb5-positive Zellen 20%-25% der Lineage−c-Kit+Sca-1+CD150+CD34−/niedrigenFlk2−-Fraktion ausmachen.
- Hoxb5pos oder Hoxb5neg pHSC-Sortierung
- Bereiten Sie ein 1,5 ml proteinarmes Bindungsröhrchen mit 600 μl Ca 2+- und Mg2+-freiem PBS zu, das mit 10 % hitzeinaktiviertem FBS ergänzt wird.
- Setzen Sie das 1,5-ml-Röhrchen mit niedrigem Proteinbindungsgehalt auf eine Sortiersammelvorrichtung und sortieren Sie die Hoxb5-pos- oder Hoxb5-neg-pHSCs mit der in Schritt 6.1.3 festgelegten Gating-Strategie in das 1,5-ml-Röhrchen. Verwenden Sie in der ersten Sortierung die Ausbeute aus dem Sortiergenauigkeitsmodus.
- Setzen Sie die 96-Well-Platte mit den in Schritt 5.5 vorbereiteten Stützzellen auf den Tisch der automatischen Zellabscheidungseinheit (ACDU). Setzen Sie das in Schritt 6.2.2 vorbereitete 1,5-ml-Röhrchen mit niedriger Proteinbindung auf die Ladeöffnung eines Durchflusszytometers.
- Sortieren Sie die hoxb5pos oder Hoxb5neg pHSCs in eine 96-Well-Platte mit den unterstützenden Zellen unter Verwendung der in Schritt 6.1.3 festgelegten Gating-Strategie. Sortieren Sie 10 Hoxb5pos oder Hoxb5neg pHSCs, um ihre Selbsterneuerungsfähigkeit zu testen.
Anmerkungen: Eine doppelte Sortierung wird empfohlen, um die Reinheit zu erhöhen. Verwenden Sie in der zweiten Sortierung Reinheit als empfohlenen Sortiergenauigkeitsmodus. - In der Regel werden 500-1.000 Hoxb5pos pHSCs und 1.500-4.000 Hoxb5neg pHSCs nach doppelter Sortierung geerntet. Fahren Sie so schnell wie möglich nach der HSC-Sortierung mit den Transplantationsverfahren fort, um die Lebensfähigkeit der Zellen zu verbessern (idealerweise innerhalb von 1-2 Stunden).
7. Transplantation
- Legen Sie die in Schritt 6.2.4 vorbereitete HSC-sortierte 96-Well-Platte auf Eis. Behandeln Sie die HSC-sortierte 96-Well-Platte unter sterilen Bedingungen, idealerweise in einer Zellenhaube.
- Betäuben Sie eine Empfängermaus mit 2%igem Isofluran in einer Gasanästhesie-Induktionskammer. Sobald das Tier vollständig betäubt ist, entfernen Sie es und legen Sie es auf die Seite. Um eine ausreichende Anästhesie zu gewährleisten, vergewissern Sie sich, dass Sie sich nicht als Reaktion auf einen schädlichen Reiz bewegen.
- Führen Sie nach der Bestätigung der ordnungsgemäßen Anästhesie so schnell wie möglich eine retroorbitale Injektion durch, um zu verhindern, dass die Maus das Bewusstsein wiedererlangt. Die retroorbitale Injektion dauert weniger als 30 s.
HINWEIS: Da die Injektionszeit kurz ist, beenden wir den Eingriff, ohne Augensalbe auf die Augen aufzutragen. Wenn der Eingriff jedoch länger dauert, empfehlen wir die Verwendung von Augensalbe. - Pipettieren Sie die Zellen vorsichtig in die HSC-sortierte 96-Well-Platte, um sie zu mischen. Sammeln Sie die Spenderzellen mit einer 30-g-Insulinspritze in der Sortierplatte und injizieren Sie sie in den retroorbitalen Venenplexus der Empfängermäuse. Das empfohlene injizierbare Volumen beträgt ≤200 μl.
- Beobachten Sie, bis die Mäuse bei Bewusstsein sind und sich in einem sauberen Käfig bewegen. Bringen Sie sie in ihre Käfige zurück, nachdem Sie ihre Genesung bestätigt haben.
8. Periphere Blutanalyse
- Entnahme von 50 μl peripherem Blut aus der Schwanzvene und resuspendiert es mit 100 μl Ca 2+- und Mg2+-freiem PBS mit 2 mM EDTA. Übertragen Sie alle Proben auf eine 96-Well-Platte. Bei 400 x g und 4 °C 5 min zentrifugieren und den Überstand entsorgen.
- Fügen Sie 200 μl Lysepuffer für rote Blutkörperchen hinzu und inkubieren Sie ihn 3 Minuten lang auf Eis. Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min und entsorgen Sie den Überstand. Wiederholen Sie den Vorgang noch einmal.
- Fügen Sie 200 μl Zellfärbepuffer hinzu. Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min und entsorgen Sie den Überstand.
- Antikörper-Mastermix gemäß Tabelle 2 vorbereiten. 50 μl Antikörper-Mastermix zugeben und 30 Minuten auf Eis inkubieren.
- Fügen Sie 150 μl Zellfärbepuffer hinzu. Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min und entsorgen Sie den Überstand.
- Fügen Sie 200 μl Zellfärbepuffer hinzu. Zentrifugieren Sie die Proben bei 400 x g und 4 °C für 5 min und entsorgen Sie den Überstand. Resuspendieren Sie 200 μl Zellfärbepuffer und fügen Sie vor der Analyse gemäß den Anweisungen des Herstellers ein Färbereagenz für tote Zellen hinzu.
- Analysieren Sie den peripheren Blutchimärismus mit einem Durchflusszytometer, wie zuvor beschrieben16. Entnahme von Blut nach 4 Wochen, 8 Wochen, 12 Wochen und 16 Wochen nach der Transplantation, um die Rekonstitution mehrerer Linien zu verfolgen. Repräsentative Diagramme der Durchflusszytometrie sind in Abbildung 3 dargestellt.
Ergebnisse
Bisher wurde die Selbsterneuerungskapazität mit Hilfe von kompetitiven Transplantationsassays gemessen, bei denen angenommen wurde, dass Spender-HSZ ihre Selbsterneuerungsfähigkeit nur dann behalten, wenn Spenderzellen mit mehreren Linien im peripheren Blut des Empfängers beobachtet werden17. Darüber hinaus werden LT-HSZ in mehreren Berichten als Zellen definiert, die auch mehrere Monate nach der zweiten Knochenmarktransplantation noch periphere Blutzellen produzieren10,18. Um ihre Selbsterneuerungsfähigkeiten zu vergleichen, wurden daher 10 Hoxb5pos oder Hoxb5neg pHSCs, die aus Hoxb5-Reportermäusen isoliert wurden, in letal bestrahlte primäre Empfängermäuse mit 2 x 105 ganzen Knochenmarkszellen transplantiert. Dann, 16 Wochen nach der Primärtransplantation, wurden 1 x 107 Knochenmarkzellen, die von den primären Empfängermäusen isoliert wurden, in letal bestrahlte sekundäre Empfängermäuse transplantiert, um die langfristige Selbsterneuerungsfähigkeit zu beurteilen (Abbildung 1). Abbildung 2 zeigt repräsentative durchflusszytometrische Diagramme der Knochenmarkanalyse der Hoxb5-tri-mCherry-Mäuse. Etwa 20%-25% der Zellen in der pHSC-Fraktion, die durch Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2− definiert wurde, waren Hoxb5-pos-pHSCs, die nur 0,001%-0,00125% des Knochenmarks von Mäusen ausmachen. Abbildung 3 zeigt repräsentative Durchflusszytometrie-Diagramme der peripheren Blutanalyse in den Empfängermäusen. Die CD45.2-Spendermäuse (Hoxb5-tri-mCherry-Mäuse), CD45.1/CD45.2-unterstützende Zellen und CD45.1-Empfängermäuse wurden darauf vorbereitet, die Spender-, Stütz- und Empfängerzellen separat zu analysieren.
Abbildung 4 zeigt periphere Blutanalysen bei den Empfängermäusen 4 Wochen, 8 Wochen, 12 Wochen und 16 Wochen nach der Transplantation, um den Spenderchimärismus zu bestätigen. Diese Analysen zeigten, dass, obwohl Hoxb5 pos und Hoxb5neg pHSCs 4 Wochen nach der Transplantation einen ähnlichen Spenderchimärismus aufweisen, eine kontinuierliche Hämatopoese nur bei den Hoxb5pos pHSC-Empfängern beobachtet wurde (Abbildung 4A,B). Auf der anderen Seite verloren Hoxb5neg HSCs 8 Wochen nach der Transplantation die Fähigkeit, hämatopoetische Zellen zu produzieren (Abbildung 4A,B). In der sekundären Transplantationsanalyse wiesen nur die Hoxb5pos pHSC-Empfänger eine robuste Hämatopoese auf (Abbildung 5A,B). Im Gegensatz dazu wurden in den Hoxb5 neg pHSC-Empfängermäusen kaum Spenderzellen beobachtet, was darauf hindeutet, dass Hoxb5neg pHSCs innerhalb von 16 Wochen nach der Transplantation ihre Fähigkeit zur Selbsterneuerung bei primären Empfängermäusen verlieren. Diese Daten zeigen, dass die Hoxb5-Expression als spezifischer Marker für LT-HSCs verwendet werden kann.

Abbildung 1: Experimentelles Schema für langfristige hämatopoetische Rekonstitutionsassays. Die Empfängermäuse wurden letal bestrahlt und kompetitiv mit 10 HSCs und 2 x 105 ganzen Knochenmarkszellen (Stützzellen) transplantiert. Für sekundäre Transplantationen wurden 1 x 107 ganze Knochenmarkszellen von den primären Empfängermäusen übertragen. Abkürzungen: PB = peripheres Blut; WBM = ganzes Knochenmark. Diese Abbildung wurde von Chen et al.16 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
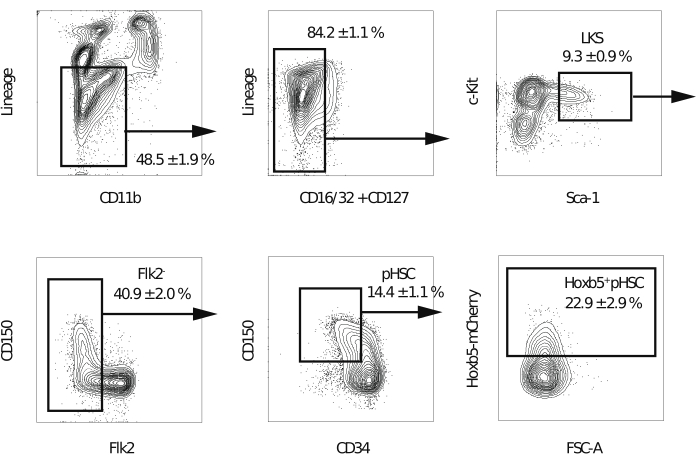
Abbildung 2: Gating-Strategie für die Sortierung von Hoxb5pos und Hoxb5neg pHSCs. Repräsentatives Durchflusszytometrie-Gating zur Isolierung von LKS, Flk2−, pHSC, Hoxb5pos und Hoxb5neg pHSCs nach Ausschluss von Dubletten und toten Zellen. Die Werte geben den prozentualen Anteil jedes Bruchteils ± s.d. an (n = 3). Zu den Linien gehören B220, CD3ε, CD4, CD8a, Gr-1 und Ter-119. Diese Abbildung wurde von Chen et al.16 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
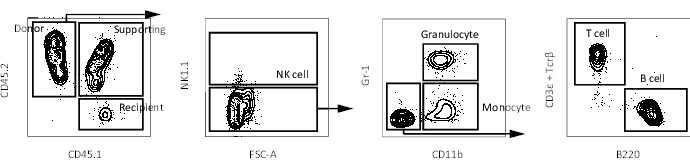
Abbildung 3: Repräsentative FACS-Diagramme des peripheren Blutes in einer Empfängermaus. Gating-Schema zur Identifizierung peripherer Blutzellen (NK-Zelle, Granulozyten, Monozyten, T-Zelle und B-Zelle) in einer Empfängermaus nach dem Ausschluss von Dubletten und toten Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Chimärismus bei Empfängermäusen nach Primärtransplantation. (A) Prozentualer Chimärismus nach 4 Wochen, 8 Wochen, 12 Wochen und 16 Wochen bei primären Empfängern, die 10 Hoxb5neg (n = 9), Hoxb5lo (n = 13) oder Hoxb5hi (n = 18) pHSCs erhielten. Jede Spalte stellt eine einzelne Maus dar. Die Hoxb5-Hi-Fraktion wurde als die oberen 5% der Hoxb5-Expression und andere als Hoxb5-Lo-Fraktion definiert. (B) Der durchschnittliche Beitrag der Spenderlinie bei 10-zelligen Primärtransplantationen. Die Fehlerbalken kennzeichnen die s.d. Diese Abbildung wurde von Chen et al.16 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Chimärismus bei den Empfängermäusen nach der Sekundärtransplantation . (A) Prozentualer Chimärismus nach 4 Wochen, 8 Wochen, 12 Wochen und 16 Wochen nach der Sekundärtransplantation des gesamten Knochenmarks. (B) Individueller Spenderchimärismus nach Abstammungslinie bei sekundären Empfängern des gesamten Knochenmarks. Jede Zeile steht für eine einzelne Maus. Diese Abbildung wurde von Chen et al.16 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Antikörper | Klonen | Konzentration | Fluorochrome |
| Flk-2 | A2-F10 | 4 μg/ml | PerCP/eFlour710 |
| CD150 | TC15-12F12.2 | 4 μg/ml | BV421 |
| CD11b | M1/70 | 4 μg/ml | BV711 |
| SCA-1 | D7 | 4 μg/ml | BUV395 |
| CD16/32 | 93 | 4 μg/ml | A-700 |
| CD127 | A7R34 | 4 μg/ml | A-700 |
| CD3ε | 145-2C11 | 10 μg/ml | Biotin |
| CD4 | GK1.5 | 10 μg/ml | Biotin |
| CD8a | 53-6.7 | 10 μg/ml | Biotin |
| Gr-1 | RB6-8C5 | 10 μg/ml | Biotin |
| B220 | RA3-6B2 | 10 μg/ml | Biotin |
| Ter119 | TER119 | 10 μg/ml | Biotin |
Tabelle 1: Antikörper-Mastermix für die hämatopoetische Stammzellfärbung.
| Antikörper | Klonen | Konzentration | Fluorochrome |
| CD45.1 | A20 | 1 μg/ml | FITC |
| CD45.2 | 104 | 1 μg/ml | PE |
| Gr-1 | RB6-8C5 | 2,5 μg/ml | A700 |
| NK1.1 | PK136 | 1 μg/ml | PerCP-Cyanin5,5 |
| CD11b | M1/70 | 1 μg/ml | BUV395 |
| CD3ε | 145-2C11 | 1 μg/ml | BV421 |
| TCRβ | H57-597 | 1 μg/ml | BV421 |
| B220 | RA3-6B2 | 1 μg/ml | BV786 |
Tabelle 2: Antikörper-Mastermix für die Färbung peripherer Blutzellen.
Diskussion
Traditionell wurden HSCs, die durch Zelloberflächenmarker definiert sind, hergestellt, um die Funktionen von HSCs zu untersuchen, wie z. B. die Fähigkeit zur Selbsterneuerung und die Multipotenz 19,20,21. Die immunphänotypisch definierte (Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−) HSC-Fraktion enthält jedoch zwei diskrete HSZ-Populationen: LT-HSCs und ST-HSCs 9,10. Daher ist die spezifische Analyse von bonafide HSCs, LT-HSCs, noch nicht gelungen. Dementsprechend wird eine Isolationsmethode für LT-HSZ mit dem Hoxb5-Reportersystem die Suche nach den molekularen Mechanismen der Selbsterneuerungsfähigkeit erheblich unterstützen.
Hier werden wir kritische Schritte in diesem Protokoll besprechen. Zunächst müssen die Schritte 1 bis 7 ohne Unterbrechung abgeschlossen werden. Diese Schritte dauern in der Regel 9-12 Stunden, und es ist wichtig, die Proben während dieser Verfahren so weit wie möglich bei 4 °C zu halten, um die Lebensfähigkeit der Probe zu erhalten. Als nächstes werden etwa 1 x 108 Knochenmarkzellen von einer Maus entnommen. Daher müssen wir eine ausreichende Menge an Antikörpern verwenden, um die Färbeleistung zu reproduzieren. Darüber hinaus ist der Antikörper für das CD34-Antigen (Klon; RAM34) benötigt 90 min für eine ausreichende Färbung, während 30 min für andere Antikörper ausreichen. Zweitens verursacht die Bestrahlung bei den Empfängermäusen in der Regel eine Panzytopenie. Wenn von Empfängern stammende Neutrophile in vielen Empfängermäusen persistieren, deutet dies darauf hin, dass die Strahlendosis unzureichend war. In einem solchen Fall empfiehlt sich eine Optimierung der Strahlendosis. Drittens: Wenn die meisten Mäuse kurz nach der Transplantation sterben, gibt es zwei mögliche Erklärungen: eine unzureichende Anzahl von Stützzellen oder eine erfolglose retroorbitale Injektion.
Seit Jahrzehnten ist umstritten, ob die bonafide HSC-Fraktion homogen oder heterogen ist22,23,24. In dieser Studie wiesen die Empfängermäuse, die die Hoxb5pos pHSC-Transplantation erhielten, unterschiedliche Spenderchimären und Differenzierungsmuster auf (Abbildung 4A), was darauf hindeutet, dass diese Fraktion heterogen sein könnte. Diese Schwankungen könnten jedoch sowohl durch die Verwendung von ungereinigten Knochenmarkzellen als Stützzellen als auch durch die unterschiedliche Strahlenempfindlichkeit einzelner Mäuse verursacht werden25.
Zusammenfassend haben wir ein Schritt-für-Schritt-Protokoll für die Isolierung von LT-HSCs und ST-HSCs mit dem Hoxb5-Reportersystem demonstriert. Bisher hing der Nachweis von LT-HSZ vom kompetitiven Transplantationstest ab, der mehr als 8 Monate dauerte. Im Gegensatz dazu ermöglicht uns das Hoxb5-Reportersystem, sowohl LT-HSCs als auch ST-HSCs prospektiv zu identifizieren und für verschiedene Funktionsanalysen zu verwenden. Abbildung 4 und Abbildung 5 zeigen auch, dass das Hoxb5-Expressionsniveau mit dem Grad des Spenderchimärismus bei den zweiten Empfängermäusen zu korrelieren scheint. Darüber hinaus haben wir mit Hilfe des Hoxb5-Reportersystems bereits gezeigt, dass LT-HSCs und ST-HSCs komplementär für eine kontinuierliche hämatopoetische Rekonstitution nach hämatopoetischer Stammzelltransplantation wirken26. Darüber hinaus konnten wir zeigen, dass die exogene Expression von Hoxb5 das Zellschicksal von ST-HSCs teilweise in das von LT-HSCs umkehren kann, was darauf hindeutet, dass die An- oder Abwesenheit von Hoxb5 die Heterogenität der Selbsterneuerungsfähigkeit in der durch Zelloberflächenmarker definierten HSC-Fraktion27 erklärt.
Zusätzlich zu diesen Erkenntnissen ermöglicht uns die prospektive Isolierung von LT-HSCs die Analyse von LT-HSCs unter verschiedenen physiologischen Bedingungen, wie Alterung, Entzündung usw. Diese Analysen werden das Verständnis der Funktionen von LT-HSZ erheblich erleichtern.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte im Zusammenhang mit dieser Studie.
Danksagungen
Wir danken Hiroshi Kiyonari für die Tierpflege und die Bereitstellung von Empfängermäusen am RIKEN BDR sowie Hitomi Oga, Kayoko Nagasaka und Masaki Miyahashi für das Labormanagement an der Universität Kobe. Die Autoren schätzen auch die anhaltende Unterstützung für diese Arbeit sehr. Masanori Miyanishi wurde von der Japan Society for the Promotion of Science (JSPS) KAKENHI Grant Numbers JP17K07407 und JP20H03268, der Mochida Memorial Foundation for Medical and Pharmaceutical Research, der Life Science Foundation of Japan, der Takeda Science Foundation, der Astellas Foundation for Research on Metabolic Disorders und AMED-PRIME, AMED unter der Fördernummer JP18gm6110020 unterstützt. Taro Sakamaki wird von den JSPS KAKENHI Grant Numbers JP21K20669 und JP22K16334 unterstützt und wurde unterstützt von das JSPS Core-to-Core-Programm und das RIKEN Junior Research Associate Program. Katsuyuki Nishi wurde durch die JSPS-Fördernummer KAKENHI JP18J13408 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
Referenzen
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten