Method Article
שיטת בידוד לתאי גזע המטופויטיים לטווח ארוך וקצר
In This Article
Summary
אנו מציגים פרוטוקול שלב אחר שלב לבידוד תאי גזע המטופויטיים ארוכי טווח (LT-HSCs) ותאי HSC לטווח קצר (ST-HSCs) באמצעות מערכת הדיווח Hoxb5.
Abstract
יכולת התחדשות עצמית ופוטנציאל התמיינות רב-שושלות נחשבים בדרך כלל למאפיינים המגדירים של תאי גזע המטופויטיים (HSC). עם זאת, מחקרים רבים הציעו כי הטרוגניות תפקודית קיימת בתא HSC. ניתוחים חד-תאיים שנערכו לאחרונה דיווחו על שיבוטים של HSC עם גורלות תאים שונים בתוך תא HSC, המכונים שיבוטים מוטים של HSC. המנגנונים העומדים בבסיס תוצאות הטרוגניות או שאינן ניתנות לשחזור מובנים מעט, במיוחד לגבי משך ההתחדשות העצמית כאשר שברי HSC מטוהרים מושתלים על ידי אימונוסטיין קונבנציונלי. לכן, קביעת שיטת בידוד ניתנת לשחזור עבור HSCs לטווח ארוך (LT-HSCs) ו- HSCs לטווח קצר (ST-HSCs), המוגדרת על ידי משך ההתחדשות העצמית שלהם, היא חיונית להתגברות על בעיה זו. באמצעות סינון רב-שלבי בלתי משוחד, זיהינו גורם שעתוק, Hoxb5, שעשוי להיות סמן בלעדי של LT-HSCs במערכת המטופויטית של עכבר. בהתבסס על ממצא זה, הקמנו קו עכברים של כתב Hoxb5 ובודדנו בהצלחה LT-HSCs ו-ST-HSCs. כאן אנו מתארים פרוטוקול מפורט לבידוד LT-HSCs ו- ST-HSCs באמצעות מערכת הכתב Hoxb5 . שיטת בידוד זו תסייע לחוקרים להבין טוב יותר את מנגנוני ההתחדשות העצמית ואת הבסיס הביולוגי להטרוגניות כזו בתא HSC.
Introduction
תאי גזע המטופויטיים (HSCs), בעלי יכולת התחדשות עצמית ורב-עוצמה, שוכנים בפסגת ההיררכיה ההמטופויטית 1,2. בשנת 1988 הדגימו וייסמן ועמיתיו לראשונה כי בידוד של HSCs עכבריים יכול להיות מושג באמצעות ציטומטריית זרימה3. לאחר מכן, דווח כי חלק שהוגדר על ידי שילוב של סמני פני התא, Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−, מכיל את כל HSCs בעכברים 4,5,6,7,8.
הוגדרו אימונופנוטיפית (שושלת−c-Kit+Sca-1+CD150+CD34−/loFlk2−) HSCs (להלן: pHSCs) נחשבו בעבר הומוגניים מבחינה תפקודית. עם זאת, ניתוחים חד-תאיים אחרונים גילו כי pHSCs עדיין מפגינים הטרוגניות ביחס ליכולת ההתחדשות העצמית שלהם 9,10 ורב-עוצמה11,12. באופן ספציפי, נראה כי שתי אוכלוסיות קיימות בחלק pHSC ביחס ליכולת ההתחדשות העצמית שלהם: תאי גזע המטופויטיים לטווח ארוך (LT-HSCs), שיש להם יכולת התחדשות עצמית מתמשכת, ותאי גזע המטופויטיים לטווח קצר (ST-HSCs), שיש להם יכולת התחדשות עצמית חולפת 9,10.
נכון להיום, המנגנונים המולקולריים של יכולת התחדשות עצמית המבדילים בין LT-HSCs ו-ST-HSCs עדיין אינם מובנים. חיוני לבודד את שתי אוכלוסיות התאים בהתבסס על יכולות ההתחדשות העצמית שלהן ולגלות את המנגנונים המולקולריים העומדים בבסיסן. מספר מערכות כתב הוכנסו גם לטיהור LT-HSCs13,14,15; עם זאת, טוהר LT-HSC המוגדר על ידי כל מערכת דיווח משתנה, וטיהור LT-HSC בלעדי לא הושג עד כה.
לכן, פיתוח מערכת בידוד עבור LT-HSCs ו-ST-HSCs יאיץ את המחקר בנוגע ליכולת התחדשות עצמית במקטע pHSC. בבידוד של LT-HSCs ו-ST-HSCs, מחקר שהשתמש בסינון רב-שלבי ובלתי מוטה זיהה גן יחיד, Hoxb5, המתבטא באופן הטרוגני בחלק pHSC16. בנוסף, ניתוח מח עצם של עכברי כתב Hoxb5 גילה כי כ 20%-25% של מקטע pHSC מורכב מתאיקופה Hoxb5. בדיקת השתלות תחרותית באמצעות Hoxb5 pos pHSCs ו- Hoxb5 neg pHSCs גילתה כי רק ל- Hoxb5pos pHSCs יש יכולת התחדשות עצמית לטווח ארוך, בעוד ש- Hoxb5 neg pHSCs מאבדים את יכולת ההתחדשות העצמית שלהם תוך תקופה קצרה, מה שמצביע על כך ש- Hoxb5 מזהה LT-HSCs בשבר pHSC16.
כאן, אנו מדגימים פרוטוקול שלב אחר שלב לבידוד LT-HSCs ו- ST-HSCs באמצעות מערכת הכתב Hoxb5 . בנוסף, אנו מציגים בדיקת השתלות תחרותית כדי להעריך את יכולת ההתחדשות העצמית של Hoxb5pos/neg pHSCs (איור 1). מערכת כתבים זו של Hoxb5 מאפשרת לנו לבודד באופן פרוספקטיבי LT-HSCs ו-ST-HSCs ותורמת להבנת המאפיינים הספציפיים של LT-HSC.
Protocol
כל הניסויים בבעלי חיים שתוארו אושרו על ידי מרכז RIKEN לחקר דינמיקה של מערכות ביולוגיות.
1. התניה מוקדמת של העכברים המקבלים
- הכינו עכברים קונגניים זכרים C57BL/6 בני 8-10 שבועות כעכברים מושתלים. מספר העכברים המקבלים תלוי בפרוטוקול הניסוי. בדרך כלל אנו מכינים 10-20 עכברים לכל מצב.
- האכילו את העכברים במים מעוקרים בתוספת אנרופלוקסצין (170 מ"ג/ליטר). מכיוון שהעכברים המוקרנים רגישים מאוד לזיהום, שמרו על הכלובים נקיים ככל האפשר.
הערה: תוספת אנטיביוטיקה מתחילה 24 שעות לפני ההקרנה ונמשכת 3 שבועות לאחר ההשתלה כדי למנוע זיהומים.
- האכילו את העכברים במים מעוקרים בתוספת אנרופלוקסצין (170 מ"ג/ליטר). מכיוון שהעכברים המוקרנים רגישים מאוד לזיהום, שמרו על הכלובים נקיים ככל האפשר.
- הקרנת גוף כוללת
- הקרנת הגוף הכוללת הורסת את תאי מח העצם המקבל כדי להבטיח קליטה של התאים התורמים. העבירו את העכברים המקבלים לכלוב הקרנה. יש להקרין באופן קטלני את העכברים המושתלים במנה אחת של 8.7 Gy ב-12-16 שעות לפני ההשתלה.
הערה: מינון הקרינה והזמן עשויים להשתנות בהתאם לציוד. מינון הקרינה הקטלנית צריך להיות מאושר עם מקרין של החוקר וזן עכבר. - החזירו אותם לכלובים שלהם לאחר הקרנת הגוף הכוללת.
- הקרנת הגוף הכוללת הורסת את תאי מח העצם המקבל כדי להבטיח קליטה של התאים התורמים. העבירו את העכברים המקבלים לכלוב הקרנה. יש להקרין באופן קטלני את העכברים המושתלים במנה אחת של 8.7 Gy ב-12-16 שעות לפני ההשתלה.
2. איסוף תאי מח העצם התורם
- הכינו עכבר Hoxb5-tri-mCherry זכר בן 12 שבועות, והרדימו את העכבר על ידי חשיפה ל-CO2 ולאחר מכן פריקת צוואר הרחם או בשיטות שאושרו על ידי ועדת האתיקה המקומית של בעלי חיים.
הערה: אמצעי האחסון מגיב לכל עכבר מתואר בשלבים הבאים. - בתנאים סטריליים יש להסיר את העור ולחשוף את העצמות (עצם הירך, השוקה, האגן, עצם הזרוע). חותכים את השרירים העיקריים ולוקחים את העצמות (עצם הירך, השוקה, האגן, הומרוס) מהעכבר. הניחו אותם בכלי תרבית תאים סטריליים עם PBS קר כקרח ללא Ca 2+ו-Mg 2+.
- קצצו את השרירים והרקמות הסיביות מהעצמות באמצעות פינצטה, מספריים קטנים ומגבונים למניעת זיהום. היזהר לא לשבור את העצמות במהלך שלב זה. השליכו את כל העצמות השבורות על מנת לשמור על סטריליות.
- לעקר טיט ו pestle עם 70% אתנול (EtOH), ולתת להם להתייבש לחלוטין. יש לאזן את שיווי המשקל עם חיץ מכתים לתאים (PBS נטול Ca 2+ ו-Mg2+ בתוספת FBS מומת חום 2%, 2 mM EDTA, 100 U/mL פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין).
- שים את העצמות במכתש, ולהוסיף 3 מ"ל של חיץ מכתים תאים. למחוץ את העצמות לפתוח עם pestle. מפרקים את גושי התאים על ידי פיפטינג עדין, ומעבירים את תרחיף התא דרך מסננת תאים של 100 מיקרומטר לתוך צינור של 50 מ"ל.
- חזור על שלב 2.5 עד שהפתרון יתבהר. בדרך כלל, שלוש פעמים זה מספיק.
3. הפרדת תאי c-kit+ על ידי מיון מגנטי
- צביעת נוגדנים למיון מגנטי
- צנטריפוגה הדגימות ב 400 x גרם ו 4 ° C במשך 5 דקות. שאפו את הסופרנטנט, והשעו מחדש את הגלולה ב 1 מ"ל של חיץ צביעת התא. יש להוסיף 10 μL של חולדה-IgG (5 מ"ג/מ"ל) כדי להפחית קשירת נוגדנים לא ספציפיים, ולזלף בעדינות מעלה ומטה באמצעות פיפטה P1,000. דוגרים על קרח במשך 15 דקות.
- מוסיפים את נוגדן c-Kit (שיבוט 2B8) בריכוז של 4 מיקרוגרם/מ"ל, ומערבבים עם פיפטה P1,000. דוגרים על קרח במשך 15 דקות.
- מוסיפים 5 מ"ל של חיץ צביעת תאים, ומערבבים היטב. צנטריפוגה הדגימות ב 400 x גרם, 4 ° C, 5 דקות. שאפו את הסופרנטנט, והשעו מחדש את הגלולה ב-500 מיקרוליטר של חיץ צביעת תאים.
- הוסיפו 35 מיקרו-ליטר מיקרו-כדוריות נגד APC כדי להעשיר את תאי c-Kit+ , וערבבו עם פיפטה P1,000. דוגרים על קרח במשך 15 דקות.
- הוסף 4-5 מ"ל של חיץ מכתים תאים. צנטריפוגה הדגימות ב 400 x גרם ו 4 ° C במשך 5 דקות. שאפו את הסופרנטנט, והשעו מחדש את הגלולה ב 1 מ"ל של חיץ צביעת התא.
- מיון תאי C-Kit+ באופן מגנטי
- בצע את הוראות היצרן כדי למיין את התאים. בקצרה, פריים עמוד מיון מגנטי עם 3 מ"ל של חיץ צביעת תאים. סנן את הדגימה (1 מ"ל) דרך מסננת תאים של 40 מיקרומטר וטען את הדגימה על עמודת המיון המגנטי.
- יש לשטוף על ידי הוספת 3 מ"ל של חיץ צביעת תאים שלוש פעמים. הוסף את מאגר צביעת התאים רק כאשר מאגר העמודות ריק.
- שים את עמוד המיון המגנטי על גבי צינור קר כקרח של 15 מ"ל והוסף 5 מ"ל של חיץ צביעת תאים. שטפו את התאים על ידי דחיפת הבוכנה בחוזקה לתוך העמודה. שמור את הזרימה על קרח.
הערה: במקרה של אובדן דגימה בשוגג, אנו שומרים על הזרימה עד סוף הניסוי.
4. צביעת תאי גזע המטופויטיים
- צנטריפוגה הדגימה שהוכנה בשלב 3.2.3 ב 400 x גרם ו 4 ° C במשך 5 דקות. שאפו את הסופר-נאנט.
- מוסיפים את נוגדן CD34 (שיבוט RAM34) בריכוז של 50 מיקרוגרם / מ"ל לכדור, ודגרים על קרח במשך 60 דקות.
הערה: הכנת התאים התומכים במהלך השעה הראשונה של הדגירה עם CD34 מומלצת כדי לקצר את זמן העיבוד. - הכינו את תערובת האב של הנוגדנים לפי טבלה 1. מוסיפים 100 מיקרוליטר של תערובת האב לדגימה, ודורים על קרח במשך 30 דקות. הנוגדן לאנטיגן CD34 (שיבוט; RAM34) דורש 90 דקות להכתמה מספקת.
- הוסף 4-5 מ"ל של חיץ צביעת תאים. צנטריפוגה הדגימה ב 400 x גרם ו 4 ° C במשך 5 דקות. שאפו את הסופר-נאנט. מוסיפים סטרפטווידין-BUV737 בריכוז של 3 מק"ג/מ"ל לכדורית, ודורים על קרח במשך 30 דקות.
- הוסף 4-5 מ"ל של חיץ צביעת תאים. צנטריפוגה הדגימה ב 400 x גרם ו 4 ° C במשך 5 דקות. שאפו את הסופרנטנט, והשעו מחדש את הגלולה ב-400 מיקרוליטר של חיץ צביעת תאים. שמור את הדגימה על קרח.
5. תמיכה בהכנת התא
- הכינו עכבר קונגני CD45.1+ CD45.2+ בן 12 שבועות; באופן אידיאלי, זה צריך להיות באותו גיל כמו העכבר התורם. יש להרדים את העכבר על ידי חשיפה ל-CO2 ולאחר מכן פריקת צוואר הרחם או שימוש בשיטות שאושרו על ידי ועדת האתיקה המקומית של בעלי חיים.
הערה: בדוגמה שסופקה, עכברים קונגניים CD45.1+ CD45.2+ גודלו בבית על ידי חציית B6. עכברי CD45.1 קונגניים עם עכברי C57BL/6J16. - בתנאים סטריליים, קחו גם את עצם הירך וגם את עצם השוקה, והניחו אותם בכלי תרבית תאים סטריליים עם PBS קר כקרח ללא Ca 2+ו-Mg 2+. קצצו את השרירים והרקמות הסיביות מהעצמות באמצעות פינצטה ומספריים קטנים.
- חותכים את שני קצוות העצמות במספריים חדים וסטריליים. השתמש במחט 23 גרם ובמזרק 5 מ"ל מלא במאגר תרחיף תאים קר כקרח (PBS ללא Ca 2+ ו- Mg2+ בתוספת FBS מומתק חום 2%, 100 U/mL פניצילין וסטרפטומיצין 100 מיקרוגרם/מ"ל) כדי לשטוף את מח העצם החוצה לתוך צלחת תרבית תאים סטרילית עם חיץ תרחיף תאים. לפרק את גושי התאים על ידי pipetting עדין.
- סנן את תרחיף התא דרך מסננת תאים של 40 מיקרומטר באמצעות פיפטה P1,000. ספור את מספר התא של תרחיף התא באמצעות המוציטומטר והכן תרחיף תאי מח עצם המכיל 1 x 106 תאים / מ"ל.
- מעבירים 200 μL של תרחיף תאי מח העצם (2 x 105 תאים) לצלחת בעלת 96 בארות, תחתית עגולה. יש לשמור על קרח עד לשימוש.
הערה: לוחות תחתונים עגולים מומלצים לאיסוף תאים קל.
6. מיון Hoxb5pos או Hoxb5neg pHSC
- הגדרת Gating
- העבירו 400 μL של הדגימה שהוכנה בשלב 4.5 למבחנה עגולה מפוליסטירן עם מכסה הצמדה של מסננת תאים 35 מיקרומטר. הכינו מגיב צביעת תאים מתים, והוסיפו אותו לדגימה לפני הניתוח בהתאם להוראות היצרן.
- הפעל ציטומטר זרימה, והפעל את תוכנת הניתוח בהתאם להוראות היצרן. לאחר מכן, לחץ על טען וקבל את הנתונים.
הערה: מומלץ להשתמש בציטומטר זרימה המצויד בחמישה לייזרים ובפייה של 70 מיקרומטר כדי לשפר את טוהר התאים הממיינים. - לאחר ניכוי כפילים, תאים מתים ותאים חיוביים לשושלת, שער את שבר השושלת−c-Kit+Sca-1+ . לאחר מכן, שער החוצה את החלק Flk2+ . לאחר מכן, שער Hoxb5pos או Hoxb5neg pHSCs בשבר CD150+CD34−/נמוך (איור 2). בצע פיצוי על החפיפה הספקטרלית בניסוי הראשון.
הערה: תאים חיוביים של Hoxb5 צפויים לייצג 20%-25% מהשושלת−c-Kit+Sca-1+CD150+CD34−/FLK2 נמוך.
- מיון Hoxb5pos או Hoxb5neg pHSC
- הכינו צינור קשירת חלבון נמוך של 1.5 מ"ל עם 600 μL של PBS ללא Ca 2+ ו-Mg2+ בתוספת 10% FBS מומת חום.
- הגדר את צינור קשירת החלבון הנמוך של 1.5 מ"ל במכשיר איסוף מיון, ומיין את ה- PCHSC של Hoxb5 pos או Hoxb5 neg לצינורשל 1.5 מ"ל באמצעות אסטרטגיית ה- gating שנקבעה בשלב 6.1.3. במיון הראשון, השתמש בתפוקה ממצב דיוק המיון.
- הגדר את לוח 96 הקידוחים עם התאים התומכים שהוכנו בשלב 5.5 בשלב יחידת תצהיר התאים האוטומטית (ACDU). הגדר את צינור קשירת החלבון הנמוך בנפח 1.5 מ"ל שהוכן בשלב 6.2.2 ליציאת הטעינה של ציטומטר זרימה.
- מיין אתנקודות ה- PHSC של Hoxb5 אוHoxb5 neg ללוח של 96 בארות עם התאים התומכים באמצעות אסטרטגיית gating שנקבעה בשלב 6.1.3. מיין 10נקודות מכירה של Hoxb5 או Hoxb5neg pHSCs כדי לבדוק את יכולות ההתחדשות העצמית שלהם.
הערה: מומלץ לבצע מיון כפול כדי לשפר את הטוהר. במיון השני, השתמש בטוהר כמצב דיוק המיון המומלץ. - בדרך כלל, 500-1,000 pHSCs מסוג Hoxb5pos ו-1,500-4,000 Hoxb5neg pHSCs נקצרים לאחר מיון כפול. המשך בהליכי ההשתלה בהקדם האפשרי לאחר מיון HSC כדי לשפר את כדאיות התא (באופן אידיאלי תוך 1-2 שעות).
7. השתלה
- הניחו את הצלחת הממוינת ב-HSC עם 96 בארות שהוכנה בשלב 6.2.4 על קרח. טפל בצלחת 96 בארות ממוינת HSC בתנאים סטריליים, רצוי במכסה מנוע של תא.
- מרדימים עכבר מושתל עם 2% איזופלורן בתא השראת גז. לאחר שהחיה מורדמת לחלוטין, הוציאו אותה והניחו אותה על צדה. כדי להבטיח הרדמה מספקת, יש לוודא שאין תנועה בתגובה לגירוי מזיק.
- לאחר אישור הרדמה מתאימה, בצע הזרקת רטרו-אורביטל בהקדם האפשרי כדי למנוע מהעכבר לחזור להכרה. הזרקת רטרו-אורביטל אורכת פחות מ-30 שניות.
הערה: מכיוון שזמן ההזרקה קצר, אנו מסיימים את ההליך מבלי למרוח משחת עיניים בעיניים. עם זאת, אם ההליך לוקח זמן רב יותר, אנו ממליצים על שימוש משחה אופתלמית. - מקציפים בעדינות את התאים בצלחת 96 בארות ממוינת HSC כדי לערבב אותם. אספו את התאים התורמים בצלחת המיון באמצעות מזרק אינסולין 30 גרם, והזריקו אותם למקלעת הוורידית הרטרו-אורביטלית של העכברים המקבלים. נפח ההזרקה המומלץ הוא ≤200 μL.
- התבוננו עד שהעכברים יהיו בהכרה וינועו בכלוב נקי. החזירו אותם לכלובים לאחר אישור החלמתם.
8. ניתוח דם היקפי
- לאסוף 50 μL של דם היקפי מן הווריד הזנב, ולהשעות אותו עם 100 μL של Ca 2 + ו Mg 2+ חינם PBS עם2 mM EDTA. מעבירים את כל הדגימות לצלחת של 96 בארות. צנטריפוגה ב 400 x גרם ו 4 ° C במשך 5 דקות, ו להשליך את supernatant.
- מוסיפים 200 μL של חיץ ליזה של תאי דם אדומים, ודגורים על קרח במשך 3 דקות. צנטריפוגו את הדגימות בטמפרטורה של 400 x גרם ו-4 מעלות צלזיוס למשך 5 דקות, והשליכו את הסופרנטנט. חזור על הפעולה פעם נוספת.
- הוסף 200 μL של חיץ צביעת תאים. צנטריפוגו את הדגימות בטמפרטורה של 400 x גרם ו-4 מעלות צלזיוס למשך 5 דקות, והשליכו את הסופרנטנט.
- הכינו תערובת אב נוגדנים לפי טבלה 2. מוסיפים 50 μL של תערובת מאסטר נוגדנים, ודגורים על קרח במשך 30 דקות.
- הוסף 150 μL של חיץ צביעת תאים. צנטריפוגו את הדגימות בטמפרטורה של 400 x גרם ו-4 מעלות צלזיוס למשך 5 דקות, והשליכו את הסופרנטנט.
- הוסף 200 μL של חיץ צביעת תאים. צנטריפוגו את הדגימות בטמפרטורה של 400 x גרם ו-4 מעלות צלזיוס למשך 5 דקות, והשליכו את הסופרנטנט. יש להשהות מחדש ב-200 מיקרוליטר של חיץ צביעת תאים, ולהוסיף מגיב צביעת תאים מתים לפני הניתוח בהתאם להוראות היצרן.
- ניתוח כימריזם דם היקפי באמצעות ציטומטר זרימה כפי שתואר קודם16. יש לאסוף דם לאחר 4 שבועות, 8 שבועות, 12 שבועות ו-16 שבועות לאחר ההשתלה כדי לעקוב אחר בנייה מחדש של שושלות מרובות. תרשימי ציטומטריה של זרימה מייצגת מוצגים באיור 3.
תוצאות
בעבר, יכולת ההתחדשות העצמית נמדדה באמצעות מבחני השתלה תחרותיים, שבהם HSCs של תורמים נחשבים כשומרים על יכולת ההתחדשות העצמית שלהם רק אם תאי תורם רב-שושלות בדם ההיקפי של המקבל נצפים17. בנוסף, מספר דוחות מגדירים LT-HSCs כתאים הממשיכים לייצר תאי דם היקפיים מספר חודשים לאחר השתלת מח העצם השנייה10,18. לכן, על מנת להשוות את יכולות ההתחדשות העצמית שלהם, 10עכברי Hoxb5 pos או Hoxb5neg pHSCs שבודדו מעכברי כתב Hoxb5 הושתלו בעכברים מושתלים ראשוניים המוקרנים באופן קטלני עם 2 x 105 תאי מח עצם שלמים. לאחר מכן, 16 שבועות לאחר ההשתלה הראשונית, 1 x 107 תאי מח עצם שבודדו מהעכברים המושתלים העיקריים הושתלו בעכברים מושתלים משניים שהוקרנו באופן קטלני כדי להעריך את יכולת ההתחדשות העצמית לטווח ארוך (איור 1). איור 2 מראה חלקות ציטומטריה של זרימה מייצגת של ניתוח מח עצם של עכברי Hoxb5-tri-mCherry. כ-20%-25% מהתאים במקטע pHSC שהוגדר על ידי שושלת-c-Kit+Sca-1+CD150+CD34−/lo Flk2− היו pHSCs מסוג Hoxb5pos, המהווים רק 0.001%-0.00125% ממח עצם העכבר. איור 3 מציג חלקות ציטומטריה של זרימה מייצגת של ניתוח הדם ההיקפי בעכברים המושתלים. העכברים שתרמו CD45.2 (עכברי Hoxb5-tri-mCherry), תאים תומכים CD45.1/CD45.2 ועכברים מושתלי CD45.1 הוכנו, בהתאמה, לנתח בנפרד את התאים התורמים, התומכים והמקבלים.
איור 4 מראה ניתוחי דם היקפיים בעכברים המושתלים לאחר 4 שבועות, 8 שבועות, 12 שבועות ו-16 שבועות לאחר ההשתלה כדי לאשר כימריזם של תורם. ניתוחים אלה גילו שאף על פי ש-Hoxb5 pos ו-Hoxb5neg pHSCs מציגים כימריזם דומה מתורם 4 שבועות לאחר ההשתלה, המטופואזיס מתמשך נצפה רק אצל מקבלי Hoxb5pos pHSC (איור 4A,B). מצד שני, Hoxb5neg HSCs החלו לאבד את היכולת לייצר תאים המטופויטיים 8 שבועות לאחר ההשתלה (איור 4A,B). בניתוח ההשתלה השניונית, רק מושתלי Hoxb5pos pHSC הציגו המטופויזיס חזק (איור 5A,B). לעומת זאת, תאי תורם כמעט ולא נצפו בעכברים מושתלי Hoxb5 neg pHSC, דבר המצביע על כך שתאי Hoxb5neg pHSC מאבדים את יכולת ההתחדשות העצמית שלהם תוך 16 שבועות לאחר ההשתלה בעכברים מושתלים ראשוניים. נתונים אלה מראים כי ביטוי Hoxb5 יכול לשמש סמן ספציפי עבור LT-HSCs.

איור 1: סכמה ניסיונית לבדיקות בנייה מחדש המטופויטיות ארוכות טווח. העכברים המקבלים הוקרנו באופן קטלני והושתלו באופן תחרותי עם 10 HSCs ו 2 x 105 תאי מח עצם שלמים (תאים תומכים). עבור השתלות משניות, 1 x 107 תאי מח עצם שלמים הועברו מהעכברים המקבלים העיקריים. קיצורים: PB = דם היקפי; WBM = מח עצם שלם. נתון זה שונה מ- Chen et al.16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
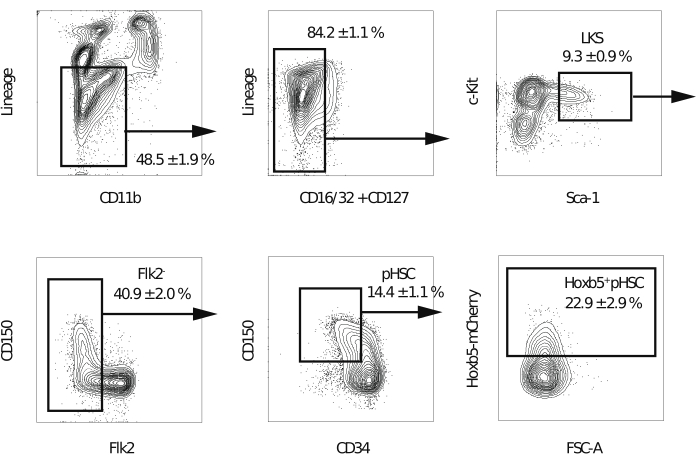
איור 2: אסטרטגיית Gating למיוןHoxb5 pos ו-Hoxb5neg pHSCs. ציטומטריית זרימה מייצגת לבידוד LKS, Flk2−, pHSC, Hoxb5pos ו- Hoxb5neg pHSCs לאחר הרחקת כפילים ותאים מתים. הערכים מציינים את האחוז של כל שבר ± s.d. (n = 3). השושלות כוללות את B220, CD3ε, CD4, CD8a, Gr-1 ו-Ter-119. נתון זה שונה מ- Chen et al.16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
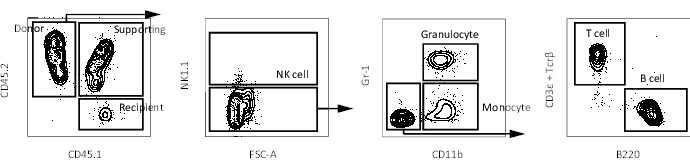
איור 3: חלקות FACS מייצגות של דם היקפי בעכבר מקבל. תוכנית Gating לזיהוי תאי דם היקפיים (תא NK, גרנולוציטים, מונוציטים, תאי T ותאי B) בעכבר מקבל לאחר הרחקה של כפילים ותאים מתים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: כימריזם בעכברים מושתלים לאחר השתלה ראשונית. (A) אחוז הכימריזם לאחר 4 שבועות, 8 שבועות, 12 שבועות ו-16 שבועות אצל מושתלים ראשוניים שקיבלו 10 Hoxb5neg (n = 9), Hoxb5lo (n = 13), או Hoxb5hi (n = 18) pHSCs. כל עמודה מייצגת עכבר בודד. שבר Hoxb5hi הוגדר כשבר 5% העליון של ביטוי Hoxb5 ואחרים כשברHoxb5 lo. (B) התרומה הממוצעת של שושלת התורמים ב-10 השתלות תאים ראשוניות. קווי השגיאה מציינים את ה- s.d. נתון זה שונה מ- Chen et al.16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: כימריזם בעכברים המושתלים לאחר ההשתלה השניונית. (A) אחוז הכימריזם לאחר 4 שבועות, 8 שבועות, 12 שבועות ו-16 שבועות לאחר ההשתלה המשנית של מח עצם שלם. (B) כימריזם של תורם בודד לפי שושלת אצל מושתלים משניים של מח עצם שלם. כל שורה מייצגת עכבר בודד. נתון זה שונה מ- Chen et al.16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| נוגדן | שיבוט | ריכוז | פלואורוכרומים |
| FLK-2 | A2-F10 | 4 מיקרוגרם/מ"ל | PerCP/eFlour710 |
| CD150 | TC15-12F12.2 | 4 מיקרוגרם/מ"ל | BV421 |
| CD11b | M1/70 | 4 מיקרוגרם/מ"ל | BV711 |
| סקה-1 | D7 | 4 מיקרוגרם/מ"ל | BUV395 |
| CD16/32 | 93 | 4 מיקרוגרם/מ"ל | A-700 |
| CD127 | A7R34 | 4 מיקרוגרם/מ"ל | A-700 |
| CD3ε | 145-2ג11 | 10 מיקרוגרם/מ"ל | ביוטין |
| CD4 | GK1.5 | 10 מיקרוגרם/מ"ל | ביוטין |
| CD8a | 53-6.7 | 10 מיקרוגרם/מ"ל | ביוטין |
| Gr-1 | RB6-8C5 | 10 מיקרוגרם/מ"ל | ביוטין |
| B220 | RA3-6B2 | 10 מיקרוגרם/מ"ל | ביוטין |
| צרפת | TER119 | 10 מיקרוגרם/מ"ל | ביוטין |
טבלה 1: תערובת אב נוגדנים לצביעת תאי גזע המטופויטיים.
| נוגדן | שיבוט | ריכוז | פלואורוכרומים |
| CD45.1 | א20 | 1 מיקרוגרם/מ"ל | FITC |
| CD45.2 | 104 | 1 מיקרוגרם/מ"ל | PE |
| Gr-1 | RB6-8C5 | 2.5 מיקרוגרם/מ"ל | A700 |
| NK1.1 | PK136 | 1 מיקרוגרם/מ"ל | PerCP-ציאנין5.5 |
| CD11b | M1/70 | 1 מיקרוגרם/מ"ל | BUV395 |
| CD3ε | 145-2ג11 | 1 מיקרוגרם/מ"ל | BV421 |
| TCRβ | H57-597 | 1 מיקרוגרם/מ"ל | BV421 |
| B220 | RA3-6B2 | 1 מיקרוגרם/מ"ל | BV786 |
טבלה 2: תערובת אב נוגדנים לצביעת תאי דם היקפיים.
Discussion
באופן מסורתי, HSCs המוגדרים על ידי סמנים בפני השטח של התא הוכנו כדי לחקור את הפונקציות של HSCs, כגון יכולת התחדשות עצמית ורב-עוצמה 19,20,21. עם זאת, החלק האימונופנוטיפי המוגדר (Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−) HSC מכיל שתי אוכלוסיות HSC בדידות: LT-HSCs ו-ST-HSCs 9,10. לכן, הניתוח הספציפי של HSCs bonafide, LT-HSCs, עדיין לא הושג. בהתאם לכך, שיטת בידוד עבור LT-HSCs באמצעות מערכת הכתב Hoxb5 תועיל משמעותית לחיפוש אחר המנגנונים המולקולריים של יכולת התחדשות עצמית.
כאן נדון בצעדים קריטיים בפרוטוקול זה. ראשית, יש להשלים את שלב 1 עד שלב 7 ללא הפרעה. צעדים אלה אורכים בדרך כלל 9-12 שעות, וחשוב לשמור על הדגימות בטמפרטורה של 4 מעלות צלזיוס לאורך כל ההליכים הללו, ככל האפשר, על מנת לשמור על כדאיות הדגימה. לאחר מכן, כ 1 x 108 תאי מח עצם נקצרים מעכבר. לכן, עלינו להשתמש בכמות מספקת של נוגדנים על מנת לשחזר את ביצועי הצביעה. בנוסף, הנוגדן לאנטיגן CD34 (שיבוט; RAM34) דורש 90 דקות להכתמה מספקת, בעוד 30 דקות מספיקות לנוגדנים אחרים. שנית, הקרנה גורמת בדרך כלל לפנציטופניה בעכברים המקבלים. אם נויטרופילים שמקורם במושתל קיימים בעכברים מושתלים רבים, הדבר מצביע על כך שמנת הקרינה לא הייתה מספקת. במקרה כזה מומלץ לבצע אופטימיזציה של מינון הקרינה. שלישית, אם רוב העכברים מתים זמן קצר לאחר ההשתלה, ישנם שני הסברים אפשריים: מספר לא מספק של תאים תומכים או הזרקה רטרו-אורביטלית לא מוצלחת.
במשך עשרות שנים, זה היה שנוי במחלוקת אם חלק HSC bonafide הוא הומוגני או הטרוגני22,23,24. במחקר זה, העכברים המושתלים שקיבלו את השתלת Hoxb5pos pHSC הציגו כימרות ודפוסי התמיינות שונים של תורמים (איור 4A), מה שמצביע על כך שחלק זה יכול להיות הטרוגני. עם זאת, תנודות אלה יכולות להיגרם הן על ידי שימוש בתאי מח עצם לא מטוהרים כתאים תומכים והן על ידי רגישויות רדיו שונות של עכברים בודדים25.
לסיכום, הדגמנו פרוטוקול שלב אחר שלב לבידוד LT-HSCs ו-ST-HSCs באמצעות מערכת הכתבים Hoxb5. עד כה, הזיהוי של LT-HSCs היה תלוי במבחן ההשתלה התחרותי, אשר דורש יותר מ 8 חודשים. לעומת זאת, מערכת הכתבים Hoxb5 מאפשרת לנו לזהות הן LT-HSCs והן ST-HSCs באופן פרוספקטיבי ולהשתמש בהם לניתוחים פונקציונליים שונים. איור 4 ואיור 5 מראים גם שרמת הביטוי של Hoxb5 מתואמת עם מידת הכימריזם של התורם בעכברים המקבלים השניים. בנוסף, תוך ניצול מערכת הכתבים Hoxb5, חשפנו בעבר כי LT-HSCs ו- ST-HSCs פועלים באופן משלים לבנייה מחדש המטופויטית מתמשכת לאחר השתלת תאי גזע המטופויטיים26. יתר על כן, הראינו כי ביטוי אקסוגני של Hoxb5 יכול להפוך חלקית את גורל התא של ST-HSCs לזה של LT-HSCs, מה שמצביע על כך שנוכחותו או היעדרו של Hoxb5 מסבירה את ההטרוגניות של יכולת ההתחדשות העצמית בשבר HSC27 המוגדר על פני השטח של התא.
בנוסף לממצאים אלה, הבידוד הפרוספקטיבי של LT-HSCs מאפשר לנו לנתח LT-HSCs בתנאים פיזיולוגיים שונים, כגון הזדקנות, דלקת וכדומה. ניתוחים אלה יקלו מאוד על הבנת הפונקציות של LT-HSCs.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים הקשורים למחקר זה.
Acknowledgements
אנו מודים להירושי קיונארי על הטיפול בבעלי חיים ועל כך שסיפק עכברים מושתלים ב- RIKEN BDR, כמו גם היטומי אוגה, קאיוקו נגאסאקה ומסאקי מיהאשי לניהול מעבדה באוניברסיטת קובה. המחברים גם מעריכים מאוד את התמיכה המתמשכת בעבודה זו. מסאנורי מיאנישי נתמך על ידי האגודה היפנית לקידום המדע (JSPS) מספרי מענק KAKENHI JP17K07407 ו- JP20H03268, קרן הזיכרון Mochida למחקר רפואי ופרמצבטי, קרן מדעי החיים של יפן, קרן המדע טקדה, קרן אסטלס לחקר הפרעות מטבוליות, ו- AMED-PRIME, AMED תחת מענק מספר JP18gm6110020. Taro Sakamaki נתמך על ידי מספרי המענק של JSPS KAKENHI JP21K20669 ו- JP22K16334 ונתמך על ידי תוכנית הליבה לליבה של JSPS ותוכנית עמיתי המחקר הצעירים של RIKEN. Katsuyuki Nishi נתמך על ידי JSPS מספר מענק KAKENHI JP18J13408.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
References
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved