Method Article
Método de aislamiento para células madre hematopoyéticas a largo y corto plazo
En este artículo
Resumen
Presentamos un protocolo paso a paso para el aislamiento de células madre hematopoyéticas a largo plazo (LT-HSCs) y HSCs a corto plazo (ST-HSCs) utilizando el sistema reportero Hoxb5.
Resumen
La capacidad de autorrenovación y el potencial de diferenciación multilinaje se consideran generalmente como las características definitorias de las células madre hematopoyéticas (HSC). Sin embargo, numerosos estudios han sugerido que existe heterogeneidad funcional en el compartimento HSC. Análisis recientes de células individuales han reportado clones de HSC con diferentes destinos celulares dentro del compartimento HSC, que se conocen como clones de HSC sesgados. Los mecanismos subyacentes a los resultados heterogéneos o poco reproducibles son poco conocidos, especialmente con respecto a la duración de la autorrenovación cuando las fracciones purificadas de HSC se trasplantan mediante inmunotinción convencional. Por lo tanto, establecer un método de aislamiento reproducible para las HSC a largo plazo (LT-HSC) y las HSC a corto plazo (ST-HSC), definido por la duración de su autorrenovación, es crucial para superar este problema. Mediante el cribado imparcial de varios pasos, identificamos un factor de transcripción, Hoxb5, que puede ser un marcador exclusivo de LT-HSC en el sistema hematopoyético de ratón. Con base en este hallazgo, establecimos una línea de ratón reportero Hoxb5 y aislamos con éxito LT-HSC y ST-HSC. Aquí describimos un protocolo detallado para el aislamiento de LT-HSC y ST-HSC utilizando el sistema informador Hoxb5 . Este método de aislamiento ayudará a los investigadores a comprender mejor los mecanismos de autorrenovación y la base biológica de dicha heterogeneidad en el compartimento HSC.
Introducción
Las células madre hematopoyéticas (HSC), que poseen capacidad de autorrenovación y multipotencia, residen en el ápice de la jerarquía hematopoyética 1,2. En 1988, Weissman y sus colegas demostraron por primera vez que el aislamiento de las HSC de ratón podría lograrse utilizando la citometría de flujo3. Posteriormente, se informó que una fracción definida por una combinación de marcadores de superficie celular, Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2−, contenía todas las HSCs en ratones 4,5,6,7,8.
Las HSC inmunofenotípicamente definidas (Linaje−c-Kit+Sca-1+CD150+CD34−/loFlk2−) (en adelante, pHSCs) se consideraban previamente funcionalmente homogéneas. Sin embargo, análisis unicelulares recientes han revelado que las pHSCs todavía exhiben heterogeneidad con respecto a su capacidad de autorrenovación9,10 y multipotencia11,12. Específicamente, dos poblaciones parecen existir en la fracción pHSC con respecto a su capacidad de autorrenovación: las células madre hematopoyéticas a largo plazo (LT-HSCs), que tienen capacidad de auto-renovación continua, y las células madre hematopoyéticas a corto plazo (ST-HSCs), que tienen capacidad de auto-renovación transitoria 9,10.
Hasta la fecha, los mecanismos moleculares de la capacidad de autorrenovación que distinguen las LT-HSC y las ST-HSC siguen siendo poco conocidos. Es crucial aislar ambas poblaciones celulares en función de sus capacidades de autorrenovación y descubrir los mecanismos moleculares subyacentes. También se han introducido varios sistemas de notificación para purificar LT-HSC13,14,15; sin embargo, la pureza LT-HSC definida por cada sistema informador es variable, y hasta la fecha no se ha logrado una purificación exclusiva de LT-HSC.
Por lo tanto, el desarrollo de un sistema de aislamiento para LT-HSC y ST-HSC acelerará la investigación sobre la capacidad de autorrenovación en la fracción pHSC. En el aislamiento de LT-HSCs y ST-HSCs, un estudio que utilizó cribado imparcial de múltiples pasos identificó un solo gen, Hoxb5, que se expresa heterogéneamente en la fracción pHSC16. Además, el análisis de médula ósea de los ratones reporteros Hoxb5 reveló que aproximadamente el 20% -25% de la fracción pHSC consiste en célulasPos Hoxb5. Un ensayo de trasplante competitivo utilizando Hoxb5 pos pHSCs y Hoxb5 neg pHSCs reveló que solo Hoxb5pos pHSCs poseen capacidad de auto-renovación a largo plazo, mientras que Hoxb5neg pHSCs pierden su capacidad de auto-renovación en un corto período de tiempo, indicando que Hoxb5 identifica LT-HSCs en la fracción pHSC16.
Aquí, demostramos un protocolo paso a paso para aislar LT-HSC y ST-HSC utilizando el sistema informador Hoxb5 . Además, presentamos un ensayo de trasplante competitivo para evaluar la capacidad de autorrenovación de las pHSC Hoxb5pos/neg (Figura 1). Este sistema reportero Hoxb5 nos permite aislar prospectivamente LT-HSCs y ST-HSCs y contribuye a la comprensión de las características específicas de LT-HSC.
Protocolo
Todos los experimentos con animales descritos fueron aprobados por el Centro RIKEN para la Investigación de Dinámica de Biosistemas.
1. Preacondicionamiento de los ratones receptores
- Preparar ratones congénicos machos C57BL/6 de 8-10 semanas de edad como ratones receptores. El número de ratones receptores depende del protocolo experimental. Por lo general, preparamos de 10 a 20 ratones para cada condición.
- Alimente a los ratones con agua esterilizada suplementada con enrofloxacino (170 mg / L). Como los ratones receptores irradiados son altamente susceptibles a la infección, mantenga las jaulas lo más limpias posible.
NOTA: La suplementación con antibióticos comienza 24 h antes de la irradiación y continúa durante 3 semanas después del trasplante para evitar infecciones.
- Alimente a los ratones con agua esterilizada suplementada con enrofloxacino (170 mg / L). Como los ratones receptores irradiados son altamente susceptibles a la infección, mantenga las jaulas lo más limpias posible.
- Irradiación corporal total
- La irradiación corporal total destruye las células de la médula ósea receptoras para asegurar el injerto de las células del donante. Transfiera los ratones receptores a una jaula de irradiación. Irradiar letalmente a los ratones receptores con una dosis única de 8,7 Gy a las 12-16 h antes del trasplante.
NOTA: La dosis de radiación y el tiempo pueden variar dependiendo del equipo. La dosis de radiación letal debe confirmarse con el irradiador del investigador y la cepa de ratón. - Devuélvalos a sus jaulas después de la irradiación corporal total.
- La irradiación corporal total destruye las células de la médula ósea receptoras para asegurar el injerto de las células del donante. Transfiera los ratones receptores a una jaula de irradiación. Irradiar letalmente a los ratones receptores con una dosis única de 8,7 Gy a las 12-16 h antes del trasplante.
2. Recolección de las células de la médula ósea del donante
- Preparar un ratón macho Hoxb5-tri-mCherry de 12 semanas de edad, y sacrificar al ratón por exposición aCO2 seguida de luxación cervical o utilizando métodos aprobados por el comité local de ética animal.
NOTA: El volumen de reactivo por ratón se describe en los pasos siguientes. - En condiciones estériles, retire la piel y exponga los huesos (fémur, tibia, pelvis, húmero). Corte los músculos principales y tome los huesos (fémur, tibia, pelvis, húmero) del ratón. Colóquelos en platos de cultivo celular estéril con PBS helado sin Ca 2+- y Mg2+.
- Recorte los músculos y los tejidos fibrosos de los huesos con pinzas, tijeras pequeñas y toallitas húmedas para evitar la contaminación. Tenga cuidado de no romperse los huesos durante este paso. Deseche cualquier hueso roto para mantener la esterilidad.
- Esterilizar un mortero con etanol al 70% (EtOH), y dejar secar completamente. Equilibrar con tampón de tinción celular (PBS libre de Ca 2+ y Mg2+ suplementado con FBS inactivado por calor al 2%, 2 mM EDTA, 100 U/ml de penicilina y 100 μg/ml de estreptomicina).
- Coloque los huesos en el mortero y agregue 3 ml de tampón de tinción celular. Aplastar los huesos abiertos con el mortero. Desagregue los grupos celulares mediante un pipeteo suave y transfiera la suspensión celular a través de un filtro celular de 100 μm a un tubo de 50 ml.
- Repita el paso 2.5 hasta que la solución se aclare. Por lo general, tres veces es suficiente.
3. Separación de las células c-kit+ mediante clasificación magnética
- Tinción de anticuerpos para clasificación magnética
- Centrifugar las muestras a 400 x g y 4 °C durante 5 min. Aspirar el sobrenadante y resuspender el pellet en 1 ml de tampón de tinción celular. Añadir 10 μL de IgG de rata (5 mg/ml) para reducir la unión de anticuerpos no específicos, y pipetear suavemente hacia arriba y hacia abajo con una pipeta P1.000. Incubar en hielo durante 15 min.
- Añadir el anticuerpo c-Kit (clon 2B8) a una concentración de 4 μg/ml y mezclar con una pipeta P1.000. Incubar en hielo durante 15 min.
- Agregue 5 ml de tampón de tinción celular y mezcle bien. Centrifugar las muestras a 400 x g, 4 °C, 5 min. Aspirar el sobrenadante y resuspender el pellet en 500 μL de tampón de tinción celular.
- Agregue 35 μL de microperlas anti-APC para enriquecer las células c-Kit+ y mezcle con una pipeta P1,000. Incubar en hielo durante 15 min.
- Agregue 4-5 ml de tampón de tinción celular. Centrifugar las muestras a 400 x g y 4 °C durante 5 min. Aspirar el sobrenadante y resuspender el pellet en 1 ml de tampón de tinción celular.
- Clasificación magnética de las células c-Kit+
- Siga las instrucciones del fabricante para clasificar las celdas. En resumen, prepare una columna de clasificación magnética con 3 ml de tampón de tinción celular. Filtrar la muestra (1 ml) a través de un filtro celular de 40 μm y cargar la muestra en la columna de clasificación magnética.
- Lavar agregando 3 ml de tampón de tinción celular tres veces. Agregue el tampón de tinción celular solo cuando el depósito de columna esté vacío.
- Coloque la columna de clasificación magnética encima de un tubo de 15 ml helado y agregue 5 ml de tampón de tinción celular. Enjuague las celdas empujando firmemente el émbolo hacia la columna. Mantenga el flujo en hielo.
NOTA: En caso de pérdida accidental de la muestra, mantenemos el flujo hasta el final del experimento.
4. Tinción de células madre hematopoyéticas
- Centrifugar la muestra preparada en el paso 3.2.3 a 400 x g y 4 °C durante 5 min. Aspirar el sobrenadante.
- Añadir el anticuerpo CD34 (clon RAM34) a una concentración de 50 μg/ml al pellet, e incubar en hielo durante 60 min.
NOTA: Se recomienda la preparación de las células de soporte durante la primera hora de incubación con CD34 para acortar el tiempo de procesamiento. - Prepare la mezcla maestra de anticuerpos de acuerdo con la Tabla 1. Añadir 100 μL de la mezcla maestra a la muestra, e incubar en hielo durante 30 min. El anticuerpo para el antígeno CD34 (clon; RAM34) requiere 90 minutos para una tinción suficiente.
- Agregue 4-5 ml de tampón de tinción celular. Centrifugar la muestra a 400 x g y 4 °C durante 5 min. Aspirar el sobrenadante. Añadir estreptavidina-BUV737 a una concentración de 3 μg/ml al pellet, e incubar en hielo durante 30 min.
- Agregue 4-5 ml de tampón de tinción celular. Centrifugar la muestra a 400 x g y 4 °C durante 5 min. Aspirar el sobrenadante y resuspender el pellet en 400 μL de tampón de tinción celular. Mantenga la muestra en hielo.
5. Apoyo a la preparación celular
- Preparar un ratón congénico CD45.1+ CD45.2+ de 12 semanas de edad; Idealmente, esta debería ser la misma edad que el ratón donante. Eutanasia del ratón por exposición aCO2 seguida de luxación cervical o utilizando métodos aprobados por el comité local de ética animal.
NOTA: En el ejemplo proporcionado, los ratones congénicos CD45.1+ CD45.2+ fueron criados internamente cruzando B6. Ratones congénicos CD45.1 con ratones C57BL/6J16. - En condiciones estériles, tome tanto los fémures como las tibias, y colóquelos en platos de cultivo celular estéril con PBS helado sin Ca 2+ y Mg2+. Recorte los músculos y tejidos fibrosos de los huesos con pinzas y tijeras pequeñas.
- Corte ambos extremos de los huesos con tijeras afiladas y estériles. Use una aguja de 23 G y una jeringa de 5 ml llena de tampón de suspensión de células heladas (PBS libre de Ca 2+ y Mg2+ suplementado con FBS inactivado por calor al 2%, 100 U/ml de penicilina y estreptomicina de 100 μg/ml) para enjuagar la médula ósea en una placa de cultivo celular estéril con tampón de suspensión celular. Desagregue los grupos de células mediante un pipeteo suave.
- Filtrar la suspensión celular a través de un filtro celular de 40 μm utilizando una pipeta P1,000. Contar el número de células de la suspensión celular con un hemocitómetro y preparar una suspensión de células de médula ósea que contenga 1 x 106 células/ml.
- Transfiera 200 μL de la suspensión de células de la médula ósea (2 x 105 células) a una placa de fondo redondo de 96 pocillos. Mantener en hielo hasta su uso.
NOTA: Se recomiendan placas de fondo redondo para facilitar la recolección de celdas.
6. Hoxb5pos o Hoxb5neg pHSC clasificación
- Configuración de Gating
- Transfiera 400 μL de la muestra preparada en el paso 4.5 a un tubo de ensayo de poliestireno de fondo redondo con una tapa de presión del filtro de células de 35 μm. Prepare el reactivo de tinción de células muertas y agréguelo a la muestra antes del análisis de acuerdo con las instrucciones del fabricante.
- Encienda un citómetro de flujo e inicie el software de análisis de acuerdo con las instrucciones del fabricante. A continuación, pulse Cargar y adquiera los datos.
NOTA: Se recomienda un citómetro de flujo equipado con cinco láseres y una boquilla de 70 μm para mejorar la pureza de las células clasificadas. - Después de excluir dobletes, células muertas y células positivas para linaje, compuerta la fracción Lineage−c-Kit+Sca-1+. A continuación, elimine la fracción Flk2+. Luego, compuerta Hoxb5pos o Hoxb5neg pHSCs en la fracción CD150+CD34−/baja (Figura 2). Realizar la compensación por la superposición espectral en el primer experimento.
NOTA: Se espera que las células positivas para Hoxb5 representen el 20% -25% de la fracción Lineage−c-Kit+Sca-1+CD150+CD34−/Flk2− baja.
- Hoxb5pos o Hoxb5neg pHSC clasificación
- Prepare un tubo de unión a proteínas bajas en 1,5 ml con 600 μL de PBS libre de Ca 2+ y Mg2+ suplementado con FBS inactivado térmicamente al 10%.
- Coloque el tubo de unión a proteínas bajas de 1,5 ml en un dispositivo de recolección de clasificación y clasifique las pHSC Hoxb5pos o Hoxb5neg en el tubo de 1,5 ml utilizando la estrategia de compuerta establecida en el paso 6.1.3. En la primera clasificación, utilice el rendimiento del modo de precisión de clasificación.
- Ajuste la placa de 96 pocillos con las celdas de soporte preparadas en el paso 5.5 en la etapa de la unidad de deposición de células automatizada (ACDU). Coloque el tubo de unión a proteínas bajas de 1,5 ml preparado en el paso 6.2.2 en el puerto de carga de un citómetro de flujo.
- Clasifique laspHSC Hoxb5 pos o Hoxb5neg en una placa de 96 pocillos con las celdas de soporte utilizando la estrategia de compuerta establecida en el paso 6.1.3. Ordene 10 Hoxb5 pos oHoxb5 neg pHSC para probar sus capacidades de autorrenovación.
NOTA: Se recomienda la doble clasificación para mejorar la pureza. En la segunda clasificación, utilice la pureza como el modo de precisión de clasificación recomendado. - Normalmente, 500-1.000Hoxb5 pos pHSCs y 1.500-4.000 Hoxb5neg pHSCs se cosechan después de la doble clasificación. Proceda con los procedimientos de trasplante tan pronto como sea posible después de la clasificación HSC para mejorar la viabilidad celular (idealmente dentro de 1-2 h).
7. Trasplante
- Colocar en hielo la placa de 96 pocillos clasificada por HSC preparada en el paso 6.2.4. Manipule la placa de 96 pocillos clasificada por HSC en condiciones estériles, idealmente en una campana de celda.
- Anestesiar a un ratón receptor con isoflurano al 2% en una cámara de inducción de anestesia con gas. Una vez que el animal esté completamente anestesiado, retírelo y colóquelo de lado. Para asegurar suficiente anestesia, confirme que no hay movimiento en respuesta a un estímulo nocivo.
- Después de la confirmación de la anestesia adecuada, realice una inyección retroorbital lo antes posible para evitar que el ratón recupere la conciencia. La inyección retroorbital tarda menos de 30 s.
NOTA: Dado que el tiempo de inyección es corto, terminamos el procedimiento sin aplicar ungüento oftálmico en los ojos. Sin embargo, si el procedimiento toma más tiempo, recomendamos el uso de ungüento oftálmico. - Pipetea suavemente las células en la placa de 96 pocillos clasificada por HSC para mezclarlas. Recoger las células del donante en la placa de clasificación con una jeringa de insulina de 30 G e inyectarlas en el plexo venoso retroorbital de los ratones receptores. El volumen inyectable recomendado es de ≤200 μL.
- Observe hasta que los ratones estén conscientes y se muevan en una jaula limpia. Devuélvalos a sus jaulas después de confirmar su recuperación.
8. Análisis de sangre periférica
- Recoger 50 μL de sangre periférica de la vena de la cola, y resuspenderla con 100 μL de Ca 2+- y Mg2+-libre de PBS con 2 mM EDTA. Transfiera todas las muestras a una placa de 96 pocillos. Centrifugar a 400 x g y 4 °C durante 5 min, y desechar el sobrenadante.
- Agregue 200 μL de tampón de lisis de glóbulos rojos e incube en hielo durante 3 minutos. Centrifugar las muestras a 400 x g y 4 °C durante 5 min, y desechar el sobrenadante. Repita una vez más.
- Añadir 200 μL de tampón de tinción celular. Centrifugar las muestras a 400 x g y 4 °C durante 5 min, y desechar el sobrenadante.
- Prepare la mezcla maestra de anticuerpos de acuerdo con la Tabla 2. Añadir 50 μL de mezcla maestra de anticuerpos e incubar en hielo durante 30 min.
- Añadir 150 μL de tampón de tinción celular. Centrifugar las muestras a 400 x g y 4 °C durante 5 min, y desechar el sobrenadante.
- Añadir 200 μL de tampón de tinción celular. Centrifugar las muestras a 400 x g y 4 °C durante 5 min, y desechar el sobrenadante. Resuspender en 200 μL de tampón de tinción celular y agregar reactivo de tinción de células muertas antes del análisis de acuerdo con las instrucciones del fabricante.
- Analizar el quimerismo de sangre periférica utilizando un citómetro de flujo como se describió anteriormente16. Recolectar sangre a las 4 semanas, 8 semanas, 12 semanas y 16 semanas después del trasplante para seguir la reconstitución multilinaje. En la Figura 3 se proporcionan gráficos de citometría de flujo representativos.
Resultados
Anteriormente, la capacidad de autorrenovación se ha medido mediante ensayos de trasplante competitivos, en los que se cree que las HSC del donante conservan su capacidad de autorrenovación solo si se observan células donantes de múltiples linajes en la sangre periféricareceptora 17. Además, varios relatos definen las LT-HSC como células que continúan produciendo células de sangre periférica varios meses después del segundo trasplante de médula ósea10,18. Por lo tanto, para comparar sus capacidades de auto-renovación, 10 Hoxb5pos o Hoxb5 neg pHSCs aislados de ratones reporteros Hoxb5 fueron trasplantados en ratones receptores primarios irradiados letalmente con 2 x 105 células de médula ósea entera. Luego, 16 semanas después del trasplante primario, se trasplantaron 1 x 107 células de médula ósea aisladas de los ratones receptores receptores primarios en ratones receptores secundarios irradiados letalmente para evaluar la capacidad de autorenovación a largo plazo (Figura 1). La Figura 2 muestra gráficos de citometría de flujo representativos del análisis de médula ósea de los ratones Hoxb5-tri-mCherry. Aproximadamente el 20%-25% de las células en la fracción pHSC definida por Lineage−c-Kit+Sca-1+CD150+CD34−/loFlk2− eran Hoxb5pos pHSCs, que representan solo el 0,001%-0,00125% de la médula ósea del ratón. La Figura 3 muestra gráficos de citometría de flujo representativos del análisis de sangre periférica en los ratones receptores. Los ratones donantes CD45.2 (ratones Hoxb5-tri-mCherry), las células de soporte CD45.1 / CD45.2 y los ratones receptores CD45.1 se prepararon, respectivamente, para analizar por separado las células donantes, de soporte y receptoras.
La Figura 4 muestra análisis de sangre periférica en los ratones receptores a las 4 semanas, 8 semanas, 12 semanas y 16 semanas después del trasplante para confirmar el quimerismo del donante. Estos análisis revelaron que aunque Hoxb5 pos y Hoxb5neg pHSCs presentan quimerismo donante similar 4 semanas después del trasplante, la hematopoyesis continua se observó solo en los receptores de Hoxb5pos pHSC (Figura 4A, B). Por otro lado, las HSC Hoxb5neg comenzaron a perder la capacidad de producir células hematopoyéticas 8 semanas después del trasplante (Figura 4A, B). En el análisis de trasplante secundario, solo los receptores de Hoxb5pos pHSC presentaron hematopoyesis robusta (Figura 5A, B). En contraste, apenas se observaron células de donantes en los ratones receptores de Hoxb5 neg pHSC, lo que sugiere que las pHSC de Hoxb5neg pierden su capacidad de autorrenovación dentro de las 16 semanas posteriores al trasplante en ratones receptores primarios. Estos datos demuestran que la expresión de Hoxb5 se puede utilizar como un marcador específico para LT-HSCs.

Figura 1: Esquema experimental para ensayos de reconstitución hematopoyética a largo plazo. Los ratones receptores fueron irradiados letalmente y trasplantados competitivamente con 10 HSC y 2 x 105 células de médula ósea entera (células de soporte). Para trasplantes secundarios, se transfirieron 1 x 107 células enteras de médula ósea de los ratones receptores primarios. Abreviaturas: PB = sangre periférica; WBM = médula ósea total. Esta cifra ha sido modificada de Chen et al.16. Haga clic aquí para ver una versión más grande de esta figura.
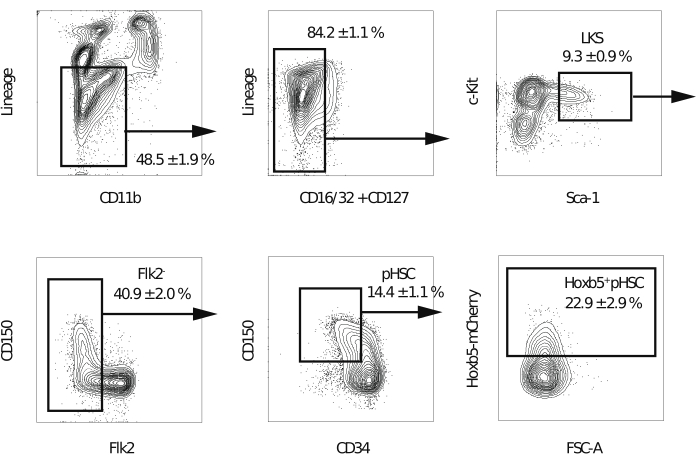
Figura 2: Estrategia de acceso para ordenarHoxb5 pos y Hoxb5neg pHSCs. Citometría de flujo representativa para aislar LKS, Flk2−, pHSC, Hoxb5pos y Hoxb5neg pHSCs después de la exclusión de dobletes y células muertas. Los valores indican el porcentaje de cada fracción ± s.d. (n = 3). Los linajes incluyen B220, CD3ε, CD4, CD8a, Gr-1 y Ter-119. Esta cifra ha sido modificada de Chen et al.16. Haga clic aquí para ver una versión más grande de esta figura.
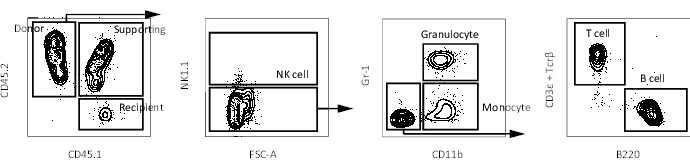
Figura 3: Gráficos representativos del FACS de sangre periférica en un ratón receptor. Esquema de gating para identificar células sanguíneas periféricas (células NK, granulocitos, monocitos, células T y células B) en un ratón receptor después de la exclusión de dobletes y células muertas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Quimerismo en ratones receptores después del trasplante primario. (A) Quimerismo porcentual a las 4 semanas, 8 semanas, 12 semanas y 16 semanas en receptores primarios que recibieron 10 Hoxb5neg (n = 9), Hoxb5lo (n = 13) o Hoxb5hi (n = 18) pHSCs. Cada columna representa un ratón individual. La fracción Hoxb5hi se definió como el 5% superior de la expresión Hoxb5 y otros como la fracciónHoxb5 lo. (B) La contribución promedio del linaje del donante en trasplantes primarios de 10 células. Las barras de error indican el s.d. Esta cifra ha sido modificada de Chen et al.16. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Quimerismo en los ratones receptores después del trasplante secundario. (A) Quimerismo porcentual a las 4 semanas, 8 semanas, 12 semanas y 16 semanas después del trasplante secundario de médula ósea completa. (B) Quimerismo individual del donante por linaje en receptores secundarios de médula ósea total. Cada línea representa un ratón individual. Esta cifra ha sido modificada de Chen et al.16. Haga clic aquí para ver una versión más grande de esta figura.
| Anticuerpo | Clon | Concentración | Fluorocromos |
| Flk-2 | A2-F10 | 4 μg/ml | PerCP/eFlour710 |
| CD150 | TC15-12F12.2 | 4 μg/ml | BV421 |
| CD11b | M1/70 | 4 μg/ml | BV711 |
| SCA-1 | D7 | 4 μg/ml | BUV395 |
| CD16/32 | 93 | 4 μg/ml | A-700 |
| CD127 | A7R34 | 4 μg/ml | A-700 |
| CD3ε | 145-2C11 | 10 μg/ml | Biotina |
| CD4 | GK1.5 | 10 μg/ml | Biotina |
| CD8a | 53-6.7 | 10 μg/ml | Biotina |
| Gr-1 | RB6-8C5 | 10 μg/ml | Biotina |
| B220 | RA3-6B2 | 10 μg/ml | Biotina |
| Ter119 | TER119 | 10 μg/ml | Biotina |
Tabla 1: Mezcla maestra de anticuerpos para la tinción de células madre hematopoyéticas.
| Anticuerpo | Clon | Concentración | Fluorocromos |
| CD45.1 | A20 | 1 μg/ml | FITC |
| CD45.2 | 104 | 1 μg/ml | PEI |
| Gr-1 | RB6-8C5 | 2,5 μg/ml | A700 |
| NK1.1 | PK136 | 1 μg/ml | PerCP-cianina5.5 |
| CD11b | M1/70 | 1 μg/ml | BUV395 |
| CD3ε | 145-2C11 | 1 μg/ml | BV421 |
| TCRβ | H57-597 | 1 μg/ml | BV421 |
| B220 | RA3-6B2 | 1 μg/ml | BV786 |
Tabla 2: Mezcla maestra de anticuerpos para la tinción de células sanguíneas periféricas.
Discusión
Tradicionalmente, las HSC definidas por marcadores de superficie celular se han preparado para estudiar las funciones de las HSC, como la capacidad de autorrenovación y la potencia múltiple 19,20,21. Sin embargo, la fracción HSC inmunofenotípicamente definida (Linaje−c-Kit+Sca-1+CD150+CD34−/lo Flk2−) contiene dos poblaciones discretas de HSC: LT-HSCs y ST-HSCs 9,10. Por lo tanto, el análisis específico de las HSC de buena fe, LT-HSC, aún no se ha logrado. En consecuencia, un método de aislamiento para LT-HSCs utilizando el sistema reportero Hoxb5 beneficiará significativamente la búsqueda de los mecanismos moleculares de la capacidad de autorrenovación.
Aquí, discutiremos los pasos críticos en este protocolo. Primero, el paso 1 al paso 7 deben completarse sin interrupción. Estos pasos suelen durar de 9 a 12 h, y es importante mantener las muestras a 4 °C durante estos procedimientos, tanto como sea posible, para mantener la viabilidad de la muestra. A continuación, se cosechan aproximadamente 1 x 108 células de médula ósea de un ratón. Por lo tanto, necesitamos usar un volumen suficiente de anticuerpos para reproducir el rendimiento de la tinción. Además, el anticuerpo para el antígeno CD34 (clon; RAM34) requiere 90 min para una tinción suficiente, mientras que 30 min es suficiente para otros anticuerpos. En segundo lugar, la irradiación generalmente causa pancitopenia en los ratones receptores. Si los neutrófilos derivados del receptor persisten en muchos ratones receptores, esto indica que la dosis de radiación fue insuficiente. En tal caso, se recomienda la optimización de la dosis de radiación. En tercer lugar, si la mayoría de los ratones mueren poco después del trasplante, hay dos explicaciones posibles: un número inadecuado de células de soporte o una inyección retroorbitaria fallida.
Durante décadas, ha sido controvertido si la fracción HSC de buena fe es homogénea o heterogénea22,23,24. En este estudio, los ratones receptores que recibieron el trasplanteHoxb5 pos pHSC presentaron diferentes quimeras de donantes y patrones de diferenciación (Figura 4A), lo que indica que esta fracción podría ser heterogénea. Sin embargo, estas fluctuaciones podrían ser causadas tanto por el uso de células de médula ósea no purificadas como las células de soporte y las diferentes radiosensibilidades de ratones individuales25.
En resumen, hemos demostrado un protocolo paso a paso para el aislamiento de LT-HSC y ST-HSC utilizando el sistema reportero Hoxb5. Hasta la fecha, la detección de LT-HSCs ha dependido del ensayo de trasplante competitivo, que requiere más de 8 meses. Por el contrario, el sistema reportero Hoxb5 nos permite identificar prospectivamente tanto LT-HSC como ST-HSC y usarlos para diversos análisis funcionales. La Figura 4 y la Figura 5 también muestran que el nivel de expresión de Hoxb5 parece estar correlacionado con el grado de quimerismo del donante en los segundos ratones receptores. Además, aprovechando el sistema reportero Hoxb5, previamente revelamos que las LT-HSC y ST-HSC funcionan de manera complementaria para la reconstitución hematopoyética continua después del trasplante de células madre hematopoyéticas26. Además, demostramos que la expresión exógena de Hoxb5 podría revertir parcialmente el destino celular de las ST-HSC al de las LT-HSC, lo que indica que la presencia o ausencia de Hoxb5 explica la heterogeneidad de la capacidad de auto-renovación en la fracción HSC definida por el marcador de superficie celular27.
Además de estos hallazgos, el aislamiento prospectivo de LT-HSC nos permite analizar LT-HSC bajo diversas condiciones fisiológicas, como envejecimiento, inflamación, etc. Estos análisis facilitarán enormemente la comprensión de las funciones de las LT-HSC.
Divulgaciones
Los autores declaran que no hay conflictos de intereses asociados con este estudio.
Agradecimientos
Agradecemos a Hiroshi Kiyonari por el cuidado de los animales y por proporcionar ratones receptores en RIKEN BDR, así como a Hitomi Oga, Kayoko Nagasaka y Masaki Miyahashi por la gestión del laboratorio en la Universidad de Kobe. Los autores también aprecian enormemente el apoyo continuo a este trabajo. Masanori Miyanishi fue apoyado por la Sociedad Japonesa para la Promoción de la Ciencia (JSPS) KAKENHI Grant Numbers JP17K07407 y JP20H03268, The Mochida Memorial Foundation for Medical and Pharmaceutical Research, The Life Science Foundation of Japan, The Takeda Science Foundation, The Astellas Foundation for Research on Metabolic Disorders, y AMED-PRIME, AMED bajo el número de subvención JP18gm6110020. Taro Sakamaki cuenta con el apoyo de los números de subvención JSPS KAKENHI JP21K20669 y JP22K16334 y cuenta con el apoyo de el JSPS Core-to-Core Program y el RIKEN Junior Research Associate Program. Katsuyuki Nishi fue apoyado por JSPS Número de subvención KAKENHI JP18J13408.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
Referencias
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados