Method Article
İlaç Tedavisini Takiben Tümör Agregaları İçindeki Bölgesel Hücre Yoğunluğunun Tahribatsız Değerlendirilmesi
Bu Makalede
Özet
Mevcut protokol, 3D tümör agregalarında hızlı, tahribatsız ve etiketsiz bölgesel hücre yoğunluğu ve canlılık ölçümü için görüntü tabanlı bir teknik geliştirmektedir. Bulgular, çekirdek bölgelerde agregaların geliştirilmesinde dış katmanlardan daha yüksek hücre yoğunluklarına ve Trastuzumab ile tedavi edilen HER2 + agregalarında ağırlıklı olarak periferik hücre ölümüne sahip bir hücre yoğunluğu gradyanı ortaya koymuştur.
Özet
Çok hücreli tümör sferoidi (MCTS) modelleri, kanser progresyonu ve ilaç keşfinin in vitro çalışması için artan yararlılık göstermiştir. Bu nispeten basit avasküler yapılar, 3D yapı ve patofizyolojik gradyanlar gibi in vivo tümörlerin kilit yönlerini taklit eder. MCTS modelleri, küresel gelişim sırasında ve ilaçlara yanıt olarak kanser hücresi davranışı hakkında fikir verebilir; ancak, gerekli boyutları, tahribatsız değerlendirme için kullanılan araçları büyük ölçüde sınırlar. Optik Koherens Tomografi yapısal görüntüleme ve Imaris 3D analiz yazılımı, MCTS'lerde bölgesel hücre yoğunluğunun hızlı, tahribatsız ve etiketsiz ölçümü için araştırılmıştır. Bu yaklaşım, MCTS'leri 4 günlük bir olgunlaşma süresi boyunca ve klinik olarak ilgili bir anti-HER2 ilacı olan Trastuzumab ile genişletilmiş 5 günlük bir tedavi boyunca değerlendirmek için kullanılır. Kısaca, AU565 HER2 + meme kanseri MCTS'leri, farklı morfolojilerin agregalarını (sırasıyla daha kalın, disk benzeri 2.5D agregaları veya düz 2D agregaları) keşfetmek için Matrigel (bir bazal membran matrisi) ilavesi olsun veya olmasın sıvı kaplama yoluyla oluşturuldu. Dış bölge, geçiş bölgesi ve iç çekirdek içindeki hücre yoğunluğu, olgunlaşmış MCTS'lerde karakterize edildi ve çekirdek bölgelerde dış katmanlara kıyasla daha yüksek hücre yoğunluklarına sahip bir hücre yoğunluğu gradyanı ortaya çıkardı. Matris ilavesi hücre yoğunluğunu yeniden dağıttı ve bu gradyanı geliştirdi, dış bölge yoğunluğunu azalttı ve çekirdeklerdeki hücre sıkıştırmasını artırdı. İlaç yanıtındaki potansiyel bölgesel farklılıkları değerlendirmek için giderek daha derin 100 μm bölgelerinde ilaç tedavisini takiben hücre yoğunluğu (0 saat, 24 saat, 5 gün) ölçüldü. Son zaman noktasında, neredeyse tüm hücre ölümünün her bir agreganın dış 200 μm'si ile sınırlı olduğu görülürken, agreganın derinliklerindeki hücreler büyük ölçüde etkilenmemiş görünüyordu ve muhtemelen ilaç penetrasyonundaki sınırlamalar nedeniyle ilaç yanıtındaki bölgesel farklılıkları gösteriyordu. Mevcut protokol, yoğun hücresel dokulardaki bölgesel hücre yoğunluğunu tahribatsız bir şekilde ölçmek ve uzunlamasına ölçmek için benzersiz bir teknik sağlar.
Giriş
Araştırmacılar, tümör progresyonunun bazı temel özelliklerini incelemek için büyük ölçüde in vitro sistemlerde tezgah üstü 3D kültürüne yöneldiler. Bu araştırmanın çoğu, çok hücreli tümör sferoidlerinin (MCTS'ler) ve daha karmaşık organoidlerinyeniden ortaya çıkmasıyla yönlendirilmiştir 1,2. Bu modeller avasküler olmasına rağmen, in vivo 3,4,5 meydana gelen fizyolojik ve patolojik süreçleri özetlemek için güçlü bir araç sağlarlar. Özellikle, orta büyüklükteki modeller (300-500 μm çapında), 3D yapı, patofizyolojik gradyanlar ve çekirdek içindeki hipoksiye bağlı metastatik sinyalleme gibi temel tümör özelliklerini taklit edebilir. Bu modellerin vaskülarize in vivo tümörlerde görülen karakteristik konsantrik tabakaları, yani proliferatif hücrelerin dış tabakasını, yaşlı/sessiz hücrelerin bir geçiş tabakasını ve çekirdekte hipoksi yaşayan hücreleri gösterdiği iyi belgelenmiştir 3,6,7,8,9 . Bu modellerden, bu katmanlar içindeki hücre davranışını karakterize ederek, gelişim sırasında ve ilaca yanıt olarak benzersiz bir anlayış kazanılabilir. Bununla birlikte, onları in vitro modellerde bu kadar güçlü kılan gradyanları geliştirmek için gerekli olan gerekli MCTS boyutu, tahribatsız değerlendirme için kullanılan araçları büyük ölçüde sınırlar. Gerçekten de, MTCS'lerin tahribatsız analizi ile ilgili en büyük zorluklardan biri, hücre ölçeğindeki ayrıntıları ölçmektir. Parlak alan ve faz kontrastı mikroskopisi, 3D MCTS'lerin büyümesini ve gelişimini tahribatsız bir şekilde değerlendirmek için rutin olarak kullanılır. Bununla birlikte, bu modaliteler 2D projeksiyonlarla sınırlıdır ve bu modellerin10,11,12,13 gibi önemli 3D yapısını görselleştirme kapasitesinden yoksundur. Sitotoksisite ve hücre proliferasyonu ile ilgili bilgiler tipik olarak floresan görüntüleme (yani, ışık tabakası mikroskopisi, konfokal mikroskopi) veya ex vivo immünohistolojik boyama14,15,16 yoluyla toplanır. Bu yaklaşımlar doku yapısı, hücresel yoğunluk ve hücresel fonksiyon hakkında değerli, yüksek çözünürlüklü bilgiler sağlarken, genellikle optik temizleme, sabitleme / boyama veya uzunlamasına analizleri önleyen gömme gibi numune hazırlama gerektirir.
Optik Koherens Tomografi (OKT), yukarıda belirtilen bazı zorlukların üstesinden gelme potansiyeline sahip, tahribatsız bir yapısal görüntüleme yöntemidir. Hücresel çözünürlüğe ve tüm çok hücreli agregaları 17,18,19 görselleştirebilecek kadar geniş bir görüş alanına (10 mm x10 mm'ye kadar) sahiptir. Daha da önemlisi, kullanılan ışığın görünür doğası nedeniyle, bu teknik tamamen tahribatsız ve etiketsizdir17. Ayrıca, numuneler numune hazırlığı gerektirmeden yerinde görüntülenebilir, böylece numuneler doğrudan inkübatörden alınabilir, OCT ile hızlı bir şekilde taranabilir (tarama süresi ~ 5-10 dakika), daha sonra inkübatöre geri döndürülerek uzunlamasına karakterizasyon sağlanabilir. Tümör sferoid davranışını analiz etmek için OKT'yi kullanmayı amaçlayan birçok çalışma yakın zamanda ortaya çıkmıştır. En heyecan verici gösterilerden birinde, Huang ve ark. OCT'yi büyük tümör sferoid modellerindeki nekrotik çekirdekleri tahribatsız bir şekilde tespit etmek için kullandılar ve canlı ve ölü hücre bölgelerinin, etiketsiz canlılık izleme20 için kullanılabilecek optik zayıflamada fark edilebilir farklılıklara sahip olduğunu belirttiler. Benzer şekilde, Hari ve ark., örneklerde hipoksi varlığını incelemek için OCT ile görüntülenen insan kolon kanseri (HCT116) sferoidlerinin kırılma indisi (RI) ölçümlerini gerçekleştirdi21. Ölçümleri doğrudan çıkarımlar için yeterli değildi, ancak daha sonra konfokal mikroskopi ile tanımlanan nekrotik çekirdeklerin alanıyla ilişkili yerlerde, boyut olmasa da daha düşük RI gözlemlediler. Abd El-Sadek ve ark. meme kanseri tümör modellerinin bölgesel doku canlılığını görselleştirmek ve ölçmek için OCT'yi kullandılar22. Doku dinamiklerini görselleştirmek için iki OCT tabanlı yöntem bildirdiler ve bu metriklerdeki farklılıklar ile canlı / ölü hücrelerin mikroskopi ile tanımlanmış bölgeleri arasında ılımlı bir korelasyon gösterdiler.
OCT'yi kullanarak yayınladığımız çalışmamız, gelişim sırasında MCTS'lerin meme kanseri modellerinde 3D morfolojiyi ve hücre sayısını ölçmek için kantitatif, tahribatsız bir yaklaşım oluşturmak için bu önceki literatüre dayanmaktadır10,23. OCT hacim taramalarında görüntülenen hücre boyutundaki nesnelerin (yani lekelerin) sayısını saymak için Imaris 3D render görüntü analiz yazılımı kullanılarak, hücre sayımları, agrega ayrışması üzerine hemositometre ile belirlenenlere istatistiksel olarak benzeyen MCTS'lerde tahribatsız olarak ölçülmüştür. Bununla birlikte, OKT'nin yapısal doğası nedeniyle, nekroz nedeniyle hücre ölümünden sonra hala mevcut olan hücre zarları yanlışlıkla canlı hücreler olarak sayılabilir. Ayrıca, bu karakterizasyon, umut verici bir başarı ile bir ilaç rejimine tabi tutulan bireysel agregalar içindeki hücre canlılığını tahribatsız bir şekilde izlemeye genişletildi10. Önemli olarak, OCT-Imaris yaklaşımımızdan, ayrışma üzerine bu örneklerde karşılaştırılanlarla benzer hücre canlılığının bildirildiği belirtildi. Bu tahribatsız ve etiketsiz hücre yaklaşımı, hücrelerin 3B yapılar içinde ve yoğun agregalar içinde yapı/agrega yapısından ödün vermeden uzunlamasına sayılmasını sağlar.
Bu çalışma, OCT-Imaris'in hem 3D agrega morfolojisini hem de hücre sayısını ölçme yeteneğinden yararlanarak yoğun agregalar içindeki bölgesel hücre yoğunluğunu doğrudan ölçmek için geliştirilmiş bir yaklaşım bildirmektedir. Bu metodolojik ilerleme, MCTS modellerinin karakteristik eşmerkezli katmanları içinde hücrelerin uzamsal dağılımının ve proliferasyonunun daha ayrıntılı bir resmini sağlar. Genel bir ortalama toplam hücre yoğunluğunu hesaplamak yerine, bu tür yerel yoğunluk ölçümleri, sıkıştırma ile ilişkili olanlar gibi hücre yoğunluğu gradyanlarını ortaya çıkarabilir. Bu bölgesel değerlendirme, lokal hücre yoğunluğundaki değişikliklerle ölçüldüğü gibi, bölgesel ilaç yanıtını değerlendirmek için kemoterapötik ile tedavi edilen agregalara da uygulanır. OCT ve gelişmiş görüntüleme analiz yöntemlerinin bu kombinasyonu, hangi bölgelerin hücre yoğunluğunda azalma yaşadığına bağlı olarak ilaç penetrasyonunu araştırmak için kullanılabilecek bölgesel hücre canlılığının ölçülmesini sağlar. Bu, yoğun hücresel dokulardaki ilaca yanıt olarak bölgesel hücre yoğunluğunu ve canlılığını tahribatsız bir şekilde ölçen ve uzunlamasına ölçen ilk rapordur. Üç boyutlu hücre yoğunluğunun ve tüm MCTS'ler boyunca uzamsal dağılımın bu şekilde karakterize edilmesi, kanser tedavisinde ilaç dağıtımını optimize etmeye ve kanser modelinin ilerlemesinin anlaşılmasını geliştirmeye yardımcı olabilir.
Protokol
Bu çalışmada AU565 (HER2+) ve MDA-MB-231 meme kanseri hücre hatları kullanılmıştır (bkz.
1. Tümör agregalarının hazırlanması
- Roswell Park Memorial Institute (RPMI) 1640 bazal ortam (+) kullanarak AU565 (HER2+) meme kanseri hücre büyüme ortamını,% 10 (v / v) fetal sığır serumu ve% 1 penisilin / streptomisin ile desteklenmiş L-glutamin kullanarak hazırlayın (bkz.
- MDA-MB-231 üçlü negatif meme kanseri hücre büyüme ortamını,% 10 (v / v) fetal sığır serumu (FBS), 100 U / mL penisilin / streptomisin ve 2 mM L-glutamin ile desteklenmiş Dulbecco'nun Modifiye Kartal Ortamı (DMEM) kullanarak hazırlayın (bkz.
- Her iki hücre hattının% 70-90 birleşik hücre kültürlerini (~ 3-4 günlük hazırlık) standart koşullarda (37 ° C,% 5 CO2,% 95 bağıl nem) hazırlayın. Standart tripsinizasyon yöntemini izleyerek hücre monokatmanlarını kültür şişelerinden ayırın.
NOT: Hücrelerin tripsine aşırı maruz kalmasını önleyin, canlılıklarını etkileyin.- AU565 hücreleri için, şişedeki hücre ortamını bir pipet kullanarak (veya varsa, boru yoluyla otoklavlanmış bir cam pipet ucuna bağlı bir vakum pompası kullanarak) aspire edin ve 2 mL Tripsin-EDTA ile değiştirin. Şişeyi oda sıcaklığında 3 dakika bekletin ve ardından 4 dakika daha inkübatöre geçin. Daha sonra, tripsini nötralize etmek için şişeye 6 mL büyüme ortamı ekleyin.
- MDA-MB-231 hücreleri için, şişeden hücre ortamını adım 1.3.1'de gerçekleştirilenle aynı şekilde aspire edin ve 1.5 mL Tripsin-EDTA ile değiştirin. 7 dakikalık inkübasyondan sonra, tripsini nötralize etmek için şişeye 8,5 mL büyüme ortamı ekleyin.
- Süspansiyondaki hücre sayısını belirlemek için bir hemositometreye hücre süspansiyonunun 10 μL'sini ekleyin24. Ortamdaki hücreleri istenen konsantrasyonda 2.5 × 105 hücre / mL'de yeniden askıya alın.
- 50 μL hücre süspansiyonunu, yuvarlak tabanlı, yapışmayan, 96 delikli bir plakanın her bir kuyucuğuna dağıtın. Matrigel olmadan hazırlanan süspansiyonlar için (bazal membran matrisi, Malzeme Tablosuna bakınız), her bir kuyucuğa 50 μL düz büyüme ortamı ekleyin.
- Bodrum membran matrisi ile hazırlanan süspansiyonlar için, matris şişesini -20 °C depodan çıkarın ve gece boyunca çözülmesi için buzdolabına koyun. Büyüme ortamı içeren bir kap hazırlayın ve soğutmak için 10 dakika soğutun.
- Dondurulmuş bir pipet ucu kullanarak, matrisi soğutulmuş ortama ekleyin, böylece bu çözeltinin son konsantrasyonu% 5 olur. Bu ortamın 50 μL'sini her bir kuyucuğa ekleyin, böylece bu kuyucuklardaki matrisin son konsantrasyonu% 2.53'tür.
NOT: Önceki çalışmalarda, agrega morfolojisi bu hücre hatları10,25 için değerlendirilmiş ve MDA-MB-231 agregalarının membran matrisinin eklenmesiyle sferoidler oluşturduğunu, matris ve AU565+/- matrisi olmayan MDA-MB-231 kültürlerinin hepsinin disk şeklinde agregalar oluşturduğunu bulmuştur. Yeterince küresel agregaları tanımlamak için 0 (düzlem) - 1.0 (mükemmel küre) arasında bir ölçekte >0.8'lik niceliklendirilmiş sferiklik kullanıldı ve böylece in vivo benzeri davranış26,27 için gerekli yüzey-hacim oranına sahip olması bekleniyordu.
- Her bir kuyucuğun dibinde bir hücre peletinin toplanmasını sağlamak için plakaları tohumlamadan hemen sonra oda sıcaklığında 10 dakika boyunca 123 x g'de santrifüj yapın.
NOT: Bu adım, tohumlamadan sonra mümkün olduğunca çabuk gerçekleşmelidir. Yazarlar, bu adımlar arasındaki çok fazla zamanın, hücrelerin her bir kuyunun dibine ve kenarlarına yerleşmesine izin verdiğini, kuyunun dibinde toplanma ve toplanma yeteneklerini engellediğini gözlemlemişlerdir. - Plakaları 4 gün boyunca inkübe edin, bu noktada hücre agregalarının olgunlaştığı kabul edilir.
NOT: Bodrum membran matrisi ile hazırlanan AU565 agregaları, ilaç yanıt çalışması için ek 5 günlük bir kültür süresi gerektirir (toplam 9 gün, 4. günde ortam değişimi).
2. Trastuzumab'ın (TZM) AU565 hücre agregalarına uygulanması
- AU565 büyüme ortamında 500 μg/mL TZM çözeltisi hazırlayın (bkz. Malzeme Tablosu). 4. Günde, her bir kuyucuğa bu çözeltinin 10 μL'sini ekleyin, böylece her bir kuyucuktaki son konsantrasyon 50 μg / mL'dir.
- Kültür, TZM'nin eklenmesini takiben 5 gün daha toplanır ve kilit zaman noktalarında değerlendirilir.
NOT: Bu çalışmada, ilacı analiz etmek için 0 saat (uyuşturmadan hemen önce), 24 saat ve ilaç sonrası 120 saatlik zaman noktaları kullanılmıştır.
3. Optik Koherens Tomografi görüntüleme
NOT: Buradaki örnekler, her olgunlaşma günü (1-4) boyunca Optik Koherens Tomografi (OCT) ile ve daha sonra seçilen uyuşturulmuş agregalar için 5. günde (ilaç ilavesi sonrası 24 saat) ve 9. günde (ilaç ilavesi sonrası 120 saat) görüntülenmiştir. Bu çalışmada OCT görüntüleme için ticari bir Spektral-Domain Optik Koherens Tomografi (SDOCT, bakınız Malzeme Tablosu) sistemi kullanılmıştır. Bu yaklaşım hemen hemen her OCT sistemine uygun olmasına ve izlenen prosedür genellikle farklı sistemler arasında benzer olmasına rağmen, takip edilen ayrıntılı adımların bazıları mevcut ekipmana özgüdür.
- Yapısal görüntüleme için bir OCT sistemi kullanın. Yüksek çözünürlüklü görüntü toplama için A tarama hızını 5,5 kHz'e ayarlayın. Sıvı ortamdaki numuneler için kırılma indeksini 1,33'e ayarlayın. Voksel boyutunu 1,10 x 1,10 x 2,58 μm3 olarak ayarlayın.
- Ekranın sağ tarafındaki Görüntü Parametreleri penceresinde, X, Y ve Z değerlerini (mm cinsinden) girerek görüş alanını (FOV) örnek bu ilgi alanı içinde kapsanacak şekilde ayarlayın.
NOT: Bu çalışmalar için FOV tipik olarak 1.5 x 1.5 x 0.5 mm3 olarak ayarlanmıştır. 'Açı' girişini 0 ila 90 derece arasında değiştirerek ve görsel onay gerçekleştirerek numunenin bu bölgeye sığdığından emin olun. - 3D Alma Modu'na tıklayın ve ardından örneğin 3D hacim taramasını toplamak için Kaydet'e tıklayın.
4. Görüntü analizi
- OCT dosyasını yazılım biçiminde dışa aktarın (Imaris, bkz.
- OCT dosyasını yazılım geliştirme kitinde açın. Dışa Aktar'a tıklayın, dosya türünü .jpg ayarlayın ve görüntüleri boş bir klasöre aktarın.
- Görüntü işleme yazılımını açın (FIJI, bkz. Malzeme Tablosu) ve dışa aktarılan JPEG'lerin depolandığı klasörden görüntü dizisini içe aktarın. Görüntü dizisini bir araya getirmek için yazılım kullanın ve ardından bu dosyayı TIFF görüntüsü olarak kaydedin.
- Aşağıdaki adımları izleyerek bir birim yeniden yapılandırması oluşturun.
- Imaris'i açın ve Arena içinde dönüştürülen TIFF dosyasına gidin. Görüntü Özelliklerini Düzenle> ye gidin ve OCT görüntüsündeki voksel boyutunu (μm cinsinden) ilgili XYZ kutularına girin. Ardından, Tamam'a tıklayın.
NOT: Ekranın sol tarafındaki örnek nesne ağacında, yazılım gecikmesini önlemek için Ses düzeyi sekmesinin seçimini kaldırın. - Nesneler ağacının üstündeki Yeni Yüzeyler Ekle'ye tıklayın. Ağacın altındaki menüde, Otomatik Oluşturmayı Atla üzerine tıklayın ve manuel olarak düzenleyin. Görüntü Ayarı penceresinde, örnek ile arka plan arasındaki kontrastı artırmak ve örnek görselleştirmeyi geliştirmek için kırmızı ve siyah okları manuel olarak kaydırın.
- 'Dilim konumunu' numunenin bir kenarındaki dilime, yani numune sinyalinin ilk göründüğü yere ayarlayın. Fareyi Gezinti modundan Seç moduna değiştirmek için escape tuşunu kullanın ve ardından Çiz'e tıklayın. Sinyali görüntüleyen bölgenin anahattını manuel olarak izleyin.
- Giriş kutusuna bir sonraki konumu girerek dilim konumunu ilerletin. Bu sonraki pozisyon, numuneye bir öncekinden ≤100 dilim daha fazla olmalıdır. Sinyali görüntüleyen bölgeyi manuel olarak izleyin.
- Numunenin karşı kenarına ulaşılana kadar numunenin kalınlığı boyunca Adım 4.2.4'ü tekrarlayın. Ardından, bu dilimleri bir araya getirmek ve hacim yeniden yapılandırmasını tamamlamak için sol menüdeki Yüzey Oluştur'a tıklayın.
- Düzenle'ye ve ardından Maske Seçimi'ne tıklayın. Bu, Görüntü Ayarı penceresinde yalnızca yalıtılmış örneği içeren yeni bir kanal oluşturur. Numunenin morfolojik özellikleri artık İstatistik > Ayrıntılı sekmesinde bulunabilir.
NOT: Bu yaklaşım, bu güncel çalışmada bildirilen sferisite ve hacimleri belirlemek için izlenmiştir.
- Imaris'i açın ve Arena içinde dönüştürülen TIFF dosyasına gidin. Görüntü Özelliklerini Düzenle> ye gidin ve OCT görüntüsündeki voksel boyutunu (μm cinsinden) ilgili XYZ kutularına girin. Ardından, Tamam'a tıklayın.
- Aşağıdaki adımları izleyerek bir numunenin toplam hücre yoğunluğunu elde edin.
- Nesne ağacının üstünde, Yeni Noktalar Ekle'yi seçin. Algoritma Ayarları menüsünde, tüm kutuların seçimini kaldırın. Kaynak Kanal ekranına gitmek için Mavi Ok'a tıklayın.
- Görüntülenen açılır menüden, adım 5.2.8'de oluşturulan ve genellikle Kanal 2 olarak adlandırılan maskelenmiş kanalı seçin. XY çap kutusuna numunenin ortalama hücre çapını girin. Arka Plan Çıkarma seçeneğinin işaretli olduğundan emin olun.
NOT: AU565 ve MDA-MB-231 hücreleriyle yapılan bu çalışma için çap 10 μm olarak ayarlanmıştır. Bu seçim hücre boyutunu temel alır (Tartışma bölümünde açıklanmıştır).
- Görüntülenen açılır menüden, adım 5.2.8'de oluşturulan ve genellikle Kanal 2 olarak adlandırılan maskelenmiş kanalı seçin. XY çap kutusuna numunenin ortalama hücre çapını girin. Arka Plan Çıkarma seçeneğinin işaretli olduğundan emin olun.
- Noktaları Sınıflandırın ekranına gitmek için Mavi Ok'a tıklayın. Menünün altındaki grafikte, sarı eşiğin sol kenarını tıklayıp grafiğin sol kenarına sürükleyin, böylece tüm nesneler sarı gölgeli eşiğe dahil edilir. Ardından, spot oluşturma işlemini tamamlamak için Yeşil Ok'a tıklayın.
- İstatistikler > Genel > Toplam Nokta Sayısı'na tıklayarak tanımlanan nesnelerin sayısını (örneğin, örnek hücre sayısını) elde edin.
- Ortalama toplam hücre yoğunluğunu belirlemek için, toplamın hücre sayısını (adım 4.3.3'te ölçülen) toplam hacme (adım 4.2.6'da belirlenen) bölün.
- Nesne ağacının üstünde, Yeni Noktalar Ekle'yi seçin. Algoritma Ayarları menüsünde, tüm kutuların seçimini kaldırın. Kaynak Kanal ekranına gitmek için Mavi Ok'a tıklayın.
- Küresel agregaların eşmerkezli katmanlarında bölgesel yoğunluğu değerlendirin (Şekil 1A).
- Morfolojik ve hücre yoğunluğu analizini takiben, bölgesel yoğunluğu değerlendirin. Adım 4.2.5'te oluşturulan yüzeye tıklayın ve Yüzeyler Stili/Kalitesi sekmesine gidin. En iyi görünürlük için seçimi Merkez Noktası olarak değiştirin ve piksel genişliğini ≤20 olarak değiştirin. İstatistikler > Ayrıntılı > Konumu'na gidin ve merkez noktanın konumunu kaydedin.
- Nesne ağacının üstündeki menüden Yeni Referans Çerçevesi Ekle'yi seçin. Menüde XY'nin yanındaki Görünür ve Düzelt kutularını işaretleyin. Referans çerçevesi simgesinin ortasını, orta noktayla aynı hizada olacak şekilde tıklatın ve sürükleyin. XY Görünür ve Düzelt kutularının seçimini kaldırın ve XZ için seçin.
- Bir kez daha, referans çerçevesi simgesinin merkezini tıklayın ve merkez noktasıyla aynı hizada olacak şekilde sürükleyin. Son olarak, referans çerçevesi merkez noktasıyla mükemmel bir şekilde hizalanana kadar bu üç sabit düzlem arasında geçiş yaparak YZ düzlemi için bunu tekrarlayın. Nesne ağacındaki referans çerçevesine çift tıklayın ve Orta veya Benzer olarak yeniden adlandırın.
- Adım 4.3'te oluşturulan noktalara tıklayın ve İstatistik > Ayrıntılı > Konum Referans Çerçevesi'ne gidin. En yüksek değerden en düşük değere doğru sıralanana kadar Konum X Referans Çerçevesi'ne tıklayın. En yüksek değeri kaydedin - bu, numunenin en uzak kenarını, yani numune yarıçapını gösterir.
NOT: Burada kullanılan örnekler XY düzleminde dairesel olduğundan, hesaplamalar X veya Y ekseni boyunca benzer sonuçlarla gerçekleştirilebilir. X-Y simetrisi göstermeyen numuneler için (asimetrik, elipsoid, düzensiz geometriler vb.) bu analizlerin birden fazla eksen boyunca yapılması önerilir. - İstatistikler'e gidin. Menünün sağ alt köşesinde, Tüm İstatistikleri Dosyaya Aktar'ı tıklayın ve verileri bir e-tabloya kaydedin.
- X ekseni boyunca eşmerkezli katmanları tanımlamak için manuel hesaplamalar yapın.
NOT: Bu çalışmada kullanılan örnekler yaklaşık 500 μm çapındadır; Böylece, iki dış 200 μm kalınlığında eşmerkezli bölge ve bir iç 100 μm kalınlığında merkezi bölge vardır. Difüzyon davranışlarının bu mesafe7,28,29,30 arasında değişmesi beklendiğinden 200 μm kalınlığındaki bölgelerin korunması önerilir. Bu mantığa uygun olarak, daha büyük numuneler için daha fazla eşmerkezli bölge kullanılması ve daha küçük numuneler için bunun tersi de önerilir. - Adım 4.4.3'te bulunan dış yarıçaptan 200 μm çıkararak 200 μm'lik bir dış katman bölgesi ayarlayın. Böylece, dış bölge, Xyarıçapı ile Xdış, iç kenar arasında X konumlu noktaları kapsayacaktır (Şekil 1A, turuncu bölge).
- Xdış, iç kenardan 200 μm çıkararak bir geçiş bölgesi ayarlayın. Geçiş bölgesi, Xdış, iç kenar ve Xgeçişi , iç kenar arasında X konumlu noktaları kapsayacaktır (Şekil 1A, pembe bölge).
- Örnek merkezi ile Xgeçişi, iç kenar arasındaki kalan noktaları kapsayan merkezi bir çekirdek bölgesi ayarlayın (Şekil 1A, mavi bölge).
- 4.4.4. adımda oluşturulan kaydedilmiş e-tablo dosyasını açın. Kaynak Referans Çerçevesinden Uzaklık sekmesine gidin.
- Çekirdek bölgedeki nokta sayısını 'COUNTIF (Sütun x, "< Xgeçişli, iç kenar"), buradax Sütunu 'Kaynak Referans Çerçevesinden Uzaklık' sütunudur. Elde edilen değer, bu bölgedeki hücre numarasıdır. Hücre yoğunluğunu elde etmek için bu değeri bölgenin hacmine bölün.
- Benzer şekilde, 'COUNTIF (Sütun x, "< Xdış, iç kenar") - COUNTIF (Sütunx, "> Xgeçişli, iç kenar") kullanarak geçiş bölgesindeki hücre sayısını hesaplayın.
- Dış bölgedeki hücre sayısını 'COUNTIF' (Sütunx,"> Xgeçişli, iç kenar) kullanarak hesaplayın.
- Küresel olmayan örneklerdeki bölgesel hücre yoğunluğunu 'Bölgesel Tapalar' aracılığıyla değerlendirin (Şekil 1B).
NOT: Konsantrik katmanlara sahip olmayan küresel olmayan numuneler için, agrega boyunca çeşitli radyal derinliklerde yerel hücre yoğunluğunu örneklemek için 'Bölgesel Fiş' yöntemi geliştirilmiştir.- Merkezi referans çerçevesini (Şekil 1B, merkezi sarı daire) ayarlamak ve toplam örnek yarıçapını elde etmek için 4.4.1-4.4.3 arasındaki adımları yineleyin.
- Referans çerçevelerinin geçiş ve dış bölgeler içindeki yerleşimini tanımlamak için manuel hesaplamalar yapın, böylece hücre yoğunluğu bu konumlardaki numunede değerlendirilebilir.
- Dış konumu hesaplamak için, adım 4.5.1'deki örnek yarıçap değerinden 50 μm çıkarın ve bu değeri X konumu olarak kullanın.
NOT: Numunenin X ekseni boyunca hücre yoğunluğunu ölçmek üzere belirli bir numune içindeki tüm fişler için adım 4.5.1'de kaydedilen aynı Y ve Z konum değerlerini kullanın (Şekil 1B, en soldaki sarı daire). - Nesne ağacının üstünde, Yeni Noktalar Ekle'ye tıklayın ve Otomatik Oluşturmayı Atla, Manuel Olarak Düzenle'ye tıklayın. İşaretçi 'seç' modundayken, ekrana bir nokta yerleştirmek için shift tuşunu basılı tutun. Soldaki menüye, yukarıda hesaplanan XYZ konum değerlerini girin. En iyi görünürlük için XY ve Z çaplarını ≤20 olarak ayarlayın.
- Bu nokta konumuna bir referans çerçevesi eklemek için adım 4.4.2'yi yineleyin. Bu başvuru çerçevesini nesne ağacının dışındaki veya benzerinde yeniden adlandırın.
- Geçiş (orta nokta) konumunu hesaplamak için, Xmerkez konum değerinin ve Xdış konum değerlerinin ortalamasını bulun. Bu değeri, geçiş referans çerçevesi için X konumu olarak kullanın. Yukarıdaki gibi, numunenin X ekseni boyunca hücre yoğunluğunu ölçmek için belirli bir numunedeki tüm fişler için adım 4.5.1'de kaydedilen aynı Y ve Z değerlerini kullanın (Şekil 1B, orta sarı daire).
- Orta referans çerçevesini bu konuma yerleştirmek için adım 4.4.2'yi tekrarlayın ve oluşturulduktan sonra 'geçişli' veya benzeri bir şekilde yeniden adlandırın.
- Dış konumu hesaplamak için, adım 4.5.1'deki örnek yarıçap değerinden 50 μm çıkarın ve bu değeri X konumu olarak kullanın.
- Adım 4.3'te oluşturulan noktalara tıklayın ve İstatistikler'e gidin. Menünün sağ alt köşesinde, Tüm İstatistikleri Dosyaya Aktar'ı tıklayın ve verileri bir e-tabloya kaydedin.
- E-tabloyu açın. Kaynak Referans Çerçevesinden Uzaklık sekmesine gidin. Her nesnenin referans çerçevelerine olan uzaklığı A sütununda gösterilir ve her nesne için referans çerçevelerinin gruplandırılması G sütununda gösterilir.
- Her referans çerçevesindeki mesafelerle çalışmak için bu sütundaki değerleri filtreleyin. Referans çerçevelerinin her biri için, 'COUNTIF (Sütun x, "≤50") işlevini kullanarak çerçevenin 50 mikrometre içindeki nesnelerin sayısını hesaplayın; buradax Sütunu, her grup için 'Kaynak Referans Çerçevesinden Uzaklık' sütunudur. Elde edilen değer, bu bölgesel fişteki hücre sayısına karşılık gelir. Hücre yoğunluğunu elde etmek için bu değeri 100-μm fişin hacmine bölün.
- Mekansal Olarak Rafine Edilmiş Bölgesel Fiş yöntemini gerçekleştirin (Şekil 1C).
NOT: Bu yaklaşım, ilaç uygulamasına yanıt olarak bölgesel hücre canlılığını değerlendirmek için kullanılmıştır. Daha fazla referans çerçevesi eklemek, model kalınlığı boyunca hesaplanabilen hücre yoğunluklarının çözünürlüğünü artırır.- Merkez referans çerçevesini (Şekil 1C, merkezi sarı daire) ayarlamak ve örnek yarıçapını elde etmek için 4.4.1-4.4.3 arasındaki adımları yineleyin.
- İlgilenilen ek yerleri belirlemek için el ile hesaplamalar yapın. Bunu yapmak için, X merkez değerine 100 μm ekleyin ve ardından merkez eksen boyunca ilk konumu tanımlamak içinmerkez noktasının Y ve Z değerlerini kullanın. Bu konuma adım 4.4.2'de olduğu gibi bir referans çerçevesi ekleyin (Şekil 1C, orta daireye bitişik sarı daire).
NOT: Daha yüksek çözünürlüklü yoğunluk izleme istiyorsanız bu adımda daha az μm ekleyin. - 4.6.2 adımlarını tekrarlayın ve numunenin kalınlığı boyunca eşit aralıklı tapalardan oluşan bir eksen oluşturmak için her sıralı X konumuna 100 μm (veya istenen sayıda μm) ekleyin. Son referans çerçevesini numunenin dış yarıçapından ≤50 μm uzağa yerleştirin (Şekil 1C, sarı daireler).
- Her 100 μm çaplı tıkaçta hücre sayılarını elde etmek için 4.5.3-4.5.5 arasındaki adımları yineleyin. Yerel hücre yoğunluğunu elde etmek için bu değerleri karşılık gelen her fişin hacmine bölün.
- İlaç denemesinin her zaman noktasında toplanan OCT verileri için bu bölümdeki tüm adımları tekrarlayın. Tedavi süresi boyunca her bir konumdaki hücre sayısının karşılaştırılması, hücre yoğunluğunun nerede azaldığını (yani, hücre ölümü yaşayan bölgeler) ve sonuç olarak, ilacın ne kadar derine nüfuz ettiğini (yani, hangi katmanların hücre yoğunluğunda bir düşüş gördüğünü, hücre yoğunluğu seviyelerinde bir artış gösterenlere karşı hücre yoğunluğunu koruduğunu veya gösterdiğini) ortaya çıkarmalıdır.
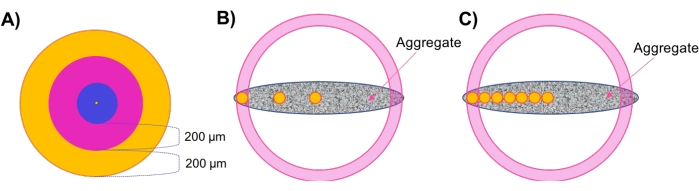
Şekil 1: Şematik çizim . (A) Küresel agregalarda bölgesel hücre yoğunluğunu değerlendirmek için eşmerkezli katman (kabuklar) yaklaşımı. (B) Bölgesel tapa yöntemi, her bölgede/kalınlıkta yoğunluk göstergesi olarak küçük (100 μm çapında) küresel tapaların (sarı renkle gösterilen) kullanıldığı küresel olmayan agregalarda yerel hücre yoğunluğunu değerlendirmek için geliştirilmiştir. (C) İlaç penetrasyon çalışmaları için mekansal olarak rafine edilmiş bölgesel tıkaç yöntemi kullanılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Önceki bir yayında,10 Ekim kullanılarak hücresel agregalar içindeki küresel hücre yoğunluğunun tahribatsız ölçümü için bir yöntem oluşturulmuştur. Burada, bu teknik, gelişmekte olan hücre agregalarının bölgesel hücre yoğunluğunu değerlendirmek için genişletilmiştir. Şekil 1, hücre yoğunluğunun, Şekil 1B, C'deki sarı dairelerle gösterilen küçük (100 μm çapında) küresel tıkaçlara bakılarak bir sferoidin eşmerkezli katmanlarında veya daha yerel olarak değerlendirilebildiği bu uzantının bir şemasını göstermektedir. MDA-MB-231 tümör sferoidleri başlangıçta agrega içinde bir merkez noktası belirleyerek ve sferoidin ardışık konsantrik katmanlarındaki nesne / hücre sayısını sayarak değerlendirildi. Bu sonuçlar Şekil 2'de sunulmuştur. Öğrencinin t-testi, küresel çekirdekte geçişsel (p = 4.3e-4) ve dış katmanlardan (p = 4.0e-6) anlamlı derecede daha yüksek hücre yoğunluğu ortaya koydu. Bu sonuç, 4 gün sonra küresel çekirdekte sıkışmayı gösterir.

Şekil 2: Küresel MDA-MB-231 agregaları için eşmerkezli katman yaklaşımı ile hesaplanan bölgesel yoğunluk farklılıkları. Şekil, toplam çekirdekte en yoğun şekilde paketlenmiş hücrelere (n = 3) sahip radyal hücre yoğunluğu gradyanını ve çekirdekten uzaklıkla azalan yerel hücre yoğunluğunu göstermektedir. Ortalama toplam hücre sayısı mavi bir çizgiyle gösterilir. İç görüntünün ölçek çubuğu 100 μm'dir. Ortalama ± SD olarak gösterilen veriler (*= p < 0,05, ***= p < 0,001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bununla birlikte, bu eşmerkezli katman tekniğinin bir sınırlaması, yalnızca küresel agregalarda kullanılabilmesidir. Böylece, hücre sayma yaklaşımı, sanal bir biyopsiye benzer şekilde, agrega yoluyla sıralı konumlardaki küçük bölgeleri örnekleyen bir Bölgesel Fiş yöntemi oluşturmak için uyarlanmıştır. Bu tıkaçlar, belirli derinliklerde yerel hücre yoğunluğunun ölçümlerini sağlar. Bu teknik, aynı MDA-MB-231 sferoidleri üzerinde analizler yapılarak eşmerkezli tabaka yaklaşımına karşı doğrulanmıştır (Şekil 3). Sonuçlar, bu küresel agregalar için bölgesel tıkaç ve eşmerkezli katman yaklaşımları arasında iyi bir uyum olduğunu göstermiştir. Öğrencinin t-testleri, dış ve geçiş katmanlarını ölçme yaklaşımları (sırasıyla p = 0.243 ve 0.484) ile toplam çekirdekteki yoğunlukları hesaplarken hafif ama anlamlı bir fark (p = 0.017) arasında istatistiksel bir fark ortaya koymamıştır.
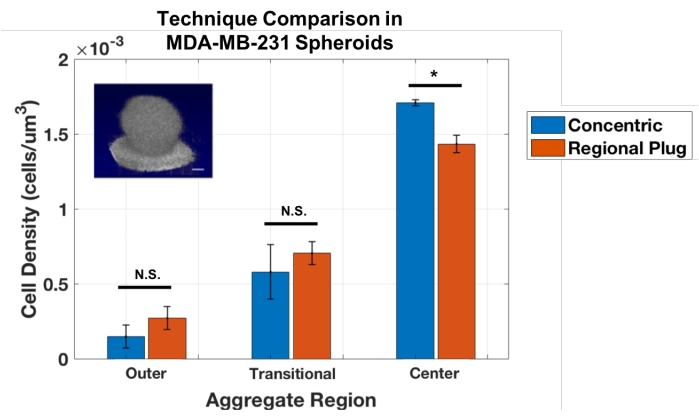
Şekil 3: Konsantrik bölge ve bölgesel tapa yaklaşımları, küresel MDA-MB-231 agregalarında hücre yoğunluğunu ölçmek için benzer sonuçlar verir (n = 3). Ortalama ± SD olarak gösterilen veriler (* = p < 0,05). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu teknik daha sonra, olgunluğun 4. Gününde hem küresel hem de küresel olmayan tümör agregalarını değerlendirmek için uygulandı (Şekil 4), hücre tipine bakılmaksızın test edilen tüm morfolojiler için çekirdek sıkıştırmaya yönelik benzer bir eğilim gözlendi. Bu eğilim en çok, agregasyonu teşvik ettiği bilinen, ancak eksojen faktörleri ve bileşimi zayıf bir şekilde karakterize edilenbir katkı maddesi olan Matrigel (bazal membran matrisi) ile hazırlanan örneklerde belirgindi. İlginç bir şekilde, matrisin eklenmesi hacmi veya hücre sayısını etkilemiyor gibi görünmektedir ve bu nedenle hücre çoğalması üzerinde ihmal edilebilir bir etkiye sahip gibi görünmektedir. Daha ziyade, matris ilavesi hücre yoğunluğunu yeniden dağıtıyor, önemli çekirdek sıkıştırmasını teşvik ediyor ve dış katmanlardaki hücre yoğunluğunu azaltıyor gibi görünüyor. Bu sonuçlar ayrıca AU565 hücrelerinin matris aracılı toplama etkilerine MDA-MB-231 hücrelerinden daha az duyarlı göründüğünü göstermektedir. Bu bulgular, matrisin farklı meme kanseri hücre hatlarında hücre agregasyonunu sağladığı fiziksel mekanizmalar hakkında değerli bilgiler sağlar. Önemli olarak, bölgesel fiş yaklaşımı, küresel veya küresel olmayan agrega geometrileri gösteren tüm MCTS'lere uygun olmalıdır.

Şekil 4: Matriks ilavesi daha fazla agregasyonu teşvik eder ve kanser hücre hatlarında hücre yoğunluğunu yeniden dağıtır. Hem MDA-MB-231 (A, B) hem de AU565 (C, D) hücre hatları için, matris ilavesi dış bölgedeki yoğunluğu azaltır ve genel hücre sayısını önemli ölçüde değiştirmeden merkezdeki sıkıştırmayı (n = 3) arttırır. Ortalama toplam hücre sayıları mavi çizgilerle gösterilir. İç ölçek çubukları = 100 μm. Ortalama ± SD olarak gösterilen veriler (*= p < 0,05, **= p < 0,01, ***= p < 0,001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Daha sonra, bu bölgesel tıkaç yaklaşımı, TZM ile tedavi edilen tümör agregalarında hücre ölümünü tahribatsız olarak izlemek için kullanıldı. Membran matrisi ile hazırlanan AU565 MCTS'ler, gelişimin 4. gününde TZM ile tedavi edildi ve 9. güne kadar, 0 saat (ilaç öncesi), 24 saat ve 120 saat (5 gün) anahtar OCT görüntüleme zaman noktaları ile kültürlendi. Uzamsal olarak tanımlanmış bölgesel tapa yöntemi, Şekil 1C'deki sarı dairelerde gösterildiği gibi, her bir agreganın tüm kalınlığı boyunca her 100 μm'de bir tapalarla her 100 μm'de bir ayarlanmış olarak her zaman noktasında uygulanmıştır. Orta fişin boyutu sabit tutulurken, dış fişin çapının dalgalanmasına izin verildi, bu da agrega boyutunun değişmesine karşılık geldi. Hücre yoğunluğundaki küçük dalgalanmalar, her bir agreganın iç 500 μm'sinde zaman içinde gözlendi ve bu da minimum hücre ölümünü gösterdi (Şekil 5). Gerçekten de, çoğu hücre ölümü, her bir agreganın dış 200 μm'sinde, özellikle de analiz edilen tüm agregalar için 120 saatlik zaman noktasında tamamen kaybolan en dıştaki 100 μm'de meydana geldi. Hücre ölümünün çoğunlukla MCTS'lerin dış katmanlarında gösterge ilaç yanıtı olarak görselleştirilmesi, moleküler ağırlığı 145 kDa34 olan klinik olarak ilgili bir antikor ilacı olan TZM'nin ilaç penetrasyon sorunları ile tutarlıdır. Gerçekten de, ilaç, modellere 200 μm'den daha derine nüfuz etme kabiliyetine meydan okuması beklenen bu yoğun hücresel modeller aracılığıyla pasif difüzyona dayanır.
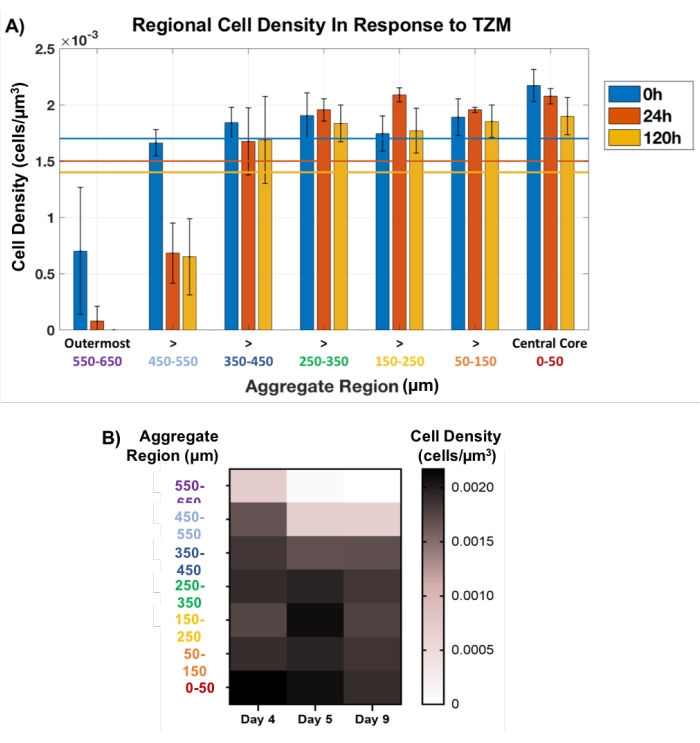
Şekil 5: İlacın cevabında hücre canlılığı, agrega kalınlığı boyunca ölçülür. İç çekirdekteki fiş 100 μm çapında sabit tutulurken, dış bölgedeki tapanın değişen agrega boyutuyla dalgalanmasına izin verildi. (A) TZM ilavesine yanıt olarak bölgesel hücre yoğunluğu, hücre ölümünün büyük ölçüde dış 200 μm, özellikle de 120 saatlik tedaviden sonra tamamen kaybolan dış 100 μm ile sınırlı olduğunu ortaya koymuştur. Agregaların iç 500 μm kalınlığı, hücre sayısında çok az değişiklik gözlemledi (n = 3). Ortalama toplam hücre sayıları, her zaman noktası için karşılık gelen renkli çizgilerle gösterilir. Veriler ortalama ± SD. (B) Toplam kalınlığın bir fonksiyonu olarak ilaca yanıt olarak ortalama hücre yoğunluğundaki değişimi temsil eden ısı haritası grafiği. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Mana
Çok hücreli tümör sferoidleri (MCTS'ler), tümör progresyonunu ve ilaç taramasını incelemek için güçlü 3D in vitro modellerdir 1,2,3. Bu nispeten basit agrega modellerinin faydasını ilerletmek, hem tümör modeli progresyonunu hem de terapötik yanıtı etkilediği bilinen morfoloji ve hücre yoğunluğu gibi temel özelliklerinin karakterizasyonuna büyük ölçüde dayanır. Bununla birlikte, gerekli boyutları, özellikle tahribatsız analizler için bu özelliklerin değerlendirilmesinde zorluklar ortaya çıkarmaktadır. Sunulan yöntem, yoğun 3B agrega modellerinin ayrı bölgelerinde hücre yoğunluğunun ve canlılığının uzunlamasına ve etiketsiz ölçümü için yeni bir araç sağlar. Aynı agrega, birden fazla geliştirme günü boyunca Optik Koherens Tomografi (OCT) ile yeniden görüntülenebilir. Bu hacimsel taramalar, MCTS'lerin olgunlaşması sırasında hücre yoğunluğunun bölgesel olarak nasıl geliştiğini karakterize etmek için analiz edilebilir. Aynı prensipler, hücre yoğunluğunun nerede azaldığını, yani ilacın aktif olarak hücreleri öldürdüğü yeri belirlemek için belirli bir ilaç rejimi boyunca uzunlamasına görüntülenebilen uyuşturulmuş agregaların analizi için de geçerlidir. Bu yaklaşım, geleneksel olarak fiksasyon, boyama ve / veya kesitleme gerektiren benzer hücre ölçeğinde bilgi elde etmek için önceki yöntemlere göre önemli ölçüde gelişir, böylece uzunlamasına analizleri engeller. Gerçekten de, bu araç, belirli bir çalışma için gereken numune sayısını önemli ölçüde azaltma potansiyeline sahiptir, çünkü aynı numuneler art arda analiz edilebilir. Bunun aynı zamanda her zaman noktasında katma değer getirmesi beklenmektedir, çünkü gelişmeler, yaşa uygun terminal örneklerinden gelen korelasyonlu verilere güvenmek yerine, belirli bir uyarana yanıt verirken tek bir toplam içinde izlenebilir. Burada gösterilen bu MCTS uygulamasının ötesinde, bu OCT-Imaris yöntemi diğer hücresel agregaları, embriyoid cisimleri, daha karmaşık organoidleri veya birkaç milimetre kalınlığa kadar doku örneklerini inceleyebilir. Bu protokol, agrega geliştirme sırasında hücre sıkıştırmasının ve yoğun agrega modellerinde ilaç yanıtının anlaşılmasını geliştirecektir.
Değişiklik
Sunulan protokol, MDA-MB-231 ve AU565 MCTSS modellerinin analizi için optimize edilmiştir. Diğer hücre hatları kullanılarak yapılan modeller uygulanabilir; Bununla birlikte, ortalama hücre boyutundaki ve agrega morfolojisindeki değişiklikler nedeniyle bazı protokol optimizasyonları gerekebilir. MDA-MB-231 ve AU565 hücrelerinin 2D olarak kaplandığı ve mikroskopi yoluyla ortalama bir hücre boyutu elde edildiği ayrı bir çalışma yapıldı. Bu çap, Imaris "lekeleri" fonksiyonu içindeki XY çapı olarak kullanıldı, böylece bu yaklaşık boyuttaki nesneler sayıldı. Bu değerin değiştirilmesi, örnek10 içinde bulunan nesnelerin sayısını değiştirir ve bu giriş hücre boyutuyla yakından eşleştiğinde daha doğru sonuçlar elde edilmesi beklenir. Bu nedenle, kullanılan hücre tipi için ortalama hücre boyutu ile uygun bir XY çapı bilgilendirilmelidir.
Kritik adımlar ve sorun giderme
OCT görüntüleme sırasındaki kritik adımlardan biri, tarama çözünürlüğünün seçimidir. Kullanıcı tarafından ayarlanan piksel boyutu, kullanılan hücre türünün ortalama boyutunu oluşturmak için birden çok piksele ihtiyaç duyulacak kadar küçük olmalıdır. Bu, OCT'nin hücrelerin çözünürlüğünü iyileştirerek ve stokastik piksel gürültüsünün hücre sayımını olumsuz yönde etkileme olasılığını azaltarak Imaris içindeki "noktalar" analizinin doğruluğunu artırır.
Numunenin Imaris referans çerçevesi içinde izole edilmesi, hücre yoğunluğu için çıktı değerlerini büyük ölçüde etkiler. Kullanıcı bu adımı gerçekleştirirken, tüm numune analizlerinde tutarlı bir şekilde uygulanması gereken bir öznellik ve önyargı düzeyi eşlik eder. Imaris analizine başlamak için numuneyi hacim taraması içinde izole ederken, agrega anahatlarını doğru bir şekilde izlemek ve eserlerin dahil edilmesini önlemek için özen gösterilmelidir (yani, substratlardan veya ortam yüksekliğinden yansımalar).
Bölgesel fiş analizi sırasında referans çerçevelerinin uygun şekilde yerleştirilmesi bir diğer kritik adımdır. Girişte belirtildiği gibi, model geliştirme sırasında analiz edilmesi gereken üç kritik bölge, proliferatif dış bölge, yaşlanan / sessiz hücrelerden oluşan geçiş bölgesi ve hipoksik çekirdektir. Referans çerçevelerinin her katmanın merkezine yerleştirilmesinin, o bölgedeki hücre yoğunluğunun en doğru tahminini vermesi beklenir. Bu referans çerçevesi yerleşimi, ilaç çalışması için burada kullanılan ayrıntılı bölgesel tıkaç analizleri için daha da önemlidir, çünkü ilaç yanıtını daha doğru bir şekilde analiz etmek için eşit aralıklı bölgeler oluşturulmalıdır.
Sınırlamalar ve gelecekteki araştırmalar
Önerilen yöntemin ana sınırlaması, OCT birim taraması içindeki toplamı izole etmek için Imaris içinde gerçekleştirilen kullanıcı tabanlı dilim dilim izlemedir. Bu, biraz öznel olan ve bu nedenle bir miktar kullanıcılar arası değişkenlik kazandırması beklenen doğru sonuçlar için kritik bir adımdır. Bunu ele almak için, şu anda taramayı Imaris'e yüklemeden önce Matlab (veya benzeri) içinde gerçekleştirilen bir kenar algılama algoritması eklemeye çalışıyoruz. Bu algoritma, ilerici B-tarama dilimlerindeki numune kenarlarını objektif olarak tanımlamalıdır, bundan sonra önerilen analizler bu önceden izole edilmiş numune bölgesinde gerçekleştirilebilir. Bu sınırlamanın ele alınması, kullanıcı tabanlı değişkenliği ortadan kaldıracak ve bu OCT tabanlı aracın daha geniş uygulanabilirliğine yol açması beklenmektedir.
OCT'nin ilaç tedavisi sırasında agregalar içindeki canlı hücreleri doğru bir şekilde görüntüleme yeteneği, ilacın üzerinde çalıştığı hücre ölümü moduna bağlıdır. Önceki çalışma, nekroz ve apoptoz10 yoluyla hücreleri öldüren iyi bilinen bir anti-kanser ilacı olan Doksorubisin'e yanıt olarak OCT / Imaris'ten bildirilen canlı hücre sayısında nicel yanlışlıkları ortaya koymuştur. Bunun, yapısal görüntüleme sırasında canlı hücreler olarak görünmesi beklenen nekroz sırasında kalan hücre zarlarından kaynaklandığı varsayılmaktadır. TZM'nin öncelikle apoptoz35 yoluyla hücreleri öldürdüğü bilinmektedir; Bu nedenle, hücreler öldüğünde, OCT tarafından izlenmeyecek / sayılmayacak kadar küçük parçalara ayrılmaları gerekir. Apoptotik bir ilaçla daha fazla doğrulama testine ihtiyaç duyulmasına rağmen, erken pilot deneylerimiz, OCT / Imaris'in TZM ile uyuşturulmuş MCTS'lerde ayrışmış hücre sayımlarına mükemmel bir şekilde uyum sağladığını göstermektedir (yayınlanmamış veriler). Bu nedenle, burada sunulan canlı hücre sonuçlarının nekroza neden olan ilaçlardan daha doğru olması beklenmektedir. Bu ayrım, uyuşturulmuş agregalarda canlılık testi için bu yaklaşımı uygularken akılda tutulmalıdır.
Tümör agregalarının tahribatsız değerlendirilmesinde gelecekteki araştırmaların, hem dış uyaranların hem de ilaç tedavisinin nasıl geliştiğinin ve yanıt verdiğinin anlaşılmasını iyileştirmesi beklenmektedir. Burada sunulanlar gibi analitik araçların geliştirilmesi, özellikle ilaç taraması ve doğum/etkinlik değerlendirmesi gibi etkili uygulamalarda model faydasını genişletmeli ve sonuç doğruluğunu artırmalıdır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma NIH R01 BRG CA207725 (MB/DTC) ve NIH R01 CA233188 (MB) tarafından desteklenmiştir. Bu deneyler için sağlanan Trastuzumab için AMC Eczanesi'ne teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
Referanslar
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır