Method Article
Avaliação não destrutiva da densidade celular regional dentro dos agregados tumorais após o tratamento medicamentoso
Neste Artigo
Resumo
O presente protocolo desenvolve uma técnica baseada em imagem para a densidade celular regional rápida, não destrutiva e livre de rótulos e a medição da viabilidade dentro dos agregados tumorais 3D. Os achados revelaram um gradiente de densidade celular, com densidades celulares mais altas em regiões centrais do que camadas externas no desenvolvimento de agregados e morte celular predominantemente periférica em agregados HER2+ tratados com Trastuzumab.
Resumo
Modelos de spheroids tumores multicelulares (MCTSs) têm demonstrado utilidade crescente para o estudo in vitro da progressão do câncer e descoberta de medicamentos. Esses construtos avasculares relativamente simples imitam aspectos-chave de tumores in vivo , como estrutura 3D e gradientes fisiodológicos. Os modelos mctss podem fornecer insights sobre o comportamento das células cancerosas durante o desenvolvimento de esferoides e em resposta a drogas; no entanto, seu tamanho necessário limita drasticamente as ferramentas utilizadas para avaliação não destrutiva. As imagens estruturais de tomografia de Coerência Óptica e o software de análise 3D Imaris são explorados para medição rápida, não destrutiva e livre de rótulos da densidade celular regional dentro dos MCTSs. Esta abordagem é utilizada para avaliar os MCTSs durante um período de maturação de 4 dias e durante um tratamento prolongado de 5 dias com Trastuzumab, um medicamento anti-HER2 clinicamente relevante. Resumidamente, os MCTSs de câncer de mama AU565 HER2+ foram criados por sobreposição líquida com ou sem a adição de Matrigel (uma matriz de membrana de porão) para explorar agregados de diferentes morfologias (agregados 2.5D mais espessos, semelhantes a discos ou agregados 2D planos, respectivamente). A densidade celular dentro da região externa, região transitória e núcleo interno foi caracterizada em MCTSs amadurecidos, revelando um gradiente de densidade celular com maiores densidades celulares em regiões centrais em comparação com camadas externas. A adição matricial redistribuiu a densidade celular e aumentou esse gradiente, diminuindo a densidade da zona externa e aumentando a compactação celular nos núcleos. A densidade celular foi quantificada após o tratamento medicamentoso (0h, 24 h, 5 dias) dentro de zonas progressivamente mais profundas de 100 μm para avaliar potenciais diferenças regionais na resposta a medicamentos. No ponto de tempo final, quase todas as mortes celulares pareciam estar restritas aos 200 μm externos de cada agregado, enquanto as células mais profundas no agregado pareciam em grande parte não afetadas, ilustrando diferenças regionais na resposta à droga, possivelmente devido a limitações na penetração de drogas. O protocolo atual fornece uma técnica única para quantificar involuntariamente a densidade celular regional dentro de tecidos celulares densos e medi-la longitudinalmente.
Introdução
Pesquisadores têm se voltado em grande parte para a cultura 3D benchtop sistemas in vitro para estudar algumas das principais características da progressão do tumor. Grande parte desta pesquisa tem sido liderada pelo ressurgimento de esferoides multicelulares tumorais (MCTSs) e organoides mais complexos 1,2. Embora esses modelos sejam avasculares, eles fornecem uma poderosa ferramenta para recapitulação de processos fisiológicos e patológicos que ocorrem in vivo 3,4,5. Em particular, modelos de tamanho médio (300-500 μm de diâmetro) podem imitar características principais do tumor, como estrutura 3D, gradientes fisiopatológicos e sinalização metastática devido à hipóxia dentro do núcleo. Está bem documentado que esses modelos exibem as camadas concêntricas características vistas em tumores in vivo vascularizados, ou seja, uma camada externa de células proliferativas, uma camada transitória de células senescentes/quiescentes, e células que experimentam hipóxia no núcleo 3,6,7,8,9 . Uma visão única pode ser obtida a partir desses modelos caracterizando o comportamento celular dentro dessas camadas, durante o desenvolvimento e em resposta à droga. No entanto, o tamanho necessário do MCTS, necessário para desenvolver os gradientes que os tornam tão poderosos modelos in vitro, limita drasticamente as ferramentas usadas para avaliação não destrutiva. De fato, um dos maiores desafios com a análise não destrutiva dos MTCSs é quantificar detalhes em escala celular. A microscopia de campo brilhante e de contraste de fase são rotineiramente utilizadas para avaliar o crescimento e o desenvolvimento de MCTSs 3D de forma não destrutiva. No entanto, essas modalidades estão limitadas a projeções 2D, sem capacidade de visualização da estrutura 3D crucial desses modelos 10,11,12,13. Informações sobre citotoxicidade e proliferação celular são tipicamente coletadas através de imagens fluorescentes (ou seja, microscopia de folha de luz, microscopia confocal) ou coloração imunohistológica ex vivo 14,15,16. Embora essas abordagens forneçam informações valiosas e de alta resolução sobre estrutura tecidual, densidade celular e função celular, muitas vezes requerem preparação de amostras, como limpeza óptica, fixação/coloração ou incorporação que previne análises longitudinais.
A Tomografia Óptica coerência (OCT) é uma modalidade de imagem estrutural não destrutiva que tem potencial para superar alguns dos desafios mencionados acima. Possui resolução celular e um campo de visão suficientemente amplo (até 10 mm x 10 mm) capaz de visualizar agregados multicelulares inteiros 17,18,19. É importante ressaltar que, devido à natureza visível da luz utilizada, esta técnica é completamente não destrutiva e livre de rótulos17. Além disso, as amostras podem ser imagens in situ sem exigir a preparação da amostra, de modo que as amostras podem ser retiradas diretamente da incubadora, rapidamente escaneadas com OCT (duração de varredura ~5-10 min), e depois devolvidas à incubadora, permitindo a caracterização longitudinal. Muitos estudos que buscam usar o OCT para analisar o comportamento esferoide tumoral surgiram recentemente. Em uma das demonstrações mais emocionantes, Huang et al. usaram o OCT para detectar de forma não destrutiva núcleos necroses dentro de grandes modelos de esferoides tumorais, observando que regiões de células vivas e mortas possuem diferenças perceptíveis na atenuação óptica, que podem ser utilizadas para o monitoramento de viabilidade semrótulos 20. Da mesma forma, Hari et al. realizaram medições de índice refrativo (RI) de esferoides de câncer de cólon humano (HCT116) imagens com OCT para estudar a presença de hipóxia dentro das amostras21. Suas medidas não foram suficientes para inferências diretas, embora tenham observado menor RI em locais que se correlacionavam com o local, embora não tamanho, de núcleos necrosados, posteriormente identificados via microscopia confocal. Abd El-Sadek et al. usaram o OCT para visualizar e quantificar a viabilidade do tecido regional dos modelos de tumor de câncer de mama22. Eles relataram dois métodos baseados em OCT para visualizar a dinâmica tecidual e mostraram uma correlação moderada entre diferenças nessas métricas e regiões identificadas por microscopia de células vivas/mortas.
Nosso trabalho publicado usando o OCT baseou-se nesta literatura anterior para estabelecer uma abordagem quantitativa e não destrutiva para medir a morfologia 3D e a contagem de células dentro dos modelos de câncer de mama mctss durante o desenvolvimento10,23. Usando o software de análise de imagem de renderização 3D Imaris para contar o número de objetos do tamanho de células (ou seja, manchas) visualizados dentro dos volumes de OCT, as contagens de células foram medidas não destrutivamente em MCTSs estatisticamente semelhantes aos determinados via hemocitômetro após dissociação agregada. No entanto, devido à natureza estrutural do OCT, as membranas celulares ainda presentes após a morte celular por necrose podem ser erroneamente contadas como células vivas. Além disso, essa caracterização foi estendida à viabilidade celular não destrutiva dentro de agregados individuais submetidos a um regime de drogas com sucesso promissor10. É importante ressaltar que a viabilidade celular semelhante foi relatada a partir da nossa abordagem OCT-Imaris com o que foi benchmarked dentro dessas amostras após a dissociação. Essa abordagem celular não destrutiva e livre de rótulos permite que as células sejam contadas dentro de construtos 3D e agregados densos longitudinalmente sem sacrificar a estrutura de construção/agregado.
O presente trabalho relata uma abordagem melhorada para quantificar diretamente a densidade celular regional dentro de agregados densos, aproveitando a capacidade dos OCT-Imaris de medir tanto a morfologia agregada 3D quanto o número celular. Esse avanço metodológico fornece um quadro mais detalhado da distribuição espacial e proliferação das células dentro das camadas concêntricas características dos modelos MCTSs. Em vez de simplesmente calcular uma densidade celular agregada média global, tais medidas de densidade local podem revelar gradientes de densidade celular, como aqueles associados à compactação. Esta avaliação regional também é aplicada a agregados tratados com quimioterapia para avaliar a resposta regional de medicamentos, medida por mudanças na densidade celular local. Essa combinação de OCT e métodos avançados de análise de imagens fornecem quantificação da viabilidade celular regional, que pode ser usada para explorar a penetração de medicamentos com base em quais regiões experimentam diminuição na densidade celular. Este é o primeiro relatório para quantificar de forma não destrutiva a densidade celular regional e a viabilidade em resposta à droga dentro de tecidos celulares densos e medi-la longitudinalmente. Tal caracterização da densidade celular tridimensional e distribuição espacial em todo o MCTSs pode ajudar a otimizar o fornecimento de medicamentos no tratamento do câncer e melhorar a compreensão da progressão do modelo de câncer.
Protocolo
Foram utilizadas linhas de células cancerígenas de mama AU565 (HER2+) e MDA-MB-231 para o presente estudo (ver Tabela de Materiais).
1. Preparação de agregados tumorais
- Prepare a mídia de crescimento de células cancerígenas de mama AU565 (HER2+) usando o Roswell Park Memorial Institute (RPMI) 1640 basal medium (+) em L-glutamina suplementada com 10% (v/v) soro bovino fetal e 1% penicilina/estreptomicina (ver Tabela de Materiais).
- Prepare a mídia de crescimento de células cancerígenas de mama MDA-MB-231 triplamente negativa usando o DMEM (Modified Eagle's Medium) de Dulbecco complementado com 10% (v/v) soro bovino fetal (FBS), 100 U/mL de penicilina/estreptomicina e 2 mM de L-glutamina (ver Tabela de Materiais).
- Prepare 70%-90% de culturas celulares confluentes de ambas as linhas celulares (~3-4 dias de preparação) em condições padrão (37 °C, 5% CO2, 95% umidade relativa). Desprender moncaminhas celulares de seus frascos de cultura seguindo o método padrão de trippsinização.
NOTA: Evite a superexposição das células para a trippsina, afetando sua viabilidade.- Para células AU565, aspire a mídia celular do frasco usando uma pipeta (ou, se disponível, usando uma bomba de vácuo conectada via tubo a uma ponta de pipeta de vidro autoclaved) e substitua por 2 mL Trypsin-EDTA. Deixe o frasco por 3 minutos em temperatura ambiente e, em seguida, mova-se para a incubadora por 4 minutos adicionais. Depois, adicione 6 mL de mídia de crescimento ao frasco para neutralizar a trippsina.
- Para células MDA-MB-231, aspirar a mídia celular do frasco da mesma forma que realizada na etapa 1.3.1 e substituir por 1,5 mL Trypsin-EDTA. Após 7 minutos de incubação, adicione 8,5 mL de mídia de crescimento ao frasco para neutralizar o trypsin.
- Adicione 10 μL da suspensão celular a um hemótmetro para determinar o número de células na suspensão24. Células resuspendas na mídia na concentração desejada de 2,5 × 105 células/mL.
- Dispense 50 μL de suspensão celular em cada poço de uma placa redonda, não aderente, de 96 poços. Para suspensões preparadas sem Matrigel (matriz de membrana de porão, ver Tabela de Materiais), adicione 50 μL de mídia de crescimento simples a cada poço.
- Para suspensões preparadas com a matriz de membrana do porão, remova o frasco de matriz a partir de -20 °C de armazenamento e coloque-o na geladeira para descongelar durante a noite. Prepare um recipiente com mídia de crescimento e leve à geladeira por 10 minutos para esfriar.
- Usando uma ponta de pipeta congelada, adicione a matriz à mídia refrigerada de tal forma que a concentração final desta solução seja de 5%. Adicione 50 μL desta mídia a cada poço, de tal forma que a concentração final de matriz nesses poços seja de 2,5%3.
NOTA: Em trabalhos anteriores, a morfologia agregada foi avaliada para essas linhas celulares10,25, e constatou que os agregados MDA-MB-231 formam esferoides com a adição da matriz de membrana, enquanto as culturas MDA-MB-231 sem a matriz e a UI565+/matriz formam agregados em forma de disco. A esférico quantificada de >0,8 em uma escala de 0 (plano) - 1.0 (esfera perfeita) foi usada para identificar agregados suficientemente esféricos e, portanto, espera-se ter a relação superfície-volume necessária para o comportamento in vivo 26,27.
- Centrifugar as placas a 123 x g por 10 minutos em temperatura ambiente imediatamente após a semeadura para garantir a coleta de uma pelota de célula na parte inferior de cada poço.
NOTA: Esta etapa deve ocorrer o mais rapidamente possível após a semeadura. Os autores observaram que muito tempo entre essas etapas permite que as células se instalem entre os fundos e laterais de cada poço, inibindo sua capacidade de coletar e agregar na parte inferior do poço. - Incubar as placas por 4 dias, momento em que os agregados celulares são considerados amadurecidos.
NOTA: Os agregados AU565 preparados com a matriz de membrana do porão requerem um período de cultura adicional de 5 dias para o estudo de resposta a medicamentos (9 dias no total, mudança de mídia no dia 4).
2. Administração de Trastuzumab (TZM) a agregados celulares AU565
- Prepare 500 μg/mL de solução TZM (ver Tabela de Materiais) em mídia de crescimento AU565. No dia 4, adicione 10 μL desta solução a cada poço, de tal forma que a concentração final dentro de cada poço seja de 50 μg/mL.
- A cultura agrega por 5 dias adicionais após a adição do TZM e avalia em pontos-chave.
NOTA: Para o presente estudo, foram utilizados pontos de tempo de 0h (imediatamente antes da droga), 24h e 120h pós-droga para análise da droga.
3. Imagem de tomografia de coerência óptica
NOTA: As amostras aqui foram imagens com Tomografia de Coerência Óptica (OCT) durante cada dia de maturação (1-4), e depois novamente no dia 5 (24 h pós-adição de drogas) e no dia 9 (120 h pós-adição de drogas) para agregados drogados selecionados. Foi utilizado um sistema comercial de Coerência Óptica de Domínio Espectral (SDOCT, ver Tabela de Materiais) para imagem OCT para o presente estudo. Embora essa abordagem seja acessível a quase qualquer sistema de OCT, e o procedimento seguido seja geralmente semelhante entre diferentes sistemas, algumas das etapas detalhadas que se seguem são específicas para o equipamento atual.
- Utilize um sistema OCT para imagens estruturais. Defina a taxa de digitalização A para 5,5 kHz para coleta de imagens de alta resolução. Defina o índice de refração para 1,33 para amostras em meio líquido. Ajuste o tamanho do voxel para 1,10 x 1,10 x 2,58 μm3.
- Na janela Parâmetros de imagem no lado direito da tela, defina o campo de visão (FOV) inserindo valores X, Y e Z (em mm) de tal forma que a amostra seja englobada dentro desta região de interesse.
NOTA: O FOV para esses estudos foi tipicamente definido como 1,5 x 1,5 x 0,5 mm3. Certifique-se de que a amostra se encaixa dentro desta região alternando a entrada 'Ângulo' entre 0 e 90 graus e realizando confirmação visual. - Clique no Modo de Aquisição 3D e clique em Gravar para coletar a varredura de volume 3D da amostra.
4. Análise de imagem
- Exporte o arquivo OCT para o formato de software (Imaris, ver Tabela de Materiais).
- Abra o arquivo OCT no kit de desenvolvimento de software. Clique em Exportar, defina o tipo de arquivo para .jpg e exporte as imagens para uma pasta vazia.
- Abra o software de processamento de imagens (FIJI, veja Tabela de Materiais) e importe a sequência de imagens da pasta onde os JPEGs exportados são armazenados. Use o software para costurar a sequência de imagem e, em seguida, salvar este arquivo como uma imagem TIFF.
- Crie uma reconstrução de volume seguindo as etapas abaixo.
- Abra Imaris e navegue até o arquivo TIFF convertido dentro da Arena. Vá editar > Propriedades de Imagem e insira o tamanho do voxel (em μm) da imagem OCT nas caixas XYZ correspondentes. Em seguida, clique em OK.
NOTA: Dentro da árvore de objeto de amostra no lado esquerdo da tela, desmarque a guia Volume para evitar a defasagem do software. - Clique em Adicionar novas superfícies acima da árvore de objetos. No menu abaixo da árvore, clique em Pular criação automática e editar manualmente. Dentro da janela Ajuste de exibição , deslize manualmente as setas vermelha e preta para melhorar o contraste entre a amostra e o fundo e melhorar a visualização da amostra.
- Ajuste a 'posição de fatia' na fatia em uma borda da amostra, ou seja, onde o sinal de amostra aparece pela primeira vez. Use a tecla escape para alterar o mouse do modo Navegação para o modo Selecionar e, em seguida, clique em Desenhar. Rastreie manualmente o contorno da região exibindo o sinal.
- Avance a posição da fatia digitando a próxima posição na caixa de entrada. Esta próxima posição deve ser ≤100 fatias mais para dentro da amostra do que a anterior. Rastreie manualmente a região exibindo o sinal.
- Repita o passo 4.2.4 através da espessura da amostra até que a borda oposta da amostra seja atingida. Em seguida, clique em Criar superfície no menu esquerdo para costurar essas fatias e completar a reconstrução do volume.
- Clique em Editar e clique em Seleção de máscaras. Isso cria um novo canal na janela Ajuste de exibição contendo apenas a amostra isolada. As características morfológicas da amostra agora podem ser encontradas na guia Estatísticas > Detalhado .
NOTA: Esta abordagem foi seguida para determinar as esferi cidades e volumes relatados neste presente estudo.
- Abra Imaris e navegue até o arquivo TIFF convertido dentro da Arena. Vá editar > Propriedades de Imagem e insira o tamanho do voxel (em μm) da imagem OCT nas caixas XYZ correspondentes. Em seguida, clique em OK.
- Obtenha a densidade celular total de uma amostra seguindo os passos abaixo.
- Acima da árvore do objeto, selecione Adicionar novos pontos. No menu Configurações de algoritmo , desmarque todas as caixas. Clique na Seta Azul para mover-se para a tela do Canal fonte.
- A partir do menu suspenso que aparece, selecione o canal mascarado criado na etapa 5.2.8, tipicamente chamado de Canal 2. Insira o diâmetro médio da célula para a amostra na caixa de diâmetro XY. Certifique-se de que a subtração de fundo seja verificada.
NOTA: Para este trabalho com células AU565 e MDA-MB-231, o diâmetro foi definido para 10 μm. Esta seleção é baseada no tamanho da célula (explicada na seção Discussão).
- A partir do menu suspenso que aparece, selecione o canal mascarado criado na etapa 5.2.8, tipicamente chamado de Canal 2. Insira o diâmetro médio da célula para a amostra na caixa de diâmetro XY. Certifique-se de que a subtração de fundo seja verificada.
- Clique na Seta Azul para mover-se para a tela Classificar Pontos . No gráfico na parte inferior do menu, clique e arraste a borda esquerda do limiar amarelo para a borda esquerda do gráfico, de modo que todos os objetos estejam incluídos no limiar amarelo sombreado. Em seguida, clique no Arqueiro Verde para completar a criação do local.
- Obtenha o número de objetos identificados (ou seja, contagem de células de amostra) clicando em Estatísticas > Número Total > De Vagas.
- Para determinar a densidade celular agregada média, divida a contagem celular do agregado (medida na etapa 4.3.3) por volume agregado (determinado na etapa 4.2.6).
- Acima da árvore do objeto, selecione Adicionar novos pontos. No menu Configurações de algoritmo , desmarque todas as caixas. Clique na Seta Azul para mover-se para a tela do Canal fonte.
- Avaliar a densidade regional em camadas concêntricas de agregados esféricos (Figura 1A).
- Após análise morfológica e densidade celular, avalie a densidade regional. Clique na superfície criada na etapa 4.2.5 e navegue até a guia Estilo/Qualidade superfícies . Altere a seleção para Center Point e altere a largura do pixel para ≤20 para melhor visibilidade. Navegue até Estatísticas > Posição detalhada > e regise a localização do ponto central.
- Selecione Adicionar novo quadro de referência no menu acima da árvore de objeto. Verifique as caixas Visível e Fixa ao lado de XY no menu. Clique e arraste o centro do ícone do quadro de referência de tal forma que ele esteja alinhado com o ponto central. Desmarque as caixas XY Visible e Fix e selecione-as para XZ.
- Mais uma vez, clique e arraste o centro do ícone do quadro de referência de tal forma que ele esteja em linha com o ponto central. Por fim, repita isso para o plano YZ, alternando entre esses três planos fixos até que o quadro de referência se alinhe perfeitamente com o ponto central. Clique duas vezes no quadro de referência na árvore do objeto e renomeie-o Centro ou Similar.
- Clique nas manchas criadas na etapa 4.3 e navegue até Estatísticas > Quadro de Referência de Posição > Detalhado. Clique no Quadro de Referência da Posição X até classificar de maior a menor valor. Registre o maior valor - isso indica a borda mais distante da amostra, ou seja, raio amostral.
NOTA: Uma vez que as amostras utilizadas aqui são circulares no plano XY, os cálculos podem ser realizados ao longo do eixo X ou Y com resultados semelhantes. Para amostras que não apresentam simetria X-Y (assimétrica, elipsoide, geometrias irregulares, etc.), recomenda-se realizar essas análises ao longo de múltiplos eixos. - Navegue até estatísticas. No canto inferior direito do menu, clique em Exportar todas as estatísticas para arquivar e salvar dados em uma planilha.
- Realize cálculos manuais para identificar camadas concêntricas ao longo do eixo X.
NOTA: As amostras utilizadas neste estudo tinham aproximadamente 500 μm de diâmetro; assim, existem duas zonas concêntricas externas de 200 μm de espessura e uma zona central interna de 100 μm de espessura. Recomenda-se manter zonas de 200 μm de espessura, pois espera-se que os comportamentos de difusão mudem nessa distância 7,28,29,30. De acordo com esse raciocínio, também é recomendado o uso de zonas mais concêntricas para amostras maiores e vice-versa para amostras menores. - Defina uma região de camada externa de 200 μm subtraindo 200 μm do raio externo encontrado na etapa 4.4.3. Assim, a região externa abrangerá pontos com posições X entreraio X e Xexterno, borda interna (Figura 1A, região laranja).
- Defina uma região transitória subtraindo 200 μm de Xexterior, borda interna. A região transitória abrangerá pontos com posições X entre X, borda interna e Xtransição, borda interna (Figura 1A, região rosa).
- Estabeleça uma região central que abranja os pontos restantes entre o centro amostral e xtransição, borda interna (Figura 1A, região azul).
- Abra o arquivo de planilha salvo criado na etapa 4.4.4. Navegue até a guia Distância da Estrutura de Referência de Origem.
- Calcule o número de pontos na região central usando a função' COUNTIF (Colunax, "< Xtransição, borda interna"), onde a Colunax é a coluna 'Distância do Quadro de Referência de Origem'. O valor resultante é o número de célula nesta região. Divida esse valor pelo volume da região para obter densidade celular.
- Da mesma forma, calcule o número de células na região transitória usando 'COUNTIF (Colunax, "< Xexterior, borda interna") - COUNTIF (Colunax, "> Xtransição, borda interna").
- Calcule o número de células na região externa usando 'COUNTIF (Colunax,"> Xtransição, borda interna").
- Avaliar a densidade celular regional em amostras não esféricas através de 'Plugs Regionais' (Figura 1B).
NOTA: Para amostras não esféricas que não possuem camadas concêntricas, o método 'Plug Regional' é desenvolvido para amostrar a densidade celular local em várias profundidades radiais ao longo do agregado.- Repita as etapas 4.4.1-4.4.3 para definir o quadro de referência central (Figura 1B, círculo amarelo central) e obter o raio amostral total.
- Realize cálculos manuais para identificar a colocação de quadros de referência dentro das regiões transitórias e externas, de modo que a densidade celular possa ser avaliada na amostra nesses locais.
- Para calcular a localização externa, subtraia 50 μm do valor do raio da amostra da etapa 4.5.1 e use este valor como posição X.
NOTA: Utilize os mesmos valores de posição Y e Z registrados na etapa 4.5.1 para todos os plugues dentro de uma determinada amostra para medir a densidade celular ao longo do eixo X da amostra (Figura 1B, círculo amarelo mais à esquerda). - Acima da árvore do objeto, clique em Adicionar novos pontos e clique em Pular criação automática, editar manualmente. Com o ponteiro no modo 'selecionar', segure shift+click para colocar um ponto na tela. No menu esquerdo, insira os valores de posição XYZ calculados acima. Ajuste os diâmetros XY e Z para ≤20 para melhor visibilidade.
- Repita o passo 4.4.2 para adicionar um quadro de referência neste local. Renomeie este quadro de referência na árvore de objetos exterior ou similar.
- Para calcular a localização transitória (ponto médio), encontre a média do valor de posiçãocentral X e os valoresde posição externa X. Use este valor como a posição X para o quadro de referência transitório. Como acima, utilize os mesmos valores Y e Z registrados na etapa 4.5.1 para todos os plugues dentro de uma determinada amostra para medir a densidade celular ao longo do eixo X da amostra (Figura 1B, círculo amarelo médio).
- Repita o passo 4.4.2 para colocar o quadro de referência do meio neste local, renomeando-o como "transitório" ou similar uma vez criado.
- Para calcular a localização externa, subtraia 50 μm do valor do raio da amostra da etapa 4.5.1 e use este valor como posição X.
- Clique nas manchas criadas na etapa 4.3 e navegue até estatísticas. No canto inferior direito do menu, clique em Exportar todas as estatísticas para arquivar e salvar dados em uma planilha.
- Abra a planilha. Navegue até a guia Distância da Estrutura de Referência de Origem. A distância de cada objeto aos quadros de referência é mostrada na coluna A, e o agrupamento de quadros de referência para cada objeto é mostrado na coluna G. Use a função 'MOD' para atribuir numericamente cada distância ao seu quadro de referência correspondente, onde 0 é o quadro central, 1 é a transição e 2 é o externo.
- Filtre os valores nesta coluna para trabalhar com as distâncias em cada quadro de referência. Para cada um dos quadros de referência, calcule o número de objetos dentro de 50 micrômetros do quadro usando a função 'COUNTIF (Colunax, "≤50"), onde a Colunax é a coluna 'Distância do Quadro de Referência de Origem' para cada grupo. O valor resultante corresponde ao número de células naquele plugue regional. Divida esse valor pelo volume do plugue de 100-μm para obter densidade celular.
- Executar o método de plugue regional espacialmente refinado (Figura 1C).
NOTA: Esta abordagem foi utilizada para avaliar a viabilidade celular regional em resposta à aplicação de medicamentos. Incluir mais quadros de referência melhora a resolução de densidades celulares capazes de ser calculadas em toda a espessura do modelo.- Repita as etapas 4.4.1-4.4.3 para definir o quadro de referência central (Figura 1C, círculo amarelo central) e obter o raio da amostra.
- Realize cálculos manuais para determinar locais adicionais de interesse. Para isso, adicione 100 μm ao valordo centro X e, em seguida, use os valores Y e Z do ponto central para definir a primeira localização ao longo do eixo central. Adicione um quadro de referência a esta posição como na etapa 4.4.2 (Figura 1C, círculo amarelo adjacente ao círculo central).
NOTA: Adicione menos μm nesta etapa se buscar um rastreamento de densidade de resolução mais alto. - Repita as etapas 4.6.2, adicionando 100 μm (ou número desejado de μm) a cada local X sequencial para estabelecer um eixo de plugues igualmente espaçados através da espessura da amostra. Coloque o último quadro de referência ≤ 50 μm de distância do raio externo da amostra (Figura 1C, círculos amarelos).
- Repita as etapas 4.5.3-4.5.5 para obter contagem celular dentro de cada plugue de 100 μm de diâmetro. Divida esses valores pelo volume de cada plugue correspondente para obter densidade celular local.
- Repita todas as etapas nesta seção para dados de OCT coletados em cada ponto de tempo do teste de drogas. Comparar a contagem de células em cada local através do curso de tempo de tratamento deve revelar onde a densidade celular está diminuindo (ou seja, regiões que experimentam morte celular) e, consequentemente, quão profunda a droga está penetrando (ou seja, quais camadas vêem uma queda na densidade celular versus aquelas que mantêm ou apresentam um aumento nos níveis de densidade celular).
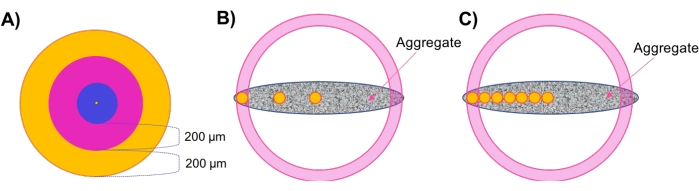
Figura 1: Ilustração esquemática. (A) A abordagem de camada concêntrica (conchas) para avaliar a densidade celular regional em agregados esféricos. (B) O método de plugue regional foi desenvolvido para avaliar a densidade celular local em agregados não esféricos, onde pequenos (100 μm de diâmetro) plugues esféricos (mostrados em amarelo) são usados como indicadores de densidade em cada zona/espessura. (C) O método de plugue regional espacialmente refinado é empregado para estudos de penetração de medicamentos. Clique aqui para ver uma versão maior desta figura.
Resultados
Em uma publicação anterior, foi estabelecido um método para a medição não destrutiva da densidade celular global dentro de agregados celulares usando10 de outubro. Aqui, essa técnica é estendida para avaliar a densidade celular regional dos agregados celulares em desenvolvimento. A Figura 1 mostra um esquema desta extensão, onde a densidade celular pode ser avaliada em camadas concêntricas de um esfóide ou mais localmente olhando em vez disso para pequenos (100 μm de diâmetro) plugues esféricos, denotados pelos círculos amarelos na Figura 1B,C. Os esferoides tumorais MDA-MB-231 foram avaliados inicialmente estabelecendo um ponto central dentro do agregado e contando o número de objetos/células em camadas concêntricas sequenciais do esferoide. Estes resultados são apresentados na Figura 2. O teste t do aluno revelou densidade celular significativamente maior no núcleo esferoide do que nas camadas transitórias (p = 4,3e-4) e externas (p = 4,0e-6). Este resultado indica compactação no núcleo esferoide após 4 dias.

Figura 2: Diferenças na densidade regional calculadas pela abordagem de camada concêntrica para agregados esféricos MDA-MB-231. A figura ilustra um gradiente de densidade celular radial com células (n = 3) mais densamente embaladas no núcleo agregado, e a densidade celular local diminuindo com a distância do núcleo. A contagem média total de células é mostrada com uma linha azul. A barra de escala para a imagem de entrada é de 100 μm. Dados apresentados como média ± SD (*= p < 0,05, ***= p < 0,001). Clique aqui para ver uma versão maior desta figura.
No entanto, uma limitação dessa técnica de camada concêntrica é que ela só pode ser usada em agregados esféricos. Assim, a abordagem de contagem de células foi adaptada para estabelecer um método de Plug Regional, que amostra pequenas zonas em locais sequenciais através do agregado, semelhante a uma biópsia virtual. Estes plugues fornecem medidas da densidade celular local em profundidades específicas. Esta técnica foi validada contra a abordagem de camada concêntrica realizando análises nos mesmos esferoides MDA-MB-231 (Figura 3). Os resultados mostraram boa concordância entre o plug regional e as abordagens de camada concêntrica para esses agregados esféricos. Os t-testes do aluno não revelaram diferenças estatísticas entre as abordagens para medir as camadas externa e transitória (p = 0,243 e 0,484, respectivamente) e uma pequena, mas significativa diferença ao calcular as densidades no núcleo agregado (p = 0,017).
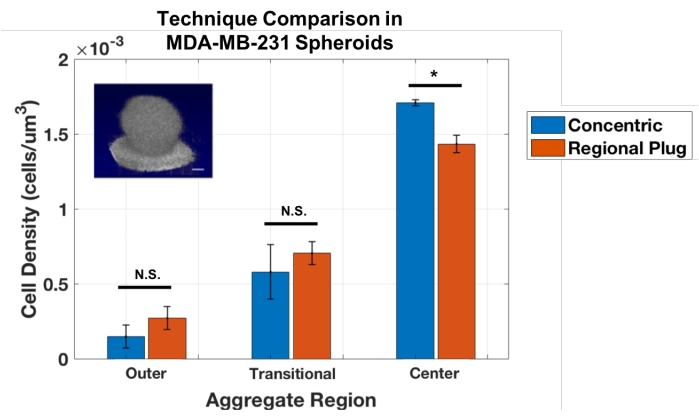
Figura 3: As abordagens de zona concêntrica e de plugue regional fornecem resultados semelhantes para quantificar a densidade celular nos agregados esféricos MDA-MB-231 (n = 3). Dados apresentados como média ± SD (* = p < 0,05). Clique aqui para ver uma versão maior desta figura.
Esta técnica foi então aplicada para avaliar tanto os agregados de tumores esféricos quanto não esféricos no dia 4 da maturidade (Figura 4), observando uma tendência semelhante à compactação do núcleo para todas as morfologias testadas, independentemente do tipo celular. Essa tendência foi mais proeminente nas amostras preparadas com Matrigel (a matriz de membrana do porão), um aditivo conhecido por promover a agregação, mas cujos fatores exógenos e composição são mal caracterizados 31,32,33. Curiosamente, a adição da matriz não parece afetar o volume ou a contagem de células e, portanto, parece ter influência insignificante na proliferação celular. Em vez disso, a adição matricial parece redistribuir a densidade celular, promovendo compactação significativa do núcleo e diminuindo a densidade celular nas camadas externas. Esses resultados também indicam que as células AU565 parecem menos sensíveis aos efeitos de agregação mediadas por matriz do que as células MDA-MB-231. Esses achados fornecem uma visão valiosa dos mecanismos físicos pelos quais a matriz permite a agregação celular em diferentes linhas celulares de câncer de mama. É importante ressaltar que a abordagem de plugue regional deve se adequar a quaisquer MCTSs que exibam geometrias agregadas esféricas ou não esféricas.

Figura 4: A adição matricial promove mais agregação e redistribui a densidade celular nas linhas celulares cancerosas. Tanto para as linhas celulares MDA-MB-231 (A,B) quanto para AU565 (C,D), a adição de matriz diminui a densidade na zona externa e aumenta a compactação no centro (n = 3) sem alterar consideravelmente a contagem geral de células. A contagem total média de células é mostrada com linhas azuis. Barras de escala de entrada = 100 μm. Dados apresentados como média ± DP (*= p < 0,05, **= p < 0,01, ***= p < 0,001). Clique aqui para ver uma versão maior desta figura.
Em seguida, esta abordagem de plugue regional foi usada para rastrear a morte celular em agregados de tumor tratados com TZM não destrutivamente. Os MCTSs AU565 preparados com a matriz de membrana foram tratados com TZM no dia 4 de desenvolvimento, e cultivados até o dia 9, com pontos de tempo de imagem oct chave em 0h (pré-fás), 24 h e 120 h (5 dias). O método de plugue regional espacialmente definido foi aplicado em cada ponto de tempo, com plugues definidos a cada 100 μm em toda a espessura de cada agregado, como mostrado pelos círculos amarelos na Figura 1C. O tamanho do plugue central foi mantido constante enquanto o plugue externo foi permitido flutuar em diâmetro, correspondendo à alteração do tamanho agregado. Pequenas flutuações na densidade celular foram observadas ao longo do tempo dentro dos 500 μm internos de cada agregado, indicando morte celular mínima (Figura 5). De fato, a maioria das mortes por células ocorreu nos 200 μm externos de cada agregado, particularmente nos 100 μm externos, que desapareceram completamente pelo ponto de tempo de 120 h para todos os agregados analisados. A visualização da morte celular como resposta indicativa de drogas principalmente nas camadas externas de MCTSs é consistente com problemas de penetração de drogas de TZM, uma droga de anticorpo clinicamente relevante com um peso molecular de 145 kDa34. De fato, a droga se baseia na difusão passiva através desses modelos celulares densos, o que deverá desafiar sua capacidade de penetrar mais fundo do que 200 μm nos modelos.
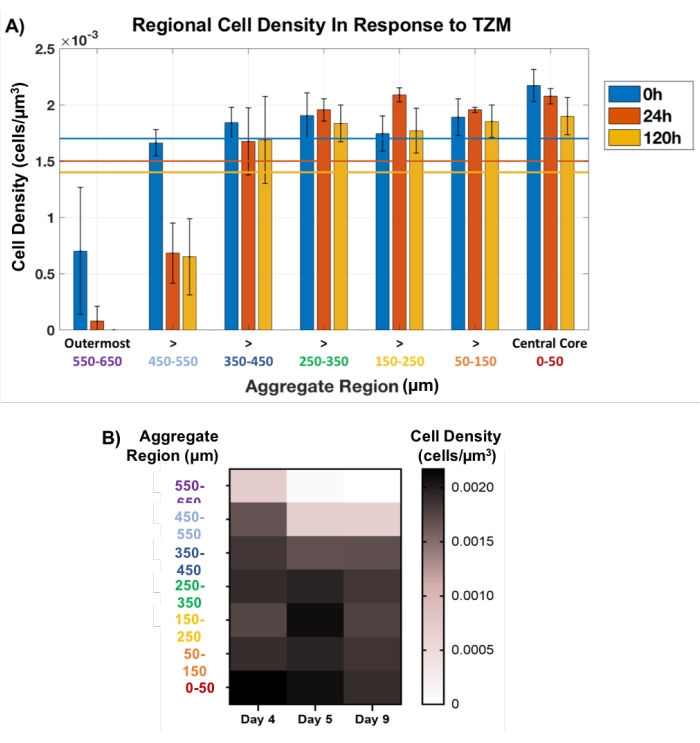
Figura 5: Viabilidade celular em resposta à droga, medida em toda a espessura agregada. O plugue no núcleo interno foi mantido constante a 100 μm de diâmetro, enquanto que na zona externa foi permitido flutuar com a mudança de tamanho agregado. (A) A densidade celular regional em resposta à adição de TZM revelou que a morte celular foi em grande parte restrita aos 200 μm externos, particularmente os 100 μm externos, que desapareceram completamente após 120 h de tratamento. A espessura interna de 500 μm dos agregados observou pouca alteração na contagem celular (n = 3). A contagem total média de células é mostrada com linhas coloridas correspondentes para cada ponto de tempo. Os dados são mostrados como gráfico médio ± SD. (B) mapa térmico representando a mudança na densidade celular média em resposta à droga em função da espessura agregada. Clique aqui para ver uma versão maior desta figura.
Discussão
Significado
Os spheróides tumorais multicelulares (MCTSs) são poderosos modelos in vitro 3D para estudar a progressão do tumor e o rastreamento de medicamentos 1,2,3. O avanço da utilidade desses modelos agregados relativamente simples depende fortemente da caracterização de suas características-chave, como morfologia e densidade celular, que são conhecidas por influenciar tanto a progressão do modelo tumoral quanto a resposta terapêutica. No entanto, seu tamanho necessário introduz desafios na avaliação dessas características, particularmente para análises não destrutivas. O método apresentado fornece uma nova ferramenta para quantificação longitudinal e livre de rótulos da densidade celular e viabilidade dentro de regiões discretas de modelos agregados 3D densos. O mesmo agregado pode ser reimagem com tomografia de coerência óptica (OCT) durante vários dias de desenvolvimento. Essas varreduras volumosas podem ser analisadas para caracterizar como a densidade celular evolui regionalmente durante a maturação dos MCTSs. Esses mesmos princípios se aplicam à análise de agregados drogados, que podem ser imagens longitudinalmente ao longo de um determinado regime de drogas para determinar onde a densidade celular está diminuindo, ou seja, onde a droga pode estar matando ativamente as células. Essa abordagem melhora significativamente em relação aos métodos anteriores para a obtenção de informações semelhantes em escala celular, o que tradicionalmente requer fixação, coloração e/ou secção, impedindo assim análises longitudinais. De fato, esta ferramenta tem o potencial de reduzir drasticamente o número de amostras necessárias para um determinado estudo, pois as mesmas amostras podem ser analisadas consecutivamente. Espera-se também que isso introduza valor agregado em cada ponto de tempo, pois os desenvolvimentos podem ser rastreados dentro de um único agregado, pois ele responde a um determinado estímulo, em vez de depender de dados correlacionados de amostras terminais com correspondência etária. Além desta aplicação MCTS demonstrada aqui, este método OCT-Imaris pode estudar outros agregados celulares, corpos embrionários, organoides mais complexos ou amostras de tecido até alguns milímetros de espessura. Este protocolo melhorará a compreensão da compactação celular durante o desenvolvimento agregado e a resposta a medicamentos dentro de modelos agregados densos.
Modificações
O protocolo apresentado foi otimizado para análise dos modelos MCTSS MDA-MB-231 e AU565. Modelos feitos utilizando outras linhas celulares são aplicáveis; no entanto, alguma otimização de protocolo pode ser necessária devido a alterações no tamanho médio da célula e morfologia agregada. Foi realizado um estudo separado no qual as células MDA-MB-231 e AU565 foram banhadas em 2D e obtiveram um tamanho celular médio via microscopia. Este diâmetro foi utilizado como o diâmetro XY dentro da função "manchas" Imaris, de tal forma que objetos deste tamanho aproximado foram contados. A alteração desse valor altera o número de objetos localizados dentro da amostra10, e resultados mais precisos são esperados quando essa entrada corresponde intimamente ao tamanho da célula. Assim, um diâmetro XY adequado deve ser informado pelo tamanho médio da célula para o tipo de célula utilizada.
Etapas críticas e solução de problemas
Uma das etapas críticas durante a imagem de OCT é a seleção da resolução de varredura. O tamanho do pixel definido pelo usuário deve ser suficientemente pequeno, de modo que vários pixels são necessários para compor o tamanho médio do tipo de célula que está sendo usado. Isso melhora a precisão da análise de "manchas" dentro de Imaris, melhorando a resolução das células do OCT e reduzindo a possibilidade de que o ruído de pixels estocásticos afete negativamente a contagem de células.
O isolamento da amostra dentro do quadro de referência Imaris influencia muito os valores de saída para a densidade celular. À medida que o usuário realiza esta etapa, ele é acompanhado por um nível de subjetividade e viés que deve ser aplicado consistentemente em todas as análises amostrais. Ao isolar a amostra dentro da varredura de volume para iniciar a análise de Imaris, deve-se tomar cuidado para traçar contornos agregados com precisão e evitar a inclusão de artefatos (ou seja, reflexos de substratos ou altura da mídia).
A colocação adequada de quadros de referência durante a análise de plugues regionais é outra etapa crítica. Como afirmado na introdução, as três zonas críticas a serem analisadas durante o desenvolvimento do modelo são a região externa proliferativa, a região transitória composta por células senescentes/quiescentes, e o núcleo hipóxico. Espera-se que a colocação de quadros de referência no centro de cada camada produza a estimativa mais precisa da densidade celular dentro dessa região. Esta colocação de quadro de referência é de importância ainda maior para as análises detalhadas do plugue regional utilizadas neste estudo de medicamentos, uma vez que zonas espaçadas uniformemente devem ser estabelecidas para analisar a resposta de medicamentos com mais precisão.
Limitações e pesquisas futuras
A principal limitação do método proposto é o rastreamento fatia-por-fatia baseado no usuário realizado dentro de Imaris para isolar o agregado dentro da varredura de volume de OCT. Este é um passo crítico para resultados precisos, que é um tanto subjetivo e, portanto, espera-se que transmita algum nível de variabilidade entre usuários. Para lidar com isso, estamos atualmente buscando incorporar um algoritmo de detecção de borda realizado dentro do Matlab (ou similar) antes de carregar a varredura em Imaris. Este algoritmo deve identificar objetivamente bordas de amostra em fatias progressivas de B-scan, após as quais as análises propostas podem ser realizadas nesta região amostral pré-isolada. O enfrentamento dessa limitação removerá a variabilidade baseada no usuário e espera-se que leve a uma aplicabilidade mais ampla desta ferramenta baseada em OCT.
A capacidade do OCT de imagem precisa de células vivas dentro de agregados durante o tratamento medicamentoso depende do modo de morte celular em que a droga opera. O trabalho anterior revelou imprecisões quantitativas na contagem de células vivas relatadas a partir de OCT/Imaris em resposta à Doxorubicina, uma conhecida droga anticâncer que mata células através de necrose e apoptose10. Isso é hipótese de ser devido às membranas celulares remanescentes durante a necrose, que devem aparecer como células vivas durante a imagem estrutural. TZM é conhecido por matar células principalmente através da apoptose35; assim, quando as células morrem, elas devem se dividir em pedaços suficientemente pequenos para não serem rastreados/contados por OUTUBRO. Embora mais testes de validação com uma droga apoptótica seja necessário, nossos primeiros experimentos piloto mostram a excelente concordância de OCT/Imaris com contagem de células dissociadas em MCTSs drogados com TZM (dados não publicados). Assim, prevê-se que os resultados das células vivas aqui apresentados sejam mais precisos do que as drogas indutoras de necrose. Essa distinção deve ser mantida em mente ao aplicar esta abordagem para testes de viabilidade em agregados drogados.
Espera-se que futuras pesquisas na avaliação não destrutiva dos agregados tumorais melhorem a compreensão de como eles se desenvolvem e respondem tanto a estímulos externos quanto ao tratamento medicamentoso. O desenvolvimento de ferramentas analíticas, como a aqui apresentada, deve ampliar a utilidade do modelo e melhorar a precisão dos resultados, particularmente dentro de aplicações impactantes, como triagem de medicamentos e avaliação de entrega/eficácia.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado pelo NIH R01 BRG CA207725 (MB/DTC) e NIH R01 CA233188 (MB). Gostaríamos de agradecer à Farmácia AMC pelo Trastuzumab fornecido para esses experimentos.
Materiais
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
Referências
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados