Method Article
Zerstörungsfreie Bewertung der regionalen Zelldichte innerhalb von Tumoraggregaten nach medikamentöser Behandlung
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll entwickelt eine bildbasierte Technik zur schnellen, zerstörungsfreien und markierungsfreien Messung der regionalen Zelldichte und -lebensfähigkeit innerhalb von 3D-Tumoraggregaten. Die Ergebnisse zeigten einen Zelldichtegradienten mit höheren Zelldichten in Kernregionen als in äußeren Schichten in sich entwickelnden Aggregaten und überwiegend peripherem Zelltod in HER2+-Aggregaten, die mit Trastuzumab behandelt wurden.
Zusammenfassung
Multizelluläre Tumorsphäroid-Modelle (MCTSs) haben einen zunehmenden Nutzen für In-vitro-Studien zur Krebsprogression und Arzneimittelentdeckung gezeigt. Diese relativ einfachen avaskulären Konstrukte ahmen Schlüsselaspekte von In-vivo-Tumoren nach, wie 3D-Struktur und pathophysiologische Gradienten. MCTS-Modelle können Einblicke in das Verhalten von Krebszellen während der Sphäroidentwicklung und als Reaktion auf Medikamente liefern; Ihre erforderliche Größe schränkt jedoch die für die zerstörungsfreie Bewertung verwendeten Werkzeuge drastisch ein. Optische Kohärenztomographie Strukturbildgebung und Imaris 3D-Analysesoftware werden für die schnelle, zerstörungsfreie und markierungsfreie Messung der regionalen Zelldichte innerhalb von MCTS erforscht. Dieser Ansatz wird verwendet, um MCTS über eine 4-tägige Reifezeit und während einer ausgedehnten 5-tägigen Behandlung mit Trastuzumab, einem klinisch relevanten Anti-HER2-Medikament, zu bewerten. Kurz gesagt, AU565 HER2+ Brustkrebs-MCTSs wurden mittels flüssiger Überlagerung mit oder ohne Zugabe von Matrigel (einer Basalmembranmatrix) hergestellt, um Aggregate verschiedener Morphologien (dickere, scheibenartige 2,5D-Aggregate bzw. flache 2D-Aggregate) zu untersuchen. Die Zelldichte innerhalb der äußeren Region, der Übergangsregion und des inneren Kerns wurde in gereiften MCTSs charakterisiert, was einen Zelldichtegradienten mit höheren Zelldichten in den Kernregionen im Vergleich zu den äußeren Schichten zeigte. Die Matrixaddition verteilte die Zelldichte neu und verstärkte diesen Gradienten, verringerte die Dichte der äußeren Zone und erhöhte die Zellverdichtung in den Kernen. Die Zelldichte wurde nach medikamentöser Behandlung (0 h, 24 h, 5 Tage) in zunehmend tieferen 100-μm-Zonen quantifiziert, um mögliche regionale Unterschiede in der Arzneimittelreaktion zu bewerten. Zum letzten Zeitpunkt schien fast der gesamte Zelltod auf die äußeren 200 μm jedes Aggregats beschränkt zu sein, während Zellen tiefer im Aggregat weitgehend unberührt zu sein schienen, was regionale Unterschiede in der Arzneimittelreaktion veranschaulicht, möglicherweise aufgrund von Einschränkungen der Arzneimittelpenetration. Das aktuelle Protokoll bietet eine einzigartige Technik, um die regionale Zelldichte in dichtem Zellgewebe zerstörungsfrei zu quantifizieren und in Längsrichtung zu messen.
Einleitung
Forscher haben sich weitgehend auf 3D-Tischkultur-In-vitro-Systeme konzentriert, um einige der wichtigsten Merkmale der Tumorprogression zu untersuchen. Ein Großteil dieser Forschung wurde durch das Wiederauftreten von multizellulären Tumorsphäroiden (MCTSs) und komplexeren Organoidengeleitet 1,2. Obwohl diese Modelle avaskulär sind, bieten sie ein leistungsfähiges Werkzeug zur Rekapitulation physiologischer und pathologischer Prozesse, die in vivo 3,4,5 auftreten. Insbesondere mittelgroße Modelle (300-500 μm Durchmesser) können wichtige Tumormerkmale wie 3D-Struktur, pathophysiologische Gradienten und metastatische Signalgebung aufgrund von Hypoxie im Kern nachahmen. Es ist gut dokumentiert, dass diese Modelle die charakteristischen konzentrischen Schichten aufweisen, die in vaskularisierten In-vivo-Tumoren zu sehen sind, nämlich eine äußere Schicht proliferativer Zellen, eine Übergangsschicht von seneszenten/ruhenden Zellen und Zellen, die im Kern an Hypoxie leiden 3,6,7,8,9 . Aus diesen Modellen können einzigartige Erkenntnisse gewonnen werden, indem das Zellverhalten innerhalb dieser Schichten, während der Entwicklung und als Reaktion auf das Medikament charakterisiert wird. Die erforderliche MCTS-Größe, die notwendig ist, um die Gradienten zu entwickeln, die sie zu so leistungsfähigen In-vitro-Modellen machen, schränkt jedoch die für die zerstörungsfreie Bewertung verwendeten Werkzeuge drastisch ein. Tatsächlich ist eine der größten Herausforderungen bei der zerstörungsfreien Analyse von MTCS die Quantifizierung von Details im Zellmaßstab. Die Hellfeld- und Phasenkontrastmikroskopie wird routinemäßig eingesetzt, um das Wachstum und die Entwicklung von 3D-MCTS zerstörungsfrei zu bewerten. Diese Modalitäten sind jedoch auf 2D-Projektionen beschränkt, da sie nicht in der Lage sind, die entscheidende 3D-Struktur dieser Modelle10,11,12,13 zu visualisieren. Informationen über Zytotoxizität und Zellproliferation werden typischerweise durch fluoreszierende Bildgebung (d. h. Lichtblattmikroskopie, konfokale Mikroskopie) oder ex vivo immunhistologische Färbung14,15,16 gesammelt. Während diese Ansätze wertvolle, hochauflösende Informationen über Gewebestruktur, Zelldichte und Zellfunktion liefern, erfordern sie häufig eine Probenvorbereitung wie optisches Clearing, Fixierung / Färbung oder Einbettung, die Längsschnittanalysen verhindert.
Die optische Kohärenztomographie (OCT) ist eine zerstörungsfreie strukturelle Bildgebungsmodalität, die das Potenzial hat, einige der oben genannten Herausforderungen zu überwinden. Es verfügt über eine zelluläre Auflösung und ein ausreichend breites Sichtfeld (bis zu 10 mm x 10 mm), das in der Lage ist, ganze mehrzellige Aggregate zu visualisieren17,18,19. Wichtig ist, dass diese Technik aufgrund der sichtbaren Natur des verwendeten Lichts völlig zerstörungsfrei und markierungsfreiist 17. Außerdem können Proben in situ abgebildet werden, ohne dass eine Probenvorbereitung erforderlich ist, so dass die Proben direkt aus dem Inkubator entnommen, schnell mit OCT gescannt (Scandauer ~ 5-10 min) und dann in den Inkubator zurückgeführt werden können, was eine Längscharakterisierung ermöglicht. Viele Studien, die OCT zur Analyse des Tumorsphäroidverhaltens einsetzen wollen, sind kürzlich aufgetaucht. In einer der aufregendsten Demonstrationen verwendeten Huang et al. OCT, um nekrotische Kerne in großen Tumorsphäroidmodellen zerstörungsfrei zu erkennen, und stellten fest, dass lebende und tote Zellregionen erkennbare Unterschiede in der optischen Dämpfung aufweisen, die für die markierungsfreie Lebensfähigkeitsüberwachung verwendet werden können20. In ähnlicher Weise führten Hari et al. Messungen des Brechungsindex (RI) von humanem Darmkrebs (HCT116) -Sphäroiden durch, die mit OCT aufgenommen wurden, um das Vorhandensein von Hypoxie in den Probenzu untersuchen 21. Ihre Messungen reichten nicht für direkte Schlussfolgerungen aus, obwohl sie niedrigere RI an Orten beobachteten, die mit der Stelle, wenn auch nicht mit der Größe, nekrotischer Kerne korrelierten, die später durch konfokale Mikroskopie identifiziert wurden. Abd El-Sadek et al. verwendeten OCT, um die regionale Gewebelebensfähigkeit von Brustkrebstumormodellen zu visualisieren und zu quantifizieren22. Sie berichteten über zwei OCT-basierte Methoden zur Visualisierung der Gewebedynamik und zeigten eine moderate Korrelation zwischen Unterschieden in diesen Metriken und mikroskopisch identifizierten Regionen lebender / toter Zellen.
Unsere veröffentlichte Arbeit unter Verwendung von OCT baute auf dieser früheren Literatur auf, um einen quantitativen, zerstörungsfreien Ansatz zur Messung der 3D-Morphologie und Zellzahl in MCTSs Brustkrebsmodellen während der Entwicklungzu etablieren 10,23. Mit der Imaris 3D-Rendering-Bildanalysesoftware zur Zählung der Anzahl der zellgroßen Objekte (d. h. Flecken), die in den OCT-Volumenscans abgebildet wurden, wurden die Zellzahlen zerstörungsfrei in MCTSs gemessen, die statistisch denen ähnlich waren, die über Hämozytometer bei aggregierter Dissoziation bestimmt wurden. Aufgrund der strukturellen Natur der OCT können Zellmembranen, die nach dem Zelltod durch Nekrose noch vorhanden sind, fälschlicherweise als lebende Zellen gezählt werden. Darüber hinaus wurde diese Charakterisierung auf die zerstörungsfreie Verfolgung der Zelllebensfähigkeit innerhalb einzelner Aggregate ausgeweitet, die einem Wirkstoffregime mit vielversprechendem Erfolg unterzogen wurden10. Wichtig ist, dass festgestellt wurde, dass eine ähnliche Zelllebensfähigkeit von unserem OCT-Imaris-Ansatz berichtet wurde, mit dem, was in diesen Proben bei Dissoziation verglichen wurde. Dieser zerstörungsfreie und markierungsfreie Zellansatz ermöglicht es, Zellen innerhalb von 3D-Konstrukten und dichte Aggregate längs zu zählen, ohne die Konstrukt- / Aggregatstruktur zu beeinträchtigen.
Die vorliegende Arbeit berichtet über einen verbesserten Ansatz zur direkten Quantifizierung der regionalen Zelldichte innerhalb dichter Aggregate, indem die Fähigkeit von OCT-Imaris genutzt wird, sowohl die Morphologie als auch die Zellzahl von 3D-Aggregaten zu messen. Diese methodische Weiterentwicklung liefert ein detaillierteres Bild der räumlichen Verteilung und Proliferation von Zellen innerhalb der charakteristischen konzentrischen Schichten von MCTS-Modellen. Anstatt einfach eine durchschnittliche Gesamtzelldichte zu berechnen, können solche lokalen Dichtemessungen Zelldichtegradienten aufdecken, z. B. solche, die mit der Verdichtung verbunden sind. Diese regionale Bewertung wird auch auf Aggregate angewendet, die mit einem Chemotherapeutikum behandelt werden, um die regionale Arzneimittelreaktion zu bewerten, gemessen an Veränderungen der lokalen Zelldichte. Diese Kombination aus OCT und fortschrittlichen bildgebenden Analysemethoden bietet eine Quantifizierung der regionalen Zelllebensfähigkeit, die verwendet werden kann, um die Arzneimittelpenetration basierend darauf zu untersuchen, in welchen Regionen die Zelldichte abnimmt. Dies ist der erste Bericht, der die regionale Zelldichte und Lebensfähigkeit als Reaktion auf das Medikament in dichtem Zellgewebe zerstörungsfrei quantifiziert und in Längsrichtung misst. Eine solche Charakterisierung der dreidimensionalen Zelldichte und der räumlichen Verteilung über ganze MCTS kann dazu beitragen, die Arzneimittelabgabe bei der Krebsbehandlung zu optimieren und das Verständnis der Progression von Krebsmodellen zu verbessern.
Protokoll
Für die vorliegende Studie wurden AU565 (HER2+) und MDA-MB-231 Brustkrebszelllinien verwendet (siehe Materialtabelle).
1. Vorbereitung von Tumoraggregaten
- Bereiten Sie AU565 (HER2+) Brustkrebszellwachstumsmedien mit dem Basalmedium (+) des Roswell Park Memorial Institute (RPMI) 1640 in L-Glutamin vor, ergänzt mit 10% (v/v) fetalem Rinderserum und 1% Penicillin/Streptomycin (siehe Materialtabelle).
- Bereiten Sie MDA-MB-231 dreifach negative Wachstumsmedien für Brustkrebszellen mit Dulbeccos modifiziertem Eagle's Medium (DMEM) vor, das mit 10% (v/v) fetalem Rinderserum (FBS), 100 E/ml Penicillin/Streptomycin und 2 mM L-Glutamin (siehe Materialtabelle) ergänzt wird.
- Bereiten Sie 70% -90% konfluente Zellkulturen beider Zelllinien (~ 3-4 Tage Vorbereitung) unter Standardbedingungen (37 ° C, 5% CO2, 95% relative Luftfeuchtigkeit) vor. Lösen Sie Zellmonoschichten von ihren Kulturkolben nach der Standard-Trypsinisierungsmethode.
HINWEIS: Verhindern Sie eine übermäßige Exposition der Zellen gegenüber dem Trypsin, die ihre Lebensfähigkeit beeinträchtigt.- Für AU565-Zellen aspirieren Sie Zellmedien aus dem Kolben mit einer Pipette (oder, falls verfügbar, mit einer Vakuumpumpe, die über einen Schlauch mit einer Pipettenspitze aus Autoklavglas verbunden ist) und ersetzen Sie sie durch 2 ml Trypsin-EDTA. Lassen Sie den Kolben 3 Minuten bei Raumtemperatur stehen und gehen Sie dann für weitere 4 Minuten in den Inkubator. Danach fügen Sie 6 ml Wachstumsmedien in den Kolben hinzu, um das Trypsin zu neutralisieren.
- Bei MDA-MB-231-Zellen werden die Zellmedien wie in Schritt 1.3.1 aus dem Kolben abgeholt und durch 1,5 ml Trypsin-EDTA ersetzt. Nach 7 Minuten Inkubation 8,5 ml Wachstumsmedien in den Kolben geben, um das Trypsin zu neutralisieren.
- Fügen Sie 10 μL der Zellsuspension zu einem Hämozytometer hinzu, um die Anzahl der Zellen in der Suspension24 zu bestimmen. Resuspendieren Sie Zellen in Medien in der gewünschten Konzentration von 2,5 × 105 Zellen/ml.
- Geben Sie 50 μL Zellsuspension in jede Vertiefung einer runden, nicht haftenden 96-Well-Platte ab. Für Suspensionen, die ohne Matrigel hergestellt wurden (Basalmembranmatrix, siehe Materialtabelle), fügen Sie 50 μL reines Wachstumsmedium zu jeder Vertiefung hinzu.
- Für Suspensionen, die mit der Basalmembranmatrix hergestellt wurden, entfernen Sie die Matrixdurchstechflasche aus der Lagerung von -20 °C und legen Sie sie in den Kühlschrank, um sie über Nacht aufzutauen. Bereiten Sie einen Behälter mit Wachstumsmedien vor und kühlen Sie ihn 10 Minuten zum Abkühlen.
- Mit einer gefrorenen Pipettenspitze die Matrix in gekühlte Medien geben, so dass die Endkonzentration dieser Lösung 5% beträgt. Fügen Sie 50 μL dieses Mediums zu jeder Vertiefung hinzu, so dass die endgültige Konzentration der Matrix in diesen Vertiefungen 2,5%3 beträgt.
HINWEIS: In früheren Arbeiten wurde die Aggregatmorphologie für diese Zelllinien10,25 bewertet und festgestellt, dass MDA-MB-231-Aggregate unter Zugabe der Membranmatrix Sphäroide bilden, während MDA-MB-231-Kulturen ohne Matrix und AU565+/- Matrix alle scheibenförmige Aggregate bilden. Die quantifizierte Kugel von >0,8 auf einer Skala von 0 (Ebene) - 1,0 (perfekte Kugel) wurde verwendet, um ausreichend sphärische Aggregate zu identifizieren, und daher wurde erwartet, dass sie das erforderliche Oberfläche-zu-Volumen-Verhältnis für das in vivo-ähnliche Verhalten26,27 haben.
- Zentrifugieren Sie die Platten bei 123 x g für 10 min bei Raumtemperatur unmittelbar nach der Aussaat, um die Sammlung eines Zellpellets am Boden jeder Vertiefung sicherzustellen.
HINWEIS: Dieser Schritt muss so schnell wie möglich nach der Aussaat erfolgen. Die Autoren beobachteten, dass zu viel Zeit zwischen diesen Schritten es den Zellen ermöglicht, sich über die Böden und Seiten jedes Brunnens niederzulassen, was ihre Fähigkeit hemmt, sich am Boden des Brunnens zu sammeln und zu aggregieren. - Inkubieren Sie die Platten für 4 Tage, woraufhin die Zellaggregate als gereift gelten.
HINWEIS: AU565-Aggregate, die mit der Basalmembranmatrix hergestellt wurden, benötigen eine zusätzliche 5-tägige Kulturperiode für die Arzneimittelreaktionsstudie (insgesamt 9 Tage, Medienwechsel an Tag 4).
2. Verabreichung von Trastuzumab (TZM) an AU565-Zellaggregate
- Bereiten Sie 500 μg/ml TZM-Lösung (siehe Materialtabelle) in AU565-Wachstumsmedien vor. An Tag 4 fügen Sie 10 μL dieser Lösung zu jeder Vertiefung hinzu, so dass die Endkonzentration in jeder Vertiefung 50 μg/ml beträgt.
- Kultur aggregiert für 5 zusätzliche Tage nach der Hinzufügung von TZM und bewertet zu wichtigen Zeitpunkten.
HINWEIS: Für die vorliegende Studie wurden Zeitpunkte von 0 h (unmittelbar vor der Medikamentennahme), 24 h und 120 h nach dem Medikament verwendet, um das Medikament zu analysieren.
3. Bildgebung der optischen Kohärenztomographie
HINWEIS: Die Proben hierin wurden mit optischer Kohärenztomographie (OCT) während jedes Tages der Reifung (1-4) und dann wieder an Tag 5 (24 h nach der Drogenzugabe) und Tag 9 (120 h nach der Drogenzugabe) für ausgewählte unter Drogen gesetzte Aggregate abgebildet. Für die aktuelle Studie wurde ein kommerzielles Spectral-Domain Optical Coherence Tomography (SDOCT, siehe Table of Materials) System für die OCT-Bildgebung verwendet. Obwohl dieser Ansatz für fast jedes OCT-System zugänglich ist und das angewandte Verfahren im Allgemeinen zwischen verschiedenen Systemen ähnlich sein wird, sind einige der folgenden detaillierten Schritte spezifisch für die derzeitige Ausrüstung.
- Verwenden Sie ein OCT-System für die strukturelle Bildgebung. Stellen Sie die A-Scan-Rate für eine hochauflösende Bilderfassung auf 5,5 kHz ein. Setzen Sie den Brechungsindex für Proben in einem flüssigen Medium auf 1,33. Stellen Sie die Voxelgröße auf 1,10 x 1,10 x 2,58 μm3 ein.
- Legen Sie im Fenster Bildparameter auf der rechten Seite des Bildschirms das Sichtfeld (Field of View, FOV) fest, indem Sie X-, Y- und Z-Werte (in mm) eingeben, sodass die Probe in diesem interessierenden Bereich enthalten ist.
HINWEIS: Das Sichtfeld für diese Studien wurde typischerweise auf 1,5 x 1,5 x0,5 mm 3 festgelegt. Stellen Sie sicher, dass die Probe in diesen Bereich passt, indem Sie den "Winkel"-Eingang zwischen 0 und 90 Grad wechseln und eine visuelle Bestätigung durchführen. - Klicken Sie auf 3D-Erfassungsmodus und dann auf Aufzeichnen , um den 3D-Volumenscan der Probe zu erfassen.
4. Bildanalyse
- Exportieren Sie die OAT-Datei in das Softwareformat (Imaris, siehe Materialverzeichnis).
- Öffnen Sie die OAT-Datei im Software Development Kit. Klicken Sie auf Exportieren, setzen Sie den Dateityp auf .jpg und exportieren Sie die Bilder in einen leeren Ordner.
- Öffnen Sie die Bildverarbeitungssoftware (FIJI, siehe Materialverzeichnis) und importieren Sie die Bildsequenz aus dem Ordner, in dem die exportierten JPEGs gespeichert sind. Verwenden Sie Software, um die Bildsequenz zusammenzusetzen, und speichern Sie diese Datei dann als TIFF-Bild.
- Erstellen Sie eine Volume-Rekonstruktion, indem Sie die folgenden Schritte ausführen.
- Öffne Imaris und navigiere zur konvertierten TIFF-Datei in der Arena. Gehen Sie zu Bearbeiten > Bildeigenschaften und geben Sie die Voxelgröße (in μm) aus dem OAT-Bild in die entsprechenden XYZ-Felder ein. Klicken Sie dann auf OK.
HINWEIS: Deaktivieren Sie in der Beispielobjektstruktur auf der linken Seite des Bildschirms die Registerkarte Lautstärke , um Softwareverzögerungen zu vermeiden. - Klicken Sie über dem Objektbaum auf Neue Flächen hinzufügen (Add New Surfaces ). Klicken Sie im Menü unter dem Baum auf Automatische Erstellung überspringen und bearbeiten Sie manuell. Schieben Sie im Fenster " Anzeigeanpassung" die roten und schwarzen Pfeile manuell, um den Kontrast zwischen dem Beispiel und dem Hintergrund zu verbessern und die Beispielvisualisierung zu verbessern.
- Passen Sie die 'Slice-Position' an die Slice an einer Kante der Probe an, d.h. an der Stelle, an der das Sample-Signal zuerst erscheint. Verwenden Sie die Esc-Taste, um die Maus vom Navigationsmodus in den Auswahlmodus zu wechseln, und klicken Sie dann auf Zeichnen. Verfolgen Sie manuell den Umriss des Bereichs, in dem das Signal angezeigt wird.
- Verschieben Sie die Segmentposition, indem Sie die nächste Position in das Eingabefeld eingeben. Diese nächste Position muss ≤100 Scheiben weiter in der Probe sein als die vorherige. Verfolgen Sie manuell den Bereich, in dem das Signal angezeigt wird.
- Wiederholen Sie Schritt 4.2.4 durch die Dicke der Probe, bis die gegenüberliegende Kante der Probe erreicht ist. Klicken Sie dann im linken Menü auf Oberfläche erstellen , um diese Segmente zusammenzufügen und die Volumenrekonstruktion abzuschließen.
- Klicken Sie auf Bearbeiten und dann auf Maskenauswahl. Dadurch wird ein neuer Kanal im Fenster "Anzeigeanpassung" erstellt, der nur das isolierte Sample enthält. Die morphologischen Merkmale der Probe finden Sie nun auf der Registerkarte Statistik > Detailliert.
HINWEIS: Dieser Ansatz wurde verfolgt, um die in dieser aktuellen Studie berichteten Sphärizitäten und Volumina zu bestimmen.
- Öffne Imaris und navigiere zur konvertierten TIFF-Datei in der Arena. Gehen Sie zu Bearbeiten > Bildeigenschaften und geben Sie die Voxelgröße (in μm) aus dem OAT-Bild in die entsprechenden XYZ-Felder ein. Klicken Sie dann auf OK.
- Ermitteln Sie die Gesamtzelldichte einer Probe, indem Sie die folgenden Schritte ausführen.
- Wählen Sie über der Objektstruktur die Option Neue Spots hinzufügen aus. Deaktivieren Sie im Menü Algorithmuseinstellungen alle Kontrollkästchen. Klicken Sie auf den blauen Pfeil , um zum Bildschirm Quellkanal zu gelangen.
- Wählen Sie aus dem angezeigten Dropdown-Menü den in Schritt 5.2.8 erstellten maskierten Kanal aus, der in der Regel Kanal 2 heißt. Geben Sie den durchschnittlichen Zelldurchmesser für die Probe in das Feld XY-Durchmesser ein. Stellen Sie sicher, dass die Hintergrundsubtraktion aktiviert ist.
HINWEIS: Für diese Arbeit mit AU565- und MDA-MB-231-Zellen wurde der Durchmesser auf 10 μm eingestellt. Diese Auswahl basiert auf der Zellgröße (erläutert im Abschnitt Diskussion).
- Wählen Sie aus dem angezeigten Dropdown-Menü den in Schritt 5.2.8 erstellten maskierten Kanal aus, der in der Regel Kanal 2 heißt. Geben Sie den durchschnittlichen Zelldurchmesser für die Probe in das Feld XY-Durchmesser ein. Stellen Sie sicher, dass die Hintergrundsubtraktion aktiviert ist.
- Klicken Sie auf den blauen Pfeil , um zum Bildschirm Spots klassifizieren zu gelangen. Klicken Sie im Diagramm unten im Menü auf den linken Rand des gelben Schwellenwerts, und ziehen Sie ihn an den linken Rand des Diagramms, sodass alle Objekte in den gelb schattierten Schwellenwert einbezogen werden. Klicken Sie dann auf den grünen Pfeil , um die Spot-Erstellung abzuschließen.
- Rufen Sie die Anzahl der identifizierten Objekte (d. h. die Anzahl der Stichprobenzellen) ab, indem Sie auf Statistik > Gesamt- > Gesamtzahl der Flecken klicken.
- Um die durchschnittliche Aggregatzelldichte zu bestimmen, teilen Sie die Zellzahl des Aggregats (gemessen in Schritt 4.3.3) durch das Aggregatvolumen (bestimmt in Schritt 4.2.6).
- Wählen Sie über der Objektstruktur die Option Neue Spots hinzufügen aus. Deaktivieren Sie im Menü Algorithmuseinstellungen alle Kontrollkästchen. Klicken Sie auf den blauen Pfeil , um zum Bildschirm Quellkanal zu gelangen.
- Beurteilung der regionalen Dichte in konzentrischen Schichten sphärischer Aggregate (Abbildung 1A).
- Nach der morphologischen und Zelldichteanalyse wird die regionale Dichte bewertet. Klicken Sie auf die in Schritt 4.2.5 erstellte Fläche, und navigieren Sie zur Registerkarte Flächenstil/-qualität. Ändern Sie die Auswahl in Mittelpunkt und ändern Sie die Pixelbreite in ≤20, um die beste Sichtbarkeit zu gewährleisten. Navigieren Sie zu Statistik > Detaillierte > Position und notieren Sie die Position des Center-Spots.
- Wählen Sie im Menü über dem Objektbaum die Option Neuen Bezugsrahmen hinzufügen (Add New Reference Frame). Aktivieren Sie die Kontrollkästchen Sichtbar und Fix neben XY im Menü. Klicken Sie auf die Mitte des Referenzrahmensymbols, und ziehen Sie sie so, dass sie mit der mittleren Stelle übereinstimmt. Deaktivieren Sie die Felder XY Visible (XY Visible) und Fix (XY Visible) und aktivieren Sie sie für XZ.
- Klicken und ziehen Sie erneut die Mitte des Referenzrahmensymbols, sodass sie mit dem mittleren Punkt übereinstimmt. Wiederholen Sie dies schließlich für die YZ-Ebene und wechseln Sie zwischen diesen drei festen Ebenen, bis das Bezugssystem perfekt mit dem Mittelpunkt übereinstimmt. Doppelklicken Sie im Objektbaum auf den Bezugsrahmen und benennen Sie ihn in Center oder ähnlich um.
- Klicken Sie auf die in Schritt 4.3 erstellten Punkte und navigieren Sie zu Statistik > Detaillierter > Positionsreferenzrahmen. Klicken Sie auf Position X Referenzrahmen , bis er vom höchsten zum niedrigsten Wert sortiert wird. Notieren Sie den höchsten Wert - dies zeigt den entferntesten Rand der Probe an, d. H. Probenradius.
HINWEIS: Da die hier verwendeten Proben kreisförmig in der XY-Ebene sind, können Berechnungen entlang der X- oder Y-Achse mit ähnlichen Ergebnissen durchgeführt werden. Für Proben, die keine X-Y-Symmetrie aufweisen (asymmetrisch, ellipsoid, unregelmäßige Geometrien usw.), wird empfohlen, diese Analysen entlang mehrerer Achsen durchzuführen. - Navigieren Sie zu Statistiken. Klicken Sie in der unteren rechten Ecke des Menüs auf Alle Statistiken in Datei exportieren und speichern Sie die Daten in einer Tabelle.
- Führen Sie manuelle Berechnungen durch, um konzentrische Ebenen entlang der X-Achse zu identifizieren.
HINWEIS: Die in dieser Studie verwendeten Proben hatten einen Durchmesser von etwa 500 μm. Somit gibt es zwei äußere 200 μm dicke konzentrische Zonen und eine innere 100 μm dicke zentrale Zone. Es wird empfohlen, Zonen beizubehalten, die 200 μm dick sind, da sich das Diffusionsverhalten in dieser Entfernungvoraussichtlich ändern wird 7,28,29,30. In Übereinstimmung mit dieser Argumentation wird auch empfohlen, für größere Proben konzentrischere Zonen zu verwenden und umgekehrt für kleinere Stichproben. - Legen Sie einen äußeren Schichtbereich von 200 μm fest, indem Sie 200 μm vom äußeren Radius in Schritt 4.4.3 subtrahieren. Somit umfasst der äußere Bereich Punkte mit X-Positionen zwischenX-Radius und Xäußerer, innerer Kante (Abbildung 1A, orangefarbener Bereich).
- Legen Sie einen Übergangsbereich fest, indem Sie 200 μm von Xäußerer, innerer Kante subtrahieren. Der Übergangsbereich umfasst Punkte mit X-Positionen zwischen X Außenkante, Innenkante und XÜbergangskante, Innere Kante (Abbildung 1A, rosa Bereich).
- Legen Sie einen zentralen Kernbereich fest, der die verbleibenden Punkte zwischen dem Stichprobenmittelpunkt und Xübergangsweise Innenkante umfasst (Abbildung 1A, blauer Bereich).
- Öffnen Sie die gespeicherte Tabellenkalkulationsdatei, die in Schritt 4.4.4 erstellt wurde. Navigieren Sie zur Registerkarte Entfernung vom Ursprungsreferenzrahmen.
- Berechnen Sie die Anzahl der Punkte im Kernbereich mit der Funktion 'COUNTIF (Spalte x, "< Xtransitional,inner-edge"), wobei Spaltex die Spalte 'Entfernung vom Ursprungsbezugssystem' ist. Der resultierende Wert ist die Zellennummer in diesem Bereich. Teilen Sie diesen Wert durch das Volumen des Bereichs, um die Zelldichte zu erhalten.
- Berechnen Sie auf ähnliche Weise die Anzahl der Zellen im Übergangsbereich mit 'COUNTIF (Spalte x, "< X außen,innere Kante") - COUNTIF(Spaltex, "> XÜbergangskante,innere Kante").
- Berechnen Sie die Anzahl der Zellen im äußeren Bereich mit 'COUNTIF (Spaltex,"> Xtransitional,inner-edge").
- Bewerten Sie die regionale Zelldichte in nicht-sphärischen Proben über "Regional Plugs" (Abbildung 1B).
HINWEIS: Für nicht-sphärische Proben, die keine konzentrischen Schichten aufweisen, wird die "Regional Plug"-Methode entwickelt, um die lokale Zelldichte in verschiedenen radialen Tiefen im gesamten Aggregat zu untersuchen.- Wiederholen Sie die Schritte 4.4.1-4.4.3, um den zentralen Bezugsrahmen (Abbildung 1B, zentraler gelber Kreis) festzulegen und den gesamten Probenradius zu erhalten.
- Führen Sie manuelle Berechnungen durch, um die Platzierung von Referenzrahmen innerhalb der Übergangs- und Außenregionen zu identifizieren, so dass die Zelldichte in der Probe an diesen Stellen beurteilt werden kann.
- Um die äußere Position zu berechnen, subtrahieren Sie 50 μm vom Probenradiuswert aus Schritt 4.5.1 und verwenden diesen Wert als X-Position.
HINWEIS: Verwenden Sie dieselben Y- und Z-Positionswerte, die in Schritt 4.5.1 für alle Stecker innerhalb einer bestimmten Probe aufgezeichnet wurden, um die Zelldichte entlang der X-Achse der Probe zu messen (Abbildung 1B, gelber Kreis ganz links). - Klicken Sie oberhalb des Objektbaums auf Neue Spots hinzufügen und dann auf Automatische Erstellung überspringen, manuell bearbeiten. Halten Sie den Mauszeiger im Auswahlmodus gedrückt, um eine Stelle auf dem Bildschirm zu platzieren. Geben Sie im linken Menü die oben berechneten XYZ-Positionswerte ein. Stellen Sie die Durchmesser XY und Z für beste Sichtbarkeit auf ≤20 ein.
- Wiederholen Sie Schritt 4.4.2, um an dieser Stelle einen Referenzrahmen hinzuzufügen. Benennen Sie diesen Bezugsrahmen im Objektbaum outer oder ähnlich um.
- Um die Übergangsposition (Mittelpunktposition) zu berechnen, suchen Sie den Mittelwert des X-Mittelpunktpositionswerts und derX-Außenpositionswerte. Verwenden Sie diesen Wert als X-Position für den Übergangsbezugsrahmen. Wie oben beschrieben, verwenden Sie dieselben Y- und Z-Werte, die in Schritt 4.5.1 für alle Stecker innerhalb einer bestimmten Probe aufgezeichnet wurden, um die Zelldichte entlang der X-Achse der Probe zu messen (Abbildung 1B, mittlerer gelber Kreis).
- Wiederholen Sie Schritt 4.4.2, um den mittleren Bezugsrahmen an dieser Stelle zu platzieren, und benennen Sie ihn nach der Erstellung in "übergangsweise" oder ähnliches um.
- Um die äußere Position zu berechnen, subtrahieren Sie 50 μm vom Probenradiuswert aus Schritt 4.5.1 und verwenden diesen Wert als X-Position.
- Klicken Sie auf die in Schritt 4.3 erstellten Spots und navigieren Sie zu Statistiken. Klicken Sie in der unteren rechten Ecke des Menüs auf Alle Statistiken in Datei exportieren und speichern Sie die Daten in einer Tabelle.
- Öffnen Sie die Tabelle. Navigieren Sie zur Registerkarte Entfernung vom Ursprungsreferenzrahmen. Der Abstand jedes Objekts zu den Bezugssystemen wird in Spalte A angezeigt, und die Gruppierung der Bezugssysteme für jedes Objekt wird in Spalte G angezeigt. Verwenden Sie die Funktion 'MOD', um jeden Abstand numerisch dem entsprechenden Bezugssystem zuzuweisen, wobei 0 der Mittelrahmen, 1 der Übergang und 2 der äußere ist.
- Filtern Sie die Werte in dieser Spalte, um mit den Abständen in jedem Bezugssystem zu arbeiten. Berechnen Sie für jeden der Bezugsrahmen die Anzahl der Objekte innerhalb von 50 Mikrometern des Rahmens mit der Funktion 'COUNTIF (Spalte x, "≤50"), wobei Spaltex die Spalte 'Entfernung vom Ursprungsbezugsrahmen' für jede Gruppe ist. Der resultierende Wert entspricht der Anzahl der Zellen in diesem regionalen Plug. Teilen Sie diesen Wert durch das Volumen des 100-μm-Steckers, um eine Zelldichte zu erhalten.
- Führen Sie die Spatially-Refined Regional Plug-Methode aus (Abbildung 1C).
HINWEIS: Dieser Ansatz wurde verwendet, um die regionale Zelllebensfähigkeit als Reaktion auf die Arzneimittelanwendung zu bewerten. Die Einbeziehung weiterer Referenzrahmen verbessert die Auflösung von Zelldichten, die über die gesamte Modelldicke berechnet werden können.- Wiederholen Sie die Schritte 4.4.1-4.4.3, um das mittlere Bezugssystem einzustellen (Abbildung 1C, zentraler gelber Kreis) und den Probenradius zu erhalten.
- Führen Sie manuelle Berechnungen durch, um zusätzliche Standorte von Interesse zu bestimmen. Addieren Sie dazu den X-Mittelwert um 100 μm, und verwenden Sie dann die Y- und Z-Werte des Mittelpunkts, um die erste Position entlang derMittelachse zu definieren. Fügen Sie dieser Position einen Bezugsrahmen hinzu, wie in Schritt 4.4.2 (Abbildung 1C, gelber Kreis neben dem Mittelkreis).
HINWEIS: Fügen Sie bei diesem Schritt weniger μm hinzu, wenn Sie eine Verfolgung mit höherer Auflösungsdichte anstreben. - Wiederholen Sie die Schritte 4.6.2, indem Sie jeder sequenziellen X-Position 100 μm (oder die gewünschte Anzahl von μm) hinzufügen, um eine Achse von Pfropfen mit gleichem Abstand durch die Dicke der Probe zu erstellen. Platzieren Sie das letzte Bezugssystem ≤50 μm vom äußeren Radius der Probe entfernt (Abbildung 1C, gelbe Kreise).
- Wiederholen Sie die Schritte 4.5.3-4.5.5, um Zellzahlen innerhalb jedes Steckers mit einem Durchmesser von 100 μm zu erhalten. Teilen Sie diese Werte durch das Volumen jedes entsprechenden Steckers, um die lokale Zelldichte zu erhalten.
- Wiederholen Sie alle Schritte in diesem Abschnitt für OAT-Daten, die zu jedem Zeitpunkt der Arzneimittelprüfung erfasst wurden. Der Vergleich der Zellzahl an jedem Ort während des Behandlungszeitverlaufs sollte zeigen, wo die Zelldichte abnimmt (d. H. Regionen, in denen der Zelltod auftritt) und folglich, wie tief das Medikament eindringt (d. H. Welche Schichten sehen einen Abfall der Zelldichte im Vergleich zu denen, die eine Zunahme der Zelldichte aufrechterhalten oder aufweisen).
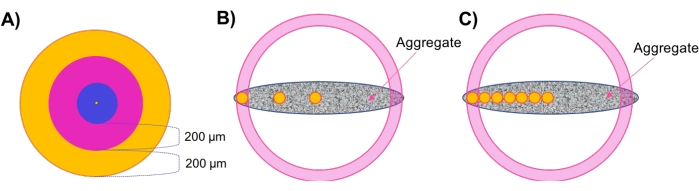
Abbildung 1: Schematische Darstellung. (A) Der Ansatz der konzentrischen Schicht (Schalen) zur Beurteilung der regionalen Zelldichte in sphärischen Aggregaten. (B) Die regionale Plug-Methode wurde entwickelt, um die lokale Zelldichte in nicht-sphärischen Aggregaten zu bewerten, wobei kleine (100 μm Durchmesser) sphärische Pfropfen (gelb dargestellt) als Dichteindikatoren für jede Zone/Dicke verwendet werden. (C) Für Studien zur Arzneimittelpenetration wird die räumlich verfeinerte regionale Plug-Methode angewandt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
In einer früheren Veröffentlichung wurde eine Methode zur zerstörungsfreien Messung der globalen Zelldichte innerhalb zellulärer Aggregate unter Verwendung vonOCT 10 etabliert. Hierin wird diese Technik erweitert, um die regionale Zelldichte von sich entwickelnden Zellaggregaten zu beurteilen. Abbildung 1 zeigt ein Schema dieser Ausdehnung, bei dem die Zelldichte in konzentrischen Schichten eines Sphäroids oder lokaler bewertet werden kann, indem stattdessen kleine (100 μm Durchmesser) sphärische Pfropfen betrachtet werden, die durch die gelben Kreise in Abbildung 1B,C gekennzeichnet sind. MDA-MB-231-Tumorsphäroide wurden zunächst bewertet, indem ein Mittelpunkt innerhalb des Aggregats festgelegt und die Anzahl der Objekte/Zellen in sequentiellen konzentrischen Schichten des Sphäroides gezählt wurde. Diese Ergebnisse sind in Abbildung 2 dargestellt. Die t-Tests von Student zeigten eine signifikant höhere Zelldichte im Sphäroidkern als in den Übergangsschichten (p = 4,3e-4) und äußeren Schichten (p = 4,0e-6). Dieses Ergebnis zeigt eine Verdichtung im Sphäroidkern nach 4 Tagen an.

Abbildung 2: Unterschiede in der regionalen Dichte, berechnet durch konzentrischen Schichtansatz für sphärische MDA-MB-231-Aggregate. Die Abbildung zeigt einen radialen Zelldichtegradienten mit Zellen (n = 3), die am dichtesten im Aggregatkern gepackt sind, und der lokalen Zelldichte, die mit dem Abstand vom Kern abnimmt. Die durchschnittliche Gesamtzahl der Zellen wird mit einer blauen Linie angezeigt. Die Maßstabsleiste für das Einschubbild beträgt 100 μm. Daten dargestellt als Mittelwert ± SD (*= p < 0,05, ***= p < 0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Eine Einschränkung dieser konzentrischen Schichttechnik besteht jedoch darin, dass sie nur auf sphärischen Aggregaten verwendet werden kann. Daher wurde der Zellzählansatz angepasst, um eine regionale Plug-Methode zu etablieren, die kleine Zonen an sequentiellen Stellen durch das Aggregat abtastet, ähnlich einer virtuellen Biopsie. Diese Plugs liefern Messungen der lokalen Zelldichte in bestimmten Tiefen. Diese Technik wurde gegen den konzentrischen Schichtansatz validiert, indem Analysen an denselben MDA-MB-231-Sphäroiden durchgeführt wurden (Abbildung 3). Die Ergebnisse zeigten eine gute Übereinstimmung zwischen den regionalen Plug- und konzentrischen Schichtansätzen für diese sphärischen Aggregate. Die t-Tests der Studenten ergaben keine statistischen Unterschiede zwischen den Ansätzen zur Messung der äußeren und Übergangsschicht (p = 0,243 bzw. 0,484) und einen geringen, aber signifikanten Unterschied bei der Berechnung der Dichten am Aggregatkern (p = 0,017).
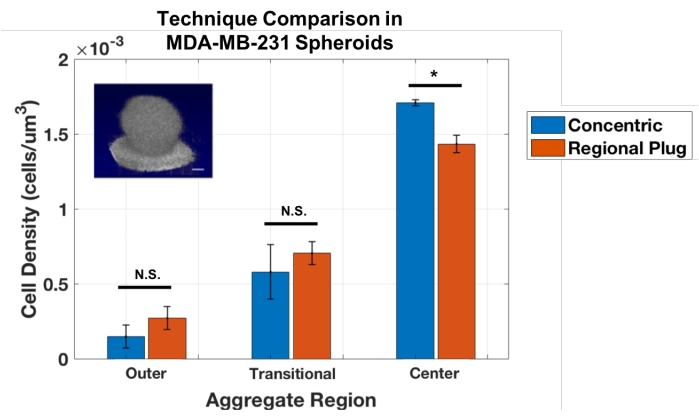
Abbildung 3: Konzentrische Zonen- und regionale Plug-Ansätze liefern ähnliche Ergebnisse zur Quantifizierung der Zelldichte in sphärischen MDA-MB-231-Aggregaten (n = 3). Daten dargestellt als Mittelwert ± SD (* = p < 0,05). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diese Technik wurde dann angewendet, um sowohl sphärische als auch nicht-sphärische Tumoraggregate am Tag 4 der Reife zu bewerten (Abbildung 4), wobei ein ähnlicher Trend zur Kernverdichtung für alle getesteten Morphologien unabhängig vom Zelltyp beobachtet wurde. Dieser Trend zeigte sich am deutlichsten in den Proben, die mit Matrigel (der Basalmembranmatrix) hergestellt wurden, einem Additiv, von dem bekannt ist, dass es die Aggregation fördert, dessen exogene Faktoren und Zusammensetzung jedoch schlecht charakterisiertsind 31,32,33. Interessanterweise scheint die Zugabe der Matrix das Volumen oder die Zellzahl nicht zu beeinflussen und scheint daher einen vernachlässigbaren Einfluss auf die Zellproliferation zu haben. Vielmehr scheint die Matrixaddition die Zelldichte neu zu verteilen, eine signifikante Kernverdichtung zu fördern und die Zelldichte in den äußeren Schichten zu verringern. Diese Ergebnisse deuten auch darauf hin, dass AU565-Zellen weniger empfindlich auf matrixvermittelte Aggregationseffekte reagieren als MDA-MB-231-Zellen. Diese Ergebnisse liefern wertvolle Einblicke in die physikalischen Mechanismen, durch die die Matrix die Zellaggregation in verschiedenen Brustkrebszelllinien ermöglicht. Wichtig ist, dass der regionale Plug-Ansatz für alle MCTSs geeignet ist, die sphärische oder nicht-sphärische Aggregatgeometrien aufweisen.

Abbildung 4: Die Matrixaddition fördert mehr Aggregation und verteilt die Zelldichte in Krebszelllinien neu. Sowohl für MDA-MB-231 (A,B) als auch für AU565 (C,D) Zelllinien verringert die Matrixaddition die Dichte in der äußeren Zone und erhöht die Verdichtung im Zentrum (n = 3), ohne die Gesamtzellzahl merklich zu verändern. Die durchschnittliche Gesamtzahl der Zellen wird mit blauen Linien angezeigt. Inset-Skalenbalken = 100 μm. Daten dargestellt als Mittelwert ± SD (*= p < 0,05, **= p < 0,01, ***= p < 0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Als nächstes wurde dieser regionale Plug-Ansatz verwendet, um den Zelltod in TZM-behandelten Tumoraggregaten zerstörungsfrei zu verfolgen. AU565 MCTSs, die mit der Membranmatrix hergestellt wurden, wurden am Tag 4 der Entwicklung mit TZM behandelt und bis Tag 9 kultiviert, wobei die wichtigsten OCT-Bildgebungszeitpunkte bei 0 h (Pre-Drug), 24 h und 120 h (5 Tage) lagen. Die räumlich definierte regionale Plug-Methode wurde an jedem Zeitpunkt angewendet, wobei die Stecker alle 100 μm über die gesamte Dicke jedes Aggregats eingestellt wurden, wie die gelben Kreise in Abbildung 1C zeigen. Die Größe des Mittelsteckers wurde konstant gehalten, während der äußere Stecker im Durchmesser schwanken durfte, was der sich ändernden Aggregatgröße entspricht. Geringfügige Schwankungen der Zelldichte wurden im Laufe der Zeit innerhalb der inneren 500 μm jedes Aggregats beobachtet, was auf einen minimalen Zelltod hindeutet (Abbildung 5). Tatsächlich traten die meisten Zelltodesfälle in den äußeren 200 μm jedes Aggregats auf, insbesondere in den äußersten 100 μm, die bis zum 120-h-Zeitpunkt für alle analysierten Aggregate vollständig verschwanden. Die Visualisierung des Zelltods als indikative Arzneimittelreaktion hauptsächlich in den äußeren Schichten von MCTSs steht im Einklang mit den Penetrationsproblemen von TZM, einem klinisch relevanten Antikörperwirkstoff mit einem Molekulargewicht von 145 kDa34. Tatsächlich beruht das Medikament auf der passiven Diffusion durch diese dichten zellulären Modelle, von der erwartet wird, dass sie ihre Fähigkeit, tiefer als 200 μm in die Modelle einzudringen, in Frage stellt.
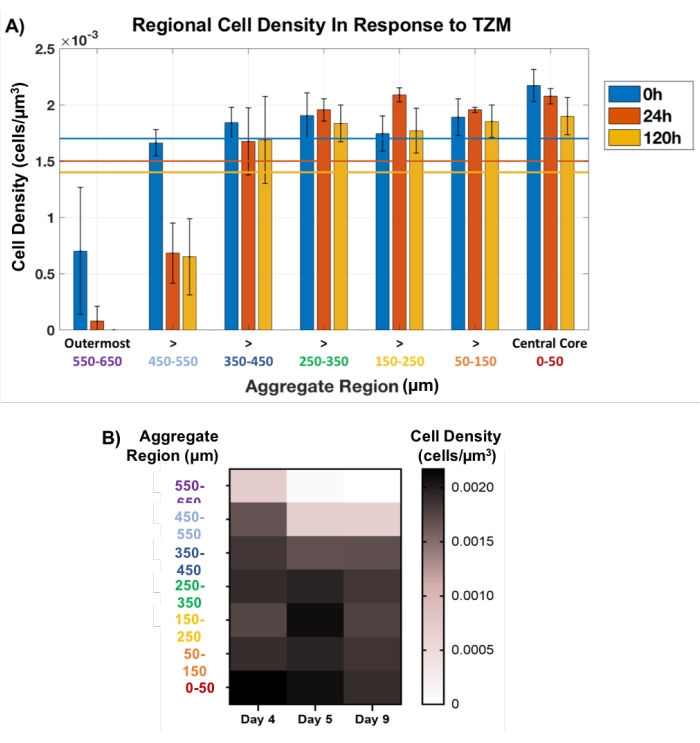
Abbildung 5: Zelllebensfähigkeit als Reaktion auf das Arzneimittel, gemessen über die gesamte Aggregatdicke. Der Pfropfen am inneren Kern wurde konstant bei 100 μm Durchmesser gehalten, während der in der äußeren Zone mit wechselnder Aggregatgröße schwanken durfte. (A) Die regionale Zelldichte als Reaktion auf die TZM-Addition ergab, dass der Zelltod weitgehend auf die äußeren 200 μm beschränkt war, insbesondere auf die äußeren 100 μm, die nach 120 h Behandlung vollständig verschwanden. Die innere Dicke der Aggregate von 500 μm beobachtete eine geringe Veränderung der Zellzahl (n = 3). Die durchschnittliche Gesamtzahl der Zellen wird mit entsprechenden farbigen Linien für jeden Zeitpunkt angezeigt. Die Daten werden als durchschnittliche ± SD dargestellt. (B) Heatmap-Diagramm, das die Änderung der durchschnittlichen Zelldichte als Reaktion auf den Wirkstoff als Funktion der Aggregatdicke darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Bedeutung
Multizelluläre Tumorsphäroide (MCTSs) sind leistungsstarke 3D-In-vitro-Modelle zur Untersuchung der Tumorprogression und des Arzneimittelscreenings 1,2,3. Die Förderung des Nutzens dieser relativ einfachen Aggregatmodelle hängt stark von der Charakterisierung ihrer Hauptmerkmale wie Morphologie und Zelldichte ab, von denen bekannt ist, dass sie sowohl die Progression des Tumormodells als auch die therapeutische Reaktion beeinflussen. Ihre erforderliche Größe bringt jedoch Herausforderungen bei der Bewertung dieser Eigenschaften mit sich, insbesondere bei zerstörungsfreien Analysen. Die vorgestellte Methode bietet ein neues Werkzeug für die longitudinale und markierungsfreie Quantifizierung der Zelldichte und Lebensfähigkeit in diskreten Bereichen von dichten 3D-Aggregatmodellen. Dasselbe Aggregat kann mit der optischen Kohärenztomographie (OCT) über mehrere Entwicklungstage neu abgebildet werden. Diese volumetrischen Scans können analysiert werden, um zu charakterisieren, wie sich die Zelldichte während der MCTS-Reifung regional entwickelt. Dieselben Prinzipien gelten für die Analyse von unter Drogen gesetzten Aggregaten, die in Längsrichtung während eines bestimmten Arzneimittelregimes abgebildet werden können, um festzustellen, wo die Zelldichte abnimmt, d.h. wo das Medikament aktiv Zellen abtöten kann. Dieser Ansatz verbessert sich deutlich gegenüber früheren Methoden zur Gewinnung ähnlicher Informationen auf Zellskala, die traditionell eine Fixierung, Färbung und/oder Schnittung erfordern, wodurch Längsschnittanalysen ausgeschlossen werden. Tatsächlich hat dieses Tool das Potenzial, die Anzahl der für eine bestimmte Studie benötigten Proben drastisch zu reduzieren, da dieselben Proben nacheinander analysiert werden können. Es wird auch erwartet, dass dies zu jedem Zeitpunkt einen Mehrwert bringt, da Entwicklungen innerhalb eines einzigen Aggregats verfolgt werden können, während es auf einen bestimmten Stimulus reagiert, anstatt sich auf korrelierte Daten aus altersangepassten Terminalstichproben zu verlassen. Über diese hierin gezeigte MCTS-Anwendung hinaus kann diese OCT-Imaris-Methode andere zelluläre Aggregate, embryoide Körper, komplexere Organoide oder Gewebeproben mit einer Dicke von einigen Millimetern untersuchen. Dieses Protokoll wird das Verständnis der Zellverdichtung während der Aggregatentwicklung und der Arzneimittelreaktion in dichten Aggregatmodellen verbessern.
Änderungen
Das vorgestellte Protokoll wurde für die Analyse von MDA-MB-231 und AU565 MCTSS-Modellen optimiert. Modelle, die mit anderen Zelllinien erstellt wurden, sind anwendbar; Aufgrund von Änderungen der durchschnittlichen Zellgröße und der Aggregatmorphologie kann jedoch eine gewisse Protokolloptimierung erforderlich sein. Es wurde eine separate Studie durchgeführt, in der MDA-MB-231- und AU565-Zellen in 2D plattiert wurden und eine durchschnittliche Zellgröße durch Mikroskopie erhalten wurden. Dieser Durchmesser wurde als XY-Durchmesser innerhalb der Imaris-Funktion "Spots" verwendet, so dass Objekte dieser ungefähren Größe gezählt wurden. Wenn Sie diesen Wert ändern, ändert sich die Anzahl der Objekte in Stichprobe10, und genauere Ergebnisse werden erwartet, wenn diese Eingabe der Zellengröße nahe kommt. Daher muss ein geeigneter XY-Durchmesser durch die durchschnittliche Zellgröße für den verwendeten Zelltyp informiert werden.
Kritische Schritte und Fehlerbehebung
Einer der kritischen Schritte bei der OCT-Bildgebung ist die Auswahl der Scanauflösung. Die vom Benutzer festgelegte Pixelgröße muss so klein sein, dass mehrere Pixel benötigt werden, um die durchschnittliche Größe des verwendeten Zellentyps zu erfassen. Dies verbessert die Genauigkeit der "Spots" -Analyse in Imaris, indem die OCT-Auflösung der Zellen verbessert und die Möglichkeit verringert wird, dass stochastisches Pixelrauschen die Zellzählung negativ beeinflusst.
Die Isolierung der Probe innerhalb des Imaris-Referenzrahmens beeinflusst stark die Ausgangswerte für die Zelldichte. Während der Benutzer diesen Schritt durchführt, wird er von einem Maß an Subjektivität und Verzerrung begleitet, das konsistent auf alle Probenanalysen angewendet werden muss. Bei der Isolierung der Probe innerhalb des Volumenscans, um mit der Imaris-Analyse zu beginnen, muss darauf geachtet werden, dass die Aggregatumrisse genau verfolgt werden und das Einbeziehen von Artefakten (d. h. Reflexionen von Substraten oder Medienhöhe) vermieden wird.
Die richtige Platzierung von Referenzrahmen während der regionalen Plug-Analyse ist ein weiterer kritischer Schritt. Wie in der Einleitung erwähnt, sind die drei kritischen Zonen, die während der Modellentwicklung analysiert werden müssen, die proliferative äußere Region, die Übergangsregion, die aus seneszenten/ruhenden Zellen besteht, und der hypoxische Kern. Es wird erwartet, dass die Platzierung von Referenzrahmen in der Mitte jeder Schicht die genaueste Schätzung der Zelldichte in dieser Region liefert. Diese Referenzrahmenplatzierung ist für die detaillierten regionalen Plug-Analysen, die hier für die Arzneimittelstudie verwendet werden, von noch größerer Bedeutung, da gleichmäßig verteilte Zonen eingerichtet werden müssen, um das Arzneimittelansprechen genauer zu analysieren.
Einschränkungen und zukünftige Forschung
Die Haupteinschränkung der vorgeschlagenen Methode ist die benutzerbasierte Slice-by-Slice-Ablaufverfolgung, die in Imaris durchgeführt wird, um das Aggregat innerhalb des OAT-Volume-Scans zu isolieren. Dies ist ein kritischer Schritt für genaue Ergebnisse, die etwas subjektiv sind und daher ein gewisses Maß an Variabilität zwischen den Benutzern vermitteln sollen. Um dies zu beheben, versuchen wir derzeit, einen Kantenerkennungsalgorithmus zu integrieren, der in Matlab (oder ähnlichem) durchgeführt wird, bevor der Scan in Imaris hochgeladen wird. Dieser Algorithmus sollte Probenkanten in progressiven B-Scan-Scheiben objektiv identifizieren, wonach die vorgeschlagenen Analysen an diesem vorisolierten Probenbereich durchgeführt werden können. Die Behebung dieser Einschränkung wird die benutzerbasierte Variabilität beseitigen und wird voraussichtlich zu einer breiteren Anwendbarkeit dieses ÜLG-basierten Tools führen.
Die Fähigkeit der OCT, lebende Zellen innerhalb von Aggregaten während der medikamentösen Behandlung genau abzubilden, hängt von der Art des Zelltods ab, auf der das Medikament wirkt. Die früheren Arbeiten zeigten quantitative Ungenauigkeiten in der Lebendzellzahl, die von OCT / Imaris als Reaktion auf Doxorubicin berichtet wurden, ein bekanntes Krebsmedikament, das Zellen über Nekrose und Apoptoseabtötet 10. Es wird angenommen, dass dies auf die übrig gebliebenen Zellmembranen während der Nekrose zurückzuführen ist, von denen erwartet wird, dass sie während der strukturellen Bildgebung als lebende Zellen erscheinen. Es ist bekannt, dass TZM Zellen hauptsächlich über Apoptose35 abtötet; Wenn also Zellen sterben, müssen sie in Stücke zerfallen, die klein genug sind, um von OCT nicht verfolgt / gezählt zu werden. Obwohl weitere Validierungstests mit einem apoptotischen Medikament erforderlich sind, zeigen unsere frühen Pilotexperimente die ausgezeichnete Übereinstimmung von OCT/Imaris mit dissoziierten Zellzahlen in MCTSs, die mit TZM betrogen wurden (unveröffentlichte Daten). Daher wird erwartet, dass die hier vorgestellten Lebendzellergebnisse genauer sind als nekroseinduzierende Medikamente. Diese Unterscheidung muss bei der Anwendung dieses Ansatzes für die Rentabilitätsprüfung in unter Drogen gesetzten Aggregaten berücksichtigt werden.
Es wird erwartet, dass die zukünftige Forschung in der zerstörungsfreien Bewertung von Tumoraggregaten das Verständnis dafür verbessern wird, wie sie sich entwickeln und sowohl auf externe Reize als auch auf die medikamentöse Behandlung reagieren. Die Entwicklung von Analysewerkzeugen, wie das hier vorgestellte, sollte den Modellnutzen erweitern und die Ergebnisgenauigkeit verbessern, insbesondere in wirkungsvollen Anwendungen wie Arzneimittelscreening und Abgabe- / Wirksamkeitsbewertung.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde von NIH R01 BRG CA207725 (MB/DTC) und NIH R01 CA233188 (MB) unterstützt. Wir danken AMC Pharmacy für das Trastuzumab, das für diese Experimente zur Verfügung gestellt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
Referenzen
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten