Method Article
薬物治療後の腫瘍凝集体内の局所細胞密度の非破壊的評価
要約
本プロトコルは、3D腫瘍凝集体内の迅速、非破壊的、かつラベルフリーの局所細胞密度および生存率測定のための画像ベースの技術を開発する。この知見は、細胞密度勾配を明らかにし、トラスツズマブで処理したHER2+凝集体では、凝集体の発生と主に末梢細胞死において、コア領域における細胞密度が外層よりも高いことを明らかにした。
要約
多細胞腫瘍スフェロイド(MCTS)モデルは、がんの進行に関する インビトロ 研究および創薬の有用性が高まっていることを実証している。これらの比較的単純な無血管構築物は、3D構造および病態生理学的勾配などの in vivo 腫瘍の重要な態様を模倣する。MCTSモデルは、スフェロイド発生中および薬物に対する応答における癌細胞の挙動に関する洞察を提供することができる。ただし、必要なサイズは、非破壊評価に使用されるツールを大幅に制限します。光コヒーレンス断層撮影構造イメージングとImaris 3D解析ソフトウェアは、MCTS内の局所細胞密度の迅速、非破壊、およびラベルフリー測定のために探求されています。このアプローチは、4日間の成熟期間にわたって、および臨床的に関連する抗HER2薬であるトラスツズマブによる5日間の延長治療を通してMCTSを評価するために利用される。簡単に説明すると、AU565 HER2+乳がんMCTSは、異なる形態の凝集体(それぞれ、より厚い、円盤状の2.5D凝集体または平らな2D凝集体)を探索するために、マトリゲル(基底膜マトリックス)の添加の有無にかかわらず、液体オーバーレイ を介して 作成された。外側領域、遷移領域、および内側コア内の細胞密度は、成熟したMCTSにおいて特徴付けられ、外層と比較してコア領域におけるより高い細胞密度を有する細胞密度勾配を明らかにした。マトリックスは、セル密度を再分配し、この勾配を強化し、外側ゾーン密度を減少させ、コア内のセル圧縮を増加させる。細胞密度を、薬物応答の潜在的な地域差を評価するために、漸進的に深い100μmゾーン内の薬物処理(0時間、24時間、5日)後に定量した。最終時点までに、ほとんどすべての細胞死は各凝集体の外側200μmに拘束されているように見えたが、凝集体内のより深い細胞はほとんど影響を受けていないように見え、おそらく薬物浸透の制限による薬物応答の局所的な違いを示した。現在のプロトコルは、高密度の細胞組織内の局所細胞密度を非破壊的に定量化し、それを縦方向に測定する独自の技術を提供します。
概要
研究者らは、腫瘍進行の重要な特徴のいくつかを研究するために、主にベンチトップ3D培養in vitroシステムに目を向けている。この研究の多くは、多細胞腫瘍スフェロイド(MCTS)およびより複雑なオルガノイド1,2の再出現によって導かれてきた。これらのモデルは水蒸気であるが、それらはインビボで起こる生理学的および病理学的プロセスを反復するための強力なツールを提供する3、4、5。特に、中規模モデル(直径300~500μm)は、3D構造、病態生理学的勾配、コア内の低酸素による転移性シグナル伝達などの主要な腫瘍特徴を模倣することができる。これらのモデルは、血管化されたin vivo腫瘍に見られる特徴的な同心円状の層、すなわち増殖性細胞の外層、老化/静止細胞の移行層、およびコア3,6,7,8,9において低酸素状態を経験している細胞を示すことが十分に文書化されている3,6,7,8,9 .これらのモデルから、これらの層内、開発中および薬物への応答における細胞挙動を特徴付けることによって、独自の洞察を得ることができます。しかし、インビトロモデルを非常に強力にする勾配を開発するために必要なMCTSサイズは、非破壊評価に使用されるツールを大幅に制限します。実際、MTCSの非破壊分析における最大の課題の1つは、細胞スケールの詳細を定量化することです。明視野顕微鏡および位相差顕微鏡は、3D MCTSの成長と発達を非破壊的に評価するために日常的に利用されています。しかし、これらのモダリティは2D投影に限定されており、これらのモデル10,11,12,13の重要な3D構造を視覚化する能力に欠けている。細胞毒性および細胞増殖に関する情報は、典型的には、蛍光画像化(すなわち、光シート顕微鏡、共焦点顕微鏡)またはエクスビボ免疫組織学的染色14、15、16を介して収集される。これらのアプローチは、組織構造、細胞密度、および細胞機能に関する貴重で高解像度の情報を提供しますが、多くの場合、縦方向の分析を妨げる光学的透明化、固定/染色、埋め込みなどのサンプル調製が必要です。
光コヒーレンス断層撮影(OCT)は、上記の課題のいくつかを克服する可能性を秘めた非破壊構造イメージングモダリティです。これは、セルラー解像度と十分に広い視野(最大10mm x 10mm)を誇り、多細胞集合体全体を視覚化することができます17、18、19。重要なことに、使用される光の目に見える性質のために、この技術は完全に非破壊的であり、ラベルフリーである17。また、サンプルをインキュベーターから直接採取し、OCT(スキャン時間〜5〜10分)で迅速にスキャンし、インキュベーターに戻すことができるため、サンプル調製を必要とせずにその場でサンプルを画像化することができ、縦方向の特性評価が可能になります。腫瘍スフェロイドの挙動を分析するためにOCTを使用しようとする多くの研究が最近出現した。最もエキサイティングなデモンストレーションの1つで、HuangらはOCTを使用して大型腫瘍スフェロイドモデル内の壊死コアを非破壊的に検出し、生細胞領域と死細胞領域には光減衰の識別可能な違いがあり、ラベルフリーの生存率モニタリングに利用できる可能性があると指摘しました20。同様に、Hariらは、試料21内の低酸素症の存在を研究するために、OCTで画像化したヒト結腸癌(HCT116)スフェロイドの屈折率(RI)測定を実施した。彼らの測定値は直接推論には十分ではなかったが、後に共焦点顕微鏡によって同定された壊死コアの部位(サイズではないが)と相関する場所でRIの低下を観察した。Abd El-SadekらはOCTを用いて、乳癌腫瘍モデルの局所組織生存率を可視化および定量化した22。彼らは、組織ダイナミクスを視覚化するための2つのOCTベースの方法を報告し、これらのメトリックの違いと顕微鏡検査で同定された生細胞/死細胞の領域との間に中程度の相関関係を示した。
OCTを用いた我々の出版された研究は、この先行文献に基づいて構築され、開発中のMCTS乳癌モデル内の3D形態および細胞数を測定するための定量的、非破壊的アプローチを確立した10,23。Imaris 3Dレンダリング画像解析ソフトウェアを使用して、OCTボリュームスキャン内で画像化された細胞サイズのオブジェクト(すなわち、スポット)の数をカウントし、凝集解離時に血球計数器を介して決定されたものと統計的に類似していたMCTSにおいて、細胞カウントを非破壊的に測定した。しかし、OCTの構造的性質上、壊死による細胞死後もなお存在する細胞膜は、誤って生細胞として数えられることがある。さらに、この特徴付けは、有望な成功を伴う薬物レジメンに付された個々の凝集体内の細胞生存率を非破壊的に追跡するために拡張された10。重要なことに、我々のOCT-Imarisアプローチから、解離時にこれらのサンプル内でベンチマークされたものと同様の細胞生存率が報告されたことに留意された。この非破壊的でラベルフリーの細胞アプローチにより、構築物/凝集体構造を犠牲にすることなく、3Dコンストラクトおよび高密度凝集体内で細胞を縦方向にカウントできます。
本研究は、OCT-Imarisの3D凝集体形態と細胞数の両方を測定する能力を活用することにより、高密度凝集体内の局所細胞密度を直接定量化する改善されたアプローチを報告している。この方法論の進歩は、MCTSモデルの特徴的な同心円層内の細胞の空間分布と増殖のより詳細な画像を提供する。このような局所密度測定は、単に凝集体全体の平均細胞密度を計算するのではなく、圧縮に関連するものなどの細胞密度勾配を明らかにすることができる。この局所的評価は、局所細胞密度の変化によって測定される局所的な薬物応答を評価するために、化学療法で処理された凝集体にも適用される。OCTと高度なイメージング解析方法のこの組み合わせは、細胞密度の低下を経験する領域に基づいて薬物浸透を探索するために使用することができる局所細胞生存率の定量化を提供する。これは、高密度の細胞組織内の薬物に応答して局所的な細胞密度および生存率を非破壊的に定量化し、それを縦方向に測定する最初の報告である。MCTS全体にわたる3次元細胞密度および空間分布のこのような特性評価は、がん治療における薬物送達を最適化し、がんモデルの進行の理解を改善するのに役立つ可能性がある。
プロトコル
AU565(HER2+)およびMDA-MB-231乳癌細胞株を本研究に使用した( 材料表を参照のこと)。
1. 腫瘍凝集体の調製
- ロズウェルパーク記念研究所(RPMI)1640基礎培地(+)に10%(v/v)のウシ胎児血清および1%ペニシリン/ストレプトマイシンを添加したL-グルタミン(+)を用いて、AU565(HER2+)乳癌細胞増殖培地を調製する( 材料表参照)。
- 10%(v/v)ウシ胎児血清(FBS)、100U/mLのペニシリン/ストレプトマイシン、および2mMのL-グルタミンを添加したダルベッコの改変イーグル培地(DMEM)を用いて、MDA-MB-231トリプルネガティブ乳癌細胞増殖培地を調製する( 材料表を参照)。
- 両方の細胞株の70%〜90%コンフルエント細胞培養物(〜3〜4日間の調製)を標準条件(37°C、5%CO2、95%相対湿度)で調製する。標準的なトリプシン処理方法に従って、細胞単層を培養フラスコから剥離する。
注:細胞のトリプシンへの過剰暴露を防ぎ、生存率に影響を与えます。- AU565細胞の場合、ピペットを使用してフラスコから細胞培地を吸引し(または、利用可能な場合は、チューブ を介して オートクレーブ処理されたガラスピペットチップに接続された真空ポンプを使用して)、2mLのトリプシン-EDTAと交換する。フラスコを室温で3分間放置した後、インキュベーターにさらに4分間移動させる。その後、フラスコに6mLの増殖培地を加え、トリプシンを中和する。
- MDA-MB-231細胞の場合、工程1.3.1で行ったのと同じ方法でフラスコから細胞培地を吸引し、1.5 mLのトリプシン-EDTAに置換した。7分間のインキュベーション後、8.5 mLの成長培地をフラスコに加え、トリプシンを中和する。
- 10 μLの細胞懸濁液を血球計数器に加え、懸濁液24中の細胞数を決定した。2.5 × 105cells/ mLの所望の濃度で培地に細胞を再懸濁する。
- 50 μL の細胞懸濁液を、丸底非付着性の 96 ウェルプレートの各ウェルに分注します。マトリゲルなしで調製した懸濁液(基底膜マトリックス、 材料表を参照)の場合、50μLのプレーン増殖培地を各ウェルに加える。
- 基底膜マトリックスで調製した懸濁液の場合、マトリックスバイアルを-20°C保存から取り出し、冷蔵庫に入れて一晩解凍する。成長培地を入れた容器を用意し、10分間冷蔵して冷やします。
- 凍結ピペットチップを使用して、この溶液の最終濃度が5%になるように冷却媒体にマトリックスを加える。この培地を各ウェルに50 μL加え、これらのウェル中のマトリックスの最終濃度が2.5%3になるようにします。
注:以前の研究では、これらの細胞株10、25について凝集体形態を評価し、MDA-MB-231凝集体は膜マトリックスを添加してスフェロイドを形成し、マトリックスを含まないMDA-MB-231培養物およびAU565+/-マトリックスはすべて円盤状の凝集体を形成することを見出した。0(平面)~1.0(真球)のスケールで>0.8の定量化された真球度を使用して、十分に球状の凝集体を同定し、したがって、in vivo様挙動に必要な表面対体積比を有することが期待された26,27。
- 播種直後にプレートを室温で123 x g で10分間遠心分離し、各ウェルの底部に細胞ペレットを確実に集めた。
注: この手順は、シード後できるだけ早く実行する必要があります。著者らは、これらのステップの間にあまりにも多くの時間を費やすと、細胞が各ウェルの底部および側面を横切って沈降し、ウェルの底部で収集および凝集する能力が阻害されることを観察した。 - プレートを4日間インキュベートし、その時点で細胞凝集塊が成熟したと考えられる。
注:基底膜マトリックスで調製したAU565凝集体は、薬物応答試験のために追加の5日間の培養期間(合計9日間、4日目の培地交換)を必要とする。
2. AU565細胞凝集体へのトラスツズマブ(TZM)の投与
- AU565成長培地に500μg/mLのTZM溶液( 材料表を参照)を調製する。4日目に、各ウェル内の最終濃度が50μg/mLになるように、この溶液を各ウェルに10μL加える。
- 培養物は、TZMの添加後さらに5日間凝集し、重要な時点で評価する。
注:本研究では、薬物の分析に0時間(投薬直前)、24時間、および120時間後の時点を使用した。
3. 光コヒーレンス断層撮影イメージング
注:本明細書のサンプルは、成熟の各日(1〜4)の間、および選択された薬物凝集体について5日目(薬物添加後24時間)および9日目(薬物添加後120時間)に再び光コヒーレンス断層撮影(OCT)で画像化された。OCTイメージング用の市販のスペクトルドメイン光コヒーレンス断層撮影(SDOCT、 材料表を参照)システムが現在の研究に使用された。このアプローチはほぼすべてのOCTシステムに適しており、従う手順は異なるシステム間で一般的に似ていますが、以下の詳細な手順のいくつかは現在の機器に固有のものです。
- 構造イメージングにOCTシステムを利用する。高解像度の画像収集のために、A-スキャンレートを5.5kHzに設定します。液体媒体中のサンプルの屈折率を 1.33 に設定します。ボクセルサイズを 1.10 x 1.10 x 2.58 μm3 に設定します。
- 画面右側の [イメージ パラメーター] ウィンドウで、サンプルがこの関心領域内に収まるように、X、Y、Z の値 (mm 単位) を入力して、視野 (FOV) を設定します。
注:これらの研究のFOVは通常、1.5 x 1.5 x 0.5 mm3に設定されました。「角度」入力を0度から90度の間で交互に行い、目視確認を行うことで、サンプルがこの領域内に収まることを確認します。 - [3D 取得モード]をクリックし、[ 記録 ]をクリックしてサンプルの3Dボリュームスキャンを収集します。
4. 画像解析
- OCTファイルをソフトウェア形式にエクスポートします(Imaris、 材料表を参照)。
- ソフトウェア開発キットでOCTファイルを開きます。 [エクスポート]をクリックし、ファイルタイプを.jpgに設定し、イメージを空のフォルダにエクスポートします。
- 画像処理ソフトウェア(FIJI、 資料表を参照)を開き、エクスポートされたJPEGが保存されているフォルダから画像シーケンスをインポートします。ソフトウェアを使用してイメージシーケンスをステッチし、このファイルを TIFF イメージとして保存します。
- 以下の手順に従ってボリュームの再構築を作成します。
- Imaris を開き、アリーナ内の変換された TIFF ファイルに移動します。 [>イメージのプロパティの編集] に移動し、OCTイメージのボクセルサイズ(μm単位)を対応するXYZボックスに入力します。次に、[ OK]をクリックします。
メモ: 画面の左側にあるサンプルオブジェクトツリーで、「 ボリューム 」タブの選択を解除して、ソフトウェアの遅延を防止します。 - オブジェクトツリーの上にある 「新規サーフェスを追加」 をクリックします。ツリーの下のメニューで、[ 自動作成をスキップ ]をクリックして手動で編集します。 [表示調整] ウィンドウ内で、赤と黒の矢印を手動でスライドさせて、サンプルと背景のコントラストを高め、サンプルの視覚化を改善します。
- 「スライス位置」をサンプルの一方の端、つまりサンプル信号が最初に表示されるスライスに調整します。エスケープキーを使用してマウスをナビゲーションモードから選択モードに変更し、[ 描画]をクリックします。信号を表示している領域の輪郭を手動でトレースします。
- 次の位置を入力ボックスに入力して、スライス位置を進めます。この次の位置は、前の位置よりもサンプルに ≤100 スライス深くなければなりません。信号を表示している領域を手動でトレースします。
- サンプルの反対側の端に達するまで、サンプルの厚さをステップ 4.2.4 を繰り返します。次に、左側のメニューの [サーフェスの作成 ]をクリックして、これらのスライスをステッチし、ボリュームの再構築を完了します。
- [編集]をクリックし、[マスクの選択]をクリックします。これにより、「表示調整」ウィンドウに、分離されたサンプルのみを含む新しいチャンネルが作成されます。サンプルの形態学的特性は、統計量>詳細タブで確認できるようになりました。
注:このアプローチは、この現在の研究で報告された真球度と体積を決定するために従った。
- Imaris を開き、アリーナ内の変換された TIFF ファイルに移動します。 [>イメージのプロパティの編集] に移動し、OCTイメージのボクセルサイズ(μm単位)を対応するXYZボックスに入力します。次に、[ OK]をクリックします。
- 以下の手順に従って、サンプルの総細胞密度を取得します。
- オブジェクトツリーの上で、「 新規スポットを追加」を選択します。 アルゴリズム設定 メニューで、すべてのボックスの選択を解除します。 青い矢印 をクリックして、ソースチャンネル画面に移動します。
- 表示されるドロップダウンメニューから、手順 5.2.8 で作成したマスクされたチャンネル(通常はチャンネル 2)を選択します。サンプルの平均セル径をXY径ボックスに入力します。 「バックグラウンド減算」 がチェックされていることを確認します。
メモ: AU565 および MDA-MB-231 セルでのこの作業では、直径を 10 μm に設定しました。この選択は、セル サイズ (「ディスカッション」セクションで説明) に基づきます。
- 表示されるドロップダウンメニューから、手順 5.2.8 で作成したマスクされたチャンネル(通常はチャンネル 2)を選択します。サンプルの平均セル径をXY径ボックスに入力します。 「バックグラウンド減算」 がチェックされていることを確認します。
- 青い矢印をクリックして、[スポットの分類]画面に移動します。メニューの下部にあるグラフで、黄色のしきい値の左端をクリックしてグラフの左端にドラッグします。これにより、すべてのオブジェクトが黄色の網掛けされたしきい値に含まれます。次に、緑色の矢印をクリックしてスポットの作成を完了します。
- 識別されたオブジェクトの数(つまり、サンプルセル数)を取得するには、[ 統計]>[全体>スポットの総数]をクリックします。
- 平均凝集体細胞密度を求めるには、凝集体の細胞数(ステップ 4.3.3 で測定)を凝集体体積 (ステップ 4.2.6 で測定) で割ります。
- オブジェクトツリーの上で、「 新規スポットを追加」を選択します。 アルゴリズム設定 メニューで、すべてのボックスの選択を解除します。 青い矢印 をクリックして、ソースチャンネル画面に移動します。
- 球状集合体の同心円状層における地域密度を評価する(図1A).
- 形態学的および細胞密度分析に続いて、局所密度を評価する。手順 4.2.5 で作成したサーフェスをクリックし、[ サーフェスのスタイル/品質] タブに移動します。選択範囲を 中心点 に変更し、ピクセル幅を ≤20 に変更して、見やすくします。[統計] > [詳細な>位置] に移動し、中心スポットの位置を記録します。
- オブジェクトツリーの上にあるメニューから「新規参照フレームを追加」を選択します。メニューの [XY] の横にある [表示] ボックスと [修正] ボックスをオンにします。参照フレームアイコンの中心をクリックしてドラッグし、中央のスポットと一直線に揃えます。「XY 表示」ボックスと「修正」ボックスの選択を解除し、「XZ」用に選択します。
- もう一度、参照フレームアイコンの中心をクリックしてドラッグし、中央のスポットと一直線に揃えます。最後に、YZ 平面に対してこれを繰り返し、参照フレームが中心スポットと完全に揃うまで、これら 3 つの固定平面を交互に繰り返します。オブジェクトツリーの参照フレームをダブルクリックし、 Center または類似の名前を変更 します。
- ステップ4.3で作成したスポットをクリックし、 統計>詳細>位置参照フレームに移動します。 「X参照フレームの位置」 をクリックして、最高値から最低値にソートします。最高値を記録する - これはサンプルの最も遠いエッジ、すなわちサンプル半径を示します。
メモ: ここで使用したサンプルは XY 平面内で円形であるため、X 軸または Y 軸に沿って計算を実行し、同様の結果を得ることができます。X-Y 対称性を示さないサンプル(非対称、楕円体、不規則な形状など)については、これらの解析を複数の軸に沿って実行することをお勧めします。 - [統計] に移動します。メニューの右下隅にある [すべての統計をファイルにエクスポート ]をクリックし、データをスプレッドシートに保存します。
- 手動計算を実行して、X 軸に沿って同心円状のレイヤーを識別します。
注:この研究で使用したサンプルは直径約500μmでした。したがって、厚さ200μmの外側の同心円ゾーンが2つと内側の厚さ100μmの中央ゾーンが1つあります。拡散挙動はこの距離7、28、29、30にわたって変化すると予想されるため、厚さ200μmのゾーンを維持することが推奨される。この推論に従って、大きなサンプルにはより多くの同心円ゾーンを使用し、小さなサンプルにはその逆を使用することも推奨されます。 - ステップ4.4.3で見つけた外層半径から200μmを引いて、200μmの外層領域を設定します。したがって、外側領域は、X半径 とX外側、内側エッジ との間のX位置を有するスポットを包含する(図1A、オレンジ色の領域)。
- Xアウターエッジ、インナーエッジから200μmを引いて遷移領域を設定します。トランジション領域は、Xアウター、インナーエッジ、およびXトランジショナル、インナーエッジの間のX位置を持つスポットを包含します(図1A、ピンク色の領域)。
- サンプル中心とX遷移、内縁 との間の残りのスポットを包含する中心コア領域を設定する(図1A、青色領域)。
- 手順 4.4.4 で作成した保存済みのスプレッドシートファイルを開きます。「原点参照フレームからの距離」タブに移動します。
- 関数の COUNTIF (列 x, "< X遷移,内側エッジ") を使用してコア領域のスポット数を計算します。列x は「原点参照フレームからの距離」列です。結果の値は、この領域のセル番号です。この値を領域の体積で除算し、細胞密度を求める。
- 同様の方法で、'COUNTIF (列x, "< X 外側,内側-縁") - COUNTIF(列x, "> Xtransitional,inner-edge") を使用して、遷移領域内のセル数を計算します。
- 外側領域のセル数は、'COUNTIF (列x,"> X遷移、内側エッジ") を使用して計算します。
- 非球形サンプル中の局所細胞密度を「地域プラグ」 を介して 評価します(図1B)。
注: 同心円層を持たない非球形サンプルの場合、「リージョナルプラグ」法は、集合体全体のさまざまな半径方向の深さでローカルセル密度をサンプリングするために開発されています。- 手順4.4.1~4.4.3を繰り返して中央の参照フレーム(図1B、中央の黄色の円)を設定し、サンプル半径の合計を求めます。
- 手動計算を実行して、遷移領域と外部領域内の参照フレームの配置を特定し、これらの位置でサンプル内のセル密度を評価できるようにします。
- 外側の位置を計算するには、ステップ 4.5.1 のサンプル半径値から 50 μm を減算し、この値を X 位置として使用します。
メモ: 手順 4.5.1 で記録したのと同じ Y 位置と Z 位置の値を、特定のサンプル内のすべてのプラグに対して使用して、サンプルの X 軸に沿ったセル密度を測定します(図 1B、左端の黄色い円)。 - オブジェクトツリーの上にある「 新規スポットの追加」 をクリックし、「 自動作成をスキップ」、「手動で編集」をクリックします。ポインタを「選択」モードで、Shiftキーを押しながらクリックして画面上にスポットを配置します。左側のメニューで、上記で計算したXYZポジション値を入力します。XY 直径と Z 直径を ≤20 に調整して、視認性を高めます。
- 手順 4.4.2 を繰り返して、このスポット位置に参照フレームを追加します。オブジェクトツリーの外側または類似のこの参照フレームの名前を変更します。
- 遷移(中点)位置を計算するには、X中心 位置値と X外側 位置値の平均を求めます。この値をトランジション参照フレームの X 位置として使用します。上記のように、ステップ4.5.1で記録した同じY値とZ値を所定のサンプル内のすべてのプラグに使用して、サンプルのX軸に沿った細胞密度を測定します(図1B、中央の黄色の円)。
- 手順 4.4.2 を繰り返して、中央の参照フレームをこの位置に配置し、作成したら「トランジショナル」または同様の名前を変更します。
- 外側の位置を計算するには、ステップ 4.5.1 のサンプル半径値から 50 μm を減算し、この値を X 位置として使用します。
- ステップ4.3で作成したスポットをクリックし、 統計に移動します。メニューの右下隅にある [すべての統計をファイルにエクスポート ]をクリックし、データをスプレッドシートに保存します。
- スプレッドシートを開きます。「原点参照フレームからの距離」タブに移動します。各オブジェクトの参照フレームまでの距離が列 A に示され、各オブジェクトの参照フレームのグループ化が列 G に示されます。'MOD' 関数を使用して、対応する参照フレームに各距離を数値で割り当てます。0 は中心フレーム、1 は遷移フレーム、2 は外側です。
- この列の値をフィルター処理して、各参照フレームの距離を操作します。各参照フレームについて、関数 'COUNTIF (列 x, "≤50") を使用してフレームから 50 マイクロメートル以内のオブジェクト数を計算します。列x は各グループの「原点参照フレームからの距離」列です。結果の値は、その地域のプラグ内のセルの数に対応します。この値を100μmプラグの体積で除算して、セル密度を求めます。
- 空間的に洗練されたリージョナルプラグ法を実行します(図1C)。
注:このアプローチは、薬物適用に応答して局所細胞生存率を評価するために使用された。参照フレームを増やすと、モデルの厚さ全体で計算できるセル密度の分解能が向上します。- 手順4.4.1~4.4.3を繰り返して中央参照フレーム(図1C、中央の黄色の円)を設定し、サンプル半径を取得します。
- 手動計算を実行して、追加の対象場所を決定します。これを行うには、Xの中心 値に 100 μm を加算し、中心点の Y 値と Z 値を使用して、中心軸に沿った最初の位置を定義します。手順4.4.2のようにこの位置に参照フレームを追加します(図1C、中央の円に隣接する黄色の円)。
メモ: より高い分解能の密度トラッキングを求める場合は、このステップで追加する μm を少なくします。 - ステップ4.6.2を繰り返し、各連続したX位置に100μm(または所望のμm数)を加えて、サンプルの厚さに沿って等間隔のプラグの軸を確立します。最後の参照フレームをサンプルの外側の半径から≤50μm離して配置します(図1C、黄色の円)。
- 手順 4.5.3 ~ 4.5.5 を繰り返して、直径 100 μm の各プラグ内のセル数を取得します。これらの値を対応する各プラグの体積で除算して、局所的な細胞密度を求めます。
- 薬物試験の各時点で収集されたOCTデータについて、このセクションのすべての手順を繰り返します。治療時間経過を通じて各位置の細胞数を比較すると、細胞密度が低下している場所(すなわち、細胞死を経験している領域)が明らかになり、その結果、薬物がどの程度深く浸透しているか(すなわち、細胞密度の低下を見る層 と細胞密度レベルの増加を維持または表示する層)が明らかになるはずである。
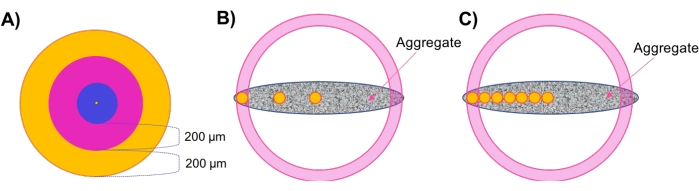
図1:概略図 (A)球状凝集体の局所細胞密度を評価するための同心円層(シェル)アプローチ。(B)地域プラグ法は、非球状凝集体の局所細胞密度を評価するために開発され、小さな(直径100μmの)球状プラグ(黄色で表示)が各ゾーン/厚さの密度指標として使用されます。(C)空間的に精製された地域プラグ法が薬物浸透研究に採用されている。 この図の拡大版を表示するには、ここをクリックしてください。
結果
以前の出版物では、OCT10を使用して細胞凝集体内の全球細胞密度を非破壊的に測定するための方法が確立された。本明細書では、この技術は、発達中の細胞凝集塊の局所的な細胞密度を評価するために拡張される。図1は、この拡張の概略図を示しており、図1B、Cの黄色の円で示された小さな(直径100μmの)球形プラグを代わりに見ることによって、回転楕円体の同心円層またはより局所的に細胞密度を評価できます。MDA-MB-231腫瘍スフェロイドは、凝集体内に中心点を設定し、スフェロイドの連続した同心円層内の物体/細胞の数を数えることによって最初に評価された。これらの結果を図 2 に示します。スチューデントのt検定は、回転楕円体コアにおいて、遷移層(p = 4.3e-4)および外層(p = 4.0e-6)よりも有意に高い細胞密度を明らかにした。この結果は、4日後の回転楕円体コアの圧密化を示す。

図2:球状MDA-MB-231集合体の同心円層アプローチによって計算された地域密度の違い。この図は、凝集体コアに最も密集した細胞(n = 3)と、コアからの距離とともに減少する局所的な細胞密度との放射状細胞密度勾配を示しています。平均合計セル数は青い線で示されます。差し込み画像のスケールバーは100μmです。データは平均として示され±SDです(*= p < 0.05、***= p < 0.001)。この図の拡大版を表示するには、ここをクリックしてください。
しかし、この同心円層技術の限界は、球状の集合体に対してのみ使用できることである。したがって、細胞計数アプローチは、仮想生検に似た集合体を介して連続した位置の小さなゾーンをサンプリングするRegional Plug法を確立するために適応された。これらのプラグは、特定の深さでの局所セル密度の測定を提供します。この手法は、同じMDA-MB-231回転楕円体に対して解析を実行することによって、同心円層アプローチに対して検証されました(図3)。結果は、これらの球状集合体について、地域プラグと同心円層アプローチの間に良好な一致を示した。スチューデントのt検定では、外側層と遷移層を測定するためのアプローチ(それぞれp = 0.243と0.484)の間に統計的な違いはなく、集約コアでの密度を計算する際のわずかな有意差(p = 0.017)が明らかになりました。
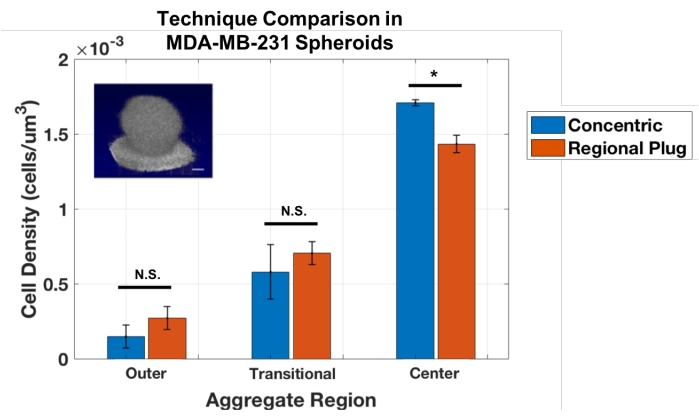
図3:同心円ゾーンおよび地域プラグアプローチは、球状MDA-MB-231凝集体(n = 3)の細胞密度を定量化するための同様の結果を提供する。 データは平均±として示されたSDである(*= p <0.05)。 この図の拡大版を表示するには、ここをクリックしてください。
次に、この手法を適用して、成熟4日目に球状および非球状の腫瘍凝集体の両方を評価し(図4)、細胞型に関係なく、試験したすべての形態についてコア圧密化に向けた同様の傾向を観察した。この傾向は、凝集を促進することが知られているが、その外因性因子および組成がほとんど特徴付けられていない添加剤であるマトリゲル(基底膜マトリックス)を用いて調製されたサンプルにおいて最も顕著であった31、32、33。興味深いことに、マトリックスの添加は、体積または細胞数に影響を及ぼさないようであり、したがって、細胞増殖に無視できる程度の影響しか及ぼさないようである。むしろ、マトリックス添加は細胞密度を再分配し、コアの大幅な圧縮を促進し、外層の細胞密度を低下させるように見える。これらの結果はまた、AU565細胞がMDA-MB-231細胞よりもマトリックス媒介性凝集効果に対して感受性が低いように見えることも示している。この新知見は、マトリックスがさまざまな乳がん細胞株における細胞凝集を可能にする物理的メカニズムに関する貴重な手掛かりとなる。重要なのは、地域プラグ アプローチは、球面または非球面の集合体ジオメトリを表示する MCTS に適している必要があることです。

図4:マトリックス添加は、より多くの凝集を促進し、癌細胞株における細胞密度を再分配する。MDA-MB-231(A,B)およびAU565(C,D)細胞株の両方について、マトリックス添加は、全体的な細胞数を著しく変化させることなく、外側ゾーンの密度を低下させ、中心(n = 3)における圧密を増加させる。平均合計セル数は青い線で示されます。インセットスケールバー = 100 μm。平均として示されたデータはSD±(*= p < 0.05、**= p < 0.01、***= p < 0.001)。 この図の拡大版を表示するには、ここをクリックしてください。
次に、この局所プラグアプローチを用いて、TZM処理腫瘍凝集体における細胞死を非破壊的に追跡した。膜マトリックスで調製したAU565 MCTSを、発生4日目にTZMで処理し、0時間(プレドラッグ)、24時間、および120時間(5日)の重要なOCTイメージングタイムポイントで、9日目まで培養した。空間的に定義された地域プラグ法は、図1Cの黄色い円で示すように、各骨材の厚さ全体にわたって100μmごとにプラグをセットして、各時点で適用した。センタープラグのサイズは一定に保たれ、外側プラグは直径を変動させ、凝集体サイズの変化に対応しました。細胞密度のわずかな変動は、各凝集体の内部500μm内で経時的に観察され、最小限の細胞死を示した(図5)。実際、ほとんどの細胞死は、各凝集体の外側200μm、特に最も外側の100μmで発生し、分析されたすべての凝集体の120時間時点までに完全に消失した。主にMCTSの外層における指標薬物応答としての細胞死の可視化は、分子量145kDa34の臨床的に関連する抗体医薬であるTZMの薬物浸透の問題と一致している。実際、この薬剤はこれらの高密度細胞モデルを介した受動拡散に依存しており、モデルに200μm以上深く浸透する能力に挑戦することが期待されています。
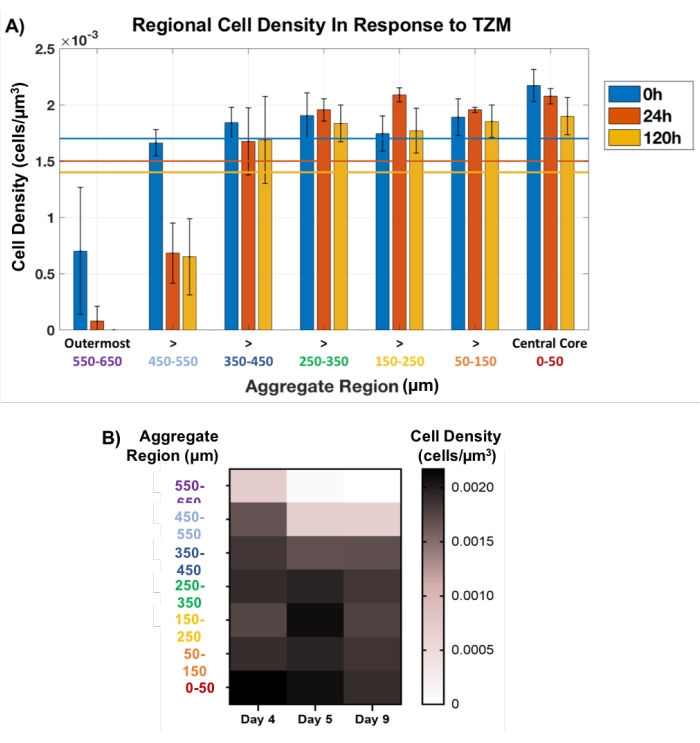
図5:薬物に応答した細胞生存率を、凝集体厚さ全体にわたって測定する。 内核のプラグは直径100μmで一定に保たれ、外側のゾーンのプラグは凝集体サイズの変化とともに変動させた。(A)TZM添加に応答した局所細胞密度は、細胞死が外側200μm、特に外側100μmに大きく制約され、治療の120時間後に完全に消失したことを明らかにした。凝集体の厚さ500μmの内側では、細胞数にほとんど変化が見られなかった(n=3)。平均合計セル数は、各タイムポイントに対応する色付きの線で示されます。(B)ヒートマッププロットは、凝集体厚さの関数として薬物に応答した平均細胞密度の変化を表す平均±SDとして示される。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
意味
多細胞腫瘍スフェロイド(MCTS)は、腫瘍の進行および薬物スクリーニングを研究するための強力な3D in vitroモデルである1,2,3。これらの比較的単純な集合体の有用性を前進させることは、腫瘍モデルの進行および治療応答の両方に影響を与えることが知られている形態および細胞密度などのそれらの主要な特徴の特性評価に大きく依存する。しかし、それらの必要なサイズは、特に非破壊分析において、これらの特性を評価する際に課題をもたらします。提示された方法は、高密度3D凝集モデルの離散領域内の細胞密度および生存率の縦方向およびラベルフリー定量化のための新しいツールを提供する。同じ集合体は、複数の開発日にわたって光コヒーレンス断層撮影(OCT)で再画像化することができます。これらの体積スキャンは、MCTSの成熟中に細胞密度が局所的にどのように進化するかを特徴付けるために分析することができる。これらの同じ原理は、薬物投与凝集体の分析にも適用され、これは、所与の薬物レジメン全体を通して縦方向に画像化して、細胞密度が低下している場所、すなわち、薬物が細胞を積極的に殺している可能性がある場所を決定することができる。このアプローチは、従来、固定、染色および/または切片化を必要とする同様の細胞スケール情報を得るための以前の方法よりも大幅に改善され、したがって縦断的分析を排除する。実際、このツールは、同じサンプルを連続して分析できるため、特定の研究に必要なサンプル数を劇的に減らす可能性があります。これはまた、年齢が一致した端末サンプルからの相関データに頼るのではなく、特定の刺激に応答する単一の集計内で開発を追跡できるため、各時点で付加価値をもたらすことも期待されます。本明細書で実証されたこのMCTSアプリケーションを超えて、このOCT-Imaris法は、他の細胞凝集体、胚様体、より複雑なオルガノイド、または厚さ数ミリメートルまでの組織サンプルを研究することができる。このプロトコルは、凝集体発生中の細胞圧縮および高密度凝集体モデル内の薬物応答の理解を向上させる。
変更
提示されたプロトコルは、MDA-MB-231およびAU565 MCTSSモデルの解析用に最適化された。他の細胞株を用いて作製されたモデルも適用可能である。しかし、平均細胞サイズおよび凝集形態の変化のために、いくつかのプロトコル最適化が必要な場合がある。MDA-MB-231およびAU565細胞を2Dで播種し、顕微鏡 観察によって 平均細胞サイズを得た別の研究を実施した。この直径は、イマリスの「スポット」関数内のXY直径として利用され、このおおよそのサイズのオブジェクトがカウントされました。この値を変更すると、サンプル10 内にあるオブジェクトの数が変更され、この入力がセル サイズに密接に一致する場合に、より正確な結果が期待されます。したがって、適切なXY直径は、使用される細胞型の平均細胞サイズによって知らされなければならない。
重要な手順とトラブルシューティング
OCTイメージング中の重要なステップの1つは、スキャン解像度の選択です。ユーザーが設定するピクセル サイズは、使用されるセル タイプの平均サイズを構成するために複数のピクセルが必要になるように、十分に小さくする必要があります。これにより、OCTのセルの分解能が向上し、確率的ピクセルノイズがセルカウントに悪影響を及ぼす可能性が低減されるため、イマリス内の「スポット」分析の精度が向上します。
イマリス参照フレーム内でのサンプルの単離は、細胞密度の出力値に大きく影響します。ユーザーがこのステップを実行すると、すべてのサンプル分析に一貫して適用する必要がある主観性とバイアスのレベルが伴います。Imaris分析を開始するためにボリュームスキャン内でサンプルを分離する場合は、凝集アウトラインを正確にトレースし、アーチファクト(基板または媒体の高さからの反射)の混入を避けるように注意する必要があります。
地域プラグ解析中の参照フレームの適切な配置も重要なステップです。はじめに述べたように、モデル開発中に分析すべき3つの重要なゾーンは、増殖性外側領域、老化/静止細胞からなる遷移領域、および低酸素コアである。各レイヤーの中央に参照フレームを配置すると、その領域内のセル密度の最も正確な推定が得られることが期待されます。この参照フレームの配置は、薬物応答をより正確に分析するために等間隔のゾーンを確立しなければならないため、薬物研究のために本明細書で使用される詳細な地域プラグ分析にとってさらに重要である。
限界と今後の研究
提案された方法の主な制限は、OCTボリュームスキャン内で集合体を分離するためにImaris内で実行されるユーザーベースのスライスごとのトレースです。これは正確な結果を得るための重要なステップであり、やや主観的であるため、ユーザー間のある程度の変動性を付与することが期待されます。これに対処するために、私たちは現在、スキャンをImarisにアップロードする前に、Matlab(または同様のもの)内で実行されるエッジ検出アルゴリズムを組み込もうとしています。このアルゴリズムは、プログレッシブBスキャンスライス内のサンプルエッジを客観的に識別し、その後、提案された分析をこの事前に単離されたサンプル領域に対して実行することができます。この制限に対処することで、ユーザーベースの変動性が取り除かれ、このOCTベースのツールの適用範囲が広がることが期待されます。
薬物治療中に凝集体内の生細胞を正確に画像化するOCTの能力は、薬物が作用する細胞死の様式に依存する。以前の研究は、壊死およびアポトーシス を介して 細胞を殺すよく知られている抗癌剤であるドキソルビシンに応答してOCT/Imarisから報告された生細胞数の定量的不正確さを明らかにした10。これは、壊死時に細胞膜が残り、構造イメージング中に生細胞として現れると予想されるためであると仮定されている。TZMは、主にアポトーシス を介して 細胞を殺すことが知られている35;したがって、細胞が死ぬと、OCTによって追跡/カウントされないほど十分に小さい断片に分解されなければなりません。アポトーシス薬によるさらなる検証試験が必要ですが、私たちの初期のパイロット実験は、TZMで薬を投与したMCTSの解離細胞数に対するOCT/Imarisの優れた合意を示しています(未発表データ)。したがって、本明細書に提示される生細胞結果は、壊死誘導薬よりも正確であると予想される。この区別は、このアプローチを薬物凝集体における生存率試験に適用する際に留意しなければならない。
腫瘍凝集体の非破壊的評価における将来の研究は、それらが外部刺激と薬物治療の両方にどのように発達し、応答するかの理解を改善することが期待される。ここに提示されているような分析ツールの開発は、特に薬物スクリーニングや送達/有効性評価などの影響力のあるアプリケーションにおいて、モデルの有用性を拡大し、結果の精度を向上させる必要があります。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、NIH R01 BRG CA207725 (MB/DTC) および NIH R01 CA233188 (MB) によって支持された。これらの実験に提供されたトラスツズマブについて、AMC薬局に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
参考文献
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved