Method Article
Evaluación no destructiva de la densidad celular regional dentro de los agregados tumorales después del tratamiento farmacológico
En este artículo
Resumen
El presente protocolo desarrolla una técnica basada en imágenes para la medición rápida, no destructiva y libre de etiquetas de la densidad celular regional y la viabilidad dentro de agregados tumorales 3D. Los hallazgos revelaron un gradiente de densidad celular, con densidades celulares más altas en las regiones centrales que en las capas externas en los agregados en desarrollo y predominantemente muerte celular periférica en agregados HER2+ tratados con Trastuzumab.
Resumen
Los modelos de esferoides tumorales multicelulares (MCTS) han demostrado una utilidad cada vez mayor para el estudio in vitro de la progresión del cáncer y el descubrimiento de fármacos. Estas construcciones avasculares relativamente simples imitan aspectos clave de los tumores in vivo , como la estructura 3D y los gradientes fisiopatológicos. Los modelos MCTS pueden proporcionar información sobre el comportamiento de las células cancerosas durante el desarrollo de esferoides y en respuesta a los medicamentos; sin embargo, su tamaño requerido limita drásticamente las herramientas utilizadas para la evaluación no destructiva. Se exploran imágenes estructurales de tomografía de coherencia óptica y software de análisis 3D Imaris para la medición rápida, no destructiva y sin etiquetas de la densidad celular regional dentro de los MCTS. Este enfoque se utiliza para evaluar los MCTS durante un período de maduración de 4 días y durante un tratamiento prolongado de 5 días con Trastuzumab, un fármaco anti-HER2 clínicamente relevante. Brevemente, los MCTS de cáncer de mama AU565 HER2+ se crearon a través de una superposición líquida con o sin la adición de Matrigel (una matriz de membrana basal) para explorar agregados de diferentes morfologías (agregados 2.5D más gruesos, similares a discos o agregados 2D planos, respectivamente). La densidad celular dentro de la región externa, la región de transición y el núcleo interno se caracterizó en los MCTS maduros, revelando un gradiente de densidad celular con densidades celulares más altas en las regiones centrales en comparación con las capas externas. La adición de la matriz redistribuyó la densidad celular y mejoró este gradiente, disminuyendo la densidad de la zona externa y aumentando la compactación celular en los núcleos. La densidad celular se cuantificó después del tratamiento farmacológico (0 h, 24 h, 5 días) dentro de zonas progresivamente más profundas de 100 μm para evaluar las posibles diferencias regionales en la respuesta al fármaco. En el punto de tiempo final, casi toda la muerte celular parecía estar limitada a los 200 μm externos de cada agregado, mientras que las células más profundas en el agregado parecían en gran medida no afectadas, lo que ilustra las diferencias regionales en la respuesta al fármaco, posiblemente debido a limitaciones en la penetración del fármaco. El protocolo actual proporciona una técnica única para cuantificar de forma no destructiva la densidad celular regional dentro de tejidos celulares densos y medirla longitudinalmente.
Introducción
Los investigadores han recurrido en gran medida a los sistemas in vitro de cultivo 3D de sobremesa para estudiar algunas de las características clave de la progresión tumoral. Gran parte de esta investigación ha sido liderada por la reaparición de esferoides tumorales multicelulares (MCTS) y organoides más complejos 1,2. Aunque estos modelos son avasculares, proporcionan una poderosa herramienta para recapitular los procesos fisiológicos y patológicos que ocurren in vivo 3,4,5. En particular, los modelos de tamaño mediano (300-500 μm de diámetro) pueden imitar características clave del tumor, como la estructura 3D, los gradientes fisiopatológicos y la señalización metastásica debido a la hipoxia dentro del núcleo. Está bien documentado que estos modelos muestran las capas concéntricas características observadas en tumores vascularizados in vivo, a saber, una capa externa de células proliferativas, una capa de transición de células senescentes / quiescentes y células que experimentan hipoxia en el núcleo 3,6,7,8,9 . Se puede obtener una visión única de estos modelos al caracterizar el comportamiento celular dentro de estas capas, durante el desarrollo y en respuesta al medicamento. Sin embargo, el tamaño MCTS requerido, necesario para desarrollar los gradientes que los hacen tan potentes modelos in vitro, limita drásticamente las herramientas utilizadas para la evaluación no destructiva. De hecho, uno de los mayores desafíos con el análisis no destructivo de los MTCS es cuantificar los detalles a escala celular. La microscopía de campo brillante y de contraste de fase se utiliza rutinariamente para evaluar el crecimiento y desarrollo de los MCTS 3D de forma no destructiva. Sin embargo, estas modalidades se limitan a proyecciones 2D, careciendo de la capacidad de visualizar la estructura 3D crucial de estos modelos 10,11,12,13. La información sobre citotoxicidad y proliferación celular se recopila típicamente a través de imágenes fluorescentes (es decir, microscopía de lámina de luz, microscopía confocal) o tinción inmunohistológica ex vivo 14,15,16. Si bien estos enfoques proporcionan información valiosa y de alta resolución sobre la estructura del tejido, la densidad celular y la función celular, a menudo requieren la preparación de muestras, como la limpieza óptica, la fijación / tinción o la incrustación que impide los análisis longitudinales.
La tomografía de coherencia óptica (OCT) es una modalidad de imagen estructural no destructiva que tiene el potencial de superar algunos de los desafíos mencionados anteriormente. Cuenta con resolución celular y un campo de visión suficientemente amplio (hasta 10 mm x 10 mm) capaz de visualizar agregados multicelulares completos 17,18,19. Es importante destacar que, debido a la naturaleza visible de la luz utilizada, esta técnica es completamente no destructiva y libre de etiquetas17. Además, las muestras se pueden obtener imágenes in situ sin necesidad de preparación de muestras, de modo que las muestras se pueden tomar directamente de la incubadora, escanearse rápidamente con OCT (duración del escaneo ~ 5-10 min) y luego devolverse a la incubadora, lo que permite la caracterización longitudinal. Recientemente han surgido muchos estudios que buscan usar oct para analizar el comportamiento de los esferoides tumorales. En una de las demostraciones más emocionantes, Huang et al. utilizaron oct para detectar núcleos necróticos de forma no destructiva dentro de grandes modelos de esferoides tumorales, señalando que las regiones de células vivas y muertas poseen diferencias discernibles en la atenuación óptica, que pueden utilizarse para el monitoreo de viabilidad sin etiquetas20. Del mismo modo, Hari et al. realizaron mediciones del índice de refracción (RI) de los esferoides del cáncer de colon humano (HCT116) fotografiados con OCT para estudiar la presencia de hipoxia en las muestras21. Sus mediciones no fueron suficientes para inferencias directas, aunque observaron una RI más baja en ubicaciones que se correlacionaban con el sitio, aunque no el tamaño, de los núcleos necróticos, identificados más tarde a través de microscopía confocal. Abd El-Sadek et al. utilizaron oct para visualizar y cuantificar la viabilidad tisular regional de los modelos tumorales de cáncer de mama22. Informaron dos métodos basados en OCT para visualizar la dinámica de los tejidos y mostraron una correlación moderada entre las diferencias en estas métricas y las regiones identificadas por microscopía de células vivas / muertas.
Nuestro trabajo publicado utilizando OCT se basó en esta literatura previa para establecer un enfoque cuantitativo y no destructivo para medir la morfología 3D y el recuento de células dentro de los modelos de cáncer de mama MCTS durante el desarrollo10,23. Utilizando el software de análisis de imágenes de renderizado 3D Imaris para contar el número de objetos del tamaño de una célula (es decir, manchas) fotografiados dentro de los escaneos de volumen de OCT, los recuentos de células se midieron de manera no destructiva en MCTS que fueron estadísticamente similares a los determinados a través del hemocitómetro tras la disociación agregada. Sin embargo, debido a la naturaleza estructural de la OCT, las membranas celulares aún presentes después de la muerte celular por necrosis pueden contarse erróneamente como células vivas. Además, esta caracterización se extendió para rastrear de manera no destructiva la viabilidad celular dentro de agregados individuales sometidos a un régimen farmacológico con un éxito prometedor10. Es importante destacar que se observó que se informó una viabilidad celular similar a partir de nuestro enfoque OCT-Imaris con lo que se comparó dentro de estas muestras tras la disociación. Este enfoque celular no destructivo y libre de etiquetas permite que las células se cuenten dentro de construcciones 3D y agregados densos longitudinalmente sin sacrificar la estructura de construcción / agregado.
El presente trabajo informa de un enfoque mejorado para cuantificar directamente la densidad celular regional dentro de agregados densos aprovechando la capacidad de OCT-Imaris para medir tanto la morfología agregada 3D como el número de células. Este avance metodológico proporciona una imagen más detallada de la distribución espacial y la proliferación de las células dentro de las capas concéntricas características de los modelos MCTS. En lugar de simplemente calcular una densidad celular agregada promedio general, tales mediciones de densidad local pueden revelar gradientes de densidad celular, como los asociados con la compactación. Esta evaluación regional también se aplica a los agregados tratados con un quimioterapéutico para evaluar la respuesta regional al fármaco, medida por los cambios en la densidad celular local. Esta combinación de OCT y métodos avanzados de análisis de imágenes proporciona cuantificación de la viabilidad celular regional, que puede usarse para explorar la penetración del fármaco en función de qué regiones experimentan disminuciones en la densidad celular. Este es el primer informe para cuantificar de forma no destructiva la densidad celular regional y la viabilidad en respuesta al fármaco dentro de tejidos celulares densos y medirlo longitudinalmente. Dicha caracterización de la densidad celular tridimensional y la distribución espacial a lo largo de mcTS completos puede ayudar a optimizar la administración de fármacos en el tratamiento del cáncer y mejorar la comprensión de la progresión del modelo de cáncer.
Protocolo
Para el presente estudio se utilizaron las líneas celulares de cáncer de mama AU565 (HER2+) y MDA-MB-231 (ver Tabla de Materiales).
1. Preparación de agregados tumorales
- Prepare los medios de crecimiento de células de cáncer de mama AU565 (HER2+) utilizando el medio basal (+) 1640 del Roswell Park Memorial Institute (RPMI) en L-glutamina suplementada con suero bovino fetal al 10% (v/v) y penicilina/estreptomicina al 1% (ver Tabla de materiales).
- Prepare los medios de crecimiento celular de cáncer de mama triple negativos MDA-MB-231 utilizando el Medio de Águila Modificada (DMEM) de Dulbecco complementado con suero bovino fetal (FBS) al 10% (v/ v), 100 U / ml de penicilina / estreptomicina y 2 mM de L-glutamina (consulte la Tabla de materiales).
- Preparar cultivos celulares confluentes al 70%-90% de ambas líneas celulares (~3-4 días de preparación) en condiciones estándar (37 °C, 5% CO2, 95% de humedad relativa). Separe las monocapas celulares de sus matraces de cultivo siguiendo el método estándar de tripsinización.
NOTA: Prevenir la sobreexposición de las células a la tripsina, afectando su viabilidad.- Para las células AU565, aspire los medios celulares del matraz con una pipeta (o, si está disponible, utilizando una bomba de vacío conectada a través de tubos a una punta de pipeta de vidrio en autoclave) y reemplácelos con 2 ml de tripsina-EDTA. Deje el matraz durante 3 minutos a temperatura ambiente y luego muévase a la incubadora durante 4 minutos adicionales. Después, agregue 6 ml de medios de crecimiento al matraz para neutralizar la tripsina.
- Para las células MDA-MB-231, aspire los medios celulares del matraz de la misma manera que se realizó en el paso 1.3.1 y reemplácelos con 1,5 ml de tripsina-EDTA. Después de 7 min de incubación, agregue 8.5 ml de medios de crecimiento al matraz para neutralizar la tripsina.
- Agregue 10 μL de la suspensión celular a un hemocitómetro para determinar el número de células en la suspensión24. Resuspend células en medios a la concentración deseada de 2,5 × 105 células/ml.
- Dispense 50 μL de suspensión celular en cada pocillo de una placa de fondo redondo, no adherente, de 96 pocillos. Para las suspensiones preparadas sin Matrigel (matriz de membrana basal, ver Tabla de Materiales), agregue 50 μL de medios de crecimiento lisos a cada pozo.
- Para suspensiones preparadas con la matriz de membrana basal, retire el vial de matriz del almacenamiento de -20 °C y colóquelo en el refrigerador para descongelarlo durante la noche. Prepare un recipiente con medios de crecimiento y refrigere durante 10 minutos para enfriar.
- Usando una punta de pipeta congelada, agregue la matriz a los medios refrigerados de tal manera que la concentración final de esta solución sea del 5%. Agregue 50 μL de este medio a cada pozo, de modo que la concentración final de matriz en estos pozos sea del 2,5%3.
NOTA: En trabajos anteriores, se evaluó la morfología agregada para estas líneas celulares10,25, y se encontró que los agregados MDA-MB-231 forman esferoides con la adición de la matriz de membrana, mientras que los cultivos MDA-MB-231 sin la matriz y la matriz AU565+/- forman agregados en forma de disco. Se utilizó la esfericidad cuantificada de >0,8 en una escala de 0 (plano) a 1,0 (esfera perfecta) para identificar agregados suficientemente esféricos y, por lo tanto, se esperaba que tuvieran la relación superficie-volumen requerida para un comportamiento in vivo 26,27.
- Centrifugar las placas a 123 x g durante 10 min a temperatura ambiente inmediatamente después de la siembra para asegurar la recolección de un pellet celular en el fondo de cada pozo.
NOTA: Este paso debe realizarse lo más rápido posible después de la siembra. Los autores observaron que demasiado tiempo entre estos pasos permite que las células se asienten en los fondos y lados de cada pozo, inhibiendo su capacidad de recolectar y agregar en el fondo del pozo. - Incubar las placas durante 4 días, momento en el que los agregados celulares se consideran maduros.
NOTA: Los agregados AU565 preparados con la matriz de la membrana basal requieren un período de cultivo adicional de 5 días para el estudio de respuesta al fármaco (9 días en total, cambio de medios en el día 4).
2. Administración de Trastuzumab (TZM) a agregados celulares AU565
- Preparar 500 μg/ml de solución TZM (ver Tabla de Materiales) en medios de crecimiento AU565. En el día 4, agregue 10 μL de esta solución a cada pozo, de modo que la concentración final dentro de cada pozo sea de 50 μg / ml.
- El cultivo se agrega durante 5 días adicionales después de la adición de TZM y se evalúa en puntos de tiempo clave.
NOTA: Para el presente estudio, se utilizaron puntos de tiempo de 0 h (inmediatamente antes de la droga), 24 h y 120 h después de la droga para analizar la droga.
3. Tomografía de coherencia óptica
NOTA: Las muestras aquí contenidas fueron fotografiadas con Tomografía de Coherencia Óptica (OCT) durante cada día de maduración (1-4), y luego nuevamente el día 5 (24 h después de la adición del fármaco) y el día 9 (120 h después de la adición del fármaco) para los agregados farmacados seleccionados. Para el estudio actual se utilizó un sistema comercial de tomografía de coherencia óptica de dominio espectral (SDOCT, ver Tabla de materiales) para imágenes de OCT. Aunque este enfoque es susceptible a casi cualquier sistema de PTU, y el procedimiento seguido será generalmente similar entre diferentes sistemas, algunos de los pasos detallados que siguen son específicos del equipo actual.
- Utilice un sistema OCT para imágenes estructurales. Establezca la velocidad de escaneo A en 5,5 kHz para la recopilación de imágenes de alta resolución. Establezca el índice de refracción en 1,33 para muestras en un medio líquido. Establezca el tamaño del vóxel en 1,10 x 1,10 x 2,58 μm3.
- En la ventana Parámetros de imagen en el lado derecho de la pantalla, establezca el campo de visión (FOV) introduciendo valores X, Y y Z (en mm) de modo que la muestra esté comprendida dentro de esta región de interés.
NOTA: El FOV para estos estudios se estableció típicamente en 1,5 x 1,5 x 0,5 mm3. Asegúrese de que la muestra encaja dentro de esta región alternando la entrada 'Ángulo' entre 0 y 90 grados y realizando la confirmación visual. - Haga clic en Modo de adquisición 3D y luego haga clic en Grabar para recopilar el escaneo de volumen 3D de la muestra.
4. Análisis de imágenes
- Exporte el archivo OCT al formato de software (Imaris, consulte Tabla de materiales).
- Abra el archivo OCT en el kit de desarrollo de software. Haga clic en Exportar, establezca el tipo de archivo en .jpg y exporte las imágenes a una carpeta vacía.
- Abra el software de procesamiento de imágenes (FIJI, consulte Tabla de materiales) e importe la secuencia de imágenes desde la carpeta donde se almacenan los JPEG exportados. Utilice el software para unir la secuencia de imágenes y, a continuación, guarde este archivo como una imagen TIFF.
- Cree una reconstrucción de volumen siguiendo los pasos que se indican a continuación.
- Abra Imaris y navegue hasta el archivo TIFF convertido dentro de la Arena. Vaya a Editar > propiedades de imagen e introduzca el tamaño del vóxel (en μm) de la imagen oct oct en los cuadros XYZ correspondientes. Luego, haga clic en Aceptar.
NOTA: Dentro del árbol de objetos de ejemplo en el lado izquierdo de la pantalla, anule la selección de la pestaña Volumen para evitar el retraso del software. - Haga clic en Agregar nuevas superficies encima del árbol de objetos. En el menú debajo del árbol, haga clic en Omitir creación automática y edite manualmente. Dentro de la ventana Ajuste de pantalla , deslice manualmente las flechas rojas y negras para mejorar el contraste entre la muestra y el fondo y mejorar la visualización de la muestra.
- Ajuste la 'Posición del corte' al corte en un borde de la muestra, es decir, donde aparece por primera vez la señal de muestra. Utilice la tecla de escape para cambiar el ratón del modo de navegación al modo de selección y, a continuación, haga clic en Dibujar. Trazar manualmente el contorno de la región que muestra la señal.
- Avance la posición del segmento introduciendo la siguiente posición en el cuadro de entrada. Esta siguiente posición debe ser ≤100 cortes más en la muestra que la anterior. Rastree manualmente la región que muestra la señal.
- Repita el paso 4.2.4 a través del grosor de la muestra hasta que se alcance el borde opuesto de la muestra. Luego, haga clic en Crear superficie en el menú de la izquierda para unir estas rebanadas y completar la reconstrucción del volumen.
- Haga clic en Editar y, a continuación, haga clic en Selección de máscara. Esto crea un nuevo canal en la ventana Ajuste de pantalla que contiene solo la muestra aislada. Las características morfológicas de la muestra ahora se pueden encontrar en la pestaña Estadísticas > Detallado .
NOTA: Este enfoque se siguió para determinar las esfericidades y volúmenes reportados dentro de este estudio actual.
- Abra Imaris y navegue hasta el archivo TIFF convertido dentro de la Arena. Vaya a Editar > propiedades de imagen e introduzca el tamaño del vóxel (en μm) de la imagen oct oct en los cuadros XYZ correspondientes. Luego, haga clic en Aceptar.
- Obtenga la densidad celular total de una muestra siguiendo los pasos a continuación.
- Encima del árbol de objetos, seleccione Agregar nuevos puntos. En el menú Configuración del algoritmo , anule la selección de todos los cuadros. Haga clic en la flecha azul para pasar a la pantalla Canal de origen.
- En el menú desplegable que aparece, seleccione el canal enmascarado creado en el paso 5.2.8, normalmente denominado Canal 2. Introduzca el diámetro medio de la celda de la muestra en el cuadro diámetro XY. Asegúrese de que la resta de fondo esté marcada.
NOTA: Para este trabajo con celdas AU565 y MDA-MB-231, el diámetro se estableció en 10 μm. Esta selección se basa en el tamaño de la celda (explicado en la sección Discusión).
- En el menú desplegable que aparece, seleccione el canal enmascarado creado en el paso 5.2.8, normalmente denominado Canal 2. Introduzca el diámetro medio de la celda de la muestra en el cuadro diámetro XY. Asegúrese de que la resta de fondo esté marcada.
- Haga clic en la flecha azul para pasar a la pantalla Clasificar manchas . En el gráfico de la parte inferior del menú, haga clic y arrastre el borde izquierdo del umbral amarillo hasta el borde izquierdo del gráfico, de modo que todos los objetos se incluyan en el umbral sombreado amarillo. Luego, haga clic en la flecha verde para completar la creación del spot.
- Obtenga el número de objetos identificados (es decir, el recuento de celdas de muestra) haciendo clic en Estadísticas > General > Número total de manchas.
- Para determinar la densidad celular agregada promedio, divida el recuento de células del agregado (medido en el paso 4.3.3) por el volumen agregado (determinado en el paso 4.2.6).
- Encima del árbol de objetos, seleccione Agregar nuevos puntos. En el menú Configuración del algoritmo , anule la selección de todos los cuadros. Haga clic en la flecha azul para pasar a la pantalla Canal de origen.
- Evaluar la densidad regional en capas concéntricas de agregados esféricos (Figura 1A).
- Después del análisis morfológico y de densidad celular, evalúe la densidad regional. Haga clic en la superficie creada en el paso 4.2.5 y navegue hasta la ficha Estilo/Calidad de superficies . Cambie la selección a Punto central y cambie el ancho de píxel a ≤20 para obtener la mejor visibilidad. Vaya a Estadísticas > Posición detallada > y registre la ubicación del lugar central.
- Seleccione Agregar nuevo marco de referencia en el menú situado encima del árbol de objetos. Marque las casillas Visible y Fix junto a XY en el menú. Haga clic y arrastre el centro del icono del marco de referencia de modo que esté en línea con el punto central. Anule la selección de los cuadros XY Visible y Fix y selecciónelos para XZ.
- Una vez más, haga clic y arrastre el centro del icono del marco de referencia de modo que esté en línea con el punto central. Por último, repita esto para el plano YZ, alternando entre estos tres planos fijos hasta que el marco de referencia se alinee perfectamente con el punto central. Haga doble clic en el marco de referencia en el árbol de objetos y cámbiele el nombre Centro o Similar.
- Haga clic en los puntos creados en el paso 4.3 y navegue hasta Estadísticas > detallado > marco de referencia de posición. Haga clic en Marco de referencia de la posición X hasta que se ordene de mayor a menor valor. Registre el valor más alto: esto indica el borde más alejado de la muestra, es decir, el radio de la muestra.
NOTA: Dado que las muestras utilizadas aquí son circulares en el plano XY, los cálculos se pueden realizar a lo largo del eje X o Y con resultados similares. Para muestras que no exhiben simetría X-Y (asimétrica, elipsoide, geometrías irregulares, etc.), se recomienda realizar estos análisis a lo largo de múltiples ejes. - Vaya a Estadísticas. En la esquina inferior derecha del menú, haga clic en Exportar todas las estadísticas a archivo y guarde los datos en una hoja de cálculo.
- Realice cálculos manuales para identificar capas concéntricas a lo largo del eje X.
NOTA: Las muestras utilizadas en este estudio tenían aproximadamente 500 μm de diámetro; por lo tanto, hay dos zonas concéntricas externas de 200 μm de espesor y una zona central interna de 100 μm de espesor. Se recomienda mantener zonas de 200 μm de espesor porque se espera que los comportamientos de difusión cambien a lo largo de esta distancia 7,28,29,30. De acuerdo con este razonamiento, también se recomienda utilizar zonas más concéntricas para muestras más grandes y viceversa para muestras más pequeñas. - Establezca una región de capa externa de 200 μm restando 200 μm del radio exterior que se encuentra en el paso 4.4.3. Por lo tanto, la región exterior abarcará puntos con posiciones X entre elradio X y Xexterior, borde interior (Figura 1A, región naranja).
- Establezca una región de transición restando 200 μm de Xborde exterior, interior. La región de transición abarcará puntos con posiciones X entre Xexterior, borde interno y Xtransición, borde interno (Figura 1A, región rosa).
- Establezca una región central del núcleo que abarque los puntos restantes entre el centro de la muestra y Xtransición, borde interno (Figura 1A, región azul).
- Abra el archivo de hoja de cálculo guardado creado en el paso 4.4.4. Desplácese hasta la pestaña Distancia desde el marco de referencia de origen.
- Calcule el número de puntos en la región central utilizando la función COUNTIF (Columnax, "< Xtransicional, borde interno"), donde la Columnax es la columna 'Distancia desde el marco de referencia de origen'. El valor resultante es el número de celda de esta región. Divida este valor por el volumen de la región para obtener densidad celular.
- De manera similar, calcule el número de celdas en la región de transición usando 'COUNTIF (Columnax, "< Xexterior, borde interno") - COUNTIF (Columnax, "> Xtransición, borde interno").
- Calcule el número de celdas en la región externa usando 'COUNTIF (Columnax,"> Xtransicional,borde interno").
- Evaluar la densidad celular regional en muestras no esféricas a través de 'Tapones Regionales' (Figura 1B).
NOTA: Para muestras no esféricas que no tienen capas concéntricas, el método 'Regional Plug' se desarrolla para muestrear la densidad celular local a varias profundidades radiales en todo el agregado.- Repita los pasos 4.4.1-4.4.3 para establecer el marco de referencia central (Figura 1B, círculo amarillo central) y obtener el radio total de la muestra.
- Realizar cálculos manuales para identificar la colocación de marcos de referencia dentro de las regiones de transición y externas, de modo que se pueda evaluar la densidad celular en la muestra en estas ubicaciones.
- Para calcular la ubicación exterior, reste 50 μm del valor del radio de la muestra del paso 4.5.1 y utilice este valor como posición X.
NOTA: Utilice los mismos valores de posición Y y Z registrados en el paso 4.5.1 para todos los tapones dentro de una muestra dada para medir la densidad celular a lo largo del eje X de la muestra (Figura 1B, círculo amarillo más a la izquierda). - Sobre el árbol de objetos, haga clic en Agregar nuevos puntos y haga clic en Omitir creación automática, Editar manualmente. Con el puntero en modo 'seleccionar', mantenga presionada la tecla Mayús + clic para colocar un lugar en la pantalla. En el menú de la izquierda, ingrese los valores de posición XYZ calculados anteriormente. Ajuste los diámetros XY y Z a ≤20 para obtener la mejor visibilidad.
- Repita el paso 4.4.2 para agregar un marco de referencia en esta ubicación de lugar. Cambie el nombre de este marco de referencia en el árbol de objetos exterior o similar.
- Para calcular la ubicación de transición (punto medio), busque el promedio del valor de posicióncentral X y los valores de posiciónexterior X. Utilice este valor como posición X para el marco de referencia de transición. Como se mencionó anteriormente, utilice los mismos valores Y y Z registrados en el paso 4.5.1 para todos los tapones dentro de una muestra dada para medir la densidad celular a lo largo del eje X de la muestra (Figura 1B, círculo amarillo medio).
- Repita el paso 4.4.2 para colocar el marco de referencia central en esta ubicación, renombrándolo como "transicional" o similar una vez creado.
- Para calcular la ubicación exterior, reste 50 μm del valor del radio de la muestra del paso 4.5.1 y utilice este valor como posición X.
- Haga clic en los puntos creados en el paso 4.3 y navegue hasta Estadísticas. En la esquina inferior derecha del menú, haga clic en Exportar todas las estadísticas a archivo y guarde los datos en una hoja de cálculo.
- Abre la hoja de cálculo. Desplácese hasta la pestaña Distancia desde el marco de referencia de origen. La distancia de cada objeto a los marcos de referencia se muestra en la columna A, y la agrupación de marcos de referencia para cada objeto se muestra en la columna G. Utilice la función 'MOD' para asignar numéricamente cada distancia a su marco de referencia correspondiente, donde 0 es el marco central, 1 es la transición y 2 es el exterior.
- Filtre los valores de esta columna para trabajar con las distancias de cada marco de referencia. Para cada uno de los marcos de referencia, calcule el número de objetos dentro de los 50 micrómetros del marco utilizando la función 'COUNTIF (Columnax, "≤50"), donde columnax es la columna 'Distancia desde el marco de referencia de origen' para cada grupo. El valor resultante corresponde al número de celdas en ese enchufe regional. Divida este valor por el volumen del tapón de 100 μm para obtener la densidad celular.
- Realice el método de enchufe regional espacialmente refinado (Figura 1C).
NOTA: Este enfoque se utilizó para evaluar la viabilidad celular regional en respuesta a la aplicación de fármacos. La inclusión de más marcos de referencia mejora la resolución de las densidades de celdas que se pueden calcular en todo el grosor del modelo.- Repita los pasos 4.4.1-4.4.3 para establecer el marco de referencia central (Figura 1C, círculo amarillo central) y obtener el radio de la muestra.
- Realice cálculos manuales para determinar ubicaciones adicionales de interés. Para ello, agregue 100 μm al valordel centro X y, a continuación, utilice los valores Y y Z del punto central para definir la primera ubicación a lo largo del eje central. Agregue un marco de referencia a esta posición como en el paso 4.4.2 (Figura 1C, círculo amarillo adyacente al círculo central).
NOTA: Agregue menos μm en este paso si busca un seguimiento de densidad de mayor resolución. - Repita los pasos 4.6.2, agregando 100 μm (o el número deseado de μm) a cada ubicación secuencial de X para establecer un eje de tapones igualmente espaciados a través del grosor de la muestra. Coloque el último marco de referencia ≤50 μm de distancia del radio exterior de la muestra (Figura 1C, círculos amarillos).
- Repita los pasos 4.5.3-4.5.5 para obtener recuentos de celdas dentro de cada tapón de 100 μm de diámetro. Divida estos valores por el volumen de cada tapón correspondiente para obtener la densidad de celdas locales.
- Repita todos los pasos de esta sección para los datos de OCT recopilados en cada punto temporal del ensayo farmacológico. La comparación del recuento celular en cada ubicación a través del curso del tiempo de tratamiento debe revelar dónde está disminuyendo la densidad celular (es decir, las regiones que experimentan la muerte celular) y, en consecuencia, qué tan profundo está penetrando el medicamento (es decir, qué capas ven una caída en la densidad celular en comparación con aquellas que mantienen o muestran un aumento en los niveles de densidad celular).
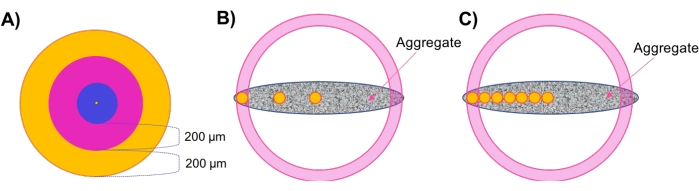
Figura 1: Ilustración esquemática. (A) El enfoque de capa concéntrica (conchas) para evaluar la densidad celular regional en agregados esféricos. (B) El método del tapón regional se desarrolló para evaluar la densidad celular local en agregados no esféricos, donde se utilizan pequeños tapones esféricos (100 μm de diámetro) (mostrados en amarillo) como indicadores de densidad en cada zona / espesor. (C) El método de enchufe regional espacialmente refinado se emplea para los estudios de penetración de drogas. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
En una publicación anterior, se estableció un método para la medición no destructiva de la densidad celular global dentro de agregados celulares utilizando OCT10. Aquí, esta técnica se extiende para evaluar la densidad celular regional de los agregados celulares en desarrollo. La Figura 1 muestra un esquema de esta extensión, donde la densidad celular se puede evaluar en capas concéntricas de un esferoide o más localmente mirando en su lugar pequeños tapones esféricos (100 μm de diámetro), denotados por los círculos amarillos en la Figura 1B, C. Los esferoides tumorales MDA-MB-231 se evaluaron inicialmente estableciendo un punto central dentro del agregado y contando el número de objetos /células en capas concéntricas secuenciales del esferoide. Estos resultados se presentan en la Figura 2. Las pruebas t de Student revelaron una densidad celular significativamente mayor en el núcleo esferoide que en las capas de transición (p = 4.3e-4) y externas (p = 4.0e-6). Este resultado indica compactación en el núcleo esferoide después de 4 días.

Figura 2: Diferencias en la densidad regional calculadas por el enfoque de capa concéntrica para agregados esféricos MDA-MB-231. La figura ilustra un gradiente de densidad celular radial con celdas (n = 3) más densamente empaquetadas en el núcleo agregado, y la densidad celular local disminuyendo con la distancia desde el núcleo. El recuento total promedio de células se muestra con una línea azul. La barra de escala para la imagen insertada es de 100 μm. Los datos se muestran como media ± DE (*= p < 0,05, ***= p < 0,001). Haga clic aquí para ver una versión más grande de esta figura.
Sin embargo, una limitación de esta técnica de capa concéntrica es que solo se puede usar en agregados esféricos. Por lo tanto, el enfoque de conteo celular se adaptó para establecer un método Regional Plug, que muestrea pequeñas zonas en ubicaciones secuenciales a través del agregado, similar a una biopsia virtual. Estos tapones proporcionan mediciones de la densidad celular local a profundidades específicas. Esta técnica fue validada contra el enfoque de capa concéntrica mediante la realización de análisis en los mismos esferoides MDA-MB-231 (Figura 3). Los resultados mostraron una buena concordancia entre los enfoques de tapón regional y capa concéntrica para estos agregados esféricos. Las pruebas t de Student no revelaron diferencias estadísticas entre los enfoques para medir las capas externas y de transición (p = 0,243 y 0,484, respectivamente) y una diferencia leve pero significativa al calcular las densidades en el núcleo agregado (p = 0,017).
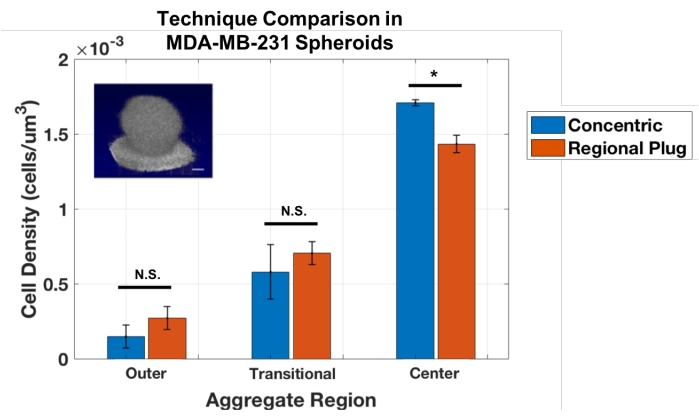
Figura 3: Los enfoques de zona concéntrica y tapón regional ofrecen resultados similares para cuantificar la densidad celular en agregados esféricos MDA-MB-231 (n = 3). Los datos se muestran como media ± DE (* = p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
Esta técnica se aplicó para evaluar los agregados tumorales esféricos y no esféricos en el día 4 de madurez (Figura 4), observando una tendencia similar hacia la compactación del núcleo para todas las morfologías probadas, independientemente del tipo de célula. Esta tendencia fue más destacada en las muestras preparadas con Matrigel (la matriz de la membrana basal), un aditivo conocido por promover la agregación pero cuyos factores exógenos y composición están mal caracterizados 31,32,33. Curiosamente, la adición de la matriz no parece afectar el volumen o el recuento de células y, por lo tanto, parece tener una influencia insignificante en la proliferación celular. Más bien, la adición de la matriz parece redistribuir la densidad celular, promoviendo una compactación significativa del núcleo y disminuyendo la densidad celular en las capas externas. Estos resultados también indican que las células AU565 parecen menos sensibles a los efectos de agregación mediados por la matriz que las células MDA-MB-231. Estos hallazgos proporcionan información valiosa sobre los mecanismos físicos por los cuales la matriz permite la agregación celular en diferentes líneas celulares de cáncer de mama. Es importante destacar que el enfoque de enchufe regional debe adaptarse a cualquier MCTS que muestre geometrías agregadas esféricas o no esféricas.

Figura 4: La adición de matriz promueve una mayor agregación y redistribuye la densidad celular en las líneas celulares de cáncer. Para las líneas celulares MDA-MB-231 (A,B) y AU565 (C,D), la adición de matrices disminuye la densidad en la zona externa y aumenta la compactación en el centro (n = 3) sin cambiar apreciablemente el recuento total de células. Los recuentos totales promedio de células se muestran con líneas azules. Barras de escala insertadas = 100 μm. Los datos mostrados como media ± DE (*= p < 0,05, **= p < 0,01, ***= p < 0,001). Haga clic aquí para ver una versión más grande de esta figura.
A continuación, este enfoque de tapón regional se utilizó para rastrear la muerte celular en agregados tumorales tratados con TZM de manera no destructiva. Los MCTS AU565 preparados con la matriz de membrana se trataron con TZM en el día 4 de desarrollo y se cultivaron hasta el día 9, con puntos de tiempo clave de imágenes de OCT a las 0 h (pre-fármaco), 24 h y 120 h (5 días). El método de enchufe regional definido espacialmente se aplicó en cada punto de tiempo, con tapones establecidos cada 100 μm a lo largo de todo el grosor de cada agregado, como lo muestran los círculos amarillos en la Figura 1C. El tamaño del enchufe central se mantuvo constante mientras que el enchufe exterior se dejó fluctuar en diámetro, lo que corresponde al cambio de tamaño agregado. Se observaron fluctuaciones menores en la densidad celular a lo largo del tiempo dentro de los 500 μm internos de cada agregado, lo que indica una muerte celular mínima (Figura 5). De hecho, la mayoría de las muertes celulares ocurrieron en los 200 μm externos de cada agregado, particularmente en los 100 μm más externos, que desaparecieron por completo en el punto de tiempo de 120 h para todos los agregados analizados. La visualización de la muerte celular como respuesta indicativa al fármaco principalmente en las capas externas de los MCTS es consistente con los problemas de penetración del fármaco de TZM, un fármaco de anticuerpos clínicamente relevante con un peso molecular de 145 kDa34. De hecho, el fármaco se basa en la difusión pasiva a través de estos modelos celulares densos, lo que se espera que desafíe su capacidad para penetrar más de 200 μm en los modelos.
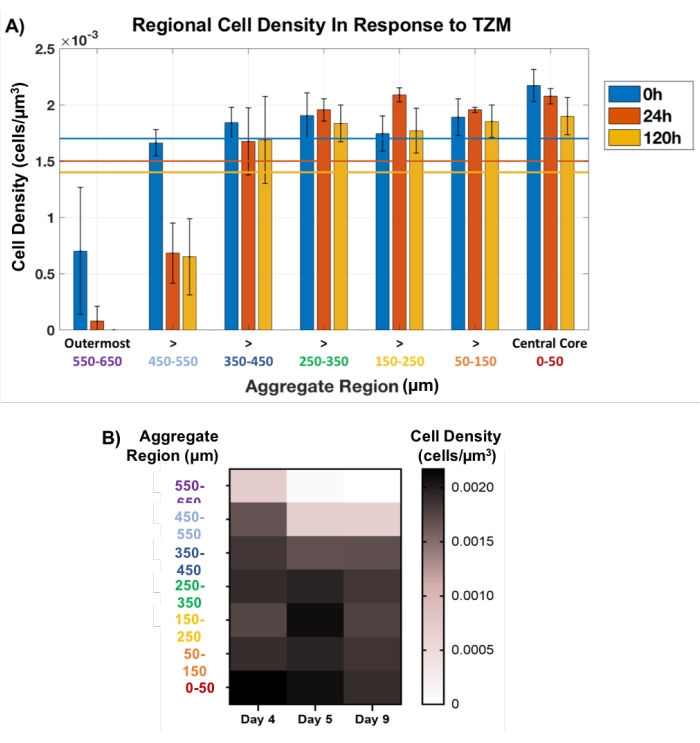
Figura 5: Viabilidad celular en respuesta al fármaco, medida a lo largo del espesor agregado. El tapón en el núcleo interno se mantuvo constante a 100 μm de diámetro, mientras que el de la zona exterior se dejó fluctuar con el cambio de tamaño del agregado. (A) La densidad celular regional en respuesta a la adición de TZM reveló que la muerte celular se limitó en gran medida a los 200 μm externos, particularmente a los 100 μm externos, que desaparecieron por completo después de 120 h de tratamiento. El espesor interno de 500 μm de los agregados observó pocos cambios en el recuento celular (n = 3). Los recuentos totales promedio de celdas se muestran con las líneas de color correspondientes para cada punto de tiempo. Los datos se muestran como promedio ± SD. (B) Gráfico de mapa de calor que representa el cambio en la densidad celular promedio en respuesta al fármaco en función del grosor del agregado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Importancia
Los esferoides tumorales multicelulares (MCTS) son potentes modelos 3D in vitro para estudiar la progresión tumoral y el cribadofarmacológico 1,2,3. El avance de la utilidad de estos modelos agregados relativamente simples depende en gran medida de la caracterización de sus características clave, como la morfología y la densidad celular, que se sabe que influyen tanto en la progresión del modelo tumoral como en la respuesta terapéutica. Sin embargo, su tamaño requerido introduce desafíos en la evaluación de estas características, particularmente para los análisis no destructivos. El método presentado proporciona una nueva herramienta para la cuantificación longitudinal y sin etiquetas de la densidad celular y la viabilidad dentro de regiones discretas de modelos de agregados 3D densos. El mismo agregado se puede volver a visualizar con tomografía de coherencia óptica (OCT) durante varios días de desarrollo. Estas exploraciones volumétricas se pueden analizar para caracterizar cómo evoluciona la densidad celular regionalmente durante la maduración de mcTS. Estos mismos principios se aplican al análisis de agregados drogados, que se pueden visualizar longitudinalmente a lo largo de un régimen de medicamentos determinado para determinar dónde está disminuyendo la densidad celular, es decir, dónde el medicamento puede estar matando activamente las células. Este enfoque mejora significativamente con respecto a los métodos anteriores para obtener información similar a escala celular, que tradicionalmente requiere fijación, tinción y / o seccionamiento, lo que impide los análisis longitudinales. De hecho, esta herramienta tiene el potencial de reducir drásticamente el número de muestras necesarias para un estudio determinado, ya que las mismas muestras se pueden analizar consecutivamente. También se espera que esto introduzca un valor agregado en cada punto temporal, ya que los desarrollos se pueden rastrear dentro de un solo agregado a medida que responde a un estímulo dado, en lugar de depender de datos correlacionados de muestras terminales coincidentes con la edad. Más allá de esta aplicación de MCTS demostrada aquí, este método OCT-Imaris puede estudiar otros agregados celulares, cuerpos embrioides, organoides más complejos o muestras de tejido de hasta unos pocos milímetros de espesor. Este protocolo mejorará la comprensión de la compactación celular durante el desarrollo de agregados y la respuesta a fármacos dentro de modelos de agregados densos.
Modificaciones
El protocolo presentado fue optimizado para el análisis de los modelos MDA-MB-231 y AU565 MCTSS. Los modelos realizados con otras líneas celulares son aplicables; sin embargo, es posible que se requiera cierta optimización del protocolo debido a cambios en el tamaño promedio de las células y la morfología agregada. Se realizó un estudio separado en el que las células MDA-MB-231 y AU565 se enchaparon en 2D y obtuvieron un tamaño celular promedio mediante microscopía. Este diámetro se utilizó como el diámetro XY dentro de la función de "manchas" de Imaris de tal manera que se contaron objetos de este tamaño aproximado. Al cambiar este valor, se cambia el número de objetos ubicados en la muestra10, y se esperan resultados más precisos cuando esta entrada coincida estrechamente con el tamaño de la celda. Por lo tanto, un diámetro XY adecuado debe ser informado por el tamaño promedio de la celda para el tipo de célula utilizada.
Pasos críticos y solución de problemas
Uno de los pasos críticos durante la obtención de imágenes octáticas es la selección de la resolución de escaneo. El tamaño de píxel establecido por el usuario debe ser lo suficientemente pequeño como para que se necesiten varios píxeles para comprender el tamaño promedio del tipo de celda que se está utilizando. Esto mejora la precisión del análisis de "manchas" dentro de Imaris al mejorar la resolución de las células de la OCT y reducir la posibilidad de que el ruido estocástico de los píxeles afecte negativamente el recuento de células.
El aislamiento de la muestra dentro del marco de referencia de Imaris influye en gran medida en los valores de salida para la densidad celular. A medida que el usuario realiza este paso, se acompaña de un nivel de subjetividad y sesgo que debe aplicarse de manera consistente en todos los análisis de muestra. Al aislar la muestra dentro del escaneo de volumen para comenzar el análisis de Imaris, se debe tener cuidado de rastrear los contornos agregados con precisión y evitar la inclusión de artefactos (es decir, reflejos de sustratos o altura del medio).
La colocación adecuada de los marcos de referencia durante el análisis de enchufes regionales es otro paso crítico. Como se indica en la introducción, las tres zonas críticas a analizar durante el desarrollo del modelo son la región externa proliferativa, la región de transición que consiste en células senescentes / quiescentes y el núcleo hipóxico. Se espera que la colocación de marcos de referencia dentro del centro de cada capa produzca la estimación más precisa de la densidad celular dentro de esa región. Esta ubicación del marco de referencia es aún más importante para los análisis detallados de tapones regionales utilizados en este documento para el estudio de drogas, ya que se deben establecer zonas espaciadas uniformemente para analizar la respuesta a los medicamentos con mayor precisión.
Limitaciones e investigación futura
La principal limitación del método propuesto es el seguimiento sector por segmento basado en el usuario realizado dentro de Imaris para aislar el agregado dentro del escaneo de volumen de OCT. Este es un paso crítico para obtener resultados precisos, que es algo subjetivo y, por lo tanto, se espera que imparta cierto nivel de variabilidad entre usuarios. Para abordar esto, actualmente estamos buscando incorporar un algoritmo de detección de bordes realizado dentro de Matlab (o similar) antes de cargar el escaneo en Imaris. Este algoritmo debe identificar objetivamente los bordes de la muestra en cortes de exploración B progresiva, después de lo cual se pueden realizar los análisis propuestos en esta región de muestra preaislada. Abordar esta limitación eliminará la variabilidad basada en el usuario y se espera que conduzca a una aplicabilidad más amplia de esta herramienta basada en OCT.
La capacidad de la OCT para obtener imágenes precisas de células vivas dentro de agregados durante el tratamiento farmacológico depende del modo de muerte celular en el que opera el fármaco. El trabajo previo reveló inexactitudes cuantitativas en el recuento de células vivas reportado de OCT / Imaris en respuesta a doxorrubicina, un medicamento contra el cáncer bien conocido que mata las células a través de la necrosis y la apoptosis10. Se supone que esto se debe a las membranas celulares sobrantes durante la necrosis, que se espera que aparezcan como células vivas durante las imágenes estructurales. Se sabe que TZM mata las células principalmente a través de la apoptosis 35; por lo tanto, cuando las células mueren, deben descomponerse en pedazos lo suficientemente pequeños como para no ser rastreados / contados por oct. Aunque se necesitan más pruebas de validación con un fármaco apoptótico, nuestros primeros experimentos piloto muestran la excelente concordancia de OCT / Imaris con los recuentos de células disociadas en MCTS drogados con TZM (datos no publicados). Por lo tanto, se anticipa que los resultados de células vivas presentados aquí son más precisos que los medicamentos que inducen necrosis. Esta distinción debe tenerse en cuenta al aplicar este enfoque para las pruebas de viabilidad en agregados drogados.
Se espera que la investigación futura en la evaluación no destructiva de agregados tumorales mejore la comprensión de cómo se desarrollan y responden tanto a los estímulos externos como al tratamiento farmacológico. El desarrollo de herramientas analíticas, como la que se presenta en este documento, debería ampliar la utilidad del modelo y mejorar la precisión de los resultados, particularmente dentro de aplicaciones impactantes como la detección de drogas y la evaluación de la entrega / eficacia.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por NIH R01 BRG CA207725 (MB/DTC) y NIH R01 CA233188 (MB). Nos gustaría agradecer a AMC Pharmacy por el Trastuzumab proporcionado para estos experimentos.
Materiales
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
Referencias
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados