Method Article
הערכה לא הרסנית של צפיפות תאים אזורית בתוך אגרגטים סרטניים בעקבות טיפול תרופתי
In This Article
Summary
הפרוטוקול הנוכחי מפתח טכניקה מבוססת תמונה למדידת צפיפות תאים אזורית מהירה, לא הרסנית ונטולת תוויות בתוך אגרגטים של גידולים תלת-ממדיים. הממצאים חשפו שיפוע של צפיפות תאים, עם צפיפות תאים גבוהה יותר באזורי ליבה מאשר שכבות חיצוניות באגרגטים מתפתחים ומוות בעיקר של תאים היקפיים באגרגטים HER2+ שטופלו בטרסטוזומאב.
Abstract
מודלים של ספרואידים של גידולים רב-תאיים (MCTSs) הדגימו תועלת גוברת למחקר במבחנה של התקדמות הסרטן וגילוי תרופות. המבנים האווסקולריים הפשוטים יחסית האלה מחקים היבטים מרכזיים של גידולי in vivo , כגון מבנה תלת-ממדי ושיפועים פתופיזיולוגיים. מודלים של MCTSs יכולים לספק תובנות על התנהגות תאי סרטן במהלך התפתחות הספרואידים ובתגובה לתרופות; עם זאת, גודלם הנדרש מגביל באופן דרסטי את הכלים המשמשים להערכה לא הרסנית. קוהרנטיות אופטית טומוגרפיה הדמיה מבנית ותוכנת ניתוח תלת-ממד של אימאריס נחקרות למדידה מהירה, לא הרסנית ונטולת תוויות של צפיפות תאים אזורית בתוך MCTSs. גישה זו משמשת להערכת MCTS במהלך תקופת התבגרות של 4 ימים ולאורך טיפול ממושך של 5 ימים עם Trastuzumab, תרופה רלוונטית מבחינה קלינית נגד HER2. בקצרה, MCTS של סרטן השד AU565 HER2+ נוצרו באמצעות שכבת-על נוזלית עם או בלי תוספת של Matrigel (מטריצת ממברנת מרתף) כדי לחקור אגרגטים של מורפולוגיות שונות (אגרגטים עבים יותר, דמויי דיסק 2.5D או אגרגטים דו-ממדיים שטוחים, בהתאמה). צפיפות התא בתוך האזור החיצוני, אזור המעבר והליבה הפנימית התאפיינה ב-MCTS שהבשילו, וחשפו שיפוע של צפיפות תאים עם צפיפות תאים גבוהה יותר באזורי הליבה בהשוואה לשכבות החיצוניות. תוספת המטריצה חילקה מחדש את צפיפות התאים ושיפרה את השיפוע הזה, תוך הפחתת צפיפות האזור החיצוני והגברת דחיסת התאים בליבות. צפיפות התאים כומתה לאחר טיפול תרופתי (0 שעות, 24 שעות, 5 ימים) בתוך אזורים עמוקים יותר ויותר של 100 מיקרומטר כדי להעריך הבדלים אזוריים פוטנציאליים בתגובה לתרופות. בנקודת הזמן האחרונה, נראה היה שכמעט כל מקרי המוות של התאים מוגבלים ל-200 מיקרומטר החיצוניים של כל צבירה, בעוד שתאים עמוקים יותר במצטבר נראו ברובם לא מושפעים, מה שממחיש הבדלים אזוריים בתגובה לתרופות, אולי בגלל מגבלות בחדירת הסמים. הפרוטוקול הנוכחי מספק טכניקה ייחודית לכימות לא הרסני של צפיפות התאים האזורית בתוך רקמות תאיות צפופות ולמדוד אותה לאורך.
Introduction
חוקרים פנו במידה רבה למערכות במבחנה של תרבית תלת-ממדית כדי לחקור כמה מתכונות המפתח של התקדמות הגידול. חלק גדול ממחקר זה הובל על ידי הופעתם מחדש של כדוריות גידול רב-תאיות (MCTSs) ואורגנואידים מורכבים יותר 1,2. למרות שמודלים אלה הם avascular, הם מספקים כלי רב עוצמה לסיכום תהליכים פיזיולוגיים ופתולוגיים המתרחשים in vivo 3,4,5. בפרט, מודלים בינוניים (קוטר 300-500 מיקרומטר) יכולים לחקות תכונות גידול מרכזיות כגון מבנה תלת-ממדי, גרדיאנטים פתופיזיולוגיים ואיתות גרורתי עקב היפוקסיה בתוך הליבה. מתועד היטב כי מודלים אלה מציגים את השכבות הקונצנטריות האופייניות שנראו בגידולי in vivo וסקולריים, כלומר שכבה חיצונית של תאים מתרבים, שכבת מעבר של תאים סנסנטיים/קוויזנטיים, ותאים החווים היפוקסיה בליבת 3,6,7,8,9 . ניתן להפיק תובנות ייחודיות ממודלים אלה על ידי אפיון התנהגות התאים בתוך שכבות אלה, במהלך ההתפתחות ובתגובה לתרופה. עם זאת, גודל ה- MCTS הנדרש, הדרוש לפיתוח הדרגות שהופכות אותם למודלים חזקים כל כך במבחנה, מגביל באופן דרסטי את הכלים המשמשים להערכה לא הרסנית. ואכן, אחד האתגרים הגדולים ביותר בניתוח לא הרסני של MTCS הוא כימות פרטים בקנה מידה של תאים. מיקרוסקופיית שדה בהיר וניגודיות פאזה משמשת באופן שגרתי להערכת צמיחה והתפתחות של MCTS תלת-ממדיים באופן לא הרסני. עם זאת, אופנות אלה מוגבלות לתחזיות דו-ממדיות, וחסרות את היכולת לדמיין את המבנה התלת-ממדי החיוני של מודלים אלה 10,11,12,13. מידע על ציטוטוקסיות והתפשטות תאים נאסף בדרך כלל באמצעות הדמיה פלואורסצנטית (כלומר, מיקרוסקופיה של יריעות אור, מיקרוסקופיה קונפוקלית) או צביעה אימונוהיסטולוגית ex vivo 14,15,16. בעוד שגישות אלה מספקות מידע רב ערך ברזולוציה גבוהה על מבנה הרקמה, צפיפות התאים ותפקוד התאים, לעתים קרובות הן דורשות הכנת דגימות כגון ניקוי אופטי, תיקון/צביעה או הטבעה המונעת ניתוחים אורכיים.
טומוגרפיה של קוהרנטיות אופטית (OCT) היא שיטת הדמיה מבנית לא הרסנית שיש לה פוטנציאל להתגבר על כמה מהאתגרים שהוזכרו לעיל. הוא מתהדר ברזולוציה תאית ובשדה ראייה רחב מספיק (עד 10 מ"מ x 10 מ"מ) המסוגל לדמיין אגרגטים רב-תאיים שלמיםבגודל 17,18,19. חשוב לציין, בשל האופי הנראה של האור שבו נעשה שימוש, טכניקה זו היא לחלוטין לא הרסנית ונטולת תוויות17. כמו כן, ניתן לצלם דגימות באתרן ללא צורך בהכנת דגימה, כך שניתן לקחת דגימות היישר מהאינקובטור, לסרוק במהירות עם OCT (משך הסריקה ~ 5-10 דקות), ואז להחזיר לאינקובטור, מה שמאפשר אפיון אורכי. מחקרים רבים המבקשים להשתמש ב- OCT כדי לנתח התנהגות ספרואידית של גידולים צצו לאחרונה. באחת ההדגמות המרגשות ביותר, Huang et al. השתמשו ב-OCT כדי לזהות באופן לא הרסני ליבות נמקיות בתוך מודלים כדוריים גדולים של גידולים, וציינו כי באזורי תאים חיים ומתים יש הבדלים ניכרים בהנחתה אופטית, אשר עשויים לשמש לניטור כדאיות ללא תווית20. באופן דומה, Hari et al. ערכו מדידות של מקדם שבירה (RI) של כדוריות של סרטן המעי הגס האנושי (HCT116) שצולמו עם OCT כדי לחקור את נוכחותה של היפוקסיה בתוך הדגימות21. המדידות שלהם לא הספיקו להסקת מסקנות ישירות, אם כי הם כן צפו ב-RI נמוך יותר במיקומים שקושרו לאתר, אם כי לא לגודל, של ליבות נמקיות, שזוהו מאוחר יותר באמצעות מיקרוסקופיה קונפוקלית. עבד אל-סאדק ואחרים השתמשו ב-OCT כדי לדמיין ולכמת את כדאיות הרקמות האזורית של מודלים של גידולי סרטן שד22. הם דיווחו על שתי שיטות מבוססות OCT להדמיית דינמיקה של רקמות והראו מתאם מתון בין הבדלים במדדים אלה לבין אזורים שזוהו על ידי מיקרוסקופיה של תאים חיים/מתים.
העבודה שלנו שפורסמה באמצעות OCT התבססה על ספרות קודמת זו כדי לבסס גישה כמותית ולא הרסנית למדידת המורפולוגיה התלת-ממדית וספירת התאים במודלים של סרטן השד MCTSs במהלך הפיתוח10,23. באמצעות תוכנת ניתוח תמונות לעיבוד תמונה בתלת-ממד של Imaris כדי לספור את מספר העצמים בגודל התא (כלומר, כתמים) שצולמו בתוך סריקות נפח OCT, ספירות התאים נמדדו באופן לא הרסני ב-MCTS שהיו דומים סטטיסטית לאלה שנקבעו באמצעות המוציטומטר בעת דיסוציאציה מצטברת. עם זאת, בשל האופי המבני של OCT, קרומי התאים שעדיין קיימים לאחר מוות תאי על ידי נמק עשויים להיספר בטעות כתאים חיים. יתר על כן, אפיון זה הורחב למעקב לא הרסני אחר כדאיות התאים בתוך אגרגטים בודדים הנתונים למשטר תרופות עם הצלחה מבטיחה10. חשוב לציין כי כדאיות דומה של תאים דווחה מגישת OCT-Imaris שלנו עם מה שנבחן בדגימות אלה לאחר הדיסוציאציה. גישה זו של תאים לא הרסניים ונטולי תוויות מאפשרת לספור את התאים בתוך מבנים תלת-ממדיים ואגרגטים צפופים לאורך מבלי להקריב את המבנה/מבנה הצבירה.
העבודה הנוכחית מדווחת על גישה משופרת לכימות ישיר של צפיפות התאים האזורית בתוך אגרגטים צפופים על ידי מינוף היכולת של OCT-Imaris למדוד הן את המורפולוגיה של הצבר התלת-ממדי והן את מספר התאים. התקדמות מתודולוגית זו מספקת תמונה מפורטת יותר של ההתפלגות המרחבית של התאים והתפשטותם בתוך השכבות הקונצנטריות האופייניות למודלים של MCTSs. במקום פשוט לחשב את צפיפות התאים המצטברת הממוצעת הכוללת, מדידות צפיפות מקומיות כאלה יכולות לחשוף גרדיאנטים של צפיפות תאים, כגון אלה הקשורים לדחיסה. הערכה אזורית זו מיושמת גם על אגרגטים שטופלו בכימותרפיה כדי להעריך את התגובה האזורית לתרופות, כפי שנמדדה על ידי שינויים בצפיפות התאים המקומית. שילוב זה של OCT ושיטות ניתוח הדמיה מתקדמות מספק כימות של כדאיות תאים אזורית, אשר ניתן להשתמש בה כדי לחקור את חדירת התרופות על סמך אילו אזורים חווים ירידה בצפיפות התאים. זהו הדו"ח הראשון שמכומת באופן לא הרסני את צפיפות התאים האזורית ואת הכדאיות שלהם בתגובה לתרופה בתוך רקמות תאיות צפופות ומודד אותה לאורך. אפיון כזה של צפיפות תאים תלת-ממדית והתפלגות מרחבית לאורך MCTS שלמים עשוי לסייע באופטימיזציה של אספקת תרופות בטיפול בסרטן ולשפר את ההבנה של התקדמות מודל הסרטן.
Protocol
AU565 (HER2+) ו-MDA-MB-231 קווי תאי סרטן השד שימשו למחקר הנוכחי (ראו טבלת חומרים).
1. הכנת אגרגטים לגידולים
- הכן AU565 (HER2+) מדיה לצמיחת תאי סרטן השד באמצעות מכון הזיכרון רוזוול פארק (RPMI) 1640 מדיום בסיסי (+) ב- L-גלוטמין בתוספת 10% (v/v) סרום בקר עוברי ו-1% פניצילין/סטרפטומיצין (ראה טבלת חומרים).
- הכן את מדיית גדילת תאי השד המשולשת-שלילית של MDA-MB-231 באמצעות מדיום הנשר המהונדס (DMEM) של Dulbecco עם תוספת של 10% (v/v) סרום בקר עוברי (FBS), 100 U/mL של פניצילין/סטרפטומיצין ו-2 mM של L-גלוטמין (ראו טבלת חומרים).
- הכינו 70%-90% תרביות תאים מתמזגות של שני קווי התאים (כ-3-4 ימי הכנה) בתנאים סטנדרטיים (37°C, 5% CO2, 95% לחות יחסית). נתקו את חד-שכבתי התאים מבקבוקי התרבית שלהם בשיטת טריפסיניזציה סטנדרטית.
הערה: מנע חשיפת יתר של תאים לטריפסין, תוך השפעה על הכדאיות שלהם.- עבור תאי AU565, שאפו את המדיה התאית מהבקבוק באמצעות פיפטה (או, אם היא זמינה, באמצעות משאבת ואקום המחוברת באמצעות צינורות לקצה פיפטה מזכוכית אוטוקלאבית) והחליפו ב-2 מ"ל טריפסין-EDTA. השאירו את הבקבוקון למשך 3 דקות בטמפרטורת החדר, ולאחר מכן עברו לחממה למשך 4 דקות נוספות. לאחר מכן, הוסף 6 מ"ל של מדיית גדילה לבקבוק כדי לנטרל את הטריפסין.
- עבור תאי MDA-MB-231, שאפו למדיית תאים מהבקבוק באותו אופן כפי שבוצע בשלב 1.3.1 והחליפו ב-1.5 מ"ל טריפסין-EDTA ב-1.5 מ"ל. לאחר 7 דקות של דגירה, הוסיפו 8.5 מ"ל של מדיית גדילה לבקבוק כדי לנטרל את הטריפסין.
- הוסף 10 μL של תרחיף התא להמוציטומטר כדי לקבוע את מספר התאים בהשעיה24. תחייה של תאים במדיה בריכוז הרצוי של 2.5 × 105 תאים/מ"ל.
- מחלקים 50 μL של תרחיף תא לכל באר של צלחת עגולה עם תחתית עגולה, שאינה דבקה, בעלת 96 בארות. עבור מתלים שהוכנו ללא Matrigel (מטריצת קרום מרתף, ראה טבלת חומרים), הוסף 50 μL של מדיית גדילה רגילה לכל באר.
- עבור מתלים שהוכנו עם מטריצת קרום המרתף, הסר את בקבוקון המטריצה מאחסון של -20 מעלות צלזיוס והנח אותו במקרר כדי להפשיר למשך הלילה. מכינים מיכל עם מדיית גדילה ומכניסים למקרר למשך 10 דקות לצינון.
- באמצעות קצה פיפטה קפוא, הוסף את המטריצה למדיה מצוננת כך שהריכוז הסופי של תמיסה זו הוא 5%. הוסף 50 μL של מדיה זו לכל באר, כך שהריכוז הסופי של מטריצה בבארות אלה הוא 2.5%3.
הערה: בעבודה קודמת, המורפולוגיה של הצבירה הוערכה עבור קווי תאים אלה 10,25, ומצאה כי אגרגטים MDA-MB-231 יוצרים ספרואידים עם תוספת של מטריצת הממברנה, בעוד שתרביות MDA-MB-231 ללא המטריצה ומטריצת AU565+/- יוצרות כולן אגרגטים בצורת דיסק. כדוריות מכמתת של >0.8 בסולם מ-0 (מישור) - 1.0 (כדור מושלם) שימשה לזיהוי אגרגטים כדוריים מספיק ולכן ציפתה להיות בעלת יחס פני השטח לנפח הנדרש להתנהגות דמוית in vivo 26,27.
- צנטריפוגה של הצלחות ב-123 x g למשך 10 דקות בטמפרטורת החדר מיד לאחר הזריעה כדי להבטיח איסוף של כדור תא בתחתית כל באר.
הערה: שלב זה חייב להתבצע במהירות האפשרית לאחר הזריעה. החוקרים הבחינו כי זמן רב מדי בין השלבים הללו מאפשר לתאים להתיישב על פני התחתית והצדדים של כל באר, מה שמעכב את יכולתם לאסוף ולהצטבר בתחתית הבאר. - דגירה של הצלחות במשך 4 ימים, ואז אגרגטים התאים נחשבים לבוגרים.
הערה: אגרגטים AU565 שהוכנו עם מטריצת קרום המרתף דורשים תקופת תרבית נוספת של 5 ימים עבור מחקר התגובה לתרופות (9 ימים בסך הכל, שינוי מדיה ביום 4).
2. ניהול אגרגטים של תאי טרסטוזומאב (TZM) ל-AU565
- הכן 500 מיקרוגרם/מ"ל של תמיסת TZM (ראה טבלת חומרים) במדיית צמיחה AU565. ביום 4, הוסיפו 10 מיקרול של תמיסה זו לכל באר, כך שהריכוז הסופי בכל באר הוא 50 מיקרוגרם/מ"ל.
- התרבות מצטברת למשך 5 ימים נוספים לאחר הוספת TZM ומעריכה בנקודות זמן מרכזיות.
הערה: עבור המחקר הנוכחי, נקודות זמן של 0 שעות (מיד לפני הסימום), 24 שעות, ו 120 שעות לאחר התרופה שימשו לניתוח התרופה.
3. הדמיית טומוגרפיה קוהרנטית אופטית
הערה: הדגימות כאן צולמו עם טומוגרפיה קוהרנטית אופטית (OCT) במהלך כל יום של התבגרות (1-4), ולאחר מכן שוב ביום 5 (24 שעות לאחר תוספת סמים) וביום 9 (120 שעות לאחר תוספת סמים) עבור אגרגטים מסוממים נבחרים. במחקר הנוכחי נעשה שימוש במערכת מסחרית של טומוגרפיה קוהרנטית אופטית בתחום הספקטרלי(SDOCT, ראו טבלת חומרים) להדמיית OCT. למרות שגישה זו מקובלת כמעט על כל מערכת OCT, וההליך שיתבצע יהיה דומה בדרך כלל בין מערכות שונות, חלק מהשלבים המפורטים הבאים הם ספציפיים לציוד הנוכחי.
- השתמש במערכת OCT להדמיה מבנית. הגדר את קצב סריקת A ל- 5.5 קילוהרץ לאיסוף תמונות ברזולוציה גבוהה. הגדר את מדד השבירה ל- 1.33 עבור דגימות במדיום נוזלי. הגדר את גודל הווקסל ל- 1.10 x 1.10 x 2.58 מיקרומטר3.
- בחלון פרמטרי תמונה בצד ימין של המסך, הגדר את שדה הראייה (FOV) על-ידי הזנת ערכי X, Y ו- Z (במ"מ) כך שהמדגם יוכלל בתוך אזור עניין זה.
הערה: FOV עבור מחקרים אלה הוגדר בדרך כלל על 1.5 x 1.5 x 0.5 מ"מ3. ודא שהדגימה מתאימה לאזור זה על-ידי החלפת קלט 'זווית' בין 0 ל-90 מעלות וביצוע אישור חזותי. - לחץ על מצב רכישה בתלת-ממד ולאחר מכן לחץ על רשומה כדי לאסוף את סריקת עוצמת הקול התלת-ממדית של הדגימה.
4. ניתוח תמונות
- ייצא את קובץ OCT לתבנית התוכנה (Imaris, ראה טבלת חומרים).
- פתח את קובץ OCT בערכת פיתוח התוכנה. לחץ על ייצוא, הגדר את סוג הקובץ .jpg וייצא את התמונות לתיקיה ריקה.
- פתח את תוכנת עיבוד התמונה (FIJI, ראה טבלת חומרים) ויבא את רצף התמונות מהתיקיה שבה מאוחסנים קובצי JPEG המיוצאים. השתמש בתוכנה כדי לתפור את רצף התמונה יחד, ולאחר מכן שמור קובץ זה כתמונת TIFF.
- צור שחזור אמצעי אחסון בהתאם לשלבים הבאים.
- פתח את אימריס ונווט לקובץ ה- TIFF שהומר בתוך הארנה. עבור אל ערוך > מאפייני תמונה והזן את גודל הווקסל (ב- μm) מתמונת OCT לתיבות XYZ המתאימות. לאחר מכן, לחץ על אישור.
הערה: בתוך עץ האובייקטים לדוגמה בצד שמאל של המסך, בטל את הבחירה בכרטיסיה עוצמת קול כדי למנוע השהיה בתוכנה. - לחץ על הוסף משטחים חדשים מעל עץ האובייקטים. בתפריט שמתחת לעץ, לחץ על דלג על יצירה אוטומטית וערוך באופן ידני. בתוך החלון 'התאמת תצוגה' , החליקו ידנית את החצים האדומים והשחורים כדי לשפר את הניגודיות בין הדגימה לרקע ולשפר את ההדמיה לדוגמה.
- התאם את 'מיקום פרוסה' לפרוסה בקצה אחד של הדגימה, כלומר, היכן שאות הדגימה מופיע לראשונה. השתמש במקש הבריחה כדי לשנות את העכבר ממצב הניווט למצב בחר ולאחר מכן לחץ על ציור. עקוב באופן ידני אחר קווי המתאר של האזור המציג את האות.
- קדם את מיקום הפרוסה על-ידי הזנת המיקום הבא בתיבת הקלט. המיקום הבא חייב להיות ≤100 פרוסות רחוק יותר לתוך המדגם מאשר הקודם. עקוב באופן ידני אחר האזור המציג את האות.
- חזור על שלב 4.2.4 דרך עובי הדגימה עד שיגיע לקצה הנגדי של הדגימה. לאחר מכן, לחץ על צור משטח בתפריט הימני כדי לתפור פרוסות אלה יחד ולהשלים את שחזור עוצמת הקול.
- לחץ על ערוך ולאחר מכן לחץ על בחירת מסיכה. פעולה זו יוצרת ערוץ חדש בחלון 'התאמת תצוגה' המכיל רק את המדגם המבודד. מאפיינים מורפולוגיים של המדגם ניתן למצוא כעת בכרטיסייה סטטיסטיקה > מפורט .
הערה: גישה זו נעשתה כדי לקבוע את הכדוריות והכספים שדווחו במחקר הנוכחי.
- פתח את אימריס ונווט לקובץ ה- TIFF שהומר בתוך הארנה. עבור אל ערוך > מאפייני תמונה והזן את גודל הווקסל (ב- μm) מתמונת OCT לתיבות XYZ המתאימות. לאחר מכן, לחץ על אישור.
- קבל את צפיפות התא הכוללת של הדגימה בהתאם לשלבים הבאים.
- מעל עץ האובייקטים, בחר הוסף נקודות חדשות. בתפריט הגדרות אלגוריתם , בטל את הבחירה בכל התיבות. לחץ על החץ הכחול כדי לעבור למסך ערוץ המקור.
- מהתפריט הנפתח שמופיע, בחר את הערוץ עם מסיכה שנוצר בשלב 5.2.8, המכונה בדרך כלל ערוץ 2. הזן את קוטר התא הממוצע עבור הדגימה בתיבה בקוטר XY. ודא שחיסור הרקע נבדק.
הערה: עבור עבודה זו עם תאי AU565 ו- MDA-MB-231, הקוטר הוגדר ל- 10 מיקרומטר. בחירה זו מבוססת על גודל התא (מוסבר בסעיף דיון).
- מהתפריט הנפתח שמופיע, בחר את הערוץ עם מסיכה שנוצר בשלב 5.2.8, המכונה בדרך כלל ערוץ 2. הזן את קוטר התא הממוצע עבור הדגימה בתיבה בקוטר XY. ודא שחיסור הרקע נבדק.
- לחץ על החץ הכחול כדי לעבור למסך 'סווג כתמים' . בגרף שבתחתית התפריט, לחץ וגרור את הקצה השמאלי של הסף הצהוב לקצה השמאלי של הגרף, כך שכל האובייקטים ייכללו בסף המוצלל הצהוב. לאחר מכן, לחץ על החץ הירוק כדי להשלים את יצירת הנקודה.
- קבל את מספר האובייקטים שזוהו (כלומר, ספירת תאים לדוגמה) על-ידי לחיצה על סטטיסטיקה > המספר הכולל > הכולל של הכתמים.
- כדי לקבוע את צפיפות התאים המצטברת הממוצעת, חלקו את ספירת התאים של הצבירה (הנמדדת בשלב 4.3.3) בנפח הצבירה (שנקבע בשלב 4.2.6).
- מעל עץ האובייקטים, בחר הוסף נקודות חדשות. בתפריט הגדרות אלגוריתם , בטל את הבחירה בכל התיבות. לחץ על החץ הכחול כדי לעבור למסך ערוץ המקור.
- להעריך את הצפיפות האזורית בשכבות קונצנטריות של אגרגטים כדוריים (איור 1א).
- לאחר ניתוח מורפולוגי וצפיפות תאים, העריכו את הצפיפות האזורית. לחץ על המשטח שנוצר בשלב 4.2.5 ונווט לכרטיסיה סגנון/איכות משטחים . שנה את הבחירה ל-Center Point ושנה את רוחב הפיקסל ל-≤20 לקבלת התצוגה הטובה ביותר. נווט אל סטטיסטיקה > מיקום > מפורט ותעד את מיקום הנקודה המרכזית.
- בחר הוסף מסגרת הפניה חדשה מהתפריט שמעל עץ האובייקטים. סמן את התיבות גלוי ותקן לצד XY בתפריט. לחץ וגרור את מרכז סמל מסגרת ההפניה כך שהוא יתאים לנקודה המרכזית. בטלו את הבחירה בתיבות XY גלוי ותיקון ובחרו בהן עבור XZ.
- שוב, לחץ וגרור את מרכז סמל מסגרת ההפניה כך שהוא יתאים לנקודה המרכזית. לבסוף, חזור על כך עבור מישור YZ, לסירוגין בין שלושת המישורים הקבועים הללו עד שמסגרת הייחוס תתיישר באופן מושלם עם הנקודה המרכזית. לחץ פעמיים על מסגרת ההפניה בעץ האובייקט ושנה את שמה למרכז או דומה.
- לחץ על המקומות שנוצרו בשלב 4.3 ונווט אל סטטיסטיקה > מסגרת הפניה מפורטת של מיקום >. לחץ על מסגרת הפניה של מיקום X עד שהיא תמיין מהערך הגבוה ביותר לערך הנמוך ביותר. רשום את הערך הגבוה ביותר - זה מציין את הקצה הרחוק ביותר של המדגם, כלומר, רדיוס הדגימה.
הערה: מאחר שהדגימות המשמשות כאן הן מעגליות במישור XY, ניתן לבצע חישובים לאורך ציר X או Y עם תוצאות דומות. עבור דגימות שאינן מציגות סימטריית X-Y (אסימטרית, אליפסואידית, גיאומטריות לא סדירות וכו '), מומלץ לבצע ניתוחים אלה לאורך צירים מרובים. - נווט אל סטטיסטיקה. בפינה השמאלית התחתונה של התפריט, לחץ על ייצוא כל הנתונים הסטטיסטיים לקובץ ושמור נתונים בגיליון אלקטרוני.
- בצע חישובים ידניים כדי לזהות שכבות קונצנטריות לאורך ציר ה- X.
הערה: הדגימות ששימשו במחקר זה היו בקוטר של כ-500 מיקרומטר; לפיכך, ישנם שני אזורים קונצנטריים חיצוניים בעובי 200 מיקרומטר ואזור מרכזי פנימי אחד בעובי 100 מיקרומטר. מומלץ לשמור על אזורים בעובי של 200 מיקרומטר מכיוון שהתנהגויות הדיפוזיה צפויות להשתנות במהלך מרחק זה 7,28,29,30. בהתאם להנמקה זו, מומלץ גם להשתמש באזורים קונצנטריים יותר עבור דגימות גדולות יותר ולהיפך עבור דגימות קטנות יותר. - הגדר אזור שכבה חיצוני של 200 מיקרומטר על-ידי חיסור של 200 מיקרומטר מהרדיוס החיצוני שנמצא בשלב 4.4.3. לפיכך, האזור החיצוני יכלול כתמים עם מיקומי X ביןרדיוס Xל-X חיצוני,קצה פנימי (איור 1A, אזור כתום).
- הגדר אזור מעבר על-ידי חיסור של 200 מיקרומטרמהקצה החיצוני והפנימי X. אזור המעבר יכלול כתמים עם מיקומי X בין Xחיצוני,פנימי-קצה,ו-X מעברי,קצה פנימי (איור 1A, אזור ורוד).
- הגדר אזור ליבה מרכזי המקיף את הכתמים הנותרים בין מרכז הדגימה לבין Xמעבר,קצה פנימי (איור 1A, אזור כחול).
- פתח את קובץ הגיליון האלקטרוני שנשמר שנוצר בשלב 4.4.4. נווט אל הכרטיסיה מרחק ממסגרת הפניה של המקור.
- חשב את מספר הנקודות באזור הליבה באמצעות הפונקציה COUNTIF (עמודהx, "< Xמעבר, קצה פנימי"), כאשר עמודהx היא העמודה 'מרחק ממסגרת הפניה של המקור'. הערך המתקבל הוא מספר התא באזור זה. חלק ערך זה בנפח האזור כדי לקבל את צפיפות התא.
- באופן דומה, חשב את מספר התאים באזור המעבר באמצעות 'COUNTIF (עמודהx, "< Xחיצוני,קצה פנימי") - COUNTIF(עמודה x, "> Xמעבר,קצה פנימי").
- חישוב מספר התאים באזור החיצוני באמצעות 'COUNTIF (עמודהx,"> Xמעבר,קצה פנימי").
- הערך את צפיפות התאים האזורית בדגימות לא כדוריות באמצעות 'תקעים אזוריים' (איור 1B).
הערה: עבור דגימות לא כדוריות שאין להן שכבות קונצנטריות, שיטת 'תקע אזורי' מפותחת כדי לדגום צפיפות תאים מקומית בעומקים רדיאליים שונים לאורך הצבירה.- חזור על שלבים 4.4.1-4.4.3 כדי להגדיר את מסגרת הייחוס המרכזית (איור 1B, עיגול צהוב מרכזי) ולקבל את רדיוס הדגימה הכולל.
- בצע חישובים ידניים כדי לזהות את המיקום של מסגרות ייחוס בתוך אזורי המעבר והחיצוניים, כך שניתן יהיה להעריך את צפיפות התאים במדגם במיקומים אלה.
- כדי לחשב את המיקום החיצוני, הפחת 50 μm מערך רדיוס הדגימה משלב 4.5.1 והשתמש בערך זה כמיקום X.
הערה: השתמש באותם ערכי מיקום Y ו-Z שנרשמו בשלב 4.5.1 עבור כל התקעים בתוך מדגם נתון כדי למדוד את צפיפות התא לאורך ציר ה-X של הדגימה (איור 1B, העיגול הצהוב השמאלי ביותר). - מעל עץ האובייקטים, לחץ על הוסף נקודות חדשות ולחץ על דלג על יצירה אוטומטית, ערוך ידנית. עם המצביע במצב 'בחירה', החזק shift+click כדי למקם נקודה על המסך. בתפריט הימני, הזן את ערכי המיקום של XYZ המחושבים לעיל. התאם את קוטרי XY ו- Z ל- ≤20 לקבלת הראות הטובה ביותר.
- חזור על שלב 4.4.2 כדי להוסיף מסגרת ייחוס במיקום נקודה זה. שנה את השם של מסגרת ייחוס זו בעץ האובייקטים החיצוני או דומה.
- כדי לחשב את מיקום המעבר (נקודת האמצע), מצא את הממוצע של ערך המיקוםשל מרכז X ואת ערכי המיקוםהחיצוני X. השתמש בערך זה כמיקום X עבור מסגרת הייחוס המעברית. כנ"ל, השתמש באותם ערכי Y ו-Z שנרשמו בשלב 4.5.1 עבור כל התקעים בתוך מדגם נתון כדי למדוד את צפיפות התא לאורך ציר ה-X של המדגם (איור 1B, העיגול הצהוב האמצעי).
- חזור על שלב 4.4.2 כדי למקם את מסגרת ההפניה האמצעית במיקום זה, תוך שינוי שמה ל'מעבר' או דומה לה לאחר שנוצרה.
- כדי לחשב את המיקום החיצוני, הפחת 50 μm מערך רדיוס הדגימה משלב 4.5.1 והשתמש בערך זה כמיקום X.
- לחץ על הנקודות שנוצרו בשלב 4.3 ונווט אל סטטיסטיקה. בפינה השמאלית התחתונה של התפריט, לחץ על ייצוא כל הנתונים הסטטיסטיים לקובץ ושמור נתונים בגיליון אלקטרוני.
- פתח את הגיליון האלקטרוני. נווט אל הכרטיסיה מרחק ממסגרת הפניה של המקור. המרחק של כל אובייקט למסגרות ההפניה מוצג בעמודה A, וקיבוץ מסגרות ההתייחסות עבור כל אובייקט מוצג בעמודה G. השתמש בפונקציה 'MOD' כדי להקצות באופן מספרי כל מרחק למסגרת הייחוס המתאימה לו, כאשר 0 היא מסגרת המרכז, 1 הוא המעבר ו- 2 הוא החיצוני.
- סנן את הערכים בעמודה זו כדי לעבוד עם המרחקים בכל מסגרת הפניה. עבור כל אחת ממסגרות הייחוס, חשב את מספר העצמים בטווח של 50 מיקרומטרים של המסגרת באמצעות הפונקציה 'COUNTIF (עמודה x, "עמודהx, "≤50"), כאשר עמודהx היא העמודה 'מרחק ממסגרת הפניה של המקור' עבור כל קבוצה. הערך המתקבל מתאים למספר התאים בתקע אזורי זה. חלק ערך זה בנפח של תקע 100 מיקרומטר כדי לקבל צפיפות תאים.
- בצע את שיטת התקע האזורי המעודן מרחבית (איור 1C).
הערה: גישה זו שימשה להערכת כדאיות תאים אזורית בתגובה ליישום תרופות. הכללת מסגרות ייחוס נוספות משפרת את הרזולוציה של צפיפויות התאים שניתן לחשב לאורך עובי המודל.- חזור על שלבים 4.4.1-4.4.3 כדי להגדיר את מסגרת הייחוס המרכזית (איור 1C, עיגול צהוב מרכזי) ולקבל את רדיוס הדגימה.
- בצע חישובים ידניים כדי לקבוע מיקומים נוספים של עניין. לשם כך, הוסף 100 מיקרומטר לערךמרכז X, ולאחר מכן השתמש בערכי Y ו- Z של נקודת המרכז כדי להגדיר את המיקום הראשון לאורך ציר המרכז. הוסף מסגרת ייחוס למיקום זה כמו בשלב 4.4.2 (איור 1C, עיגול צהוב הסמוך לעיגול מרכזי).
הערה: הוסף פחות מיקרומטר בשלב זה אם אתה מחפש מעקב אחר צפיפות ברזולוציה גבוהה יותר. - חזור על שלבים 4.6.2, והוסף 100 מיקרומטר (או מספר μm רצוי) לכל מיקום X רציף כדי ליצור ציר של תקעים במרווחים שווים דרך עובי הדגימה. מקם את מסגרת הייחוס האחרונה ≤50 מיקרומטר הרחק מהרדיוס החיצוני של הדגימה (איור 1C, עיגולים צהובים).
- חזור על שלבים 4.5.3-4.5.5 כדי לקבל ספירות תאים בתוך כל תקע בקוטר 100 מיקרומטר. חלקו ערכים אלה בנפח של כל תקע מתאים כדי לקבל צפיפות תאים מקומית.
- חזור על כל השלבים בסעיף זה עבור נתוני OCT שנאספו בכל נקודת זמן של ניסוי התרופה. השוואת ספירת התאים בכל מקום במהלך הטיפול אמורה לחשוף היכן צפיפות התאים יורדת (כלומר, אזורים שחווים מוות תאי) וכתוצאה מכך, עד כמה עמוקה התרופה חודרת (כלומר, אילו שכבות רואות ירידה בצפיפות התאים לעומת אלה ששומרות או מציגות עלייה ברמות צפיפות התאים).
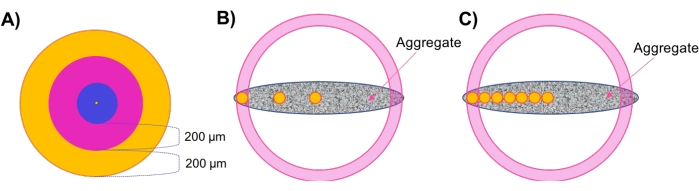
איור 1: המחשה סכמטית. (A) גישת השכבה הקונצנטרית (קונכיות) להערכת צפיפות התא האזורית באגרגטים כדוריים. (B) שיטת התקע האזורי פותחה כדי להעריך את צפיפות התאים המקומיים באגרגטים לא כדוריים, שבהם תקעים כדוריים קטנים (בקוטר 100 מיקרומטר) (המוצגים בצהוב) משמשים כמאינדיקטורים לצפיפות בכל אזור/עובי. (C) שיטת התקע האזורית המעודנת מרחבית משמשת למחקרי חדירה לתרופות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
בפרסום קודם, נקבעה שיטה למדידה לא הרסנית של צפיפות התאים הגלובלית בתוך אגרגטים תאיים באמצעות OCT10. כאן, טכניקה זו מורחבת כדי להעריך את צפיפות התאים האזורית של אגרגטים מתפתחים של תאים. איור 1 מראה שרטוט של הרחבה זו, שבה ניתן להעריך את צפיפות התא בשכבות קונצנטריות של ספרואיד או באופן מקומי יותר על ידי התבוננות במקום זאת בתקעים כדוריים קטנים (בקוטר 100 מיקרומטר), המסומנים על ידי העיגולים הצהובים באיור 1B,C. כדוריות הגידול MDA-MB-231 הוערכו בתחילה על ידי הגדרת נקודת מרכז בתוך הצבירה וספירת מספר העצמים/תאים בשכבות קונצנטריות עוקבות של הספרואיד. התוצאות האלה מוצגות באיור 2. בדיקת t של התלמיד גילתה צפיפות תאים גבוהה יותר באופן משמעותי בליבת הספרואיד מאשר בשכבות המעבר (p = 4.3e-4) ובשכבות החיצוניות (p = 4.0e-6). תוצאה זו מצביעה על דחיסה בליבת הספרואיד לאחר 4 ימים.

איור 2: הבדלים בצפיפות האזורית המחושבים לפי גישת השכבה הקונצנטרית עבור מצרפי MDA-MB-231 כדוריים. האיור ממחיש שיפוע של צפיפות תאים רדיאלית כאשר תאים (n = 3) ארוזים בצפיפות הרבה ביותר בליבת הצבירה, וצפיפות התאים המקומית יורדת עם המרחק מהליבה. ספירת התאים הכוללת הממוצעת מוצגת עם קו כחול. סרגל קנה המידה של התמונה הנכנסת הוא 100 מיקרומטר. הנתונים מוצגים כממוצע ± SD (*= p < 0.05, ***= p < 0.001). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
עם זאת, מגבלה של טכניקת שכבה קונצנטרית זו היא שניתן להשתמש בה רק על אגרגטים כדוריים. לפיכך, גישת ספירת התאים הותאמה כדי לבסס שיטת תקע אזורית, אשר דוגמת אזורים קטנים במיקומים רציפים באמצעות הצבר, בדומה לביופסיה וירטואלית. תקעים אלה מספקים מדידות של צפיפות התא המקומי בעומקים ספציפיים. טכניקה זו אומתה כנגד גישת השכבה הקונצנטרית על ידי ביצוע ניתוחים על אותם כדורי MDA-MB-231 (איור 3). התוצאות הראו הסכמה טובה בין גישות התקע האזורי והשכבה הקונצנטרית עבור אגרגטים כדוריים אלה. מבחני t של התלמיד לא חשפו הבדלים סטטיסטיים בין הגישות למדידת השכבות החיצוניות והשכבות המעבריות (p = 0.243 ו- 0.484, בהתאמה) והבדל קל אך משמעותי בעת חישוב הצפיפויות בליבת הצבירה (p = 0.017).
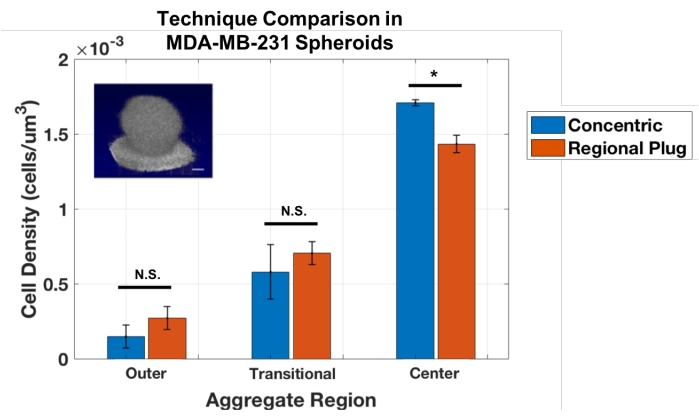
איור 3: גישות אזור קונצנטרי ותקע אזורי מספקות תוצאות דומות לכימות צפיפות התאים באגרגטים כדוריים מסוג MDA-MB-231 (n = 3). הנתונים מוצגים כממוצע ± SD (* = p < 0.05). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טכניקה זו יושמה לאחר מכן כדי להעריך הן אגרגטים של גידולים כדוריים והן לא כדוריים ביום 4 לבגרות (איור 4), תוך התבוננות במגמה דומה של דחיסת ליבה עבור כל המורפולוגיות שנבדקו, ללא קשר לסוג התא. מגמה זו בלטה בעיקר בדגימות שהוכנו עם Matrigel (מטריצת קרום המרתף), תוסף הידוע כמקדם צבירה אך הגורמים וההרכב האקסוגניים שלו מאופיינים בצורה גרועה 31,32,33. באופן מעניין, נראה כי הוספת המטריצה אינה משפיעה על הנפח או על ספירת התאים ולכן נראה שיש לה השפעה זניחה על התפשטות התאים. במקום זאת, נראה כי תוספת המטריצה מפיצה מחדש את צפיפות התאים, מקדמת דחיסת ליבה משמעותית ומפחיתה את צפיפות התאים בשכבות החיצוניות. תוצאות אלה מצביעות גם על כך שתאי AU565 נראים פחות רגישים להשפעות צבירה בתיווך מטריצה מאשר תאי MDA-MB-231. ממצאים אלה מספקים תובנה רבת ערך לגבי המנגנונים הפיזיקליים שבאמצעותם המטריצה מאפשרת צבירה של תאים בקווים שונים של תאי סרטן השד. חשוב לציין שגישת התקע האזורית צריכה להתאים לכל MCTS המציגים גיאומטריות צבירה כדוריות או לא כדוריות.

איור 4: תוספת מטריצה מקדמת יותר צבירה ומחלקת מחדש את צפיפות התאים בקווי תאים סרטניים. הן עבור קווי התאים MDA-MB-231 (A,B) והן עבור AU565 (C,D), הוספת מטריצה מפחיתה את הצפיפות באזור החיצוני ומגבירה את הדחיסה במרכז (n = 3) מבלי לשנות באופן ניכר את ספירת התאים הכוללת. ספירת התאים הכוללת הממוצעת מוצגת עם קווים כחולים. פסי קנה מידה משובצים = 100 מיקרומטר. נתונים המוצגים כממוצע ± SD (*= p < 0.05, **= p < 0.01, ***= p < 0.001). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לאחר מכן, גישת תקע אזורית זו שימשה למעקב אחר מוות תאי באגרגטים של גידולים שטופלו ב-TZM באופן לא הרסני. AU565 MCTS שהוכנו עם מטריצת הממברנה טופלו ב-TZM ביום 4 של הפיתוח, ועברו תרבית עד היום ה-9, עם נקודות זמן מרכזיות להדמיית OCT ב-0 שעות (טרום-תרופה), 24 שעות ו-120 שעות (5 ימים). שיטת התקע האזורי המוגדרת מרחבית יושמה בכל נקודת זמן, כאשר התקעים נקבעו כל 100 מיקרומטר לאורך כל העובי של כל צבירה, כפי שמוצג על ידי העיגולים הצהובים באיור 1C. גודלו של התקע המרכזי הוחזק קבוע בעוד שהתקע החיצוני הורשה להשתנות בקוטר, בהתאם לגודל האגרגטים המשתנה. תנודות קלות בצפיפות התאים נצפו לאורך זמן בתוך 500 מיקרומטר הפנימיים של כל צבירה, מה שמעיד על מוות מינימלי של תאים (איור 5). ואכן, רוב מקרי המוות של התאים התרחשו ב-200 מיקרומטר החיצוניים של כל צבירה, במיוחד ב-100 מיקרומטר החיצוניים ביותר, שנעלמו לחלוטין בנקודת הזמן של 120 שעות עבור כל הצברים שנותחו. ההדמיה של מוות תאי כתגובה תרופתית מעידה בעיקר בשכבות החיצוניות של MCTSs עולה בקנה אחד עם בעיות חדירת תרופות של TZM, תרופת נוגדנים רלוונטית מבחינה קלינית עם משקל מולקולרי של 145 kDa34. ואכן, התרופה מסתמכת על דיפוזיה פסיבית באמצעות מודלים תאיים צפופים אלה, מה שצפוי לאתגר את יכולתה לחדור לעומק של יותר מ-200 מיקרומטר לתוך המודלים.
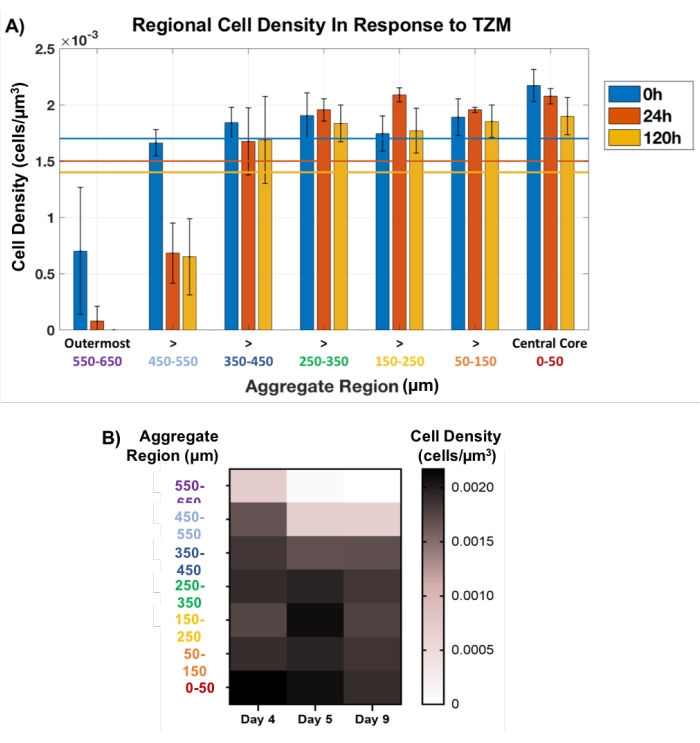
איור 5: כדאיות התאים בתגובה לתרופה, הנמדדת לאורך כל עובי הצבירה. התקע בליבה הפנימית נשמר קבוע בקוטר של 100 מיקרומטר, בעוד שבאזור החיצוני הותר להשתנות עם שינוי גודל הצבירה. (A) צפיפות תאים אזורית בתגובה לתוספת TZM גילתה כי מוות התאים היה מוגבל במידה רבה ל-200 מיקרומטר החיצוניים, במיוחד ל-100 מיקרומטר החיצוניים, שנעלמו לחלוטין לאחר 120 שעות של טיפול. העובי הפנימי של 500 מיקרומטר של האגרגטים הבחין בשינוי קטן בספירת התאים (n = 3). ספירת התאים הכוללת הממוצעת מוצגת עם קווים צבעוניים מתאימים עבור כל נקודת זמן. הנתונים מוצגים כממוצע ± SD. (B) תרשים מפת חום המייצג את השינוי בצפיפות התא הממוצעת בתגובה לתרופה כפונקציה של עובי הצבירה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
משמעות
כדוריות גידול רב-תאיות (MCTSs) הן מודלים תלת-ממדיים חזקים במבחנה לחקר התקדמות הגידול ובדיקת תרופות 1,2,3. קידום התועלת של מודלים מצטברים פשוטים יחסית אלה מסתמך במידה רבה על אפיון התכונות העיקריות שלהם, כגון מורפולוגיה וצפיפות תאים, אשר ידועים כמשפיעים הן על התקדמות מודל הגידול והן על התגובה הטיפולית. עם זאת, גודלם הנדרש מציב אתגרים בהערכת מאפיינים אלה, במיוחד עבור ניתוחים לא הרסניים. השיטה המוצגת מספקת כלי חדש לכימות אורכי ונטול תוויות של צפיפות התאים וכדאיותם בתוך אזורים בדידים של מודלים צפופים של צבירה תלת-ממדית. ניתן לצלם מחדש את אותו צבירה עם טומוגרפיה קוהרנטית אופטית (OCT) במשך מספר ימי פיתוח. ניתן לנתח סריקות נפחיות אלה כדי לאפיין כיצד צפיפות התאים מתפתחת באופן אזורי במהלך התבגרות MCTSs. אותם עקרונות חלים על ניתוח של אגרגטים מסוממים, אשר ניתן לדמותם לאורך כל משטר תרופות נתון כדי לקבוע היכן צפיפות התאים יורדת, כלומר, היכן התרופה עשויה להרוג תאים באופן פעיל. גישה זו משפרת באופן משמעותי את השיטות הקודמות לקבלת מידע דומה בקנה מידה של תאים, אשר באופן מסורתי דורש קיבוע, צביעה ו/או חתך, ובכך מונעת ניתוחי אורך. ואכן, לכלי זה יש פוטנציאל להפחית באופן דרמטי את מספר הדגימות הדרושות למחקר נתון, שכן ניתן לנתח את אותן דגימות ברצף. זה גם צפוי להכניס ערך מוסף בכל נקודת זמן, שכן ניתן לעקוב אחר ההתפתחויות בתוך צבירה אחת כשהוא מגיב לגירוי נתון, במקום להסתמך על נתונים מתואמים מדגימות סופניות תואמות גיל. מעבר ליישום MCTS זה שהודגם כאן, שיטת OCT-Imaris זו יכולה לחקור אגרגטים תאיים אחרים, גופים עובריים, אורגנואידים מורכבים יותר או דגימות רקמה בעובי של עד כמה מילימטרים. פרוטוקול זה ישפר את ההבנה של דחיסת תאים במהלך פיתוח אגרגטים ותגובת תרופות בתוך מודלים של אגרגטים צפופים.
שינויים
הפרוטוקול המוצג הותאם לניתוח מודלים של MDA-MB-231 ו- AU565 MCTSS. מודלים שנעשו באמצעות קווי תאים אחרים ישימים; עם זאת, ייתכן שיידרש אופטימיזציה מסוימת של הפרוטוקול עקב שינויים בגודל התא הממוצע ובמורפולוגיה של הצבירה. בוצע מחקר נפרד שבו תאי מד"א-MB-231 ו-AU565 צופו בדו-ממד והשיגו גודל תא ממוצע באמצעות מיקרוסקופיה. קוטר זה שימש כקוטר XY בתוך פונקציית "הכתמים" של אימאריס, כך שחפצים בגודל משוער זה נספרו. שינוי ערך זה משנה את מספר האובייקטים הממוקמים בתוך המדגם10, וצפויות תוצאות מדויקות יותר כאשר קלט זה תואם באופן הדוק את גודל התא. לפיכך, קוטר XY מתאים חייב להיות מעודכן על ידי גודל התא הממוצע עבור סוג התא המשומש.
שלבים קריטיים ופתרון בעיות
אחד השלבים הקריטיים במהלך הדמיית OCT הוא בחירת רזולוציית הסריקה. גודל הפיקסלים שהוגדר על-ידי המשתמש חייב להיות קטן מספיק כך שיהיה צורך בפיקסלים מרובים כדי להרכיב את הגודל הממוצע של סוג התא שבו נעשה שימוש. זה משפר את הדיוק של ניתוח "כתמים" בתוך אימאריס על ידי שיפור הרזולוציה של OCT של התאים והפחתת האפשרות שרעש פיקסלים סטוכסטי ישפיע לרעה על ספירת התאים.
בידוד הדגימה בתוך מסגרת הייחוס של אימריס משפיע מאוד על ערכי הפלט של צפיפות התא. כאשר המשתמש מבצע שלב זה, הוא מלווה ברמה של סובייקטיביות והטיה שיש ליישם באופן עקבי בכל ניתוחי המדגם. בעת בידוד המדגם בתוך סריקת הנפח כדי להתחיל בניתוח אימאריס, יש להקפיד לעקוב אחר קווי מתאר מצטברים במדויק ולהימנע מהכללת ממצאים (כלומר, השתקפויות ממצעים או מגובה המדיה).
מיקום נכון של מסגרות ייחוס במהלך ניתוח תקעים אזורי הוא צעד קריטי נוסף. כפי שצוין במבוא, שלושת האזורים הקריטיים שיש לנתח במהלך פיתוח המודל הם האזור החיצוני המתפשט, אזור המעבר המורכב מתאים סנסנטיים/קוויזנטיים, והליבה ההיפוקסית. המיקום של מסגרות הייחוס במרכז כל שכבה צפוי להניב את ההערכה המדויקת ביותר של צפיפות התאים באותו אזור. למיקום מסגרת ייחוס זה יש חשיבות רבה עוד יותר עבור ניתוחי התקעים האזוריים המפורטים המשמשים כאן למחקר התרופה, שכן יש לקבוע אזורים במרווחים שווים כדי לנתח את תגובת התרופה בצורה מדויקת יותר.
מגבלות ומחקרים עתידיים
המגבלה העיקרית של השיטה המוצעת היא מעקב פרוסה אחר פרוסה מבוסס משתמש המבוצע בתוך אימריס כדי לבודד את הצבירה בתוך סריקת נפח OCT. זהו צעד קריטי לתוצאות מדויקות, שהוא סובייקטיבי במקצת, ולכן צפוי להקנות רמה מסוימת של שונות בין משתמשים. כדי לטפל בכך, אנו מבקשים כעת לשלב אלגוריתם זיהוי קצה שבוצע בתוך Matlab (או דומה לו) לפני העלאת הסריקה לאימאריס. אלגוריתם זה אמור לזהות באופן אובייקטיבי קצוות דגימה בפרוסות סריקת B פרוגרסיביות, ולאחר מכן ניתן לבצע את הניתוחים המוצעים באזור מדגם מבודד מראש זה. טיפול במגבלה זו יסיר את השונות מבוססת המשתמש וצפוי להוביל לתחולה רחבה יותר של כלי מבוסס OCT זה.
היכולת של OCT לדמות במדויק תאים חיים בתוך אגרגטים במהלך הטיפול התרופתי מותנית באופן המוות התאי שבו פועלת התרופה. העבודה הקודמת חשפה אי דיוקים כמותיים בספירת התאים החיים שדווחו מ-OCT/Imaris בתגובה לדוקסורוביצין, תרופה אנטי-סרטנית ידועה שהורגת תאים באמצעות נמק ואפופטוזיס10. ההשערה היא שזה נובע משאריות קרומי התאים במהלך הנמק, אשר צפויים להופיע כתאים חיים במהלך הדמיה מבנית. ידוע כי TZM הורג תאים בעיקר באמצעות אפופטוזיס35; לכן, כאשר תאים מתים, הם חייבים להתפרק לחתיכות קטנות מספיק כדי לא להיות במעקב / נספר על ידי OCT. למרות שנדרשות בדיקות אימות נוספות עם תרופה אפופטוטית, ניסויי הפיילוט המוקדמים שלנו מראים את ההסכמה המצוינת של OCT/Imaris לספירת תאים מנותקת ב-MCTSs המסוממים ב-TZM (נתונים שלא פורסמו). לפיכך, תוצאות התאים החיים המוצגות כאן צפויות להיות מדויקות יותר מתרופות הגורמות לנמק. יש לזכור הבחנה זו כאשר מיישמים גישה זו לבדיקת כדאיות באגרגטים מסוממים.
מחקר עתידי בהערכה לא הרסנית של אגרגטי גידולים צפוי לשפר את ההבנה כיצד הם מתפתחים ומגיבים הן לגירויים חיצוניים והן לטיפול תרופתי. פיתוח כלים אנליטיים, כמו זה המוצג כאן, אמור להרחיב את התועלת של המודל ולשפר את דיוק התוצאות, במיוחד ביישומים בעלי השפעה כגון סינון תרופות והערכת אספקה/יעילות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי NIH R01 BRG CA207725 (MB/DTC) ו-NIH R01 CA233188 (MB). ברצוננו להודות לבית המרקחת AMC על הטרסטוזומאב שסופק לניסויים אלה.
Materials
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
References
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved