Method Article
药物治疗后肿瘤聚集体内区域细胞密度的无损评估
摘要
本方案开发了一种基于图像的技术,用于在3D肿瘤聚集体中快速,无破坏性和无标记的区域细胞密度和活力测量。研究结果揭示了细胞密度梯度,在发育中的聚集体中,核心区域的细胞密度高于外层,并且在用曲妥珠单抗处理的HER2 +聚集体中主要是外周细胞死亡。
摘要
多细胞肿瘤球状体(MCTS)模型已被证明对癌症进展和药物发现的 体外 研究越来越有用。这些相对简单的无血管构建体模仿 体内 肿瘤的关键方面,例如3D结构和病理生理梯度。MCTSS模型可以提供对球体发育期间和药物响应的癌细胞行为的见解;然而,它们所需的尺寸极大地限制了用于非破坏性评估的工具。探索光学相干断层扫描结构成像和Imaris 3D分析软件,以快速,无损和无标记地测量MCTS中的区域细胞密度。该方法用于评估 4 天成熟期的 MCTS,以及临床上相关的抗 HER2 药物曲妥珠单抗的 5 天延长治疗期间。简而言之,AU565 HER2 +乳腺癌MCTS 是通过 液体覆盖物创建的,无论是否添加Matrigel(基底膜基质),以探索不同形态的聚集体(分别为较厚的盘状2.5D聚集体或扁平2D聚集体)。在成熟的MCTS中表征了外部区域,过渡区域和内核内的细胞密度,揭示了与外层相比,核心区域具有更高细胞密度的细胞密度梯度。基质添加重新分配了细胞密度并增强了这种梯度,降低了外区密度并增加了核心中的细胞压实度。在逐渐深的100μm区域内进行药物治疗后(0小时,24小时,5天)的细胞密度定量,以评估药物反应的潜在区域差异。到最后一个时间点,几乎所有的细胞死亡似乎都被限制在每个聚集体的外200μm,而聚集体中更深处的细胞似乎基本上不受影响,这表明药物反应的区域差异可能是由于药物渗透的限制。目前的方案提供了一种独特的技术来无损量化致密细胞组织内的区域细胞密度并对其进行纵向测量。
引言
研究人员已经在很大程度上转向台式3D培养体外系统来研究肿瘤进展的一些关键特征。这项研究的大部分是由多细胞肿瘤球状体(MCTS)和更复杂的类器官1,2的重新出现引起的。虽然这些模型是无血管的,但它们为概括体内发生的生理和病理过程提供了强大的工具3,4,5。特别是,中型模型(直径300-500μm)可以模拟关键的肿瘤特征,例如3D结构,病理生理梯度和由于核心缺氧引起的转移信号传导。有据可查的是,这些模型显示了血管化体内肿瘤中的特征性同心层,即增殖细胞的外层,衰老/静止细胞的过渡层以及核心缺氧的细胞3,6,7,8,9.通过表征这些层内的细胞行为,在发育过程中和对药物的反应,可以从这些模型中获得独特的见解。然而,开发梯度所需的MCTS尺寸,使它们如此强大的体外模型所必需的,极大地限制了用于无损评估的工具。事实上,对MTCS进行非破坏性分析的最大挑战之一是量化细胞规模的细节。明场和相差显微镜通常用于无损评估3D MCTS的生长和发育。然而,这些模态仅限于2D投影,缺乏可视化这些模型的关键3D结构的能力10,11,12,13。关于细胞毒性和细胞增殖的信息通常通过荧光成像(即,光片显微镜、共聚焦显微镜)或离体免疫组织染色14、15、16收集。虽然这些方法提供了有关组织结构、细胞密度和细胞功能的有价值的高分辨率信息,但它们通常需要样品制备,例如光学清除、固定/染色或嵌入,以防止纵向分析。
光学相干断层扫描(OCT)是一种非破坏性结构成像方式,有可能克服上述一些挑战。它具有蜂窝分辨率和足够宽的视野(高达10 mm x 10 mm),能够可视化整个多细胞聚集体17,18,19。重要的是,由于所用光的可见性质,这种技术是完全非破坏性的,并且没有标签17。此外,样品可以在不需要样品制备的情况下 原位 成像,这样就可以直接从培养箱中取出样品,用OCT快速扫描(扫描持续时间约为5-10分钟),然后返回培养箱,从而实现纵向表征。最近出现了许多试图使用OCT来分析肿瘤球体行为的研究。在最令人兴奋的演示之一中,Huang等人使用OCT来无损检测大型肿瘤球体模型中的坏死核心,并指出活细胞和死细胞区域在光学衰减方面具有明显的差异,可用于无标记的生存能力监测20。类似地,Hari等人对用OCT成像的人类结肠癌(HCT116)球体进行了折射率(RI)测量,以研究样品21中缺氧的存在。他们的测量不足以进行直接推断,尽管他们确实在与坏死核心的部位相关(尽管不是大小)的位置观察到较低的RI,后来 通过 共聚焦显微镜识别出来。Abd El-Sadek等人使用OCT来可视化和量化乳腺癌肿瘤模型22的区域组织生存能力。他们报告了两种基于OCT的可视化组织动力学的方法,并显示这些指标的差异与显微镜识别的活/死细胞区域之间存在中等相关性。
我们发表的工作使用OCT建立在先前的文献的基础上,建立了一种定量的,非破坏性的方法,以在开发过程中测量MCTSs乳腺癌模型中的3D形态和细胞计数10,23。使用Imaris 3D渲染图像分析软件来计算OCT体积扫描中成像的细胞大小的物体(即斑点)的数量,在MCTS中无损测量细胞计数,这些计数在统计学上与在聚合解离时 通过 血细胞计数器确定的细胞计数相似。然而,由于OCT的结构性质,细胞因坏死而死亡后仍然存在的细胞膜可能被错误地计为活细胞。此外,这种表征被扩展到无损跟踪单个聚集体内的细胞活力,并受到有希望成功的药物治疗方案10。重要的是,值得注意的是,我们的OCT-Imaris方法报告了类似的细胞活力,并且在解离时对这些样品进行了基准测试。这种非破坏性和无标记的细胞方法使细胞能够在3D构建体和密集聚集体中纵向计数,而不会牺牲构建/聚集体结构。
本工作报告了一种改进的方法,通过利用OCT-Imaris测量3D聚集体形态和细胞数量的能力,直接量化密集聚集体中的区域细胞密度。这种方法学上的进步提供了MCTS模型的特征同心层内细胞空间分布和增殖的更详细的图片。这种局部密度测量不是简单地计算总体平均细胞密度,而是可以揭示细胞密度梯度,例如与压实相关的梯度。这种区域评估也适用于用化疗药物治疗的聚集体,以评估区域药物反应,通过局部细胞密度的变化来衡量。OCT和高级成像分析方法的这种组合提供了区域细胞活力的定量,可用于根据哪些区域经历细胞密度降低来探索药物渗透。这是第一份非破坏性地量化区域细胞密度和活力以响应致密细胞组织内药物并纵向测量的报告。这种对整个MCTS的三维细胞密度和空间分布的表征可能有助于优化癌症治疗中的药物递送,并提高对癌症模型进展的理解。
研究方案
AU565(HER2+)和MDA-MB-231乳腺癌细胞系用于本研究(见 材料表)。
1. 制备肿瘤聚集体
- 使用罗斯威尔公园纪念研究所(RPMI)1640基础培养基(+)在L-谷氨酰胺中制备AU565(HER2 +)乳腺癌细胞生长培养基,并补充10%(v / v)胎牛血清和1%青霉素/链霉素(见 材料表)。
- 使用Dulbecco的改良鹰培养基(DMEM)制备MDA-MB-231三阴性乳腺癌细胞生长培养基,并补充10%(v / v)胎牛血清(FBS),100 U / mL青霉素/链霉素和2mM L-谷氨酰胺(见 材料表)。
- 在标准条件(37°C,5%CO2,95%相对湿度)下制备两种细胞系的70%-90%汇合细胞培养物(约3-4天的制备)。按照标准胰蛋白酶消化方法从培养瓶中分离细胞单层。
注意:防止细胞过度暴露于胰蛋白酶,影响其活力。- 对于 AU565 细胞,使用移液器(或者,如果可用,使用 通过 管道连接到高压灭菌玻璃移液器吸头的真空泵)从烧瓶中吸出细胞培养基,并替换为 2 mL 胰蛋白酶-EDTA。将烧瓶在室温下放置3分钟,然后移至培养箱中再放置4分钟。然后,向烧瓶中加入6mL生长培养基以中和胰蛋白酶。
- 对于MDA-MB-231细胞,以与步骤1.3.1中相同的方式从烧瓶中吸取细胞培养基,并用1.5mL胰蛋白酶-EDTA代替。孵育7分钟后,向烧瓶中加入8.5mL生长培养基以中和胰蛋白酶。
- 向血细胞计数器中加入10μL细胞悬浮液以确定悬浮液24中的细胞数量。将细胞重悬于培养基中,所需浓度为2.5×105 个细胞/ mL。
- 将50μL细胞悬浮液分配到圆底,非粘附的96孔板的每个孔中。对于没有基质凝胶(基底膜基质,见 材料表)制备的悬浮液,向每个孔中加入50μL普通生长培养基。
- 对于用基底膜基质制备的悬浮液,从-20°C储存中取出基质小瓶并将其放入冰箱中解冻过夜。准备一个装有生长培养基的容器,冷藏10分钟以冷却。
- 使用冷冻的移液器吸头,将基质加入冷却介质中,使得该溶液的最终浓度为5%。向每个孔中加入50μL该培养基,使得这些孔中基质的最终浓度为2.5%3。
注意:在以前的工作中,评估了这些细胞系10,25的聚集体形态,发现MDA-MB-231聚集体在添加膜基质后形成球状体,而没有基质的MDA-MB-231培养物和AU565 + / -基质都形成盘状聚集体。使用从0(平面)到1.0(完美球体)的尺度上量化的>0.8的球形,以识别足够的球形聚集体,因此期望具有体内类似行为26,27的必要表面体积比。
- 接种后立即在室温下将板以123× g 离心10分钟,以确保在每个孔的底部收集细胞沉淀。
注意:此步骤必须在播种后尽快进行。作者观察到,这些步骤之间的时间过长,使细胞在每孔的底部和侧面沉降,抑制了它们在孔底部收集和聚集的能力。 - 将板孵育4天,此时细胞聚集体被认为是成熟的。
注意:用基底膜基质制备的AU565聚集体需要额外的5天培养期用于药物反应研究(总共9天,第4天更换培养基)。
2. 曲妥珠单抗(TZM)对AU565细胞聚集体的给药
- 在AU565生长培养基中制备500μg/ mL的TZM溶液(参见 材料表)。在第4天,向每个孔中加入10μL该溶液,使得每个孔内的最终浓度为50μg/ mL。
- 在添加TZM后再进行5天的培养,并在关键时间点进行评估。
注意:对于本研究,使用0小时(紧接用药前),24小时和120小时的时间点来分析药物。
3. 光学相干断层扫描成像
注意:本文的样品在成熟每天(1-4)期间用光学相干断层扫描(OCT)成像,然后在第5天(药物添加后24小时)和第9天(药物添加后120小时)再次对选定的药物聚集体进行成像。用于OCT成像的商业光谱域光学相干断层扫描(SDOCT,见 材料表)系统用于当前的研究。虽然这种方法几乎适用于任何OCT系统,并且所遵循的程序在不同系统之间通常相似,但以下一些详细步骤特定于当前设备。
- 利用 OCT 系统进行结构成像。将A扫描速率设置为5.5 kHz,以进行高分辨率图像采集。将液体介质中样品的折射率设置为 1.33。将体素大小设置为 1.10 x 1.10 x 2.58 μm3。
- 在屏幕右侧的 "图像参数" 窗口中,通过输入 X、Y 和 Z 值(以 mm 为单位)来设置视场 (FOV),以便样本包含在此感兴趣区域中。
注意:这些研究的视场通常设置为1.5 x 1.5 x 0.5 mm3。通过在 0 到 90 度之间交替"角度"输入并执行视觉确认,确保样品适合此区域。 - 单击 "3D 采集模式",然后单击" 记录 "以收集样品的 3D 体积扫描。
4. 图像分析
- 将OCT文件导出为软件格式(伊万里,参见 材料表)。
- 打开软件开发工具包中的 OCT 文件。单击" 导出",将文件类型设置为.jpg,然后将图像导出到空文件夹中。
- 打开图像处理软件(FIJI,请参阅 材料表),然后从存储导出的 JPEG 的文件夹中导入图像序列。使用软件将图像序列拼接在一起,然后将此文件另存为 TIFF 图像。
- 按照以下步骤创建卷重建。
- 打开伊万里,然后导航到竞技场内转换后的TIFF文件。转到 "编辑>图像属性" ,然后将 OCT 图像中的体素大小(以 μm 为单位)输入到相应的 XYZ 框中。然后,单击 "确定"。
注:在屏幕左侧的示例对象树中,取消选择" 音量 "选项卡以防止软件滞后。 - 单击对象树上方 的"添加新曲面 "。在树下方的菜单中,单击跳过 自动创建 并手动编辑。在 "显示调整 "窗口中,手动滑动红色和黑色箭头以增强样品与背景之间的对比度并改善样品可视化效果。
- 将"切片位置"调整到样品一条边缘的切片,即样品信号首次出现的位置。使用转义键将鼠标从"导航"模式更改为"选择"模式,然后单击" 绘制"。手动跟踪显示信号的区域的轮廓。
- 通过在输入框中输入下一个位置来推进切片位置。下一个位置必须比前一个位置进一步≤100切片到样品中。手动跟踪显示信号的区域。
- 通过样品的厚度重复步骤4.2.4,直到到达样品的另一边缘。然后,单击左侧菜单中的" 创建曲面 ",将这些切片拼接在一起并完成体积重建。
- 单击 "编辑",然后单击" 蒙版选择"。这将在"显示调整"窗口中创建一个仅包含隔离样品的新通道。现在可以在 "统计>详细 "选项卡中找到样本的形态学特征。
注:采用这种方法来确定本研究中报告的球形和体积。
- 打开伊万里,然后导航到竞技场内转换后的TIFF文件。转到 "编辑>图像属性" ,然后将 OCT 图像中的体素大小(以 μm 为单位)输入到相应的 XYZ 框中。然后,单击 "确定"。
- 按照以下步骤获得样品的总细胞密度。
- 在对象树上方,选择 "添加新点"。在 "算法设置" 菜单中,取消选择所有框。单击 蓝色箭头 以移动到源通道屏幕。
- 从显示的下拉菜单中,选择在步骤 5.2.8 中创建的屏蔽通道,通常名为通道 2。在 XY 直径框中输入样品的平均细胞直径。确保选中 "背景减法 "。
注意:对于 AU565 和 MDA-MB-231 电池的这项工作,直径设置为 10 μm。此选择基于单元格大小(在"讨论"部分中进行了说明)。
- 从显示的下拉菜单中,选择在步骤 5.2.8 中创建的屏蔽通道,通常名为通道 2。在 XY 直径框中输入样品的平均细胞直径。确保选中 "背景减法 "。
- 单击 蓝色箭头 以移动到 "分类点" 屏幕。在菜单底部的图形中,单击黄色阈值的左边缘并将其拖动到图形的左边缘,以便所有对象都包含在黄色阴影阈值中。然后,单击 绿箭头 以完成点创建。
- 通过单击 "统计">"总体>"总点数"来获取识别的对象数(即样本细胞计数)。
- 要确定平均聚集体细胞密度,请将聚集体的细胞计数(在步骤 4.3.3 中测量)除以聚集体积(在步骤 4.2.6 中确定)。
- 在对象树上方,选择 "添加新点"。在 "算法设置" 菜单中,取消选择所有框。单击 蓝色箭头 以移动到源通道屏幕。
- 评估球形聚集体同心层中的区域密度(图 1A).
- 在形态学和细胞密度分析之后,评估区域密度。单击在步骤 4.2.5 中创建的曲面,然后导航到曲面 样式/质量 选项卡。将选区更改为 中心点 ,并将像素宽度更改为≤20 以获得最佳可见性。导航到 "统计信息">"详细>位置 "并记录中心点的位置。
- 从对象树上方的菜单中选择 添加新参考框架 。选中菜单中 XY 旁边的 可见 和 修复 框。单击并拖动参考框图标的中心,使其与中心点对齐。取消选择"XY 可见 "和" 修复 "框,然后为 XZ 选择它们。
- 再次单击并拖动参考框图标的中心,使其与中心点对齐。最后,对 YZ 平面重复此操作,在这三个固定平面之间交替,直到参考系与中心点完全对齐。双击对象树中的参考框架,并将其重命名为 "居中" 或 "相似"。
- 单击在步骤 4.3 中创建的点,然后导航到 "统计信息>详细>位置参考帧"。单击 位置 X 参考帧, 直到它从最高值到最低值排序。记录最大值 - 这表示样本的最远边缘,即样本半径。
注意:由于此处使用的样本在XY平面上是圆形的,因此可以沿X或Y轴进行计算,结果相似。对于不表现出X-Y对称性的样品(不对称,椭球体,不规则几何形状等),建议沿多个轴执行这些分析。 - 导航到"统计信息"。在菜单的右下角,单击" 将所有统计信息导出到文件" ,然后将数据保存到电子表格中。
- 执行手动计算以识别沿 X 轴的同心层。
注:本研究中使用的样品直径约为500μm;因此,有两个外部200μm厚的同心区和一个内部100μm厚的中心区。建议保持200μm厚的区域,因为扩散行为预计会在此距离7,28,29,30内发生变化。为了与这一推理保持一致,还建议对较大的样品使用更多的同心区域,反之亦然。 - 通过在步骤 4.4.3 中找到的外半径减去 200 μm 来设置 200 μm 的外层区域。因此,外部区域将包含 X半径 和 X外侧内边缘 之间具有 X 位置的斑点(图 1A,橙色区域)。
- 通过从 X外侧、内边缘减去 200 μm 来设置过渡区域。过渡区域将包括 X外缘、内边缘和 X过渡内 边缘之间具有 X 位置的斑点(图 1A,粉红色区域)。
- 设置一个中心核心区域,包括样品中心和X过渡内边缘 之间的剩余点(图1A,蓝色区域)。
- 打开在步骤 4.4.4 中创建的已保存电子表格文件。导航到距原点参考框的距离选项卡。
- 使用函数"COUNTIF"(列x,"< X过渡,内边缘")计算核心区域中的点数,其中列 x 是"与原点参考帧的距离"列。结果值是此区域中的像元编号。将此值除以该区域的体积以获得细胞密度。
- 以类似的方式,使用"COUNTIF(列x,"<X外侧,内边缘")计算过渡区域中的单元格数 - COUNTIF(列x,">X过渡,内边缘")。
- 使用"COUNTIF(列 x,">X 过渡,内边缘")计算外部区域中的单元格数。
- 通过"区域插头"评估非球形样品中的区域细胞密度(图1B)。
注意:对于没有同心层的非球形样品,开发了"区域堵塞"方法,以在整个聚集体的不同径向深度对局部细胞密度进行采样。- 重复步骤4.4.1-4.4.3以设置中心参考系(图1B,中心黄色圆圈)并获得总样品半径。
- 执行手动计算以确定过渡区域和外部区域内参考系的位置,以便可以在这些位置的样品中评估细胞密度。
- 要计算外部位置,请从步骤4.5.1的样品半径值中减去50μm,并将此值用作X位置。
注意:对于给定样品中的所有插头,使用步骤4.5.1中记录的相同的Y和Z位置值,以测量样品X轴上的细胞密度(图1B,最左侧的黄色圆圈)。 - 在对象树上方,单击 "添加新点" ,然后单击" 跳过自动创建,手动编辑"。当指针处于"选择"模式时,按住Shift键并单击以在屏幕上放置一个点。在左侧菜单中,输入上面计算的 XYZ 位置值。将 XY 和 Z 直径调整为 ≤20 以获得最佳可见性。
- 重复步骤 4.4.2 以在此点位置添加参考框。将此参考系重命名为对象树外部或类似名称。
- 要计算过渡(中点)位置,请查找 X中心 位置值和 X外部 位置值的平均值。使用此值作为过渡参考系的 X 位置。如上所述,对于给定样品中的所有塞子,使用步骤4.5.1中记录的相同Y和Z值来测量样品X轴上的细胞密度(图1B,中间黄色圆圈)。
- 重复步骤4.4.2将中间参考系放在此位置,一旦创建,将其重命名为"过渡"或类似名称。
- 要计算外部位置,请从步骤4.5.1的样品半径值中减去50μm,并将此值用作X位置。
- 单击在步骤 4.3 中创建的点,然后导航到 统计信息。在菜单的右下角,单击" 将所有统计信息导出到文件" ,然后将数据保存到电子表格中。
- 打开电子表格。导航到距原点参考框的距离选项卡。每个对象到参考系的距离显示在 A 列中,每个对象的参考帧分组显示在列 G 中,使用 'MOD' 函数以数字方式将每个距离分配给其相应的参考系,其中 0 是中心帧,1 是过渡帧,2 是外部。
- 过滤此列中的值以处理每个参考系中的距离。对于每个参考帧,使用函数"COUNTIF(列x,"≤50")计算帧 50 微米范围内的对象数,其中列 x 是每组的"距原点参考帧的距离"列。生成的值对应于该区域插头中的像元数。将此值除以100μm插头的体积以获得细胞密度。
- 执行空间优化区域插头方法(图 1C)。
注意:该方法用于评估响应药物应用的区域细胞活力。包含更多参考系可提高能够在整个模型厚度中计算的像元密度的分辨率。- 重复步骤4.4.1-4.4.3以设置中心参考系(图1C,中心黄色圆圈)并获得样品半径。
- 执行手动计算以确定其他感兴趣的位置。为此,请在 X中心 值上添加 100 μm,然后使用中心点的 Y 和 Z 值沿中心轴定义第一个位置。将参考框架添加到此位置,如步骤4.4.2所示(图1C,与中心圆相邻的黄色圆圈)。
注意:如果寻求更高分辨率的密度跟踪,则在此步骤中添加较少的μm。 - 重复步骤4.6.2,向每个连续的X位置添加100μm(或所需数量的μm),以在样品的厚度上建立一个等间距的塞子轴。将最后一个参考系放置在距离样品外半径≤50μm(图1C,黄色圆圈)。
- 重复步骤4.5.3-4.5.5以获得每个100μm直径插头内的细胞计数。将这些值除以每个相应插头的体积,以获得局部细胞密度。
- 对在药物试验的每个时间点收集的OCT数据重复本节中的所有步骤。比较整个治疗过程中每个位置的细胞计数应揭示细胞密度下降的位置(即经历细胞死亡的区域),以及药物穿透的深度(即,哪些层看到细胞密度下降 与那些保持或显示细胞密度水平增加的层)。
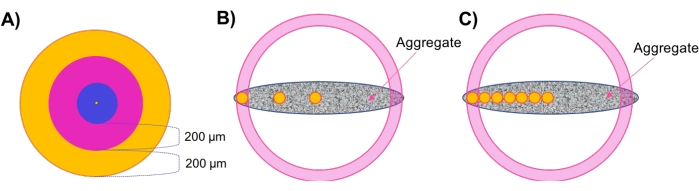
图 1:示意图 (A) 用于评估球形聚集体中区域细胞密度的同心层(壳)方法。(B) 开发了区域塞子法来评估非球形聚集体中的局部细胞密度,其中使用小的(直径100μm)球形塞子(以黄色显示)作为每个区域/厚度的密度指标。(C) 在药物渗透研究中采用空间细化的区域插头方法。 请点击此处查看此图的大图。
结果
在先前的出版物中,建立了一种使用OCT10对细胞聚集体内全局细胞密度进行非破坏性测量的方法。在本文中,该技术被扩展为评估发育中的细胞聚集体的区域细胞密度。图1显示了该扩展的示意图,其中可以通过观察小的(直径为100μm)的球形塞子(用图1B,C中的黄色圆圈表示)来评估细胞密度。MDA-MB-231肿瘤球体最初通过在聚集体内设置中心点并计数球体连续同心层中的物体/细胞数量来评估。这些结果如图 2 所示。学生的t检验显示,球体核心的细胞密度明显高于过渡层(p = 4.3e-4)和外层(p = 4.0e-6)。该结果表明4天后球芯被压实。

图 2:通过同心层方法计算球形 MDA-MB-231 集料的区域密度差异。 该图显示了径向细胞密度梯度,其中细胞(n = 3)在聚集体核心中的密度最大,并且局部细胞密度随着与核心的距离而减小。平均总细胞计数以蓝线显示。插图的比例尺为 100 μm。数据显示为±标清的平均值(*= p < 0.05,***= p < 0.001)。 请点击此处查看此图的大图。
然而,这种同心层技术的局限性在于它只能用于球形聚集体。因此,调整细胞计数方法以建立区域堵塞方法,该方法通过聚集体在顺序位置对小区域进行采样,类似于虚拟活检。这些插头提供特定深度的局部细胞密度测量。通过在相同的MDA-MB-231球体上进行分析,针对同心层方法验证了该技术(图3)。结果表明,对于这些球形骨料,区域塞子和同心层方法之间具有良好的一致性。学生的 t检验显示,测量外层和过渡层的方法之间没有统计学差异(p = 0.243和0.484),并且在计算聚集岩心的密度时存在微小但显着的差异(p = 0.017)。
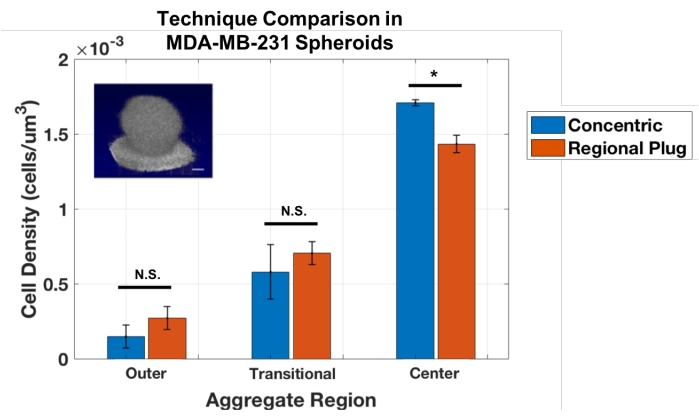
图 3:同心区域和区域插头方法为量化球形 MDA-MB-231 聚集体中的细胞密度提供了类似的结果 (n = 3)。 数据显示为±标清的平均值(* = p < 0.05)。 请点击此处查看此图的大图。
然后将该技术应用于在成熟期的第4天评估球形和非球形肿瘤聚集体(图4),观察到所有测试的形态的相似核心压实趋势,无论细胞类型如何。这种趋势在用Matrigel(基底膜基质)制备的样品中最为突出,Matrigel是一种已知可促进聚集的添加剂,但其外源性因素和组成表征较差31,32,33。有趣的是,基质的添加似乎不会影响体积或细胞计数,因此似乎对细胞增殖的影响可以忽略不计。相反,基质添加似乎重新分配了细胞密度,促进了显着的核心压实并降低了外层的细胞密度。这些结果还表明,AU565细胞对基质介导的聚集效应的敏感性低于MDA-MB-231细胞。这些发现为基质使细胞聚集在不同乳腺癌细胞系中的物理机制提供了有价值的见解。重要的是,区域插头方法应适合任何显示球面或非球面集料几何形状的 MCTS。

图4:基质添加促进更多的聚集并重新分配癌细胞系中的细胞密度。 对于MDA-MB-231(A,B)和AU565(C,D)细胞系,基质添加会降低外部区域的密度并增加中心(n = 3)的压实度,而不会明显改变总细胞计数。平均细胞总数以蓝线显示。插入比例尺 = 100 μm。数据显示为±标清平均值(*= p < 0.05,**= p < 0.01,***= p < 0.001)。 请点击此处查看此图的大图。
接下来,这种区域性塞子方法用于无损跟踪TZM治疗的肿瘤聚集体中的细胞死亡。在发育的第4天用TZM处理用膜基质制备的AU565 MCTS,并培养至第9天,在0小时(药物前),24小时和120小时(5天)具有关键的OCT成像时间点。在每个时间点应用空间定义的区域插头方法,在每个聚集体的整个厚度中每100μm设置一次插头,如图 1C中的黄色圆圈所示。中心塞子的尺寸保持不变,而外部塞子的直径允许波动,对应于骨料尺寸的变化。随着时间的推移,在每个聚集体的内部500μm内观察到细胞密度的微小波动,表明最小的细胞死亡(图5)。事实上,大多数细胞死亡发生在每个聚集体的外侧200μm,特别是在最外层的100μm中,对于所有分析的聚集体,它在120小时的时间点完全消失。细胞死亡作为指示性药物反应的可视化主要在MCTS的外层与TZM的药物渗透问题一致,TZM是一种临床相关的抗体药物,分子量为145 kDa34。事实上,该药物依赖于通过这些致密细胞模型的被动扩散,预计这将挑战其穿透超过200μm进入模型的能力。
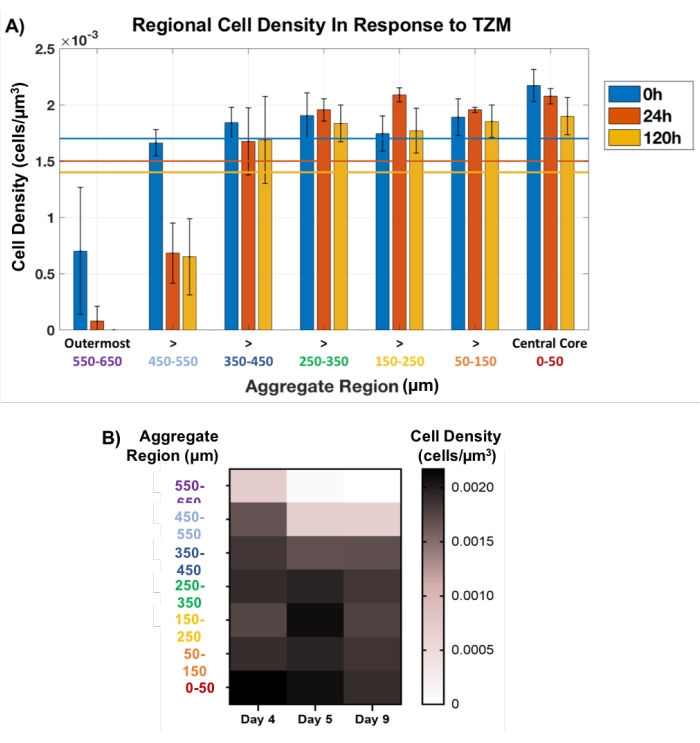
图5:细胞对药物的响应活力,在整个聚集体厚度中测量。 内芯的塞子保持在直径100 μm的恒定水平,而外层的塞子则允许随着骨料尺寸的变化而波动。(A)响应于TZM添加的区域细胞密度显示,细胞死亡在很大程度上限制在外部200 μm,特别是外部100 μm,其在处理120 h后完全消失。聚集体的内部500μm厚度观察到细胞计数变化很小(n = 3)。每个时间点的平均总细胞计数都用相应的彩色线条显示。数据显示为平均±SD.(B)热图图,表示响应药物的平均细胞密度的变化作为聚集体厚度的函数。 请点击此处查看此图的大图。
讨论
意义
多细胞肿瘤球体(MCTS)是用于研究肿瘤进展和药物筛选1,2,3的强大3D体外模型。推进这些相对简单的聚合模型的实用性在很大程度上依赖于其关键特征的表征,例如形态学和细胞密度,已知这些特征会影响肿瘤模型的进展和治疗反应。然而,它们所需的尺寸在评估这些特征时带来了挑战,特别是对于非破坏性分析。该方法为在密集3D聚集模型的离散区域内对细胞密度和活力进行纵向和无标记定量提供了一种新工具。同一骨料可以在多个开发日内使用光学相干断层扫描(OCT)重新成像。可以分析这些体积扫描,以表征MCTS成熟期间细胞密度如何区域演变。这些相同的原理适用于药物聚集体的分析,可以在整个给定的药物方案中纵向成像,以确定细胞密度在哪些方面正在下降,即药物可能在哪些地方积极杀死细胞。这种方法显着改善了先前获取类似细胞规模信息的方法,传统上需要固定,染色和/或切片,因此排除了纵向分析。事实上,该工具有可能大大减少给定研究所需的样本数量,因为相同的样本可以连续分析。预计这也将在每个时间点引入附加值,因为当单个聚合响应给定刺激时,可以在单个集合中跟踪发展,而不是依赖于来自年龄匹配的终端样本的相关数据。除了本文演示的MCTS应用之外,这种OCT-Imaris方法可以研究其他细胞聚集体,胚芽体,更复杂的类器官或厚达几毫米的组织样品。该协议将提高对聚集体发育过程中细胞压实的理解以及密集聚集模型中的药物反应。
修改
所提出的协议针对MDA-MB-231和AU565 MCTSS模型的分析进行了优化。使用其他细胞系制作的模型适用;然而,由于平均细胞大小和聚集体形态的变化,可能需要一些方案优化。进行了另一项研究,其中MDA-MB-231和AU565细胞在2D中接种 并通过 显微镜获得平均细胞大小。该直径被用作Imaris"斑点"函数中的XY直径,因此计算了这种近似大小的物体。更改此值会更改位于样本10 中的对象数,并且当此输入与像元大小紧密匹配时,预期结果会更准确。因此,合适的XY直径必须由所用细胞类型的平均细胞大小来告知。
关键步骤和故障排除
OCT 成像过程中的关键步骤之一是选择扫描分辨率。用户设置的像素大小必须足够小,以便需要多个像素来构成所用单元格类型的平均大小。这提高了Imaris内部"斑点"分析的准确性,提高了OCT对细胞计数的分辨率,并降低了随机像素噪声对细胞计数产生负面影响的可能性。
在伊万里思参考系内分离样品会极大地影响细胞密度的输出值。当用户执行此步骤时,它伴随着一定程度的主观性和偏差,必须始终如一地应用于所有样品分析。在体积扫描中分离样品以开始Imaris分析时,必须注意准确跟踪聚集体轮廓,并避免包含伪影(即来自基板或介质高度的反射)。
在区域插头分析期间正确放置参考系是另一个关键步骤。如引言所述,在模型开发过程中要分析的三个关键区域是增殖性外部区域,由衰老/静止细胞组成的过渡区域和缺氧核心。在每层中心放置参考系有望对该区域内的细胞密度进行最准确的估计。这种参考系的位置对于本文用于药物研究的详细区域塞子分析更为重要,因为必须建立均匀间隔的区域才能更准确地分析药物反应。
局限性和未来研究
所建议方法的主要限制是在 Imaris 中执行基于用户的逐个切片跟踪,以隔离 OCT 卷扫描中的聚合。这是获得准确结果的关键步骤,这有点主观,因此预计会带来一定程度的用户间差异。为了解决这个问题,我们目前正在寻求在将扫描上传到Imaris之前,在Matlab(或类似)中执行的边缘检测算法。该算法应客观地识别逐行B扫描切片中的样品边缘,然后可以对该预隔离的样品区域进行所提出的分析。解决此限制将消除基于用户的可变性,并有望使这种基于OCT的工具具有更广泛的适用性。
在药物治疗期间,OCT在聚集体内准确成像活细胞的能力取决于药物操作的细胞死亡模式。先前的工作揭示了OCT / Imaris报告的活细胞计数在响应阿霉素时的定量不准确,多柔比星是一种着名的抗癌药物, 通过 坏死和凋亡杀死细胞10。据推测,这是由于坏死过程中剩余的细胞膜,预计在结构成像过程中会出现活细胞。已知TZM主要 通过 细胞凋亡35杀死细胞;因此,当细胞死亡时,它们必须分解成足够小的碎片,以免被OCT跟踪/计数。虽然需要使用凋亡药物进行进一步的验证测试,但我们早期的试点实验表明,在用TZM(未发表的数据)下药的MCTS中,OCT/Imaris与解离细胞计数非常吻合。因此,本文提出的活细胞结果预计比诱导坏死的药物更准确。在将这种方法应用于药物聚集体的可行性测试时,必须牢记这一区别。
未来对肿瘤聚集体进行无损评估的研究有望提高对它们如何发展和响应外部刺激和药物治疗的理解。分析工具的开发,如本文介绍的工具,应扩大模型的实用性并提高结果准确性,特别是在药物筛选和递送/疗效评估等有影响力的应用中。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了美国国立卫生研究院R01 BRG CA207725(MB / DTC)和NIH R01 CA233188(MB)的支持。我们要感谢AMC药房为这些实验提供的曲妥珠单抗。
材料
| Name | Company | Catalog Number | Comments |
| 96 well plates | Greiner Bio-One | 650970 | CellStar Cell-Repellent Surface, https://shop.gbo.com/en/usa/products/bioscience/cell-culture-products/cellstar-cell-repellent-surface/ |
| 0.25% trypsin, 2.21 mM EDTA | Corning | 25-053-CI | |
| AU565 breast cancer cells | ATCC | ||
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| FIJI software | open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| Hemocytometer | Fisher Scientific | 0267151B | |
| Imaris image analysis software | Bitplane | Current version 9.8 | |
| L-glutamine | Lonza | 17-605E | |
| Matrigel | Corning | 354263 | |
| MDA-MB-231 breast cancer cells | ATCC | ||
| Microscope | Zeiss | Z1 AxioVision | |
| Penicilin streptomycin | Corning | 30-0002CI | |
| Plate centrifuge | Eppendorf | ||
| RPMI medium 1640 | Gibco | 11875-085 | |
| Spectral Domain Optical Coherence Tomography | ThorLabs | TEL220C1 | |
| T75 cell culture flasks | Greiner Bio-One | 658175 | |
| Trastuzumab | Remnant clinical samples of Trastuzumab were used in this study, generously gifted by the Albany Medical College Pharmacy. |
参考文献
- Sutherland, R., JA, M., Inch, W. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. Journal of the National Cancer Institute. 46 (1), 113-120 (1971).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Nagelkerke, A., Bussink, J., Sweep, F. C. G. J., Span, P. N. Generation of multicellular tumor spheroids of breast cancer cells: How to go three-dimensional. Analytical Biochemistry. 437 (1), 17-19 (2013).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Hirschhaeuser, F., et al. Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148 (1), 3-15 (2010).
- Jiang, Y., Pjesivac-Grbovic, J., Cantrell, C., Freyer, J. P. A multiscale model for avascular tumor growth. Biophysical Journal. 89 (6), 3884-3894 (2005).
- Freyei, J. P., Sutherland, R. M. Regulation of growth saturation and development of necrosisin EMT6/R0 multicellular spheroids by the glucose and oxygen supply. Cancer Research. 46 (7), 3504-3512 (1986).
- Desoize, B., Jardillier, J. C. Multicellular resistance: a paradigm for clinical resistance. Critical Reviews in Oncology Hematology. 36 (2-3), 193-207 (2000).
- Mellor, H. R., Ferguson, D. J. P., Callaghan, R. A model of quiescent tumour microregions for evaluating multicellular resistance to chemotherapeutic drugs. British Journal of Cancer. 93 (3), 302-309 (2005).
- Roberge, C. L., et al. Non-destructive tumor aggregate morphology and viability quantification at cellular resolution, during development and in response to drug. Acta Biomaterialia. 117, 322-334 (2020).
- Piccinini, F., Tesei, A., Bevilacqua, A. Single-image based methods used for non-invasive volume estimation of cancer spheroids a practical assessing approach based on entry-level equipment. Computer Methods and Programs in Biomedicine. 135, 51-60 (2016).
- Imamura, Y., et al. Comparison of 2D- and 3D-culture models as drug-testing platforms in breast cancer. Oncology Reports. 33 (4), 1837-1843 (2015).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 1-13 (2018).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7 (9), 819-830 (2012).
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integrative Biology. 3 (1), 31-38 (2011).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
- Huang, D., et al. Optical coherence tomography HHS public access. Science. 254 (5035), 1178-1181 (1991).
- Zhong, H. Q., et al. Enhancement of permeability of glycerol with ultrasound in human normal and cancer breast tissues in vitro using optical coherence tomography. Laser Physics Letters. 7 (5), 388-395 (2010).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Hari, N., Patel, P., Ross, J., Hicks, K., Vanholsbeeck, F. Optical coherence tomography complements confocal microscopy for investigation of multicellular tumour spheroids. Scientific Reports. 9 (1), 1-11 (2019).
- El-Sadek, I. A., et al. Three-dimensional dynamics optical coherence tomography for tumor spheroid evaluation. Biomedical Optics Express. 12 (11), 6844(2021).
- Kingsley, D. M., et al. Laser-based 3D bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomateralia. 95, 357-370 (2019).
- Absher, M. Hemocytometer counting. Tissue Culture. , 395-397 (1973).
- Roberge, C. L., Rudkouskaya, A., Barroso, M., Corr, D. T. Longitudinal, label-free assessment of cell density and viability in multicellular tumor spheroids via optical coherence tomography. Summer Biomechanics, Bioengineering, and Biotransport Conference. , (2020).
- Bellotti, C., Duchi, S., Bevilacqua, A., Lucarelli, E., Piccinini, F. Long term morphological characterization of mesenchymal stromal cells 3D spheroids built with a rapid method based on entry-level equipment. Cytotechnology. 68 (6), 2479-2490 (2016).
- Noto, A., et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells. Cell Death & Disease. 4 (12), 947(2013).
- Riffle, S., Hegde, R. S. Modeling tumor cell adaptations to hypoxia in multicellular tumor spheroids. Journal of Experimental & Clinical Cancer Research. 36, 102(2017).
- Wilson, W. R., Hay, M. P. Targeting hypoxia in cancer therapy. Nature Reviews Cancer. 11, 393-410 (2011).
- Grimes, D. R., Kelly, C., Bloch, K., Partridge, M. A method for estimating the oxygen consumption rate in multicellular tumour spheroids. Journal of the Royal Society Interface. 11 (92), 20131124(2014).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology & Therapeutics. 163, 94-108 (2016).
- Pozzi, S., et al. Meet me halfway: Are in vitro 3D cancer models on the way to replace in vivo models for nanomedicine development. Advanced Drug Delivery Reviews. 175, 113760(2021).
- Nguyen, E. H., Daly, W. T., Belair, D. G., Le, N. N., Murphy, W. L. High throughput screening format identifies synthetic mimics of matrigel for tubulogenesis screening. , Available from: https://abstracts.biomaterials.org/data/papers/2015/abstracts/547.pdf (2015).
- Duchnowska, R., Szczylik, C. Central nervous system metastases in breast cancer patients administered trastuzumab. Cancer Treatment Reviews. 31 (4), 312-318 (2005).
- Zazo, S., et al. Generation, characterization, and maintenance of trastuzumab-resistant HER2+ breast cancer cell lines. American Journal of Cancer Research. 6 (11), 2661-2678 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。