Method Article
Podosit Proteinleri Nephrin, Actin ve Podocin'in Genleşme Mikroskopisi ile Görüntülenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Sunulan yöntem, floresan etiketli hücresel proteinlerin, geleneksel bir mikroskopta 70 nm çözünürlüğe yol açan genleşme mikroskopisi ile görselleştirilmesini sağlar.
Özet
Glomerüler endotel, glomerüler bodrum membranı ve podositlerden oluşan glomerüler filtrenin bozulması albüminüri ile sonuçlanır. Podosit ayak prosesleri, podocin gibi sitoskeletal adaptör proteinlerine bağlanan aktin demetleri içerir. Podocin gibi adaptör proteinleri, nefrin gibi glomerüler yarık diyaframın omurgasını aktin sitoskeleton'a bağlar. Bu ve diğer podositik proteinlerin lokalizasyonunu ve işlevini incelemek, glomerüler filtrenin sağlık ve hastalıktaki rolünün anlaşılması için gereklidir. Sunulan protokol, kullanıcının geleneksel bir mikroskopta süper çözünürlüklü görüntüleme ile hücrelerde akrin, podokin ve nefrin görselleştirmesini sağlar. İlk olarak, hücreler geleneksel bir immünoresans tekniği ile lekelenir. Numunedeki tüm proteinler daha sonra kovalently şişme bir hidrojel'e tutturulır. Proteinaz K ile sindirim yoluyla, yapısal proteinler son adımda jelin izotropik şişmesine izin vererek bölünür. Numunenin suda diyaliz edilmesi, numunenin 4-4,5 kat genişlemesine neden olur ve numune geleneksel bir floresan mikroskobu ile görüntülenebilir ve 70 nm'lik potansiyel bir çözünürlük sağlar.
Giriş
Albüminüri kardiyovasküler riskin taşıyıcı bir parametresidir ve glomerüler filtrenin bozulmasından kaynaklanır1. Glomerüler filtre fenestratlı endotel, glomerüler bodrum zarı ve podositlerin oluşturduğu yarık diyaframdan oluşur. Podositlerin birincil ve ikincil ayak süreçleri glomerulum2'ninkılcal duvarının etrafına sarılır. Ayak proseslerinin hassas yapısı, birden fazla yarık diyafram proteini ve diğer adaptör proteinleri için çapa görevi gören kortikal akrin demetleri tarafından korunur2. Yarık diyaframın omurga proteinine nephrin denir ve karşıt podositlerin nefrin molekülleriyle homofilik bir şekilde etkileşime girer. Çeşitli adaptör proteinleri aracılığıyla, nephrin aktin sitoskeleton2,3ile bağlantılıdır. Nefrin kodlayıcı gen NPHS1'deki mutasyonlar Finlandiya tip4'ünnefrotik sendromuna yol açar.
Nephrin'in etkileşime giren proteinlerinden biri, stomatin ailesinin saç tokası benzeri bir proteini olan podocin3. Podocin lipid salları için nephrin işe ve actin sitoskeleton5bağlar . Podocin NPHS2 geni tarafından kodlanmıştır. NPHS2'deki mutasyonlar steroid dirençli nefrotik sendroma yol açar6.
Akin adaptör proteinlerini görselleştirmek ve birlikte lokalize etmek için immünofluoresans teknikleri kullanılabilir. Ne yazık ki, ışığın kırınım bariyeri geleneksel floresan mikroskopların çözünürlüğünü 200-350 nm7ile sınırlar. Yeni mikroskopi teknikleri, örneğin uyarılmış emisyon tükenmesi (STED)8, foto-aktif lokalizasyon mikroskopisi (PALM)9, stokastik optik rekonstrüksiyon mikroskopisi (STORM veya dSTORM) veya zemin durumu silme mikroskopisi ve ardından bireysel molekül dönüşü (GSDIM) 9,10,11, yaklaşık 10 nm'ye kadar bir çözünürlük sağlar. Bununla birlikte, bu süper çözünürlük teknikleri çok pahalı mikroskoplar, iyi eğitimli personel gerektirir ve bu nedenle birçok laboratuvarda mevcut değildir.
Genleşme mikroskopisi (ExM), geleneksel mikroskoplarla süper çözünürlüklü görüntüleme sağlayan ve büyük bir araştırma topluluğu için potansiyel olarak kullanılabilen yeni ve basit bir tekniktir12. Protein tutma genleşme mikroskopisinde (proExM), ilgi örneği (hücreler veya doku) sabitlenir ve floroforlarla lekelenir13. Numune içindeki proteinler daha sonra küçük bir molekül (6-(((Acryloyl)amino)heksanoik asit, süksinimsal ester, AcX) tarafından koordine bir şekilde şişme bir hidrojel13'etutturulr. Proteinaz K (ProK) ile enzimmatik sindirim yoluyla, proteinler ve floroforlar genişlemeden sonra jel içindeki göreceli konumlarınıkorurlar 13. Jelin şişmesi sonrasında, numune 4,5 kata (90 kat hacimsel genleşme) kadar genişleyerek yaklaşık 60-70 nm (300 nm/4,5) etkili bir yanal çözünürlüğe sahiptir. Bu tekniğin modifikasyonları, geleneksel mikroskoplarda14,15,16'da20-30 nm çözünürlük oluşturarak 10 kat genişlemeye(1.000kat hacimsel genişleme) bile izin verebilir.
Fare ve insan böbreklerinin glomerüler yapıları ExM17ile görselleştirilmiştir. Bu yazıda, geleneksel bir floresan mikroskobu kullanarak F-actin ve aksin adaptörü protein podocin'in süper çözünürlüklü görüntülerini görselleştirmek için ayrıntılı bir proExM protokolü sunuyoruz.
Protokol
1. Hücrelerin bölünmesi ve tohumlama
- %10 fetal baldır serumu (FCS), steril Fosfat tamponlu salin (PBS) ve steril tripsin dahil olmak üzere steril Dulbecco Modifiye Eagle's Medium 'u (DMEM) 37 °C'ye ısıtın. Temiz bankı aktif hale getir.
- Steril tokmaklar kullanarak her kuyuya bir steril cam kapak kayması (10 mm) ekleyerek 6 kuyulu bir plaka hazırlayın.
- Temiz tezgahın altına Cos7 hücreli 10 cm hücre kültürü yemeği koyun. Temiz tezgahın altında, bir vakum cihazı kullanarak hücrelerin ortamını aspire edin.
- Angüle edilmiş hücre kültürü çanasını bir elinizde tutun ve hücrelerin durulamasını önlemek için hücre kültürü çanağının yanına 10 mL steril PBS ekleyin. PBS'nin tüm hücre kültürü çanasını durulaması için hücre kültürü çanasını yere koyun.
- PBS'yi çıkarın ve hücre kültürü çanağının ortasına 1 mL tripsin ekleyin ve 37 °C'de 5 dakika kuluçkaya yatırın.
- %10 FCS dahil olmak üzere 10 mL DMEM ekleyerek ve hücreleri manuel olarak ayırmak için bir pipetle hücre çözeltisini yukarı ve aşağı pipetle kapatarak trypnizasyon reaksiyonunu durdurun.
- Sayım odası kullanarak mililitre başına hücre numarasını analiz edin.
- Cam kapağın üzerine kuyu başına 2 mL ortamda 68.000 hücre tohumu 6 kuyu plakasında kayar. Plakayı yatay ve dikey olarak dikkatlice sallayarak hücreleri 6 kuyu plakası içinde dağıtın.
NOT: Hücreler dağınık olarak uzanmalıdır. - %5 CO2ile 37 °C inkübatörde hücreleri bir gecede kuluçkaya yatırın.
2. Hücrelerin transeksiyon
- İki steril 1,5 mL tüp hazırlayın (biri seyreltilmiş DNA (A) için ve diğeri katyonik lipid transfeksiyon (B) için seyreltilmiş reaktif için). Pipet 0.75 μg nefrin ve 0.75 μg podocin cDNA ekspresyon plazmid kuyu başına bir 1.5 mL tüp içine ve kuyu başına 100 μL azaltılmış serum ortamına seyreltin. İkinci 1,5 mL tüpe kuyu başına 3 μL katyonik lipid transfeksiyon reaktifi ekleyin ve 100 μL azaltılmış serum ortamı ile seyreltin. Her iki reaksiyona da oda sıcaklığında 5 dakika kuluçkaya yatır.
- Her iki reaksiyoni (A ve B) bir DNA lipit kompleksinde birleştirin ve oda sıcaklığında 20 dakika kuluçkaya yatır. Her kuyuya 200 μL DNA-lipit kompleksi ekleyin.
- Transfected hücreleri 37 °C'de, ortamı değiştirmeden 48 saat boyunca% 5 CO2 ile kuluçkaya yatırın.
3. Hücresel yapıların immünoblabeling
- Bir sabitleme çözeltisi (PBS'de %4 (w/v) paraformaldehit, 1 mL/kuyu), permeabilizasyon çözeltisi (PBS'de %0,5 (w/v) Triton X-100, 1 mL/well) ve bir engelleme çözeltisi (PBS'de %5 (v/v) sığır serum albümini, 1 mL/kuyu) hazırlayın.
- Ortamı bir vakum cihazıyla çıkarın. Ekstra ortamı çıkarmak için her kuyuya 2 mL PBS ekleyin. PBS'i tamamen aspire edin.
NOT: Hücrelerin PBS ile yıkanmasını önlemek için, PBS'yi doğrudan cam kapak kaymasına değil pipetle yıkadığından emin olun. - PBS'de çözünmüş %4 (w/v) paraformaldehit (PFA) içeren hücreleri oda sıcaklığında 10 dakika boyunca sabitlayın.
NOT: Alternatif olarak, hücreleri% 3 (v / v) glioksial-etanol18'desabitler. - Cam kapak kaymalarına doğrudan pipetlemekten kaçınarak PFA'yı atın ve hücreleri PBS'de iki kez (her biri 2 mL) yıkayın. Sabit hücreleri ODA sıcaklığında 10 dakika boyunca PBS'de Triton X-100%0,5 (w/v) ile permeabilize edin.
- Permeabilizasyon çözeltisini çıkarın ve adım 3.2'de belirtildiği gibi PBS ile iki kez yıkayın.
- PBS'de oda sıcaklığında 1 saat boyunca %5 (v/v) BSA'nın 1 mL'sini ekleyerek hücreleri engelleyin. Hücreleri 4 °C'de bir gecede birincil antikorun 200 μL'si (PBS'de % 1 (v/v) BSA'da 1:200 anti-podokin antikoru) ile kuluçkaya yatırın.
NOT: Alternatif olarak, birincil antikoru oda sıcaklığında 1 saat kuluçkaya yatırın. - Birincil antikoru çıkarın ve adım 3.2'de olduğu gibi PBS ile üç kez yıkayın. İkincil antikor (keçi anti-tavşan Alexa 488 1:1000 içinde 1% (v/v) BSA PBS) oda sıcaklığında 1 saat için ekleyin. Bir kutu kullanarak hücreleri karanlıkta tutun.
- İkincil antikorları atın ve PBS ile üç kez yıkayın.
- PBS'yi çıkarın ve hücreleri oda sıcaklığında 1 saat boyunca PBS'de% 1 (v/ v) BSA'da 1:100 μL anti-nefrin antikoru ile kuluçkaya yatırın. PBS ile üç kez yıkayın. Bir kutu kullanarak hücreleri karanlıkta tutun.
- PBS'yi çıkarın ve oda sıcaklığında 1 saat boyunca ikincil antikor eşek anti-gine domuzu 633, 1:200 ile kuluçkaya yatırın. PBS ile üç kez yıkayın. Bir kutu kullanarak hücreleri karanlıkta tutun.
4. Genleşme mikroskopisi
- Hazırlık
- Jelleşme odası için ara parçaları oluşturmak için, cam kapak kaymalarını #1.0 ve #1.5'i elmas bir bıçak kullanarak 5 mm çizgiler halinde (cam slayt başına dört) kesin. #1,5 mm kapak kayması şeritlerini cam bir kaydıraktan 2,5 cm uzunluğunda bir kare oluşturacak şekilde yerleştirin ve bir boyama odasınayerleştirin (Şekil 2A1-C1). Pipet bir damla ddH2O kare köşelerine cam kapak kayma şeritleri birbirine ve cam slayta yapışmak için (Şekil 2A2-C2).
NOT: Yapışıklık kuvveti kaybolacağı için ddH2O'nun tamamen kurutılmasından kaçının. Gerekirse, daha fazla ddH2damlacık uygulayın #1. - #1,5 mm kapak kaymalarına kapak kayması başına dört #1,0 cam kapak kayması şeridi yerleştirin. Her #1,5 mm kapak kayması şeridine bir damlacık pipet takarak şeritleri yapıştırın (Şekil 2A3-C3).
NOT: Protokolün ilerlemesinde kullanımı kolaylaştırmak için jelin kalınlığı en az 0,15 mm olmalıdır. Bununla birlikte, hücrelerin üstünde aşırı jel olmasını önlemek için, aralayıcıların yüksekliğini hücre alt tabakasına yakın tutun. #1.5 ve #1.0 kapak kayması şeritlerini aralayıcı olarak kullanarak, ara uzayların yüksekliği yaklaşık 0,3 mm olacaktır. Hücreler kapak camına yapışır (yükseklik 0,12 mm). Bu nedenle, jel işlemek için yeterince kalın olacaktır, ancak #1.0 ve #1.5 kapak cam şeritleri aralayıcı olarak kullanılarak hücrelerin üstündeki aşırı jelden kaçınılır. - Jelasyon odası kapağı için, bir kapak camını (#1,5) parafin filmi ile sarın. Parafin filmi üzerinde herhangi bir kıvrım veya kirden kaçının (Şekil 2A5-C5).
- Jelleşme odası için ara parçaları oluşturmak için, cam kapak kaymalarını #1.0 ve #1.5'i elmas bir bıçak kullanarak 5 mm çizgiler halinde (cam slayt başına dört) kesin. #1,5 mm kapak kayması şeritlerini cam bir kaydıraktan 2,5 cm uzunluğunda bir kare oluşturacak şekilde yerleştirin ve bir boyama odasınayerleştirin (Şekil 2A1-C1). Pipet bir damla ddH2O kare köşelerine cam kapak kayma şeritleri birbirine ve cam slayta yapışmak için (Şekil 2A2-C2).
- Ankraj ve polimerizasyon (jelleşme)
- Bağlantı arabelleği hazırlayın (bkz. Tablo 1). Ankraj tedavisi için PBS'yi kuyu başına 250 μL ankraj tamponu ile doğrudan cam kapak kayması üzerine değiştirin ve oda sıcaklığında 3 saat kuluçkaya yatırın. Bir kutu kullanarak substratı karanlıkta tutun.
NOT: Alternatif olarak, oda sıcaklığında gece boyunca kuluçkaya yatırın. Her deney için taze ankraj tamponu hazırlayın ve düzgün bir şekilde çözünene kadar 10-15 dakika bekleyin. 6-((Acryloyl)amino)heksanoik asit, süksinimimidyl ester (AcX) yeterli ankraj sağlamak için her 4-5 ayda bir değiştirilmelidir. - Ankraj tamponu çıkarın ve kuyu başına 1,5 mL PBS ile bir kez yıkayın.
- Akrin liflerini lekelemek için ExM uyumlu bir phalloidin çözeltisini çözün ve phalloidini (PBS/kuyuda% 1 (v/v) BSA'nın 195 μL'sinde seyreltilmiş 5 μL phalloidin) oda sıcaklığında 45 dakika kuluçkaya yatırın. Bir kutu kullanarak örnekleri karanlıkta tutun.
- Bu arada, sodyum akrilatını karıştırma cihazı kullanarak ddH2O'da çözün. Buz üzerinde monomer çözeltisini hazırlayın (bkz. Tablo 1).
NOT: Çözünmüş sodyum akrilat net ve renksiz bir çözelti olmalıdır. Çözelti sarı ise, yeni sodyum akrilit ile değiştirin. - Jelleşme çözeltisini buz üzerinde hazırlayın (bkz. Tablo 1). Jelasyon çözeltisi jelleşme odasına uygulanmadan hemen önce jelleşme çözeltisine pipet amonyumperoksisidsülfat (APS).
- Phalloidin'i hücrelerden çıkarın ve oda sıcaklığında iki kez 1,5 mL PBS ile yıkayın. Numunenin cam kapak kayması üzerinde çıkarılmasını kolaylaştırmak için kuyunun içinde 1,5 mL PBS bırakın.
- Kapak camındaki hücreleri, kapak camı kaymasını 6 kuyulu plakadan kaldırmak için tokalar ve bir kanül kullanarak jelleşme odasına yerleştirin.
NOT: Hücreler cam kapak kaymasının üstünde olmalıdır. Cam kapak kayması ara parçalarına dokunmamalıdır. - Jelleşme çözeltisine aps ekleyin ve kısa süre içinde girdap. Pipet 200 μL jelleşme çözeltisi numune üzerinde (Şekil 2A4-C4). Jel içindeki hava kabarcıklarından kaçınarak jelleşme odasını dikkatlice kapatın (Şekil 2A5-C5).
- Jelleşme odasını ıslak boyama odasında polimerize etmek için 37 °C'de en az 1 saat kuluçkaya bırakın.
- Bağlantı arabelleği hazırlayın (bkz. Tablo 1). Ankraj tedavisi için PBS'yi kuyu başına 250 μL ankraj tamponu ile doğrudan cam kapak kayması üzerine değiştirin ve oda sıcaklığında 3 saat kuluçkaya yatırın. Bir kutu kullanarak substratı karanlıkta tutun.
- Homojenizasyon (sindirim)
- Leke haznesini inkübatörden çıkar. Jelasyon odası kapağını açmak için, kapak ve aralayıcı arasına bir jilet takın. Kapağı dikkatlice çıkarın. Araları jiletle çıkarın ve jiletle keserek tüm ekstra jeli ortadan kaldırın.
- Jel ve kapak camı ile slaytı PBS ile dolu bir tabağa koyun. Hafifçe sallayarak, müstakil kapak camını jelden çıkarın. Jeli tabaktan kolayca çıkarmak için, jeli slayda tutturmak için jelin altına slaydı koyun.
- Jel slayttayken, jeli jilet kullanarak küçük parçalara bölün (jelin çeyreği iki ila üç parçaya ayrılır). Bir parça jeli cam tabanlı 6 kuyulu bir tabağa hafifçe itin ve bir boya fırçasıyla katlayın. Jelin susuz kalmasını önlemek için boya fırçasını kullanarak jeli biraz PBS ile nemlendirin.
NOT: Hücreler aşağı doğru bakacaktır. - Ters mikroskop kullanarak, genişletmeden sonra genişletme faktörünü belirlemek için düşük sayısal diyafram açıklığına sahip genel bakış görüntüleri alın.
- Sindirim arabelleği hazırlayın (bkz. Tablo 1). Sindirim çözeltisini almak için sindirim tamponunda Proteinaz K ila 4 U/mL seyreltin.
NOT: Proteinaz K içermeyen sindirim tamponu 1-2 hafta boyunca 4 °C'de saklanabilir. - Her kuyuya 500 μL sindirim çözeltisi ekleyin ve jeli çözeltinin içine daldırın. Oda sıcaklığında gece boyunca sindirin ve numuneleri karanlıkta tutarak kapağı kapatın.
NOT: Alternatif olarak, 1 saat boyunca 37 °C'de sindirin.
- Genişleme
- Sindirim solüsyonunu bir pipetle çıkarın ve atın. 1 mL ddH2O ekleyin Daldırma jelini oda sıcaklığında 10 dakika kuluçkaya bırakın.
- Suyu çıkarın ve 1 mL taze ddH2O ekleyin.
NOT: 4,5 kata kadar numune genişlemesi elde edilebilir. Jel optik olarak netleşir.
- Görüntüleme
- Suyu jelden çıkarın ve doğrudan mikroskopiye başlayın. Ters mikroskop kullanarak, öncelikle genişleme öncesi durumda görüntülenmiş hücreleri bulmak için bir hava hedefi (düşük büyütme) kullanın (adım 4.3.4).
- Daha iyi çözünürlük için 40x (yağ/su) ve 63x hedefe geçin. İlginin dalga boyu ile heyecanlandırın ve görüntüyü kamera üzerinden alın.
- Doğrulama
- Örneğin genel bir görüntüsünü alın. 4.3.4 adımında görüntülenmiş örnekteki yapıları bulun ve eşleştirin. Doğrulama için en iyi sinyal-gürültü oranına sahip kanalı kullanın (Şekil 3 A-B).
NOT: Genişletilmemiş durumda elde edilen görüntüde olduğu gibi benzer parlaklık elde etmek için görüntüleme parametrelerini ayarlayın (adım 4.3.4). - ImageJ ile döndürerek ve kaydırarak genişletme öncesi ve sonrası görüntüleri kaplayın. Açıkça tanımlanabilir yapılar arasındaki mesafeleri ölçmek için ImageJ'deki mesafe ölçüm aracını kullanın. En az 10 farklı yapıyı ölçün.
NOT: Alternatif olarak,14'te açıklandığı gibi mesafeleri ölçmek için bir Python komut dosyası kullanın. - Genişletme sonrası/öncesi ölçümleri bölerek genişleme faktörünü hesaplayın.
- Bozulmaları belirlemek için, daha yüksek sayısal diyafram açıklığına sahip görüntüler çekin (Şekil 4A-B). Bu görüntüleri kaplayın ve ImageJ ile veya15'te açıklandığı gibi analiz edin.
NOT: Bozulmaların tespiti rutin olarak yapılmalıdır, ancak her numunede mutlaka yapılmamalıdır.
- Örneğin genel bir görüntüsünü alın. 4.3.4 adımında görüntülenmiş örnekteki yapıları bulun ve eşleştirin. Doğrulama için en iyi sinyal-gürültü oranına sahip kanalı kullanın (Şekil 3 A-B).
Sonuçlar
Bu proExM protokolünün kavramı ve zamanlaması Şekil 1'de tasvir edilmiştir. 5. günde, transfected hücreler ilgi proteinini hedefleyen floresan antikorlarla sabitlenir ve lekelenir (Şekil 1A,B). 6. günde, AcX ile tedavi tüm proteinler üzerinde amin gruplarının oluşumuna yol açar (floroforlar dahil) (Şekil 1A,B)12. Hidrojel polimerizasyonu üzerine, bu amin grupları hidrojele doğrusal olarak bağlanır (gün 6). Jelin polimerizasyonundan sonra, hücrenin yapısal proteinlerinin yok edilmesine neden olan proteinaz K ile homojenizasyon (sindirim) gerçekleştirilir (gün 6, Şekil 1A,B). Floresan etiketli antikorlar sindirimden sonra çoğunlukla korunur. Yapısal proteinlerin bozulması nedeniyle, hidrojelin su diyalizi, 7. günde hidrojel içindeki hücrenin izotropik genişlemesine neden olur (Şekil 1A,B). Numunenin görüntülenmesi geleneksel floresan mikroskop ile gerçekleştirilir (Şekil 1A). Genişletme faktörünü belirlemek ve bozulmaları dışlamak için veri doğrulaması yapılmalıdır (Şekil 1A).
Hücrenin izotropik olarak genişlemesini gerçekleştirmek için jelleşme adımı gereklidir. Şekil 2 bir jelasyon odasının yanal ve üst görünümünü gösterir. Cam kapak kaymaları jelleşme odasının ara tabaklarını oluşturur(Şekil 2A1-3/C1-3). Sabit ve lekeli hücrelere sahip kapak camı, hücreler yukarı doğru bir cam slayda yerleştirilmiştir(Şekil 2A4-C4). Jelasyon odasının kapağı parafilm ile sarılır ve kapalı kabarcık içermez (Şekil 2A5-C5).
Bu ExM protokolü dört kata kadar genişleme sağlar. Genişleme faktörünü belirlemek için, genişlemeden önce ve sonra hücrelerin görüntülenerek belirlenmesi esastır (Şekil 3A + B). Yetersiz ankraj ve homojenizasyon hücrelerin bozulmasına ve yırtılmasına yol açabilir. Şekil 4A + B, farklı büyütme görüntülerinde yırtılmış hücrelerin temsili örneklerini göstermektedir.
Bu yöntem, F-actin ve akrin adaptör proteinlerinin, örneğin podocin ve nefrin(Şekil 5)birlikte lokalizasyonunu araştırmak için kullanılabilir. Podocin yeşil, actin ise mavi ile etiketlenmiştir (Şekil 5). Nephrin yeşil ile işaretlenmiştir. Beyaz alanlar birlikte yerelleştirmeyi gösterir.
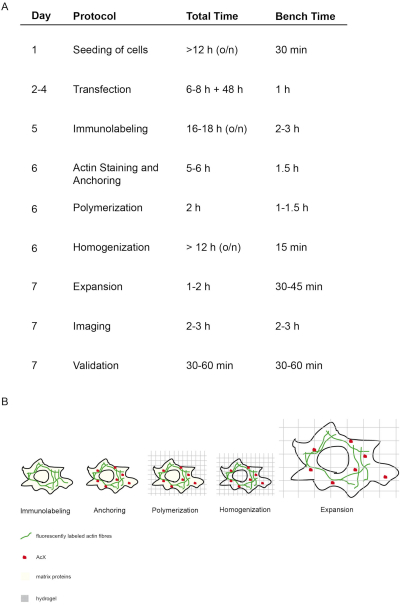
Şekil 1: Bu ExM protokolünün kavramı ve zamanlaması. (A) "Protokol" sütununda, protokolün her adımı özetlenmiştir. (A + B) Hücrelerin tohumlama ve transfeksiyondan sonra immünofluoresan etiketlemesi yapılır (İmmün etiketleme). (A + B) Küçük molekül AcX (kırmızı nokta) tüm proteinlere bağlanır ve bunları hidrojel 'e (Ankraj) tutturır. (A + B) Polimerizasyon yoluyla floroforlar da dahil olmak üzere tüm proteinler AcX aracılığıyla hidrojel (Polimerizasyon) ile birlikte bağlanır. (A + B) Homojenizasyon yapısal matris proteinlerinin sindirimine yol açar. (A + B) Genleşme suda diyaliz ile sağlanır. (A) Görüntüleme ve görüntülemenin doğrulanması deneyi sonuçlandırmaz. (A) Protokolün tamamı, birçok kuluçka adımıyla (günlük toplam süre sütun "toplam süre") 7 gün (sütun "gün") gerektirir, ancak gerçek tezgah süresi ilgili sütun "tezgah süresi"nde belirtildiği gibi çok daha azdır. 14 'tendeğiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
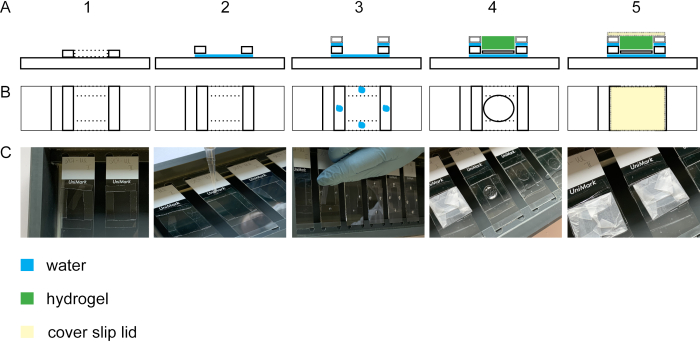
Şekil 2: Jelasyon odasının inşası. Dört #1,5 kapak şeridine sahip bir cam kaydırağın yan görünümü (A1) ve üst görünümü (B1 + C1). Cam slayt ve kapak kayması şeritleri arasına bir damla su ekleyerek, şeritler cam slayda yapışır(yan görünüm A2, üst görünüm B2, C2). #1.5 kapak çizgilerindeki su damlacıkları, #1.5 kapak çizgilerinin üzerine yerleştirilmiş #1.0 kapak çizgilerinin yapıştırılmasına yol açar(yan görünüm A3, üst görünüm B3, C3). Kapak fişi üzerindeki örnek, kanatçıklar kullanılarak dikdörtgenin ortasına yerleştirilir. Jel üstte pipetlenmiştir(yan görünüm A4, üst görünüm B4, C4). (A5) Parafilme sarılmış bir kapak kaymasından yapılmış kapalı kapak da dahil olmak üzere monte edilmiş jelasyon odasının yan görünümü ve üst görünümü (B5 ve C5). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
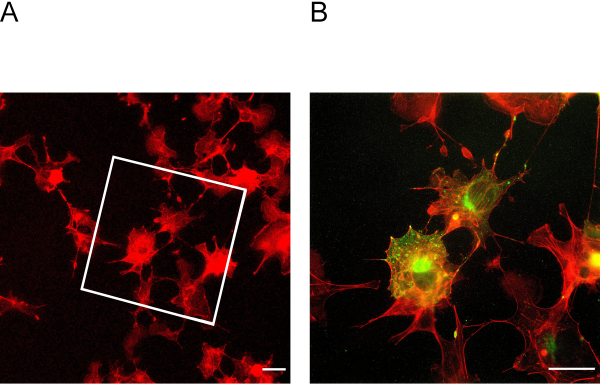
Şekil 3: Genişlemeden önce ve sonra hücreler. (A) Genişlemeden önceki hücreler akredin için boyanmıştır. Kutu, Şekil 3B'deki genişletilmiş hücrelerin hangi alanda olduğunu gösterir. (B) Genişlemeden sonraki hücreler kırmızıda aksin ve yeşil podokin için lekelenir. Podocin hücre çevresinde aksin ile birlikte lokalize olur. Ölçek çubuğu = 5 μm, genişleme faktörü = 2. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Hücrelerin bozulmaları ve yırtılmaları. (A + B) Aksinin (kırmızı) için immün lekeli cos7 hücrelerinin temsili mikroskobik görüntüleri. Hücreler sabitlendi, lekelendi, tutturuldu, sindirildi ve genişletildi. (A) Hücrelerin yırtılmaları. Oklar yırtılmış alanları gösteriyordu. Ölçek çubuğu = 5 μm, genişleme faktörü = 4. (B) Hücrelerin yırtılması ve bozulması. Beyaz oklar yırtılmış alanları gösteriyordu. Ölçek çubuğu = 5 μm, genişleme faktörü = 4. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
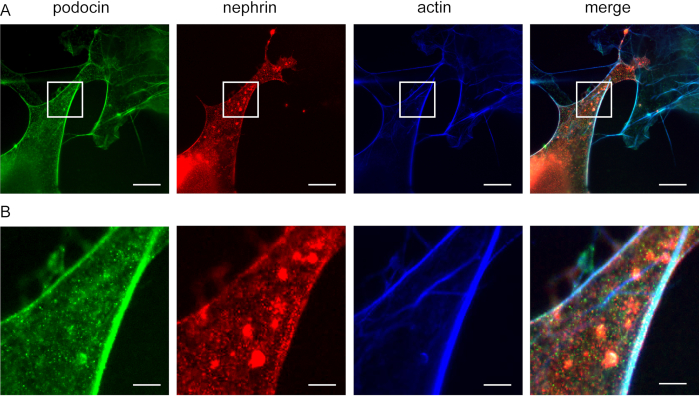
Şekil 5: Podocin nephrin ve actin ile birlikte lokalize olur. Cos7 hücreleri immünoresantrik olarak podokin, aksin ve nefrin için etiketlenmiştir. (A) ExM ile podokin (yeşil), aksin (mavi) ve nefrin (kırmızı) için boyanmış Cos7 hücreleri. Podocin, actin ve nephrin ile birlikte lokalize olur. Ölçek çubuğu = 200 nm, genişletme faktörü = 4. (B) Belirtilen alanın büyütümü (A), Ölçek çubuğu = 40 nm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bağlantı arabelleği | nihai konsantrasyon | ||
| NaHCO3 | 150 mM | ||
| Akrilil-X, SE (Acx) | 0,1 mg/ml | ||
| Monomer çözümü | Stok çözelti konsantrasyonu g/100 ml | miktar (ml) | son konsantrasyon (g/100 ml) |
| sodyum akrilat | 38 | 2.25 | 8.6 |
| akrilamid | 50 | 0.5 | 2.5 |
| N,N'-Metilennebisacrylamide | 2 | 0.75 | 0.15 |
| sodyum klorür | 29.2 | 4 | 11.7 |
| Pbs | 10x | 1 | 1x |
| Su | 0.75 | ||
| Toplam | 9.4 | ||
| Jelleşme çözümü | Stok çözelti konsantrasyonu | miktar (μl) | son konsantrasyon (mg/ml) |
| monomer çözelti | Na | 190 | Na |
| Aps | 10% | 4 | 0.1 |
| TEMED | >99% | 4 | 0.1 |
| Su | Na | 2 | Na |
| Toplam | 200 | ||
| Sindirim çözümü | nihai konsantrasyon | ||
| Tris Cl, pH 8.0 | 1 M | ||
| EDTA pH 8.0 | 0,5 M | ||
| Triton X-100 | 0.005% | ||
| Guanidin HCL | 8 M | ||
| Su | |||
| proteinaz K | 4 U/ml |
Tablo 1: ExM için Çözümler.
Tartışmalar
Sunulan yöntem, araştırmacının hücresel proteinleri, örneğin podocin, nephrin ve sitoskeletal bileşenleri, örneğin F-actin'i görselleştirmesini sağlar. Bu protokolde, transfected cos7 hücreleri, yarık diyafram proteinlerinin F-actin ile etkileşimini incelemek için bir model olarak kullanılır. Ne yazık ki, ölümsüzleştirilmiş podosit hücre hatları yeterli miktarda yarık diyafram proteinini ifade etmez19.
Bu yöntemle hücresel proteinler geleneksel floresan mikroskop kullanılarak nano ölçekli çözünürlükle görselleştirilebiliyor. Protokoldeki en kritik adımlar şunlardır: 1) protein amin gruplarının AcX ile hidrojele yeterince tutturulması, 2) hidrojelin yeterli polimerizasyonu, 3) sindirim için optimal zamanlama ve 4) uyumlu floroforların seçimi.
Genleşme sırasında proteinin hidrojel içindeki konumunu korumak için hücresel proteinlerin hidrojel'e tutturulması bu yöntem için gereklidir. AcX, hücre ve dokulardaki amin protein gruplarına bağlanan küçük bir moleküldür. AcX, proteinlerle karbon-karbon çift bant oluşturarak, polimerizasyon adımı20'deproteinlerin hidrojel içine dahil edilmesine olanak tanır. AcX ayrıca antikorları entegre eder, böylece acx tedavisinden önce immünofluoresans antikorları ile etiketleme yapılabilir. Yetersiz ankraj, hücrelerin yırtılmasına ve bozulmasına neden olabilir. Amin gruplarının fiksatifler tarafından değiştirilmesi nedeniyle, fiksatif veya fiksasyon zamanını optimize etmek gerekir. Ek olarak, yetersiz depolama veya optimize edilmemiş ankraj koşulları yırtılmalara ve bozulmalara neden olabilir. Deneyimlerimize dayanarak, AcX 3-4 aydan fazla kullanıldığında en uygun etkisini kaybeder.
Jelin polimerizasyonu sıcaklığa bağlıdır. Bu nedenle, jelleşme odasına pipetlemeden önce polimerizasyon çözeltilerini buz üzerinde tutmanızı öneririz. Ek olarak, erken jel oluşumunu önlemek için jelleşme adımının kullanım süresi kısa (5 dakikadan az) tutulmalıdır. Polimerizasyon çözeltisinin iyice karıştırılması düzensiz polimerizasyonu önler. Hava kabarcıkları numuneye dokunurken genleşme sürecini etkileyecek ve daha fazla polimerizasyon çözeltisi eklenerek önlenebilir.
Hücresel proteinlerin hidrojel içine dahil edildikten sonra, genişlemeyi sağlamak için mekanik homojenizasyon adımına (veya sindirime) ihtiyaç vardır. Isı ve deterjan veya enzimatik sindirim gibi farklı yöntemler mevcuttur ve araştırılan numune12, 14,20'yegöre özelleştirilmelidir. Bu protokolde enzmatik sindirim için proteaz Proteinaz K kullanılır. Proteinaz K, floresan antikorlar da dahil olmak üzere diğer proteinlerin çoğunu korurken yapısal proteinleri yok etmek için yeterli bir dozajda uygulanır12. Sindirim eksikse, örnek genişletme yetersizdir. Ek olarak, numune genişletme işlemi sırasında yırtılabilir (Şekil 3). Yetersiz bir numune genişlemesi meydana gelmişse, su değişimi önerilir. Alternatif olarak, enzymatic sindirim süresi ayarlanabilir veya Proteinaz K'nin yeni bir aliquot'u açılabilir.
Örnek aşırı sindirilirse, floresan sinyalleri azalır. Bu durumda sindirim süresi azaltılmalıdır. Genel olarak ExM'de, numunenin hacimsel genişlemesi nedeniyle hacim birimi başına floresan sinyal yoğunluğu azalır14. Bu nedenle, görüntüleme sırasında daha uzun maruz kalma süreleri göz önünde bulundurulmalıdır.
ExM uyumlu floroforları seçmek önemlidir. Siyanin boyaları polimerizasyon sırasında bozulur adım13. Bakteriyokromlara dayanan floresan proteinler de büyük ölçüde yok edilir13. Bununla birlikte, GFP benzeri proteinlerin çoğukorunacaktır 13. Ek olarak, streptavidin ayrıca küçük bir molekül etiketi13aracılığıyla S-nitrolysation gibi çeviri sonrası modifikasyonları etiketleyerek ön genişletme uygulanabilir.
Aktin sitoskeleton hedeflemek için küçük bir etiketleme molekülü olan phalloidin, ExM21ile uyumlu değildir. Phalloidinin yetersiz ankrajını aşmak için, üç değerli ankraj (TRITON)21. Bu yaklaşım, biyomoleküllerin eşzamanlı olarak hedeflenerek, etiketlenerek ve aşılandırarak21.
Bu yöntem, RNA moleküllerini lekelenecek şekilde değiştirilebilir (ExFish)22. Yinelemeli genleşme mikroskopisinde (iExM) veya X10 mikroskopide, ilk genişletilmiş hidrojel içinde ikinci bir şişme jel uygulanarak veya farklı bir hidrojel kullanılarak tek bir genleşme adımı yapılarak 60-70 nm çözünürlük yaklaşık25nm'ye kadar uzatılabilir 15,16. Ultrayapı genleşme mikroskopisi (U-ExM), proteinlerin bir ultrayapısal elemente (örneğin, mitokondriler, mikrotübüller) atfedilmesini koruyarak süper çözünürlük sağlar23. ExFish (RNA ve DNA) ve proExM yöntemlerinin bir kombinasyonu daha önce de22,24. Sunulan protokol, yarık diyafram proteinlerini araştırmak için bir model olarak transfected cos7 hücrelerini kullanır. Diğer yerleşik kültürlü böbrek hücrelerinin, örneğin HEK293T hücrelerinin bu protokol için benzer şekilde kullanılabileceğini bekliyoruz. Hücre hattına bağlı olarak, farklı kültleme ve transfeksiyon koşulları için ayarlamalar yapılması gerekebilir.
ExM, immün lekeli örneklerin çözünürlüğünü yaklaşık 4 kat artırarak 70 nm13yanal uzamsal çözünürlüğe ulaşır. Diğer süper çözünürlüklü tekniklerle karşılaştırıldığında, ExM geleneksel bir floresan mikroskop13,14üzerinde gerçekleştirilir. Bu nedenle, ExM yöntemini yürütmek için pahalı ekipman veya özel eğitimli personel gerekli değildir14. Tüm floroforlar ExM ile uyumlu olmasa da, genellikle süper çözünürlüklü mikroskopi için gerekli foto-fiziksel özelliklere sahip optimize edilmiş floroforlara sahip birçok mevcut antikor vardır14. Bu yöntemin temel dezavantajı, ExM'nin canlı örneklerle uyumsuz olmasıdır12,14.
Gelecekte, hidrojel'in kimyasal bileşimini iyileştirmek daha da yüksek uzamsal çözünürlüğe yol açabilir12. Farklı protokollerin kombinasyonu, aynı örnek içindeki komplekslerdeki proteinlerin, RNA'nın, DNA'nın veya lipitlerin bu kadar yüksek çözünürlüklü12ile görselleştirilmesini de sağlayabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar Blanka Duvnjak ve Nikola Kuhr'a mükemmel teknik yardımları için teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acrylamide >99% | Sigma-Aldrich | A3553-100G | |
| 6-((Acryloyl)amino)hexanoic acid, succinimidyl ester, Acryloyl-X, SE | invitrogen | A-20770 | store up to 4 months |
| APS | Sigma-Aldrich | A3678-25G | |
| Deckgläser (cover glasses) | Engelbrecht | K12432 | 24x32mm #1.0 |
| Diamont cutter | VWR | 201-0392 | for cutting the cover slips |
| Guanidine HCl | Sigma-Aldrich | G3272-100G | 8M Stock can be kept at RT |
| Marten hair paintbrush | Leon Hardy | 3 (770) | |
| "Menzel" Deckgläser (cover glasses) | Thermo Fischer | 15654786 | 24x24mm #1.5 |
| N,N`-Methylenbisacrylamide | Sigma-Aldrich | M7256-25G | |
| Objektträger UniMark | Marienfeld | 703010 | |
| Proteinase K | New England Biolabs | P8107S | |
| Sodium Acrylate | Sigma-Aldrich | 408220 | check purity |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | |
| Staining chamber | produced at the university's workshop | ||
| TEMED | ROTH | 2367.1 | |
| 6-Well glass bottom plates | Cellvis | P06-1.5H-N | |
| Antibodies | |||
| Actin-ExM 546 | chrometra | non-available | 1:40 |
| Anti Podocin produced in rabbit | Sigma | P-0372-200UL | 1:200 |
| Donkey anti guinea-pig CF633 | Sigma | SAB4600129-50UL | 1:200 |
| Goat anti rabbit 488 | Life Technologies | A11034 | 1:1000 |
| Guinea pig anti nephrin | Origene | BP5030 | 1:100 |
| Software | |||
| FIJI | |||
| Visiview | |||
| microscope | |||
| AXIO Observer Z1 | Zeiss | non-available |
Referanslar
- Matsushita, K., et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 375 (9731), 2073-2081 (2010).
- Faul, C., Asanuma, K., Yanagida-Asanuma, E., Kim, K., Mundel, P. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton. Trends in Cell Biology. 17 (9), 428-437 (2007).
- Saleem, M. A., et al. Co-localization of nephrin, podocin, and the actin cytoskeleton - Evidence for a role in podocyte foot process formation. American Journal of Pathology. 161 (4), 1459-1466 (2002).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein - nephrin - is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Huber, T. B., et al. Podocin-mediated recruitment of nephrin into lipid rafts is required for efficient nephrin signaling. Journal of the American Society of Nephrology. 14, 8(2003).
- Boute, N., et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nature Genetics. 24 (4), 349-354 (2000).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440 (7086), 935-939 (2006).
- van de Linde, S., et al. Direct stochastic optical reconstruction microscopy with standard fluorescent probes. Nature Protocols. 6 (7), 991-1009 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Testa, I., et al. Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength. Biophysical Journal. 99 (8), 2686-2694 (2010).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Truckenbrodt, S., Sommer, C., Rizzoli, S. O., Danzl, J. G. A practical guide to optimization in X10 expansion microscopy. Nature Protocols. 14 (3), 832-863 (2019).
- Truckenbrodt, S., et al. X10 expansion microscopy enables 25-nm resolution on conventional microscopes. Embo Reports. 19 (9), (2018).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Chozinski, T. J., et al. nanoscale optical imaging of mouse and human kidney via expansion microscopy. Scientific Reports. 8 (1), 10396(2018).
- Richter, K. N., et al. Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy. The EMBO Journal. 37 (1), 139-159 (2018).
- Rinschen, M. M., et al. Quantitative deep mapping of the cultured podocyte proteome uncovers shifts in proteostatic mechanisms during differentiation. American Journal of Physiology-Cell Physiology. 311 (3), 404-417 (2016).
- Asano, S. M., et al. Expansion microscopy: protocols for imaging proteins and RNA in cells and tissues. Current Protocols in Cell Biology. 80 (1), 56(2018).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 7860-7867 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır