Method Article
Imagem de Proteínas Podocíticas Nephrin, Actin e Podocina com Microscopia de Expansão
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O método apresentado permite a visualização de proteínas celulares fluorescentes com microscopia de expansão levando a uma resolução de 70 nm em um microscópio convencional.
Resumo
A interrupção do filtro glomerular composto pelo endotélio glomerular, membrana glomerular do porão e podocitos, resulta em albuminúria. Os processos do pé podocyte contêm feixes de actina que se ligam a proteínas adaptadoras citoesquelletal, como a podocina. Essas proteínas adaptadoras, como a podocina, ligam a espinha dorsal do diafragma de fenda glomerular, como a nefrina, ao citoesqueleto de actina. Estudar a localização e função dessas e outras proteínas podocíticas é essencial para a compreensão do papel do filtro glomerular na saúde e na doença. O protocolo apresentado permite que o usuário visualize actina, podocina e nefrina em células com imagens de super resolução em um microscópio convencional. Primeiro, as células são manchadas com uma técnica convencional de imunofluorescência. Todas as proteínas dentro da amostra são então covalentemente ancoradas a um hidrogel inchado. Através da digestão com proteinase K, as proteínas estruturais são cortadas permitindo o inchaço isotropical do gel na última etapa. A diálise da amostra na água resulta em uma expansão de 4-4,5 vezes da amostra e a amostra pode ser imageda através de um microscópio de fluorescência convencional, tornando uma resolução potencial de 70 nm.
Introdução
Albuminúria é um parâmetro substituto de risco cardiovascular e resulta da interrupção do filtro glomerular1. O filtro glomerular é composto do endotélio fenestrado, da membrana glomerular do porão e do diafragma cortado formado por podocitos. Processos primários e secundários de pés de podocitos envolvem a parede capilar do glomerulum2. A estrutura delicada dos processos dos pés é mantida por feixes de actina cortical que também servem como âncoras para proteínas de diafragma de fenda múltipla e outras proteínasadaptadoras 2. A proteína backbone do diafragma é chamada de nefrina e interage de forma homofílica com moléculas de nefetos de podocitos opostos. Através de diversas proteínas adaptadoras, a nefrina está ligada ao citoesqueleto de actina2,3. Mutações no gene de codificação de nefrina NPHS1 levam à síndrome nefrótica do finlandês tipo4.
Uma das proteínas interativas de nefrina é a podocina, uma proteína semelhante ao grampo de cabelo da família estomatina3. Podocin recruta nefrina para jangadas lipídicas e a liga ao citoesqueleto de actina5. Podocina é codificado pelo gene NPHS2. Mutações no NPHS2 levam à síndrome nefrótica resistente a esteroides6.
Para visualizar e co-localizar proteínas adaptadoras de actina, podem ser utilizadas técnicas de imunofluorescência. Infelizmente, a barreira de difração da luz limita a resolução de microscópios convencionais de fluorescência para 200-350 nm7. Novas técnicas de microscopia, por exemplo, estimuladas pelo esgotamento das emissões (STED)8,microscopia de localização ativada por foto (PALM)9,microscopia de reconstrução óptica estocástica (STORM ou dSTORM) ou microscopia de exclusão de estado terrestre seguida pelo retorno individual da molécula (GSDIM)9,10,11, permitem uma resolução de aproximadamente 10 nm. No entanto, essas técnicas de super resolução exigem microscópios altamente caros, pessoal bem treinado e, portanto, não estão disponíveis em muitos laboratórios.
A microscopia de expansão (ExM) é uma técnica nova e simples que permite imagens de super resolução com microscópios convencionais e está potencialmente disponível para uma grande comunidade de pesquisa12. Na microscopia de expansão de retenção de proteínas (proExM), a amostra de interesse (células ou tecidos) é fixa e manchada com fluoroforos13. As proteínas dentro da amostra são então covalentemente ancoradas por uma pequena molécula (6-(Acryloyl)amino)ácido hexanoico, éster succinimidyl, AcX) em um hidrogel inchado13. Através da digestão enzimática com proteinase K (ProK), proteínas e fluoroforos mantêm sua posição relativa dentro do gel após a expansão13. Após o inchaço do gel, a amostra expande-se até 4,5 vezes (expansão volutiva de 90 vezes) levando a uma resolução lateral eficaz de aproximadamente 60-70 nm (300 nm/4.5). Modificações desta técnica podem até permitir uma expansão de 10 vezes (expansão volutiva de 1.000 vezes), tornando uma resolução de 20-30 nm nos microscópios convencionais14,15,16.
Estruturas glomerulares de camundongos e rins humanos foram visualizadas via ExM17. Dentro deste artigo, apresentamos um protocolo proExM detalhado para visualizar imagens de super resolução de F-actin e podocina de proteína actina dentro das células usando um microscópio de fluorescência convencional.
Protocolo
1. Divisão e semeadura de células
- Aqueça o Meio de Águia Modificada (DMEM) de Dulbecco, incluindo soro de bezerro fetal de 10%, soro tamponado fosfato estéril (PBS) e trippsina estéril a 37 °C. Ative o banco limpo.
- Prepare uma placa de 6 poços adicionando um deslizamento de tampa de vidro estéril (10 mm) a cada poço usando fórceps estéreis.
- Coloque um prato de cultura celular de 10 cm com células Cos7 sob o banco limpo. Sob o banco limpo, aspire o meio das células usando um dispositivo de vácuo.
- Segure o prato de cultura celular angulado em uma mão e adicione 10 mL de PBS estéril ao lado do prato de cultura celular para evitar enxaguar as células. Coloque o prato de cultura celular para baixo para que PBS enxague o prato de cultura celular completa.
- Retire o PBS e adicione 1 mL de trippsina no meio do prato de cultura celular e incubar por 5 min a 37 °C.
- Pare a reação de trippsinização adicionando 10 mL de DMEM incluindo 10% DE FCS e pipeta a solução celular para cima e para baixo com um pipettor para separar manualmente as células.
- Analise o número do celular por mililitro usando uma câmara de contagem.
- Sementes 68.000 células em 2 mL médio por poço sobre a tampa de vidro desliza na placa de 6 poços. Distribua as células dentro da placa de 6 poços agitando cautelosamente a placa horizontal e verticalmente.
NOTA: As células devem estar espalhadas. - Incubar as células durante a noite em uma incubadora de 37 °C com 5% de CO2.
2. Transfecção de células
- Prepare dois tubos estéreis de 1,5 mL (um para DNA diluído (A) e outro para reagente diluído para transfecção lipídica cônica (B)). Pipeta 0,75 μg de nefrina e 0,75 μg de expressão de podocina cDNA plasmid por poço em um tubo de 1,5 mL e diluí-lo em 100 μL de meio soro reduzido por poço. Adicione 3 μL de reagente de transfecção lipídica cationic por poço ao segundo tubo de 1,5 mL e diluir com 100 μL de meio soro reduzido. Incubar ambas as reações por 5 minutos à temperatura ambiente.
- Combine ambas as reações (A e B) a um complexo de DNA-lipíde, e incubar por 20 minutos à temperatura ambiente. Adicione cautelosamente 200 μL do complexo DNA-lipíde, a cada poço.
- Incubar as células transfeinadas a 37 °C com 5% de CO2 por 48 h sem alterar o meio.
3. Imunolabelamento de estruturas celulares
- Prepare uma solução de fixação (4% (w/v) paraformaldeído em PBS, 1 mL/well), a solução de permeabilização (0,5% (w/v) Triton X-100 em PBS, 1 mL/bem), e uma solução de bloqueio (5% (v/v) albumina de soro bovino na PBS, 1 mL/well).
- Remova o meio com um dispositivo de vácuo. Adicione 2 mL de PBS a cada poço para remover o meio extra. Aspire completamente a PBS.
NOTA: Para evitar lavar as células com PBS, certifique-se de pipetar PBS não na tampa do vidro escorregar diretamente. - Fixar células com paraformaldeído (FPF) de 4% (c/v) dissolvido em PBS por 10 minutos à temperatura ambiente.
NOTA: Alternativamente, fixar células em 3% (v/v) glyoxal-etanol18. - Descarte pfa e lave células duas vezes em PBS (2 mL cada) evitando tubos diretos nos deslizamentos de tampa de vidro. Permeabilize as células fixas com Triton X-100 0,5% (w/v) em PBS por 10 minutos em temperatura ambiente.
- Remova a solução de permeabilização e lave duas vezes com PBS conforme indicado na etapa 3.2.
- Bloqueie as células adicionando 1 mL de 5% (v/v) BSA no PBS por 1 h à temperatura ambiente. Incubar as células com 200 μL do anticorpo primário (anticorpo anti-podocina 1:200 em 1% (v/v) BSA em PBS) durante a noite a 4 °C.
NOTA: Alternativamente, incubar o anticorpo primário por 1h à temperatura ambiente. - Remova o anticorpo primário e lave três vezes com PBS como na etapa 3.2. Adicione o anticorpo secundário (anti-coelho de cabra Alexa 488 1:1000 em 1% (v/v) BSA na PBS) por 1h à temperatura ambiente. Mantenha as células no escuro usando uma caixa.
- Descarte o anticorpo secundário e lave com PBS três vezes.
- Remova o PBS e incuba as células com 200 μL de anticorpo anti-nefrina 1:100 em 1% (v/v) BSA em PBS por 1 h à temperatura ambiente. Lave com PBS três vezes. Mantenha as células no escuro usando uma caixa.
- Remova a PBS e incubar com o anticorpo secundário anti-cobaia 633, 1:200, por 1h em temperatura ambiente. Lave com PBS três vezes. Mantenha as células no escuro usando uma caixa.
4. Microscopia de expansão
- preparação
- Para formar os espaçadores para a câmara de gelação, corte a tampa de vidro desliza #1,0 e #1,5 em listras de 5 mm (quatro por lâmina de vidro) usando uma faca de diamante. Posicione as faixas de deslizamento de cobertura de #1,5 mm para que elas formem um quadrado de 2,5 cm de comprimento em um escorregador de vidro e coloque-as em uma câmara de coloração(Figura 2A1-C1). Pipeta uma gota de ddH2O nos cantos da praça para aderir as faixas de deslizamento de tampa de vidro entre si e ao escorregador de vidro(Figura 2A2-C2).
NOTA: Evite a secagem completa do ddH2O, pois a força de adesão se perderá. Se necessário, aplique mais gotículas de ddH2O. Aguarde aproximadamente 20 min para que os deslizamentos de cobertura de #1,5 mm sejam fixados com faca antes de começar com a etapa 4.1.2. - Coloque quatro tiras de deslizamento de tampa de vidro #1.0 por deslizamento de tampa nos deslizamentos de cobertura de #1,5 mm. Adere as listras ao pipetar uma gotícula em cada faixa de deslizamento de cobertura de #1,5 mm(Figura 2A3-C3).
NOTA: A espessura do gel deve ser de pelo menos 0,15 mm para facilitar o manuseio no andamento do protocolo. No entanto, para evitar o excesso de gel em cima das células, mantenha a altura dos espaçadores perto do substrato celular. Usando #1,5 e #1.0 como espaçadores, a altura dos espaçadores será de aproximadamente 0,3 mm. As células aderem ao vidro de cobertura (altura de 0,12 mm). Portanto, o gel será espesso o suficiente para manusear, mas o gel excessivo em cima das células é evitado usando #1,0 e #1,5 tampam listras de vidro como espaçadores. - Para a tampa da câmara de gelação, enrole um copo de tampa (#1,5) com filme de parafina. Evite dobras ou sujeira no filme de parafina(Figura 2A5-C5).
- Para formar os espaçadores para a câmara de gelação, corte a tampa de vidro desliza #1,0 e #1,5 em listras de 5 mm (quatro por lâmina de vidro) usando uma faca de diamante. Posicione as faixas de deslizamento de cobertura de #1,5 mm para que elas formem um quadrado de 2,5 cm de comprimento em um escorregador de vidro e coloque-as em uma câmara de coloração(Figura 2A1-C1). Pipeta uma gota de ddH2O nos cantos da praça para aderir as faixas de deslizamento de tampa de vidro entre si e ao escorregador de vidro(Figura 2A2-C2).
- Ancoragem e polimerização (gelação)
- Prepare o tampão de ancoragem (ver Tabela 1). Para tratamento de ancoragem, substitua o PBS por 250 μL de tampão de ancoragem por poço diretamente no deslizamento da tampa de vidro e incubar por 3h à temperatura ambiente. Mantenha o substrato no escuro usando uma caixa.
NOTA: Alternativamente, incubar durante a noite à temperatura ambiente. Prepare um novo tampão de ancoragem para cada experimento e espere por 10-15 min até que seja dissolvido corretamente. 6-(Acryloyl)amino)ácido hexanoico, éster succinimidyl (AcX) deve ser substituído a cada 4-5 meses para garantir a ancoragem adequada. - Remova o tampão de ancoragem e lave uma vez com 1,5 mL PBS por poço.
- Para colorir as fibras de actina, descongele uma solução de fhalloidina compatível exM e incubar a faloidina (5 μL de phalloidin diluída em 195 μL de 1% (v/v) BSA em PBS/well) por 45 min à temperatura ambiente. Mantenha amostras no escuro usando uma caixa.
- Enquanto isso, dissolva o acrilato de sódio em ddH2O usando um dispositivo de agitação. No gelo, prepare a solução monômero (ver Tabela 1).
NOTA: O acrilato de sódio dissolvido deve ser uma solução clara e incolor. Se a solução for amarela, substitua-se por novo acrilato de sódio. - Prepare a solução de gelagem no gelo (ver Tabela 1). Pipeta ammoniumperoxidsulfate (APS) na solução de gelagem logo antes da solução de gelagem ser aplicada na câmara de gelação.
- Remova a falooidina das células e lave com 1,5 mL de PBS duas vezes à temperatura ambiente. Deixe 1,5 mL PBS dentro do poço para facilitar a remoção da amostra no deslizamento da tampa do vidro.
- Coloque as células no vidro de cobertura na câmara de gelagem usando fórceps e uma cânula para levantar o deslizamento de vidro de cobertura da placa de 6 poços.
NOTA: As células devem estar na parte superior do deslizamento da tampa do vidro. O deslizamento da tampa de vidro não deve tocar os espaçadores. - Adicione APS à solução de gelagem e vórtice em breve. Pipeta 200 μL de solução de gelagem na amostra (Figura 2A4-C4). Feche cautelosamente a câmara de gelação evitando bolhas de ar dentro do gel (Figura 2A5-C5).
- Incubar a câmara de gelagem por pelo menos 1 h a 37 °C para polimerizar o gel na câmara de coloração molhada.
- Prepare o tampão de ancoragem (ver Tabela 1). Para tratamento de ancoragem, substitua o PBS por 250 μL de tampão de ancoragem por poço diretamente no deslizamento da tampa de vidro e incubar por 3h à temperatura ambiente. Mantenha o substrato no escuro usando uma caixa.
- Homogeneização (digestão)
- Tire a câmara de coloração da incubadora. Para abrir a tampa da câmara de gelação, introduza uma lâmina de barbear entre a tampa e o espaçador. Remova a tampa com cautela. Remova os espaçadores com a lâmina de barbear e elimine todo o gel extra cortando-o com a lâmina de barbear.
- Coloque o slide com o gel e cubra o vidro em um prato cheio de PBS. Tremendo suavemente, remova o vidro de cobertura separado do gel. Para remover o gel do prato facilmente, coloque o slide abaixo do gel para fixar o gel ao slide.
- Com o gel no slide, divida o gel em pequenos pedaços (quarto do gel é dividido em duas a três peças) usando a lâmina de barbear. Empurre suavemente um pedaço de gel em um poço de uma placa de 6 poços com fundo de vidro e enfold-lo por um pincel. Mantenha o gel hidratado com um pouco de PBS usando o pincel para evitar a desidratação do gel.
NOTA: As células enfrentam para baixo. - Usando um microscópio invertido, faça imagens de visão geral com baixa abertura numérica para determinar o fator de expansão após a expansão.
- Prepare o tampão de digestão (ver Tabela 1). Diluir Proteinase K a 4 U/mL no tampão de digestão para receber a solução de digestão.
NOTA: O tampão de digestão sem Proteinase K pode ser armazenado a 4 °C por 1-2 semanas. - Adicione 500 μL da solução de digestão a cada poço e mergulhe o gel dentro da solução. Deixe digerir durante a noite à temperatura ambiente e feche a tampa mantendo as amostras no escuro.
NOTA: Alternativamente, deixe digerir a 37 °C por 1h.
- expansão
- Remova a solução de digestão com uma pipeta e descarte-a. Adicione 1 mL de ddH2O. Incubar o gel imerso por 10 minutos à temperatura ambiente.
- Retire a água e adicione 1 mL de ddHfresco 2O. Aguarde 10 min e continue trocando água a cada 10 minutos até que um platô de expansão seja atingido.
NOTA: A expansão da amostra até 4,5 vezes é alcançável. O gel fica opticamente claro.
- imagiologia
- Remova a água do gel e inicie diretamente a microscopia. Utilizando um microscópio invertido, utilize principalmente um objetivo de ar (baixa ampliação) para encontrar células imagens no estado de pré-expansão (etapa 4.3.4).
- Mude para um objetivo de 40x (óleo/água) e 63x para uma melhor resolução. Excite-se com o comprimento de onda de interesse e leve a imagem através da câmera.
- validação
- Faça uma visão geral da amostra. Encontre e combine as mesmas estruturas dentro da amostra que foram imagens na etapa 4.3.4. Use o canal com a melhor relação sinal-ruído para validação(Figura 3 A-B).
NOTA: Ajuste os parâmetros de imagem para obter brilho semelhante à da imagem adquirida no estado não expandido (etapa 4.3.4). - Sobreposição de imagens pré e pós-expansão girando e mudando-as com ImageJ. Use a ferramenta de medição de distância no ImageJ para medir as distâncias entre estruturas claramente identificáveis. Meça pelo menos 10 estruturas diferentes.
NOTA: Alternativamente, use um script Python para medir distâncias descritas em14. - Calcule o fator de expansão dividindo as medições pós/pré-expansão.
- Para determinar distorções, tire imagens com maior abertura numérica(Figura 4A-B). Sobreponha essas imagens e analise-as com ImageJ ou conforme descrito em15.
NOTA: A determinação de distorções deve ser realizada rotineiramente, mas não necessariamente em todas as amostras.
- Faça uma visão geral da amostra. Encontre e combine as mesmas estruturas dentro da amostra que foram imagens na etapa 4.3.4. Use o canal com a melhor relação sinal-ruído para validação(Figura 3 A-B).
Resultados
O conceito e o tempo deste protocolo proExM são retratados na Figura 1. No dia 5, as células transfeinadas são fixas e manchadas com anticorpos fluorescentes voltados para a proteína de interesse (Figura 1A,B). No dia 6, o tratamento com AcX leva à formação de grupos de amina em todas as proteínas (incluindo fluoroforos) (Figura 1A,B)12. Após a polimerização do hidrogel, esses grupos de amina se ligam covalentemente ao hidrogel (dia 6). Após a polimerização do gel, a homogeneização (digestão) é realizada com proteinase K resultando na destruição de proteínas estruturais da célula (dia 6, Figura 1A,B). Anticorpos fluorescentes rotulados permanecem preservados principalmente após a digestão. Devido à interrupção das proteínas estruturais, a diálise hídrica do hidrogel resulta na expansão isotrópica da célula dentro do hidrogel no dia 7 (Figura 1A,B). A imagem da amostra é realizada com um microscópio de fluorescência convencional(Figura 1A). A validação dos dados para determinar o fator de expansão e excluir distorções deve ser realizada(Figura 1A).
Para realizar a expansão da célula isotropicamente, o passo de gelação é essencial. A Figura 2 mostra a visão lateral e superior de uma câmara de gelação. Os deslizamentos de tampa de vidro constroem os espaçadores da câmara de gelação (Figura 2A1-3/C1-3). O vidro de cobertura com as células fixas e manchadas é posicionado com as células para cima em uma lâmina de vidro (Figura 2A4-C4). A tampa da câmara de gelação é enrolada com parafilme e é fechada sem bolhas(Figura 2A5-C5).
Este protocolo ExM permite a expansão de até quatro vezes. Para determinar o fator de expansão, é essencial a imagem das células antes e depois da expansão(Figura 3A + B). Ancoragem e homogeneização insuficientes podem levar a distorções e rupturas de células. A Figura 4A + B mostra exemplos representativos de células rompidas em diferentes imagens de ampliação.
Este método pode ser usado para investigar a co-localização de proteínas adaptadoras F-actin e actina, por exemplo, podocina e nefrina(Figura 5). Podocin é retratado em verde enquanto actina é rotulado em azul (Figura 5). Nephrin está marcado em verde. Áreas brancas indicam co-localização.
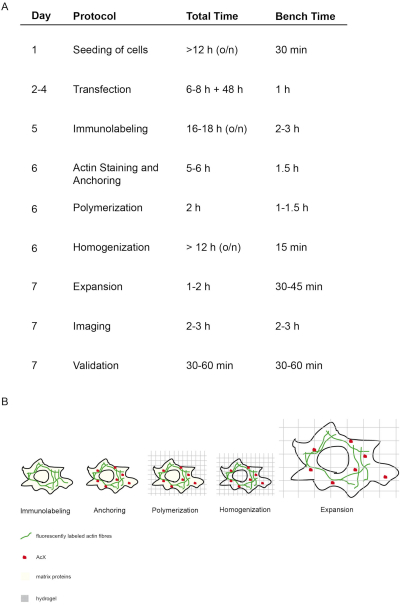
Figura 1: Conceito e tempo deste protocolo ExM. (A) Na coluna "protocolo", cada etapa do protocolo é delineada. (A + B) Após a semeadura e transfecção das células, é realizada rotulagem imunofluorescente (Imunolabeling). (A + B) A pequena molécula AcX (ponto vermelho) se liga a todas as proteínas e as ancora ao hidrogel (Ancoragem). (A + B) Através da polimerização todas as proteínas, incluindo fluoroforos, são covalentemente ligadas via AcX ao hidrogel (Polimerização). (A + B) A homogeneização leva à digestão de proteínas de matriz estrutural. (A + B) A expansão é alcançada pela diálise na água. (A) A imagem e validação de imagens finaliza o experimento. (A) Todo o protocolo requer 7 dias (coluna "dia") com muitas etapas de incubação (tempo total por dia coluna "tempo total"), mas o tempo real de bancada é muito menor como indicado na respectiva coluna "tempo de bancada". Modificado a partir de14. Clique aqui para ver uma versão maior desta figura.
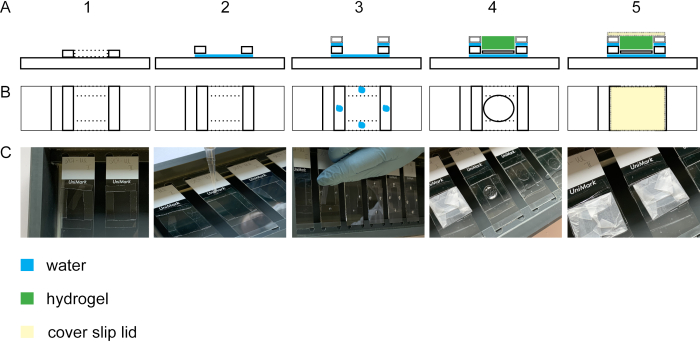
Figura 2: Construção da câmara de gelação. Vista lateral (A1) e vista superior(B1 + C1) de um escorregador de vidro com quatro faixas de cobertura #1,5. Adicionando uma gota de água entre o escorregador de vidro e as listras de deslizamento de cobertura, as listras aderirão ao escorregador de vidro(vista lateral A2, vista superior B2, C2). Gotículas de água nas faixas de cobertura #1,5 levam à adesão de faixas de cobertura #1.0 colocadas em cima das faixas de cobertura #1,5(vista lateral A3, vista superior B3, C3). A amostra no deslizamento da tampa é colocada no meio do retângulo usando fórceps. O gel é pipetado na parte superior(vista lateral A4, vista superior B4, C4). (A5) Vista lateral e vista superior(B5 e C5) da câmara de gelação montada, incluindo a tampa fechada que é construída a partir de um deslizamento de cobertura envolto em parafilm. Clique aqui para ver uma versão maior desta figura.
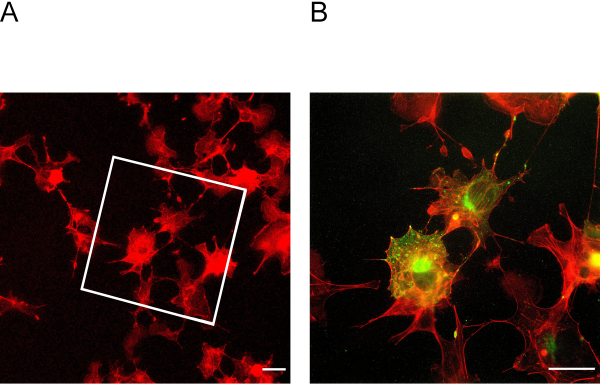
Figura 3: Células antes e depois da expansão. (A) Células antes da expansão manchada para actin. A caixa indica em que área estão as células expandidas na Figura 3B. (B) Células após expansão manchadas para actina em vermelho e podocina em verde. Podocin co-localiza com actina na periferia celular. Barra de escala = 5 μm, fator de expansão = 2. Clique aqui para ver uma versão maior desta figura.

Figura 4: Distorções e rupturas de células. (A + B) Imagens microscópicas representativas de células cos7 imuno-manchadas para actina (vermelho). As células foram fixadas, manchadas, ancoradas, digeridas e expandidas. (A)Rupturas de células. As flechas indicaram áreas rompidas. Barra de escala = 5 μm, fator de expansão = 4. (B) Rupturas e distorção das células. As flechas brancas indicavam áreas rompidas. Barra de escala = 5 μm, fator de expansão = 4. Clique aqui para ver uma versão maior desta figura.
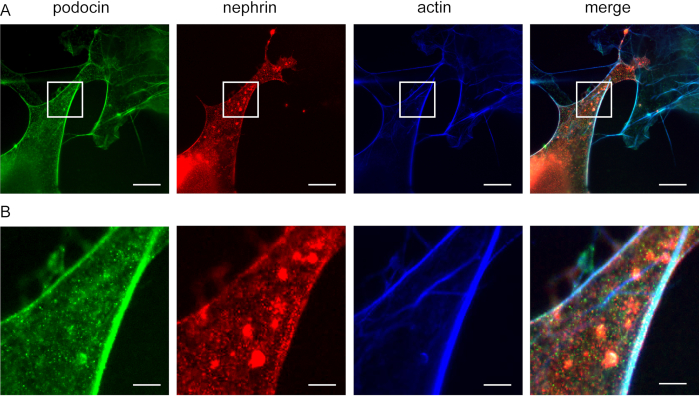
Figura 5: Podocin co-localiza com nefrina e actina. Células Cos7 imunofluorescentamente rotuladas para podocina, actina e nefrina. (A) Células Cos7 manchadas para podocina (verde), actina (azul) e nefrina (vermelha) com ExM. Podocin co-localiza com actina e nefrina. Barra de escala = 200 nm, fator de expansão = 4. (B) Ampliação da área indicada em (A), Barra de escala = 40 nm. Clique aqui para ver uma versão maior desta figura.
| Tampão de ancoragem | concentração final | ||
| NaHCO3 | 150 mM | ||
| Acryloyl-X, SE (AcX) | 0,1 mg/ml | ||
| Solução monômera | Concentração de solução de estoque g/100 ml | quantidade (ml) | concentração final (g/100 ml) |
| acrilato de sódio | 38 | 2.25 | 6.x |
| acrilamida | 50 | 0.5 | 2.5 |
| N,N'-Methylenebisacrilamida | 2 | 0.75 | 0.15 |
| cloreto de sódio | 29.2 | 4 | 11.7 |
| Pbs | 10x | 1 | 1x |
| Água | 0.75 | ||
| total | 9.4 | ||
| Solução de gelagem | Concentração de solução de estoque | quantidade (μl) | concentração final (mg/ml) |
| solução monômero | NA | 190 | NA |
| Aps | 10% | 4 | 0.1 |
| TEMED | >99% | 4 | 0.1 |
| Água | NA | 2 | NA |
| total | 200 | ||
| Solução de digestão | concentração final | ||
| Tris Cl, pH 8.0 | 1 M | ||
| EDTA pH 8.0 | 0,5 M | ||
| Tritão X-100 | 0.005% | ||
| Guanidin HCL | 8 M | ||
| Água | |||
| proteinase K | 4 U/ml |
Tabela 1: Soluções para ExM.
Discussão
O método apresentado permite ao pesquisador visualizar proteínas celulares, por exemplo, podocina, nefrina e componentes citoesqueletal, por exemplo, F-actin. Dentro deste protocolo, as células cos7 transfectadas são usadas como modelo para estudar a interação de proteínas de diafragma cortadas com F-actin. Infelizmente, as linhas celulares podocyte imortalizadas não expressam quantidades endógenas suficientes de proteínas de diafragma cortadas19.
Com este método, as proteínas celulares podem ser visualizadas com resolução nanoescala usando um microscópio de fluorescência convencional. Os passos mais críticos dentro do protocolo são: 1) ancoragem suficiente de grupos de proteínas amina ao hidrogel com AcX, 2) polimerização adequada do hidrogel, 3) tempo ideal para digestão e 4) seleção de fluoroforos compatíveis.
A ancoragem de proteínas celulares no hidrogel é essencial para este método, a fim de preservar a posição da proteína dentro do hidrogel durante a expansão. AcX é uma pequena molécula que se liga a grupos de proteínas de amina dentro de células e tecidos. A AcX cria uma dupla banda carbono-carbono com proteínas, permitindo a incorporação das proteínas no hidrogel na etapa de polimerização20. AcX também integra anticorpos para que a rotulagem com anticorpos de imunofluorescência possa ser realizada antes do tratamento AcX. Ancoragem insuficiente pode levar a rupturas e distorções das células. Devido à modificação de grupos de amina por fixação, é preciso otimizar o fixador ou o tempo de fixação. Além disso, condições insuficientes de armazenamento ou ancoragem não otimizadas podem resultar em rupturas e distorções. Com base em nossa experiência, a AcX perde seu efeito ideal quando usada por mais de 3-4 meses.
A polimerização do gel é dependente da temperatura. Recomendamos, portanto, manter as soluções de polimerização no gelo antes de encanar na câmara de gelação. Além disso, o tempo de manuseio da etapa de gelação deve ser mantido curto (menos de 5 minutos) para evitar a formação prematura de gel. A mistura completa da solução de polimerização evita a polimerização desigual. As bolhas de ar afetarão o processo de expansão ao tocar a amostra e podem ser evitadas adicionando mais solução de polimerização.
Após a incorporação das proteínas celulares dentro do hidrogel, a etapa de homogeneização mecânica (ou digestão) é necessária para garantir a expansão. Diferentes métodos, por exemplo, calor e detergente ou digestão enzimática, existem e precisam ser personalizados para a amostra investigada12,14,20. Dentro deste protocolo, o protease Proteinase K é usado para digestão enzimática. Proteinase K é aplicada em uma dosagem suficiente para destruir proteínas estruturais, preservando a maioria das outras proteínas, incluindo anticorpos fluorescentes12. Se a digestão estiver incompleta, a expansão da amostra é insuficiente. Além disso, a amostra pode rasgar durante o processo de expansão(Figura 3). Se ocorreu uma expansão amostral inadequada, recomenda-se a substituição da água. Alternativamente, o tempo para a digestão enzimática pode ser ajustado ou uma nova alíquota do Proteinase K aberto.
Se a amostra for super digerida, os sinais de fluorescência serão diminuídos. Neste caso, o tempo de digestão deve ser reduzido. Em ExM em geral, a intensidade do sinal de fluorescência por unidade de volume é reduzida devido à expansão volutiva da amostra14. Portanto, é preciso considerar tempos de exposição mais longos durante a imagem.
É essencial selecionar fluoroforos compatíveis com ExM. Os corantes de cianeto são degradados durante a etapa de polimerização13. Proteínas de fluorescência baseadas em bacteriophytocroromes também são em grande parte destruídas13. No entanto, a maioria das proteínas semelhantes ao GFP será preservada13. Além disso, o streptavidin também pode ser aplicado antes da expansão, rotulando modificações pós-translacionais, como a nitrolise S através de uma pequena marca de molécula13.
A falooidina, uma pequena molécula de rotulagem para atingir o citoesqueleto de actina, não é compatível com o ExM21. Para superar a ancoragem insuficiente da faloideina, a ancoragem trivalente (TRITON) foi introduzida21. Esta abordagem oferece segmentação simultânea, rotulagem e enxerto de biomoléculas21.
Este método pode ser modificado para colorir moléculas de RNA (ExFish)22. Em microscopia de expansão iterativa (iExM) ou microscopia X10, a resolução de 60-70 nm pode ser estendida para aproximadamente 25 nm aplicando um segundo gel inchado dentro do primeiro hidrogel expandido ou conduzindo um único passo de expansão usando um hidrogel diferente15,16. A microscopia de expansão da ultraestrutura (U-ExM) permite a super resolução de proteínas preservando sua atribuição a um elemento ultraestrutural (por exemplo, mitocronsia, microtúbulos)23. Uma combinação de métodos ExFish (RNA e DNA) e proExM já foram realizados anteriormente, bem como22,24. O protocolo apresentado utiliza células cos7 transfeinadas como modelo para investigar proteínas de diafragma cortadas. Esperamos que outras células renais cultivadas residentes, por exemplo, células HEK293T, possam ser usadas da mesma forma para este protocolo. Dependendo da linha celular, podem ser necessários ajustes para as diferentes condições de cultivo e transfecção.
ExM aumenta a resolução de amostras imuno-manchadas em cerca de 4 vezes atingindo uma resolução espacial lateral de 70 nm13. Comparado com outras técnicas de super-resolução, o ExM é realizado em um microscópio de fluorescência convencional13,14. Portanto, nenhum equipamento caro ou pessoal especificamente treinado é necessário para conduzir o método ExM14. Embora nem todos os fluoroforos sejam compatíveis com o ExM, geralmente existem muitos anticorpos disponíveis com fluoroforos otimizados com propriedades foto-físicas necessárias para microscopia de super resolução14. A principal desvantagem deste método é que o ExM é incompatível com amostras vivas12,14.
No futuro, melhorar a composição química do hidrogel pode levar a uma resolução espacial ainda maior12. A combinação de diferentes protocolos também pode permitir a visualização de proteínas, RNA, DNA ou lipídios em complexos dentro da mesma amostra com tal alta resolução12.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a Blanka Duvnjak e Nikola Kuhr por sua excelente assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Acrylamide >99% | Sigma-Aldrich | A3553-100G | |
| 6-((Acryloyl)amino)hexanoic acid, succinimidyl ester, Acryloyl-X, SE | invitrogen | A-20770 | store up to 4 months |
| APS | Sigma-Aldrich | A3678-25G | |
| Deckgläser (cover glasses) | Engelbrecht | K12432 | 24x32mm #1.0 |
| Diamont cutter | VWR | 201-0392 | for cutting the cover slips |
| Guanidine HCl | Sigma-Aldrich | G3272-100G | 8M Stock can be kept at RT |
| Marten hair paintbrush | Leon Hardy | 3 (770) | |
| "Menzel" Deckgläser (cover glasses) | Thermo Fischer | 15654786 | 24x24mm #1.5 |
| N,N`-Methylenbisacrylamide | Sigma-Aldrich | M7256-25G | |
| Objektträger UniMark | Marienfeld | 703010 | |
| Proteinase K | New England Biolabs | P8107S | |
| Sodium Acrylate | Sigma-Aldrich | 408220 | check purity |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | |
| Staining chamber | produced at the university's workshop | ||
| TEMED | ROTH | 2367.1 | |
| 6-Well glass bottom plates | Cellvis | P06-1.5H-N | |
| Antibodies | |||
| Actin-ExM 546 | chrometra | non-available | 1:40 |
| Anti Podocin produced in rabbit | Sigma | P-0372-200UL | 1:200 |
| Donkey anti guinea-pig CF633 | Sigma | SAB4600129-50UL | 1:200 |
| Goat anti rabbit 488 | Life Technologies | A11034 | 1:1000 |
| Guinea pig anti nephrin | Origene | BP5030 | 1:100 |
| Software | |||
| FIJI | |||
| Visiview | |||
| microscope | |||
| AXIO Observer Z1 | Zeiss | non-available |
Referências
- Matsushita, K., et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 375 (9731), 2073-2081 (2010).
- Faul, C., Asanuma, K., Yanagida-Asanuma, E., Kim, K., Mundel, P. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton. Trends in Cell Biology. 17 (9), 428-437 (2007).
- Saleem, M. A., et al. Co-localization of nephrin, podocin, and the actin cytoskeleton - Evidence for a role in podocyte foot process formation. American Journal of Pathology. 161 (4), 1459-1466 (2002).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein - nephrin - is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Huber, T. B., et al. Podocin-mediated recruitment of nephrin into lipid rafts is required for efficient nephrin signaling. Journal of the American Society of Nephrology. 14, 8(2003).
- Boute, N., et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nature Genetics. 24 (4), 349-354 (2000).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440 (7086), 935-939 (2006).
- van de Linde, S., et al. Direct stochastic optical reconstruction microscopy with standard fluorescent probes. Nature Protocols. 6 (7), 991-1009 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Testa, I., et al. Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength. Biophysical Journal. 99 (8), 2686-2694 (2010).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Truckenbrodt, S., Sommer, C., Rizzoli, S. O., Danzl, J. G. A practical guide to optimization in X10 expansion microscopy. Nature Protocols. 14 (3), 832-863 (2019).
- Truckenbrodt, S., et al. X10 expansion microscopy enables 25-nm resolution on conventional microscopes. Embo Reports. 19 (9), (2018).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Chozinski, T. J., et al. nanoscale optical imaging of mouse and human kidney via expansion microscopy. Scientific Reports. 8 (1), 10396(2018).
- Richter, K. N., et al. Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy. The EMBO Journal. 37 (1), 139-159 (2018).
- Rinschen, M. M., et al. Quantitative deep mapping of the cultured podocyte proteome uncovers shifts in proteostatic mechanisms during differentiation. American Journal of Physiology-Cell Physiology. 311 (3), 404-417 (2016).
- Asano, S. M., et al. Expansion microscopy: protocols for imaging proteins and RNA in cells and tissues. Current Protocols in Cell Biology. 80 (1), 56(2018).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 7860-7867 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados