Method Article
הדמיה של חלבונים פודוציטיים נפרין, אקטין ופודוצ'ין עם מיקרוסקופיית הרחבה
* These authors contributed equally
In This Article
Summary
השיטה המוצגת מאפשרת הדמיה של חלבונים תאיים בעלי תווית פלואורסצנטית עם מיקרוסקופיית הרחבה המובילה לרזולוציה של 70 ננומטר על מיקרוסקופ קונבנציונלי.
Abstract
שיבוש המסנן הגלומרולרי המורכב מאנדותל גלומרולרי, קרום מרתף גלומרולרי ופודוציטים, גורם לאלבומינוריה. תהליכי כף הרגל Podocyte מכילים חבילות actin להיקשר חלבונים מתאם cytoskeletal כגון podocin. חלבוני מתאם אלה, כגון podocin, לקשר את עמוד השדרה של הסרעפת חריץ גלומרולרי, כגון nephrin, כדי cytoskeleton actin. לימוד הלוקליזציה והתפקוד של חלבונים פודוציטיים אלה ואחרים חיוני להבנת תפקידו של המסנן הגלומרולרי בבריאות ובמחלות. הפרוטוקול המוצג מאפשר למשתמש לדמיין אקטין, פודוצין ונפרין בתאים עם הדמיה ברזולוציית-על במיקרוסקופ קונבנציונלי. ראשית, תאים מוכתמים בטכניקת כשל חיסוני קונבנציונלית. כל החלבונים בתוך המדגם מעוגנים בקובאליות להידרוגל מתנפח. באמצעות עיכול עם חלבון K, חלבונים מבניים הםבקעו המאפשר נפיחות isotropical של הג'ל בשלב האחרון. דיאליזה של המדגם במים גורמת להרחבה של המדגם פי 4-4.5 וניתן לדמיין את הדגימה באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי, מה שמפחית רזולוציה פוטנציאלית של 70 ננומטר.
Introduction
אלבומינוריה הוא פרמטר פונדקאי של סיכון קרדיווסקולרי ותוצאות שיבוש של מסנן גלומרולרי1. המסנן הגלומרולרי מורכב מאנדותל fenestrated, קרום המרתף גלומרולרי ואת הסרעפת חתך שנוצר על ידי podocytes. תהליכי כף רגל ראשוניים ומשניים של podocytes לעטוף סביב הקיר נימי של גלומרולום2. המבנה העדין של תהליכי כף הרגל נשמר על ידי חבילות actin קליפת המוח אשר משמשים גם עוגנים עבור חלבוני דיאפרגמה חריץ מרובים וחלבונים מתאם אחרים2. חלבון עמוד השדרה של הסרעפת נקרא נפרין ומתקשר באופן הומופילי עם מולקולות נפרין של פודוציטים מנוגדים. באמצעות חלבונים מתאם מגוונים, נפרין מקושר אקטין ציטוסקלטון2,3. מוטציות בגן קידוד הנפרין NPHS1 מובילות לתסמונת נפרוטית מהסוג הפיני4.
אחד החלבונים המקיימים אינטראקציה של nephrin הוא podocin, חלבון דמוי סיכת ראש של משפחת סטומטין3. פודוצ'ין מגייס את נפרין לרפסודות השומנים ומקשר אותה לציטוטוסלקטון5. Podocin מקודד על ידי הגן NPHS2. מוטציות NPHS2 להוביל לתסמונת נפרוטית עמידה בפני סטרואידים6.
כדי לדמיין ולמקם במשותף חלבונים מתאם actin, ניתן להשתמש בטכניקות כשל חיסוני. למרבה הצער, מחסום עקיפה של האור מגביל את הרזולוציה של מיקרוסקופים פלואורסצנטיים קונבנציונליים ל 200-350 ננומטר7. טכניקות מיקרוסקופיה חדשניות, למשל, דלדול פליטה מגורה (STED)8, מיקרוסקופיה לוקליזציה המופעלת על ידי צילום (PALM)9, מיקרוסקופיה של שחזור אופטי סטוכסטי (STORM או dSTORM) או מיקרוסקופיית מחיקת מצב קרקע ואחריה החזרת מולקולה בודדת (GSDIM)9,10,11, לאפשר רזולוציה של עד כ 10 ננומטר. עם זאת, טכניקות אלה רזולוציה סופר דורשים מיקרוסקופים יקרים מאוד, כוח אדם מאומן היטב ולכן אינם זמינים במעבדות רבות.
מיקרוסקופיה הרחבה (ExM) היא טכניקה חדשנית ופשוטה המאפשרת הדמיה ברזולוציית על עם מיקרוסקופים קונבנציונליים והיא זמינה לקהילת מחקר גדולה12. במיקרוסקופיית הרחבת שימור חלבונים (proExM), מדגם העניין (תאים או רקמה) קבוע ומוכתם בפלואורופורים13. חלבונים בתוך המדגם מעוגנים אז בקובאליות על ידי מולקולה קטנה (6-(אקרילויל)חומצה הקסאנואית, succinimidyl אסתר, AcX) לתוך הידרוג'ל מתנפח13. באמצעות עיכול אנזימטי עם פרוטאינאז K (ProK), חלבונים ופלואורופורים שומרים על מיקומם היחסי בתוך הג'ל לאחר התרחבות13. לאחר נפיחות של הג'ל, המדגם מתרחב עד פי 4.5 (הרחבה נפחית פי 90) המוביל לרזולוציה רוחבית יעילה של כ 60-70 ננומטר (300 ננומטר / 4.5). שינויים בטכניקה זו יכולים אפילו לאפשר הרחבה של פי 10 (הרחבה נפחית של פי 1,000), מה שמגדיל את הרזולוציה של 20-30 ננומטר במיקרוסקופים קונבנציונליים14,15,16.
מבנים גלומרולריים של עכבר וכליות אדם כבר דמיינו באמצעות ExM17. בתוך נייר זה, אנו מציגים פרוטוקול proExM מפורט כדי לדמיין תמונות ברזולוציה סופר של F-actin ואת podocin חלבון מתאם actin בתוך תאים באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי.
Protocol
1. פיצול וזריעת תאים
- לחמם את מדיום הנשר שונה של Dulbecco סטרילי (DMEM) כולל 10% סרום עגל עוברי (FCS), מלוחים סטריליים פוספט אגירה (PBS) ו טריפסין סטרילי ל 37 °C (69 °F). הפעל את הספסל הנקי.
- הכינו צלחת של 6 בארות על ידי הוספת כיסוי זכוכית סטרילי אחד (10 מ"מ) לכל באר באמצעות מלקחיים סטריליים.
- שים צלחת 10 ס"מ תרבות התא עם תאי Cos7 מתחת לספסל נקי. מתחת לספסל הנקי, שאף את מדיום התאים באמצעות מכשיר ואקום.
- החזק את צלחת תרבות התא angulated ביד אחת ולהוסיף 10 מ"ל של PBS סטרילי לצד של צלחת תרבות התא, כדי למנוע שטיפה את התאים. מניחים את צלחת תרבות התא למטה, כך PBS שוטף את צלחת תרבות התא המלא.
- הסר את PBS ולהוסיף 1 מ"ל של טריפסין לאמצע צלחת תרבות התא דגירה במשך 5 דקות ב 37 מעלות צלזיוס.
- לעצור את תגובת trypsinization על ידי הוספת 10 מ"ל של DMEM כולל 10% FCS ו pipette פתרון התא למעלה ולמטה עם pipettor להפריד באופן ידני את התאים.
- לנתח את מספר התא למיליליטר באמצעות תא ספירה.
- זרע 68,000 תאים ב 2 מ"ל בינוני לכל באר על כיסוי זכוכית מחליק בצלחת 6-well. פזרו את התאים בתוך הלוח של 6 בארות על ידי טלטול זהיר של הצלחת אופקית ואנכית.
הערה: תאים צריכים לשכב מפוזרים. - דגירה התאים לילה באינקובטור 37 °C (37 °F) עם 5% CO2.
2. הדבקה של תאים
- הכן שני צינורות סטריליים 1.5 מ"ל (אחד עבור DNA מדולל (A) ואחד עבור ריאגנט מדולל עבור transfection השומנים הקטיוניים (B)). פיפטה 0.75 מיקרוגרם של nephrin ו 0.75 מיקרוגרם של פלסמיד ביטוי cDNA podocin לכל באר לתוך צינור אחד 1.5 מ"ל לדלל אותו לתוך 100 μL של מדיום סרום מופחת לכל באר. הוסף 3 μL של ריאגנט transfection השומנים הקטיוניים לכל טוב לצינור השני 1.5 מ"ל לדלל עם 100 μL של מדיום סרום מופחת. דגירה שתי התגובות במשך 5 דקות בטמפרטורת החדר.
- שלבו את שתי התגובות (A ו-B) למתחם DNA-שומנים והדגירה במשך 20 דקות בטמפרטורת החדר. בזהירות להוסיף 200 μL של קומפלקס DNA-שומנים לכל באר.
- דגירה התאים transfected ב 37 °C (69 °F) עם 5% CO2 עבור 48 שעות מבלי לשנות את המדיום.
3. אימונולה של מבנים תאיים
- הכן פתרון תיקון (4% (w / v) paraformaldehyde ב PBS, 1 מ"ל / טוב), פתרון פרמביליזציה (0.5% (w / v) טריטון X-100 ב PBS, 1 מ"ל / טוב), ופתרון חסימה (5% (v / v) סרום סרום אלבומין ב PBS, 1 mL / טוב).
- הסר את המדיום באמצעות התקן ואקום. הוסף 2 מ"ל של PBS לכל באר כדי להסיר מדיום נוסף. לשאוף את PBS לחלוטין.
הערה: כדי להימנע משטיפת תאים עם PBS, הקפד pipette PBS לא על כיסוי זכוכית להחליק ישירות. - לתקן תאים עם 4% (w / v) paraformaldehyde (PFA) מומס PBS במשך 10 דקות בטמפרטורת החדר.
הערה: לחלופין, לתקן תאים ב 3% (v / v) גליוקסל-אתנול18. - השלך PFA ולשטוף תאים פעמיים PBS (2 מ"ל כל אחד) על ידי הימנעות צינור ישיר על תלושי כיסוי זכוכית. לחלחל את התאים הקבועים עם טריטון X-100 0.5% (w / v) ב PBS במשך 10 דקות בטמפרטורת החדר.
- הסר את פתרון permeabilization ולשטוף פעמיים עם PBS כפי שצוין בשלב 3.2.
- חסום את התאים על-ידי הוספת 1 מ"ל של 5% (v/v) BSA ב- PBS למשך שעה בטמפרטורת החדר. דגירה התאים עם 200 μL של הנוגדן העיקרי (נוגדן אנטי podocin 1:200 ב 1% (v / v) BSA ב PBS) לילה ב 4 °C (69 °F).
הערה: לחלופין, דגירה הנוגדן העיקרי עבור 1 שעה בטמפרטורת החדר. - הסר את הנוגדן העיקרי ולשטוף שלוש פעמים עם PBS כמו בשלב 3.2. הוסף את הנוגדן המשני (עז נגד ארנב Alexa 488 1:1000 ב 1% (v / v) BSA ב PBS) עבור 1 שעה בטמפרטורת החדר. השאר את התאים בחושך באמצעות תיבה.
- להשליך את הנוגדן המשני ולשטוף עם PBS שלוש פעמים.
- הסר PBS ולהדגיר את התאים עם 200 μL של נוגדן אנטינפרין 1:100 ב 1% (v / v) BSA ב PBS עבור 1 שעה בטמפרטורת החדר. לשטוף עם PBS שלוש פעמים. השאר את התאים בחושך באמצעות תיבה.
- הסר PBS ודגר עם חמור הנוגדן המשני נגד שרקן 633, 1:200, במשך שעה אחת בטמפרטורת החדר. לשטוף עם PBS שלוש פעמים. השאר את התאים בחושך באמצעות תיבה.
4. מיקרוסקופיית הרחבה
- הכנה
- כדי ליצור את המרווחים עבור תא הג'לציה, כיסוי זכוכית חתוך מחליק #1.0 ו- #1.5 לפסים 5 מ"מ (ארבעה כל שקופית זכוכית) באמצעות סכין יהלום. מקמו את פסי החלקת הכיסוי #1.5 מ"מ כך שייצרו ריבוע באורך 2.5 ס"מ על מגלשת זכוכית והניחו אותם בתא מכתים(איור 2A1-C1). פיפט טיפה של ddH2O לפינות הכיכר לדבוק פסים לכסות זכוכית להחליק אחד לשני אל מגלשת הזכוכית(איור 2A2-C2).
הערה: הימנע ייבוש מלא של ddH2O כמו כוח הידבקות ילך לאיבוד. במידת הצורך, יש למרוח טיפות נוספות של ddH2O. המתן כ- 20 דקות כך שתעודות כיסוי #1.5 מ"מ מחוברות ביציבות לפני שתתחיל בשלב 4.1.2. - מניחים ארבעה פסים #1.0 כיסוי זכוכית להחליק לכל כיסוי להחליק על #1.5 מ"מ לכסות תלושים. הדבק את הפסים על-ידי צנרת טיפה על כל פס החלקה #1.5 מ"מ(איור 2A3-C3).
הערה: עובי הג'ל צריך להיות לפחות 0.15 מ"מ כדי להקל על הטיפול בהתקדמות הפרוטוקול. עם זאת, כדי למנוע ג'ל מוגזם על גבי התאים, לשמור על גובה מרווחים קרוב מצע התא. על ידי שימוש #1.5 ו פסים #1.0 לכסות להחליק כמו מרווחים, גובה המרווחים יהיה כ 0.3 מ"מ. התאים נצמדים לזכוכית הכיסוי (גובה 0.12 מ"מ). לכן, הג'ל יהיה עבה מספיק כדי להתמודד אבל ג'ל מוגזם על גבי התאים נמנע באמצעות #1.0 ו #1.5 לכסות פסים זכוכית כמו מרווחים. - למכסה תא הג'לציה יש לעטוף כיסוי (#1.5) בסרט פרפין. הימנעו מקפלי או לכלוך על סרט הפרפין(איור 2A5-C5).
- כדי ליצור את המרווחים עבור תא הג'לציה, כיסוי זכוכית חתוך מחליק #1.0 ו- #1.5 לפסים 5 מ"מ (ארבעה כל שקופית זכוכית) באמצעות סכין יהלום. מקמו את פסי החלקת הכיסוי #1.5 מ"מ כך שייצרו ריבוע באורך 2.5 ס"מ על מגלשת זכוכית והניחו אותם בתא מכתים(איור 2A1-C1). פיפט טיפה של ddH2O לפינות הכיכר לדבוק פסים לכסות זכוכית להחליק אחד לשני אל מגלשת הזכוכית(איור 2A2-C2).
- עיגון ופולמור (ג'לציה)
- הכנת מאגר העיגון (ראה טבלה 1). לטיפול בעיגון, יש להחליף את PBS ב-250 μL של חיץ עיגון לבאר ישירות על כיסוי הזכוכית ולדגירה למשך 3 שעות בטמפרטורת החדר. שמור על המצע בחושך באמצעות תיבה.
הערה: לחלופין, דגירה לילה בטמפרטורת החדר. מכינים מאגר עיגון טרי לכל ניסוי ומחכים 10-15 דקות עד שהוא מומס כראוי. 6-(אקרילויל)אמינו)חומצה הקסנואית, succinimidyl אסתר (AcX) צריך להיות מוחלף כל 4-5 חודשים כדי להבטיח עיגון נאות. - הסר את מאגר העיגון ושטוף פעם אחת עם PBS של 1.5 מ"ל לבאר.
- כדי להכתים סיבי אקטין, להפשיר פתרון פאלודין תואם ExM ולהדגיר את הפאלואידין (5 μL של פאלודין מדולל ב 195 μL של 1% (v / v) BSA ב PBS / טוב) במשך 45 דקות בטמפרטורת החדר. שמור דגימות בחושך באמצעות תיבה.
- בינתיים, להמיס אקרילט נתרן ב ddH2O באמצעות מכשיר ערבוב. על הקרח, הכינו את פתרון המונומר (ראו טבלה 1).
הערה: אקרילט נתרן מומס צריך להיות פתרון ברור וחסר צבע. אם הפתרון הוא צהוב, להחליף עם אקרילט נתרן חדש. - הכינו את תמיסת הג'לינג על הקרח (ראו טבלה 1). פיפט אמוניוםפרוקסידסולפט (APS) לתוך פתרון gelling ממש לפני פתרון gelling מוחל על תא הג'לציה.
- הסר phalloidin מן התאים לשטוף עם 1.5 מ"ל של PBS פעמיים בטמפרטורת החדר. השאר 1.5 מ"ל PBS בתוך הבאר כדי להקל על הסרת המדגם על תלוש כיסוי זכוכית.
- מניחים את התאים על זכוכית הכיסוי לתוך תא gelling באמצעות מלקחיים קנולה להרים את החלקת זכוכית כיסוי מצלחת 6-well.
הערה: התאים צריכים להיות בחלק העליון של תלוש כיסוי הזכוכית. כיסוי הזכוכית לא צריך לגעת במרווחים. - הוסף APS לתמיסת gelling ומערבולת בקרוב. פיפט 200 μL של פתרון gelling על המדגם (איור 2A4-C4). סגור בזהירות את תא הג'לציה על ידי הימנעות מבועות אוויר בתוך הג'ל(איור 2A5-C5).
- דגירה תא gelling לפחות 1 שעה ב 37 מעלות צלזיוס כדי polymerize את הג'ל בתא הכתם הרטוב.
- הכנת מאגר העיגון (ראה טבלה 1). לטיפול בעיגון, יש להחליף את PBS ב-250 μL של חיץ עיגון לבאר ישירות על כיסוי הזכוכית ולדגירה למשך 3 שעות בטמפרטורת החדר. שמור על המצע בחושך באמצעות תיבה.
- הומוגניזציה (עיכול)
- תוציא את תא ההכתמה מהחממה. כדי לפתוח את מכסה תא הג'לציה, הציגו סכין גילוח בין המכסה למרווח. הסר את המכסה בזהירות. הסר את המרווחים עם סכין הגילוח ולחסל את כל הג'ל הנוסף על ידי חיתוך אותו עם סכין הגילוח.
- שים את השקופית עם הג'ל לכסות זכוכית לתוך צלחת מלאה PBS. על ידי טלטול עדין, להסיר את כיסוי מנותק מן הג'ל. כדי להסיר את הג'ל מהצלחת בקלות, לשים את השקופית מתחת לג'ל לצרף את הג'ל למגלשה.
- עם הג'ל על המגלשה, מחלקים את הג'ל לחתיכות קטנות (רבע מהג'ל מחולק לשניים עד שלושה חלקים) באמצעות סכין הגילוח. בעדינות לדחוף חתיכה אחת של ג'ל לתוך באר של צלחת 6-well עם תחתית זכוכית להקיף אותו על ידי מברשת צבע. שמור על ג'ל לחות עם כמות קטנה של PBS באמצעות מברשת צבע, כדי למנוע התייבשות של הג'ל.
הערה: התאים פונים כלפי מטה. - באמצעות מיקרוסקופ הפוך, צלם תמונות מבט כולל עם צמצם מספרי נמוך כדי לקבוע את גורם ההתפשטות לאחר ההתפשטות.
- הכן את מאגר העיכול (ראה טבלה 1). לדלל Proteinase K ל 4 U / mL במאגר העיכול כדי לקבל את פתרון העיכול.
הערה: ניתן לאחסן מאגר עיכול ללא Proteinase K ב-4°C למשך שבוע-שבועיים. - הוסף 500 μL של פתרון העיכול לכל באר לטבול את הג'ל בתוך הפתרון. תן לו לעכל לילה בטמפרטורת החדר ולסגור את המכסה שמירה על הדגימות בחושך.
הערה: לחלופין, תן לו לעכל ב 37 מעלות צלזיוס במשך 1 שעות.
- הרחבה
- הסר את פתרון העיכול עם פיפטה והשליך אותו. הוסיפו 1 מ"ל של ddH2O. דגירו את הג'ל השקוע במשך 10 דקות בטמפרטורת החדר.
- הסר את המים ולהוסיף 1 מ"ל של ddH טרי2O. לחכות 10 דקות ולהמשיך להחליף מים כל 10 דקות עד רמה של הרחבה הוא הגיע.
הערה: הרחבה לדוגמה עד פי 4.5 ניתנת להשגה. הג'ל נעשה ברור אופטית.
- הדמיה
- מוציאים את המים מהג'ל ומתחילים ישירות מיקרוסקופיה. באמצעות מיקרוסקופ הפוך, השתמש בעיקר במטרת אוויר (הגדלה נמוכה) כדי למצוא תאים בתמונה במצב שלפני ההתפשטות (שלב 4.3.4).
- עבור ליעד 40x (שמן/מים) ו- 63x לרזולוציה טובה יותר. לרגש עם אורך הגל של עניין ולקחת את התמונה דרך המצלמה.
- אימות
- צלם תמונת מבט כוללת של הדוגמה. חפש והתאם לאותם מבנים בתוך המדגם שצולמו בשלב 4.3.4. השתמשו בערוץ עם יחס האות לרעש הטוב ביותר לאימות (איור 3 A-B).
הערה: התאם את פרמטרי ההדמיה כדי להשיג בהירות דומה לזו של התמונה שנרכשה במצב שאינו מורחב (שלב 4.3.4). - שכבת-על של תמונות לפני ואחרי ההרחבה על-ידי סיבובן והסטתן באמצעות ImageJ. השתמש בכלי מדידת המרחק ב- ImageJ כדי למדוד את המרחקים בין מבנים הניתנים לזיהוי ברור. למדוד לפחות 10 מבנים שונים.
הערה: לחלופין, השתמש בתסריט פייתון כדי למדוד מרחקים כמתוארב- 14. - חשב את פקטור ההרחבה על-ידי חלוקת מדידות לאחר/קדם-הרחבה.
- לקביעת עיוותים, צלם תמונות עם פתח מספרי גבוה יותר (איור 4A-B). שכב על תמונות אלה ולנתח אותם עם ImageJ או כמתואר ב15.
הערה: קביעת עיוותים צריכה להתבצע באופן שגרתי אך לא בהכרח על כל מדגם.
- צלם תמונת מבט כוללת של הדוגמה. חפש והתאם לאותם מבנים בתוך המדגם שצולמו בשלב 4.3.4. השתמשו בערוץ עם יחס האות לרעש הטוב ביותר לאימות (איור 3 A-B).
תוצאות
הרעיון והתזמון של פרוטוקול ProExM זה מתואר באיור 1. ביום החמישי, תאים חוצה קבועים ומוכתמים בנוגדנים פלואורסצנטיים המכוונים לחלבון המעניין(איור 1A,B). ביום השישי, הטיפול ב-AcX מוביל להיווצרות קבוצות אמינים בכל החלבונים (כולל פלואורופורים)(איור 1A,B)12. לאחר פולמור של הידרוג'ל, קבוצות אמין אלה להיקשר covalently כדי הידרוג'ל (יום 6). לאחר פולמור של הג'ל, הומוגניזציה (עיכול) מבוצעת עם פרוטאינאז K וכתוצאה מכך הרס של חלבונים מבניים של התא (יום 6, איור 1A,B). נוגדנים מתויגים פלואורסצנטיים נשארים שמורים בעיקר לאחר העיכול. בשל שיבוש חלבונים מבניים, דיאליזה במים של ההידרוגל גורמת להתפשטות איזוטרופית של התא בתוך ההידרוגל ביום השביעי(איור 1A,B). הדמיה של המדגם מתבצעת במיקרוסקופ פלואורסצנטי קונבנציונלי (איור 1A). אימות נתונים כדי לקבוע את גורם ההרחבה ולא לכלול עיוותים יש לבצע (איור 1A).
כדי לבצע הרחבה של התא isotropically, שלב gelation הוא חיוני. איור 2 מציג את התצוגה הלרוחבית והעליונה של תא ג'לציה. כיסויי זכוכית בונים את החללים של תא הג'לציה(איור 2A1-3/C1-3). זכוכית הכיסוי עם התאים הקבועים והויטראז' ממוקמת עם התאים כלפי מעלה על מגלשתזכוכית (איור 2A4-C4). המכסה של תא הג'לציה עטוף בפרפילם והוא סגור ללאבועה (איור 2A5-C5).
פרוטוקול ExM זה מאפשר הרחבה של עד פי ארבעה. כדי לקבוע את גורם ההרחבה, חיוני לתמונת תאים לפני ואחרי ההתפשטות (איור 3A + B). עיגון והומוגניזציה לא מספיקים עלולים להוביל לעיוותים וקרעים של תאים. איור 4A + B מציג דוגמאות מייצגות לתאים קרועים בתמונות הגדלה שונות.
ניתן להשתמש בשיטה זו כדי לחקור לוקליזציה משותפת של חלבוני מתאם F-actin ו actin, למשל, podocin ו nephrin (איור 5). Podocin מתואר בירוק בעוד actin מסומן בכחול (איור 5). נפרין מסומן בירוק. אזורים לבנים מצביעים על לוקליזציה משותפת.
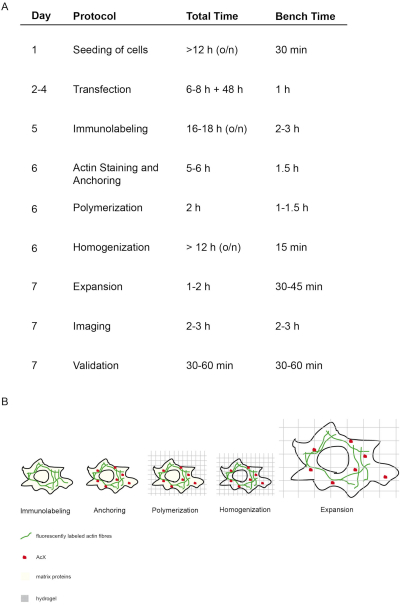
איור 1: מושג ותזמון של פרוטוקול ExM זה. (A) בעמודה "פרוטוקול", כל שלב בפרוטוקול מתואר. (A + B) לאחר זריעה והעברת תאים, מתבצע תיוג חיסוני (Immunolabeling). (A + B) המולקולה הקטנה AcX (נקודה אדומה) נקשרת לכל החלבונים ומעגנת אותם להידרוגל (עיגון). (A + B) באמצעות פולמור כל החלבונים כולל פלואורופורים קשורים בקובאליות דרך AcX להידרוג'ל (פולמוריזציה). (A + B) הומוגניזציה מובילה לעיכול של חלבוני מטריצה מבניים. (A + B) התרחבות מושגת על ידי דיאליזה במים. (A)הדמיה ואימות של הדמיה מסכמים את הניסוי. (A)הפרוטוקול כולו דורש 7 ימים (עמודה "יום") עם שלבי דגירה רבים (הזמן הכולל לטור יום "זמן כולל"), אך זמן הספסל בפועל הוא הרבה פחות כפי שצוין בעמודה המתאימה "זמן ספסל". השתנהמ- 14. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
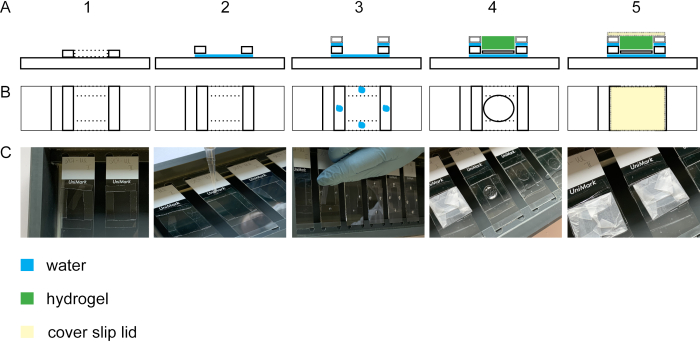
איור 2: בניית תא הג'לציה. תצוגה צדדית(A1)ותצוגה עליונה(B1 + C1)של שקופית זכוכית עם ארבעה פסים כיסוי #1.5. על ידי הוספת טיפת מים בין מגלשת הזכוכית לפסים להחליק כיסוי, הפסים יהיה לדבוק שקופית זכוכית(תצוגה צדדית A2, תצוגה עליונה B2, C2). טיפות מים על פסים כיסוי #1.5 להוביל הידבקות של פסים כיסוי #1.0 הניח על גבי פסים כיסוי #1.5 (נוף צדדי A3, נוף העליון B3, C3). הדגימה בתעודת הכיסוי ממוקמת באמצע המלבן באמצעות מלקחיים. הג'ל הוא pipetted על גבי(תצוגה צדדית A4, תצוגה עליונה B4, C4). (A5) נוף צדדי ונוף עליון(B5 ו- C5)של תא הג'לציה המורכב כולל המכסה הסגור הבנוי מתלוש כיסוי עטוף בפרפילם. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
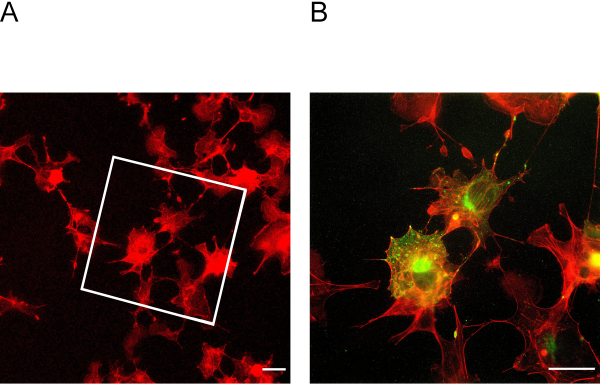
איור 3: תאים לפני ואחרי הרחבה. התיבה מציינת באיזה אזור נמצאים התאים המורחבים באיור 3B. (B) תאים לאחר התרחבות מוכתמים עבור actin באדום podocin בירוק. Podocin שותף לוקליזציה עם actin בפריפריה התא. סרגל קנה מידה = 5 מיקרומטר, גורם הרחבה = 2. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: עיוותים וקרעים של תאים. (A + B) תמונות מיקרוסקופיות מייצגות של תאי cos7 מוכתמים באימונים עבור אקטין (אדום). התאים היו קבועים, מוכתמים, מעוגנים, מתעכלים ומורחבים. (A)קרעים של תאים. החצים הצביעו על אזורים קרועים. סרגל קנה מידה = 5 מיקרומטר, גורם הרחבה = 4. (B) קרעים ועיוותים של תאים. חצים לבנים הצביעו על אזורים קרועים. סרגל קנה מידה = 5 מיקרומטר, גורם הרחבה = 4. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
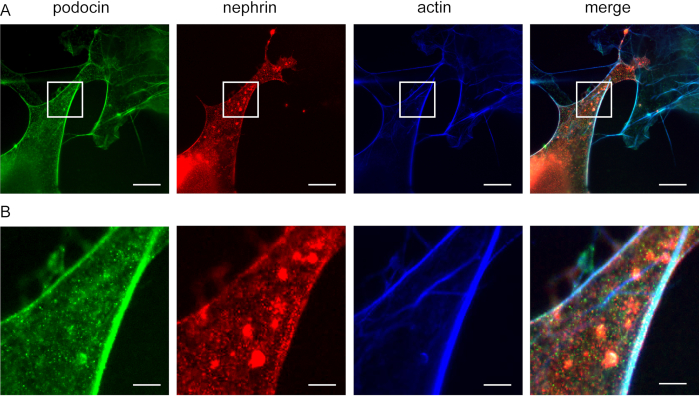
איור 5: פודוצ'ין שותף ללוקליזציה עם נפרין ואקטין. תאי Cos7 מתויגים באופן חיסוני עבור פודוצין, אקטין ונפרין. (A)תאי Cos7 מוכתמים לפודוצין (ירוק), אקטין (כחול) ונפרין (אדום) עם ExM. פודוצ'ין שותף לוקליזציה עם אקטין ונפרין. סרגל קנה מידה = 200 ננומטר, פקטור הרחבה = 4. (B) הגדלה של האזור שצוין ב- (A), סרגל קנה מידה = 40 ננומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מאגר עיגון | ריכוז סופי | ||
| נהקו3 | 150 מ"מ | ||
| אקרילויל-X, SE (AcX) | 0.1 מ"ג/מ"ל | ||
| פתרון מונומר | ריכוז תמיסת מלאי g/100 מ"ל | כמות (מ"ל) | ריכוז סופי (g/100 מ"ל) |
| נתרן אקרילאט | 38 | 2.25 | 8.6 |
| אקרילאמיד (האקרילאמיד) | 50 | 0.5 | 2.5 |
| נ'-מתאילנביסאקרימיד | 2 | 0.75 | 0.15 |
| נתרן כלורי | 29.2 | 4 | 11.7 |
| Pbs | 10x | 1 | פי 1 |
| מים | 0.75 | ||
| הכולל | 9.4 | ||
| פתרון גלינג | ריכוז פתרון מלאי | סכום (μl) | ריכוז סופי (מ"ג/מ"ל) |
| פתרון מונומר | נה | 190 | נה |
| APS | 10% | 4 | 0.1 |
| TEMED (TEMED) | >99% | 4 | 0.1 |
| מים | נה | 2 | נה |
| הכולל | 200 | ||
| פתרון עיכול | ריכוז סופי | ||
| טריס קל, עמ' 8.0 | 1 מ' | ||
| אדטה pH 8.0 | 0.5 מטר | ||
| טריטון X-100 | 0.005% | ||
| גואנידין HCL | 8 מטר | ||
| מים | |||
| פרוטאין קיי | 4 יו/מ"ל |
טבלה 1: פתרונות עבור ExM.
Discussion
השיטה המוצגת מאפשרת לחוקר לדמיין חלבונים תאיים, למשל, רכיבים פודוצין, נפרין וציטוסלטל, למשל, F-actin. בתוך פרוטוקול זה, תאי cos7 מוחצים משמשים כמודל לחקר האינטראקציה של חלבוני דיאפרגמה חתוכים עם F-actin. למרבה הצער, קווי תא podocyte מונצחים אינם מבטאים כמויות אנדוגניות מספיקות של חלבוני דיאפרגמה חתוכים19.
בשיטה זו, ניתן לדמיין חלבונים תאיים ברזולוציה ננומטרית באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי. השלבים הקריטיים ביותר בפרוטוקול הם: 1) עיגון מספיק של קבוצות חלבון אמין הידרוג'ל עם AcX, 2) פולמור נאות של הידרוג'ל, 3) תזמון אופטימלי לעיכול ו 4) מבחר של פלואורופורים תואמים.
עיגון חלבונים תאיים להידרוג'ל חיוני לשיטה זו על מנת לשמר את מיקום החלבון בתוך ההידרוגל במהלך ההתפשטות. AcX היא מולקולה קטנה הנקשרת לקבוצות אמין של חלבונים בתוך תאים ורקמות. AcX יוצר פס כפול פחמן פחמן עם חלבונים, המאפשר שילוב של החלבונים לתוך הידרוג'ל בשלבפולמורציה 20. AcX משלבת גם נוגדנים כך שניתן יהיה לבצע תיוג עם נוגדנים immunofluorescence לפני טיפול AcX. עיגון לא מספיק עלול להוביל לקרעים ולעיוותים של תאים. עקב שינוי של קבוצות אמין על ידי fixatives, אחד צריך לייעל את הקיבעון או את הזמן של קיבעון. בנוסף, תנאי אחסון או עיגון לא ממוטבים עלולים לגרום לקרע ולעיוותים. בהתבסס על הניסיון שלנו, AcX מאבד את ההשפעה האופטימלית שלו כאשר נעשה בו שימוש במשך יותר מ 3-4 חודשים.
פולמור של הג'ל תלוי בטמפרטורה. לכן, אנו ממליצים לשמור את פתרונות הפולמליזציה על הקרח לפני החדרתו לתא הג'לציה. בנוסף, זמן הטיפול של שלב gelation צריך להישמר קצר (פחות מ 5 דקות) על מנת למנוע היווצרות ג'ל מוקדם. ערבוב יסודי של פתרון הפולמליזציה מונע פולמור לא אחיד. בועות אוויר ישפיעו על תהליך ההתפשטות בעת נגיעה במדגם וניתן למנוע אותן על ידי הוספת פתרון פולמור נוסף.
לאחר שילוב של חלבונים הסלולר בתוך הידרוג'ל, שלב הומוגניזציה מכני (או עיכול) יש צורך להבטיח התרחבות. שיטות שונות, למשל, חום וחומר ניקוי או עיכול אנזימטי, קיימות וצריכות להיות מותאמות אישית למדגם שנחקר12,14,20. בתוך פרוטוקול זה, פרוטאז Proteinase K משמש לעיכול אנזימטי. Proteinase K מוחל במינון מספיק כדי להרוס חלבונים מבניים תוך שמירה על רוב החלבונים האחרים כולל נוגדנים פלואורסצנטיים12. אם העיכול אינו שלם, הרחבת הדגימה אינה מספיקה. בנוסף, הדגימה עלולה לקרוע במהלך תהליך ההרחבה (איור 3). אם חלה התרחבות מדגם לקויה, מומלץ להחליף מים. לחלופין, ניתן להתאים את הזמן לעיכול האנזימטי או לפתוח aliquot חדש של פרוטאינאז K.
אם הדגימה מתעכלת יתר על הערך, אותות הפלואורסצנטיות יופחתו. במקרה זה, יש להפחית את זמן העיכול. ב- ExM באופן כללי, עוצמת אות הפלואורסצנטיות ליחידת נפח מצטמצמת עקב ההרחבה הנפחית של המדגם14. לכן, יש לקחת בחשבון זמני חשיפה ארוכים יותר במהלך ההדמיה.
זה חיוני כדי לבחור פלואורופורים תואמי ExM. צבעי ציאנין מושפלים במהלך שלב פולמור13. חלבוני פלואורסצנטיים המבוססים על בקטריופיטוכרומים נהרסים ברובם13. עם זאת, רוב החלבונים דמויי GFP יישמרו13. בנוסף, סטרפטבידין יכול להיות מיושם גם טרום התרחבות, תיוג שינויים שלאחר תרגום כגון S-nitrolysation באמצעות תג מולקולה קטנה13.
Phalloidin, מולקולת תיוג קטנה כדי למקד את cytoskeleton actin, אינו תואם ExM21. כדי להתגבר על עיגון לא מספיק של פאלודין, עיגון trivalent (TRITON) כבר הציג21. גישה זו מציעה מיקוד בו זמנית, תיוג והשתלה של ביומולקולות21.
שיטה זו ניתנת לשינוי כדי להכתים מולקולות RNA (ExFish)22. במיקרוסקופיה הרחבה איטרטיבית (iExM) או מיקרוסקופיה X10, הרזולוציה של 60-70 ננומטר ניתן להרחיב כ 25 ננומטר על ידי החלת ג'ל מתנפח שני בתוך הידרוג'ל המורחב הראשון או ביצוע צעד הרחבה אחד באמצעות הידרוג'לשונה 15,16. מיקרוסקופיית הרחבה אולטרה-מבנית (U-ExM) מאפשרת רזולוציה מעולה של חלבונים המשמרים את ייחוסם לאלמנט אולטרה-מבני (למשל, מיטוכרונדריה, מיקרוטובולים)23. שילוב של ExFish (RNA ו- DNA) ושיטות proExM בוצעו בעבר, כמו גם22,24. הפרוטוקול המוצג משתמש בתאי cos7 חתוכים כמודל לחקור חלבוני דיאפרגמה חתוכים. אנו מצפים כי תאי כליות תרבותיים אחרים, למשל, תאי HEK293T, יכולים לשמש באופן דומה עבור פרוטוקול זה. בהתאם לקו התא, ייתכן שיהיה צורך לבצע התאמות עבור התנאים השונים של culturing ו transfection.
ExM משפר את הרזולוציה של דגימות מוכתמות אימונו על ידי כ 4-פי הגעה לרזולוציה מרחבית לרוחב של 70 ננומטר13. בהשוואה לטכניקות אחרות ברזולוציית-על, ExM מבוצעת במיקרוסקופ פלואורסצנטי קונבנציונלי13,14. לכן, אין ציוד יקר או כוח אדם מאומן במיוחד יש צורך לנהל את שיטת ExM14. למרות שלא כל הפלואורופורים תואמים ל- ExM, ישנם בדרך כלל נוגדנים זמינים רבים עם פלואורופורים ממוטבים עם תכונות פוטו-פיזיקליות הדרושות למיקרוסקופיה ברזולוציה סופר14. החיסרון העיקרי של שיטה זו היא כי ExM אינו תואם עם דגימותחיות 12,14.
בעתיד, שיפור ההרכב הכימי של הידרוג'ל עלול להוביל לרזולוציה מרחבית גבוהה עוד יותר12. השילוב של פרוטוקולים שונים עשוי גם לאפשר הדמיה של חלבונים, RNA, DNA, או שומנים במתחמים בתוך אותה מדגם עם רזולוציה גבוהה כלכך 12.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לבלנקה דובנג'אק וניקולה קוהר על הסיוע הטכני המצוין שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide >99% | Sigma-Aldrich | A3553-100G | |
| 6-((Acryloyl)amino)hexanoic acid, succinimidyl ester, Acryloyl-X, SE | invitrogen | A-20770 | store up to 4 months |
| APS | Sigma-Aldrich | A3678-25G | |
| Deckgläser (cover glasses) | Engelbrecht | K12432 | 24x32mm #1.0 |
| Diamont cutter | VWR | 201-0392 | for cutting the cover slips |
| Guanidine HCl | Sigma-Aldrich | G3272-100G | 8M Stock can be kept at RT |
| Marten hair paintbrush | Leon Hardy | 3 (770) | |
| "Menzel" Deckgläser (cover glasses) | Thermo Fischer | 15654786 | 24x24mm #1.5 |
| N,N`-Methylenbisacrylamide | Sigma-Aldrich | M7256-25G | |
| Objektträger UniMark | Marienfeld | 703010 | |
| Proteinase K | New England Biolabs | P8107S | |
| Sodium Acrylate | Sigma-Aldrich | 408220 | check purity |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | |
| Staining chamber | produced at the university's workshop | ||
| TEMED | ROTH | 2367.1 | |
| 6-Well glass bottom plates | Cellvis | P06-1.5H-N | |
| Antibodies | |||
| Actin-ExM 546 | chrometra | non-available | 1:40 |
| Anti Podocin produced in rabbit | Sigma | P-0372-200UL | 1:200 |
| Donkey anti guinea-pig CF633 | Sigma | SAB4600129-50UL | 1:200 |
| Goat anti rabbit 488 | Life Technologies | A11034 | 1:1000 |
| Guinea pig anti nephrin | Origene | BP5030 | 1:100 |
| Software | |||
| FIJI | |||
| Visiview | |||
| microscope | |||
| AXIO Observer Z1 | Zeiss | non-available |
References
- Matsushita, K., et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 375 (9731), 2073-2081 (2010).
- Faul, C., Asanuma, K., Yanagida-Asanuma, E., Kim, K., Mundel, P. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton. Trends in Cell Biology. 17 (9), 428-437 (2007).
- Saleem, M. A., et al. Co-localization of nephrin, podocin, and the actin cytoskeleton - Evidence for a role in podocyte foot process formation. American Journal of Pathology. 161 (4), 1459-1466 (2002).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein - nephrin - is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Huber, T. B., et al. Podocin-mediated recruitment of nephrin into lipid rafts is required for efficient nephrin signaling. Journal of the American Society of Nephrology. 14, 8(2003).
- Boute, N., et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nature Genetics. 24 (4), 349-354 (2000).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440 (7086), 935-939 (2006).
- van de Linde, S., et al. Direct stochastic optical reconstruction microscopy with standard fluorescent probes. Nature Protocols. 6 (7), 991-1009 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Testa, I., et al. Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength. Biophysical Journal. 99 (8), 2686-2694 (2010).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Truckenbrodt, S., Sommer, C., Rizzoli, S. O., Danzl, J. G. A practical guide to optimization in X10 expansion microscopy. Nature Protocols. 14 (3), 832-863 (2019).
- Truckenbrodt, S., et al. X10 expansion microscopy enables 25-nm resolution on conventional microscopes. Embo Reports. 19 (9), (2018).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Chozinski, T. J., et al. nanoscale optical imaging of mouse and human kidney via expansion microscopy. Scientific Reports. 8 (1), 10396(2018).
- Richter, K. N., et al. Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy. The EMBO Journal. 37 (1), 139-159 (2018).
- Rinschen, M. M., et al. Quantitative deep mapping of the cultured podocyte proteome uncovers shifts in proteostatic mechanisms during differentiation. American Journal of Physiology-Cell Physiology. 311 (3), 404-417 (2016).
- Asano, S. M., et al. Expansion microscopy: protocols for imaging proteins and RNA in cells and tissues. Current Protocols in Cell Biology. 80 (1), 56(2018).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 7860-7867 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved