Method Article
تصوير البروتينات بودوسيتيك نيفرين، أكتين، وبودوسين مع المجهر التوسع
* These authors contributed equally
In This Article
Summary
تمكن الطريقة المقدمة من تصور البروتينات الخلوية المسماة بالفلورسنت مع المجهر التوسعي مما يؤدي إلى دقة 70 نانومتر على المجهر التقليدي.
Abstract
تعطيل مرشح الكبيبي تتألف من بطانة الرحم الكبيبية، غشاء الطابق السفلي الكبيبي وpodocytes، والنتائج في الزلال. تحتوي عمليات القدم Podocyte على حزم أكتين ترتبط ببروتينات محول الهيكل الخلوي مثل بودوسين. تلك البروتينات محول، مثل بودوسين، ربط العمود الفقري للحجاب الحاجز شق الكبيبي، مثل الكليفرين، إلى الهيكل الخلوي أكتين. دراسة توطين ووظيفة هذه وغيرها من البروتينات podocytic أمر ضروري لفهم دور مرشح الكبيبي في الصحة والمرض. البروتوكول المقدم يمكن المستخدم من تصور أكتين، بودوسين، والنيفرين في الخلايا مع التصوير فائقة الدقة على المجهر التقليدي. أولا، الخلايا ملطخة بتقنية الفلورة المناعية التقليدية. ثم يتم تثبيت جميع البروتينات داخل العينة بشكل متناقض على هيدروجيل قابل للانتفاخ. من خلال الهضم مع البروتين K ، يتم شق البروتينات الهيكلية مما يسمح بتورم إيزوتروبي من الجل في الخطوة الأخيرة. يؤدي غسيل الكلى للعينة في الماء إلى توسيع العينة بمقدار 4-4.5 أضعاف ويمكن تصوير العينة عبر مجهر مضان تقليدي ، مما يجعل الدقة المحتملة 70 نانومتر.
Introduction
الزلال هو معلمة بديلة من مخاطر القلب والأوعية الدموية والنتائج من تعطيل مرشح الكبيبي1. يتكون الفلتر الكبيبي من البطانة الفينيستة، وغشاء الطابق السفلي الكبيبي والحجاب الحاجز الشقي الذي تشكله الخلايا الحبيبية. عمليات القدم الأولية والثانوية من podocytes التفاف حول جدار الشعيرات الدموية من الكبيبة2. يتم الحفاظ على الهيكل الدقيق لعمليات القدم من خلال حزم أكتين القشرية التي تعمل أيضا كمرساة لبروتينات الحجاب الحاجز متعددة الشق وغيرها من البروتينات محول2. ويسمى البروتين العمود الفقري للشق الحاجز الكليرين ويتفاعل بطريقة متجانسة مع جزيئات الكليفرين من podocytes معارضة. عن طريق البروتينات محول متنوعة, ويرتبط الكليفرين إلى الهيكل الخلوي أكتين2,3. الطفرات في الجين NPHS1 ترميز الكلية تؤدي إلى متلازمة الكلى من النوع الفنلندي4.
واحدة من البروتينات المتفاعلة في الكليفرين هو بودوسين، وهو بروتين يشبه دبوس الشعر لعائلة ستوماتين3. بودوسين يجند النيفرين إلى الطوافات الدهون ويربط ذلك إلى الهيكل الخلوي أكتين5. يتم ترميز بودوسين بواسطة الجين NPHS2. الطفرات في NPHS2 تؤدي إلى متلازمة الكلية المقاومة للستيرويد6.
لتصور والمشاركة في توطين البروتينات محول أكتين، يمكن استخدام تقنيات immunofluorescence. لسوء الحظ ، فإن حاجز الحيود للضوء يحد من دقة المجاهر الفلورية التقليدية إلى 200-350 نانومتر7. تقنيات المجهر رواية، على سبيل المثال، حفز استنفاد الانبعاثات (STED)8،الصورة تنشيط المجهر التعريب (PALM)9،مجهرية إعادة البناء البصري العشوائي (العاصفة أو dSTORM) أو المجهر حذف الحالة الأرضية تليها عودة جزيء الفردية (GSDIM)9،10،11،تمكين قرار يصل إلى ما يقرب من 10 نانومتر. ومع ذلك ، فإن هذه التقنيات فائقة الدقة تتطلب مجاهر باهظة الثمن ، وموظفين مدربين تدريبا جيدا ، وبالتالي فهي غير متوفرة في العديد من المختبرات.
المجهر التوسع (إكس إم) هو تقنية جديدة وبسيطة تمكن التصوير فائقة الدقة مع المجاهر التقليدية ويحتمل أن تكون متاحة لمجتمع بحثي كبير12. في المجهر توسيع الاحتفاظ بالبروتين (proExM) ، يتم إصلاح عينة من الفائدة (الخلايا أو الأنسجة) وملطخة بالفلوروفوريس13. ثم ترتكز البروتينات داخل العينة بشكل مكافئ بواسطة جزيء صغير (6-(Acryloyl)amino) حمض الهيكسانويك ، إستر succinimidyl ، AcX) في هيدروجيل قابل للانتفاخ13. من خلال الهضم الأنزيمي مع البروتين K (ProK) ، تحافظ البروتينات والفلوروفوريس على وضعها النسبي داخل الجل بعد التوسع13. بعد تورم الجل ، تتوسع العينة حتى 4.5 أضعاف (توسع حجمي 90 ضعفا) مما يؤدي إلى دقة الجانبية الفعالة من حوالي 60-70 نانومتر (300 نانومتر / 4.5). تعديلات هذه التقنية يمكن أن تسمح حتى لتوسيع 10 أضعاف (1000 أضعاف التوسع الحجمي)، مما يجعل قرار من 20-30 نانومتر على المجاهر التقليدية14،15،16.
وقد تم تصور الهياكل الكبيبية من الفئران والكلى البشرية عن طريق ExM17. ضمن هذه الورقة، نقدم بروتوكول proExM مفصل لتصور صور فائقة الدقة ل F-actin وبوبودوسين البروتين محول أكتين داخل الخلايا باستخدام المجهر الفلوري التقليدي.
Protocol
1. تقسيم وبذر الخلايا
- الاحماء المعقمة Dulbecco النسر المعدل المتوسط (DMEM) بما في ذلك 10٪ مصل العجل الجنيني (FCS)، الفوسفات المعقم العازلة المالحة (PBS) والريبسين العقيم إلى 37 درجة مئوية. تفعيل مقاعد البدلاء نظيفة.
- إعداد لوحة 6-جيدا بإضافة زلة غطاء زجاجي معقم واحد (10 ملم) إلى كل بئر باستخدام ملقط معقم.
- وضع طبق ثقافة الخلية 10 سم مع خلايا Cos7 تحت مقاعد البدلاء نظيفة. تحت مقاعد البدلاء نظيفة، يستنشق المتوسطة الخلايا باستخدام جهاز فراغ.
- عقد طبق ثقافة الخلية المقشورة في يد واحدة وإضافة 10 مل من برنامج تلفزيوني معقم إلى جانب طبق ثقافة الخلية لتجنب الشطف قبالة الخلايا. وضع طبق ثقافة الخلية أسفل بحيث PBS يشطف طبق ثقافة الخلية كاملة.
- إزالة برنامج تلفزيوني وإضافة 1 مل من تريبسين إلى منتصف طبق ثقافة الخلية واحتضان لمدة 5 دقائق في 37 درجة مئوية.
- وقف رد فعل المحاولة بإضافة 10 مل من DMEM بما في ذلك FCS 10٪ وماصة حل الخلية صعودا وهبوطا مع ماصة لفصل الخلايا يدويا.
- تحليل رقم الخلية لكل ملليلتر باستخدام غرفة الجرد.
- البذور 68،000 الخلايا في المتوسط 2 مل لكل بئر على الغطاء الزجاجي زلات في لوحة 6-جيدا. توزيع الخلايا داخل لوحة 6-جيدا عن طريق هز بحذر لوحة أفقيا وعموديا.
ملاحظة: يجب أن تكون الخلايا مبعثرة. - احتضان الخلايا بين عشية وضحاها في حاضنة 37 درجة مئوية مع 5٪ CO2.
2. نقل الخلايا
- إعداد أنبوبين معقمين سعة كل منهما 1.5 مل (أحدهما للحمض النووي المخفف (A) وواحد للكواشف المخففة لإصابة الدهون القيصرية (B)). ماصة 0.75 ميكروغرام من الكليفرين و 0.75 ميكروغرام من بودوسين cDNA التعبير البلازميد لكل بئر في أنبوب واحد 1.5 مل وتمييعه إلى 100 ميكروغرام من انخفاض متوسط المصل لكل بئر. أضف 3 ميكرولتر من كاشف إصابة الدهون القيصرية لكل بئر إلى أنبوب 1.5 مل الثاني وتمييعه مع 100 ميكرولتر من متوسط المصل المنخفض. احتضان كل من ردود الفعل لمدة 5 دقائق في درجة حرارة الغرفة.
- الجمع بين كل من ردود الفعل (A و B) إلى مجمع الحمض النووي الدهون واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة. إضافة بحذر 200 ميكرولتر من مجمع الحمض النووي الدهون إلى كل بئر.
- احتضان الخلايا المصابة في 37 درجة مئوية مع 5٪ CO2 لمدة 48 ساعة دون تغيير الوسط.
3. التكبيل المناعي للهياكل الخلوية
- إعداد حل تحديد (4٪ (ث / الخامس) paraformaldehyde في برنامج تلفزيوني، 1 مل / حسنا)، والحل permeabilization (0.5٪ (ث / الخامس) تريتون X-100 في برنامج تلفزيوني، 1 مل / حسنا)، وحل حجب (5٪ (v/v) ألبوم مصل البقر في برنامج تلفزيوني، 1 مل / حسنا).
- قم بإزالة الوسيطة باستخدام جهاز فراغ. إضافة 2 مل من برنامج تلفزيوني لكل بئر لإزالة المتوسطة اضافية. يستنشق برنامج تلفزيوني تماما.
ملاحظة: لتجنب غسل الخلايا مع برنامج تلفزيوني، تأكد من ماصة PBS لا على الغطاء الزجاجي زلة مباشرة. - إصلاح الخلايا مع 4٪ (ث / الخامس) paraformaldehyde (PFA) المذاب في برنامج تلفزيوني لمدة 10 دقيقة في درجة حرارة الغرفة.
ملاحظة: بدلا من ذلك، إصلاح الخلايا في 3٪ (v/v) غليوكسيال الإيثانول18. - تجاهل PFA وغسل الخلايا مرتين في برنامج تلفزيوني (2 مل لكل منهما) عن طريق تجنب الأنابيب المباشرة على زلات الغطاء الزجاجي. Permeabilize الخلايا الثابتة مع تريتون X-100 0.5٪ (ث / الخامس) في برنامج تلفزيوني لمدة 10 دقيقة في درجة حرارة الغرفة.
- إزالة الحل permeabilization وغسل مرتين مع برنامج تلفزيوني كما هو مبين في الخطوة 3.2.
- منع الخلايا عن طريق إضافة 1 مل من 5٪ (v/v) BSA في برنامج تلفزيوني لمدة 1 ساعة في درجة حرارة الغرفة. احتضان الخلايا مع 200 ميكرولتر من الأجسام المضادة الأولية (الأجسام المضادة للبودوسين 1:200 في 1٪ (v/v) BSA في برنامج تلفزيوني) بين عشية وضحاها في 4 درجة مئوية.
ملاحظة: بدلا من ذلك، احتضان الأجسام المضادة الأولية لمدة 1 ساعة في درجة حرارة الغرفة. - إزالة الأجسام المضادة الأساسية وغسل ثلاث مرات مع برنامج تلفزيوني كما هو الحال في الخطوة 3.2. إضافة الأجسام المضادة الثانوية (الماعز المضادة للأرنب اليكسا 488 1:1000 في 1٪ (v/v) BSA في برنامج تلفزيوني) لمدة 1 ساعة في درجة حرارة الغرفة. إبقاء الخلايا في الظلام باستخدام مربع.
- تجاهل الأجسام المضادة الثانوية وغسل مع برنامج تلفزيوني ثلاث مرات.
- إزالة برنامج تلفزيوني واحتضان الخلايا مع 200 ميكرولتر من الأجسام المضادة للنيفرين 1:100 في 1٪ (v/v) BSA في برنامج تلفزيوني لمدة 1 ساعة في درجة حرارة الغرفة. غسل مع برنامج تلفزيوني ثلاث مرات. إبقاء الخلايا في الظلام باستخدام مربع.
- إزالة برنامج تلفزيوني واحتضان مع حمار الأجسام المضادة الثانوية خنزير غينيا 633، 1:200، لمدة 1 ساعة في درجة حرارة الغرفة. غسل مع برنامج تلفزيوني ثلاث مرات. إبقاء الخلايا في الظلام باستخدام مربع.
4. المجهر التوسع
- اعداد
- لتشكيل الفواصل لغرفة الهلام، قطع الغطاء الزجاجي زلات #1.0 و #1.5 إلى 5 ملم المشارب (أربعة لكل شريحة زجاجية) باستخدام سكين الماس. وضع #1.5 ملم تغطية زلة المشارب بحيث تشكل مربع من 2.5 سم طول على شريحة زجاجية ووضعها في غرفة تلطيخ (الشكل 2A1-C1). ماصة قطرة من DDH2O في زوايا المربع على الالتزام بخطوط زلة الغطاء الزجاجي لبعضها البعض وإلى الشريحة الزجاجية (الشكل 2A2-C2).
ملاحظة: تجنب التجفيف الكامل من DDH2O كما سوف تضيع قوة التصاق. إذا لزم الأمر، وتطبيق المزيد من قطرات من DDH2O. الانتظار لمدة 20 دقيقة تقريبا بحيث يتم إرفاق زلات غطاء #1.5 ملم بشكل ثابت قبل البدء مع الخطوة 4.1.2. - ضع أربعة خطوط #1.0 زلة غطاء زجاجي لكل غطاء زلة على زلات غطاء #1.5 ملم. الالتزام المشارب عن طريق pipetting قطرة على كل #1.5 ملم غطاء زلة الشريط (الشكل 2A3-C3).
ملاحظة: يجب أن يكون سمك الجل 0.15 ملم على الأقل لتسهيل التعامل مع تقدم البروتوكول. ومع ذلك، لتجنب هلام المفرط على رأس الخلايا، والحفاظ على ارتفاع الفواصل قريبة من ركيزة الخلية. باستخدام #1.5 و #1.0 تغطية زلة المشارب كما الفواصل، وارتفاع الفواصل سيكون حوالي 0.3 ملم. تلتصق الخلايا بزجاج الغطاء (الارتفاع 0.12 مم). ولذلك، فإن هلام تكون سميكة بما يكفي للتعامل مع ولكن يتم تجنب هلام المفرط على رأس الخلايا باستخدام #1.0 و #1.5 تغطية خطوط الزجاج والفواصل. - بالنسبة لغطاء غرفة الهلام، قم بلف زجاج غطاء (#1.5) مع فيلم البارافين. تجنب أي طيات أو الأوساخ على فيلم البارافين(الشكل 2A5-C5).
- لتشكيل الفواصل لغرفة الهلام، قطع الغطاء الزجاجي زلات #1.0 و #1.5 إلى 5 ملم المشارب (أربعة لكل شريحة زجاجية) باستخدام سكين الماس. وضع #1.5 ملم تغطية زلة المشارب بحيث تشكل مربع من 2.5 سم طول على شريحة زجاجية ووضعها في غرفة تلطيخ (الشكل 2A1-C1). ماصة قطرة من DDH2O في زوايا المربع على الالتزام بخطوط زلة الغطاء الزجاجي لبعضها البعض وإلى الشريحة الزجاجية (الشكل 2A2-C2).
- الرسو والبوليمرة (هلام)
- قم بإعداد المخزن المؤقت للإرساء (راجع الجدول 1). لترسيخ العلاج، واستبدال برنامج تلفزيوني مع 250 ميكرولتر من مرساة العازلة لكل بئر مباشرة على زلة الغطاء الزجاجي واحتضان لمدة 3 ساعة في درجة حرارة الغرفة. الحفاظ على الركيزة في الظلام باستخدام مربع.
ملاحظة: بدلا من ذلك، احتضان بين عشية وضحاها في درجة حرارة الغرفة. إعداد العازلة مرساة جديدة لكل تجربة وانتظر لمدة 10-15 دقيقة حتى يذوب بشكل صحيح. 6-((Acryloyl)amino)حمض هيكسانويك، وينبغي استبدال إستر succinimidyl (AcX) كل 4-5 أشهر لضمان الرسو كافية. - إزالة العازلة ترسيخ وغسل مرة واحدة مع برنامج تلفزيوني 1.5 مل لكل بئر.
- لتلطيخ ألياف أكتين، إذابة محلول phalloidin متوافق ExM واحتضان phalloidin (5 ميكرولتر من phalloidin المخفف في 195 ميكرولتر من 1٪ (v/v) BSA في PBS / جيدا) لمدة 45 دقيقة في درجة حرارة الغرفة. احتفظ بعينات في الظلام باستخدام صندوق.
- في غضون ذلك، حل أكريلات الصوديوم في DDH2O باستخدام جهاز إثارة. على الجليد، وإعداد حل مونومر (انظر الجدول 1).
ملاحظة: يجب أن يكون أكريلات الصوديوم المذاب محلولا واضحا وعديم اللون. إذا كان المحلول أصفر، فاستبدله بأكريلات الصوديوم الجديدة. - إعداد حل هلام على الجليد (انظر الجدول 1). ماصة الأمونيومبيروكسيدسولفيت (APS) في حل الهلام الحق قبل تطبيق حل هلام إلى غرفة الهلام.
- إزالة phalloidin من الخلايا ويغسل مع 1.5 مل من برنامج تلفزيوني مرتين في درجة حرارة الغرفة. اترك 1.5 مل من برنامج تلفزيوني داخل البئر لتسهيل إزالة العينة على زلة الغطاء الزجاجي.
- ضع الخلايا على زجاج الغطاء في غرفة الهلام باستخدام ملقط وقنية لرفع زلة زجاج الغطاء من لوحة 6-well.
ملاحظة: يجب أن تكون الخلايا في الجزء العلوي من زلة الغطاء الزجاجي. وينبغي أن زلة غطاء الزجاج لا تلمس الفواصل. - إضافة وكالة الأنباء الجزائرية إلى حل هلام ودوامة قريبا. ماصة 200 ميكرولتر من حل هلام على العينة (الشكل 2A4 -C4). أغلق بحذر غرفة الهلام عن طريق تجنب فقاعات الهواء داخل الجل (الشكل 2A5-C5).
- احتضان غرفة هلام لمدة ساعة واحدة على الأقل في 37 درجة مئوية لبلمرة هلام في غرفة تلطيخ الرطب.
- قم بإعداد المخزن المؤقت للإرساء (راجع الجدول 1). لترسيخ العلاج، واستبدال برنامج تلفزيوني مع 250 ميكرولتر من مرساة العازلة لكل بئر مباشرة على زلة الغطاء الزجاجي واحتضان لمدة 3 ساعة في درجة حرارة الغرفة. الحفاظ على الركيزة في الظلام باستخدام مربع.
- التجانس (الهضم)
- أخرج غرفة التلطيخ من الحاضنة لفتح غطاء غرفة الهلام، أدخل شفرة حلاقة بين الغطاء والمتباعد. إزالة الغطاء بحذر. إزالة الفواصل مع شفرة الحلاقة والقضاء على جميع هلام اضافية عن طريق قطع عليه مع شفرة الحلاقة.
- وضع الشريحة مع هلام وتغطية الزجاج في طبق مليء برنامج تلفزيوني. عن طريق هز بلطف، وإزالة الزجاج غطاء منفصلة من هلام. لإزالة الجل من الطبق بسهولة، ضع الشريحة أسفل الجل لإرفاق الجل بالشريحة.
- مع هلام على الشريحة، وتقسيم هلام في قطع صغيرة (ينقسم ربع هلام إلى قطعتين إلى ثلاث قطع) باستخدام شفرة الحلاقة. دفع بلطف قطعة واحدة من هلام في بئر من لوحة 6-جيدا مع أسفل الزجاج وتطويه بواسطة فرشاة الطلاء. الحفاظ على هلام مبللة مع كمية صغيرة من برنامج تلفزيوني باستخدام فرشاة الرسم لتجنب الجفاف من هلام.
ملاحظة: تواجه الخلايا لأسفل. - باستخدام المجهر المقلوب، خذ صورا عامة ذات فتحة رقمية منخفضة لتحديد عامل التوسع بعد التوسع.
- قم بإعداد المخزن المؤقت للهضم (انظر الجدول 1). تمييع البروتين K إلى 4 U / مل في العازلة الهضم لتلقي محلول الهضم.
ملاحظة: يمكن تخزين مخزن الهضم المؤقت بدون Proteinase K عند 4 درجات مئوية لمدة 1-2 أسابيع. - أضف 500 ميكرولتر من محلول الهضم إلى كل بئر وغمر الجل داخل المحلول. السماح لها هضم بين عشية وضحاها في درجة حرارة الغرفة وإغلاق الغطاء حفظ العينات في الظلام.
ملاحظة: بدلا من ذلك، دعه يهضم عند 37 درجة مئوية لمدة ساعة واحدة.
- توسع
- إزالة محلول الهضم مع ماصة والتخلص منه. أضف 1 مل من ddH2O. احتضن الجل المغمور لمدة 10 دقائق في درجة حرارة الغرفة.
- إزالة المياه وإضافة 1 مل من ddHالطازجة 2O. الانتظار لمدة 10 دقيقة ومواصلة تبادل المياه كل 10 دقيقة حتى يتم التوصل إلى هضبة من التوسع.
ملاحظة: يمكن تحقيق توسيع العينة حتى 4.5 أضعاف. يصبح الجل واضحا بصريا.
- التصوير
- إزالة الماء من الجل وبدء المجهر مباشرة. باستخدام مجهر مقلوب، استخدم في المقام الأول هدف الهواء (التكبير المنخفض) للعثور على خلايا مصورة في حالة ما قبل التوسع (الخطوة 4.3.4).
- قم بالتبديل إلى هدف 40x (الزيت /الماء) و 63x للحصول على دقة أفضل. تثير مع الطول الموجي للاهتمام واتخاذ الصورة عبر الكاميرا.
- التحقق
- خذ صورة عامة للعينة. ابحث عن نفس الهياكل الموجودة في العينة التي تم تصويرها في الخطوة 4.3.4 ومطابقتها. استخدام القناة مع أفضل نسبة إشارة إلى الضوضاء للتحقق من صحة(الشكل 3 A-B).
ملاحظة: ضبط معلمات التصوير لتحقيق سطوع مماثل كما هو الحال في الصورة المكتسبة في حالة غير موسعة (الخطوة 4.3.4). - تراكب الصور قبل وبعد التوسع عن طريق تدويرها وتحويلها مع ImageJ. استخدم أداة قياس المسافة في ImageJ لقياس المسافات بين الهياكل التي يمكن تحديدها بوضوح. قياس ما لا يقل عن 10 هياكل مختلفة.
ملاحظة: بدلا من ذلك، استخدم برنامج نصي Python لقياس المسافات كما هو موضح في14. - حساب عامل التوسعة بقسمة قياسات ما بعد/ما قبل التوسع.
- لتحديد التشوهات ، التقاط الصور مع فتحة رقمية أعلى(الشكل 4A--باء). تراكب هذه الصور وتحليلها مع ImageJ أو كما هو موضح في15.
ملاحظة: يجب أن يتم تحديد التشوهات بشكل روتيني ولكن ليس بالضرورة على كل عينة.
- خذ صورة عامة للعينة. ابحث عن نفس الهياكل الموجودة في العينة التي تم تصويرها في الخطوة 4.3.4 ومطابقتها. استخدام القناة مع أفضل نسبة إشارة إلى الضوضاء للتحقق من صحة(الشكل 3 A-B).
النتائج
يتم تصوير مفهوم وتوقيت هذا البروتوكول proExM في الشكل 1. في اليوم 5، يتم إصلاح الخلايا المصابة وملطخة بالأجسام المضادة الفلورية التي تستهدف البروتين من الفائدة(الشكل 1A،B). في اليوم السادس، يؤدي العلاج ب AcX إلى تكوين مجموعات أمين على جميع البروتينات (بما في ذلك الفلوروفوريس) (الشكل 1A،B)12. عند بلمرة الهيدروجيل ، ترتبط هذه المجموعات الأمينية بشكل متناقض بالهيدروجيل (اليوم السادس). بعد بلمرة الجل ، يتم إجراء التجانس (الهضم) مع البروتين K مما يؤدي إلى تدمير البروتينات الهيكلية للخلية (اليوم 6 ، الشكل 1A،B). تظل الأجسام المضادة المسماة بالفلورسنت محفوظة في الغالب بعد الهضم. بسبب تعطل البروتينات الهيكلية ، يؤدي غسيل الكلى المائي للهيدروجيل إلى توسع متساوي الخواص للخلية داخل الهيدروجيل في اليوم 7(الشكل 1A،B). يتم إجراء تصوير العينة باستخدام مجهر مضان تقليدي(الشكل 1A). يجب إجراء التحقق من صحة البيانات لتحديد عامل التوسع واستبعاد التشوهات (الشكل 1A).
لتنفيذ التوسع في الخلية isotropically، خطوة هلام ضروري. يظهر الشكل 2 المنظر الجانبي والأعلى لغرفة الهلام. الزجاج الغطاء زلات بناء الفواصل من غرفة الهلام (الشكل 2A1-3/C1-3). يتم وضع الزجاج الغطاء مع الخلايا الثابتة والملطخة مع الخلايا صعودا على شريحة زجاجية (الشكل 2A4-C4). غطاء غرفة الهلام ملفوفة مع parafilm ومغلقة خالية من فقاعة(الشكل 2A5-C5).
يمكن هذا البروتوكول ExM توسيع ما يصل إلى أربعة أضعاف. لتحديد عامل التوسع، من الضروري تصوير الخلايا قبل وبعد التوسع (الشكل 3A + B). قد يؤدي عدم كفاية الرسو والتجانس إلى تشوهات وتمزقات في الخلايا. يظهر الشكل 4A + B أمثلة تمثيلية للخلايا الممزقة في صور تكبير مختلفة.
ويمكن استخدام هذه الطريقة للتحقيق في التوطين المشترك للبروتينات محول F-أكتين وأكتين، على سبيل المثال، بودوسين والنيفرين(الشكل 5). يصور بودوسين باللون الأخضر في حين وصفت actin باللون الأزرق (الشكل 5). تم وضع علامة على النيفرين باللون الأخضر. تشير المناطق البيضاء إلى التوطين المشترك.
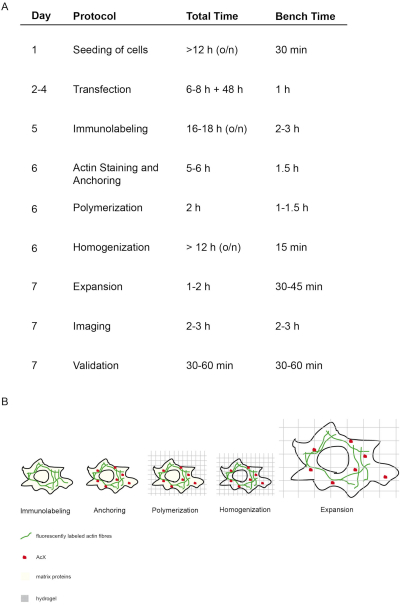
الشكل 1: مفهوم وتوقيت هذا البروتوكول ExM. (أ) في العمود "بروتوكول" ، يتم تحديد كل خطوة من البروتوكول. (أ + ب) بعد البذور وخلايا العدوى ، يتم إجراء وضع العلامات المناعية (الوسم المناعي). (أ + ب) يرتبط الجزيء الصغير AcX (النقطة الحمراء) بجميع البروتينات ويرسو عليها إلى الهيدروجيل (الرسو). (أ + ب) عن طريق البلمرة ترتبط جميع البروتينات بما في ذلك الفلوروفوريس بشكل مشترك عبر AcX إلى الهيدروجيل (البلمرة). (أ + ب) التجانس يؤدي إلى هضم البروتينات مصفوفة الهيكلية. (أ + ب) ويتحقق التوسع عن طريق غسيل الكلى في الماء. (أ)التصوير والتحقق من صحة التصوير يضع اللمسات الأخيرة على التجربة. (أ)يتطلب البروتوكول بأكمله 7 أيام (العمود "اليوم") مع العديد من خطوات الحضانة (إجمالي الوقت لكل عمود في اليوم "الوقت الإجمالي") ، ولكن الوقت الفعلي للمقاعد البدلاء أقل بكثير كما هو مبين في العمود المعني "وقت مقاعد البدلاء". تم التعديل من14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
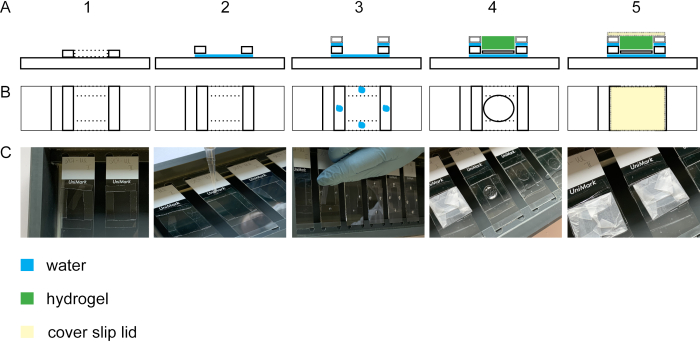
الشكل 2: بناء غرفة الهلام. منظر جانبي (A1) وعرض علوي (B1 + C1) لشريحة زجاجية مع أربعة خطوط تغطية #1.5. بإضافة قطرة ماء بين الشريحة الزجاجية وخطوط زلة الغطاء ، ستلتزم المشارب بالشريحة الزجاجية(عرض الجانب A2، العرض العلوي B2 ، C2). قطرات من الماء على خطوط تغطية #1.5 يؤدي إلى التصاق #1.0 تغطية المشارب وضعت على رأس #1.5 تغطية المشارب (الجانب عرض A3، أعلى عرض B3 ، C3). يتم وضع العينة على زلة الغطاء في منتصف المستطيل باستخدام ملقط. هو pipetted هلام على رأس (الجانب عرض A4، أعلى عرض B4 ، C4). (A5) عرض الجانب وعرض أعلى (B5 و C5) من غرفة gelation تجميعها بما في ذلك الغطاء المغلق الذي بني من زلة غطاء ملفوفة في parafilm. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
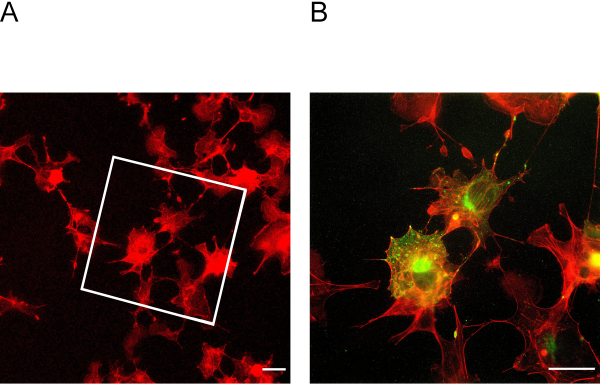
الشكل 3: خلايا قبل وبعد التوسع. (أ) خلايا قبل التوسع ملطخة actin. يشير المربع إلى المنطقة التي تقع فيها الخلايا الموسعة في الشكل 3B. (ب) الخلايا بعد التوسع ملطخة للactin في الأحمر وpodocin باللون الأخضر. بودوسين يشارك في توطين مع أكتين في محيط الخلية. شريط المقياس = 5 ميكرومتر، عامل التوسيع = 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4:تشوهات وتمزقات الخلايا. (A + B) صور مجهرية تمثيلية لخلايا cos7 الملطخة بالمناعة للactin (أحمر). كانت الخلايا ثابتة وملطخة ومرساة ومهضمة وموسعة. (أ)تمزقات الخلايا. أشارت الأسهم إلى تمزق المناطق. شريط المقياس = 5 ميكرومتر، عامل التوسيع = 4. (ب)تمزق وتشويه الخلايا. أشارت الأسهم البيضاء إلى تمزق المناطق. شريط المقياس = 5 ميكرومتر، عامل التوسيع = 4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
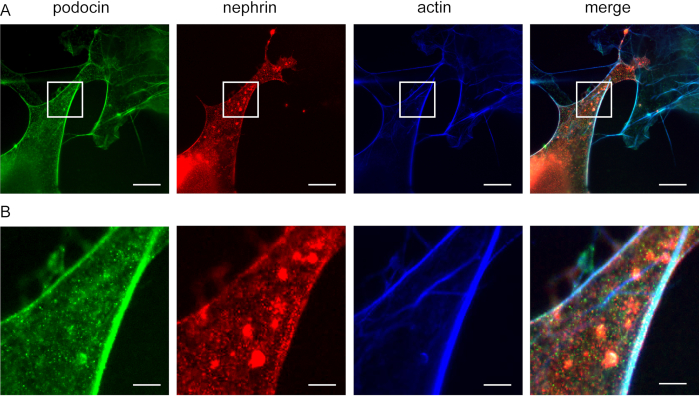
الشكل 5: بودوسين يشارك في توطين مع النيفرين والاكاتين. Cos7 الخلايا immunofluorescently المسمى لبوبودوسين، أكتين، والنيفرين. (أ)خلايا Cos7 ملطخة بودوسين (الأخضر)، أكتين (الأزرق)، والنيفرين (الأحمر) مع إكس إم. بودوسين يشارك في توطين مع أكتين والنيفرين. شريط المقياس = 200 نانومتر، عامل التوسيع = 4. (ب) تكبير المنطقة المشار إليها في (A) ، شريط المقياس = 40 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| ارتساء المخزن المؤقت | التركيز النهائي | ||
| ناهكو3 | 150 مليون متر | ||
| أكريلويل-إكس، SE (AcX) | 0.1 ملغم/مل | ||
| حل مونومر | تركيز محلول المخزون g/100 مل | المبلغ (مل) | التركيز النهائي (ز/100 مل) |
| أكريلات الصوديوم | 38 | 2.25 | 8.6 |
| أكريلاميد | 50 | 0.5 | 2.5 |
| N,N'-ميثيلينبيساكريلاميد | 2 | 0.75 | 0.15 |
| كلوريد الصوديوم | 29.2 | 4 | 11.7 |
| برنامج تلفزيوني | 10x | 1 | 1x |
| الماء | 0.75 | ||
| مجموع | 9.4 | ||
| حل جيلينج | تركيز محلول المخزون | كمية (ميكرولتر) | التركيز النهائي (ملغ / مل) |
| حل مونومر | NA | 190 | NA |
| وكالة الأنباء الجزائرية | 10% | 4 | 0.1 |
| تميم | >99٪ | 4 | 0.1 |
| الماء | NA | 2 | NA |
| مجموع | 200 | ||
| حل الهضم | التركيز النهائي | ||
| تريس Cl, pH 8.0 | 1 م | ||
| EDTA pH 8.0 | 0.5 متر | ||
| تريتون X-100 | 0.005% | ||
| جوانيدين HCL | 8 م | ||
| الماء | |||
| بروتيناز K | 4 U/مل |
الجدول 1: حلول ل ExM.
Discussion
تمكن الطريقة المعروضة المحقق من تصور البروتينات الخلوية ، على سبيل المثال ، بودوسين ، نيفرين ، ومكونات الهيكل الخلوي ، على سبيل المثال ، F-actin. ضمن هذا البروتوكول، يتم استخدام خلايا cos7 المصابة كنموذج لدراسة التفاعل بين بروتينات الحجاب الحاجز الشق مع F-actin. لسوء الحظ، خطوط خلايا podocyte الخالدة لا تعبر عن كميات داخلية كافية من بروتينات الحجاب الحاجز الشق19.
مع هذه الطريقة ، يمكن تصور البروتينات الخلوية بدقة نانوية باستخدام مجهر مضان تقليدي. الخطوات الأكثر أهمية في البروتوكول هي: 1) ترسيخ كافية من مجموعات أمين البروتين إلى الهيدروجيل مع AcX، 2) البلمرة كافية من الهيدروجيل، 3) التوقيت الأمثل للهضم و 4) اختيار الفلوروفورس متوافقة.
إن تثبيت البروتينات الخلوية على الهيدروجيل أمر ضروري لهذه الطريقة من أجل الحفاظ على موقع البروتين داخل الهيدروجيل أثناء التوسع. AcX هو جزيء صغير يرتبط بمجموعات أمينية من البروتينات داخل الخلايا والأنسجة. AcX يخلق الكربون الكربون مزدوجة النطاق مع البروتينات، وتمكين دمج البروتينات في هيدروجيل في خطوة البلمرة20. كما يدمج AcX الأجسام المضادة بحيث يمكن وضع العلامات مع الأجسام المضادة immunofluorescence قبل العلاج AcX. قد يؤدي عدم كفاية الرسو إلى تمزقات وتشوهات في الخلايا. بسبب تعديل مجموعات الأمين عن طريق المثبتات ، يحتاج المرء إلى تحسين التثبيت أو وقت التثبيت. وبالإضافة إلى ذلك، قد يؤدي عدم كفاية التخزين أو ظروف الرسو غير المحسنة إلى تمزقات وتشوهات. بناء على خبرتنا، تفقد AcX تأثيرها الأمثل عند استخدامها لأكثر من 3-4 أشهر.
البلمرة من هلام تعتمد على درجة الحرارة. لذلك، نوصي بالحفاظ على حلول البلمرة على الجليد قبل إدخاله في غرفة الهلام. بالإضافة إلى ذلك ، يجب أن يبقى وقت التعامل مع خطوة الهلام قصيرا (أقل من 5 دقائق) من أجل تجنب تشكيل الجل المبكر. خلط شامل للمحلول البلمرة يمنع البلمرة متفاوتة. سوف تؤثر فقاعات الهواء على عملية التوسع عند لمس العينة ويمكن منعها عن طريق إضافة المزيد من محلول البلمرة.
بعد دمج البروتينات الخلوية داخل الهيدروجيل ، هناك حاجة إلى خطوة التجانس الميكانيكية (أو الهضم) لضمان التوسع. توجد طرق مختلفة ، على سبيل المثال ، الحرارة والمنظفات أو الهضم الأنزيمي ، وتحتاج إلى تخصيصها للعينة التي تم التحقيق فيها12و14و20. ضمن هذا البروتوكول، يتم استخدام البروتين البروتيني بروتياز K للهضم الأنزيمي. يتم تطبيق البروتين K بجرعة كافية لتدمير البروتينات الهيكلية مع الحفاظ على معظم البروتينات الأخرى بما في ذلك الأجسام المضادة الفلورية12. إذا كان الهضم غير مكتمل، فإن توسيع العينة غير كاف. وبالإضافة إلى ذلك، يمكن للعينة المسيل للدموع أثناء عملية التوسع (الشكل 3). في حالة حدوث توسع غير كاف في العينة ، يوصى باستبدال المياه. بدلا من ذلك ، يمكن تعديل وقت الهضم الأنزيمي أو فتح aliquot جديد من Proteinase K.
إذا تم الإفراط في هضم العينة، سوف تتضاءل إشارات الفلورسينس. في هذه الحالة، يجب تقليل وقت الهضم. في ExM بشكل عام ، يتم تقليل كثافة الإشارة الفلورية لكل وحدة من وحدات الحجم بسبب التوسع الحجمي للعينة14. لذلك ، يجب النظر في أوقات التعرض الأطول أثناء التصوير.
من الضروري تحديد الفلوروفورات المتوافقة مع ExM. تتحلل الأصباغ السيانين خلال الخطوة البلمرة13. البروتينات الفلورية على أساس البكتيريا هي أيضا دمرت إلى حد كبير13. ومع ذلك، سيتم الحفاظ على معظم البروتينات مثل GFP13. وبالإضافة إلى ذلك، يمكن أيضا أن تطبق streptavidin قبل التوسع، ووضع العلامات على التعديلات ما بعد الترجمة مثل S-nitrolysation عبر علامة جزيء صغير13.
فالويدين، جزيء وسم صغير لاستهداف الهيكل الخلوي أكتين، غير متوافق مع ExM21. للتغلب على الرسو غير كافية من phalloidin, وقد أدخلت ترسي ثلاثي التكافؤ (TRITON)21. يقدم هذا النهج الاستهداف المتزامن ووضع العلامات وتطعيم الجزيئات الحيوية21.
يمكن تعديل هذه الطريقة لتلطخ جزيئات الحمض النووي الريبي (ExFish)22. في المجهر التوسع التكراري (iExM) أو X10 المجهر، يمكن تمديد القرار من 60-70 نانومتر إلى ما يقرب من 25 نانومتر عن طريق تطبيق هلام تضخم الثاني داخل هيدروجيل الموسعة الأولى أو إجراء خطوة توسعة واحدة باستخدام هيدروجيلمختلفة 15،16. المجهرية توسيع Ultrastructure (U-ExM) تمكن القرار السوبر من البروتينات الحفاظ على نسبها إلى عنصر ultrastructural (على سبيل المثال، ميتوشروندريا، microtubules)23. وقد سبق أن تم تنفيذ مزيج من ExFish (الحمض النووي الريبي والحمض النووي) وأساليب proExM وكذلك22،24. يستخدم البروتوكول المقدم خلايا cos7 المصابة كنموذج للتحقيق في بروتينات الحجاب الحاجز الشقية. ونتوقع أن خلايا الكلى المستزرعة المقيمة الأخرى، مثل خلايا HEK293T، يمكن استخدامها بالمثل لهذا البروتوكول. اعتمادا على خط الخلية، قد تحتاج إلى إجراء تعديلات لظروف زراعة ونقل مختلفة.
ExM يعزز القرار من العينات الملطخة بالمناعة من قبل حوالي 4 أضعاف التوصل إلى دقة المكانية الجانبية من 70 نانومتر13. بالمقارنة مع تقنيات الدقة الفائقة الأخرى ، يتم تنفيذ ExM على مجهر مضان تقليدي13،14. لذلك، لا توجد معدات باهظة الثمن أو الموظفين المدربين على وجه التحديد ضرورية لإجراء طريقة ExM14. على الرغم من عدم توافق جميع الفلوروفور مع ExM ، إلا أن هناك العديد من الأجسام المضادة المتاحة بشكل عام مع الفلوروفوريس الأمثل مع الخصائص الفيزيائية الضوئية اللازمة للتنظير المجهري فائق الدقة14. العيب الرئيسي لهذه الطريقة هو أن ExM غير متوافق معالعينات الحية 12،14.
في المستقبل ، قد يؤدي تحسين التركيب الكيميائي للهيدروجيل إلى دقة مكانية أعلى12. مزيج من بروتوكولات مختلفة قد تمكن أيضا التصور من البروتينات، الحمض النووي الريبي، الحمض النووي، أو الدهون في المجمعات داخل نفس العينة مع مثل هذه عالية الدقة12.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويود صاحبا البلاغ أن يشكرا بلانكا دوفنياك ونيكولا كوهر على مساعدتهما التقنية الممتازة.
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide >99% | Sigma-Aldrich | A3553-100G | |
| 6-((Acryloyl)amino)hexanoic acid, succinimidyl ester, Acryloyl-X, SE | invitrogen | A-20770 | store up to 4 months |
| APS | Sigma-Aldrich | A3678-25G | |
| Deckgläser (cover glasses) | Engelbrecht | K12432 | 24x32mm #1.0 |
| Diamont cutter | VWR | 201-0392 | for cutting the cover slips |
| Guanidine HCl | Sigma-Aldrich | G3272-100G | 8M Stock can be kept at RT |
| Marten hair paintbrush | Leon Hardy | 3 (770) | |
| "Menzel" Deckgläser (cover glasses) | Thermo Fischer | 15654786 | 24x24mm #1.5 |
| N,N`-Methylenbisacrylamide | Sigma-Aldrich | M7256-25G | |
| Objektträger UniMark | Marienfeld | 703010 | |
| Proteinase K | New England Biolabs | P8107S | |
| Sodium Acrylate | Sigma-Aldrich | 408220 | check purity |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | |
| Staining chamber | produced at the university's workshop | ||
| TEMED | ROTH | 2367.1 | |
| 6-Well glass bottom plates | Cellvis | P06-1.5H-N | |
| Antibodies | |||
| Actin-ExM 546 | chrometra | non-available | 1:40 |
| Anti Podocin produced in rabbit | Sigma | P-0372-200UL | 1:200 |
| Donkey anti guinea-pig CF633 | Sigma | SAB4600129-50UL | 1:200 |
| Goat anti rabbit 488 | Life Technologies | A11034 | 1:1000 |
| Guinea pig anti nephrin | Origene | BP5030 | 1:100 |
| Software | |||
| FIJI | |||
| Visiview | |||
| microscope | |||
| AXIO Observer Z1 | Zeiss | non-available |
References
- Matsushita, K., et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 375 (9731), 2073-2081 (2010).
- Faul, C., Asanuma, K., Yanagida-Asanuma, E., Kim, K., Mundel, P. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton. Trends in Cell Biology. 17 (9), 428-437 (2007).
- Saleem, M. A., et al. Co-localization of nephrin, podocin, and the actin cytoskeleton - Evidence for a role in podocyte foot process formation. American Journal of Pathology. 161 (4), 1459-1466 (2002).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein - nephrin - is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Huber, T. B., et al. Podocin-mediated recruitment of nephrin into lipid rafts is required for efficient nephrin signaling. Journal of the American Society of Nephrology. 14, 8(2003).
- Boute, N., et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nature Genetics. 24 (4), 349-354 (2000).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440 (7086), 935-939 (2006).
- van de Linde, S., et al. Direct stochastic optical reconstruction microscopy with standard fluorescent probes. Nature Protocols. 6 (7), 991-1009 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Testa, I., et al. Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength. Biophysical Journal. 99 (8), 2686-2694 (2010).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Truckenbrodt, S., Sommer, C., Rizzoli, S. O., Danzl, J. G. A practical guide to optimization in X10 expansion microscopy. Nature Protocols. 14 (3), 832-863 (2019).
- Truckenbrodt, S., et al. X10 expansion microscopy enables 25-nm resolution on conventional microscopes. Embo Reports. 19 (9), (2018).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Chozinski, T. J., et al. nanoscale optical imaging of mouse and human kidney via expansion microscopy. Scientific Reports. 8 (1), 10396(2018).
- Richter, K. N., et al. Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy. The EMBO Journal. 37 (1), 139-159 (2018).
- Rinschen, M. M., et al. Quantitative deep mapping of the cultured podocyte proteome uncovers shifts in proteostatic mechanisms during differentiation. American Journal of Physiology-Cell Physiology. 311 (3), 404-417 (2016).
- Asano, S. M., et al. Expansion microscopy: protocols for imaging proteins and RNA in cells and tissues. Current Protocols in Cell Biology. 80 (1), 56(2018).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 7860-7867 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved