Method Article
Изображение подоцитических белков Нефрин, Актин и Подоцин с помощью микроскопии расширения
В этой статье
Резюме
Представленный метод позволяет визуализировать флуоресцентно помеченные клеточные белки с расширением микроскопии, что приводит к разрешению 70 нм на обычном микроскопе.
Аннотация
Нарушение гломерулярного фильтра, состоящего из гломерулярного эндотелия, гломерулярной мембраны подвала и подоцитов, приводит к альбуминурии. Подоцитные процессы ног содержат актиновые пучки, которые связываются с белками цитоскелетного адаптера, такими как подоцин. Эти адаптерные белки, такие как подоцин, связывают основу диафрагмы гломерулярной щели, такой как нефрит, с актином цитоскелетом. Изучение локализации и функции этих и других подоцитных белков имеет важное значение для понимания роли гломерулярного фильтра в здоровье и болезнях. Представленный протокол позволяет пользователю визуализировать актин, подоцин и нефрит в клетках с визуализацией супер разрешения на обычном микроскопе. Во-первых, клетки окрашиваются с помощью обычной техники иммунофлуоресценции. Все белки в образце затем ковалентно закреплены на опухаемом гидрогеле. Через пищеварение с протеиназой K, структурные белки расщепляются позволяет изотропный отек геля в последний шаг. Диализ образца в воде приводит к 4-4,5-кратное расширение образца и образец может быть изображен с помощью обычного микроскопа флуоресценции, что делает потенциальное разрешение 70 нм.
Введение
Альбуминурия является суррогатным параметром сердечно-сосудистого риска и является результатом нарушения гломерулярного фильтра1. Гломерулярный фильтр состоит из фенестированного эндотелия, гломерулярной мембраны подвала и щелевой диафрагмы, образованной подоцитами. Первичные и вторичные процессы ног подоцитов обернуть вокруг капиллярной стенки гломерула2. Деликатная структура ног процессов поддерживается корковых актин расслоения, которые также служат в качестве якорей для нескольких белков щели диафрагмы и других белковадаптера 2. Белковый белок разреза диафрагмы называется нефритом и взаимодействует гомофилической манерой с молекулами нефрита противоположных подоцитов. Через различные белки адаптера, нефрит связан с актином цитоскелетом2,3. Мутации в нефрин-кодирующих ген NPHS1 приводят к нефротическому синдрому финского типа4.
Одним из взаимодействующих белков нефрита является подоцин, волосяной белок семьи стоматин3. Подоцин вербует нефрит к липидным плотам и связывает его с актином цитоскелетом5. Подоцин кодируется геном NPHS2. Мутации в NPHS2 приводят к стероидоустойчивому нефротическомусиндрому 6.
Для визуализации и локализации белков адаптера актина могут использоваться методы иммунофлуоресценции. К сожалению, дифракционный барьер света ограничивает разрешение обычных флуоресцентных микроскопов до 200-350 нм7. Новые методы микроскопии, например, стимулировали истощение выбросов (STED)8, фотоактивированная микроскопия локализации (PALM)9, стохастическая оптическая микроскопия реконструкции (STORM или dSTORM) или микроскопия удаления состояния земли с последующим индивидуальным возвращением молекулы (GSDIM)9,10,11, позволяют разрешение до приблизительно 10 нм. Тем не менее, эти методы супер разрешения требуют очень дорогих микроскопов, хорошо обученный персонал и поэтому не доступны во многих лабораториях.
Микроскопия расширения (ExM) является новым и простым методом, который позволяет супер разрешение изображения с обычными микроскопами и потенциально доступна для большого научного сообщества12. В микроскопии расширения удержания белка (proExM) образец интереса (клетки или ткани) фиксируется и окрашивается флюорофорами13. Белки в образце затем covalently якорь небольшой молекулы (6-(((Акрилоил)амино)гексаноиновой кислоты, succinimidyl эстер, AcX) в опухаемыйгидрогель 13. Благодаря энзиматическому пищеварению с протеиназой K (ProK), белки и флюорофоры сохраняют свое относительное положение в геле послерасширения 13. После отеков геля образец расширяется до 4,5 раза (90-кратное расширение объема), что приводит к эффективному боковому разрешению примерно 60-70 нм (300 нм/4,5). Модификации этого метода могут даже позволить 10-кратное расширение (1000-кратное расширение объема), что позволяет разрешение 20-30 нм на обычныхмикроскопах 14,15,16.
Гломекулярные структуры мыши и человеческих почек были визуализированы с помощью ExM17. В этой статье мы представляем подробный протокол proExM для визуализации изображений супер разрешения F-актина и подоцин белка актин-адаптера в клетках с помощью обычного флуоресцентного микроскопа.
протокол
1. Разделение и посев клеток
- Разогреть стерильные Dulbecco в модифицированных Eagle's Medium (DMEM), в том числе 10% плода теленка сыворотки (FCS), стерильный фосфат буфера солевого раствора (PBS) и стерильных трипсина до 37 градусов по Цельсию. Активируйте чистую скамейку.
- Подготовка 6-хорошо пластины, добавив один стерильный стеклянный покров скольжения (10 мм) к каждому хорошо с помощью стерильных типсов.
- Положите 10 см клеточной культуры блюдо с Cos7 клетки под чистой скамейке. Под чистой скамейкой, аспирировать клетки среды с помощью вакуумного устройства.
- Держите angulated блюдо культуры клеток в одной руке и добавить 10 мл стерильных PBS в сторону клеточной культуры блюдо, чтобы избежать полоскания клеток. Положите блюдо клеточной культуры вниз так, что PBS полоскания полной культуры клеток блюдо.
- Удалите PBS и добавьте 1 мл трипсина к середине блюда клеточной культуры и инкубировать в течение 5 минут при 37 градусов по Цельсию.
- Остановите реакцию трипсинизации, добавив 10 мл DMEM, включая 10% FCS и пипетки клеточного раствора вверх и вниз с пипеткой, чтобы вручную отделить ячейки.
- Проанализируйте номер ячейки на миллилитр с помощью счетной камеры.
- Семя 68000 клеток в 2 мл среды на колодец на стеклянную крышку скользит в 6-хорошо пластины. Распределите клетки внутри пластины 6 скважин, осторожно встряхивая пластину горизонтально и вертикально.
ПРИМЕЧАНИЕ: Клетки должны лежать рассеянными. - Инкубировать клетки на ночь в инкубаторе 37 градусов по Цельсию с 5% CO2.
2. Трансфекция клеток
- Приготовьте две стерильные трубки 1,5 мл (одна для разбавленной ДНК (A) и одна для разбавленного реагента для катионной липидной трансфекции (B)). Пипетка 0,75 мкг нефрита и 0,75 мкг плазмид экспрессии подоцина кДНА на колодец в одну трубку объемом 1,5 мл и разбавить его в 100 мкл пониженной среды сыворотки на колодец. Добавьте 3 МКЛ катионического липидного реагента на колодец во вторую трубку объемом 1,5 мл и разбавляйте 100 мкл уменьшенной среды сыворотки. Инкубировать обе реакции в течение 5 минут при комнатной температуре.
- Объедините обе реакции (A и B) с ДНК-липидным комплексом и инкубировать в течение 20 минут при комнатной температуре. Осторожно добавьте к каждой хорошо 200 МКЛ ДНК-липидного комплекса.
- Инкубировать трансфицированные клетки при 37 градусов по Цельсию с 5% CO2 в течение 48 ч без изменения среды.
3. Иммунолабелирование клеточных структур
- Подготовь решение для фиксации (4% (w/v) параформальдегид в PBS, 1 мл/колодец), раствор пермеабилизации (0,5% (w/v) Triton X-100 в PBS, 1 мл/колодец) и блокирующий раствор (5% (v/v) альбомин сыворотки крупного рогатого скота в PBS, 1 мл/колодец).
- Удалите носитель с помощью вакуумного устройства. Добавьте 2 мл PBS к каждому хорошо, чтобы удалить дополнительную среду. Аспирировать PBS полностью.
ПРИМЕЧАНИЕ: Чтобы избежать смывания клеток с PBS, убедитесь, что пипетка PBS не на стеклянную крышку скольжения непосредственно. - Исправить клетки с 4% (ж / в) параформальдегид (PFA) растворяется в PBS в течение 10 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Кроме того, исправить клетки в 3% (V / V) глиоксал-этанол18. - Отбросьте PFA и мыть клетки дважды в PBS (2 мл каждый), избегая прямого трубопроводов на стеклянной крышке скользит. Permeabilize фиксированных клеток с Triton X-100 0,5% (w/v) в PBS в течение 10 мин при комнатной температуре.
- Удалите раствор пермеабилизации и промойте дважды с помощью PBS, как указано в шаге 3.2.
- Блокируйте клетки, добавляя 1 мл 5% (v/v) BSA в PBS для 1 ч при комнатной температуре. Инкубировать клетки с 200 ЗЛ первичного антитела (анти-подоцин антитела 1:200 в 1% (V / V) BSA в PBS) в одночасье при 4 кк.
ПРИМЕЧАНИЕ: Кроме того, инкубировать первичное антитело для 1 ч при комнатной температуре. - Удалить первичные антитела и мыть три раза с PBS, как в шаге 3.2. Добавьте вторичное антитело (коза анти-кролик Alexa 488 1:1000 в 1% (v/v) BSA в PBS) для 1 h при комнатной температуре. Держите клетки в темноте с помощью коробки.
- Откажитесь от вторичного антитела и мыть с PBS три раза.
- Удалить PBS и инкубировать клетки с 200 йл анти-нефрин антитела 1:100 в 1% (v/v) BSA в PBS для 1 ч при комнатной температуре. Вымойте с PBS три раза. Держите клетки в темноте с помощью коробки.
- Удалить PBS и инкубировать со вторичным антителом осла анти-морской свинки 633, 1:200, для 1 ч при комнатной температуре. Вымойте с PBS три раза. Держите клетки в темноте с помощью коробки.
4. Микроскопия расширения
- подготовка
- Чтобы сформировать прокладки для гелеобразной камеры, вырезать стеклянную крышку скользит #1,0 и #1,5 в 5 мм полосы (по четыре на стеклянную горку) с помощью алмазного ножа. Распоистите #1,5 мм крышкой полоски скольжения так, чтобы они образуют квадрат длиной 2,5 см на стеклянной горке и поместите их в окрашивание камеры(рисунок 2A1-C1). Pipette капли ddH2O в углах площади придерживаться стеклянной крышки скольжения полос друг к другу и к стеклянной горке(рисунок 2A2-C2).
ПРИМЕЧАНИЕ: Избегайте полной сушки ddH2O, как адгезионная сила заблудится. При необходимости нанесите больше капель ddH2O. Подождите около 20 минут, чтобы #1,5 мм крышки скользит ножом, прежде чем начать с шагом 4.1.2. - Поместите четыре #1,0 стеклянной крышки скольжения полосы на крышку скольжения на #1,5 мм крышки скользит. Придерживайтесь полос, трубя каплю на каждой #1,5 мм крышки скольжения полосы(рисунок 2A3-C3).
ПРИМЕЧАНИЕ: толщина геля должна быть не менее 0,15 мм, чтобы облегчить обработку в ходе протокола. Однако, чтобы избежать чрезмерного геля на верхней части клеток, держать высоту спейсеров близко к подложки клетки. При использовании #1,5 и #1,0 крышки скольжения полосы в качестве спейсеров, высота промецев будет примерно 0,3 мм. Клетки прилипают к крышке стекла (высота 0,12 мм). Таким образом, гель будет достаточно толстым, чтобы обрабатывать, но чрезмерное гель на верхней части клеток избежать использования #1,0 и #1,5 крышки стеклянные полосы в качестве промещиков. - Для крышки гелеобразной камеры оберните крышкой стекло (#1,5) парафиновой пленкой. Избегайте складок или грязи на парафиновой пленке(рисунок 2A5-C5).
- Чтобы сформировать прокладки для гелеобразной камеры, вырезать стеклянную крышку скользит #1,0 и #1,5 в 5 мм полосы (по четыре на стеклянную горку) с помощью алмазного ножа. Распоистите #1,5 мм крышкой полоски скольжения так, чтобы они образуют квадрат длиной 2,5 см на стеклянной горке и поместите их в окрашивание камеры(рисунок 2A1-C1). Pipette капли ddH2O в углах площади придерживаться стеклянной крышки скольжения полос друг к другу и к стеклянной горке(рисунок 2A2-C2).
- Якорь и полимеризация (гелация)
- Подготовь буфер якоря (см. таблицу 1). Для крепления лечения замените PBS на 250 МКЛ якорного буфера на колодец непосредственно на стеклянную крышку скольжения и инкубировать в течение 3 ч при комнатной температуре. Держите субстрат в темноте с помощью коробки.
ПРИМЕЧАНИЕ: Кроме того, инкубировать на ночь при комнатной температуре. Подготовь свежий буфер якоря для каждого эксперимента и ждать 10-15 минут, пока он не растворяется должным образом. 6-((Acryloyl)amino)hexanoic кислота, succinimidyl ester (AcX) должны быть заменены каждые 4-5 месяцев для обеспечения адекватного крепления. - Снимите якорный буфер и вымойте один раз с 1,5 мл PBS на колодец.
- Чтобы окрашивать актиновые волокна, оттаивать совместимый с ExM фаллоидин-раствор и инкубировать фаллоидин (5 мкл фаллоидин, разбавленный в 195 мкл 1% (v/v) BSA в PBS/well) в течение 45 мин при комнатной температуре. Храните образцы в темноте с помощью коробки.
- В то же время, растворить акрилат натрия в ddH2O с помощью перемешивания устройства. На льду приготовьте раствор мономера (см. таблицу 1).
ПРИМЕЧАНИЕ: Растворенный акрилат натрия должен быть четким и бесцветным раствором. Если раствор желтый, замените новым акрилатом натрия. - Подготовь решение для гелеобразования на льду (см. таблицу 1). Pipette ammoniumperoxidsulfate (APS) в гельлинг раствор прямо перед гелеобразующий раствор применяется к гелеобразуя камеры.
- Удалить фаллоидин из клеток и мыть с 1,5 мл PBS в два раза при комнатной температуре. Оставьте 1,5 мл PBS в пределах хорошо, чтобы облегчить удаление образца на стеклянной крышке скольжения.
- Поместите клетки на крышку стекла в гелеобразующий камера с помощью типсов и канюли, чтобы поднять крышку стекла скольжения от 6-хорошо пластины.
ПРИМЕЧАНИЕ: Клетки должны быть на верхней части стеклянной крышки скольжения. Стеклянная крышка скольжения не должны касаться спейсеров. - Добавьте APS к раствору для гелеобразования и вихрю в ближайшее время. Pipette 200 йл гелеобразного раствора на образце(рисунок 2A4-C4). Осторожно закройте гелеобразную камеру, избегая пузырьков воздуха в геле(рисунок 2A5-C5).
- Инкубировать гелеобразующие камеры, по крайней мере 1 ч при 37 градусов по Цельсию для полимеризации геля во влажной камере окрашивания.
- Подготовь буфер якоря (см. таблицу 1). Для крепления лечения замените PBS на 250 МКЛ якорного буфера на колодец непосредственно на стеклянную крышку скольжения и инкубировать в течение 3 ч при комнатной температуре. Держите субстрат в темноте с помощью коробки.
- Гомогенизация (переваривание)
- Вывеми окрашивание камеры из инкубатора. Чтобы открыть крышку гелеобразной камеры, ввемит лезвие бритвы между крышкой и спейсером. Снимите крышку осторожно. Удалите проемы с лезвием бритвы и устранить все дополнительные гель, разрезая его лезвием бритвы.
- Положите слайд с гелем и крышка стекла в блюдо, наполненное PBS. Встряхивая осторожно, удалить отдельное стекло крышки из геля. Чтобы удалить гель из блюда легко, положить слайд ниже геля, чтобы прикрепить гель к слайду.
- С гелем на слайде, разделить гель на мелкие кусочки (четверть геля делится на две-три части) с помощью лезвия бритвы. Аккуратно нажмите один кусок геля в колодец 6-хорошо пластины со стеклянным дном и обвязать его кистью. Держите гель увлажненным с небольшим количеством PBS с помощью кисти, чтобы избежать обезвоживания геля.
ПРИМЕЧАНИЕ: Клетки сталкиваются вниз. - Используя перевернутый микроскоп, сделайте обзорные снимки с низкой численной диафрагмой, чтобы определить фактор расширения после расширения.
- Подготовь буфер пищеварения (см. таблицу 1). Разбавить Протеиназа K до 4 U/mL в буфер пищеварения, чтобы получить раствор пищеварения.
ПРИМЕЧАНИЕ: Буфер пищеварения без протеиназы K может храниться при 4 градусах Цельсия в течение 1-2 недель. - Добавьте 500 йл раствора пищеварения к каждому хорошо и погрузите гель в раствор. Пусть он переваривается на ночь при комнатной температуре и закрыть крышку, сохраняя образцы в темноте.
ПРИМЕЧАНИЕ: В качестве альтернативы, дайте ему переварить при 37 градусов по Цельсию в течение 1 ч.
- расширение
- Удалите раствор пищеварения с помощью пипетки и отбросьте его. Добавьте 1 мл ddH2O. Инкубировать погруженный гель в течение 10 минут при комнатной температуре.
- Удалите воду и добавьте 1 мл свежего ddH 2 O.Подождите10 минут и продолжайте обмениваться водой каждые 10 минут, пока плато расширения не будет достигнуто.
ПРИМЕЧАНИЕ: Расширение выборки в 4,5 раза достижимо. Гель становится оптически ясным.
- отображение
- Удалить воду из геля и непосредственно начать микроскопию. Используя перевернутый микроскоп, в первую очередь используйте воздушную цель (низкое увеличение), чтобы найти изображенные клетки в состоянии предварительного расширения (шаг 4.3.4).
- Переключитесь на 40x (масло/вода) и 63x цель для лучшего разрешения. Возбуждайте с длиной волны интереса и возьмите изображение через камеру.
- ратификация
- Сделай обзор изображения образца. Найти и сопоставить те же структуры в образце, которые были изображены в шаге 4.3.4. Используйте канал с лучшим соотношением сигнала к шуму для проверки(рисунок 3 A-B).
ПРИМЕЧАНИЕ: Отрегулируйте параметры изображения, чтобы достичь такой же яркости, как на изображении, приобретенное в не расширенном состоянии (шаг 4.3.4). - Наложение изображений до и после расширения путем их вращения и переноса с помощью ImageJ. Используйте инструмент измерения расстояния в ImageJ для измерения расстояний между четко идентифицируемыми структурами. Измерьте по крайней мере 10 различных структур.
ПРИМЕЧАНИЕ: В качестве альтернативы используйте скрипт Python для измерения расстояний, описанных в14. - Рассчитайте фактор расширения путем деления измерений после/до расширения.
- Для определения искажений сделайм снимки с более высокой численной диафрагмой(рисунок 4A-B). Наложить эти изображения и проанализировать их с ImageJ или, как описанов 15.
ПРИМЕЧАНИЕ: Определение искажений должно выполняться регулярно, но не обязательно на каждом образце.
- Сделай обзор изображения образца. Найти и сопоставить те же структуры в образце, которые были изображены в шаге 4.3.4. Используйте канал с лучшим соотношением сигнала к шуму для проверки(рисунок 3 A-B).
Результаты
Концепция и сроки этого протокола proExM изображены на рисунке 1. На 5-й день трансфектные клетки фиксируются и окрашиваются флуоресцентными антителами, нацеленными на белок интереса(рисунок 1A,B). На 6-й день лечение AcX приводит к образованию групп амина на всех белках (включая флюорофоры)(рисунок 1A,B)12. При полимеризации гидрогеля эти аминовые группы ковалентно связываются с гидрогелем (день 6). После полимеризации геля гомогенизация (переваривание) выполняется с помощью протеиназы K, что приводит к разрушению структурных белков клетки (день 6, рисунок 1A,B). Флуоресцентно помеченные антитела остаются в основном сохранены после пищеварения. Из-за нарушения структурных белков, водный диализ гидрогеля приводит к изотропному расширению клетки в гидрогеле на 7-й день(рисунок 1A,B). Изображение образца выполняется с помощью обычного флуоресцентного микроскопа(рисунок 1A). Проверка данных для определения фактора расширения и исключения искажений должна быть выполнена(рисунок 1A).
Для выполнения расширения виолончели изотропически, гелеобразование шаг имеет важное значение. На рисунке 2 показан боковой и верхний вид гелеобразной камеры. Стеклянная крышка скользит построить проемы гелеобразной камеры(рисунок 2A1-3/C1-3). Стекло крышки с фиксированными и окрашенными клетками расположено с клетками вверх на стеклянную горку(рисунок 2A4-C4). Крышка гелеобразной камеры обернута парафильмом и закрыта без пузырьков(рисунок 2A5-C5).
Этот протокол ExM позволяет расширить до четырех раз. Чтобы определить фактор расширения, необходимо изображение ячеек до и после расширения(рисунок 3A и B). Недостаточное закрепления и гомогенизация может привести к искажениям и разрывам клеток. На рисунке 4A и B показаны репрезентативные примеры разорванных ячеек на различных изображениях увеличения.
Этот метод может быть использован для исследования совместной локализации белков F-актина и акторного адаптера, например, подоцина и нефрита(рисунок 5). Подоцин изображен зеленым цветом, а актин помечен синим цветом(рисунок 5). Нефрин отмечен зеленым цветом. Белые области указывают на ко-локализацию.
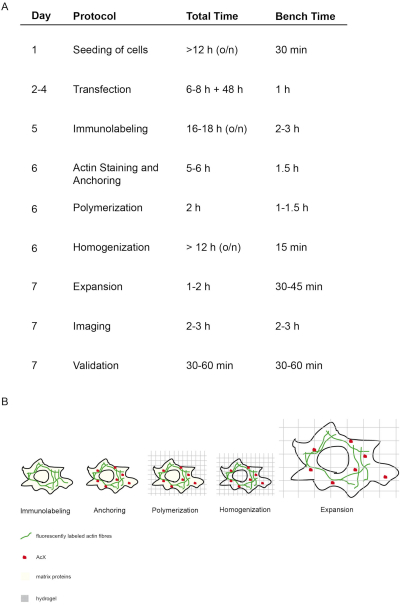
Рисунок 1: Концепция и сроки этого протокола ExM. (A)В столбце "протокол" каждый шаг протокола изложен. (Aи B) После посева и трансфектирования клеток проводится иммунофлуоресцентная маркировка (иммунолабелирование). (Aи B) Маленькая молекула AcX (красная точка) связывается со всеми белками и закрепляет их на гидрогеле (якоре). (Aи B) Через полимеризацию все белки, включая флюорофоры, ковалентно связаны через AcX с гидрогелем (полимеризацией). (Aи B) Гомогенизация приводит к перевариванию структурных матричных белков. (Aи B) Расширение достигается за счет диализа в воде. (A)Визуализация и проверка изображений завершает эксперимент. (A)Весь протокол требует 7 дней (колонка "день") со многими шагами инкубации (общее время в день столбец "общее время"), но фактическое время скамейки гораздо меньше, как указано в соответствующей колонке "скамейке времени". Изменено с14. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
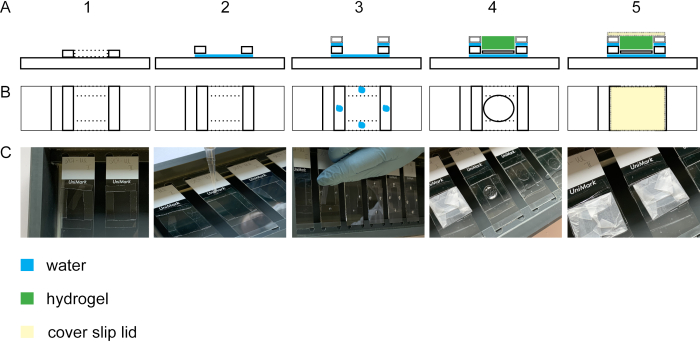
Рисунок 2: Строительство гелеобразной камеры. Видсбоку (A1)и вид сверху (B1 и C1) стеклянной горки с четырьмя #1,5 полосами крышки. Добавив каплю воды между стеклянной горкой и полосами скольжения крышки, полосы будут прилипать к стеклянной горке(вид сбоку A2, вид сверху B2, C2). Капли воды на #1,5 крышки полосы приводят к адгезии #1,0 крышки полосы, уложенные на верхней части #1,5 крышки полосы(вид сбоку A3, вид сверху B3, C3). Образец на крышке скольжения помещается в середине прямоугольника с помощью типсов. Гель пипетки на вершине (видсбоку A4, вид сверху B4, C4). (A5) Вид сбоку и вид сверху (B5 и C5) собранной гелеобразной камеры, включая закрытую крышку, которая построена из крышки скольжения, завернутые в парафильм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
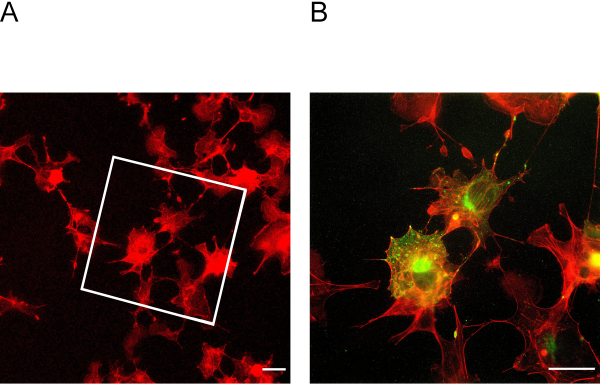
Рисунок 3: Клетки до и после расширения. ( A) Клетки перед расширением окрашенных для актина. Коробка указывает, в какой области лежат расширенные ячейки на рисунке 3B. (B) Клетки после расширения окрашены в актин в красном и podocin зеленым цветом. Подоцин ко-локализуется с актином на периферии клеток. Шкала бар 5 мкм, фактор расширения No 2. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Искажения и разрывы клеток. ( A qB) Представитель микроскопических изображений cos7 клеток иммуно-окрашенных для актина (красный). Клетки были зафиксированы, окрашены, закреплены, переварены и расширены. (A)Разрывы клеток. Стрелки указали разорванные области. Шкала бар 5 мкм, фактор расширения No 4. (B)Разрывы и искажения клеток. Белые стрелки указывали на разорванные области. Шкала бар 5 мкм, фактор расширения No 4. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
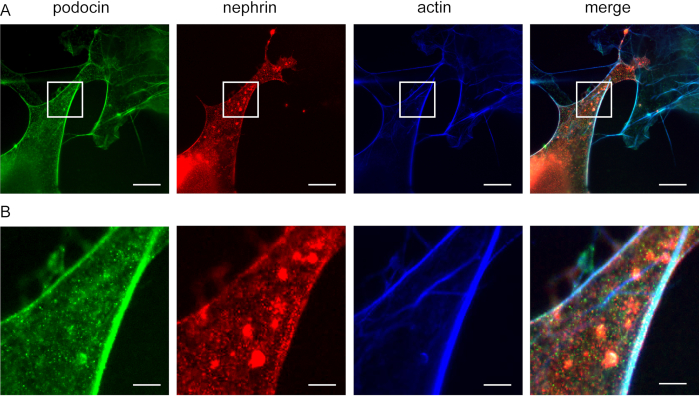
Рисунок 5: Подоцин со-локализуется с нефритом и актином. Cos7 клетки иммунофторесцентно помечены для подоцина, актина и нефрита. (A) Cos7 клетки окрашены для podocin (зеленый), актин (синий), и нефрит (красный) с ExM. Подоцин совместно локализуется с актином и нефритом. Масштабная планка 200 нм, коэффициент расширения 4. (B)Увеличение указанной области в (A), Шкала бар 40 нм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Якорный буфер | окончательная концентрация | ||
| NaHCO3 | 150 мМ | ||
| Акрилойл-Х, SE (AcX) | 0,1 мг/мл | ||
| Мономерное решение | Концентрация стокового раствора г/100 мл | количество (мл) | окончательная концентрация (г/100 мл) |
| акрилат натрия | 38 | 2.25 | 8.6 |
| акриламид | 50 | 0.5 | 2.5 |
| Н.Н'-Метиленебисакриламид | 2 | 0.75 | 0.15 |
| хлорид натрия | 29.2 | 4 | 11.7 |
| PBS | 10x | 1 | 1x |
| Вода | 0.75 | ||
| итог | 9.4 | ||
| Решение геллинга | Концентрация фондовых растворов | количество (кл) | окончательная концентрация (мг/мл) |
| мономерное решение | NA | 190 | NA |
| APS | 10% | 4 | 0.1 |
| ТЕМЕ | 99% | 4 | 0.1 |
| Вода | NA | 2 | NA |
| итог | 200 | ||
| Решение для пищеварения | окончательная концентрация | ||
| Трис Cl, рН 8,0 | 1 М | ||
| EDTA рН 8,0 | 0,5 м | ||
| Тритон X-100 | 0.005% | ||
| Гуанидин HCL | 8 М | ||
| Вода | |||
| протеиназа K | 4 U/мл |
Таблица 1: Решения для ExM.
Обсуждение
Представленный метод позволяет исследователю визуализировать клеточные белки, например, подоцин, нефрит и цитоскелетные компоненты, например, F-актин. В рамках этого протокола, трансфицированные cos7 клетки используются в качестве модели для изучения взаимодействия щелевых белков диафрагмы с F-актином. К сожалению, увековеченные линии клеток подоцитов не выражают достаточного количества разрезанных белков диафрагмы19.
С помощью этого метода клеточные белки можно визуализировать с помощью наномасштабного разрешения с помощью обычного флуоресцентного микроскопа. Наиболее важными шагами в рамках протокола являются: 1) достаточная якорь белковых групп амина к гидрогелю с AcX, 2) адекватная полимеризация гидрогеля, 3) оптимальное время для пищеварения и 4) выбор совместимых фторфоров.
При этом методе необходимо привякоть клеточные белки к гидрогелю, чтобы сохранить положение белка в гидрогеле во время расширения. AcX - это небольшая молекула, которая связывается с аминными группами белков в клетках и тканях. AcX создает углеродно-углеродную двойную полосу с белками, позволяющую включать белки в гидрогель в этапе полимеризации20. AcX также интегрирует антитела так, что маркировка с антителами иммунофторесценции может быть выполнена до лечения AcX. Недостаточное закрепления может привести к разрывам и искажениям клеток. Из-за изменения групп амина по фиксаторам, необходимо оптимизировать фиксатор или время фиксации. Кроме того, недостаточное хранение или неоптимизировали условия якоря могут привести к разрывам и искажениям. Основываясь на нашем опыте, AcX теряет свой оптимальный эффект при использовании в течение более 3-4 месяцев.
Полимеризация геля зависит от температуры. Поэтому мы рекомендуем хранить растворы полимеризации на льду перед тем, как прокачивать их в гелевую камеру. Кроме того, время обработки шага гелеобразования должно быть коротким (менее 5 минут), чтобы избежать преждевременного образования геля. Тщательное смешивание раствора полимеризации предотвращает неравномерную полимеризацию. Воздушные пузырьки будут влиять на процесс расширения при прикосновении к образцу и могут быть предотвращены путем добавления более полимеризации решения.
После включения клеточных белков в гидрогель, механический шаг гомогенизации (или пищеварения) необходимо для обеспечения расширения. Существуют различные методы, например, тепло- и моющее средство или энзиматическое пищеварение, которые необходимо настроитьпод исследуемый образец 12,14,20. В рамках этого протокола протеаза Proteinase K используется для энзиматической пищеварения. Протеиназа K применяется в дозировке, достаточной для уничтожения структурных белков, сохраняя при этом большинство других белков, включая флуоресцентныеантитела 12. Если пищеварение является неполным, расширение выборки недостаточно. Кроме того, образец может рвать во время процесса расширения(рисунок 3). При недостаточном расширении выборки рекомендуется замена воды. Кроме того, время для энзиматической пищеварения может быть скорректировано или новая алицита Proteinase K открылась.
Если образец переварен, сигналы флуоресценции будут уменьшены. В этом случае время пищеварения должно быть сокращено. В ExM в целом интенсивность сигнала флуоресценции на единицу объема снижается за счет увеличения объема выборки14. Таким образом, необходимо учитывать более длительное время экспозиции во время визуализации.
Очень важно выбрать ExM совместимые флюорофоры. Цианин красители деградируют во время полимеризации шаг13. Флуоресценции белков на основе бактериофоцитохромов также в значительной степениуничтожены 13. Тем не менее, большинство GFP-как белки будут сохранены13. Кроме того, стрептавидин также может быть применен до расширения, маркировка пост-трансляционных модификаций, таких как S-нитролизация через небольшой тегмолекулы 13.
Фаллоидин, небольшая молекула маркировки для целевой актин цитоскелет, не совместим с ExM21. Для преодоления недостаточного закрепления фаллоидин, трехвалентный якорь (TRITON) был введен21. Этот подход предлагает одновременное таргетинг, маркировку и прививку биомолекул21.
Этот метод может быть изменен, чтобы окрашивать молекулы РНК (ExFish)22. В итеративной микроскопии расширения (iExM) или X10 микроскопии, разрешение 60-70 нм может быть продлен примерно до 25нм,применяя второй опухаемый гель в течение первого расширенного гидрогеля или проведения одного шага расширения с использованием различных гидрогеля15,16. Микроскопия расширения ультраструктуры (U-ExM) позволяет сверхот резолюция белков, сохраняя их атрибуцию ультраструктурного элемента (например, митохрондрии, микротрубочек)23. Комбинация ExFish (РНК и ДНК) и proExM методы ранее были выполнены, атакже 22,24. Представленный протокол использует трансфицированные клетки cos7 в качестве модели для исследования щелевых белков диафрагмы. Мы ожидаем, что другие резиденты культурных клеток почек, например, HEK293T клетки, могут быть аналогичным образом использованы для этого протокола. В зависимости от клеточной линии, возможно, потребуется внести коррективы для различных условий культивирования и трансфекции.
ExM улучшает разрешение иммуно-окрашенных образцов примерно в 4 раза, достигая бокового пространственного разрешения 70 нм13. По сравнению с другими методами супер-разрешения, ExM выполняется на обычном флуоресцентныймикроскоп 13,14. Таким образом, для проведения методаExM 14не требуется дорогостоящее оборудование или специально обученный персонал. Несмотря на то, что не все фторфоры совместимы с ExM, Есть, как правило, много доступных антител с оптимизированными флюорофорами с фото-физические свойства, необходимые для микроскопиисупер разрешения 14. Основным недостатком этого метода является то, что ExM несовместим с живымиобразцами 12,14.
В будущем улучшение химического состава гидрогеля может привести к еще более высокому пространственному разрешению12. Сочетание различных протоколов может также позволить визуализировать белки, РНК, ДНК или липиды в комплексах в пределах одного образца с таким высоким разрешением12.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Бланку Дувняка и Николу Кухра за отличную техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Acrylamide >99% | Sigma-Aldrich | A3553-100G | |
| 6-((Acryloyl)amino)hexanoic acid, succinimidyl ester, Acryloyl-X, SE | invitrogen | A-20770 | store up to 4 months |
| APS | Sigma-Aldrich | A3678-25G | |
| Deckgläser (cover glasses) | Engelbrecht | K12432 | 24x32mm #1.0 |
| Diamont cutter | VWR | 201-0392 | for cutting the cover slips |
| Guanidine HCl | Sigma-Aldrich | G3272-100G | 8M Stock can be kept at RT |
| Marten hair paintbrush | Leon Hardy | 3 (770) | |
| "Menzel" Deckgläser (cover glasses) | Thermo Fischer | 15654786 | 24x24mm #1.5 |
| N,N`-Methylenbisacrylamide | Sigma-Aldrich | M7256-25G | |
| Objektträger UniMark | Marienfeld | 703010 | |
| Proteinase K | New England Biolabs | P8107S | |
| Sodium Acrylate | Sigma-Aldrich | 408220 | check purity |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | |
| Staining chamber | produced at the university's workshop | ||
| TEMED | ROTH | 2367.1 | |
| 6-Well glass bottom plates | Cellvis | P06-1.5H-N | |
| Antibodies | |||
| Actin-ExM 546 | chrometra | non-available | 1:40 |
| Anti Podocin produced in rabbit | Sigma | P-0372-200UL | 1:200 |
| Donkey anti guinea-pig CF633 | Sigma | SAB4600129-50UL | 1:200 |
| Goat anti rabbit 488 | Life Technologies | A11034 | 1:1000 |
| Guinea pig anti nephrin | Origene | BP5030 | 1:100 |
| Software | |||
| FIJI | |||
| Visiview | |||
| microscope | |||
| AXIO Observer Z1 | Zeiss | non-available |
Ссылки
- Matsushita, K., et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 375 (9731), 2073-2081 (2010).
- Faul, C., Asanuma, K., Yanagida-Asanuma, E., Kim, K., Mundel, P. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton. Trends in Cell Biology. 17 (9), 428-437 (2007).
- Saleem, M. A., et al. Co-localization of nephrin, podocin, and the actin cytoskeleton - Evidence for a role in podocyte foot process formation. American Journal of Pathology. 161 (4), 1459-1466 (2002).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein - nephrin - is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Huber, T. B., et al. Podocin-mediated recruitment of nephrin into lipid rafts is required for efficient nephrin signaling. Journal of the American Society of Nephrology. 14, 8(2003).
- Boute, N., et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nature Genetics. 24 (4), 349-354 (2000).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440 (7086), 935-939 (2006).
- van de Linde, S., et al. Direct stochastic optical reconstruction microscopy with standard fluorescent probes. Nature Protocols. 6 (7), 991-1009 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Testa, I., et al. Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength. Biophysical Journal. 99 (8), 2686-2694 (2010).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Truckenbrodt, S., Sommer, C., Rizzoli, S. O., Danzl, J. G. A practical guide to optimization in X10 expansion microscopy. Nature Protocols. 14 (3), 832-863 (2019).
- Truckenbrodt, S., et al. X10 expansion microscopy enables 25-nm resolution on conventional microscopes. Embo Reports. 19 (9), (2018).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Chozinski, T. J., et al. nanoscale optical imaging of mouse and human kidney via expansion microscopy. Scientific Reports. 8 (1), 10396(2018).
- Richter, K. N., et al. Glyoxal as an alternative fixative to formaldehyde in immunostaining and super-resolution microscopy. The EMBO Journal. 37 (1), 139-159 (2018).
- Rinschen, M. M., et al. Quantitative deep mapping of the cultured podocyte proteome uncovers shifts in proteostatic mechanisms during differentiation. American Journal of Physiology-Cell Physiology. 311 (3), 404-417 (2016).
- Asano, S. M., et al. Expansion microscopy: protocols for imaging proteins and RNA in cells and tissues. Current Protocols in Cell Biology. 80 (1), 56(2018).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 7860-7867 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены