Method Article
Primer Nöronlarda Proteinlerin ve Sinaptik Belirteçlerin Eş Lokalizasyonunun İncelenmesinde Süper Çözünürlüklü Görüntüleme
Bu Makalede
Özet
Bu protokol, primer nöronal kültürlerde protein ko-lokalizasyonunu incelemek için süper çözünürlüklü mikroskopinin nasıl yapılacağını göstermektedir.
Özet
Sinapslar nöronların fonksiyonel elemanları dır ve bunların kusurları veya kayıpları çeşitli nörodejeneratif ve nörolojik bozuklukların temelinde dir. Görüntüleme çalışmaları fizyolojik ve patolojik koşullarda işlevlerini ve plastisitesini araştırmak için yaygın olarak kullanılmaktadır. Büyüklükleri ve yapıları nedeniyle proteinlerin lokalizasyon çalışmaları yüksek çözünürlüklü görüntüleme teknikleri gerektirir. Bu protokolde, yapılandırılmış aydınlatma mikroskobu (SIM) kullanılarak süper çözünürlük düzeyinde sinaptik belirteçlerle hedef proteinlerin birlikte lokalizasyonu nun primer nöronlarda incelenmesi için bir prosedür tanımlıyoruz. SIM, geniş alan mikroskopisinin uzamsal çözünürlüğünü iki katına çıkararak yaklaşık 100 nm'lik bir detaya ulaşan desenli ışık aydınlatma tekniğidir. Protokol, sağlam eş yerelleştirme çalışmaları için gerekli denetimleri ve ayarları ve görüntüleme verilerini doğru analiz etmek için istatistiksel yöntemlere genel bakışı gösterir.
Giriş
Anlayış ve sinaps görünümü 18971Yılında Foster ve Sherrington tarafından ilk açıklamasından bu yana büyük ölçüde değişti. O zamandan beri, nöronal iletişim bilgimiz ve arkasındaki moleküler süreçler katlanarak 2büyüdü. Bu sinapslar iki bölmeli bir sistem olarak düşünülebilir açık hale gelmiştir: nörotransmitterlerin salınımı için veziküller içeren bir pre-sinaptik bölmesi ve reseptörleri ile post-sinaptik bölmesi3. Bu basit görüş, son yirmi yıl içinde, sinyalizasyon 4içine bağlayıcı transduce için gerekli proteinlerin karmaşık bir ağ haline gelmiştir.
Anlayış kazanımları kısmen sinapsların boyutuna uygun geleneksel ışık mikroskobu kırınım sınırını aştı süper çözünürlük teknikleri nedeniyle daha iyi5,6,7,8,9,10. Kırınım sınırı nedeniyle, optik mikroskop yanal olarak 200 nm üzerinde bir çözünürlüğe ulaşamaz11,12. Bu sınırı atlamak için, farklı yaklaşımlar kullanılarak ve farklı alt kırınım sınır kararlarına ulaşan süper çözünürlük teknikleri oluşturuldu: SIM, STED (Uyarılmış Emisyon Tükenmesi Mikroskopisi), PALM (FotoAktislokalizasyon Mikroskopisi) ve STORM (Stochastic Optical Reconstruction Microscopy)13,14. SIM uyarma ışını yolu15içine bir kırınım ızgara ekleyerek lazer tabanlı geniş alan mikroskobu sistemlerinin mekansal çözünürlüğü iki katına çıkar. Hareketli ızgara, lazer ışınlarını difüzörlererek bilinen bir aydınlatma deseni oluşturur, genellikle çizgiler. Bu amaçla yapılandırılmış ışık deseni floresan boyanın (numunenin) bilinmeyen mekansal dağılımına yerleştirilir. İki modelin oluşturduğu girişim saçaklar, normal geniş alan mikroskobu yla ayırt edilemeyen ince ayrıntıları kodlar. Son süper çözümlü görüntü, kırınım ızgarasının çevirileri ve rotasyonları ile elde edilen aynı örneğin birkaç ham görüntüsünün matematiksel yöntemlerle birleştirilmesi ve kodlanması ile elde edilir. Süper çözülmüş görüntülerin çözünürlüğü lateral de 100 nm ve eksenel yönlerde 500 nm'ye ulaşır 2D-SIM15 veya 100 nm lateral de xeksensel yönlerde 3D-SIM16.
Sinaps yeni anlayış sinaptik disfonksiyon başlangıçlı ve ilerleme önemli bir rol oynar birçok nörolojik bozukluklar ışığında daha da önemlidir17,18. Alzheimer hastalığı, Down sendromu, Parkinson hastalığı, prion hastalıkları, epilepsi, otizm spektrum bozuklukları ve diğerleri arasında kırılgan X sendromu sinaptik kompozisyon anormallikleri ile bağlantılı olmuştur, morfoloji ve fonksiyon19,20,21,22.
Son zamanlarda, SUMO özgü antikorlar bir dizi kullanarak, biz süper çözünürlük düzeyinde pre-ve post-sinaptik belirteçleri sinapofiz ve PSD95 ile SUMO proteinlerinin primer hipokampal nöronlarda co-lokalizasyon göstermek için SIM kullanılır23. Bu, nöronlarda SUMO lokalizasyonuna dair biyokimyasal ve konfokal mikroskopi kanıtlarını doğrulamamızı sağladı.
Burada, fare hipokampal primer nöronlarda proteinlerin lokalizasyonunu inceleyen bir protokol uyguluyoruz. Aynı zamanda, bu protokol birincil nöronal kültürlerin farklı adapte edilebilir.
Protokol
1. Birincil kültürler
- #1.5 (0.17 mm) kapak kalınlığı için objektif gereksinime uyan odalı kapaklı dudaklarda (Ibidi μ-Slide 8 Kuyu veya Nunc Lab-Tek Odalı Coverglass gibi) kültür faresi hipokampal primer nöronlar.
- 100 μL poli-L-lizin (100 μg/mL) ile paltolu kapaklar.
- Ertesi gün, steril fosfat tamponlu salin (PBS) ile iki kez odalı kapakları yıkayın.
- Fare birincil nöronlar elde etmek için, P1-P4yavru23gelen hipokampi izole .
- Diseksiyon Media(Tablo 1)10 mL diseksiyon hipokampi yerleştirin ve onları tüpün altına yatırın.
- Steril bir pipet kullanarak, dikkatle Diseksiyon Medya kaldırmak, tüp altında hipokampi rahatsız bırakarak.
- Hippocampi'ye 10 mL Medya(Tablo 1)ekleyin ve 37 °C'de 30 dakika kuluçkaya yatırın.
- Steril bir pipet kullanarak, dikkatli bir şekilde Medya 1 kaldırmak, tüp altında hipokampi rahatsız bırakarak.
- 10 mL Media 2(Tablo 1)ekleyin ve (kapaklı) santrifüj tüpünü kaputun altında yatay olarak 45 dakika bekletin.
- Santrifüj tüpün dikey olarak durmasını bekleyin ve dokunun tüpün dibine yerleşmesini bekleyin.
- Steril bir pipet kullanarak Media 2'yi dikkatlice çıkarın ve hipokampiyi santrifüj tüpünün altında rahatsız edilmeden bırakarak.
- 2 mL Ortam 3(Tablo 1) ekleyin.
- Filtrelenmiş uçlu bir p1000 pipet kullanarak hücreleri dokudan mekanik olarak ayırın.
- İzole nöronların bulunduğu süpernatantı 15 mL santrifüj tüpüne aktarın.
- Hücre süspansiyonuna oda sıcaklığında 300 x g'da (RT) 2 dk santrifüj edin.
- Santrifüjden sonra hücreler santrifüj tüpünün alt kısmında yer alır. Steril bir pipet kullanarak supernatant atın.
- Media 4'ün 1 mL'inde hücreleri yeniden askıya alın.
- Çözünmemiş hücreleri ortadan kaldırmak için 70 μm filtre kullanın.
- Hücre süspansiyonunun 19 μL'sine %0,4 Trypan mavisi çözeltinin 1 μL'sini ekleyerek Bürker odasındaki canlı hücreleri sayın.
- 70.000 hücre/kuyudaki plaka hücreleri kuyu başına 200 μL hacimdedir.
- Hücrelerin 37 °C ve %5 CO 2'de nemlendirilmiş bir kuluçka makinesinde 2 saat boyuncabağlanmasınaizin verin.
- Odacıklı kapakları kuvözden alın ve ortamı 200 μL Kültür Medya ile dikkatlice değiştirin.
- Odacıklı kapakları 37 °C ve %5 CO2'denemlendirilmiş bir kuluçka makinesinde bırakın.
- Her 5-7 günde bir ortamın üçte birini taze kültür medyası ile değiştirin.
- Hipokampal primer nöronlar tamamen olgunlaşmış kadar bekleyin (12-14 gün kaplama sonra) co-lokalizasyon çalışmaları gerçekleştirmek için.
2. İmmünofluoresans boyama
- Kuvözdeki odacıklı kapakları alın.
- Ortamı çıkarın.
- Kuyuları 200 μL PBS ile hızlıca yıkayın.
- PBS'de (200 μL/well) nöronlara hızlı bir şekilde düzeltmek için %4 paraformaldehit (PFA) ekleyin.
- HÜCRELERI 15 dakika boyunca RT'de kuluçkaya yatırın.
- PFA çözümlerini çıkarın.
- % 0.2 Triton X-100 (200 μL/ iyi) ile PBS ekleyerek hücreleri permeabilize.
- RT'de 1 dakika kuluçka.
- Çözeltiyi çıkarın ve numuneleri PBS'de %1 büyükbaş serum albumini (BSA) ile (200 μL/iyi) 1 saat boyunca RT'de analiz için alakasız bir proteinle plakanın tüm serbest bağlayıcı yüzeylerini pasif olarak kaplayın. Triton X-100 olmadan BSA tabanlı engelleme tamponu, %0,2 Triton X-100 ile aynı tampondan daha verimli bir şekilde antikor arka planını azaltır.
- Çözümü çıkarın.
- %1 BSA ve %0.2 Triton X-100 içeren bir PBS çözeltisinde seyreltilmiş birincil antikor (antikor seyreltmesi ve kullanılabilirliğine bağlı olarak 120-200 μL/kuyu) ekleyin. Örnekleri 2 saat kuluçkaya yatırın.
- Negatif kontrol olarak, kuyulardan birine herhangi bir birincil antikor eklemeyin. Farklı hedeflere karşı farklı türlerin birden fazla antikorları aynı anda kullanılabilir. TAVUKTA YÜKSELTİlEN MAP2 (nöronal belirteç) karşı bir antikor, farede yetiştirilen PSD95 veya sinaptophysin'e karşı bir antikor ve tavşanda yetiştirilen bir hedef proteine karşı bir antikor kullanın. Bu, üç renkli SIM analizleri sağlar.
- Kuyuları PBS (200 μL/iyi) ile üç kez hızlıca yıkayın.
- %1 BSA ve %0,2 Triton X-100 (200 μL/well) içeren bir PBS çözeltisinde seyreltilmiş ikincil antikorlar (dyLight ve Alexa sekonder antikorlar kullanılabilir). Rt'de 1 saat boyunca örnekleri kuluçkaya yatırın.
- Kuyuları PBS (200 μL/iyi) ile üç kez hızlıca yıkayın.
- Çekirdekleri lekelemek için PBS'de (200 μL/iyi) seyreltilmiş 1 μg/mL konsantrasyonda Hoechst boyaekleyin. Rt'de 10 dakika boyunca örnekleri kuluçkaya yatırın.
- PBS ile kuyuları iki kez hızlıca yıkayın.
- SIM uyumlu bir montaj antonu kullanarak hücreleri monte edin. 10 μL/well prolong cam antifade mountant kullanın.
- Hücreleri bir kapak camı (örn. 8 mm çapında yuvarlak bir kapak lı cam) ile kaplayın ve koruyun. Kare olanlar da kullanılabilir.
- Odacıklı kapakları RT'de saklayın ve görüntü almadan önce en az 48 saat bekleyin. Diamond Glass süper çözünürlüklü satın almadan önce en az iki gün kür gerektirir.
3. Antikor özgüllük kontrolü
NOT: Antikor özgüllüğünü sağlamak için iki strateji kullanın. İlk strateji, aynı substratı hedefleyen en az iki farklı antikor kullanmaktır. İkinci strateji saflaştırılmış protein hedefi veya antikor yükseltmek için kullanılan epitop ile kuluçka ile antikor nötralizasyon olduğunu.
- PBS'de %1 BSA'da 1 saat boyunca rekombinant hedef veya epitopun beş kat fazlasıyla tercih edilen antikora inkübün.
- Kuluçkadan sonra, yukarıda açıklandığı gibi 2.11 boyama için her zamanki konsantrasyonda nötralize antikor kullanın.
4. Mikroskop kalibrasyonu
NOT: Nikon tarafından üretilen n-sim süper çözünürlüklü mikroskop sistemini süper çözünürlüklü çalışmalar için rutin olarak kullanıyoruz. Ancak, diğer birçok şirket de kendi kataloglarında süper çözünürlüklü mikroskoplar sunuyoruz. Nikon'un N-SIM sistemi için özel endikasyonlar açıklansa da, takip eden talimatlar diğer sistemlere genellenebilir. SIM görüntülerin edinilmesinden önce, sistem belirli alt çözünürlüklü boyutta floresan boncuklar ile uygun bir kalibrasyon gerektirir. Buna bir örnek TetraSpeck mikroküreleridir. Bu boncuklar farklı floresan boyalar ile tek bir örnek ile farklı lazerlerin kalibrasyonu sağlamak için boyanmıştır.
- Bir su banyosu nda 10 dakika boyunca 1.8 x 108 floresan mikrosferler civarında sonicate. Nikon'un N-SIM sistemi kalibrasyon için seyrek nüfuslu çok renkli boncuk örneği gerektirir. Bu alt çözünürlük boyutu floresan boncuk yoğun bir tek katman gerektiren diğer sistemler için farklı olabilir. Floresan partiküllerin sayısını buna göre ayarlayın.
- Floresan mikrosferleri 1:500'ü çift distile suda seyreltin.
- Ek bir 10 dakika için ikinci kez Sonicate.
- Pipet 15 l sulandırılmış boncuklar odalı bir kapak bir kuyuiçine.
- Çözeltinin RT'de 5 dakika kurutulmasına izin verin.
- Montaj çözeltisinin 10 μL'sini ekleyin ve üzerine 8 mm'lik bir kapak kaydırın.
- Uygun kür izin vermek için en az 48 saat bekleyin.
- Mikroskobu ve lazerleri açın.
- Tüm mikroskop bileşenlerinin termal dengesine ulaşmak için sistemin ısınmasına izin verin. N-SIM Süper Çözünürlüklü Mikroskop Sistemi en az 3 saat sürer.
- 100x hedefini seçin.
- Lazerleri kırınım ızgara bloğunun ortasına hizalayarak kalibrasyonu başlatın. N-SIM sisteminde, bir mikrometre knob ve özel bir kamera, ışık demetlerinin hedefe ortalanmasına olanak sağlar.
- Görüntülemek için odacıklı kapak fişini mikroskopa yerleştirin. Objektif düzeltme yakasını ayarlayarak sistemi odalı kapak kalınlığına ayarlayın. N-SIM Süper Çözünürlüklü Mikroskop sistemleri ile sağlanan tescilli yazılım Olan NIS yazılımı, düzeltme yakalarını düzenlemek için otomatik bir fonksiyona sahiptir.
- Numune üzerinde odaklanmış yapılandırılmış desen aydınlatması sağlamak için her kanal için ızgara bloğu odağı ayarlayın. NIS yazılımı bu görev için otomatik bir işlev sağlar.
- Ardından, çok renkli mikrokürelerin ham 3D-SIM görüntülerini edinin. Biyolojik görüntülerin analizi için mikroskop yazılımı veya açık kaynak yazılım platformu kullanarak süper çözümlü görüntü elde etmek için ham görüntüleri yeniden oluşturmak ImageJ24 ve eklenti fairSIM25.
- Her ayrılmış dalga boyu için 4,14'te elde edilen süper çözümlü görüntünün Fourier dönüşümünü hesaplayın. Dönüştürülen görüntü doğru çiçek benzeri bir desen elde edemezse, süper çözünürlük elde edilemediğinden kalibrasyonu 4,11'den yeniden başlatın.
- Süper çözümlü görüntüde, elde edilen çözünürlüğü ölçmek için tek bir mikrosfer seçin ve her kanal için yoğunluk profilini hesaplayın. Şimdi yanal olarak 100 nm yakın olmalıdır.
- Ardından, mikrokürelerin çok kanallı bir edinimi kaplayarak kanal kaydı gerçekleştirin. Amaç, tüm kanal sinyallerini yanal ve eksenli olarak harmanlamaktır. Bu, farklı kanalların yanlış hizalanması nedeniyle renk sapmalarını ortadan kaldırır ve birlikte yerelleştirme analizine yardımcı olur.
- Açık kaynak uygulaması ImageJ için bir eklenti paketi olan SIMcheck26'nın"Aydınlatma Faz Adımları" ve "Aydınlatma Desen Odağı" işlevlerini kullanarak kalibrasyon kalitesini onaylayın. Bu amaçla, yoğun bir TetraSpeck mikroküre tabakası elde etmek ve numunenin 3D SIM görüntüsünü elde etmek için odacıklı bir kapak fişi hazırlayın. ImageJ'deki görüntüyü analiz edin ve sapmalar tespit edilirse, 4.11 adımdan mikroskop kalibrasyonünü yeniden başlatın.
5. Satın alma
- Confocal veya widefield modunda 40x hedefi kullanarak örnek analiz başlayın. Bu, iyi ayrıntıları ve geniş bir görüş alanı koruyarak, örnek navigasyon sağlar.
- Nöronal süreçleri temsil eden bir alanı belirlemek için MAP2 antikor sinyalini kullanın.
- Boyama kalitesini belirlemek için numunenin konfokal modda görüntülerini edinin. Düşük konfokal kalite, düşük SIM kalitesini yansıtacak, bu nedenle numunelerin atılmasını gerektirecektir.
- Görüntülerin alanı ve kalitesi tatmin ediciyse, hedefi 100x'e geçin.
- 100x hedefine yağ uygulayın.
- Süper çözümlenmiş görüntünün kalitesini değerlendirmek için daha sonra kullanılacak geniş alan veya konfokal görüntü elde edin (Şekil 1A,B).
- 3D-SIM moduna geçin.
- Edinme parametrelerini ayarlamak için iletişim pencerelerini kullanarak, renk bilgilerini en üst düzeye çıkarmak için kullanılabilen en yüksek bit derinliği ayarını seçin. Genellikle, 16-bit standart seçimdir. Ayrıca, sinyal-gürültü oranını artırmak için, 1 MHz gibi satın alma için düşük frekans değeri seçin.
- Histogram pencereleri kullanarak, sinyal doğrusal bir yanıt elde etmek için lazerler güç ayarlayın. Bilgi kaybını önlemek için görüntülerdeki doymuş pikselleri sınırlayın. N-SIM sistemi Andor iXon3 kamera kullanır. 16 bit'te çalışırken, kameranın doğrusal tepkisini sağlamak için 16.000 hedef yoğunluğu seçin. Alternatif olarak, satın alma dinamik aralığını en üst düzeye çıkarmak için 30.000-45.000 arasında bir aralık seçin.
- Numuneleri görüntülerken %0,1 ile %50 arasında lazer gücü ve 50 ms ile 2 s arasında maruz kalma süreleri ayarlayın. %50'nin üzerindeki lazer güçleri, kullanımdaki floroforların hızlı fotobeyazrlanmasına neden olabilir.
- Görüntüleri 3D-SIM modunda edinmeye başlayın.
- Raw görüntülerin edinim kalitesini değerlendirmek için ImageJ için ücretsiz eklentipaketi olan SIMcheck'i kullanın.
- SIMCheck herhangi bir yapı veya kalite sorunu algılamazsa, istatistiksel analize izin vermek için 4 teknik kopyadan en az 10 görüntü elde edin.
6. Post-prodüksiyon: görüntü rekonstrüksiyonu
NOT: 3D-SIM edinilmiş görüntüler, yeniden oluşturulmuş süper çözümlü görüntüleri elde etmek için işlenmesi gereken ham görüntülerdir. Ham görüntülerin yanlış yeniden yapılandırılması, örneklerin analizini etkileyecek yapılara yol açabilir. Bu nedenle rekonstrüksiyon parametrelerinin doğru şekilde seçilmesi için büyük dikkat edilmelidir.
- Süper çözümlenmiş bir görüntü elde etmek için mikroskop rekonstrüksiyon analiz yazılımını kullanarak ham görüntüleri işleyin(Şekil 1C). Alternatif olarak, ham görüntüleri yeniden oluşturmak için serbestçe kullanılabilir ImageJ eklentifairSIM kullanın.
- Mikroskop rekonstrüksiyon yazılımı veya ImageJ eklentisi SIMCheck kullanarak süper çözülmüş görüntülerin Fourier dönüşümünü hesaplayın. İyi bir yeniden oluşturulmuş görüntü, her kanal için, bir çiçek gibi görüntü dönmek gerekir. Yeniden yapılandırıladaki görüntüler çiçek benzeri bir şekli yeniden oluşturamazsa, ham görüntülerden yeniden başlatın ve Wiener filtreleme, apodization ve sıfır sıra bastırma27gibi yeniden yapılandırma parametrelerini değiştirerek yeniden oluşturun. NIS yazılımında, parametrelerin değiştirilmesinin son çözülmüş görüntüyü nasıl etkilediğini izlemek için önizlemeyi kullanarak, parametreleri değiştirmek i) Aydınlatma Modülasyon Kontrastı, ii) Yüksek Çözünürlüklü Gürültü Bastırma ve iii) Odak Dışı Bastırma.
- Daha sonra, nanoj-SQUIRREL28kullanarak tarafsız bir şekilde eserler tespit etmek için yeniden oluşturulmuş görüntü analiz , süper çözülmüş görüntülerin kalitesini değerlendirmek için bir ImageJ tabanlı eklenti.
- NanoJ-SINCAP yapıları algılarsa, ham görüntülerden yeniden başlatın ve Wiener filtreleme, apodizasyon ve sıfır sıra bastırma gibi yeniden yapılandırma parametrelerini değiştirerek yeniden yapılandırın. NIS yazılımında, parametrelerin değiştirilmesinin son çözümlenmiş görüntüyü nasıl etkilediğini izlemek için önizlemeyi kullanarak, Aydınlatma Modülasyon Kontrastı, Yüksek Çözünürlüklü Gürültü Bastırma ve Odak Dışı Bastırma parametrelerini değiştirin.
- Ortak yerelleştirme profilini ve/veya Pearson ve Mander'in katsayılarını hesaplamak için süper çözümlenmiş görüntüleri kullanın.
7. Profil analizi ile birlikte yerelleştirme
NOT: Sinaptik belirteçler ve ilgi çekici bir protein arasındaki birlikte lokalizasyonu incelemek için ilk adım olarak, süper çözümlenmiş bir görüntü alın ve sinyal çakışmasını belirlemek için tek bir lokusu analiz edin.
- Süper çözümlenmiş görüntüde tek bir locus tanımlayın.
- İlgi çekirgelerinin floresan sinyallerinin yoğunluk profillerini elde edin.
- Verileri dışa aktarın.
- Tüm sinyal tepelerini normalleştirmek ve locus'a özgü eş yerelleştirmeyi belirlemek amacıyla her kanal için karşılaştırılabilir sinyal yoğunlukları elde etmek için GraphPad Prizma veya benzer bir analiz yazılımı kullanın.
8. Pearson ve Mander katsayıları quantification
NOT: Profil analizi tek lokus eş lokalizasyonu önermişse, Pearson ve Mander'in katsayıları29,30hesaplanarak tüm resmin daha genel bir analizi yapılabilir.
- Co-localizasyon iki parametre: Pearson ve Mander's: belirlemek için JACoP31kullanın , bir ImageJ eklentisi.
9. İstatistiksel analiz
- JACoP ile toplanan verileri işlemek için GraphPad Prizma'yı veya benzer bir analiz ve grafik yazılımLarını kullanın.
- Grafikleri elde etmek ve istatistiksel alaka düzeyi için analiz edilen her durum için en az 40 SIM görüntü kullanın.
Sonuçlar
Burada nöronal proteinlerin eş lokalizasyonunu incelemek için standart iş akışını sıyoruz. Önce mikroskobu kalibre ettik ve ardından numunelerin SIM analizini yaptık. Sistemi kalibre etmek için 0,1 m çapında floresan mikroküreler kullandık. Boncukların süper çözümlü 3D-SIM görüntüleri elde edildikten sonra, temel deki görüntü verileri, bunları uzamsal frekans gösterimine dönüştürmek için Fourier dönüştürülmüştür. Şekil 2A'da,farklı çiçek deseni süper çözünürlük ayrıntı düzeylerinin bir göstergesi olarak sunulur. Daha sonra, tek bir reklamın yoğunluk profilinin(Şekil 2B,C)en yüksek düzeyinde tam genişlik hesaplanarak elde edilen çözünürlüğü ölçtük. Son olarak, yine floresan mikroküreler kullanarak kanal kaydı ile renk sapması düzeltildi(Şekil 3A,B). Daha sonra, 100x hedefi ile örnek analiz başladı ve 3D-SIM görüntüler elde etti. Simcheck'i, alan aydınlatmasının veya hareketinin kazanım sırasındaki eşitliğini değerlendirmek için kullandık (Şekil 4A). Aydınlatma deseni açıları(Şekil 4B)arasındaki yoğunluk farklarını kontrol ettik ve yerel şerit kontrastını ölçmek için modülasyon kontrastının gürültüye oranını hesapladık (Şekil 4C). Son olarak, yeniden yapılanmanın etkili çözünürlüğünü tahmin ettik (Şekil 4D).
Daha sonra NanoJ-SQUIRREL kullanarak süper çözülmüş görüntülerin kalitesini doğruladı. İlk yeniden inşa edilen resimde(Şekil 5A),NanoJ-SINCAP eserlerin varlığını tespit etti (Şekil 5C). Yeni bir süper çözümlü görüntü elde etmek için yeniden yapılandırma parametrelerini değiştirdik(Şekil 5B) ve NanoJ-SINCAP yapı eksikliğini doğruladı(Şekil 5D). Sistemi kalibre ettikten ve yeniden yapılandırılan görüntülerin kalitesini değerlendirdikten sonra MAP2, nöronal belirteç, PSD95, post-sinaptik belirteç ve hedef protein SUMO1'e karşı antikor ile boyanmış primer nöronal kültürleri analiz etmeye başladık. İlk olarak dört kanallı konfokal mikroskopi yapılan örneği 40x hedefiyle analiz ettik(Şekil 6A). Nöronal süreçleri temsil eden bir alan seçtikten sonra, 100x hedefine geçtik. NanoJ-SINCAP ile yeniden yapılanma kalitesini değerlendirmek ve ortak yerelleştirme analizi yapmak için aynı alanın hem konfokal hem de SIM görüntülerini elde ettik. Şekil 6B'de,SENP1 ve drebrin için boyanmış nöronların süper çözülmüş 3D SIM görüntüsünü gösteriyoruz. Süper çözümlü görüntülerde eş lokalizasyon profil analizi(Şekil 7A)ve Pearson ve Mander katsayıları(Şekil 7B)ölçülmesi ile analiz edilebilir.

Şekil 1: Geniş alan, konfokal ve SIM kazanımlarının karşılaştırılması. (A) SENP1 (yeşil), drebrin (kırmızı) ve MAP2 (leylak) için immünojenelenmiş primer hipokampal nöronların geniş alan görüntüsü. DAPI çekirdekleri lekelemek için kullanıldı. Ölçek çubuğu 5 μm. (B) Apanelinin aynı örneğinin konfokal görüntüsü . (C) A ve Bpaneli aynı örnek SIM görüntü . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mikroskop kalibrasyonu için mikrokürelerin 3Boyutlu SIM görüntüsünün analizi. (A) Hızlı Fourier çiçek gibi şekli ile mikrokürelerin bir edinim dönüştürmek. (B) Yanal uzamsal çözünürlüğü belirlemek için tek bir mikrosferin seçimi. (C) FWHM ölçümü ile B'deki tek mikrosferin yoğunluk profili. Değerler, enstrümanın elde ettiği çözünürlüğü temsil ediyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Üç kanal kaydı. (A) Kayıttan önce çok renkli (dalga boyları 488nm, 555nm ve 647nm) TetraSpeck mikrokürelerinin satın alınması. (B) Kalibrasyondan sonra aynı numunenin elde edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
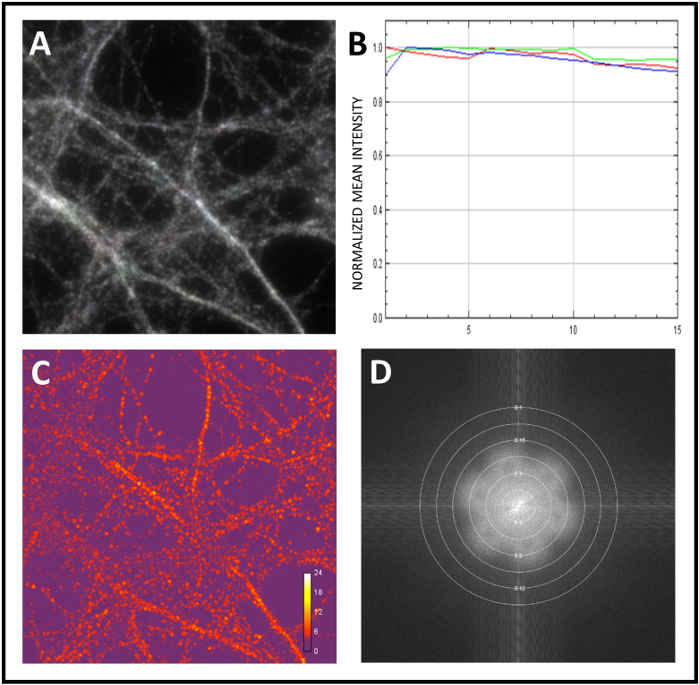
Şekil 4: SIMcheck kullanılarak ham ve yeniden oluşturulmuş görüntülerin kalite değerlendirmesi. (A) SIMCheck kullanarak Hareket ve Aydınlatma Varyasyon analizi. Griden beyaza sinyal, elde edinme sırasında homojen aydınlatmayı ve hareket eksikliğini temsil eder. (B) Ham görüntü analiz edilerek elde edilen Kanal Yoğunluk Profili. Bu örnekte yoğunluk değişimi, eksikliği veya ağartma veya dalgalanmaları önermek için çok azdır. (C) Görüntü içindeki modülasyon kontrastı-gürültü oranını hesaplamak için Ham Modülasyon Kontrastı. Isı haritası modülasyon kontrast varyasyonları gösterir. (D) Rekonstrüksiyonun etkili çözünürlüğünü belirlemek için genlik Fourier spektrumanaliz etmek için Fourier Plot yeniden. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: NanoJ-SINCAP kullanılarak süper çözünürlüklü görüntü kalitesinin değerlendirilmesi. (A) Referans süper çözünürlüklü görüntü eserler ile. (B) Referans süper çözünürlüklü görüntü kaliteli. (C) A'nınNanoJ-SINCAP hata haritasını temsil eden görüntü . Daha açık alanlar büyük ölçekli yapıları temsil ederken, koyu alanlar doğru yeniden yapılandırıcıyı temsil eder. (D) NanoJ-SINCAP hata haritası B. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: SIM görüntü örneği. (A) Primer nöronların konfokal mikroskobu. İyi çözünürlük korurken numunenin genel görünümünü elde etmek için 40X hedefi seçilmiştir. Hücreler SUMO1 (yeşil), PSD95 (kırmızı) ve MAP2 (leylak) için immünosüle edildi. DAPI çekirdekleri lekelemek için kullanıldı. Ölçek çubuğu 50 μm. Görüntüler Z projeksiyonu olarak görüntülendi. (B) 100X hedefi kullanılarak A panelindeki yeşil kutuda vurgulanan alandaki SUMO1 ve PSD95 için SIM görüntüler. Kırmızı ok uçları, yoğunluk profilini hesaplamak için Kullanılan A'da gösterilen insetin konumunu gösterir. Ölçek çubuğu 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
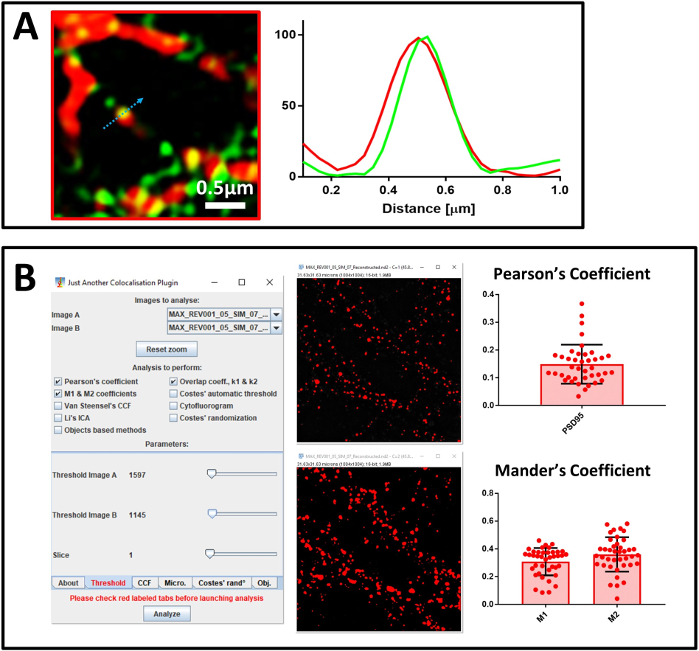
Şekil 7: Eş yerelleştirme analizi. (A) SENP1 (yeşil) ve drebrin (kırmızı), ölçek çubuğu 0.5 μm ve yoğunluk profiline karşı antikor ile boyanmış primer nöronların süper çözümlenmiş görüntüsü. Grafiğin değerleri her kanal için 100 (rasgele birim) normalleştirildi ve mavi ok tarafından gösterilen piksel yoğunluğuna karşılık geldi. (B) Pearson Korelasyon Katsayısını ve Mander'in SENP1 ile drebrin arasındaki katsayısını hesaplamak için JACoP kullanılarak analiz. Eklenti kurulumunun pencereleri ve görsel eşik gösterilir. Mander katsayısı iki değerle ifade edilir – drebrin (M1) ile eş-lokalize senp1 fraksiyonu ve SENP1 (M2) ile birlikte lokalize drebrin fraksiyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Sinapsın yapısını ve bileşimini açıklamak, hafıza ve bilişi düzenleyen fizyolojik ve patolojik süreçlerin anlaşılması için çok önemlidir. Normal durumda iken, sinapsbellek yapı taşları dır, onlar da Alzheimer hastalığı gibi karmaşık nörolojik bozukluklar altında yatan32. Burada açıklanan protokol sim adı verilen bir süper çözünürlüklü mikroskopi tekniği ile nöronal proteinlerin birlikte lokalizasyonu çalışma için hizmet vermektedir. Sim, belirli bir aydınlatma deseni kullanarak, normalde 0,03 ile 0,15 m arasında ölçen sinapsların incelenmesi için uygun olan yaklaşık 0,1 μm çözünürlüğe ulaşabilir. Daha ayrıntılı olarak, 10-20 nm çözünürlüğe ulaşabilen STED (Uyarılmış Emisyon Tükenmesi Mikroskopisi), PALM (FotoAktik Lokalizasyon Mikroskobu) veya STORM (Stochastic Optical Rekonstrüksiyon Mikroskobu) gibi diğer süper çözünürlüklü teknikleruygulanabilir 33.
Burada, birincil nöronlarda sinaptik belirteçlerle hedef proteinlerin birlikte lokalizasyonunun analizini açıklıyoruz. Protokol nöronal hücrelerin herhangi bir birincil kültür uygulanabilir, hipokampal gibi, serebellar veya kortikal nöronlar ve hatta merkezi sinir sistemine ait olmayan primer nöronların kültürleri için, enterik sinir sistemi nöronlar gibi. Ancak, süper çözünürlük düzeyinde analizin anahtarı, satın alma sırasında kullanılan odacıklı kapaklar ve hedefin kırınım indeksi ile uyumlu montaj çözümleri gibi reaktiflerdir. Biz kullanım kolaylığı için odacıklı kapakları kullanılır, ancak kaplamalı coverglass üzerinde birincil nöronlar büyüyen klasik, ucuz yöntem yine de, özellikle yüksek hassasiyetli #1.5H (0.17 mm) coverglass ile geçerlidir. Buna ek olarak, cam kırılma indeksi (1,52) ve 1,515 kırılma indeksi ile 100x hedefi için bir daldırma yağı mümkün olduğunca yakın bir kırılma indeksi ulaşabilirsiniz montaj ortamı kullanılmalıdır. Sabit oda sıcaklığı ve stabilize tablolar da satın almaların doğruluğunu garanti etmek için zorunludur.
SIM çalışmalarında hem dyLight hem de Alexa ikincil antikorları kullanıyoruz. Uyarma, emisyon ve iyi kuantum verimi gibi dar zirveleri nedeniyle, gürültü oranına en iyi sinyali gerektiren süper çözünürlüklü teknikler için endikedirler. Dempsey ve ark. süper çözünürlüklü görüntüleme için Alexa, dyLight ve diğer florofororlar karşılaştırıldı34.
Satın alma sırasında, kamerayı 10 MHz üzerinden rutin olarak 10 MHz olarak ayarlıyoruz. Ancak, 10 MHz, hızı ile, canlı görüntüler için yararlıdır. Ağartma önlemek ve florofor korumak için, biz de mümkün olduğunca düşük lazer gücü ayarlayın. Sinyal yoğunluğunu artırmak için kazanç değerleri artırılabilir. Daha düşük kazancın gürültüyü artırmadan daha temiz görüntüler garanti ettiğini belirtmekte yarar vardır. Genel olarak, odacıklı kapak altından 7 μm içinde görüntüleme sırasında en iyi sonuçlar elde edilir. Bu özellikle yağ daldırma ile 100x hedefi kullanırken önemlidir. Hücreler / dokular arasında daha derin edinimi gerekiyorsa, daha iyi bir seçim su daldırma ile 60x objektif kullanımı olabilir.
SIM çalışmaları nın gerçekleştirilmesinde karşılaşılan en önemli zorluklardan biri görüntü rekonstrüksiyonu35'tir. Eserler ve sapma olmadan süper çözülmüş görüntüler elde etmek sadece özel deneysel koşulların kullanımını değil, aynı zamanda sistemin dikkatli kalibrasyonu ve son görüntüleri elde etmek için parametre optimizasyonu gerektirir. Protokolde, sistemin kalibrasyonlarını ve ham ve yeniden oluşturulmuş görüntülerin kalite analizini değerlendirerek en yaygın hatalardan bazılarını nasıl önleyebileceğimizi anlatıyoruz. Özellikle, biz super-resolved görüntülerin ortak yapıları önlemek için doğru enstrüman ayarlarını sağlamak için ImageJ eklentileri SIMCheck ve NanoJ-SQUIRREL kullanımını açıklar. Uygulamalar, sonuçların çalışma yapılarının önceden bilinmesine karşı sübjektif kıyaslamaya dayanmayan son görüntülerin tarafsız bir kalite değerlendirmesine olanak sağlar.
Sinapofizin ve PSD95 veya drebrin'i pre-ve post-sinaptik belirteçler olarak kullanmanızı öneririz, ancak diğer belirteçler de geçerlidir. Literatürbüyük bir vücut sinaptik belirteçleri36,,37olarak fagot gibi proteinleraçıklar. Bu ön ve postsinaptik belirteçleri ancak çekirdek hariç, hücre boyunca mevcut olduğunu kayda değerdir. Sinyallerinin çoğu sinaptik değildir ancak taşıma veya bozulma, arka plan veya diğer eserlerdeki proteinleri temsil eder. Bu nedenle dikkatle analiz alanını seçmek önemlidir. Akson ve dendritik terminalleri seçmek için MAP2 antikor sinyali kullanıyoruz.
Eş-yerelleştirme analizinde iki yaklaşım kullanıyoruz. Bunlardan ilki, tek bir birlikte yerelleştirme olayını gösteren ve her kanalın katkısını tanımlayan profil analizine dayanan görsel bir yaklaşımdır. Ancak bu yaklaşımın bir ihtarı zayıf istatistiksel güçtür. Bu nedenle, biz de her görüntünün tüm alanı temsil eden olayların daha fazla sayıda analizine dayalı ikinci bir yöntem kullanmaya karar verdi. Bu yöntem Pearson korelasyon katsayısı ve Mander'in M1 ve M2 katsayıları hesaplamadayanmaktadır. Pearson'ın korelasyon katsayısını, görüntüdeki sinyallerin çakışmasını ve Mander'in M1 ve M2'sini ilgi sinyalleri arasındaki karşılıklı eş lokalizasyonu tanımlamak için kullanıyoruz38. Hesaplama için, özellikle Mander'in analizi için kritik olan analize herhangi bir arka plan katkısını atmak için manuel bir eşik belirlemenize olanak tanıyan bir özelliğe sahip olduğundan, ImageJ eklentisi JACoP'u kullanırız.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar edoardo Micotti'ye el yazmasına yönelik yapıcı eleştirileri için teşekkür etmek isterler. Bu çalışma BrightFocus A2019296F, Fondo di Beneficenza - Gruppo Intesa Sanpaolo (LC), Fondazione Regionale by la Ricerca Biomedica (Care4NeuroRare CP_20/2018) (CN) ve Marie Skłodowska-Curie Innovative Training Network (JK) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue solution | Thermo Fisher Scientific | 15250061 | Chemical |
| 70 µm filter | Corning | 352350 | Equiment |
| Alexa | Thermo Fisher Scientific | - | Antibody |
| Antibody SENP1 | Santa Cruz | sc-271360 | Antibody |
| B27 Supplement | Life Technologies | 17504044 | Chemical |
| Bovine serum albumin | Merck | 5470 | Chemical |
| CaCl2 | Merck Life Science | 21115 | Chemical |
| Chambered coverslips | Ibidi | 80826 | Equiment |
| DyLight | Thermo Fisher Scientific | - | Antibody |
| FBS (Hyclone) | GIBCO | SH3007002 (CHA1111L) | Serum |
| FluoSpheres carboxylate-modified microspheres, 0.1 μm, yellow–green fluorescent | Thermo Fisher Scientific | F8803 | Equiment |
| Glucose | Merck Life Science | G8769 | Chemical |
| Glutamax | GIBCO | 35050061 | Chemical |
| HEPES | Merck Life Science | H3537 | Chemical |
| L-Cystein | Merck Life Science | C6852-25g | Chemical |
| MAP2 | Merck | AB15452 | Antibody |
| MEM | Life Technologies | 21575022 | Medium |
| MgCl | Merck Life Science | M8266 | Chemical |
| NaOH | VWR International | 1,091,371,000 | Chemical |
| Neurobasal A | Life Technologies | 10888022 | Medium |
| N-SIM Super Resolution Microscope | Nikon | - | Instrument |
| Papain | Merck Life Science | P-3125 | Chemical |
| paraformaldehyde | Thermo Fisher Scientific | 28908 | Chemical |
| Pen/Strep 10x | Life Technologies | 15140122 | Chemical |
| phosphate-buffered saline | Gibco | 10010023 | Chemical |
| Poly-L lysine | Sigma | P2636 | Chemical |
| ProLong Diamond Glass Antifade Mountant | Thermo Fisher Scientific | P36970 | Chemical |
| PSD95 | NeuroMab | K28/43 | Antibody |
| Round coverglass | Thermo | 12052712 | Equiment |
| SUMO1 | Abcam | ab32058 | Antibody |
| Synaptophysin | Merck | S5768 | Antibody |
| Triton X-100 | Merck | T8787 | Chemical |
| Trypsin inhibitor | Merck Life Science | T9003-500MG | Chemical |
Referanslar
- Foster, M., Sherrington, C. S. . A textbook of physiology, part three: The central nervous system (7th ed.). , (1897).
- Choquet, D., Triller, A. The Dynamic Synapse. Neuron. 80 (3), 691-703 (2013).
- McAllister, A. K. Dynamic Aspects of CNS Synapse Formation. Annual Review of Neuroscience. 30 (1), 425-450 (2007).
- Yuzaki, M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annual Review of Physiology. 80 (1), 243-262 (2018).
- Baddeley, D., Bewersdorf, J. Biological Insight from Super-Resolution Microscopy: What We Can Learn from Localization-Based Images. Annual Review of Biochemistry. 87 (1), 965-989 (2018).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Vangindertael, J., et al. An introduction to optical super-resolution microscopy for the adventurous biologist. Methods and Applications in Fluorescence. 6 (2), 022003 (2018).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Scalisi, S., Barberis, A., Petrini, E. M., Zanacchi, F. C., Diaspro, A. Unveiling the Inhibitory Synapse Organization Using Superresolution Microscopy. Biophysical Journal. 116 (3), 133 (2019).
- Yang, X., Specht, C. G. Subsynaptic Domains in Super-Resolution Microscopy: The Treachery of Images. Frontiers in Molecular Neuroscience. 12, (2019).
- Monro, T. Beyond the diffraction limit. Nature Photonics. 3 (7), 361 (2009).
- Won, R. Eyes on super-resolution. Nature Photonics. 3 (7), 368-369 (2009).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific Reports. 6 (1), 27290 (2016).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Gustafsson, M. G. L., et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Brose, N., O'Connor, V., Skehel, P. Synaptopathy: dysfunction of synaptic function. Biochemical Society Transactions. 38 (2), 443-444 (2010).
- Tyebji, S., Hannan, A. J. Synaptopathic mechanisms of neurodegeneration and dementia: Insights from Huntington's disease. Progress in Neurobiology. 153, 18-45 (2017).
- Won, H., Mah, W., Kim, E. Autism spectrum disorder causes, mechanisms, and treatments: focus on neuronal synapses. Frontiers in Molecular Neuroscience. 6, (2013).
- Pfeiffer, B. E., Huber, K. M. The State of Synapses in Fragile X Syndrome. The Neuroscientist. 15 (5), 549-567 (2009).
- Pavlowsky, A., Chelly, J., Billuart, P. Emerging major synaptic signaling pathways involved in intellectual disability. Molecular Psychiatry. 17 (7), 682-693 (2012).
- Senatore, A., Restelli, E., Chiesa, R. Synaptic dysfunction in prion diseases: a trafficking problem. International Journal of Cell Biology. 2013, 543803 (2013).
- Colnaghi, L., et al. Super Resolution Microscopy of SUMO Proteins in Neurons. Frontiers in Cellular Neuroscience. 13, (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Müller, M., Mönkemöller, V., Hennig, S., Hübner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7 (1), 10980 (2016).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Schaefer, L. H., Schuster, D., Schaffer, J. Structured illumination microscopy: artefact analysis and reduction utilizing a parameter optimization approach. Journal of Microscopy. 216 (2), 165-174 (2004).
- Culley, S., et al. NanoJ-SQUIRREL: quantitative mapping and minimisation of super-resolution optical imaging artefacts. Nature Methods. 15 (4), 263-266 (2018).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of co-localization of objects in dual-colour confocal images. Journal of Microscopy. 169 (3), 375-382 (1993).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
- Bolte, S., Cordelières, F. P. A guided tour into subcellular colocalization analysis in light microscopy. Journal of Microscopy. 224, 213-232 (2006).
- Bae, J. R., Kim, S. H. Synapses in neurodegenerative diseases. BMB Reports. 50 (5), 237-246 (2017).
- Godin, A. G., Lounis, B., Cognet, L. Super-resolution Microscopy Approaches for Live Cell Imaging. Biophysical Journal. 107 (8), 1777-1784 (2014).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nature Methods. 8 (12), 1027-1036 (2011).
- Karras, C., et al. Successful optimization of reconstruction parameters in structured illumination microscopy - A practical guide. Optics Communications. 436, 69-75 (2019).
- Bereczki, E., et al. Synaptic markers of cognitive decline in neurodegenerative diseases: a proteomic approach. Brain: A Journal of Neurology. 141 (2), 582-595 (2018).
- Gilestro, G. F., Tononi, G., Cirelli, C. Widespread Changes in Synaptic Markers as a Function of Sleep and Wakefulness in Drosophila. Science. 324 (5923), 109-112 (2009).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander's overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır