Method Article
一次ニューロンにおけるタンパク質とシナプスマーカーの共局在化を研究する超分解能イメージング
要約
このプロトコルは、一次神経細胞培養におけるタンパク質の共局在化を研究するために超解像顕微鏡を採用する方法を示す。
要約
シナプスはニューロンの機能要素であり、その欠陥または損失はいくつかの神経変性疾患および神経疾患の基礎にある。画像化研究は、生理学的および病理学的状態におけるその機能および可塑性を調べるのに広く使用されている。タンパク質のサイズと構造のため、タンパク質のローカリゼーション研究には高解像度イメージング技術が必要です。本プロトコルでは、構造化された照明顕微鏡(SIM)を用いて、シナプスマーカーを用いた標的タンパク質のシナプスマーカーとの共局在化を一次ニューロンで研究する手順を説明する。SIMは、広視野顕微鏡の空間分解能を2倍にするパターン光照明技術で、約100nmのディテールに達します。このプロトコルは、堅牢な共局化研究に必要な制御と設定、およびイメージングデータを適切に分析するための統計的手法の概要を示します。
概要
シナプスの理解と見解は、フォスターとシェリントンによる1897年の最初の記述以来、大きく変わりました。それ以来、神経伝達の知識とその背後にある分子プロセスは指数関数的に成長しました 2.シナプスは、2コンパートメントシステムとして考えることができることが明らかになりました:神経伝達物質の放出のための小胞を含むシナプス前コンパートメントと受容体3を有するシナプス後コンパートメント。この単純な見解は、過去20年間で、トランスミッタ結合をシグナル4に変換するために必要なタンパク質の複雑なネットワークに進化した。
理解の利益は、シナプスの次元に合わせて従来の光顕微鏡の回折限界を克服した超解像技術による部分565、6、7、8、9、10。,7,8,9,10,回折限界のため、光学顕微鏡は横11,12,12を超える解像度に達することができない。この限界を回避するために、異なるアプローチを使用して、異なる回折限界解像度に達する超解像技術が作成されました:SIM、STED(刺激放出枯渇顕微鏡)、PALM(光活性化局在化顕微鏡)およびSTORM(確率的光学再構成顕微鏡)13、14。13,SIMは、励起ビーム経路15に回折格子を挿入することにより、レーザーベースの広視野顕微鏡システムの空間分解能を倍増する。可動格子は、レーザービームを回折して、既知の照明パターン(通常はストライプ)を作成します。この意図的に構成された光パターンは、蛍光色素(試料の)の未知の空間分布に重ね合わされる。2つのパターンによって形成された干渉縞は、通常の広視野顕微鏡法で区別できない細かい細部を符号化する。最終的な超解決画像は、回折格子の移動と回転によって得られた同じサンプルのいくつかの生画像を数学的方法で組み合わせてデコードすることによって得られます。超解決画像の解像度は、側面で100nm、横方向の軸方向で500nm、横方向では150nm、3D-SIM16の軸方向では250nmに達する。16
シナプスの新しい理解は、シナプス機能障害が発症と進行に大きな役割を果たす多くの神経疾患の観点からさらに重要である17,,18.アルツハイマー病は、ダウン症、パーキンソン病、プリオン病、てんかん、自閉症スペクトラム障害および脆弱X症候群の中でもシナプス組成物、形態および機能19、20、21、22,の異常に関連している19,。21,22
最近では、一連のSUMO特異的抗体を用いて、SIMを用いて、SYNOタンパク質の一次海馬ニューロンにおけるシナプトフィシン前および事後マーカーシナプトフィシンおよびPSD95を超分解能レベル23で共局在化させた。これにより、ニューロンにおけるSUMOの局在化の生化学的および共焦点的な顕微鏡の証拠を確認することができました。
ここでは、マウス海馬の一次ニューロンにおけるタンパク質の局在を研究するプロトコルについて述べている。同時に、このプロトコルは、異なるタイプの主要な神経細胞培養に適応され得る。
プロトコル
1. 主要文化
- #1.5(0.17 mm)のカバースリップ厚さの客観的要件に一致するチャンバーカバーリップ(イビディμスライド8ウェルまたはNunc Lab-Tekチャンバードカバーグラスなど)における培養マウス海馬主要ニューロン。
- ポリL-リジン(100 μg/mL)の100 μLのカバースリップをコーティング。
- 翌日、チャンバー付きのカバーリップを滅菌リン酸緩衝生理食塩分(PBS)で2回洗います。
- マウスの主要なニューロンを得るために、P1-P4の子犬23から海馬を分離する。
- 解剖培地の10mLに解剖カバを配置し(表1)、チューブの底部に沈着させる。
- 滅菌ピペットを使用して、慎重に解剖培地を取り出し、海馬をチューブの底に邪魔しません。
- 海馬に培地1(表1)10mLを加え、37°Cで30分間インキュベートします。
- 滅菌ピペットを使用して、慎重にチューブの底に邪魔されずに海馬を残して、メディア1を除去します。
- メディア2(表1)10mLを加え、(キャップ付き)遠心管をフードの下に45分間水平に残します。
- 遠心管を縦に立たせて、組織がチューブの底に落ち着くようにします。
- 滅菌ピペットを使用して、慎重に遠心管の底に乱れのない海馬を残して、メディア2を除去します。
- メディア3(表1)の2mLを追加します。
- p1000ピペットを使用して、濾過された先端を有し、細胞を組織から機械的に解離する。
- 単離されたニューロンに位置する上清を15 mL遠心分離管に移す。
- 室温(RT)で300xgで2分間細胞懸濁g液を遠心分離する。
- 遠心分離後、細胞は遠心分離管の底部に位置する。滅菌ピペットを使用して上清を捨てる。
- 培地4の1mLで細胞を再懸濁する。
- 70 μm フィルターを使用して、非解シシテアドセルを除去します。
- ビュルカーチャンバに1 μLの0.4%トリパンブルー溶液を19 μLのセル懸濁液に加えて、生き残った細胞を数えます。
- プレートセルは、ウェルあたり200 μLの体積で70,000個の細胞/ウェルで行います。
- 細胞を37°Cおよび5%CO2の加湿インキュベーターに2時間取り付けることを許可2する。
- チャンバーカバースリップをインキュベーターから取り出し、培地を200μLの培養メディアに慎重に交換します。
- チャンバーカバースリップは、37°Cと5%CO2の加湿インキュベーターに残2します。
- 培地の3分の1を5~7日ごとに新鮮な培養培地に置き換えます。
- 海馬の一次ニューロンが完全に成熟するまで待ちます (めっき後 12-14 日) 共局在化研究を行います.
2. 免疫蛍光染色
- インキュベーターからチャンバーカバーリップを取ります。
- メディアを取り外します。
- 200 μL の PBS で素早く井戸を洗います。
- 4%パラホルムアルデヒド(PFA)をPBS(200 μL/well)に加えて、すぐにそれらを固定します。
- RTで15分間細胞をインキュベートする。
- PFA ソリューションを削除します。
- 0.2%トリトンX-100(200 μL/well)でPBSを加えて細胞を透過させます。
- RTで1分間インキュベートします。
- 溶液を取り除き、PBS(200 μL/well)の1%のウシ血清アルブミン(BSA)をRTで1時間インキュベートし、無関係なタンパク質でプレートのすべての自由結合面を受動的に覆います。トリトンX-100のないBSAベースのブロッキングバッファーは、0.2%Triton X-100と同じバッファよりも効率的に抗体のバックグラウンドを減少させます。
- ソリューションを削除します。
- 1%BSAおよび0.2%トリトンX-100(120-200 μL/well、抗体希釈および可用性に応じて)を含むPBS溶液に希釈した一次抗体を追加します。サンプルを2時間インキュベートする。
- 陰性対照として、一次抗体を一つのウェルに添加しないでください。異なる標的に対して異なる種の複数の抗体を同時に使用してもよい。鶏で育てられたMAP2(ニューロンマーカー)に対する抗体、マウスで育てられたPSD95またはシナプトフィシンのいずれかに対する抗体、およびウサギで育てられた標的タンパク質に対する抗体を使用する。これにより、3色のSIM解析が可能になります。
- PBS(200 μL/ウェル)でウェルを3回素早く洗います。
- 1%BSAおよび0.2%トリトンX-100(200 μL/well)を含むPBS溶液中で希釈した二次抗体(dyLightおよびAlexa二次抗体の両方を使用することができる)を加える。RTで1時間サンプルをインキュベートする。
- PBS(200 μL/ウェル)でウェルを3回素早く洗います。
- PBS(200 μL/ウェル)で希釈した濃度1 μg/mLで、核を染色するようHoechst色素を加えます。RTで10分間サンプルをインキュベートします。
- PBSで2回素早く井戸を洗います。
- SIM 対応のマウントを使用してセルをマウントします。ProLongガラスアンチフェードマウンタントの10 μL/ウェルを使用してください。
- カバーグラス(直径8mmの丸いカバーグラスなど)で細胞を覆い保護します。正方形のものも使用できます。
- チャンバーカバースリップをRTに保管し、画像を取得する前に少なくとも48時間待ちます。ダイヤモンドグラスは、超解像度の買収の前に少なくとも2日間の硬化を必要とします。
3. 抗体特異性制御
注:抗体の特異性を保証するために2つの戦略を使用してください。第1の戦略は、同じ基質を標的とする少なくとも2つの異なる抗体を使用することである。第2の戦略は、抗体を上げるため、精製タンパク質標的またはエピトープを用いたインキュベーションによる抗体中和である。
- PBSで1%BSAのRTで1時間の組換え標的またはエピトープの5倍の過剰で選択した抗体をインキュベートする。
- インキュベーション後、上記の2.11から前記のように染色するための通常の濃度で中和抗体を使用する。
4. 顕微鏡キャリブレーション
注:私たちは、超解像研究のためにニコン製N-SIM超解像度顕微鏡システムを日常的に使用しています。しかし、他のいくつかの企業は、カタログに超解像度顕微鏡を提供しています。ニコンのN-SIMシステムの具体的な指示は説明されていますが、後述の手順は他のシステムに一般化することができます。SIM画像を取得する前に、システムは特定のサブ解像度サイズの蛍光ビーズを適切にキャリブレーションする必要があります。例として、テトラスペックの微小球があります。これらのビーズは、1つのサンプルで異なるレーザーのキャリブレーションを可能にするために、異なる蛍光色素で染色されています。
- 水浴で1.8 x 108蛍 光微小球の周りに10分間超音波処理します。ニコンのN-SIMシステムは、キャリブレーションのためにまばらな多色ビーズサンプルを必要とします。これは、サブ解像度サイズの蛍光ビーズの緻密な単層を必要とする他のシステムで異なる可能性があります。蛍光粒子の数を適宜調整します。
- 蛍光微小球を1:500に二重蒸留水で希釈します。
- さらに10分間2回目のソニッケートを行います。
- 希釈されたビーズの15 μLをチャンバーカバースリップの井戸にピペット。
- 溶液をRTで5分間乾燥させます。
- 取り付け溶液を10μL加え、8mmのカバースリップを上に置きます。
- 適切な硬化を可能にするために少なくとも48時間待ってください。
- 顕微鏡とレーザーをオンにします。
- システムが温まるすべての顕微鏡コンポーネントの熱平衡に達するようにします。N-SIM超解像度顕微鏡システムは、少なくとも3時間を必要とします。
- 100x の目標を選択します。
- レーザーを回折格子ブロックの中心に合わせて調整を開始します。N-SIMシステムでは、マイクロメーターノブと専用カメラを使用して、光線をターゲットにセンタリングできます。
- チャンバーカバースリップを顕微鏡に挿入して、観察します。客観的な補正カラーを調整することにより、チャンバーカバースリップの厚さにシステムを設定します。NISソフトウェアは、N-SIM超解像度顕微鏡システムで提供される独自のソフトウェアで、補正首輪を調節する自動機能を備えています。
- 各チャンネルのグレーティングブロックフォーカスを調整して、サンプルに焦点を合わせて構造化されたパターン照明を確保します。NIS ソフトウェアは、このタスクの自動機能を提供します。
- 次に、多色微小球の生の3D-SIM画像を取得します。生画像を再構成して、生体画像ImageJ24 およびプラグインfairSIM25の解析用の顕微鏡ソフトウェアまたはオープンソースソフトウェアプラットフォームを用いて超解決画像を得る。
- 4.14で得られた超分解画像のフーリエ変換を、分離された波長ごとに計算します。変換された画像が正しい花のようなパターンを得られない場合は、スーパー解像度が達成されていないので、4.11からキャリブレーションを再開します。
- 超解決イメージでは、1 つのマイクロスフィアを選択し、各チャネルの強度プロファイルを計算して、達成した解像度を測定します。横に 100 nm に近いはずです。
- 次に、マイクロスフィアのマルチチャンネル集録をオーバーレイしてチャンネル登録を行う。目標は、すべてのチャンネル信号を横に、軸に合致することです。これは異なったチャネルのずれによる色収差を除去し、共局在分析を助ける。
- オープンソースアプリケーションImageJのためのプラグインのスイートであるSIMcheck26の「照明段階ステップ」と「イルミネーションパターンフォーカス」機能を使用してキャリブレーションの品質を確認します。この最後に、チャンバーカバースリップを準備して、TetraSpeck微小球の密な単層を得て、サンプルの3D-SIM画像を取得します。ImageJで画像を解析し、収差が検出された場合は、ステップ4.11から顕微鏡キャリブレーションを再開します。
5. 取得
- 共焦点またはワイドフィールドモードで40倍の目的を使用してサンプルの分析を開始します。これにより、サンプルに移動でき、良い詳細と大きな視野を維持できます。
- MAP2抗体シグナルを使用して、ニューロンプロセスを表す領域を特定します。
- 共焦点モードでサンプルの画像を取得し、染色の品質を決定します。低い共焦点品質は、低い SIM 品質に反映されるため、サンプルを廃棄する必要があります。
- 画像の面積と品質が満足できる場合は、目的を100倍に切り替えます。
- 100xの目的に油を適用します。
- 超解決イメージの品質を評価するために後で使用されるワイドフィールドまたは共焦点イメージを取得します (図 1A,B)。
- 3D-SIM モードに切り替えます。
- ダイアログ ウィンドウを使用して取得するパラメータを設定し、色情報を最大化するために使用可能な最高のビット深度設定を選択します。通常、16 ビットが標準の選択肢です。また、信号対雑音比を向上させるために、1MHzなどの取得に低い周波数値を選択します。
- ヒストグラムウィンドウを使用して、レーザーパワーを設定して信号の線形応答を得る。情報の損失を避けるため、画像の飽和ピクセルを制限します。N-SIMシステムは、アンドーiXon3カメラを使用しています。16 ビットで作業する場合は、カメラの線形応答を確保するために、目標の強度 16,000 を選択します。または、取得のダイナミックレンジを最大化するために30,000から45,000の範囲を選択します。
- サンプルを撮影する場合は、レーザーパワーを0.1~50%に設定し、50 ms~2秒の間の露出時間を設定します。50%を超えるレーザーパワーは、使用中の蛍光色素の急速な光の漂白を引き起こす可能性があります。
- 3D-SIMモードで画像の取得を開始します。
- SIMcheck、ImageJ用の無料プラグインのスイートを使用して、生画像の取得の品質を評価します。
- SIMCheck でアーティファクトや品質の問題が検出されない場合は、4 つの技術複製から最低 10 個のイメージを取得して、統計分析を行います。
6. ポストプロダクション:画像再構成
注:3D-SIM取得画像は、再構成された超解決画像を取得するために処理する必要がある生の画像です。生画像の誤った再構成は、サンプルの分析に影響を与えるアーティファクトにつながる可能性があります。したがって、再構成パラメータを適切に選択するには、大きな注意を払う必要があります。
- 顕微鏡再構成解析ソフトウェアを用いて生画像を処理し、超分解画像を得る(図1C)。あるいは、自由に利用できる ImageJ プラグイン fairSIM を使用して、生のイメージを再構築します。
- 顕微鏡再構成ソフトウェアまたは ImageJ プラグイン SIMCheck を使用して、超解決画像のフーリエ変換を計算します。良い再構築された画像は、各チャンネルのために、花のような画像を返す必要があります。再構築された画像が花のような形状を再現できない場合は、生の画像から再開し、ウィーナーフィルタリング、アポダイゼーション、ゼロオーダー抑圧27などの再構成パラメータを修正して再構築する。NISソフトウェアでは、パラメータの変更が最終的な解決されたイメージにどのように影響するかを監視するためにプレビューを使用して、パラメータを変更i)照明変調コントラスト、ii)高解像度ノイズ抑制とiii)フォーカスの外抑制。
- 次に、再構築された画像を分析し、ImageJベースのプラグインNanoJ-SQUIRREL28を使用して、超解決画像の品質を評価することで、アーティファクトを公平に検出します。
- NanoJ-SQUIRREL がアーティファクトを検出した場合は、生の画像から再起動し、ウィーナー フィルタリング、アポダイゼーション、ゼロ オーダー抑制などの再構築パラメータを変更して再構築します。NIS ソフトウェアでは、プレビューを使用して、パラメータの変更が最終的な解決されたイメージに与える影響を監視し、パラメータ[照明変調コントラスト]、[高解像度ノイズ抑制]、および[焦点外抑制]パラメータを変更します。
- 超解決画像を使用して、共局在プロファイルおよび/またはピアソンとマンダーの係数を計算します。
7. プロファイル分析との共同ローカリゼーション
注: シナプスマーカーと目的のタンパク質の共同局在化を研究する最初のステップとして、超解決画像を取り、単一の軌跡を分析してシグナルの重複を判断します。
- 超解決画像上の単一の軌跡を識別します。
- 対象の軌跡の蛍光シグナルの強度プロファイルを取得します。
- データをエクスポートします。
- GraphPad Prism または同様の解析ソフトウェアを使用して、すべての信号ピークを正規化し、各チャネルに対して同等の信号強度を得て、軌跡固有の共局在化を決定するという最終目標を達成します。
8. ピアソンとマンダーの係数の定量化
注:プロファイル分析で単一の遺伝子座の共局在化が示唆されている場合、PearsonとManderの係数29,30,30を計算することで、画像全体のより一般的な分析を行うことができます。
- 共ローカライズの 2 つのパラメーターを決定するには、ImageJ プラグインである JACoP31を使用します: ピアソンとマンダーの。
9. 統計分析
- JACoP で収集されたデータを処理するには、GraphPad プリズム(または同様の分析およびグラフ作成ソフトウェア)を使用します。
- グラフを取得し、統計的関連性を得るために分析した各条件に少なくとも 40 SIM イメージを使用します。
結果
ここでは、神経タンパク質の共局在化を研究するための標準的なワークフローを紹介します。まず顕微鏡を校正し、次にサンプルのSIM分析を行いました。システムの較正のために、直径0.1μmの蛍光微小球を用いた。ビーズの超解決 3D-SIM 画像を取得すると、基になる画像データはフーリエ変換されて空間周波数表現に変換されます。 図2Aでは、明確な花のパターンは、超解像度の詳細レベルの指標として提示されています。次に、単一のビーズの強度プロファイルのピークの半分の最大値(FWHM)で全幅を計算することによって達成される解像度を測定しました(図2B,C)。最後に、蛍光微小球を使用して、チャネル登録による色収差を修正しました(図3A,B)。次に、100xの目的でサンプルの解析を開始し、3D-SIM画像を取得しました。SIMCheckを使用して、取得時のフィールド照明や運動の均一性を評価しました(図4A)。照明パターン角度(図4B)の強度の違いをチェックし、ノイズに対する変調コントラストの比を計算して局所ストライプコントラストを測定しました(図4C)。最後に、再構築の有効解像度を推定しました (図 4D)。
次にNanoJ-SQUIRRELを用いて超解決画像の品質を確認しました。最初の再構築された画像(図5A)では、NanoJ-SQUIRRELはアーティファクトの存在を検出した(図5C)。新しい超解決画像を得るために再構成パラメータを変更しました (図5B)そしてNanoJ-SQUIRRELは、アーティファクトの欠如を確認しました (図5D)。システムを較正し、再構築された画像の品質を評価した後、次にMAP2、ニューロンマーカー、PSD95、シナプス後マーカー、標的タンパク質SUMO1に対する抗体で染色された主要な神経細胞培養の分析を開始しました。まず、40倍の目的で4チャンネル共焦点顕微鏡を行うサンプルを分析しました(図6A)。神経細胞のプロセスを表す領域を選択すると、100xの目的に切り替えました。同じ領域の共焦点画像とSIM画像を両方取得し、NanoJ-SQUIRRELで再構築の質を評価し、共局在解析を行いました。 図6Bでは、SENP1とドレブリンに染色されたニューロンの超分解3D-SIM画像を示す。超解決画像における共局在化は、プロファイル分析(図7A)およびピアソンとマンダーの係数の定量化(図7B)で分析することができる。

図1:ワイドフィールド、共焦点、SIMの取得の比較(A)SENP1(緑色)、ドレブリン(赤)およびMAP2(モーヴ)に対して免疫染色された主要海馬ニューロンのワイドフィールド画像。ADAPIは、核を染色するために使用した。スケールバー 5 μm(B) パネルAの同じサンプルの共焦点像(C)パネル AとBの同じサンプルの SIM イメージ。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:顕微鏡キャリブレーション用の微小球の3D-SIM画像の解析(A) 花のような形をした微小球の獲得の高速フーリエ変換。(B) 横の空間分解能を決定する単一の微小球の選択。(C)そのFWHMの測定を用いて B の単一の微小球の強度プロファイル。値は、計測器によって達成される解像度を表します。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:3チャンネル登録。(A)登録前に多色(波長488nm、555nmおよび647nm)テトラスペック微小球の取得。(B)キャリブレーション後の同じサンプルの取得。この図の大きなバージョンを表示するには、ここをクリックしてください。
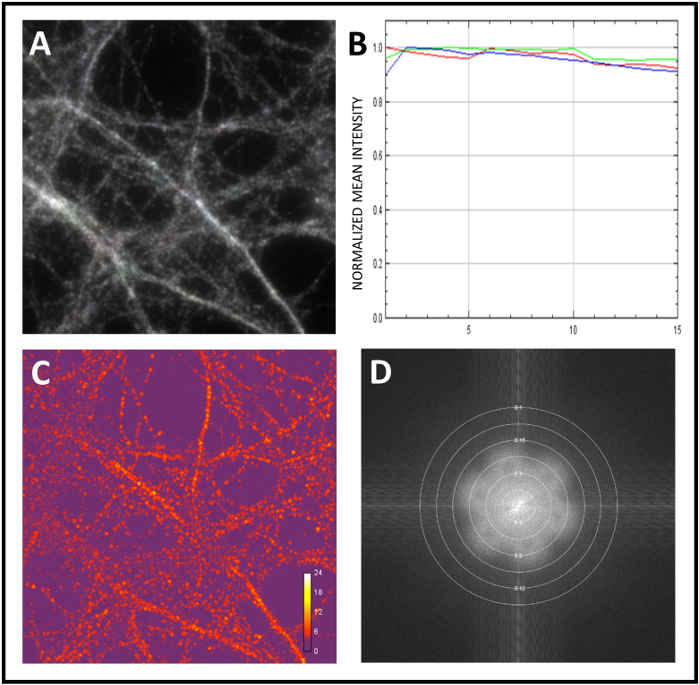
図4:SIMcheckを使用した生画像および再構成された画像の品質評価(A)SIMCheck を使用した モーションおよび照明の変化 解析シグナルグレーから白は、集録時の均一な照明と動きの欠如を表します。(B)生画像を解析した チャンネル強度プロファイル 。この例では、強度変動が最小限であり、欠乏または漂白または変動を示唆する。(C) Raw 変調 コントラスト を使用して、画像内の変調対ノイズの比率を計算します。ヒートマップは、変調コントラストの変化を示します。(D) フーリエプロットを再構築 し、振幅フーリエスペクトルを解析し、再構成の有効解像度を決定した。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図5 NanoJ-SQUIRRELを用いた超解像度画質の評価(A) アーティファクトを含む超解像度画像を参照します。(B)良質の超解像度イメージを参照。(C) Aの NanoJ-SQUIRREL エラーマップを表す画像 .明るい領域は大規模なアーティファクトを表し、暗い領域は正しい再構成を表します。(D) ナノJ-リス エラーマップ B. この図の大きなバージョンを表示するには、ここをクリックしてください。

図 6: SIM イメージのサンプル(A) 一次ニューロンの共焦点顕微鏡40X目標は、良好な解像度を維持しながら、サンプルの概要を取得するために選択されました。細胞は、SUMO1(緑色)、PSD95(赤色)およびMAP2(モーブ)について免疫染色した。DAPIは、核を染色するために使用した。スケールバー50 μm。画像はZ投影として表示されました。(B) 100X の目的を使用してパネル A の緑色のボックスで強調表示された領域上の SUMO1 および PSD95 の SIM イメージ。赤い矢印は、強度プロファイルの計算に使用される A に示すインセットの位置を示します。スケールバー5 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
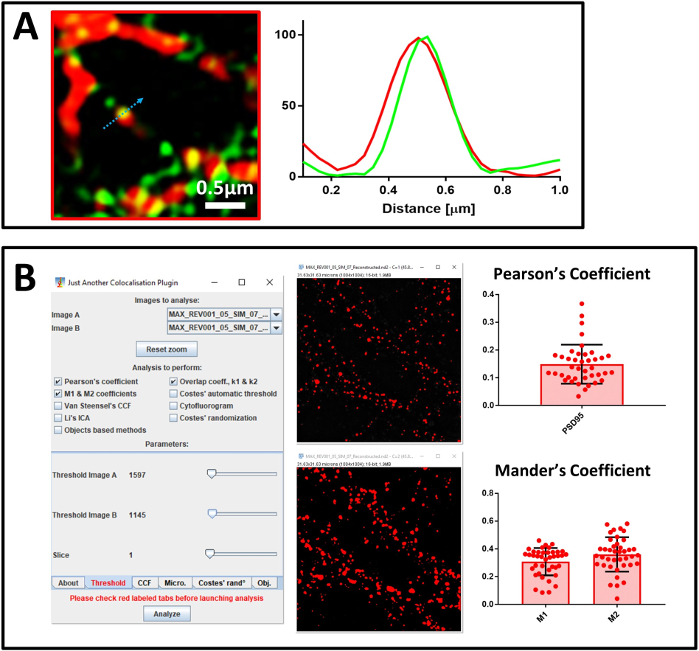
図 7: 共局化分析(A)SENP1(緑色)とdreブリン(赤)に対する抗体で染色された一次ニューロンの超分解画像、スケールバー0.5μm、およびその強度プロファイル。Aグラフの値は、各チャンネルで100(任意の単位)に正規化され、青い矢印で示されるピクセルの強度に対応しています。(B) JACoP を用いた分析により、SENP1 と drebrin の間のピアソンの相関係数とマンダー係数を計算する。プラグインのセットアップと視覚的なしきい値のウィンドウが表示されます。マンダーの係数は、ドレブリン(M1)と共局化するSENP1分率と、SENP1(M2)と共局化するdrebrin分率の2つの値で表されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
シナプスの構造と組成を解明することは、記憶と認知を調節する生理学的および病理学的プロセスを理解するために重要である。正常な状態にある間、シナプスは記憶の構成要素であり、アルツハイマー病32のような複雑な神経疾患の根源でもある。ここで説明するプロトコルは、SIMと呼ばれる超解像顕微鏡技術を用いて神経タンパク質の共局在化を研究するのに役立つ。特定の照明パターンを使用して、SIMは、通常0.03〜0.15μmの間で測定するシナプスの研究に適した約0.1μmの解像度に達することができます。さらに詳細には、STED(刺激放出枯渇顕微鏡)、PALM(光活性化局在化顕微鏡)またはSTORM(確率的光学再構成顕微鏡)などの他の超解像技術を、10〜20nmの分解能に達することができる、33を適用してもよい。
ここでは、一次ニューロンにおけるシナプスマーカーを用いた標的タンパク質の共局在化の分析について述べている。このプロトコルは、海馬、小脳、皮質ニューロンなどの神経細胞の任意の一次培養、さらには腸神経系ニューロンなどの中枢神経系に属さない一次ニューロンの培養にも適用することができる。しかし、超分解能レベルでの分析の鍵は、チャンバーカバーリップや目的の回折指数と互換性のある取り付けソリューションなど、取得中に使用される試薬です。私たちは、その使いやすさのためにチャンバーカバーリップを使用しましたが、コーティングされたカバーグラス上の一次ニューロンを成長させる古典的で安価な方法は、特に高精度の#1.5H(0.17 mm)カバーグラスで有効です。また、ガラスの屈折率(1.52)にできるだけ近い屈折率に達できる実装メディアと、屈折率1.515の100x目的に対する浸漬油を使用する必要があります。一定の室温および安定したテーブルはまた、取得の正確性を保証するために必須である。
SIM研究では、dyLight抗体とAlexa二次抗体の両方を使用しています。励起と放出の狭いピークと良好な量子収率のために、それらは最高の信号対雑音比を必要とする超解像技術のために示されています。Dempseyらは、アレクサ、ダイライトおよび他の蛍光灯を超分解能イメージング34と比較した。
撮影時には、撮影速度が遅いため、10MHz以上1MHzでカメラを日常的に設定し、10MHzよりも精度が高くノイズが少なくなります。ただし、10 MHz の速度はライブイメージに役立ちます。漂白を防ぎ、蛍光色素を保存するために、レーザーパワーをできるだけ低く設定しました。信号強度を向上させるために、ゲイン値を増やすことができます。低い利得は騒音を高めることなくよりクリーンな画像を保証することは注目に値する。一般的に、チャンバーカバースリップの底部から7μm以内にイメージングしながら最良の結果が得られます。これは、油浸漬で100xの目標を使用する場合に特に重要です。細胞/組織全体のより深い獲得が必要な場合は、水浸漬で60倍の目的を使用する方が良い選択かもしれません。
SIM研究を行う上での主な課題の1つは、画像再構成35である。アーティファクトや収差のない超解決画像を取得するには、アドホック実験条件を使用するだけでなく、システムの慎重なキャリブレーションとパラメータ最適化を行い、最終的な画像を取得する必要があります。プロトコルでは、システムの較正と生画像と再構築された画像の品質分析を評価することによって、最も一般的な間違いのいくつかを回避する方法を説明します。具体的には、ImageJ プラグイン SIMCheck と NanoJ-SQUIRREL を使用して、超解決イメージの一般的なアーティファクトを防ぐための正しい機器設定を保証する方法について説明します。アプリケーションは、研究の構造の事前知識に対して結果を主観的なベンチマークに基づいていない最終的な画像の公平な品質評価を可能にします。
シナプトフィシンとPSD95またはdrebrinをシナプス前およびシナプス後マーカーとして使用することをお勧めしますが、他のマーカーも有効です。巨大な文献体は、シナプスマーカー36、37としてファゴットなどのタンパク質を37記述する。しかし、前および後のナプティクスマーカーは、核を除いて細胞全体に存在することは注目に値する。そのシグナルの多くは非シナプスですが、輸送中または分解中のタンパク質、バックグラウンドまたは他のアーティファクトを表します。したがって、解析の領域を慎重に選択することが重要です。MAP2抗体シグナルを使用して、軸索および樹状端子を選択します。
共局在の分析では、2つのアプローチを使用します。1 つ目は、共同ローカリゼーションの単一イベントを示し、各チャネルの貢献度を識別するプロファイル分析に基づく視覚的なアプローチです。しかし、このアプローチの注意点は、統計的な力が乏しい点です。このため、各画像のフィールド全体を代表するイベント数の多い分析に基づく第2の方法も用いることにした。この方法はピアソンの相関係数とマンダーのM1係数とM2係数の計算に基づいています。ピアソンの相関係数を使用して、画像内のシグナルの重複を記述し、マンダーのM1とM2を使用して、関心のあるシグナル間の相互共局在化を記述する38.計算には、解析への背景の貢献を破棄する手動しきい値を設定できる機能があり、特にManderの分析に不可欠な機能を備えているため、ImageJプラグインJACoPを採用しています。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、原稿の建設的な批判のためにエドアルド・ミオッティに感謝したいと思います。この研究は、ブライトフォーカスA2019296F、フォンド・ディ・ベネフィチェンツァ - グルッポ・インテッサ・サンパオロ(LC)、フォンダツィオーネ・リージョネージュ・パー・ラ・リセルカ・バイオメディカ(Care4NeuroRare CP_20/2018)(CN)、マリー・スウォドフスカ・キュリー・イノベーティブ・トレーニング・ネットワーク(JK)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue solution | Thermo Fisher Scientific | 15250061 | Chemical |
| 70 µm filter | Corning | 352350 | Equiment |
| Alexa | Thermo Fisher Scientific | - | Antibody |
| Antibody SENP1 | Santa Cruz | sc-271360 | Antibody |
| B27 Supplement | Life Technologies | 17504044 | Chemical |
| Bovine serum albumin | Merck | 5470 | Chemical |
| CaCl2 | Merck Life Science | 21115 | Chemical |
| Chambered coverslips | Ibidi | 80826 | Equiment |
| DyLight | Thermo Fisher Scientific | - | Antibody |
| FBS (Hyclone) | GIBCO | SH3007002 (CHA1111L) | Serum |
| FluoSpheres carboxylate-modified microspheres, 0.1 μm, yellow–green fluorescent | Thermo Fisher Scientific | F8803 | Equiment |
| Glucose | Merck Life Science | G8769 | Chemical |
| Glutamax | GIBCO | 35050061 | Chemical |
| HEPES | Merck Life Science | H3537 | Chemical |
| L-Cystein | Merck Life Science | C6852-25g | Chemical |
| MAP2 | Merck | AB15452 | Antibody |
| MEM | Life Technologies | 21575022 | Medium |
| MgCl | Merck Life Science | M8266 | Chemical |
| NaOH | VWR International | 1,091,371,000 | Chemical |
| Neurobasal A | Life Technologies | 10888022 | Medium |
| N-SIM Super Resolution Microscope | Nikon | - | Instrument |
| Papain | Merck Life Science | P-3125 | Chemical |
| paraformaldehyde | Thermo Fisher Scientific | 28908 | Chemical |
| Pen/Strep 10x | Life Technologies | 15140122 | Chemical |
| phosphate-buffered saline | Gibco | 10010023 | Chemical |
| Poly-L lysine | Sigma | P2636 | Chemical |
| ProLong Diamond Glass Antifade Mountant | Thermo Fisher Scientific | P36970 | Chemical |
| PSD95 | NeuroMab | K28/43 | Antibody |
| Round coverglass | Thermo | 12052712 | Equiment |
| SUMO1 | Abcam | ab32058 | Antibody |
| Synaptophysin | Merck | S5768 | Antibody |
| Triton X-100 | Merck | T8787 | Chemical |
| Trypsin inhibitor | Merck Life Science | T9003-500MG | Chemical |
参考文献
- Foster, M., Sherrington, C. S. . A textbook of physiology, part three: The central nervous system (7th ed.). , (1897).
- Choquet, D., Triller, A. The Dynamic Synapse. Neuron. 80 (3), 691-703 (2013).
- McAllister, A. K. Dynamic Aspects of CNS Synapse Formation. Annual Review of Neuroscience. 30 (1), 425-450 (2007).
- Yuzaki, M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annual Review of Physiology. 80 (1), 243-262 (2018).
- Baddeley, D., Bewersdorf, J. Biological Insight from Super-Resolution Microscopy: What We Can Learn from Localization-Based Images. Annual Review of Biochemistry. 87 (1), 965-989 (2018).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Vangindertael, J., et al. An introduction to optical super-resolution microscopy for the adventurous biologist. Methods and Applications in Fluorescence. 6 (2), 022003 (2018).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Scalisi, S., Barberis, A., Petrini, E. M., Zanacchi, F. C., Diaspro, A. Unveiling the Inhibitory Synapse Organization Using Superresolution Microscopy. Biophysical Journal. 116 (3), 133 (2019).
- Yang, X., Specht, C. G. Subsynaptic Domains in Super-Resolution Microscopy: The Treachery of Images. Frontiers in Molecular Neuroscience. 12, (2019).
- Monro, T. Beyond the diffraction limit. Nature Photonics. 3 (7), 361 (2009).
- Won, R. Eyes on super-resolution. Nature Photonics. 3 (7), 368-369 (2009).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific Reports. 6 (1), 27290 (2016).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Gustafsson, M. G. L., et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Brose, N., O'Connor, V., Skehel, P. Synaptopathy: dysfunction of synaptic function. Biochemical Society Transactions. 38 (2), 443-444 (2010).
- Tyebji, S., Hannan, A. J. Synaptopathic mechanisms of neurodegeneration and dementia: Insights from Huntington's disease. Progress in Neurobiology. 153, 18-45 (2017).
- Won, H., Mah, W., Kim, E. Autism spectrum disorder causes, mechanisms, and treatments: focus on neuronal synapses. Frontiers in Molecular Neuroscience. 6, (2013).
- Pfeiffer, B. E., Huber, K. M. The State of Synapses in Fragile X Syndrome. The Neuroscientist. 15 (5), 549-567 (2009).
- Pavlowsky, A., Chelly, J., Billuart, P. Emerging major synaptic signaling pathways involved in intellectual disability. Molecular Psychiatry. 17 (7), 682-693 (2012).
- Senatore, A., Restelli, E., Chiesa, R. Synaptic dysfunction in prion diseases: a trafficking problem. International Journal of Cell Biology. 2013, 543803 (2013).
- Colnaghi, L., et al. Super Resolution Microscopy of SUMO Proteins in Neurons. Frontiers in Cellular Neuroscience. 13, (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Müller, M., Mönkemöller, V., Hennig, S., Hübner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7 (1), 10980 (2016).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Schaefer, L. H., Schuster, D., Schaffer, J. Structured illumination microscopy: artefact analysis and reduction utilizing a parameter optimization approach. Journal of Microscopy. 216 (2), 165-174 (2004).
- Culley, S., et al. NanoJ-SQUIRREL: quantitative mapping and minimisation of super-resolution optical imaging artefacts. Nature Methods. 15 (4), 263-266 (2018).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of co-localization of objects in dual-colour confocal images. Journal of Microscopy. 169 (3), 375-382 (1993).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
- Bolte, S., Cordelières, F. P. A guided tour into subcellular colocalization analysis in light microscopy. Journal of Microscopy. 224, 213-232 (2006).
- Bae, J. R., Kim, S. H. Synapses in neurodegenerative diseases. BMB Reports. 50 (5), 237-246 (2017).
- Godin, A. G., Lounis, B., Cognet, L. Super-resolution Microscopy Approaches for Live Cell Imaging. Biophysical Journal. 107 (8), 1777-1784 (2014).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nature Methods. 8 (12), 1027-1036 (2011).
- Karras, C., et al. Successful optimization of reconstruction parameters in structured illumination microscopy - A practical guide. Optics Communications. 436, 69-75 (2019).
- Bereczki, E., et al. Synaptic markers of cognitive decline in neurodegenerative diseases: a proteomic approach. Brain: A Journal of Neurology. 141 (2), 582-595 (2018).
- Gilestro, G. F., Tononi, G., Cirelli, C. Widespread Changes in Synaptic Markers as a Function of Sleep and Wakefulness in Drosophila. Science. 324 (5923), 109-112 (2009).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander's overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved