Method Article
超分辨率成像研究原发神经元中蛋白质和突触标记的共同定位
摘要
该协议演示了如何使用超分辨率显微镜来研究蛋白质在原发神经元培养物中的共定位。
摘要
突触是神经元的功能元素,其缺陷或损失是几种神经退行性和神经性疾病的基础。成像研究被广泛用于研究其在生理和病理条件下的功能和可塑性。由于其尺寸和结构,蛋白质的定位研究需要高分辨率成像技术。在该协议中,我们描述了一个程序,用于研究在初级神经元中使用结构化照明显微镜 (SIM) 在超分辨率级别使用突触标记的目标蛋白质的共同定位。SIM 是一种图案照明技术,可使广场显微镜的空间分辨率翻倍,细节达到 100 nm 左右。该协议指示强大的联合本地化研究所需的控制和设置,并概述正确分析成像数据的统计方法。
引言
自从1897年福斯特和谢林顿在1897年第一次描述突触以来,对突触的理解和看法发生了巨大的变化。从那时起,我们对神经元交流的知识及其背后的分子过程呈指数级增长。很明显,突触可以被认为是一个双隔间系统:一个包含用于释放神经递质的囊泡的突触前隔间,以及一个具有受体3的突触后隔间。在过去的二十年里,这种简单化的观点已经演变成一个复杂的蛋白质网络,这些蛋白质是将发射机结合成信号4所需的蛋白质。
理解的收获部分是由于超分辨率技术,克服了传统光显微镜的衍射极限,以适应突触的尺寸更好5,6,7,8,9,10。6,7,8,9,105由于衍射限制,光学显微镜不能达到分辨率超过200纳米横向11,12。11,为了绕过这个限制,建立了超分辨率技术,使用不同的方法,并达到不同的子衍射极限分辨率:SIM,STED(刺激发射耗竭显微镜),PALM(照片激活定位显微镜)和风暴(随机光学重建显微镜)13,,14。SIM通过将衍射光栅插入激励光束路径15,使基于激光的广场显微镜系统的空间分辨率翻倍。可移动光栅可衍射激光束,形成已知的照明模式,通常是条纹。这种有目的的结构光模式叠加到荧光染料(样品)的未知空间分布上。由两种模式形成的干扰边缘编码,否则无法区分的精细细节与正常的宽场显微镜。最终的超解析图像是通过结合和解码与数学方法相同的样本的多个原始图像通过衍射光栅的平移和旋转获得的。超分辨率图像的分辨率达到100纳米的横向和500纳米的轴向2D-SIM15或100nm在横向和250纳米的轴向为3D-SIM16。16
由于许多神经系统疾病,突触功能障碍在发病和进展17,18中起着主要作用,对突触的新理解更为重要。阿尔茨海默病、唐氏综合症、帕金森病、普里昂病、癫痫、自闭症谱系障碍和易碎X综合征等都与突触组成、形态和功能19、20、21、22,20,21,的异常有关。
最近,我们使用一组SUMO特异性抗体,使用SIM显示SUMO蛋白质的原生海马神经元与突触前和后突触标记突触物理和PSD95在超分辨率水平23的共同定位。这使我们能够确认SSUMO在神经元中的定位的生化和共体显微镜证据。
在这里,我们描述了一个协议,研究蛋白质在小鼠海马原神经元的定位。同时,此协议可适应不同类型的原发神经元培养。
研究方案
1. 主要文化
- 培养小鼠海马原神经元在室盖玻片(如伊比迪μ-滑动8井或N得不好实验室-Tek室盖玻璃),符合#1.5(0.17毫米)盖玻片厚度的客观要求。
- 涂覆室盖玻片,带 100 μL 聚 L-lysine (100 μg/mL)。
- 第二天,用无菌磷酸盐缓冲盐水(PBS)清洗两次室盖玻片。
- 要获得小鼠原发神经元,请将海马从P1-P4幼崽23中分离。
- 将解剖的海马放在10 mL的解剖介质(表1)中,并把它们放在管的底部。
- 使用无菌移液器,小心地去除解剖介质,使海马在管底不受干扰。
- 将10 mL的介质1(表1)加入海马,在37°C下孵育30分钟。
- 使用无菌移液器,小心地取出介质 1,使海马在管底不受干扰。
- 加入10 mL的介质2(表1),将(封盖)离心管水平放在发动机罩下45分钟。
- 让离心管垂直站立,让组织在管的底部沉淀。
- 使用无菌移液器,小心地取出介质 2,使海马在离心管底部不受干扰。
- 添加 2 mL 的介质 3 (表 1)
- 使用带过滤尖端的 p1000 移液器,机械地将细胞与组织分离。
- 将上一液(位于隔离神经元)转移到15 mL离心管。
- 在室温 (RT) 下,在 300 x g 下将电池 悬 架离心 2 分钟。
- 离心后,细胞位于离心管的底部。使用无菌移液器丢弃上流液。
- 在1 mL 的介质 4 中重新发送细胞。
- 使用 70 μm 过滤器消除未分离的细胞。
- 通过将 1 μL 的 0.4% Trypan 蓝色溶液添加到 19 μL 的细胞悬浮液中,计算 Bürker 腔室中的可行细胞。
- 板细胞在70,000个细胞/井的体积为200μL每井。
- 让细胞在37°C和5%CO 2的加湿培养箱中附着2小时。
- 从培养箱中取出室盖玻片,小心地用 200 μL 的文化介质更换介质。
- 将室盖玻片留在37°C和5%CO2的加湿培养箱中。
- 每 5-7 天用新鲜文化介质更换三分之一的介质。
- 等到海马原神经元完全成熟(电镀后12-14天)进行共同定位研究。
2. 免疫荧光染色
- 从孵化器中取出室盖玻片。
- 拆下介质。
- 使用 200 μL 的 PBS 快速清洗水井。
- 在PBS(200μL/井)中加入4%的甲状甲醛(PFA),以快速修复它们。
- 在RT中孵育细胞15分钟。
- 卸下 PFA 解决方案。
- 通过添加 PBS 与 0.2% Triton X-100 (200 μL/well) 来渗透细胞。
- 在 Rt 孵育 1 分钟。
- 去除溶液,在RT(200 μL/well)中用1%牛血清白蛋白(BSA)孵育样品1小时,用不相关的蛋白质被动地覆盖板的所有自由结合表面,用于分析。没有 Triton X-100 的基于 BSA 的阻塞缓冲液比使用 0.2% Triton X-100 的同一缓冲液更高效地减少抗体背景。
- 删除溶液。
- 加入含有 1% BSA 和 0.2% Triton X-100(120-200 μL/well)的 PBS 溶液中稀释的一级抗体,具体取决于抗体稀释和可用性。孵育样品2小时。
- 作为阴性控制,不要向其中一口油井添加任何原抗体。不同物种针对不同靶点的不同抗体可同时使用。使用针对鸡中凸起的 MAP2(神经元标记)的抗体、针对小鼠中凸起的 PSD95 或突触物理的抗体,以及针对兔子中凸起的目标蛋白的抗体。这允许三色 SIM 分析。
- 使用 PBS(200 μL/孔)快速清洗井三次。
- 添加二次抗体(dyLight 和 Alexa 二级抗体都可以使用)稀释在含有 1% BSA 和 0.2% Triton X-100 (200 μL/well) 的 PBS 溶液中。在RT中孵育样品1小时。
- 使用 PBS(200 μL/孔)快速清洗井三次。
- 在PBS(200μL/孔)中稀释的浓度为1μg/mL的霍赫斯特染料加入,染色核。在RT中孵育样品10分钟。
- 使用 PBS 快速清洗井两次。
- 使用 SIM 兼容的安装安装单元。使用 10 μL/井的 ProLong 玻璃防臭剂。
- 用盖玻璃(例如,直径为 8 mm 的圆形盖玻璃)盖住和保护电池。也可以使用方形的。
- 将室盖玻片存放在 RT 中,在获取图像之前至少等待 48 小时。钻石玻璃在超分辨率收购前至少需要两天的固化时间。
3. 抗体特异性控制
注:使用两种策略来保证抗体特异性。第一个策略是至少使用两种不同的抗体,针对同一基质。第二种策略是使用纯化蛋白靶点或用于提高抗体的表位孵育来培养抗体中和。
- 在PBS中,在RT中孵育5倍于重组靶点或表位,在RT下孵育1小时。
- 孵育后,使用中和抗体在通常浓度的染色,如上所述从2.11。
4. 显微镜校准
注:我们经常使用尼康制造的N-SIM超分辨率显微镜系统进行超分辨率研究。然而,其他几家公司也提供超分辨率显微镜在他们的目录。尽管介绍了尼康的 N-SIM 系统的具体指示,但以下说明可以推广到其他系统。在采集 SIM 图像之前,系统需要使用特定子分辨率尺寸的荧光珠进行适当的校准。一个例子是四普克微球。这些珠子染色有不同的荧光染料,允许用一个样品校准不同的激光器。
- 在水浴声波约1.8 x 108 荧光微球10分钟。尼康的 N-SIM 系统需要稀疏的多色珠子样品进行校准。对于需要密集单层亚分辨率荧光珠的其他系统,这可能有所不同。相应地调整荧光颗粒的数量。
- 在双蒸馏水中稀释荧光微球1:500。
- 再声一次,再用10分钟。
- 将稀释的珠子的15μL移入室盖玻片的井中。
- 让溶液在RT下干燥5分钟。
- 添加 10 μL 的安装溶液,并在顶部放置 8 mm 盖玻片。
- 等待至少 48 小时,以便进行适当的固化。
- 打开显微镜和激光。
- 让系统预热,以达到所有显微镜组件的热平衡。N-SIM 超分辨率显微镜系统至少需要 3 小时。
- 选择 100 倍目标。
- 通过将激光器与衍射光栅块的中心对齐来开始校准。在 N-SIM 系统中,一个千分尺旋钮和专用摄像机允许光束向目标中心。
- 将室盖玻片插入显微镜进行观察。通过调整目标校正环,将系统设置为室盖玻片厚度。NIS 软件是 N-SIM 超分辨率显微镜系统提供的专有软件,具有调节校正衣领的自动功能。
- 调整每个通道的光栅块焦点,以确保样品上聚焦的结构化图案照明。NIS 软件提供此任务的自动功能。
- 接下来,获取多色微球的原始 3D-SIM 图像。重建原始图像,利用显微镜软件或开源软件平台获得超解析图像,用于生物图像图像J24 和插件公平SIM25的分析。
- 计算在 4.14 中获得的超解析图像的 Fourier 变换。如果转换的图像无法获得正确的花样图案,则从 4.11 重新启动校准,因为尚未实现超分辨率。
- 在超解析图像中,选择单个微球并计算每个通道的强度轮廓,以测量实现的分辨率。它现在应该接近100纳米横向。
- 接下来,通过覆盖微球的多通道采集来执行通道注册。目标是横向和轴向地混合所有通道信号。这将消除不同通道错位导致的色差,并帮助共同本地化分析。
- 使用SIMcheck26的"照明相位步"和"照明模式焦点"功能确认校准质量,这是一套用于开源应用程序 ImageJ 的插件。为此,准备一个室盖玻片,以获得密集的利四普克微球单层,并获取样品的 3D-SIM 图像。分析 ImageJ 中的图像,如果检测到畸变,请从步骤 4.11 重新启动显微镜校准。
5. 收购
- 在共和或宽场模式下使用 40 倍目标开始分析样本。这允许导航到示例,保持良好的细节和较大的视野。
- 使用 MAP2 抗体信号识别表示神经元过程的区域。
- 在共合模式下获取样品的图像,以确定染色的质量。混血质量差会反映在 SIM质量差上,因此需要丢弃样品。
- 如果图像的面积和质量令人满意,请将目标切换到 100 倍。
- 将机油涂抹到 100 倍目标上。
- 获取宽场或共和图像,稍后将用于评估超解析图像的质量(图1A,B)。
- 切换到 3D-SIM 模式。
- 使用对话框窗口设置采集参数,选择可用于最大化颜色信息的最高位深度设置。通常,16 位是标准选择。此外,要提高信噪比,请选择低频率值进行采集,例如 1 MHz。
- 使用直方图窗口,设置激光功率,以获得信号的线性响应。为避免信息丢失,请限制图像中的饱和像素。N-SIM 系统使用 Andor iXon3 摄像机。在 16 位工作时,选择 16,000 的目标强度以确保摄像机的线性响应。或者,选择 30,000-45,000 之间的范围,以最大化采集的动态范围。
- 在成像样品时,将激光功率设置为 0.1% 到 50%,曝光时间在 50 ms 和 2 s 之间。超过 50% 的激光功率可能会导致使用的荧光团快速光漂白。
- 开始以 3D SIM 模式获取图像。
- 使用 SIMcheck,ImageJ 的一套免费插件,评估原始图像的采集质量。
- 如果 SIMCheck 未检测到任何伪影或质量问题,请从 4 个技术复制中获取至少 10 张图像,以便进行统计分析。
6. 后期制作:图像重建
注:3D-SIM 采集的图像是需要处理的原始图像,需要进行处理才能获取重建的超解析图像。原始图像的重建不正确会导致伪影,影响样本的分析。因此,应高度重视正确选择重建参数。
- 使用显微镜重建分析软件处理原始图像,以获得超解析图像(图1C)。或者,使用免费可用的 ImageJ 插件 fairSIM 来重建原始图像。
- 使用显微镜重建软件或 ImageJ 插件 SIMCheck 计算超解析图像的 Fourier 变换。对于每个通道,一个好的重建图像应返回一个花一样的图像。如果重建的图像无法重新创建花状形状,请从原始图像重新启动,然后通过修改重建参数(如维纳滤波、apodization 和零阶抑制27)进行重建。在 NIS 软件中,使用预览来监视更改参数如何影响最终解析的图像,修改参数 i) 照明调制对比度,ii) 高分辨率噪声抑制和 iii) 对焦抑制。
- 接下来,使用NanoJ-SQUIRREL28(一个基于图像J的插件来评估超解析图像28的质量)分析重建的图像,以公正地检测伪像。
- 如果 NanoJ-SQUIRREL 检测到伪影,请从原始图像重新启动,然后通过修改重建参数(如维纳滤波、足化和零阶抑制)进行重建。在 NIS 软件中,使用预览来监视更改参数如何影响最终解析的图像,修改参数照明调制对比度、高分辨率噪声抑制和对焦抑制。
- 使用超解析图像计算共同定位配置文件和/或皮尔逊和曼德的系数。
7. 与配置文件分析进行联合本地化
注:作为研究突触标记和感兴趣的蛋白质之间的共同定位的第一步,采取超解析的图像,并分析单个位置以确定信号重叠。
- 识别超解析图像上的单个位点。
- 获取感兴趣地的荧光信号的强度剖面。
- 导出数据。
- 使用 GraphPad 棱镜或类似的分析软件来规范化所有信号峰值,并获取每个通道的可比信号强度,最终目标是确定特定位置的共同定位。
8. 皮尔逊和曼德系数的量化
注:如果剖面分析建议单位点共定位,可以通过计算皮尔逊和曼德系数29,30,对整个图像进行更一般性的分析。
- 使用JACOP31,一个图像J插件,确定两个参数的共同本地化:皮尔逊和曼德的。
9. 统计分析
- 使用 GraphPad 棱镜或类似的分析和绘图软件来处理使用 JACoP 收集的数据。
- 对分析的每个条件使用至少 40 张 SIM 图像来获取图形和统计相关性。
结果
我们在这里介绍研究神经元蛋白共同定位的标准工作流程。我们首先校准了显微镜,然后对样品进行了 SIM 分析。为了校准系统,我们使用直径为0.1 μm的荧光微球。在获取珠子的超解析 3D-SIM 图像后,对底层图像数据进行 Fourier 转换,以将其重新转换为空间频率表示。在图2A中,不同的花型显示为超分辨率细节水平的指示。接下来,我们测量了通过计算单个珠的强度轮廓峰值(图2B,C)的半最大值(FWHM)的全宽来达到的分辨率。最后,我们再次使用荧光微球(图3A,B)通过通道注册纠正了色差。接下来,我们开始分析样本的100倍目标,我们获得了3D-SIM图像。我们使用 SIMCHECK 评估采集过程中场光或运动的均匀性(图 4A)。我们检查了照明模式角度之间的强度差异(图4B),并计算了调制对比度与噪声的比率,以测量局部条纹对比度(图4C)。最后,我们估计了重建的有效分辨率(图4D)。
接下来,我们使用 NanoJ-SQUIRREL 确认超解析图像的质量。在第一个重建的图像(图5A)中,NanoJ-SQUIRREL检测到了人工制品的存在(图5C)。我们更改了重建参数以获得新的超解析图像(图5B),NanoJ-SQUIRREL证实了伪像的缺乏(图5D)。在校准了系统并评估了重建图像的质量后,我们接下来开始分析与 MAP2、神经元标记、PSD95、突触后标记和靶蛋白 SUMO1 的抗体染色的主要神经元培养。我们首先分析了以40倍目标执行四通道共和显微镜的样本(图6A)。在选择表示神经元过程的区域时,我们切换到 100 倍的目标。我们获取了同一区域的共和图像和 SIM 图像,以评估 NanoJ-SQUIRREL 的重建质量,并执行共同定位分析。在 图6B中,我们显示了为SENP1和debrin染色的神经元的超解析3D-SIM图像。可以通过剖面分析(图7A)和Pearson和曼德系数的量化(图7B)分析超解析图像中的共定位。

图 1:宽场、共和 SIM 收购的比较。(A) 原海马神经元的宽场图像,用于 SENP1(绿色)、德瑞布林(红色)和 MAP2(茂变)的免疫。DAPI 是用来染色核的。刻度栏 5 μm. (B) 面板 A 同一样本的共合 图像。(C) 面板 A 和 B 同一样本 的 SIM 图像。 请单击此处查看此图的较大版本。

图2:显微镜校准微球3D-SIM图像分析。(A) 快速四人形变换,以花形获得微球。(B) 选择单个微球来确定横向空间分辨率。(C) B中单个微球的强度 剖面 ,测量其FWHM.这些值表示仪器实现的分辨率。 请单击此处查看此图的较大版本。

图3:三个通道注册。(A) 在注册前获取多色(波长488nm、555nm和647nm)四普甲板微球。(B) 校准后采集同一样品。 请单击此处查看此图的较大版本。
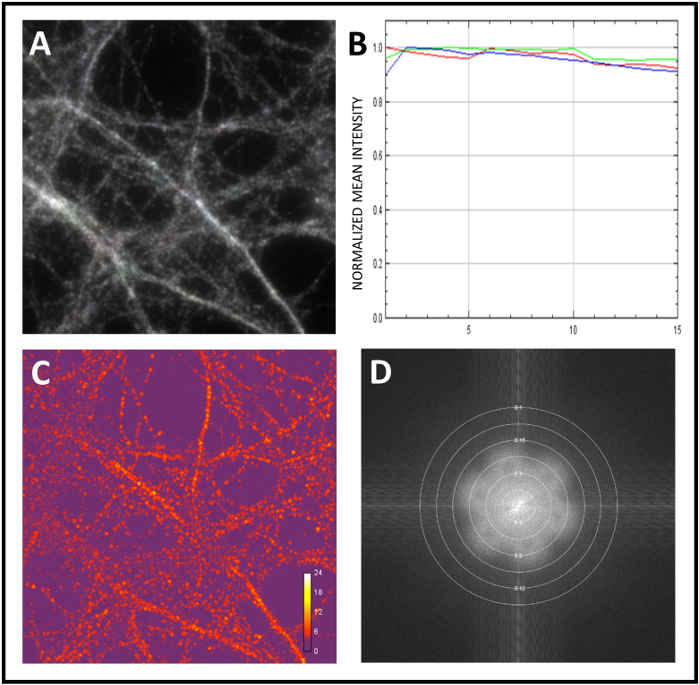
图4:使用SIMcheck对原始图像和重建图像进行质量评估。(A) 使用 SIMCheck 进行运动 和照明变化分析。信号灰色到白色表示均匀的照明和采集过程中没有移动。(B) 通过分析原始 图像获得的通道强度配置文件。在此示例中,强度变化最小,表示缺乏或漂白或波动。(C ) 原始调制 对比度,用于计算图像中调制对比度与噪声的比率。热图显示调制对比度变化。(D) 重建的四面图 分析四边形光谱的振幅,以确定重建的有效分辨率。 请单击此处查看此图的较大版本。

图5:使用NanoJ-SQUIRREL评估超分辨率图像质量。(A) 参考超分辨率图像与人工制品。(B) 参考质量好的超分辨率图像。(C) 代表纳米J-松鼠误差图 的图像。较亮区域表示大规模伪影,较暗区域表示正确的重建。(D) B 的纳米 J - 松鼠误差 图。 请单击此处查看此图的较大版本。

图6:SIM图像样本。(A) 原神经元的共体显微镜.选择 40 倍目标来获取样品的概览,同时保持良好的分辨率。为相扑1(绿色)、PSD95(红色)和MAB2(紫色)的细胞进行免疫标记。DAPI 是用来染色核的。比例杆 50 μm。图像显示为 Z 投影。(B) SUMO1 和 PSD95 的 SIM 图像,使用 100 倍目标在面板 A 中绿色框中突出显示的区域上。红色箭头表示 A 中显示的插图的位置, 用于 计算强度轮廓。比例杆 5 μm. 请单击此处查看此图的较大版本。
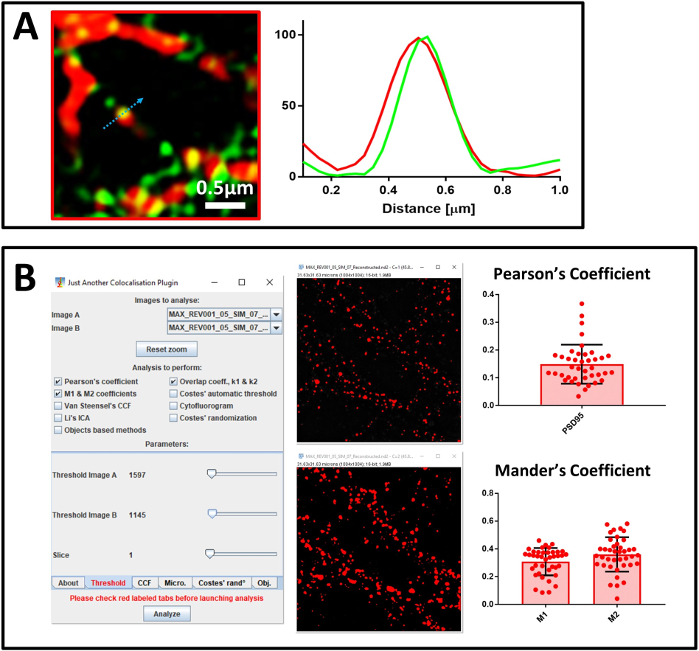
图 7:共同本地化分析。(A) 具有对 SENP1(绿色)和德瑞布林(红色)抗体的原神经元的超解析图像,比例杆 0.5 μm 及其强度轮廓。每个通道的图形值被规范化为 100(任意单位),并对应于蓝色箭头显示的像素强度。(B) 使用JACOP计算皮尔逊的关联系数和SENP1和德雷布林之间的曼德系数的分析。将显示插件设置和可视阈值的窗口。曼德系数由两个值表示 - 与德雷布林 (M1) 共同本地化的 SENP1 分数和与 SENP1 (M2) 共同本地化的 drebrin 分数。 请单击此处查看此图的较大版本。
讨论
阐明突触的结构和组成对于理解调节记忆和认知的生理和病理过程至关重要。虽然在正常状态下,突触是记忆的积木,它们也是复杂的神经系统疾病(如阿尔茨海默氏症32)的根据。此处描述的协议用于研究神经元蛋白与称为 SIM 的超分辨率显微镜技术的共同定位。使用特定的照明模式,SIM 可以达到约 0.1 μm 的分辨率,这适用于研究突触,通常测量在 0.03 和 0.15 μm 之间。对于更详细的,其他超分辨率技术,如STED(刺激发射耗竭显微镜),PALM(光激活的定位显微镜)或风暴(随机光学重建显微镜),可以达到10-20纳米的分辨率,可以应用33。
在这里,我们描述了目标蛋白与初级神经元中突触标记的共同定位分析。该协议可以应用于神经元细胞的任何原生培养物,如海马、小脑或皮质神经元,甚至适用于不属于中枢神经系统的原发神经元培养物,如肠神经系统神经元。然而,在超分辨率级别进行分析的关键是采集过程中使用的试剂,如与目标衍射指数兼容的室盖玻片和安装解决方案。我们使用室盖玻片来方便使用,但涂层盖玻璃上生长原神经元的经典、更便宜的方法仍然有效,尤其是具有高精度 #1.5H (0.17 mm) 盖板。此外,应使用能够尽可能接近玻璃折射率(1.52)的安装介质和折射率为 1.515 的 100 倍目标的浸入油。恒定的室温和稳定表也是强制性的,以确保采集的准确性。
我们在SIM研究中同时使用dyLight和Alexa二级抗体。由于其狭窄的激发和发射峰值以及良好的量子产量,它们被指示为需要最佳信噪比的超分辨率技术。登普西等人比较亚历克萨,迪莱特和其他荧光团的超分辨率成像34。
在采集过程中,我们通常将摄像机设置为 1 MHz 以上 1 MHz.1 MHz,由于采集速度较慢,使图像的精度更高,噪音更低。1 MHz 读出模式还可以以 16 位的深度进行记录(与 10 MHz 的最大 14 位相比),为图像提供更多的颜色信息和更精确的色彩渐变。但是,10 MHz,其速度,是有用的实时图像。为了避免漂白和保持荧光,我们还将激光功率定在尽可能低。为了提高信号强度,可以增加增益值。值得注意的是,较低的增益保证更简洁的图像,而不会增强噪音。一般来说,在从室盖玻片底部的 7 μm 内成像时获得最佳效果。当在油浸中使用 100 倍目标时,这一点尤其重要。如果需要在细胞/组织之间进行更深入的采集,更好的选择可能是使用 60 倍的浸入式目标。
进行SIM研究的主要挑战之一是图像重建35。获得没有伪像和畸变的超解析图像不仅需要使用临时实验条件,还需要仔细校准系统和参数优化以获得最终图像。在协议中,我们描述了如何通过评估系统的校准和原始图像和重建图像的质量分析来避免一些最常见的错误。具体来说,我们描述了使用 ImageJ 插件 SIMCheck 和 NanoJ-SQUIRREL 来确保正确的仪器设置,以防止超解析图像的常见伪影。这些应用允许对最终图像进行公正的质量评估,而最终图像不是基于对研究结构的先前知识对结果进行主观基准评估。
我们建议使用突触和PSD95或德雷布林作为突触前和后突触标记,虽然其他标记也有效。大量的文献将低音等蛋白质描述为突触标记36,37。36,值得注意的是,在细胞内,除了细胞核外,全细胞中存在前和后突触标记。它们大部分信号是非突触的,但代表传输或降解中的蛋白质、背景或其他伪影。因此,必须仔细选择分析区域。我们使用 MAP2 抗体信号来选择轴突和树突终端。
在共同本地化分析中,我们使用两种方法。第一种是可视化方法,基于配置文件分析,该分析显示联合本地化的单个事件,并确定每个渠道的贡献。然而,这种方法的一个警告是统计能力差。因此,我们还决定使用第二种方法,基于对代表每个图像整个字段的大量事件的分析。该方法基于皮尔逊相关系数和曼德M1和M2系数的计算。我们使用Pearson的关联系数来描述图像中信号的重叠,曼德的M1和M2来描述感兴趣的信号38之间的相互共定位。对于计算,我们使用 ImageJ 插件 JACoP,因为它有一个功能,允许您设置手动阈值,以放弃任何背景贡献的分析,特别是对曼德的分析至关重要。
披露声明
作者没有什么可透露的。
致谢
作者感谢爱德华多·米科蒂对手稿的建设性批评。这项研究得到了B brightFocus A2019296F、Fondo di Beneficenza - Gruppo Intesa Sanpaolo (LC)、Fdazione 区域每拉赖斯卡生物医学组织 (Care4NeuroRare CP_20/2018) (CN) 和玛丽·斯科多夫斯卡-居里创新培训网络 (JK) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue solution | Thermo Fisher Scientific | 15250061 | Chemical |
| 70 µm filter | Corning | 352350 | Equiment |
| Alexa | Thermo Fisher Scientific | - | Antibody |
| Antibody SENP1 | Santa Cruz | sc-271360 | Antibody |
| B27 Supplement | Life Technologies | 17504044 | Chemical |
| Bovine serum albumin | Merck | 5470 | Chemical |
| CaCl2 | Merck Life Science | 21115 | Chemical |
| Chambered coverslips | Ibidi | 80826 | Equiment |
| DyLight | Thermo Fisher Scientific | - | Antibody |
| FBS (Hyclone) | GIBCO | SH3007002 (CHA1111L) | Serum |
| FluoSpheres carboxylate-modified microspheres, 0.1 μm, yellow–green fluorescent | Thermo Fisher Scientific | F8803 | Equiment |
| Glucose | Merck Life Science | G8769 | Chemical |
| Glutamax | GIBCO | 35050061 | Chemical |
| HEPES | Merck Life Science | H3537 | Chemical |
| L-Cystein | Merck Life Science | C6852-25g | Chemical |
| MAP2 | Merck | AB15452 | Antibody |
| MEM | Life Technologies | 21575022 | Medium |
| MgCl | Merck Life Science | M8266 | Chemical |
| NaOH | VWR International | 1,091,371,000 | Chemical |
| Neurobasal A | Life Technologies | 10888022 | Medium |
| N-SIM Super Resolution Microscope | Nikon | - | Instrument |
| Papain | Merck Life Science | P-3125 | Chemical |
| paraformaldehyde | Thermo Fisher Scientific | 28908 | Chemical |
| Pen/Strep 10x | Life Technologies | 15140122 | Chemical |
| phosphate-buffered saline | Gibco | 10010023 | Chemical |
| Poly-L lysine | Sigma | P2636 | Chemical |
| ProLong Diamond Glass Antifade Mountant | Thermo Fisher Scientific | P36970 | Chemical |
| PSD95 | NeuroMab | K28/43 | Antibody |
| Round coverglass | Thermo | 12052712 | Equiment |
| SUMO1 | Abcam | ab32058 | Antibody |
| Synaptophysin | Merck | S5768 | Antibody |
| Triton X-100 | Merck | T8787 | Chemical |
| Trypsin inhibitor | Merck Life Science | T9003-500MG | Chemical |
参考文献
- Foster, M., Sherrington, C. S. . A textbook of physiology, part three: The central nervous system (7th ed.). , (1897).
- Choquet, D., Triller, A. The Dynamic Synapse. Neuron. 80 (3), 691-703 (2013).
- McAllister, A. K. Dynamic Aspects of CNS Synapse Formation. Annual Review of Neuroscience. 30 (1), 425-450 (2007).
- Yuzaki, M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annual Review of Physiology. 80 (1), 243-262 (2018).
- Baddeley, D., Bewersdorf, J. Biological Insight from Super-Resolution Microscopy: What We Can Learn from Localization-Based Images. Annual Review of Biochemistry. 87 (1), 965-989 (2018).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Vangindertael, J., et al. An introduction to optical super-resolution microscopy for the adventurous biologist. Methods and Applications in Fluorescence. 6 (2), 022003 (2018).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Scalisi, S., Barberis, A., Petrini, E. M., Zanacchi, F. C., Diaspro, A. Unveiling the Inhibitory Synapse Organization Using Superresolution Microscopy. Biophysical Journal. 116 (3), 133 (2019).
- Yang, X., Specht, C. G. Subsynaptic Domains in Super-Resolution Microscopy: The Treachery of Images. Frontiers in Molecular Neuroscience. 12, (2019).
- Monro, T. Beyond the diffraction limit. Nature Photonics. 3 (7), 361 (2009).
- Won, R. Eyes on super-resolution. Nature Photonics. 3 (7), 368-369 (2009).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific Reports. 6 (1), 27290 (2016).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Gustafsson, M. G. L., et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Brose, N., O'Connor, V., Skehel, P. Synaptopathy: dysfunction of synaptic function. Biochemical Society Transactions. 38 (2), 443-444 (2010).
- Tyebji, S., Hannan, A. J. Synaptopathic mechanisms of neurodegeneration and dementia: Insights from Huntington's disease. Progress in Neurobiology. 153, 18-45 (2017).
- Won, H., Mah, W., Kim, E. Autism spectrum disorder causes, mechanisms, and treatments: focus on neuronal synapses. Frontiers in Molecular Neuroscience. 6, (2013).
- Pfeiffer, B. E., Huber, K. M. The State of Synapses in Fragile X Syndrome. The Neuroscientist. 15 (5), 549-567 (2009).
- Pavlowsky, A., Chelly, J., Billuart, P. Emerging major synaptic signaling pathways involved in intellectual disability. Molecular Psychiatry. 17 (7), 682-693 (2012).
- Senatore, A., Restelli, E., Chiesa, R. Synaptic dysfunction in prion diseases: a trafficking problem. International Journal of Cell Biology. 2013, 543803 (2013).
- Colnaghi, L., et al. Super Resolution Microscopy of SUMO Proteins in Neurons. Frontiers in Cellular Neuroscience. 13, (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Müller, M., Mönkemöller, V., Hennig, S., Hübner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7 (1), 10980 (2016).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Schaefer, L. H., Schuster, D., Schaffer, J. Structured illumination microscopy: artefact analysis and reduction utilizing a parameter optimization approach. Journal of Microscopy. 216 (2), 165-174 (2004).
- Culley, S., et al. NanoJ-SQUIRREL: quantitative mapping and minimisation of super-resolution optical imaging artefacts. Nature Methods. 15 (4), 263-266 (2018).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of co-localization of objects in dual-colour confocal images. Journal of Microscopy. 169 (3), 375-382 (1993).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
- Bolte, S., Cordelières, F. P. A guided tour into subcellular colocalization analysis in light microscopy. Journal of Microscopy. 224, 213-232 (2006).
- Bae, J. R., Kim, S. H. Synapses in neurodegenerative diseases. BMB Reports. 50 (5), 237-246 (2017).
- Godin, A. G., Lounis, B., Cognet, L. Super-resolution Microscopy Approaches for Live Cell Imaging. Biophysical Journal. 107 (8), 1777-1784 (2014).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nature Methods. 8 (12), 1027-1036 (2011).
- Karras, C., et al. Successful optimization of reconstruction parameters in structured illumination microscopy - A practical guide. Optics Communications. 436, 69-75 (2019).
- Bereczki, E., et al. Synaptic markers of cognitive decline in neurodegenerative diseases: a proteomic approach. Brain: A Journal of Neurology. 141 (2), 582-595 (2018).
- Gilestro, G. F., Tononi, G., Cirelli, C. Widespread Changes in Synaptic Markers as a Function of Sleep and Wakefulness in Drosophila. Science. 324 (5923), 109-112 (2009).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander's overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。