Method Article
הדמיה סופר-רזולוציה ללמוד התאמה ית-מקומית של חלבונים וסמנים סינפטיים בנוירונים ראשוניים
In This Article
Summary
פרוטוקול זה מראה כיצד להשתמש במיקרוסקופ סופר-רזולוציה כדי ללמוד חלבון שיתוף מקומי בתרבויות עצביות עיקריות.
Abstract
סינמפסות הן האלמנטים הפונקציונליים של נוירונים והפגמים או ההפסדים שלהם הם על בסיס מספר הפרעות ניווניות ונוירולוגיות. מחקרי הדמיה נמצאים בשימוש נרחב כדי לחקור את תפקודם ואת הפלסטיות שלהם בתנאים פיזיולוגיים ופתולוגיים. בשל גודלם ומבנהם, מחקרי ים-ים של חלבונים דורשים טכניקות הדמיה ברזולוציה גבוהה. בפרוטוקול זה, אנו מתארים הליך ללמוד נוירונים ראשוניים התאמה יתיקות של חלבוני היעד עם סמנים סינפטיים ברמת סופר רזולוציה באמצעות מיקרוסקופית תאורה מובנית (SIM). SIM היא טכניקת תאורה בדוגמת אור המכפילה את הרזולוציה המרחבית של מיקרוסקופ שדה רחב, ומגיעה לפרטים של כ-100 00 00 00 00 00 00 00:00. הפרוטוקול מציין את הפקדים וההגדרות הנדרשים עבור מחקרי התאמה יתקליזציה איתנים ודה-טה-תס על השיטות הסטטיסטיות לניתוח נתוני ההדמיה כראוי.
Introduction
ההבנה והתצוגה של הסינסה השתנו מאוד מאז התיאור הראשון של פוסטר ושרינגטון ב-18971. מאז, הידע שלנו בתקשורת עצבית והתהליכים המולקולריים שמאחוריה גדל באופן אקספוננציאלי2. זה הפך להיות ברור כי סינפסות ניתן לחשוב כמערכת דו-תאים: תא טרום סינפטי המכיל שלוקות לשחרור של נוירוטרנסמיטורים ותאי פוסט-סינפטי עם קולטנים3. השקפה פשטנית זו, בעשרים השנים האחרונות, התפתחה לרשת מורכבת של החלבונים הנדרשים כדי להעביר את המשדר המחייב לאותת4.
הרווחים בהבנה נובעים בחלקם מטכניקות סופר-רזולוציה שהתגברו על מגבלת הפליטה של מיקרוסקופ אור קונבנציונלי כדי להתאים לממד של סינאפסותטוב יותר 5,6,7,8,,9,,10. בשל מגבלת הפליטה, מיקרוסקופ אופטי אינו יכול להגיע לרזולוציה מעל 200 00 0000 00:00:00,000---------------------------------------------------------,12 כדי לעקוף מגבלה זו, טכניקות סופר רזולוציה נוצרו, באמצעות גישות שונות ולהגיע לרזולוציות שונות של מגבלת תת-עקיפה: SIM, STED (מיקרוסקופית דלדול פליטה מגורה), PALM (מיקרוסקופית התאמה מקומית PhotoActivated) ו- STORM(מיקרוסקופשחזור אופטי סטוכסטי) 13,14. SIM מכפיל את הרזולוציה המרחבית של מערכות מיקרוסקופיות רחבות שדה מבוססות לייזר על-ידי הכנסת חיתוך צורב לנתיב קרן העירור15. הסורג הניתן להזזה מדרג את קרני הלייזר כדי ליצור תבנית תאורה ידועה, בדרך כלל פסים. תבנית אור מובנית בכוונה זו על-תפוצה מרחבית לא ידועה של צבע הפלורסנט (של הדגימה). שולי ההפרעה שנוצרו על ידי שני דפוסים מקודדים לפרטים עדינים שלא ניתן להבחין בהם עם מיקרוסקופיה רגילה בשטח רחב. התמונה הסופית סופר נפתרה מתקבלת על ידי שילוב ופענוח עם שיטות מתמטיות מספר תמונות גלם של אותה מדגם שהושג על ידי התרגומים והסבבים של סורג iffraction. הרזולוציה של תמונות סופר נפתרו מגיע 100 נמימה ל-500 נארם בהוראות axial עבור 2D-SIM15 או 100 נה"מ לדרבי ו 250 נה"מ בהוראות axial עבור 3D-SIM16.
ההבנה החדשה של הסינאפסה חשובה עוד יותר לאור ההפרעות הנוירולוגיות הרבות שבהן תפקוד לקוי של הסינאפטי ממלא תפקיד מרכזי בהתחלהובהתקדמות 17,18. מחלת אלצהיימר, תסמונת דאון, מחלת פרקינסון, מחלות פריון, אפילפסיה, הפרעות בספקטרום האוטיזם ותסמונת X שברירי בין היתר קושרו לחריגות בהרכב סינפטי, מורפולוגיה ותפקוד19,20,21,22.
לאחרונה, באמצעות קבוצה של נוגדנים ספציפיים SUMO, השתמשנו SIM כדי להראות התאמה לשפות אחרות בנוירונים היפוקמפוס ראשוניים של חלבוני SUMO עם סינפטופיזין סמנים לפני ופוסט סינפטי ו PSD95 ברמת סופר רזולוציה23. זה איפשר לנו לאשר ראיות ביוכימיות ומיקרוסקופיות קונפוקליות של התאמה סומו לנוירונים.
כאן, אנו מתארים פרוטוקול כדי ללמוד את ההתקמה של חלבונים בנוירונים ראשוניים היפוקמפוס העכבר. במקביל, פרוטוקול זה עשוי להיות מותאם לסוגים שונים של תרבויות עצביות עיקריות.
Protocol
1. תרבויות עיקריות
- נוירונים ראשוניים היפוקמפוס עכבר תרבות בכיסויים קאמריים (כגון Ibidi μ-Slide 8 באר או Nunc Lab-Tek Chambered Coverglass) התואמים את הדרישה האובייקטיבית עבור #1.5 (0.17 מ"מ) מכסה עובי.
- כיסויים עם 100 μL של פולי-L-לינזין (100 μg/ מ"ל).
- למחרת, לשטוף את כיסויי התא פעמיים עם תמיסת מלח סטרילית פוספט אגירה (PBS).
- כדי להשיג נוירונים ראשיים העכבר, לבודד היפוקמפוס מP1-P4 גורים23.
- מניחים היפוקמפוס מפועקע ב 10 מ"ל של דיסטוריה מדיה (שולחן 1 ) ולתת להםלהפקיד בתחתית הצינור.
- באמצעות פיפטה סטרילית, בזהירות להסיר את מדיה ניתוח, עוזב את ההיפוקמפוס ללא הפרעה בתחתית הצינור.
- מוסיפים 10 מ"ל מדיה 1(טבלה 1)להיפוקמפוס ותדגירה במשך 30 דקות ב-37°C.
- באמצעות פיפטה סטרילית, בזהירות להסיר מדיה 1, עוזב את ההיפוקמפוס ללא הפרעה בתחתית הצינור.
- הוסף 10 מ"ל של מדיה 2 (טבלה 1) ולהשאיר את צינור צנטריפוגה (כתרים) מתחת למכסה המנוע אופקית במשך 45 דקות.
- תן צינור הצנטריפוגה לעמוד אנכית כדי לאפשר את הרקמה להתיישב בתחתית הצינור.
- באמצעות פיפטה סטרילית, בזהירות להסיר מדיה 2, עוזב את ההיפוקמפוס ללא הפרעה בתחתית צינור הצנטריפוגה.
- הוסף 2 מ"ל מדיה 3 (טבלה 1).
- באמצעות p1000 פיפטה עם קצה מסונן, באופן מכני לנתק תאים מן הרקמה.
- להעביר את supernatant, שבו ממוקמים נוירונים מבודדים, לצינור צנטריפוגה 15 מ"ל.
- צנטריפוגה מתלי התא במשך 2 דקות ב 300 x g בטמפרטורת החדר (RT).
- לאחר צנטריפוגה, תאים ממוקמים בתחתית צינור הצנטריפוגה. באמצעות פיפטה סטרילית, השליכו את הסופרנטנט.
- התאים תווך מחדש ב- 1 מ"ל של מדיה 4.
- השתמש במסנן 70 μm כדי לחסל תאים לא חברותיים.
- לספור תאים קיימא בתא Bürker על ידי הוספת 1 μL של 0.4 % פתרון כחול Trypan 19 μL של מתלה התא.
- תאי לוח ב 70,000 תאים / גם בנפח של 200 μL לכל באר.
- אפשר לתאים לצרף במשך 2 שעות באינקובטור לח ב-37°C ו-5% CO2.
- מוציאים את כיסויי הכיסוי הקאמריים מהאינקובטור ומחליף בזהירות את המדיום ב-200 μL של Culture Media.
- השאירו את כיסויי הכיסויים הקאמריים באינקובטור לח ב-37°C וב-5% CO2.
- החליפו שליש מהמדיום במדיית תרבות רעננה כל 5-7 ימים.
- לחכות עד נוירונים ראשוניים היפוקמפוס הם התבגרו באופן מלא (12-14 ימים לאחר ציפוי) כדי לבצע מחקרים התאמה משותףization.
2. מכתמי חיסון
- קח את כיסויי הקאמריים מהאינקובטור.
- הסר את המדיום.
- לשטוף במהירות את בארות עם 200 μL של PBS.
- להוסיף 4% paraformaldehyde (PFA) ב PBS (200 μL / גם) לנוירונים כדי לתקן אותם במהירות.
- דגירה התאים במשך 15 דקות ב RT.
- הסר את פתרון PFA.
- לחלחל את התאים על ידי הוספת PBS עם 0.2% Triton X-100 (200 μL / גם).
- דגירה במשך 1 דקות ב RT.
- הסר את הפתרון ודגירה הדגימות עם 1% אלבומין סרום קוב (BSA) ב PBS (200 μL / גם) עבור 1 שעה ב RT כדי לכסות באופן פסיבי את כל משטחי מחייב חינם של הצלחת עם חלבון לא רלוונטי לניתוח. מאגר חסימה מבוסס BSA ללא Triton X-100 מפחית את רקע הנוגדנים בצורה יעילה יותר מאותו מאגר עם 0.2% Triton X-100.
- הסר את הפתרון.
- הוסף את הנוגדן העיקרי של בחירה מדולל בפתרון PBS המכיל 1% BSA ו 0.2% Triton X-100 (120-200 μL / טוב, בהתאם דילול הנוגדן וזמינות). דגירה הדגימות במשך 2 שעות.
- כשליטה שלילית, אין להוסיף נוגדן ראשי לאחת הבארים. ניתן להשתמש בו זמנית נגדנים מרובים של מינים שונים נגד מטרות שונות. השתמש בנוגדן נגד MAP2 (סמן עצבי) גדל עוף, נוגדן נגד PSD95 או סינפטופיזין גדל בעכבר, ונוגדן נגד חלבון היעד גדל בארנב. הדבר מאפשר ניתוחי SIM בשלושה צבעים.
- לשטוף במהירות את הבארים שלוש פעמים עם PBS (200 μL / גם).
- הוסף נוגדנים משניים (dyLight ו- Alexa נוגדנים משניים ניתן להשתמש שניהם) מדוללים בתמיסת PBS המכיל 1% BSA ו 0.2% Triton X-100 (200 μL / גם). דגירה הדגימות לשעה אחת בRT.
- לשטוף במהירות את הבארים שלוש פעמים עם PBS (200 μL / גם).
- להוסיף צבע Hoechst בריכוז של 1 μg / מ"ל מדולל PBS (200 μL / גם) כדי להכתים גרעין. דגירה הדגימות במשך 10 דקות בRT.
- לשטוף במהירות את בארות פעמיים עם PBS.
- טען תאים באמצעות mountant תואם SIM. השתמש 10 μL / באר של ProLong זכוכית נגד זכוכית Mountant.
- מכסים ומגנים על התאים באמצעות שעון כיסוי (לדוגמה, שעון כיסוי עגול בקוטר של 8 מ"מ). ניתן להשתמש גם בריבועים.
- אחסן את הכיסויים הקאמריים ב-RT והמתן לפחות 48 שעות לפני רכישת התמונות. יהלום זכוכית דורש לפחות יומיים של ריפוי לפני רכישות סופר רזולוציה.
3. בקרת ספציפיות של נוגדנים
הערה: השתמש בשתי אסטרטגיות כדי להבטיח ספציפיות לנוגדנים. האסטרטגיה הראשונה היא להשתמש לפחות בשני נוגדנים שונים המתמקדים באותו בית. האסטרטגיה השנייה היא נטרול נוגדנים על ידי דגירה עם יעד החלבון המטוהר או האפיטופ המשמש להעלאת הנוגדן.
- דגירה הנוגדן של בחירה עם חמש פעמים עודף של היעד רקומביננטי או epitope עבור 1 שעה ב RT ב 1% BSA ב PBS.
- לאחר הדגירה, השתמשו בנוגדן המנטרל בריכוז הרגיל להכתמה כמתואר לעיל מ- 2.11.
4. כיול מיקרוסקופ
הערה: אנו משתמשים באופן שגרתי במערכת מיקרוסקופ סופר-רזולוציית N-SIM המיוצרת על ידי Nikon עבור מחקרי סופר-רזולוציה. עם זאת, מספר חברות אחרות מציעות גם מיקרוסקופים ברזולוציה סופר בקטלוגים שלהם. למרות שתוארו אינדיקציות ספציפיות למערכת N-SIM של Nikon, ניתן להכלל את ההוראות הבאות למערכות אחרות. לפני רכישת תמונות SIM, המערכת דורשת כיול נכון עם חרוזי פלורסנט ספציפיים בגודל תת-רזולוציה. דוגמה לכך היא המיקרוספירות של טטרה-סק. חרוזים אלה מוכתמים בצבעי פלורסנט שונים כדי לאפשר כיול של לייזרים שונים עם מדגם אחד.
- באמבט מים sonicate סביב 1.8 x 108 מיקרוספירות פלורסנט במשך 10 דקות. מערכת N-SIM של Nikon דורשת מדגם חרוזים צבעוניים מאוכלס בדלילות עבור הכיול. זה יכול להיות שונה עבור מערכות אחרות הדורשות שכבה אחת צפופה של חרוזי פלורסנט גודל תת-רזולוציה. התאם את מספר חלקיקי הפלורסנט בהתאם.
- לדלל את המיקרוספירות פלורסנט 1:500 במים מזוקקים כפולים.
- סוניקה בפעם השנייה ל-10 דקות נוספות.
- פיפט 15 μL של חרוזים מדוללים לתוך באר של כיסוי קאמרי.
- תן לפתרון להתייבש במשך 5 דקות ב-RT.
- להוסיף 10 μL של פתרון הרכבה ולמקם כיסוי 8 מ"מ על גבי.
- המתן לפחות 48 שעות כדי לאפשר ריפוי נכון.
- הפעל את המיקרוסקופ והלייזרים.
- תן למערכת להתחמם כדי להגיע לשיווי המשקל התרמי של כל רכיבי המיקרוסקופ. N-SIM מערכת מיקרוסקופ סופר רזולוציה דורש לפחות 3 שעות.
- בחר את המטרה 100x.
- התחל את הכיול על-ידי יישור הלייזרים למרכז בלוק החיתוך. במערכת N-SIM, ידית מיקרומטר ומצלמה ייעודית מאפשרים רכז של קרני האור אל המטרה.
- הכנס את כיסויי הכיסוי הקאמריים למיקרוסקופ לצפייה. הגדר את המערכת לעובי כיסוי קאמרי על-ידי התאמת צווארון התיקון האובייקטיבי. תוכנת NIS, התוכנה הקניינית המסופקת עם מערכות מיקרוסקופ סופר-רזולוציה N-SIM, יש פונקציה אוטומטית לווסת קולרי תיקון.
- כוונן את מוקד החסימה עבור כל ערוץ כדי להבטיח תאורת תבנית מובנית ממוקדת בדוגמה. תוכנת NIS מספקת פונקציה אוטומטית עבור משימה זו.
- לאחר מכן, רכשו תמונות תלת-SIM גולמיות של המיקרוספירות הרב-צבעיות. לשחזר את התמונות הגולמיות כדי להשיג תמונה סופר נפתרה באמצעות תוכנת מיקרוסקופ או פלטפורמת תוכנה קוד פתוח לניתוח של תמונות ביולוגיות ImageJ24 ואת fairSIMתוסף 25.
- חשב, עבור כל אורך גל מופרד, את הטרנספורמציה פורייה של התמונה סופר נפתרה שהושגה ב 4.14. אם התמונה שעברה שינוי צורה אינה מצליחה להשיג תבנית דומה לפרח נכונה, הפעל מחדש את הכיול מ- 4.11 מאחר שלא הושגה רזולוציית-על.
- בתמונה הפתורה במיוחד, בחרו מיקרוספרה אחת וחשבו את פרופיל העוצמה שלה עבור כל ערוץ כדי למדוד את הרזולוציה שהושגה. עכשיו זה צריך להיות קרוב ל 100 00 0m לרוחב.
- לאחר מכן, בצע רישום ערוץ על-ידי כיסוי רכישה רב-ערוצית של המיקרוספירות. המטרה היא לתכלת את כל אותות הערוץ לרוחב ובאקסליות. זה יבטל סטייות כרומטיות בשל אי התאמה של הערוצים השונים ולעזור ניתוח התאמה קוטית.
- אשר את איכות הכיול באמצעות הפונקציות "שלב התאורה" ו"מיקוד תבנית תאורה" של SIMcheck26, סוויטה של תוספים עבור יישום קוד פתוח ImageJ. כך, הכינו כיסוי קאמרי כדי להשיג שכבה אחת צפופה של מיקרוספירות טטרה-ספליקס ורכשו תמונה תלת-סתית של הדגימה. נתח את התמונה ב- ImageJ ואם זוהו סטיות, הפעל מחדש את כיול המיקרוסקופים מ- 4.11.
5. רכישה
- התחל לנתח את הדגימה באמצעות מטרה של 40x במצב confocal או widefield. הדבר מאפשר ניווט לדוגמה, שמירה על פרטים טובים ושדה תצוגה גדול.
- השתמש באות נוגדן MAP2 כדי לזהות אזור המייצג תהליכים עצביים.
- לרכוש תמונות של המדגם במצב confocal כדי לקבוע את איכות הכתמים. איכות קונפוקלי ירודה תשקף באיכות ה-SIM ירודה, ולכן תדרוש את ההשלכה של הדגימות.
- אם האזור ואיכות התמונות משביעות רצון, העבר את המטרה ל- 100x.
- החל שמן על המטרה 100x.
- רכשו תמונה רחבה או קונקודלת שתיעשה בה שימוש מאוחר יותר להערכת איכות התמונה הפתורה באופן סופר(איור 1א', ב).
- עבור למצב תלת-SIM.
- באמצעות חלונות דו-שיח להגדרת פרמטרים לרכישה, בחר את הגדרת עומק הסיביות הגבוהה ביותר הזמינה כדי למקסם את מידע הצבע. בדרך כלל, 16 סיביות הן הבחירה הסטנדרטית. יתר על כן, כדי לשפר את יחס האות לרעש, בחר ערך בתדר נמוך לרכישה, כגון 1 MHz.
- באמצעות חלונות היסטוגרמה, הגדר כוח לייזרים כדי לקבל תגובה ליניארית של אות. כדי למנוע אובדן מידע, הגבל פיקסלים רוויים בתמונות. מערכת N-SIM משתמשת במצלמת Andor iXon3. בעת עבודה של 16 סיביות, בחר עוצמת יעד של 16,000 כדי להבטיח את התגובה הליניארית של המצלמה. לחלופין, בחר טווח בין 30,000-45,000 כדי למקסם את הטווח הדינמי של הרכישה.
- הגדר כוח לייזר בין 0.1% ל-50% בעת הדמיית הדגימות וזמן החשיפה בין 50 ms ו 2 s. כוחות לייזר מעל 50% עלולים לגרום לפוטו-בליחות מהירה של הפלואורופורים בשימוש.
- התחל לרכוש את התמונות במצב תלת-SIM.
- השתמש SIMcheck, סוויטה של תוספים חינם עבור ImageJ, כדי להעריך את איכות הרכישה של תמונות גלם.
- אם SIMCheck אינו מזהה חפצים או בעיות איכות, רכש לפחות 10 תמונות מ- 4 שכפולים טכניים כדי לאפשר ניתוח סטטיסטי.
6. פוסט-הפקה: שחזור תמונה
הערה: תמונות שנרכשו ב-3D-SIM הן תמונות גולמיות שיש לעבד כדי להשיג תמונות סופר-פתורות משוחזרות. שחזור שגוי של תמונות גולמיות יכול להוביל לחפצים שישפיעו על ניתוח הדגימות. לכן יש לשלם תשומת לב רבה לבחירת פרמטרים של שחזור כראוי.
- לעבד את התמונות הגולמיות באמצעות תוכנת ניתוח שחזור מיקרוסקופ כדי להשיג תמונה סופר נפתרה (איור 1C). לחלופין, השתמש ב- ImageJ הזמין בחופשיות fairSIM תוסף כדי לשחזר תמונות גלם.
- חשב את ההסתה Fourier של תמונות סופר נפתרו באמצעות תוכנת שחזור מיקרוסקופ או SIMCheck תוסף ImageJ. תמונה משוחזרת טובה צריכה לחזור, עבור כל ערוץ, תמונה כמו פרח. אם התמונות המשוחזרות לא מצליחות ליצור מחדש צורה בצורת פרח, הפעל מחדש מהתמונות הגולמיות ושחזר אותן על-ידי שינוי פרמטרי השחזור כגון סינון וינר, אייפודיזציה ודיכוי אפס סדר27. בתוכנה NIS, באמצעות התצוגה המקדימה כדי לפקח על האופן שבו שינוי הפרמטרים משפיע על התמונה הסופית נפתרה, לשנות את הפרמטרים i) ניגודיות אפנון תאורה, ii) דיכוי רעש ברזולוציה גבוהה ו- iii) מתוך דיכוי פוקוס.
- לאחר מכן, לנתח את התמונה המושחזרת כדי לזהות באופן לא משוחד חפצים באמצעות NanoJ-סנאי28, תוסף מבוסס ImageJ כדי להעריך את האיכות של תמונות סופר נפתרו.
- אם NanoJ-SQUIRREL מזהה חפצים, הפעל מחדש את התמונות הגולמיות ושחזר אותם על-ידי שינוי הפרמטרים לשחזור כגון סינון וינר, אייפודיזציה ודיכוי אפס סדר. בתוכנה NIS, שימוש בתצוגה המקדימה כדי לפקח על האופן שבו שינוי הפרמטרים משפיע על התמונה הסופית שנפתרה, לשנות את הפרמטרים חדות אפנון תאורה, דיכוי רעש ברזולוציה גבוהה ודיכוי מחוץ לפוקוס.
- השתמש בתמונות שנפתרו באופן סופר-פתר כדי לחשב את פרופיל הליקוטליזציה ו/או המקדם של פירסון ומנדר.
7. התאמה אישית עם ניתוח פרופיל
הערה: כצעד ראשון ללימוד התאמה לוקליזציה בין סמנים סינפטיים לבין חלבון של עניין, לקחת תמונה סופר פתורה ולנתח לוקוס יחיד כדי לקבוע חפיפה אות.
- זהה לוקוס יחיד בתמונה הסופר-פתורה.
- השג את פרופילי העוצמה של אותות הפלורסנט של לוקוס של עניין.
- יצא את הנתונים.
- השתמש ב-GraphPad Prism, או תוכנת ניתוח דומה, כדי לנרמל את כל שיאי האות ולקבל עוצמת אותות דומה עבור כל ערוץ במטרה הסופית לקבוע לוקליזציה משותפת ספציפית ל-locus.
8. כימות המקדם של פירסון ומנדר
הערה: אם ניתוח פרופיל הציע לוקליזציה אחת לוקוס, ניתוח כללי יותר של התמונה כולה יכול להתבצע על ידי חישוב המקדם של פירסון ומנדר29,30.
- השתמש JACoP31, יישום Plug-in ImageJ, כדי לקבוע את שני הפרמטרים של התאמה מקומית שיתופית: פירסון ומנדר של.
9. ניתוח סטטיסטי
- השתמש בפריזמה של GraphPad, או בתוכנה דומה לניתוח וגרפים, כדי לעבד נתונים שנאספו באמצעות JACoP.
- השתמש בלפחות 40 תמונות SIM עבור כל תנאי שנותח כדי להשיג גרפים ולמען רלוונטיות סטטיסטית.
תוצאות
אנו מציגים כאן את זרימת העבודה הסטנדרטית כדי ללמוד חלבונים עצביים שיתוף מקומי. כיילנו תחילה את המיקרוסקופ ולאחר מכן ביצענו ניתוח SIM של הדגימות. כדי לכייל את המערכת, השתמשנו במיקרוספירות פלורסנט בקוטר 0.1 μm. לאחר קבלת תמונות תלת-SIM סופר-פתורות של החרוזים, נתוני התמונה הבסיסית הופכים את פורייה כדי להמיר אותם מחדש לייצוג תדר מרחבי. באות 2A, תבנית הפרח הייחודי מוצג כאינדיקציה של רמות פירוט סופר רזולוציה. לאחר מכן מדדנו את הרזולוציה שהושגה על ידי חישוב הרוחב המלא בחצי מרבי (FWHM) של שיא פרופיל עוצמת חרוז יחיד(איור 2B,C). לבסוף, תיקנו סטייה כרומטית על ידי רישום ערוץ, שוב באמצעות מיקרוספירות פלורסנט (איור 3A,B). לאחר מכן, התחלנו לנתח את המדגם עם מטרה של פי 100 ורכשנו תמונות תלת-SIM. השתמשנו SIMCheck כדי להעריך את ההשתנות של תאורת שדה או תנועה במהלך הרכישה (איור 4A). בדקנו את ההבדלים בעוצמה בין זוויות תבנית תאורה(איור 4B) ואנחנוחישבנו את היחס של ניגוד אפנון לרעש כדי למדוד את ניגודיות פס מקומי(איור 4C). לבסוף, הערכנו את הרזולוציה היעילה של השחזור(איור 4D).
לאחר מכן אישרנו את איכות התמונות סופר נפתרו באמצעות NanoJ-סנאי. בתמונה השוחזרת הראשונה(איור 5A),NanoJ-SQUIRREL זיהה את הנוכחות של חפצים (איור 5C). שינינו את הפרמטרים שחזור כדי להשיג תמונה סופר-נפתרה חדשה(איור 5B)ו NanoJ-סנאי אישר את המחסור בחפצים(איור 5D). לאחר כיול המערכת והעריך את איכות התמונות השוחזרות, התחלנו לאחר מכן לנתח את התרבויות העצביות העיקריות המוכתמות בנוגדן נגד MAP2, סמן עצבי, PSD95, סמן פוסט-סינפטי וחלבון היעד SUMO1. ניתחנו לראשונה את המדגם ביצוע מיקרוסקופי קונפוקדי של ארבעה ערוצים עם יעד של 40x (איור 6A). לאחר בחירת אזור המייצג תהליכים עצביים, עברנו ליעד של פי 100. רכשנו הן תמונות קונפוקל והן תמונות SIM מאותו אזור כדי להעריך את איכות השחזור עם NanoJ-SQUIRREL ולבצע ניתוח התאמה מקומית. בדמות 6B,אנו מציגים את תמונת 3D-SIM סופר נפתרה של נוירונים מוכתם SENP1 ו drebrin. ניתן לנתח התאמה למיקום אחר בתמונות סופר-פתורות באמצעותניתוח פרופיל (איור 7A)וכמת של המקדם של פירסוןומנדר (איור 7B).

איור 1: השוואה בין רכישות שדה רחב, קונפוקל ו-SIM. (א)תמונת שדה רחב של נוירונים היפוקמפוס ראשוניים immunostained עבור SENP1 (ירוק), דרברין (אדום) ו MAP2 (ארגמן). DAPI שימש להכתים גרעין. סרגל קנה מידה 5 μm. (ב)תמונה קונפוקל של אותה מדגם של לוח א'. (ג)תמונת SIM של אותה מדגם של לוח A ו- B. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 2: ניתוח של תמונת תלת-SIM של מיקרוספירות לכיול מיקרוסקופ. (א)טרנספורמציה פורייה מהירה של רכישת מיקרוספירות בצורתה הפרחית. (ב)בחירה של מיקרוספירה אחת כדי לקבוע רזולוציה מרחבית רוחבית. (ג)פרופיל עוצמתי של המיקרוספרה היחידה ב-B עם מדידת ה-FWHM שלו. הערכים מייצגים את הרזולוציה שהושגה על-ידי הכלי. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 3: רישום שלושה ערוצים. (א)רכישה של מיקרוספירות טטרה-סאק (אורכי גל 488nm, 555nm ו- 647nm) TetraSpeck לפני ההרשמה. (ב)רכישת אותה מדגם לאחר כיול. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
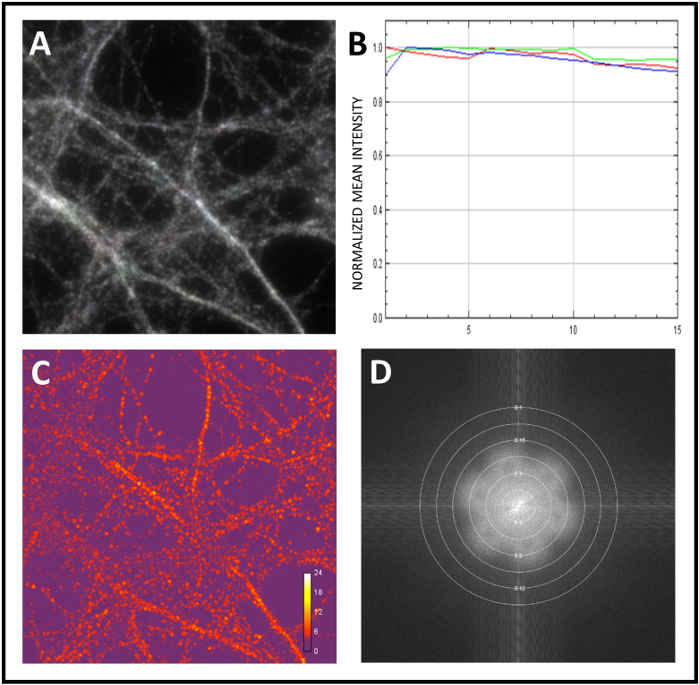
איור 4: הערכת איכות של תמונות גולמיות ושוחזרות באמצעות SIMcheck. (א) ניתוח וריאציית תנועה ותאורה באמצעות SIMCheck. אותות אפורים ללבן מייצגים תאורה הומוגנית והיעדר תנועה במהלך הרכישה. (ב) פרופיל עוצמת ערוץ שהושג על ידי ניתוח התמונה הגולמית. בדוגמה זו יש וריאציה עוצמה היא מינימלית, להציע חוסר או הלבנת או תנודות. (ג) ניגודיות אפנון גולמי כדי לחשב את היחס של אפנון ניגוד לרעש בתוך התמונה. מפת החום מציגה וריאציות ניגודיות אפנון. (ד) שוחזר העלילה Fourier לנתח את ספקטרום משרעת פורייה כדי לקבוע את הרזולוציה היעילה של השחזור. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 5: הערכת איכות התמונה ברזולוציה-על באמצעות NanoJ-SQUIRREL. (א)הפניה לתדמית סופר-רזולוציה עם חפצים. (ב)התייחסות לתדמית סופר-רזולוציה באיכות טובה. (C) תמונה המייצגת מפת שגיאה NanoJ-SQUIRREL של A. אזורים בהירים יותר מייצגים חפצים בקנה מידה גדול, בעוד אזורים כהים יותר מייצגים שחזור נכון. (D)מפת שגיאה NanoJ-SQUIRREL של B. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 6: דוגמת תמונת SIM. (א)מיקרוסקופית קונפוקל של תאי עצב ראשוניים. יעד 40X נבחר כדי לקבל סקירה של המדגם תוך שמירה על רזולוציה טובה. התאים חוסנו עבור SUMO1 (ירוק), PSD95 (אדום) ו MAP2 (ארגמן). DAPI שימש להכתים גרעין. סרגל קנה מידה 50 μm. התמונות הוצגו כהקרנת Z. (ב)תמונות SIM עבור SUMO1 ו- PSD95 באזור המסוים בתיבה הירוקה בלוח A באמצעות מטרה של 100X. ראשי חץ אדומים מציינים את מיקום המיקום של המיקום המוצג ב- A המשמש לחישוב פרופיל העוצמה. סרגל קנה מידה 5 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של דמות זו.
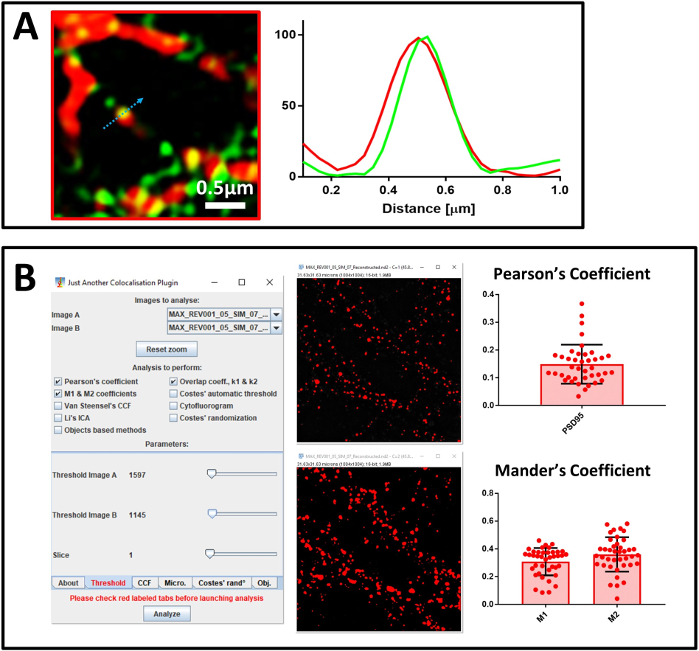
איור 7: ניתוח התאמה מקומית. (א)תמונה סופר נפתרה של נוירונים ראשוניים מוכתם בנוגדן נגד SENP1 (בירוק) ו drebrin (באדום), סרגל קנה מידה 0.5 μm, ואת פרופיל העוצמה שלה. ערכי הגרף מנורמלו עבור כל ערוץ ל- 100 (יחידה שרירותית) ומתאימו לעוצמת הפיקסל המוצגת על-ידי החץ הכחול. (ב)ניתוח באמצעות JACoP לחישוב מקדם המתאם של פירסון והמקדם של מנדר בין SENP1 וderebrin. חלונות של הגדרת יישום ה- Plug-in וסף וסף חזותי מוצגים. המקדם של מנדר בא לידי ביטוי על ידי שני ערכים – שבר SENP1 הניתן למיקום אחר עם דרברין (M1) ושבר הדרברין הניתן למיקום אחר עם SENP1 (M2). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Discussion
ההכלה של המבנה וההרכב של הסינסה חיונית להבנת התהליכים הפיזיולוגיים והפתולוגיים המווסתים את הזיכרון וההכרה. בעוד במצב נורמלי, סינופסות הן אבני הבניין של זיכרון, הם גם בבסיס הפרעות נוירולוגיות מורכבות כגון מחלת אלצהיימר32. הפרוטוקול המתואר כאן משמש לחקר ההתיקות הליקוטית של חלבונים עצביים עם טכניקת מיקרוסקופית סופר-רזולוציה הנקראת SIM. באמצעות דפוס מסוים של תאורה, SIM יכול להגיע לרזולוציה של כ 0.1 μm, אשר מתאים לחקר של סינאפסות, אשר בדרך כלל למדוד בין 0.03 ו 0.15 μm. לפרטים גדולים עוד יותר, טכניקות סופר-רזולוציה אחרות כגון STED (מיקרוסקופית דלדול פליטה מגורה), PALM (מיקרוסקופיקה למיקום מקומי PhotoActivated) או STORM (מיקרוסקופ שחזור אופטי סטוכסטי), שיכול להגיע לרזולוציה של 10-20 נה"מ, ניתןלהחיל 33.
כאן, אנו מתארים את הניתוח של התאמה ית-מקומית של חלבוני מטרה עם סמנים סינפטיים בנוירונים ראשוניים. הפרוטוקול יכול להיות מיושם על כל תרבות עיקרית של תאים עצביים, כגון היפוקמפוס, המוח הקטן או נוירונים קליפתיים ואפילו על תרבויות של נוירונים ראשוניים שלא שייכים למערכת העצבים המרכזית, כגון נוירונים מערכת העצבים הינטרית. המפתח לניתוח ברמת סופר-רזולוציה, עם זאת, הוא ריאגנטים המשמשים במהלך הרכישה, כגון כיסויים קאמריים ופתרונות הרכבה התואמים למדד החלוקה של המטרה. השתמשנו בכיסויים קאמריים להקלת השימוש שלהם, אבל השיטה הקלאסית, זולה יותר של גידול נוירונים ראשוניים על כיסוי מצופה הוא בכל זאת תקף, במיוחד עם דיוק גבוה #1.5H (0.17 מ"מ) כיסוי. בנוסף, יש להשתמש במדיה הרכבה שיכולה להגיע לאינדקס שבירה קרוב ככל האפשר לאינדקס שבירה של זכוכית (1.52) ושמן טבילה למטרה של 100x עם מדד שבירה של 1.515. טמפרטורת חדר קבועה וטבלאות מיוצבות הן גם חובה כדי להבטיח את הדיוק של הרכישות.
אנו משתמשים הן ב-dyLight והן ב-Alexa נוגדנים משניים במחקרי ה-SIM. בשל הפסגות הצרות של הדרה ופליטה ותפוקה קוונטית טובה, הם מצוינים לטכניקות סופר-רזולוציה הדורשות את יחס האות הטוב ביותר לרעש. דמפסי ואח ' השווה אלקסה, dyLight ופלואורופורים אחרים עבור הדמיה סופר רזולוציה34.
במהלך הרכישה, אנו מגדירים את המצלמה באופן שגרתי ב- 1 MHz מעל 10 MHz. 1 MHz, הודות למהירות רכישה איטית יותר, מעניק לתמונות דיוק רב יותר ופחות רעש מ- 10 MHz. מצב קריאה של 1 MHz יכול גם להקליט עם עומק קצת של 16 סיביות (בהשוואה ל-14 הסיביות המרביות של 10 MHz), תוך מתן מידע צבע נוסף ושינוי צבע מדויק יותר לתמונות. עם זאת, 10 MHz, עם המהירות שלו, שימושי עבור תמונות חיות. כדי להימנע מהלבנת ולשמר פלואורופור, אנו גם להגדיר כוח לייזר נמוך ככל האפשר. כדי לשפר את עוצמת האות, ניתן להגדיל את ערכי ההגברה. ראוי לציין כי רווח נמוך מבטיח תמונות נקיות יותר מבלי לשפר את הרעש. באופן כללי, התוצאות הטובות ביותר מתקבלות תוך הדמיה בתוך 7 μm מתחתית הכיסויים הקאמריים. הדבר חשוב במיוחד בעת שימוש ביעד 100x עם טבילה בשמן. אם נדרשת רכישה עמוקה יותר על פני התאים/רקמות, בחירה טובה יותר עשויה להיות שימוש במטרה של 60x עם טבילה במים.
אחד האתגרים העיקריים בביצוע מחקרי SIM הוא שחזור תמונה35. השגת תמונות סופר-פתורות ללא חפצים וסטייה דורשת לא רק שימוש בתנאים ניסיוניים אד הוק, אלא גם כיול זהיר של המערכת ומיטוב פרמטרים כדי להשיג את התמונות הסופיות. בפרוטוקול, אנו מתארים כיצד להימנע מכמה מהטעויות הנפוצות ביותר על ידי הערכת כיול המערכת וניתוח איכות של תמונות גולמיות ומוחזרות. באופן ספציפי, אנו מתארים את השימוש של התוספים ImageJ SIMCheck ו NanoJ-סנאי כדי להבטיח הגדרות מכשיר נכון כדי למנוע חפצים נפוצים של תמונות סופר נפתרו. היישומים מאפשרים הערכת איכות לא משוחדת של התמונות הסופיות שאינן מבוססות על בחינת ביצועים סובייקטיבית של התוצאות כנגד ידע מוקדם של מבני המחקר.
אנו מציעים להשתמש סינפטופיזין ו PSD95 או דרברין כמו סמנים לפני ופוסט סינפטי, למרות סמנים אחרים תקפים גם כן. גוף ספרותי ענק מתאר חלבונים כגון בסון בשם סמניםסינפטיים 36,37. ראוי לציין כי סמנים לפני ו postsynaptic נמצאים עם זאת בכל התא, למעט הגרעין. חלק גדול מהאות שלהם אינו סינפטי, אך מייצג חלבונים בתחבורה או השפלה, רקע או חפצים אחרים. לכן חשוב לבחור בקפידה את תחום הניתוח. אנו משתמשים באות נוגדן MAP2 כדי לבחור מסופי אקסון ודנדריטי.
בניתוח של התאמה מקומית אנו משתמשים בשתי גישות. הראשונה היא גישה חזותית, המבוססת על ניתוח פרופיל המציג אירועים בודדים של התאמה לתיאום אחר ומזהה את התרומה של כל ערוץ. עם זאת, אזהרה בגישה זו היא הכוח הסטטיסטי היוור. מסיבה זו, החלטנו גם להשתמש בשיטה שנייה המבוססת על ניתוח של מספר גדול יותר של נציג אירועים של השדה כולו של כל תמונה. שיטה זו מבוססת על חישוב מקדם המתאם של פירסון ומקדם M1 ו-M2 של מנדר. אנו משתמשים במקדם המתאם של פירסון כדי לתאר את החפיפה של אותות בתמונה ו- M1 ו-M2 של מנדר כדי לתאר התאמה הדדית בין אותותעניין 38. לצורך החישוב, אנו משתמשים בתוסף ImageJ JACoP, שכן יש לו תכונה המאפשרת לך להגדיר סף ידני כדי לבטל כל תרומת רקע לניתוח, קריטי במיוחד לניתוח של מנדר.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לאדוארדו מיצוטי על הביקורת הבונה על כתב היד. מחקר זה נתמך על ידי BrightFocus A2019296F, על ידי פונדו די Beneficenza - Gruppo Intesa Sanpaolo (LC), על ידי Fondazione Regionale per la Ricerca Biomedica (Care4NeuroRare CP_20/2018) (CN) ועל ידי מארי Skłodowska-Curie חדשני הדרכה רשת (JK).
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue solution | Thermo Fisher Scientific | 15250061 | Chemical |
| 70 µm filter | Corning | 352350 | Equiment |
| Alexa | Thermo Fisher Scientific | - | Antibody |
| Antibody SENP1 | Santa Cruz | sc-271360 | Antibody |
| B27 Supplement | Life Technologies | 17504044 | Chemical |
| Bovine serum albumin | Merck | 5470 | Chemical |
| CaCl2 | Merck Life Science | 21115 | Chemical |
| Chambered coverslips | Ibidi | 80826 | Equiment |
| DyLight | Thermo Fisher Scientific | - | Antibody |
| FBS (Hyclone) | GIBCO | SH3007002 (CHA1111L) | Serum |
| FluoSpheres carboxylate-modified microspheres, 0.1 μm, yellow–green fluorescent | Thermo Fisher Scientific | F8803 | Equiment |
| Glucose | Merck Life Science | G8769 | Chemical |
| Glutamax | GIBCO | 35050061 | Chemical |
| HEPES | Merck Life Science | H3537 | Chemical |
| L-Cystein | Merck Life Science | C6852-25g | Chemical |
| MAP2 | Merck | AB15452 | Antibody |
| MEM | Life Technologies | 21575022 | Medium |
| MgCl | Merck Life Science | M8266 | Chemical |
| NaOH | VWR International | 1,091,371,000 | Chemical |
| Neurobasal A | Life Technologies | 10888022 | Medium |
| N-SIM Super Resolution Microscope | Nikon | - | Instrument |
| Papain | Merck Life Science | P-3125 | Chemical |
| paraformaldehyde | Thermo Fisher Scientific | 28908 | Chemical |
| Pen/Strep 10x | Life Technologies | 15140122 | Chemical |
| phosphate-buffered saline | Gibco | 10010023 | Chemical |
| Poly-L lysine | Sigma | P2636 | Chemical |
| ProLong Diamond Glass Antifade Mountant | Thermo Fisher Scientific | P36970 | Chemical |
| PSD95 | NeuroMab | K28/43 | Antibody |
| Round coverglass | Thermo | 12052712 | Equiment |
| SUMO1 | Abcam | ab32058 | Antibody |
| Synaptophysin | Merck | S5768 | Antibody |
| Triton X-100 | Merck | T8787 | Chemical |
| Trypsin inhibitor | Merck Life Science | T9003-500MG | Chemical |
References
- Foster, M., Sherrington, C. S. . A textbook of physiology, part three: The central nervous system (7th ed.). , (1897).
- Choquet, D., Triller, A. The Dynamic Synapse. Neuron. 80 (3), 691-703 (2013).
- McAllister, A. K. Dynamic Aspects of CNS Synapse Formation. Annual Review of Neuroscience. 30 (1), 425-450 (2007).
- Yuzaki, M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annual Review of Physiology. 80 (1), 243-262 (2018).
- Baddeley, D., Bewersdorf, J. Biological Insight from Super-Resolution Microscopy: What We Can Learn from Localization-Based Images. Annual Review of Biochemistry. 87 (1), 965-989 (2018).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Vangindertael, J., et al. An introduction to optical super-resolution microscopy for the adventurous biologist. Methods and Applications in Fluorescence. 6 (2), 022003 (2018).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Scalisi, S., Barberis, A., Petrini, E. M., Zanacchi, F. C., Diaspro, A. Unveiling the Inhibitory Synapse Organization Using Superresolution Microscopy. Biophysical Journal. 116 (3), 133 (2019).
- Yang, X., Specht, C. G. Subsynaptic Domains in Super-Resolution Microscopy: The Treachery of Images. Frontiers in Molecular Neuroscience. 12, (2019).
- Monro, T. Beyond the diffraction limit. Nature Photonics. 3 (7), 361 (2009).
- Won, R. Eyes on super-resolution. Nature Photonics. 3 (7), 368-369 (2009).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific Reports. 6 (1), 27290 (2016).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Gustafsson, M. G. L., et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Brose, N., O'Connor, V., Skehel, P. Synaptopathy: dysfunction of synaptic function. Biochemical Society Transactions. 38 (2), 443-444 (2010).
- Tyebji, S., Hannan, A. J. Synaptopathic mechanisms of neurodegeneration and dementia: Insights from Huntington's disease. Progress in Neurobiology. 153, 18-45 (2017).
- Won, H., Mah, W., Kim, E. Autism spectrum disorder causes, mechanisms, and treatments: focus on neuronal synapses. Frontiers in Molecular Neuroscience. 6, (2013).
- Pfeiffer, B. E., Huber, K. M. The State of Synapses in Fragile X Syndrome. The Neuroscientist. 15 (5), 549-567 (2009).
- Pavlowsky, A., Chelly, J., Billuart, P. Emerging major synaptic signaling pathways involved in intellectual disability. Molecular Psychiatry. 17 (7), 682-693 (2012).
- Senatore, A., Restelli, E., Chiesa, R. Synaptic dysfunction in prion diseases: a trafficking problem. International Journal of Cell Biology. 2013, 543803 (2013).
- Colnaghi, L., et al. Super Resolution Microscopy of SUMO Proteins in Neurons. Frontiers in Cellular Neuroscience. 13, (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Müller, M., Mönkemöller, V., Hennig, S., Hübner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7 (1), 10980 (2016).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Schaefer, L. H., Schuster, D., Schaffer, J. Structured illumination microscopy: artefact analysis and reduction utilizing a parameter optimization approach. Journal of Microscopy. 216 (2), 165-174 (2004).
- Culley, S., et al. NanoJ-SQUIRREL: quantitative mapping and minimisation of super-resolution optical imaging artefacts. Nature Methods. 15 (4), 263-266 (2018).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of co-localization of objects in dual-colour confocal images. Journal of Microscopy. 169 (3), 375-382 (1993).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
- Bolte, S., Cordelières, F. P. A guided tour into subcellular colocalization analysis in light microscopy. Journal of Microscopy. 224, 213-232 (2006).
- Bae, J. R., Kim, S. H. Synapses in neurodegenerative diseases. BMB Reports. 50 (5), 237-246 (2017).
- Godin, A. G., Lounis, B., Cognet, L. Super-resolution Microscopy Approaches for Live Cell Imaging. Biophysical Journal. 107 (8), 1777-1784 (2014).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nature Methods. 8 (12), 1027-1036 (2011).
- Karras, C., et al. Successful optimization of reconstruction parameters in structured illumination microscopy - A practical guide. Optics Communications. 436, 69-75 (2019).
- Bereczki, E., et al. Synaptic markers of cognitive decline in neurodegenerative diseases: a proteomic approach. Brain: A Journal of Neurology. 141 (2), 582-595 (2018).
- Gilestro, G. F., Tononi, G., Cirelli, C. Widespread Changes in Synaptic Markers as a Function of Sleep and Wakefulness in Drosophila. Science. 324 (5923), 109-112 (2009).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander's overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved