Method Article
1차 뉴런에서 단백질과 시냅스 마커의 공동 국소화를 연구하는 초해상도 이미징
요약
이 프로토콜은 1 차적인 신경 배양에서 단백질 공동 국소화를 공부하기 위하여 초해상도 현미경 검사를 채택하는 방법을 보여줍니다.
초록
시냅스는 뉴런의 기능적 요소이며 결함이나 손실은 여러 신경 퇴행성 및 신경 장애의 기초입니다. 이미징 연구는 생리학적 및 병리학 적 조건에서 자신의 기능과 가소성을 조사하는 데 널리 사용됩니다. 단백질의 크기와 구조 때문에 고해상도 이미징 기술이 필요합니다. 이 프로토콜에서, 우리는 구조화 된 조명 현미경 검사 (SIM)를 사용하여 초해상도 수준에서 시냅스 마커와 대상 단백질의 공동 국소화를 1 차 뉴런에서 연구하는 절차를 설명합니다. SIM은 광야 현미경 검사법의 공간 해상도를 두 배로 늘려 약 100nm의 세부 사항에 도달하는 패턴 조명 기술입니다. 이 프로토콜은 강력한 공동 지역화 연구에 필요한 제어 및 설정과 이미징 데이터를 제대로 분석하는 통계 방법에 대한 개요를 나타냅니다.
서문
시냅스의 이해와 견해는 1897년 포스터와 셔링턴의 첫 번째 설명 이후1엄청나게 변했다. 그 이후로, 신경 통신및 그 뒤에 분자 프로세스에 대한 우리의 지식은 기하 급수적으로 성장했다2. 시냅스는 신경 전달 물질의 방출을위한 소포를 포함하는 사전 시냅스 구획과수용체3를가진 시냅스 후 구획으로 생각할 수 있다는 것이 분명해졌습니다. 이 단순한 보기는, 지난 20 년 에서, 신호4로송신기 결합을 변환하는 데 필요한 단백질의 복잡한 네트워크로 진화했다.
이해의 이득은 부분적으로 시냅스의 치수에 맞게 종래의 광 현미경 검사법의 회절 한계를 극복슈퍼 해상도 기술로 인해5,,6,,7,,8,,9,,10. 회절 제한으로 인해 광학 현미경은 200 nm 측면11,,12이상의 해상도에 도달할 수 없습니다. 이 한계를 우회하기 위해, 초해상도 기술은 다른 접근 방식을 사용하여 다른 부회절 제한 해상도에 도달했다 : SIM, STED (자극 방출 고갈 현미경 검사), PALM (사진 활성화 국소화 현미경 검사법) 및 STORM (스토세스 광학 재건 현미경)13,,14. SIM은 흥분 빔경로(15)에회절 격자를 삽입하여 레이저 기반 광시야 현미경 시스템의 공간 해상도를 두 배로 합니다. 이동식 격자 는 레이저 빔을 분산시켜 알려진 조명 패턴, 일반적으로 줄무늬를 만듭니다. 이러한 의도적으로 구조화된 광 패턴은 형광염(시료)의 알 수 없는 공간 분포에 중첩된다. 두 패턴에 의해 형성된 간섭 프린지는 일반 광시야 현미경 검사법과 구별할 수 없는 미세한 세부 사항에 대해 인코딩합니다. 최종 슈퍼 해결 된 이미지는 회절 격자의 번역 및 회전에 의해 얻은 동일한 샘플의 여러 원시 이미지를 수학 방법과 결합하고 디코딩하여 얻을 수 있습니다. 수퍼-리졸브 된 이미지의 해상도는 측면 방향에서 100 nm, 측면 방향에서 2D-SIM15 또는 100 nm및 3D-SIM16에대한 축 방향에서 250 nm에 도달한다.
시냅스의 새로운 이해는 시냅스 기능 장애가 발병 및 진행17,,18에서중요한 역할을 하는 많은 신경 장애에 비추어 더욱 중요합니다. 알츠하이머병, 다운증후군, 파킨슨병, 프리온질환, 간질, 자폐스펙트럼장애 및 연약한 X증후군등은 시냅스 조성, 형태학 및기능(19,,20,,21,,22)의이상과 관련이 있다.
최근에는 SUMO 특이적 항체 세트를 사용하여 SIM을 사용하여 수모 단백질의 1차 해마 뉴런에서 시냅틱 마커 시냅토피신 및 PSD95를 초해상도 레벨23에서공동 국소화를 보여주었다. 이것은 우리가 뉴런에 있는 SUMO 현지화의 생화학그리고 공초점 현미경 검사약 증거를 확인하는 것을 가능하게 했습니다.
여기에서, 우리는 마우스 해마 1 차적인 뉴런에 있는 단백질의 현지화를 연구하기 위하여 프로토콜을 기술합니다. 동시에, 이 프로토콜은 1 차적인 신경 문화의 다른 모형에 적응될 수 있습니다.
프로토콜
1. 1차 문화
- #1.5 (0.17 mm) 커버 슬립 두께에 대한 객관적인 요구 사항과 일치하는 챔버 커버립 (예 : Ibidi μ-Slide 8 Well 또는 Nunc Lab-Tek Chambered Coverglass)의 배양 마우스 해마 1 차 뉴런.
- 폴리 L-리신 (100 μg/mL)의 100 μL코팅 챔버 커버립.
- 다음 날, 멸균 인산염 완충식식염(PBS)으로 챔버 커버립을 두 번 씻는다.
- 마우스 기본 뉴런을 얻으려면 P1-P4 새끼23에서해마를 분리하십시오.
- 해부 된 해마를 해부 10 mL(표 1)에놓고 튜브 의 바닥에 입금하십시오.
- 멸균 파이펫을 사용하여 해부 매체를 조심스럽게 제거하고 해마가 튜브 바닥에 방해받지 않도록 합니다.
- 10mL의 미디어1(표 1)을해마에 넣고 37°C에서 30분간 배양합니다.
- 멸균 파이펫을 사용하여 미디어 1을 조심스럽게 제거하고 해마가 튜브 바닥에 방해받지 않도록 하십시오.
- 미디어2(표 1)의10mL를 넣고 후드 아래에 원심분리기 튜브를 수평으로 45분간 둡니다.
- 원심분리기 튜브가 수직으로 서서 조직이 튜브 의 바닥에 정착할 수 있도록 하십시오.
- 멸균 파이펫을 사용하여 Media 2를 조심스럽게 제거하고 해마를 원심분리기 튜브 바닥에 방해받지 않도록 하십시오.
- 미디어 3(표 1)의2 mL을 추가합니다.
- 여과 된 팁이있는 p1000 파이펫을 사용하여 조직에서 기계적으로 세포를 분리합니다.
- 격리된 뉴런에 위치한 상체를 15mL 원심분리기 튜브로 옮기다.
- 실온(RT)에서 300 x g에서 2분 동안 세포 현탁액을 원심분리합니다.
- 원심분리 후 세포는 원심분리기 튜브의 바닥에 위치합니다. 멸균 파이펫을 사용하여 상체를 폐기하십시오.
- 미디어 4의 1 mL에서 세포를 다시 중단합니다.
- 70 μm 필터를 사용하여 비소화 된 세포를 제거하십시오.
- 0.4% Trypan blue 용액의 1μL을 세포 현탁액의 19 μL에 추가하여 Bürker 챔버에서 실행 가능한 세포를 계산합니다.
- 70,000 개의 세포 /우물 당 200 μL의 부피에서 플레이트 셀.
- 세포가 37°C 및 5% CO2에서가습 된 인큐베이터에서 2 h를 부착할 수 있도록 한다.
- 인큐베이터에서 챔버 커버립을 꺼내 배지를 문화 미디어의 200 μL로 조심스럽게 교체하십시오.
- 챔버 커버립을 가습된 인큐베이터에 37°C 및 5% CO2로둡니다.
- 배지의 3분의 1을 5-7일마다 신선한 문화 매체로 교체하십시오.
- 해마 1 차 신경이 완전히 성숙 될 때까지 기다립니다 (도금 후 12-14 일) 공동 국소화 연구를 수행.
2. 면역 형광 염색
- 인큐베이터에서 챔버 커버립을 가져 가라.
- 매체를 제거합니다.
- PBS의 200 μL로 우물을 신속하게 세척하십시오.
- PBS(200 μL/웰)에 4%의 파라포름알데히드(PFA)를 추가하여 신속하게 수정합니다.
- RT에서 15분 동안 세포를 배양합니다.
- PFA 솔루션을 제거합니다.
- 0.2% 트리톤 X-100(200 μL/웰)로 PBS를 추가하여 세포를 페메아빌화한다.
- RT에서 1분 동안 인큐베이션을 합니다.
- PBS(200 μL/well)에서 1%의 소 세럼 알부민(BSA)으로 샘플을 배양하여 RT에서 1시간 동안 플레이트의 모든 자유 결합 표면을 분석용 과무관 단백질로 수동적으로 커버한다. Triton X-100이 없는 BSA 기반 차단 버퍼는 0.2% Triton X-100을 가진 동일한 버퍼보다 항체 배경을 보다 효율적으로 감소시킵니다.
- 솔루션을 제거합니다.
- 1% BSA 및 0.2% Triton X-100(항체 희석 및 가용성에 따라 120-200 μL/well)을 포함하는 PBS 용액에서 희석된 1차 항체를 추가합니다. 샘플을 2시간 동안 배양합니다.
- 부정적인 대조군으로서, 우물 중 하나에 어떤 1 차적인 항체를 추가하지 마십시오. 상이한 표적에 대하여 상이한 종의 다중 항체는 동시에 사용될 수 있다. 닭에서 자란 MAP2(뉴런 마커)에 대한 항체, 마우스에서 자란 PSD95 또는 시냅토피신에 대한 항체, 토끼에서 자란 표적 단백질에 대한 항체를 사용한다. 이렇게 하면 3색 SIM 분석을 수행할 수 있습니다.
- PBS(200 μL/웰)로 우물을 세 번 빠르게 씻으실 수 있습니다.
- 1% BSA 및 0.2% Triton X-100 (200 μL/웰)을 포함하는 PBS 용액에서 희석된 이차 항체(dyLight 및 Alexa 이차 항체모두 사용할 수 있음)를 추가합니다. RT에서 1h의 샘플을 배양합니다.
- PBS(200 μL/웰)로 우물을 세 번 빠르게 씻으실 수 있습니다.
- PBS(200 μL/웰)에서 희석된 1μg/mL 농도에서 Hoechst 염료를 첨가하여 핵을 더합니다. RT에서 샘플을 10분 동안 배양합니다.
- PBS로 우물을 두 번 빠르게 씻으시면 됩니다.
- SIM 호환 마운트제를 사용하여 셀을 마운트합니다. 프로롱 글래스 안티페이드 마운트제10 μL/웰을 사용하십시오.
- 커버 와 커버 유리로 세포를 보호 (예를 들어, 직경 8mm의 둥근 커버 유리). 정사각형 을 사용할 수도 있습니다.
- 챔버 커버립을 RT에 저장하고 이미지를 획득하기 전에 적어도 48 h를 기다립니다. 다이아몬드 글래스는 슈퍼 해상도 획득 전에 최소 2일 의 경화가 필요합니다.
3. 항체 특이성 제어
참고: 항체 특이성을 보장하기 위해 두 가지 전략을 사용합니다. 첫 번째 전략은 동일한 기판을 대상으로 적어도 두 개의 상이한 항체를 사용하는 것입니다. 두 번째 전략은 항체를 올리는 데 사용되는 정제된 단백질 표적 또는 에피토프를 이용한 배큐비에 의한 항체 중화이다.
- PBS에서 1% BSA에서 RT에서 1h에 대한 재조합 표적 또는 에피토프를 5배 초과하여 선택된 항체를 배양한다.
- 인큐베이션 후, 상술한 바와 같이 염색에 대한 통상농도에서 중화항체를 사용한다.
4. 현미경 교정
참고: 우리는 정기적으로 슈퍼 해상도 연구를 위해 Nikon에서 제조한 N-SIM 슈퍼 해상도 현미경 시스템을 사용합니다. 그러나, 몇몇 다른 회사는 또한 그들의 카탈로그에 초해상도 현미경을 제공합니다. Nikon의 N-SIM 시스템에 대한 구체적인 징후가 설명되어 있지만 다음 지침은 다른 시스템으로 일반화될 수 있습니다. SIM 이미지를 획득하기 전에 시스템은 특정 하위 해상도 크기의 형광 구슬을 적절히 보정해야 합니다. 예를 들어 테트라스펙 마이크로스피어입니다. 이 구슬은 하나의 샘플로 다른 레이저의 보정을 허용하기 위해 다른 형광 염료로 얼룩져 있습니다.
- 수조에서 약 1.8 x 108 형광 마이크로 스피어를 10 분 동안 초음파 처리합니다. Nikon의 N-SIM 시스템은 교정을 위해 인구밀도가 낮은 다색 구슬 샘플이 필요합니다. 이는 하위 해상도 크기의 형광 구슬의 조밀한 단일 레이어가 필요한 다른 시스템에 다를 수 있습니다. 그에 따라 형광 입자의 수를 조정합니다.
- 이중 증류수에서 형광 마이크로스피어 1:500을 희석합니다.
- 추가 10 분 동안 두 번째 를 음속.
- 희석된 구슬의 파이프 15 μL을 챔버 커버슬립의 우물로 넣습니다.
- RT에서 5분 동안 용액을 건조시키십시오.
- 장착 용액의 10μL을 추가하고 8mm 커버슬립을 위에 놓습니다.
- 적절한 경화를 허용하려면 적어도 48 시간을 기다립니다.
- 현미경과 레이저를 켭니다.
- 모든 현미경 구성 요소의 열 평형에 도달하기 위해 시스템을 따뜻하게하십시오. N-SIM 슈퍼 해상도 현미경 시스템은 적어도 3 시간이 필요합니다.
- 100x 목표를 선택합니다.
- 레이저를 회절 격자 블록의 중심에 정렬하여 교정을 시작합니다. N-SIM 시스템에서는 마이크로미터 노브와 전용 카메라를 사용하여 광선을 대상에 중앙을 구성할 수 있습니다.
- 챔버 커버슬립을 현미경으로 삽입하여 볼 수 있습니다. 객관적인 보정 칼라를 조정하여 챔버 커버슬립 두께로 시스템을 설정합니다. Nis 소프트웨어는 N-SIM 슈퍼 해상도 현미경 시스템과 함께 제공되는 독점 소프트웨어로 보정 칼라를 조절하는 자동 기능을 갖추고 있습니다.
- 각 채널에 대한 격자 블록 포커스를 조정하여 샘플에 초점을 맞춘 구조화 패턴 조명을 보장합니다. NIS 소프트웨어는 이 작업에 대한 자동 기능을 제공합니다.
- 다음으로, 다색 마이크로스피어의 원시 3D-SIM 이미지를 획득한다. 생물학적 이미지 ImageJ 24 및 플러그인fairSIM(25)의분석을 위한 현미경 소프트웨어 또는 오픈24 소스 소프트웨어 플랫폼을 사용하여 원시 이미지를 재구성하여 초고리 이미지를 얻을 수 있다.
- 각 분리된 파장에 대해 4.14에서 얻은 슈퍼 해결 된 이미지의 Fourier 변환을 계산합니다. 변형된 이미지가 올바른 꽃 모양 패턴을 얻지 못하면 슈퍼 해상도가 달성되지 않았기 때문에 4.11에서 교정을 다시 시작합니다.
- 수퍼 해결 된 이미지에서 단일 마이크로 스피어를 선택하고 각 채널에 대한 강도 프로파일을 계산하여 달성 된 해상도를 측정합니다. 이제 100nm에 가깝습니다.
- 다음으로, 마이크로스피어의 멀티채널 인수를 오버레이하여 채널 등록을 수행합니다. 목표는 모든 채널 신호를 측면및 축으로 정렬하는 것입니다. 이렇게 하면 서로 다른 채널의 정렬 불량으로 인해 색수차를 제거하고 공동 지역화 분석을 지원합니다.
- 오픈 소스 응용 프로그램 ImageJ에 대한 플러그인 제품군인 SIMcheck26의기능 "일루미네이션 단계"와 "조명 패턴 포커스"를 사용하여 교정의 품질을 확인합니다. 이를 위해 챔버 커버슬립을 준비하여 테트라스펙 마이크로스피어의 조밀한 단일 층을 확보하고 시료의 3D-SIM 이미지를 획득한다. ImageJ에서 이미지를 분석하고 수차가 감지되면 4.11 단계에서 현미경 보정을 다시 시작합니다.
5. 취득
- 공초점 또는 와이드필드 모드에서 40배 의 목표를 사용하여 샘플을 분석하기 시작합니다. 이렇게 하면 샘플에 대한 탐색을 통해 좋은 세부 정보와 넓은 시야를 유지할 수 있습니다.
- MAP2 항체 신호를 사용하여 신경 과정을 나타내는 영역을 식별합니다.
- 공초점 모드에서 샘플의 이미지를 획득하여 염색의 품질을 결정합니다. 열악한 공초점 품질은 SIM 품질이 좋지 않으므로 샘플을 폐기해야 합니다.
- 이미지와 이미지의 품질이 만족스레면 목표를 100배로 전환합니다.
- 100x 목표에 오일을 적용합니다.
- 나중에 슈퍼 해결 된 이미지의 품질을 평가하는 데 사용되는 넓은 필드 또는 공초점 이미지를 획득(그림 1A, B).
- 3D-SIM 모드로 전환합니다.
- 대화 상자 창을 사용하여 수집을 위한 매개 변수를 설정하려면 색상 정보를 최대화하기 위해 사용할 수 있는 가장 높은 비트 깊이 설정을 선택합니다. 일반적으로 16비트는 표준 선택입니다. 또한 신호 대 잡음 비율을 개선하기 위해 1MHz와 같은 획득을 위한 저주파 값을 선택합니다.
- 히스토그램 창을 사용하여 레이저 전원을 설정하여 신호의 선형 응답을 얻습니다. 정보 손실을 방지하려면 이미지의 포화 픽셀을 제한합니다. N-SIM 시스템은 Andor iXon3 카메라를 사용합니다. 16비트로 작업할 때 는 카메라의 선형 응답을 보장하기 위해 16,000의 목표 강도를 선택합니다. 또는 30,000-45,000 사이의 범위를 선택하여 인수의 동적 범위를 최대화합니다.
- 50ms와 2s 사이의 샘플 및 노출 시간을 이미징 할 때 0.1 %와 50 % 사이의 레이저 전력을 설정합니다. 50% 이상의 레이저 파워는 사용 중형 형광의 신속한 광표백을 일으킬 수 있습니다.
- 3D-SIM 모드에서 이미지 수집을 시작합니다.
- ImageJ용 무료 플러그인 제품군인 SIMcheck를 사용하여 원시 이미지 의 획득 품질을 평가합니다.
- SIMCheck에서 아티팩트 또는 품질 문제를 감지하지 못하는 경우 통계 분석을 허용하기 위해 4개의 기술 복제에서 최소 10개의 이미지를 수집합니다.
6. 포스트 프로덕션: 이미지 재구성
참고: 3D-SIM 획득 이미지는 재구성된 초해결 이미지를 얻기 위해 처리해야 하는 원시 이미지입니다. 원시 이미지를 잘못 재구성하면 샘플 분석에 영향을 주는 아티팩트가 발생할 수 있습니다. 따라서 재건 매개 변수를 올바르게 선택하려면 큰 주의를 기울여야 합니다.
- 현미경 재구성 분석 소프트웨어를 사용하여 원시 이미지를 처리하여 초해결영상(도 1C)을얻습니다. 또는 자유롭게 사용할 수 있는 ImageJ 플러그인 페어SIM을 사용하여 원시 이미지를 재구성합니다.
- 현미경 재구성 소프트웨어 또는 ImageJ 플러그인 SIMCheck를 사용하여 슈퍼 해결 된 이미지의 Fourier 변환을 계산합니다. 좋은 재구성 된 이미지는 각 채널, 꽃과 같은 이미지에 대해 반환해야합니다. 재구성된 이미지가 꽃모양모양을 다시 만들지 못하면 원시 이미지에서 다시 시작하여 Wiener 필터링, 아포디제이션 및 제로 오더억제(27)와같은 재구성 매개변수를 수정하여 재구성합니다. NIS 소프트웨어에서 미리 보기를 사용하여 매개 변수변경이 최종 해결된 이미지에 미치는 영향을 모니터링하고 매개 변수 i) 조명 변조 콘트라스트, ii) 고해상도 노이즈 억제 및 iii) 포커스 억제 를 해제합니다.
- 다음으로, 재구성된 이미지를 분석하여 ImageJ 기반 플러그인인 NanoJ-SQUIRREL28을사용하여 아티팩트를 바이어스방식으로 감지하여 수퍼리해결 이미지의 품질을 평가합니다.
- NanoJ-SQUIRREL이 아티팩트를 감지하면 원시 이미지에서 다시 시작하고 Wiener 필터링, 아포지케이화 및 제로 오더 억제와 같은 재구성 매개 변수를 수정하여 재구성합니다. NIS 소프트웨어에서 미리 보기를 사용하여 매개 변수변경이 최종 해결된 이미지에 미치는 영향을 모니터링하고 매개 변수 조명 변조 콘트라스트, 고해상도 노이즈 억제 및 초점 사용 중지 를 수정합니다.
- 슈퍼 해결된 이미지를 사용하여 공동 지역화 프로필 및/또는 Pearson 및 Mander의 계수를 계산합니다.
7. 프로파일 분석을 통해 공동 지역화
참고: 시냅스 마커와 관심 있는 단백질 간의 공동 지역화를 연구하는 첫 번째 단계로, 매우 해결된 이미지를 취하고 단일 궤적을 분석하여 신호 중첩을 결정합니다.
- 슈퍼 해결 된 이미지에서 단일 궤적을 식별합니다.
- 관심 있는 궤적의 형광 신호의 강도 프로파일을 가져옵니다.
- 데이터를 내보냅니다.
- 그래프패드 프리즘(GraphPad Prism) 또는 유사한 분석 소프트웨어를 사용하여 모든 신호 피크를 정규화하고 각 채널에 대해 유사한 신호 강도를 얻을 수 있으며, 메뚜기 별 공동 지역화를 결정하는 최종 목표를 달성합니다.
8. 피어슨과 맨더의 계수의 정량화
참고: 프로파일 분석이 단일 궤적 공동 지역화를 제안한 경우 Pearson 및 Mander의 계수를29,,30으로계산하여 전체 이미지에 대한 보다 일반적인 분석을 수행할 수 있습니다.
- ImageJ 플러그인인 JACoP31을사용하여 공동 지역화의 두 매개 변수인 Pearson's와 Mander's를 결정합니다.
9. 통계 분석
- 그래프패드 프리즘 또는 유사한 분석 및 그래프 소프트웨어를 사용하여 JACoP로 수집된 데이터를 처리합니다.
- 분석된 각 조건에 대해 최소 40개의 SIM 이미지를 사용하여 그래프를 얻고 통계적 관련성을 얻을 수 있습니다.
결과
우리는 여기에 신경 단백질 을 공동 국소화를 연구하는 표준 워크 플로우를 제시합니다. 우리는 먼저 현미경을 보정하고 다음 우리는 샘플의 SIM 분석을 수행했다. 시스템을 보정하기 위해 직경 0.1 μm의 형광 마이크로스피어를 사용했습니다. 구슬의 매우 해결된 3D-SIM 이미지를 얻으면 기본 이미지 데이터는 포리에 변환되어 공간 주파수 표현으로 다시 변환됩니다. 도 2A에서뚜렷한 꽃 패턴은 초해상도 세부 레벨의 표시로 제시된다. 다음으로 단일 비드의 강도프로파일(그림 2B,C)의피크의 전체 폭을 절반 최대(FWHM)로 계산하여 달성된 해상도를 측정했습니다. 마지막으로, 채널 등록에 의해 색수차를 수정하여 형광 마이크로스피어(그림3A, B)를다시 사용했습니다. 다음으로 100배의 목표로 샘플을 분석하기 시작했고 3D-SIM 이미지를 획득했습니다. SIMCheck를 사용하여 인수 시 현장 조명 또는 움직임의 균일성을 평가했습니다(그림4A). 조명 패턴각도(도 4B)의강도 차이를 점검하고, 국면 스트라이프 콘트라스트(도4C)를측정하기 위해 노이즈대비 변조 대비의 비율을 계산하였다. 마지막으로, 우리는 재건의 효과적인 해결을 추정(그림 4D).
우리는 다음 나노 J-다람쥐를 사용하여 슈퍼 해결 이미지의 품질을 확인했다. 첫 번째 재구성이미지(도 5A)에서나노-다람쥐는 유물의 존재를 감지하였다(도5C). 새로운 슈퍼해결영상(도 5B)을얻기 위해 재구성 파라미터를 변경하였고, 나노제이-다람쥐는 유물(도5D)의부재를 확인했다. 시스템을 보정하고 재구성된 이미지의 품질을 평가한 후, 우리는 다음으로 MAP2, 신경 마커, PSD95, 시냅스 후 마커 및 표적 단백질 SUMO1에 대하여 항체로 염색된 1차 신경 배양을 분석하기 시작했습니다. 먼저 40배목표(도 6A)로4채널 공초점 현미경검사를 수행하는 샘플을 분석하였다. 신경 과정을 나타내는 영역을 선택하면 100배의 목표로 전환했습니다. 나노J-SQUIRREL로 재건의 질을 평가하고 공동 현지화 분석을 수행하기 위해 같은 지역의 공초점 및 SIM 이미지를 모두 획득했습니다. 도 6B에서는SENP1 및 드레브린에 얼룩진 뉴런의 매우 해결된 3D-SIM 이미지를 보여줍니다. 슈퍼 해결 된 이미지의 공동 지역화는 프로파일 분석(그림 7A)및 Pearson 및 Mander의 계수의 정량화(그림 7B)로분석 될 수 있습니다.

그림 1: 와이드필드, 공초점 및 SIM 인수 비교. (A)SENP1(녹색), 드레브린(red) 및 MAP2(모브)를 위해 면역화된 1차 해마 뉴런의 와이드필드 영상. DAPI는 핵을 얼룩지게 하기 위해 사용되었다. 스케일 바 5 μm.(B)패널 A의동일한 샘플의 공초점 이미지. (C)패널 A와 B의동일한 샘플의 SIM 이미지 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 현미경 보정을 위한 현미경 의 3D-SIM 이미지의 분석. (A)꽃 모양의 마이크로스피어 의 인수의 빠른 포리에 변환. (B)측면 공간 해상도를 결정하기 위해 단일 마이크로스피어의 선택. (C)FWHM을 측정하여 B의 단일 마이크로피어의 강도 프로파일. 값은 계측기에서 달성한 해상도를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 세 개의 채널 등록. (A)등록 전 다색(파장 488nm, 555nm 및 647nm) 테트라스펙 마이크로스피어의 획득. (B)교정 후 동일한 시료의 취득. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
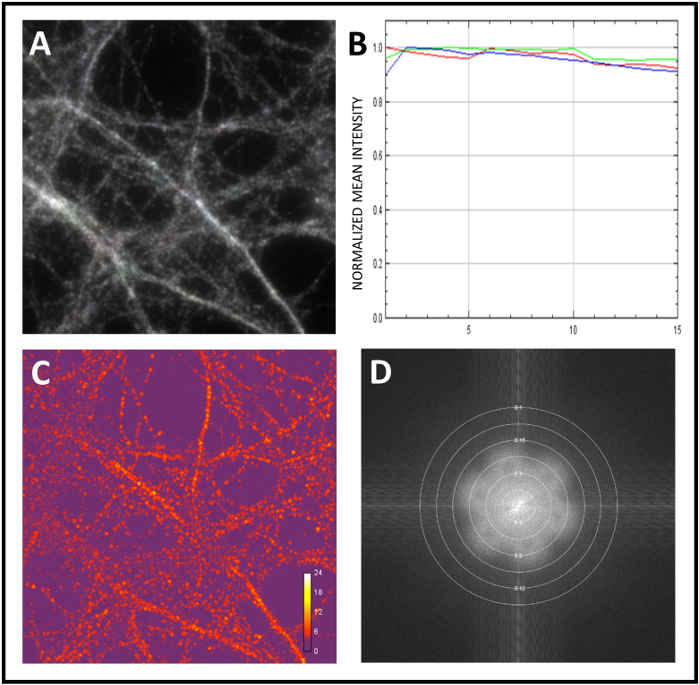
그림 4: SIMcheck를 사용하여 원시 및 재구성된 이미지의 품질 평가. (A)SIMCheck를 이용한 동작 및 조명 변동 분석. 신호 회색에서 흰색으로 가는 것은 수집 하는 동안 균일 한 조명 및 움직임의 부재를 나타냅니다. (B)원시 이미지를 분석하여 얻은 채널 강도 프로파일. 이 예에서는 강도 변화가 최소화되어 부족또는 표백 또는 변동을 제안합니다. (C) 원시 변조 대비는 이미지 내의 변조 대비 대비-노이즈의 비율을 계산한다. 히트맵은 변조 대비 변형을 보여줍니다. (D)재건의 효과적인 해결을 결정하기 위해 진폭 포리어 스펙트럼을 분석하기 위해 포리에 플롯을 재구성하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: NanoJ-SQUIRREL을 사용하여 초해상도 이미지 품질 평가. (A)유물이 있는 초해상도 이미지를 참조합니다. (B)좋은 품질의 참조 슈퍼 해상도 이미지. (C)나노J-다람쥐 오류 맵을 나타내는 이미지 A. 밝은 영역은 대규모 아티팩트를 나타내며 어두운 영역은 올바른 재구성을 나타냅니다. (D)나노J-다람쥐 오류 맵 B. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: SIM 이미지 샘플입니다. (A)1차 뉴런의 공초점 현미경 검사. 40X 목표는 좋은 해상도를 유지하면서 샘플의 개요를 얻기 위해 선택되었습니다. 세포는 SUMO1(녹색), PSD95(빨간색) 및 MAP2(mauve)를 위해 면역염색하였다. DAPI는 핵을 얼룩지게 하기 위해 사용되었다. 스케일 바 50 μm. 이미지는 Z 프로젝션으로 표시되었습니다. (B)100X 목표를 사용하여 패널 A의 녹색 상자에 강조 표시된 영역에 SUMO1 및 PSD95용 SIM 이미지. 빨간색 화살표 헤드는 강도 프로파일을 계산하는 데 사용되는 A에 표시된 인세트의 위치를 나타냅니다. 배율 막대 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
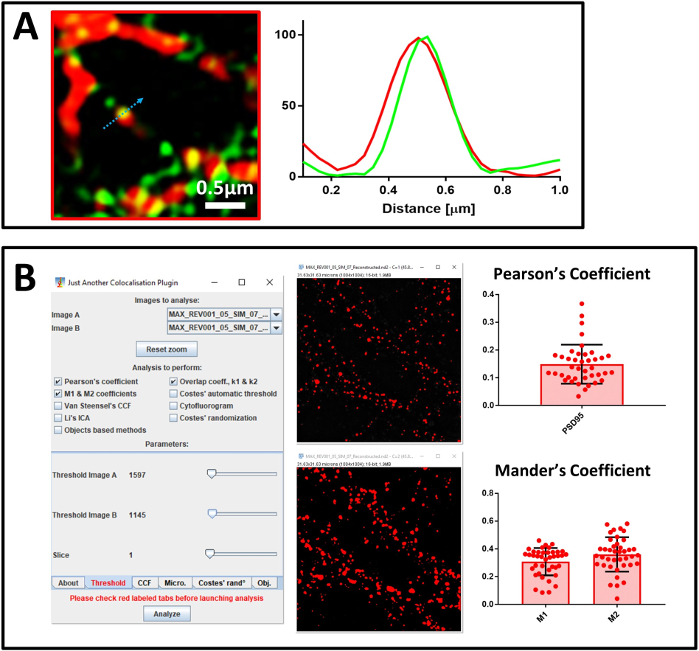
그림 7: 공동 지역화 분석. (A)SENP1(녹색) 및 드레브린(빨간색), 스케일 바 0.5 μm 및 강도 프로파일에 대한 항체로 염색된 1차 뉴런의 슈퍼 해결 된 이미지. 그래프의 값은 각 채널에 대해 100(임의 단위)으로 정규화되고 파란색 화살표로 표시된 픽셀 강도에 해당합니다. (B)JACoP를 사용하여 SENP1과 드레브린 사이의 피어슨의 상관 관계 계수와 맨더의 계수를 계산하는 분석. 플러그인 설정 및 시각적 임계값의 창이 표시됩니다. 맨더의 계수는 드레브린(M1)과 공동 으로 지역화하는 SENP1 분획과 SENP1(M2)과 공동 지역화하는 드레브린 분획의 두 가지 값으로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
시냅스의 구조와 구성을 해명하는 것은 기억과 인식을 조절하는 생리학적 및 병리학적 과정을 이해하는 데 매우 중요합니다. 정상 상태에서 시냅스는 기억의 구성 요소이며, 알츠하이머병(32)과같은 복잡한 신경 장애의 기초이기도 합니다. 여기에 설명된 프로토콜은 SIM에게 불린 초해상도 현미경 기술으로 신경 단백질의 공동 현지화를 공부하는 역할을 합니다. SIM은 특정 조명 패턴을 사용하여 약 0.1 μm의 해상도에 도달할 수 있으며, 이는 일반적으로 0.03에서 0.15 μm 사이를 측정하는 시냅스의 연구에 적합합니다. 더욱 자세히 설명하면, 10-20 nm의 해상도에 도달 할 수있는 STED (자극 방출 고갈 미세 검사법), PALM (사진 활성화 국소화 현미경 검사법) 또는 STORM (스토세스 틱 광 재건 현미경 검사법과 같은 다른 초해상도 기술은33)를적용 할 수 있습니다.
여기서는 1차 뉴런의 시냅스 마커를 가진 표적 단백질의 공동 국소화 분석을 설명합니다. 프로토콜은 해마, 소뇌 또는 피질 뉴런과 같은 신경 세포의 모든 주요 배양에 적용 될 수 있으며 장 신경계 뉴런과 같은 중추 신경계에 속하지 않는 1 차 신경 세포의 배양에도 적용 될 수 있습니다. 그러나 초해상도 수준에서 분석의 핵심은 목표의 회절 인덱스와 호환되는 챔버 커버립 및 장착 솔루션과 같이 획득 중에 사용되는 시약입니다. 우리는 사용의 용이성을 위해 챔버 커버립을 사용하지만, 코팅 된 커버 글래스에 기본 뉴런을 성장하는 고전적이고 저렴한 방법은 특히 높은 정밀도 #1.5H (0.17mm) 커버 글래스로 유효합니다. 또한, 1.515의 굴절 지수를 가진 유리(1.52)와 100x 목표에 대한 침수 오일에 가능한 한 감속 지수에 근접할 수 있는 장착 미디어를 사용해야 한다. 지속적인 실온과 안정된 테이블도 획득의 정확성을 보장하기 위해 필수입니다.
우리는 SIM 연구에서 다이라이트와 알렉사 이차 항체를 모두 사용합니다. 여기저기서 방출이 좁고 양자 수율이 좋기 때문에 소음 비율에 가장 적합한 신호가 필요한 초해상도 기술에 대해 표시됩니다. 뎀시 외. 슈퍼 해상도 이미징에 대한 알렉사, 다이라이트 및 기타 형광을비교34.
인수 하는 동안, 우리는 정기적으로 10 MHz. 1 MHz 이상 1 MHz에서 카메라를 설정, 느린 수집 속도 덕분에, 이미지보다 더 많은 정확도와 적은 소음을 제공 10 MHz의. 1 MHz 판독 모드또한 16 비트의 비트 깊이로 기록 할 수 있습니다 (10 MHz의 최대 14 비트에 비해), 더 많은 색상 정보와 더 정확한 색상 그라데이션을 제공. 그러나, 10 MHz, 그것의 속도, 라이브 이미지에 대 한 유용. 표백을 피하고 불소조를 보존하기 위해 레이저 전력을 가능한 한 낮게 설정합니다. 신호 강도를 향상시키기 위해 게인 값을 늘릴 수 있습니다. 낮은 이득은 소음을 향상하지 않고 깨끗한 이미지를 보장한다는 점에 주목할 필요가있다. 일반적으로, 챔버 커버슬립의 바닥에서 7 μm 이내의 이미징을 하는 동안 최상의 결과를 얻을 수 있습니다. 이는 오일 침수로 100배 목표를 사용할 때 특히 중요합니다. 세포/조직에 걸쳐 더 깊은 획득이 필요한 경우, 더 나은 선택은 물에 침지와 60x 목표의 사용일 수 있습니다.
SIM 연구를 수행하는 데 가장 큰 과제 중 하나는 이미지 재구성35입니다. 유물과 수차 없이 수퍼로 해결된 이미지를 얻으려면 임시 실험 조건을 사용할 뿐만 아니라 최종 이미지를 얻기 위해 시스템 및 파라미터 최적화를 신중하게 보정해야 합니다. 프로토콜에서 시스템의 교정과 원시 및 재구성 된 이미지의 품질 분석을 평가하여 가장 일반적인 실수를 피하는 방법을 설명합니다. 특히, 우리는 이미지가 매우 해결 된 이미지의 일반적인 아티팩트를 방지하기 위해 올바른 악기 설정을 보장하기 위해 ImageJ 플러그인 SIMCheck 및 NanoJ-SQUIRREL의 사용을 설명합니다. 응용 프로그램은 연구의 구조에 대한 사전 지식에 대한 결과를 주관적으로 벤치마킹에 근거하지 않는 최종 이미지의 편견없는 품질 평가를 허용합니다.
시냅토피신과 PSD95 또는 드레브린을 시냅스 마커로 사용하는 것이 좋습니다. 문학의 거대한 몸은 시냅스마커36,,37로바순과 같은 단백질을 설명합니다. 그것은 사전 및 포스트 냅 스 마커 는 그러나 세포 전체에 존재 하는 주목할 가치가 있다, 핵을 제외 하 고. 그들의 신호의 대부분은 비 시냅스이지만 수송 또는 분해, 배경 또는 기타 유물의 단백질을 나타냅니다. 따라서 분석 영역을 신중하게 선택하는 것이 중요합니다. 우리는 축축한 및 수지상 단자를 선택하기 위하여 MAP2 항체 신호를 이용합니다.
공동 지역화 분석에서 우리는 두 가지 접근 방식을 사용합니다. 첫 번째는 공동 지역화의 단일 이벤트를 표시하고 각 채널의 기여를 식별하는 프로필 분석을 기반으로 하는 시각적 접근 방식입니다. 그러나 이 접근법의 주의는 통계력이 좋지 않습니다. 이러한 이유로 각 이미지의 전체 필드를 대표하는 더 많은 수의 이벤트를 분석하여 두 번째 방법을 사용하기로 결정했습니다. 이 방법은 Pearson의 상관 관계 계수와 맨더의 M1 및 M2 계수의 계산을 기반으로 합니다. 우리는 Pearson의 상관 관계 계수를 사용하여 이미지및 Mander의 M1 및 M2에서 신호의 중복을 설명하여 관심 있는신호(38)의상호 공동 지역화를 설명합니다. 계산을 위해, 우리는 ImageJ 플러그인 JACoP를 사용, 그것은 당신이 분석에 대한 배경 기여를 폐기하는 수동 임계 값을 설정할 수있는 기능을 가지고 있기 때문에, 특히 맨더의 분석에 대한 중요한.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 원고의 건설적인 비판에 대한 도아르도 미코티에게 감사드립니다. 이 연구는 브라이트 포커스 A2019296F에 의해 지원되었다, 폰도 디 베네피첸자에 의해 - 그루프포 인테사 산파올로 (LC), 라 라이스사 바이오 메디카 당 폰다지오네 지역 (Care4NeuroRare CP_20 / 2018) (CN) 마리 Skłodowska-Curie 혁신적인 교육 네트워크 (JK)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue solution | Thermo Fisher Scientific | 15250061 | Chemical |
| 70 µm filter | Corning | 352350 | Equiment |
| Alexa | Thermo Fisher Scientific | - | Antibody |
| Antibody SENP1 | Santa Cruz | sc-271360 | Antibody |
| B27 Supplement | Life Technologies | 17504044 | Chemical |
| Bovine serum albumin | Merck | 5470 | Chemical |
| CaCl2 | Merck Life Science | 21115 | Chemical |
| Chambered coverslips | Ibidi | 80826 | Equiment |
| DyLight | Thermo Fisher Scientific | - | Antibody |
| FBS (Hyclone) | GIBCO | SH3007002 (CHA1111L) | Serum |
| FluoSpheres carboxylate-modified microspheres, 0.1 μm, yellow–green fluorescent | Thermo Fisher Scientific | F8803 | Equiment |
| Glucose | Merck Life Science | G8769 | Chemical |
| Glutamax | GIBCO | 35050061 | Chemical |
| HEPES | Merck Life Science | H3537 | Chemical |
| L-Cystein | Merck Life Science | C6852-25g | Chemical |
| MAP2 | Merck | AB15452 | Antibody |
| MEM | Life Technologies | 21575022 | Medium |
| MgCl | Merck Life Science | M8266 | Chemical |
| NaOH | VWR International | 1,091,371,000 | Chemical |
| Neurobasal A | Life Technologies | 10888022 | Medium |
| N-SIM Super Resolution Microscope | Nikon | - | Instrument |
| Papain | Merck Life Science | P-3125 | Chemical |
| paraformaldehyde | Thermo Fisher Scientific | 28908 | Chemical |
| Pen/Strep 10x | Life Technologies | 15140122 | Chemical |
| phosphate-buffered saline | Gibco | 10010023 | Chemical |
| Poly-L lysine | Sigma | P2636 | Chemical |
| ProLong Diamond Glass Antifade Mountant | Thermo Fisher Scientific | P36970 | Chemical |
| PSD95 | NeuroMab | K28/43 | Antibody |
| Round coverglass | Thermo | 12052712 | Equiment |
| SUMO1 | Abcam | ab32058 | Antibody |
| Synaptophysin | Merck | S5768 | Antibody |
| Triton X-100 | Merck | T8787 | Chemical |
| Trypsin inhibitor | Merck Life Science | T9003-500MG | Chemical |
참고문헌
- Foster, M., Sherrington, C. S. . A textbook of physiology, part three: The central nervous system (7th ed.). , (1897).
- Choquet, D., Triller, A. The Dynamic Synapse. Neuron. 80 (3), 691-703 (2013).
- McAllister, A. K. Dynamic Aspects of CNS Synapse Formation. Annual Review of Neuroscience. 30 (1), 425-450 (2007).
- Yuzaki, M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annual Review of Physiology. 80 (1), 243-262 (2018).
- Baddeley, D., Bewersdorf, J. Biological Insight from Super-Resolution Microscopy: What We Can Learn from Localization-Based Images. Annual Review of Biochemistry. 87 (1), 965-989 (2018).
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361 (6405), 880-887 (2018).
- Vangindertael, J., et al. An introduction to optical super-resolution microscopy for the adventurous biologist. Methods and Applications in Fluorescence. 6 (2), 022003 (2018).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Scalisi, S., Barberis, A., Petrini, E. M., Zanacchi, F. C., Diaspro, A. Unveiling the Inhibitory Synapse Organization Using Superresolution Microscopy. Biophysical Journal. 116 (3), 133 (2019).
- Yang, X., Specht, C. G. Subsynaptic Domains in Super-Resolution Microscopy: The Treachery of Images. Frontiers in Molecular Neuroscience. 12, (2019).
- Monro, T. Beyond the diffraction limit. Nature Photonics. 3 (7), 361 (2009).
- Won, R. Eyes on super-resolution. Nature Photonics. 3 (7), 368-369 (2009).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Scientific Reports. 6 (1), 27290 (2016).
- Galbraith, C. G., Galbraith, J. A. Super-resolution microscopy at a glance. Journal of Cell Science. 124 (10), 1607-1611 (2011).
- Gustafsson, M. G. L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. Journal of Microscopy. 198 (2), 82-87 (2000).
- Gustafsson, M. G. L., et al. Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophysical Journal. 94 (12), 4957-4970 (2008).
- Brose, N., O'Connor, V., Skehel, P. Synaptopathy: dysfunction of synaptic function. Biochemical Society Transactions. 38 (2), 443-444 (2010).
- Tyebji, S., Hannan, A. J. Synaptopathic mechanisms of neurodegeneration and dementia: Insights from Huntington's disease. Progress in Neurobiology. 153, 18-45 (2017).
- Won, H., Mah, W., Kim, E. Autism spectrum disorder causes, mechanisms, and treatments: focus on neuronal synapses. Frontiers in Molecular Neuroscience. 6, (2013).
- Pfeiffer, B. E., Huber, K. M. The State of Synapses in Fragile X Syndrome. The Neuroscientist. 15 (5), 549-567 (2009).
- Pavlowsky, A., Chelly, J., Billuart, P. Emerging major synaptic signaling pathways involved in intellectual disability. Molecular Psychiatry. 17 (7), 682-693 (2012).
- Senatore, A., Restelli, E., Chiesa, R. Synaptic dysfunction in prion diseases: a trafficking problem. International Journal of Cell Biology. 2013, 543803 (2013).
- Colnaghi, L., et al. Super Resolution Microscopy of SUMO Proteins in Neurons. Frontiers in Cellular Neuroscience. 13, (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Müller, M., Mönkemöller, V., Hennig, S., Hübner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7 (1), 10980 (2016).
- Ball, G., et al. SIMcheck: a Toolbox for Successful Super-resolution Structured Illumination Microscopy. Scientific Reports. 5 (1), 15915 (2015).
- Schaefer, L. H., Schuster, D., Schaffer, J. Structured illumination microscopy: artefact analysis and reduction utilizing a parameter optimization approach. Journal of Microscopy. 216 (2), 165-174 (2004).
- Culley, S., et al. NanoJ-SQUIRREL: quantitative mapping and minimisation of super-resolution optical imaging artefacts. Nature Methods. 15 (4), 263-266 (2018).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of co-localization of objects in dual-colour confocal images. Journal of Microscopy. 169 (3), 375-382 (1993).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
- Bolte, S., Cordelières, F. P. A guided tour into subcellular colocalization analysis in light microscopy. Journal of Microscopy. 224, 213-232 (2006).
- Bae, J. R., Kim, S. H. Synapses in neurodegenerative diseases. BMB Reports. 50 (5), 237-246 (2017).
- Godin, A. G., Lounis, B., Cognet, L. Super-resolution Microscopy Approaches for Live Cell Imaging. Biophysical Journal. 107 (8), 1777-1784 (2014).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nature Methods. 8 (12), 1027-1036 (2011).
- Karras, C., et al. Successful optimization of reconstruction parameters in structured illumination microscopy - A practical guide. Optics Communications. 436, 69-75 (2019).
- Bereczki, E., et al. Synaptic markers of cognitive decline in neurodegenerative diseases: a proteomic approach. Brain: A Journal of Neurology. 141 (2), 582-595 (2018).
- Gilestro, G. F., Tononi, G., Cirelli, C. Widespread Changes in Synaptic Markers as a Function of Sleep and Wakefulness in Drosophila. Science. 324 (5923), 109-112 (2009).
- Adler, J., Parmryd, I. Quantifying colocalization by correlation: the Pearson correlation coefficient is superior to the Mander's overlap coefficient. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (8), 733-742 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유