Method Article
Tek Hücreli Türler Arası Bakteri Etkileşimlerinin Kinetik Görselleştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu canlı-bakteriyel hücre görüntüleme protokolü zaman içinde tek hücre düzeyinde birden fazla bakteri türü arasındaki etkileşimlerin görselleştirilmesiiçin izin verir. Hızlandırılmış görüntüleme, tek tek kültür veya ortak kültürdeki her bakteri türünün gözlemlenmesine olanak sağlar ve bireysel hücre hareketliliği ve canlılığı da dahil olmak üzere çok türler arası bakteri topluluklarındaki türler arası etkileşimleri sorgular.
Özet
Polimikrobiyal topluluklar doğada her yerde bulunurlar, ancak etkileşimlerini tek hücre düzeyinde incelemek zordur. Böylece iki bakteriyel patojen arasındaki türler arası etkileşimi gözlemlemek için mikroskopi tabanlı bir yöntem geliştirilmiştir. Bu yöntemin motile Gram-negatif patojen, Pseudomonas aeruginosa ve non-motile Gram-pozitif patojen, Staphylococcus aureus arasındaki etkileşimleri sorgulamak için kullanımı burada gösterilmiştir. Bu protokol, her türün bir kapak kayması ve bir agarose pedi arasında, hücreleri tek bir düzlemde koruyan ve hem uzay hem de zaman daki bakteri davranışlarının görselleştirilmesine olanak sağlayan bir eş-aşıdan oluşur.
Ayrıca, burada gösterilen zaman atlamalı mikroskopi, monokültürde bakteri türlerinin hareketliliğindeki değişiklikler ve diğer türlerle birlikte kültür de dahil olmak üzere iki veya daha fazla bakteri türü arasında gerçekleşen erken etkileşimleri görselleştirmek için idealdir. Mikroskopi kurulumundaki sınırlı numune alanının doğası nedeniyle, hücre popülasyonları çok yüksek olduğunda bakteri türleri arasındaki etkileşimlerin incelenmesi için bu protokol daha az uygulanabilir. Bununla birlikte, protokolün canlı ve ölü bakteri hücrelerinin görüntülenmesinde boyama, floresan muhabirler aracılığıyla gen veya protein ekspresyonunun sayısallaştırılması ve hem tek tür hem de çok tür deneylerinde bakteri hücresi hareketinin izlenmesi gibi birçok farklı uygulama bulunmaktadır.
Giriş
Polimikrobiyal topluluklar doğada yaygındır, çevre çeşitli kapsayan1,2,3 ve insan nişler4,5. İnsan hastalığında en kötü üne sahip polimikrobiyal enfeksiyonların bazıları diş biyofilmleriiçerir 6, kronik yaralar7,8, ve kronik obstrüktif akciğer hastalığı olan bireylerde solunum yolu enfeksiyonları9, ventilatör ilişkili pnömoni10, ve genetik hastalık kistik fibrozis (CF)11,12. Bu enfeksiyonlar genellikle çeşitli mikrobiyal türlerden oluşur; Ancak, Gram-pozitif bakteri Staphylococcus aureus ve Gram-negatif bakteri Pseudomonas aeruginosa arasındaki etkileşimleri yeni bir odak ortaya çıkmıştır. Bu organizmalarla birlikte enfekte olmuş ve in vitro analizleri içeren çalışmalar, hastalığın ilerlemesi, mikrobiyal sağkalım, virülans, metabolizma ve antibiyotik duyarlılığı üzerinde derin ve beklenmeyen etkilere sahip olabilecek rekabetçi ve işbirliğine dayalı etkileşimleri ortaya koymaktadır (Hotterbeekx ve ark. 201713 ve Limoli ve Hoffman 20193tarafından ayrıntılı olarak incelenmiştir).
Enfeksiyon sırasında türler arası etkileşimlere olan ilginin artması, polimikrobiyal topluluk davranışlarını incelemek için çeşitli yöntemler ortaya koymuştur. Tipik olarak, bu çalışmalar monokültür ve coculture arasındaki henotik farklılıkları araştırmak için plaka veya et suyu bazlı tahliller yararlanmış. Örneğin, katı yüzeylerde P. aeruginosa ve S. aureus koculturing büyüme inhibisyonu veya koloni fenotip, pigment veya polisakkarit üretimi14,,15,16değişiklikler görselleştirme için izin verdi. Karışık türler biyofilmler, biyotik veya abiyotik yüzeylerde, yanı sıra sıvı kültüründe bakteri türlerinin koculturing de büyüme değişiklikleri ölçümü sağlamıştır, metabolizma, antibiyotik tolerans, rekabet ve canlılık, gen ve protein ekspresyonuna ek olarak17,18. Bu toplu kültür deneyleri P. aeruginosa ve S. aureus'un toplum ölçeğinde birbirlerini nasıl etkileyebileceklerine dair içgörüler ortaya çıkarmış olsa da, tek hücre düzeyinde gerçekleşen etkileşimler hakkında önemli soruları cevaplayamamaktadırlar. Burada sunulan yöntem, zaman içinde bir topluluk içinde tek hücrelerin hareket, hücre canlılığı ve gen ekspresyonundaki değişikliklere odaklanarak türler arası etkileşimleri inceleme yaklaşımlarına katkıda bulunur.
Tek hücreli etkileşimler, hücrelerin toplu topluluğunda gerçekleşen etkileşimlerden büyük ölçüde farklı olabilir. Tek hücreli analiz yoluyla, bir topluluk içindeki heterojenlik, hücrelerin mekansal yerleşiminin toplum dinamiklerini nasıl etkilediğini veya bir grubun bireysel üyeleri içinde gen ve protein ekspresyon düzeylerinin nasıl değiştiğini incelemek için ölçülebilir. İzleme hücreleri, tek hücrelerin birden fazla nesil boyunca zaman içinde nasıl hareket edip nasıl hareket ettigini de içgörü sağlayabilir. Hücre hareketini ve gen ekspresyonundaki değişiklikleri eş zamanlı olarak izleyerek gen dalgalanmaları ile buna karşılık gelen fenotipler arasında korelasyonlar yapılabilir. Tek hücredüzeyinde tek tek bakteri türlerinin incelenmesi için önceki protokoller tanımlanmıştır. Bu çalışmalar tek bir düzlemde zaman içinde canlı görüntüleme hücrelerinin yararlanmak, ve hücre bölünmesi ve antibiyotik duyarlılık gibi fenotipler gözlemlemek için yararlı olmuştur19,20. Ek canlı görüntüleme mikroskopisi büyüme, hareketlilik, yüzey kolonizasyonu ve tek bakteri türlerinin biyofilmoluşumunuizlemek için kullanılmıştır 21,22,23. Ancak, bu çalışmalar monokültürde bakterilerin fizyolojisini anlamak için anlayışlı olmakla birlikte, coculture zaman içinde birden fazla bakteri türünün tek hücreli davranışgözlem için deneyler sınırlıdır.
Burada, tek türgörüntüleme için kullanılan önceki protokoller P. aeruginosa ve S. aureusarasındaki etkileşimleri incelemek için uyarlanmıştır. Bu organizmalar hücre morfolojilerine göre faz kontrastı altında ayırt edilebilirler(P. aeruginosa basilli, S. aureus ise kokidir). Bu yöntemin geliştirilmesi son zamanlarda S. aureus24varlığında P. aeruginosa daha önce tanımlanmamış hareketlilik davranışlarının görselleştirilmesi sağladı. P. aeruginosa'nın S. aureus'u uzaktan algılama ve S. aureus hücre kümelerine doğru artan ve yönlü tek hücreli hareketlerle yanıt verme yeteneğine sahip olduğu bulunmuştur. S. aureus doğru P. aeruginosa hareketi tip IV pili gerektiren bulundu (TFP), koordine uzantısı ve geri çekme seğirme hareketliliği denilen bir hareket oluşturmak saç benzeri projeksiyonlar25.
Bu çalışmalar türler arasındaki daha önceki etkileşimleri sorgulamak için bu yöntemin yararını göstermektedir. Ancak, daha sonraki etkileşim zaman noktalarında yüksek hücre yoğunluklarında görüntüleme, daha sonra tek hücre tabakalarının tanımlanamayacağı göz önüne alındığında zordur ve bu da çoğunlukla görüntüleme sonrası analiz sırasında sorunlara yol açabilir. Bu sınırlama göz önüne alındığında, yöntem daha sonra daha sonraki etkileşimleri temsil eden yüksek hücre yoğunlukları temsilcisi geleneksel makroskopik tahliller ile takip edilebilir önceki etkileşimler için en uygundur. Bu yöntemin ek sınırlamaları düşük iş bölümü doğasını içerir, çünkü bir seferde yalnızca bir örnek görüntülenebilir ve mikroskop, kamera ve çevre odasının maliyeti. Ayrıca floresan mikroskopisi fototoksisite ve fotobeyaztma gibi bakteri hücreleri için risk oluşturur, bu nedenle floresan görüntülerin elde edilebilir sıklığını sınırlayan. Son olarak, bu yöntemde kullanılan agarose pedleri, koşullar doğru değilse pedleri küçültmeye veya genişletmeye başlayabilir göz önüne alındığında, sıcaklık ve nem gibi koşulları kontrol etmek için kritik hale, ortamdaki değişikliklere son derece duyarlıdır. Son olarak, bu yöntem ana ortam taklit etmez iken, farklı bakteri türlerinin yüzeylerde nasıl tepki ipuçları sağlar, hangi çevresel / konak koşulları taklit etmek için tasarlanmış tahlillerde takip edilebilir.
Bu yöntem, tek hücreli hareketi takip eden önceki çalışmalardan farklıdır, bu hücreler bir coverslip ve agarose ped arasında aşılanmış, yüzeyhücreleri kısıtlayan. Bu, hücre izlemenin tek bir düzlemde zaman içinde izlenmesini sağlar; ancak, hücreler sıvı26'yabatırıldığında gözlenen geçici yüzey etkileşimdöngülerini sınırlar. Bir agarose ped altında görüntüleme bakterilerin bir diğer yararı klasik P. aeruginosa seğirme motilite25incelemek için kullanılan makroskopik plaka tabanlı yüzey altı inogülasyon tahlilleri taklit olmasıdır. Bu testte, bakteri hücreleri petri kabının alt kısmı ile agar arasında aşılanır, bu mikroskop protokolü gibi, kabın alt kısmından dışa doğru hareket ederken hücreleri tek bir düzlemde tutarlar.
Burada sunulan türler arası etkileşimleri görselleştirmek için hızlandırılmış mikroskopi protokolü 1) bakteri örneği ve agarose pedinhazırlanması, 2) görüntüleme edinimi için mikroskop ayarlarının seçilmesi ve 3) görüntüleme sonrası analizden oluşur. Hücre hareketinin ve takibinin ayrıntılı görselleştirilmesi, faz kontrastı ile kısa zaman aralıklarında görüntülerin elde edilmesiyle gerçekleştirilebilir. Floresan mikroskopisi de zaman içinde hücre canlılığını veya gen ekspresyonunu belirlemek için kullanılabilir. Burada, floresan mikroskobu için adaptasyon bir örnek agarose pedleri için canlılık boyaları eklenmesi ile göstermektedir.
Protokol
NOT: Bu protokoldeki tüm sarf malzemelerinin tam açıklama ve katalog numaralarını Malzemeler Tablosu'nda bulabilirsiniz.
1. M8T minimal ortamın hazırlanması
- 2 L şişede 64 g Na2HPO4·7H2O, 15 g KH2PO4ve 800 mL ultra saf suda (UPW, direnç 18 MΩ/cm) 2,5 g NaCl eriterek 1 L M8 minimal tuz tabanı (5x) hazırlayın. pH 7.6'ya kadar. UPW ile 1 L'ye kadar tam ses düzeyi. 45 dk için otoklav.
- 1 L şişede 400 mL UPW'de 100 g glikoz uğrarak 500 mL glikoz çözeltisi (%20 w/v) hazırlayın. UPW ile 500 mL'ye komple çözüm. 45 dk için otoklav.
- 400 mL UPW'de 100 g tripton eriterek 500 mL tripton çözeltisi (%20 w/v) hazırlayın. UPW ile 500 mL'ye kadar tamamlayın. 45 dk için otoklav.
- 200 mL 5x M8 minimal tuz (1x final), 10 mL %20 glikoz (%0,2 final), 1 mL 1 MMG 1 MgSO4 (1 mM final) ve 50 mL %20 tryptone (%1 final) ilave ederek 1 L M8 + %10 tripon (M8T) minimal ortam hazırlayın. UPW ile 1 L'ye kadar tamamlayın. Steril 500 mL ortam depolama şişesine 0,2 m steril filtreden süzün.
1. Gün:
2. Bakteri bir gecede kültürlerinin hazırlanması
- 5 mL M8T minimal ortama tek bir P. aeruginosa veya S. aureus kolonisi ile aşılanın (uygun olduğunda antibiyotikler dahil) ve bir gecede 37 °C'de 16 saatten fazla havalandırma ile kuluçkaya yatırın.
NOT: Bakteriyel patojenler P. aeruginosa ve S. aureus bu yöntem için kullanılmıştır, çünkü bunlar genellikle kronik enfeksiyonlardan koizole edilmiştir ve bunların etkileşimlerinin incelenmesi polimikrobiyal enfeksiyonlar sırasında hasta sonuçlarına nasıl katkıda bulunmalarını anlamak için önemlidir. Diğer bakteri türleri çalışmanın odağına bağlı olarak kullanılabilir.
2. Gün:
3. Bakteriyel suşların alt kültürü
- Alt kültür P. aeruginosa 1:500 ve S. aureus 1:1000 taze M8T 5 mL (uygun olduğunda antibiyotik içerir). Kültürler orta günlük fazına ulaşınceye kadar 37 °C'de kuluçkaya yatırın (OD600 = ~0,3 - 0,5).
4. Ped kalıpları için malzemelerin hazırlanması
- Düz ucun yarısı 90° açıya bükülene kadar düz, yuvarlak bir laboratuvar spatulasının ucunu Bunsen brülörüyle ısıtarak metal spatulahazırlayın. Başka bir düz, yuvarlak laboratuvar spatulasının ucunu ısıtın ve son 10 mm'yi 45 °C'lik bir açıya hafifçe bükün.
- Silikon kalıpların dört köşesini, kalıpların 35 mm'lik bir tabağa sığacak şekilde kesin.
- % 70 etanol ekleyerek ve Bunsen brülör alev onları geçirerek spatulalar ve cımbız bir çift sterilize.
- Çanak ve silikon kalıpları %70 etanol ile temizleyin ve tüy bırakmayan mendillerle kurulayın.
5. Agarose pedlerin hazırlanması
NOT: Pedler, bu protokolde kullanılan bakterilerin besin kaynağı olarak M8T minimal ortam ile hazırlanır. Ancak, pedleri kullanılan besin farklı organizmalar için değiştirilebilir.
- Temiz bir 50 mL Erlenmeyer şişesinde 10 mL M8T'de %2 düşük erime agarose eritin. Mikrodalga kısa aralıklarla (2-5 s) kadar agarose üzerinde kaynama gelen şişe içeriğini önlemek için çözelti içinde. Eritildikten sonra, en az 15 dakika 50 °C su banyosunda soğumaya bırakın.
- 35 mm çanak açıklık ile silikon kesim hizalayarak kalıpları hazırlayın ve çanak silikon güvenli ve kalıp ve çanak arasındaki tüm hava kabarcıkları kaldırmak için spatula ile hafifçe dokunun.
- Bir kez serin, pipet 915 μL erimiş agarose kalıp içine. Kapağı açık bırakın ve 30 dakika oda sıcaklığında ped kuru maya bırakın.
- Kapağı kapağı ile çanak ve ek bir 2 saat oda sıcaklığında bırakın.
- Tüy bırakmayan bir mendil sıkıca yuvarlayarak nem mendilleri hazırlayın. Haddelenmiş mendilin üzerine steril petri kabının içine yerleştirin ve sile doğru 500°L steril su ekleyin. 1 saat boyunca 37 °C'ye kadar ılık.
- 1 saat boyunca 37 °C'ye kadar pedi ve steril 35 mm çanak ısıtın.
6. Bakteri hücrelerinin hazırlanması ve aşı pedleri
- Her alt kültürün OD600'ü ölçün ve P. aeruginosa'yı OD600 = 0,03 ve S. aureus'u 37 °C'ye önceden ısıtılmış M8T'de600 = 0,10'a kadar seyreltin. P. aeruginosa ve S. aureus'u 1:1 oran ve girdap olarak karıştırın.
NOT: Suşlar antibiyotik gerektiriyorsa, antibiyotikler bir gecede ve alt kültüre eklenebilir, ancak eşkültürdeki diğer türleri etkiliyorsa görüntüleme için türlerin karıştırılması nda eklenmemelidir. Plazmid stabilitesi ve antibiyotiklerin kokültürdeki tüm türler üzerindeki etkileri, kullanılan her organizma/plazmid için belirlenmelidir. - Pipet 1 μL coculture eşit bir önceden ısıtılmış, steril 35 mm cam coverslip çanak altında.
- Steril cımbız kullanarak kalıptan silikon kesiti çıkarın.
- Steril spatulalar kullanarak pedi yemekten çıkarın.
- Yastık kenarının altında hafifçe bükülmüş spatula slip, baş aşağı kalıp tutarken, steril bir Petri plaka kapağı üzerine bırakın.
NOT: Pedi dışarı zorlamamaya dikkat edin yoksa yırtın. Pedin hangi tarafının alt tabaka olduğunu takip edin.
- Yastık kenarının altında hafifçe bükülmüş spatula slip, baş aşağı kalıp tutarken, steril bir Petri plaka kapağı üzerine bırakın.
- Pedi, 90° açılı spatulayı pedin altına kaydırarak ve aşılanmış kapak kaymasının üzerine yerleştirerek alt-yan aşağı bakteri hücreleriyle tabağa aktarın. 90° açılı spatulayı kullanarak pedi kapak kaymasına karşı temize çıkarın ve hava kabarcıklarını hafifçe bastırın.
- Nemli mendillerdeki fazla nemi çıkarın ve ardından yemeğin kenarına yerleştirin ve yüzeye dokunmadığından emin olun. Örnek görüntüleme için hazır.
7. Canlı görüntüleme için mikroskobun kurulması
- Deneysel kurulumdan en az 2 saat önce 37 °C'ye kadar sıcak çevre odası.
- Brightfield ve floresan görüntüleme için mikroskop, bilgisayar ve ışık kaynakları dahil olmak üzere tüm bileşenleri açın.
- Görüntüleme yazılımını açın ve ışık kaynaklarının bağlı ve çalışır durumda olduğundan emin olun.
- Tüm görüntü düzlemlerini hizalamak için Köhler aydınlatma27 gerçekleştirin.
- İlk olarak, bir "kukla" çanak kullanarak 20x hedefi ile odak işaretli coverslip getirmek. Kondansatör taretinin "açık" konuma ayarlandıklarına emin olun.
NOT: Görüntü düzlemlerini düzgün bir şekilde hizalamak için her benzersiz amaç/örnek için Köhler aydınlatması yapılmalıdır. Ancak, odak ve düşük büyütme üzerinde "kukla" çanak ile uyum kurulum ve deneme başlangıç zamanı arasındaki zamanı sınırlamak için daha yüksek büyütme canlı numuneler üzerinde kurulum hızlandırır. - Kondansiyi odakla.
- Alan diyaframını kapatın.
NOT: Sekizgen şekilli bir diyafram açıklığı görünmelidir. Kondansatör tamamen odak dışında ise, tüm görüş alanı (FOV) koyu görünür. - Sekizgen kenarlar net olana kadar kondansatör odaklama düğmelerini döndürün.
NOT: Görüntü düzlemleri doğru hizaya yaklaştıkça ışık yoğunluğu artacaktır.
- Alan diyaframını kapatın.
- Kondansiyi hizala.
- Hizalama düğümlerini ayarlayarak alan kondansini ortala.
NOT: Sekizgen FOV'un ortasına ortalanmalıdır. Hizalama düğümleri mikroskoba bağlı olarak değişir. Örneğin, bazı mikroskop kondansatörleri tonoblara sahipken, bazılarında tornavida gerektiren vidalar vardır.
- Hizalama düğümlerini ayarlayarak alan kondansini ortala.
- Lamba filamentine odaklanın ve kondansatör diyaframAçıklığını ayarlayın.
- Hedefin arka odak düzlemini gözlemlemek için ışık yoluna bir faz teleskopu veya Bertrand lens yerleştirin.
NOT: İki eşmerkezli daire olmalıdır. - Halkalar net görünene kadar Bertrand lens odak düğmesini çevirin.
- Bertrand lensini ışık yolundan çıkarın.
- Hedefin arka odak düzlemini gözlemlemek için ışık yoluna bir faz teleskopu veya Bertrand lens yerleştirin.
- Sekizgen FOV'un hemen dışında olana kadar alan diyaframını açın.
- 100x hedefine değiştirin ve bir damla daldırma yağı eklemeden önce eşleşen faz halkasını yerine kaydırın ve hazırlanan numune kabını en üste yerleştirin.
- Bakteriyel örnek çanak ile 100x objektif Köhler aydınlatma gerçekleştirin.
- İlk olarak, bir "kukla" çanak kullanarak 20x hedefi ile odak işaretli coverslip getirmek. Kondansatör taretinin "açık" konuma ayarlandıklarına emin olun.
- Sadece ince ayar kullanarak bakterilere odaklanın. FOV'daki bakteriler mercek boyunca odaklandıktan sonra, mikroskoptaki kamera düğmesine basarak ışık yolunu kameraya çevirin.
- Görüntüleme yazılımında Aşama seçeneğini tıklatın.
- Yazılımdaki ışık kaynağını seçerek ve kullanılmak üzere istenilen ışık yüzdesini el ile girerek veya Çubuğu ışık yüzdesi ölçeğinde kaydırarak yayılan DIA LED ışığının yüzdesini ayarlayın.
- Dia LED ışık pozlama süresini, ışık kaynağına tıklayarak ve istenilen pozlama süresini manuel olarak girerek veya sağlanan açılır menüden bir pozlama süresi seçerek ayarlayın.
NOT: Pozlama süresi kullanılan kameraya bağlı olarak değişir. - Floresan kullanıyorsanız, ilgili her kanaldaki kamera ayarlarını (örneğin, TxRed, GFP) floresan kanalına tıklayarak ayarlayın.
- Yayılan floresan ışığının yüzdesini ayarlayın, ardından pozlama süresini ayarlayın (DIA LED ışığı için 7,7 ve 7,8 adımlarında yapıldığı gibi).
- Alternatif olarak, görselleştirme denetimleri açılır menüsündeki diğer bit derinliği seçeneklerinden birini seçerek dinamik aralığı ayarlamak için bit derinliğini değiştirin.
- Edinme denetimleri menüsündeki XY seçeneğini tıklayarak ilgi çekici XY konumlarını seçin.
- Sahne konumunu sevinç çubuğuyla veya ekrandaki FOV'u tıklatıp sürükleyerek taşıyın ve belirli bir konumun X ve Y koordinatlarını kaydetmek için boş kutuya tıklayın.
NOT: En fazla üç farklı XY pozisyonunun seçilmesi, mümkün olduğunca birbirine yakın, hızlandırılmış edinim için önerilir.
- Sahne konumunu sevinç çubuğuyla veya ekrandaki FOV'u tıklatıp sürükleyerek taşıyın ve belirli bir konumun X ve Y koordinatlarını kaydetmek için boş kutuya tıklayın.
- Satın alma kontrol menüsünün XY sekmesindeki PFS kutusunu tıklatarak veya joy stick kontrol panelindeki PFS düğmesine basarak mükemmel odak sistemini (PFS) açın.
- Bakteri hücrelerine odaklanmak için ince ayar düğümlerini döndürün.
- Hücreler istenilen odak düzleminde olduktan sonra her XY konumu için PFS düğmesini tıklatın.
NOT: PFS, zaman atlamalı deneyler sırasında Z eksenindeki sürüklenmeyi telafi eder. Bu zaman içinde bakteri hücrelerinin odak korumak için gereklidir. Farklı üretimler farklı kompanzasyon sistemlerine sahiptir. - Edinme denetimleri menüsündeki seçeneklerden seçim yaparak her kanal için satın alma aralığı ve sıklığı (örneğin, faz kontrastı ve her florofor) dahil olmak üzere görüntü edinme koşullarını seçin.
NOT: Burada sunulan deneylerde faz kontrastı görüntüleri her 5-10 sn aralıklarla elde edilirken, GFP ve TxRed kanallarındaki floresan görüntüler her 20 dakikada bir elde edilir. - Mikroskop ve edinme ayarları ayarlandıktan sonra görüntülemeye başlayın.
8. İsteğe bağlı: Canlı/ölü görüntüleme için modifikasyonlar
- M8T'nin 10 mL'sinde %2 agarose eritin ve 50 °C su banyosunda en az 15 dakika soğumaya bırakın.
- Erimiş agarose propidium iyodür 1 mM ekleyin.
- Soğuduktan sonra, hazırlanan kalıpta 915 μL agarose.
- Kapağı açık bırakın ve 30 dakika oda sıcaklığında ped kuru maya bırakın. Işıktan koruyun.
- Kapağı kapağı ile çanak ve ek bir 2 saat oda sıcaklığında bırakın.
- Nem mendilleri hazırlayın.
- Tüy bırakmayan bir kağıdı sıkıca yuvarlayın.
- Mendili steril bir Petri kabına yerleştirin ve menisine 500°L steril su ekleyin.
- 37 °C'de 1 saat kuluçkaya yatırın.
- 37 °C'de 1 saat boyunca pedi ve steril 35 mm çanak kuluçkaya yatırın.
- Bölüm 6'da belirtildiği gibi çanak aşılamaya devam edin: Bakteri hücrelerinin hazırlanması ve aşıpedleri.
9. Veri analizi
- Hücrelerin tanımlanması
- Görüntüleme yazılımındaki görüntü dosyasını açın ve dosyayı yalnızca izleme için kullanılacak çerçeveleri içerecek şekilde kırpın, ilgi hücrelerine yakınlaştırın ve yalnızca faz kontrast ı sevesi kanalında.
NOT: Kırpılan dosya, izleme verilerinin özgün dosyaya müdahale etmeden depolanabileceği yeni bir dosya olarak kaydedilebilir. - Çözümleme denetimleri menüsünde ilgi çekici bölgeleri (YG) seçme seçeneğini seçin ve analiz için kullanılacak ilk karedeki tek tek bakteri hücrelerini veya hücre kümelerini izleyerek ROI'ları tanımlayın.
NOT: ROI'lar el ile veya ikili olarak tanımlanabilir.- Yatırım Getirisini el ile tanımlayın
- RoI'ları el ile tanımlamak için her bir bakteri hücresinin veya hücre kümelerinin çevresini izlendirin.
NOT: Analiz yazılımında, P. aeruginosa, veya diğer çubuk şekilli hücreler, Ellips Yatırım Getirisi seçilerek ve bakteri hücresinin boyutuna göre ayarlanmış bir elips çizilerek elle izlenebilir. Alternatif olarak, çokgen yatırım getirisi seçeneği, hücre kümeleri gibi geleneksel olmayan şekilli ROI'ları izlemek için seçilebilir.
- RoI'ları el ile tanımlamak için her bir bakteri hücresinin veya hücre kümelerinin çevresini izlendirin.
- İkili ROI'ları tanımlayın
- İkili ROI'ları tanımlamak için İkili YG seçeneğini tıklatın.
NOT: Nesneler, faz kontrast ı kanalındaki daha açık pikselli arka plandan koyu pikselli bakteri hücrelerinin ayrılmasına dayanan ikili bir katmanda tanımlanır. - Hücreleri eşlemek için çözümleme denetimleri menüsünde Eşik seçeneğini belirleyin. İlgi kanalını seçin ve eşik aralığı değerlerini ayarlamak için floresan histogramındaki çubukları kaydırın.
NOT: ROI'lar için ikili nesne tanımlaması, bakteri hücrelerinin eşiğine gelindiğinde floresan görüntülerde de tanımlanabilir. Eşik, hangi floresan yoğunluklarının nesne olarak kabul edilir ve hangi floresan yoğunlukları arka planı oluşturur.
- İkili ROI'ları tanımlamak için İkili YG seçeneğini tıklatın.
- Yatırım Getirisini el ile tanımlayın
- Görüntüleme yazılımındaki görüntü dosyasını açın ve dosyayı yalnızca izleme için kullanılacak çerçeveleri içerecek şekilde kırpın, ilgi hücrelerine yakınlaştırın ve yalnızca faz kontrast ı sevesi kanalında.
- Hücre izleme
- ROI'ları el ile izlemek için, görüntüleme dizisindeki bir sonraki kareyi seçin ve her YG'yi orijinal bakteri hücresinin yeni konumuyla hizalamak üzere tıklatıp sürükleyerek ROI'ların konumunu ayarlayın.
NOT: Bakteri hücrelerinin konumları değişmemişse, ROI'ların taşınması gerekmez. - Hücrelerin izlendiği tüm sıralı karelerde tekrarlayın.
- Hücreler bölündükçe, adım 9.1'de açıklandığı gibi, kız hücreleri yeni ROI'lar olarak tanımlayın ve yeni bölünmüş hücreleri izlemeye başlayın.
NOT: Hücreler ikili olarak tanımlanırsa, seçili karelerde ROI'ları otomatik olarak izlemek için Parça İkilileri işlevini kullanın. - Hücreler seçili tüm kareler boyunca izlendikten sonra, analiz edilecek verileri dışa aktarın.
- Veri tablosunu açın ve analiz için gereken ölçümleri (örneğin, nesne hızı, ivme veya yol uzunluğu) tanımlayın.
NOT: Yönlendirselliğin ölçülmesi durumunda Yol Uzunluğu ve Çizgi Uzunluğu ölçümleri gereklidir. Çizgi Uzunluğu, Öklidizya mesafesinin veya pist inden S. aureus kolonisinin kenarına doğru düz bir mesafenin ölçümüdür. Yol Uzunluğu, biriken mesafenin veya tüm çerçevelerden parça segmentlerinin toplamının bir ölçüsüdür. Yönlendirilme, Ökaryodi uzaklığı, D(E), (Çizgi Uzunluğu), birikmiş mesafe, D(A), (Yol Uzunluğu) oranı olarak hesaplanabilir.
- ROI'ları el ile izlemek için, görüntüleme dizisindeki bir sonraki kareyi seçin ve her YG'yi orijinal bakteri hücresinin yeni konumuyla hizalamak üzere tıklatıp sürükleyerek ROI'ların konumunu ayarlayın.
- Floresan nicelleştirme
- Adım 9.1'de açıklandığı gibi floresan bakteri hücreleri için ROI'ları tanımlayın.
- Kalan floresan çerçevelerde bakteri hücreleri veya kümeler için ROI'ların izini veya hareketini tekrarlayın.
- Floresan yoğunluğunun analizi için oluşturulan tabloyu elektronik tablo dosyasına dışa aktarın.
- Veri tablosunda, izlenen bakteri hücresi(ler) Yatırım Getirisi için ortalama floresan yoğunluğunu temsil eden "Ortalama Yoğunluk" sütununa bakın.
- Zaman içinde floresan daki değişimlere bakmak için Ortalama Yoğunluk değerlerini grafiklendirin.
NOT: Floresan'ın zaman içinde değişimi, floresan olarak etiketlenmiş gen için gen ekspresyonundaki dalgalanmayı temsil eder.
Sonuçlar
Açıklanan yöntemin başarılı bir şekilde kullanılması, türler arası etkileşimlerin zaman içinde gözlemlenebildiği bir video oluşturan bir dizi kareyle sonuçlanır. Şekil 1'deki şema, görüntüleme için malzemelerin hazırlanmasında yer alan önemli adımları vurgulamak için görsel bir görüntü sağlar. Bu yöntemin kullanımı S. aureusile coculture karşı monokültür farklı davranışlar sergileyen P. aeruginosa hücrelerinin gösteri izin verdi. S. aureusile birlikte, P. aeruginosa S. aureus kolonilerine doğru tek hücreli hareketliliği artırdığında , sallarda gruplanmış kalan monokültürdeki P. aeruginosa hücreleri ile karşılaştırıldığında (Şekil 2A-2B). Floresan etiketli bakteriyel suşlar da bakteri türlerinin karışık popülasyonları görselleştirmek için izin verir. GFP etiketli P. aeruginosa kullanarak, P. aeruginosa tek hücre hareketlilik artışı ndan sonra, onlar çevreleyen ve sonunda S. aureus kolonileri işgal gözlem izin(Şekil 2C). Floresan işaretli hücrelerin kullanımı da ilk kez S. aureus kolonileri içine P. aeruginosa hücre istilası görselleştirilmesi için izin verir(Şekil 2C, alt).
Protokol türler arası etkileşimleri gözlemlemek için yüksek kaliteli görüntüler sağlarken, kalitesiz kare dizilerine yol açabilecek çeşitli yaygın sorunlar vardır. Deney süresi boyunca tutarsız nem ve yanlış kurutulmuş pedler, pedin kaydırılmasından ve hücreleri FOV'dan dışarı sürüklemesinden kaynaklanan sürüklenmeye yol açan iki yaygın sorundur(Şekil 3A). Nemdeki değişiklikler agarose pedlerin kuruluğunu etkiler. Artan nem pedleri çok ıslak hale getirir, nem yastık ve cam alt çanak alt arasında yerleşmek için izin. Nem, hareketli hücrelerin akın etmesi veya yüzmesi için yeterince kalın bir sıvı tabakası bırakır ve bakteri hücrelerini tek bir düzlemde tutmaz. Bu arada, nem azalmaları daha hızlı yastık kuru, hangi hücrelerin erken sürüklenme neden olur. Floresan ile bu yöntemi kullanırken başka bir yaygın hata çok sık floresan görüntüleri elde veya çok uzun süre floresan ışığa bakteri hücreleri maruz olduğunu. Floresan görüntüler için kısa edinme aralıkları, belirli bir dalga boyunda yüksek yoğunluklu ışıkla floroforları tekrar tekrar heyecanlandırır. Heyecanlı floroforlar daha sonra oksijen ile reaksiyona girer ler ve floroforun bozulmasına neden olur. Ortaya çıkan fotobeyazlatma, floroforun daha fazla ifade edilip katlanabilir kadar floresan tüketir, ancak bakteri hücrelerinin kendilerine zarar vermez(Şekil 3B). Ancak floresan kaybı gen/protein ekspresyonunun ölçümlerini engelleyebilir ve florofor tamamen sentezlenene ve tekrar heyecanlanana kadar hücreleri işaretsiz bırakır. Ayrıca, heyecanlı floroforlarla etkileşime girilen oksijen reaktif oksijen türleri (ROS) oluşturabilir. Bu ROS radikalleri daha sonra bakteri hücrelerine zarar vererek toksik hale gelir ve birkaç hücre bölünmesi içinde hücre ölümüyle sonuçlanır(Şekil 3C). Fotobeyaztaz ve fototoksisite süreçleri hücreler floresanlarını tamamen kaybedeceklerinden ve sonraki karelerde hücrelerin bölünmesini durduracağı ve sonunda ölebileceği nden kolayca görülebilir(Şekil 3B-3C). Deneyi kurarken son bir ortak sorun, FOV başına çok fazla hücreyle veya genellikle birbirinden 20 μm'den az olan hücrelerle başlamaktır. İlk karedeki kalabalık hücreler, etkileşimde değil, büyüdükçe birbiriyle birleşen bölünen hücreler kümeleri oluşturur. Buna ek olarak, yakınlık içinde çok yakın başlayan hücreler, diğer türlerin yanıt verebileceği salgılanan sinyallerin bir degradesini oluşturmak için yeterli zamana sahip olmayabilirler(Şekil 3D)oysa uzak bakteri hücreleri deney süresince birbirleriyle karşılaşma şansına sahip olmayabilirler.
Şekil 4, agarose pedlerine propidium iyodür ekleyerek bu protokolle bakteri hücresi canlılığının nasıl görselleştirilebildiğini gösteren bir örnektir. Propidium iyodür canlı hücreler için geçirimsizdir, ancak hasarlı membranlara sahip hücrelere girebilir ve nükleik asitlere bağlanabilir. Burada orta günlük GFP etiketli WT S. aureus tek başına medya ile tedavi edildi veya hücre içermeyen supernatant P. aeruginosa türetilmiş ve hemen tedaviden sonra görüntülenmiştir. Üç farklı kanal görüntülendi: Faz, TxRed ve GFP. Parlak yeşil hücreler, S. aureus'un sadece medya ile tedavi edildiği gibi GFP'yi aktif olarak ifade eden canlı hücreleri gösterir(Şekil 4A),ve kırmızı hücreler P. aeruginosa supernatant(Şekil 4B)ile tedavi edildikten sonra ölü propidium iyodür-lekeli S. aureus hücrelerini gösterir. Yalnızca bir zaman noktası gösterilmiş olsa da, bu yöntem hızlandırılmış canlı görüntüleme sırasında hücre canlılığını belirlemek için uyarlanabilir.
Türler arası etkileşimlerin yönlerini ölçmek için çeşitli görüntüleme sonrası analizler yapılabilir. Örneğin, hücre izleme S. aureus bir küme doğru P. aeruginosa tek hücre hareketleri yönlendirilme ölçümleri sağlayabilir. Bireysel P. aeruginosa hücrelerinin hareketleri, hücrenin S. aureus kümesine ulaştığı çerçeveden sal bıraktığı çerçeveden izlenir (Şekil 5A). P. aeruginosa salı ile S. aureus kümesi arasındaki mesafe Öksiklit uzaklığı sağlarken,toplampist uzunlukları birikmiş mesafeyi sağlar, D(A) (Şekil 5B). Her hücrenin yönelimliliği D(E)/D(A)oranı olarak hesaplanır. Coculture deneylerinde, WT P. aeruginosa S. aureus ΔagrBDCAdoğru önemli ölçüde daha yüksek yönelimlilik ile WT S. aureus doğru hareket etti , Agr-regüle salgılanan faktörler eksik bir mutant, daha önce S. aureus24 doğru yönlü hareketlilik için gerekli olduğu belirlenen (Şekil 5C).
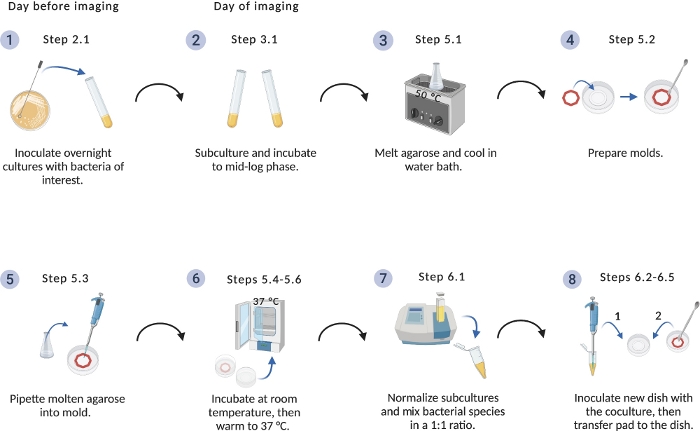
Şekil 1: Görüntüleme kurulum protokolü şeması.
Bakteri kültürleri ve agarose pedleri hazırlanması için kritik adımlar genel bakış. BioRender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
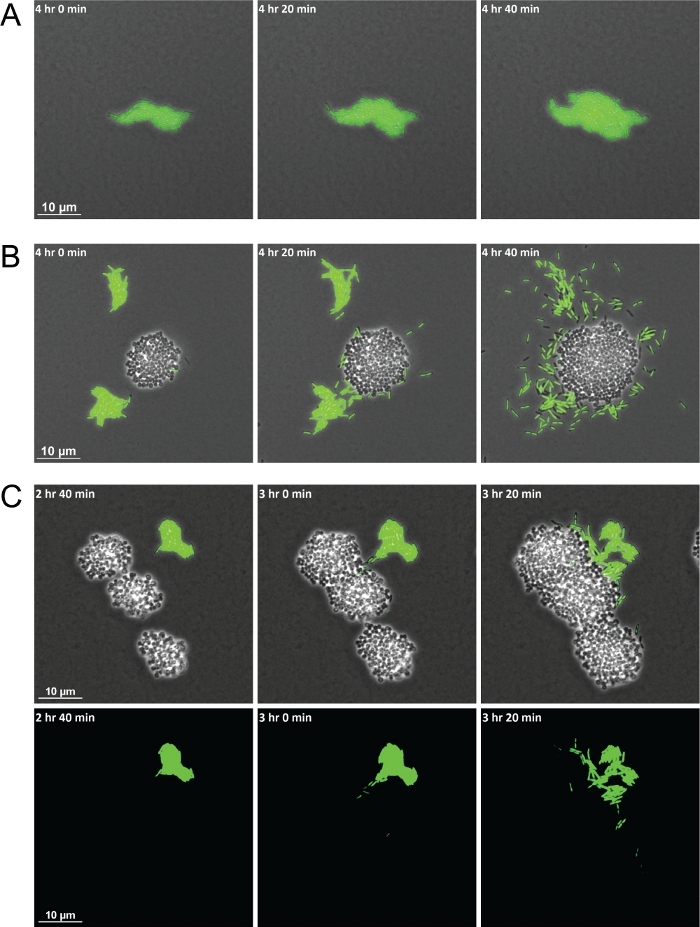
Şekil 2: Zaman atlamalı, canlı görüntüleme mikroskobu S. aureus ile birlikte p. aeruginosa davranışında farklılıklar göstermektedir.
P. aeruginosa (basilli, yeşil) monokültür(A)ve S. aureus (cocci, işaretsiz)(B)ile coculture temsili snap snap çekim. (C) Floresan etiketli bakteriler, S. aureus kümelerini istila eden P. aeruginosa tek hücrelerinin görüntülenmesine olanak sağlar. Faz kontrastı ve GFP kanal kaplaması (üstte) ve GFP kanalı tek başına (altta). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
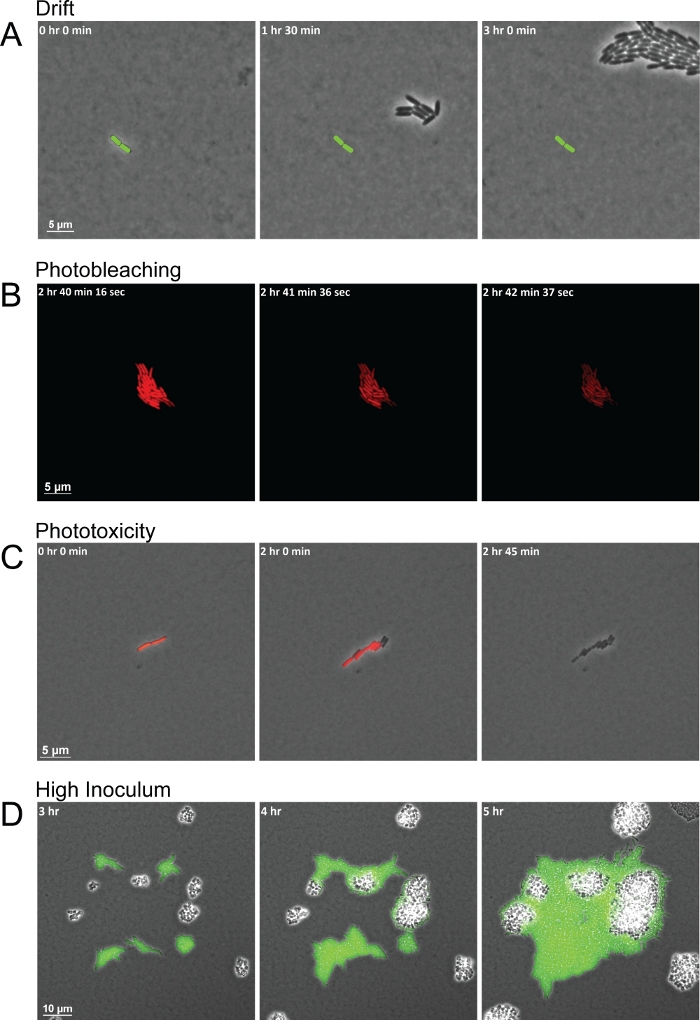
Şekil 3: Kötü görüntü edinimine yol açan yaygın görüntüleme sorunlarının temsili anlık görüntüleri.
(A)Yanlış kurutulmuş pedler ve tutarsız nem görüntüleme süresi boyunca FOV boyunca hücrelerin sürüklenme yol açar. Kurucu hücrenin konumu her karede (yeşil çubuk) işaretlenir. (B) Çok uzun süre ışığa maruz kalma fotobeyazner bir süre için floresan tespit düzeylerini tüketmek, ancak hücreleri öldürmez. (C) Fototoksisite, ışığa sık sık maruz kalma sonucu hücre ölümüne yol açar. Fototoksisitenin ilk belirtileri hücreler floresanmayı durdurup bölünmeyi başaramadıklarında görülür. (D) FOV'daki yüksek baş inokül, hücreleri kalabalıklar ve türler arası etkileşimlerin gözlemlemesini engeller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
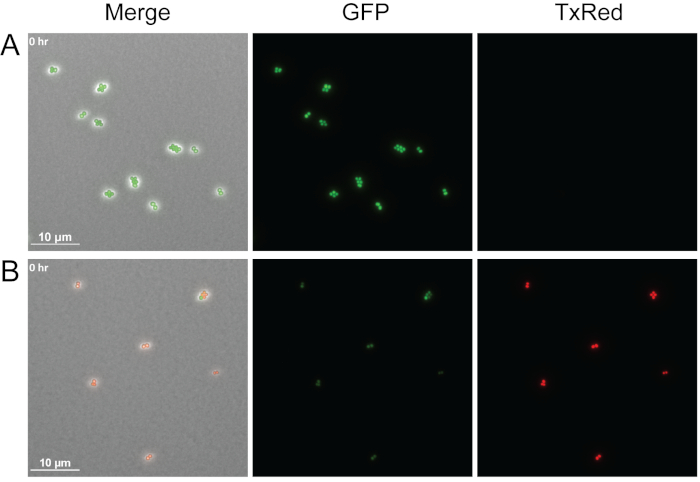
Şekil 4: Canlı ile ölü S. aureus hücrelerinin karşılaştırılması.
GFP etiketli WT S. aureus için temsili anlık çekim ya orta tek başına tedavi (A) veya hücresiz P. aeruginosa supernatant (B). Tedavinin ardından hücreler hemen görüntülendi. Canlı hücreler (yeşil) aktif GFP ifade ve propidium iyodür hariç, ölü hücreler (kırmızı) GFP floresan ve membran permeabilizasyonu kaybetmek propidium iyodür hücrelere girmek ve nükleik asitler bağlamak için izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: S. aureusile birlikte p. aeruginosa hücre izleme analizi .
Daha önce, bu yöntem wt veya ΔagrBDCA S. aureusile coculture WT P. aeruginosa hücre izleme gerçekleştirmek için yöntem kullanılmıştır. (A) S. aureus ΔagrBDCAile bir coculture P. aeruginosa tek hücreli parça gösterimi . (B) Ökaryo uzaklığı şeması (D(E)) ve birikmiş mesafe (D(A)ölçümleri yönlendirselliği belirlemek için kullanılır ((D(E)/D(A)). (C) WT ve ΔagrBDCA S. aureusile birlikte tek WT P. aeruginosa hücrelerinin yönlendirilmislik ölçümleri . Bu rakam Limoli ve ark. 201924'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan yöntemler, hücre izleme ve hücre canlılığının izlenmesi de dahil olmak üzere diğer uygulamalar için değişiklikler ile tek hücre düzeyinde bakteri türleri etkileşimlerinin canlı hücre görüntüleme için bir protokol açıklar. Bu yöntem, mikroorganizmaların zaman içinde diğer türlerle birlikte tek hücreli davranışlarını incelemek için yeni yollar açılmaktadır. Özellikle protokol, özellikle hem yüzey hem de sıvı ile ilişkili uzantıları olan organizmaların hareketliliği incelerken bakteriyel yüzey davranışlarını gözlemlemede bu cokültür yönteminin yararlılığını göstermektedir. Örneğin, tek bir odak düzleminde bakteri hareketini bir yüzeyle sınırlandırarak, S. aureus'a yanıt olarak P. aeruginosa'nın artmış ve yönlü pili aracılı hareketliliği görüntülenebilir.
Daha önce de belirtildiği gibi, bu görüntüleme yöntemi ile en iyi sonuçları elde etmek, numune nin ve görüntüleme cihazlarının (yani hedefler ve aşama) sıcaklığı ve nemi de dahil olmak üzere çeşitli koşulların göz önünde bulundurulması nı gerektirir. Daha fazla ipucu ve sorun giderme için Ek Dosya 1'ebakın. Protokolün başarılı bir şekilde kullanılmasında kritik bir adım agarose pedleri hazırlanması, yetersiz kurutma pedleri en yaygın sorunlardan biri olduğu gibi. Şekil 3A'dagösterildiği gibi , pedler yeterince uzun süre kurutulmamışsa, zaman atlamalı görüntülemenin başlangıcında sürüklenme görülür, oysa çok uzun süre kurutulan pedler küçülmeye başlar ve hücreler birkaç saat içinde FOV'dan görüntülemeye doğru sürüklenir. Tüm malzemelerin deney süresince tek tip sıcaklık ve nemde, sahne başı bir kuluçka makinesi ve nemli tüy bırakmayan mendil ler kullanarak önceden ısıtılmasını ve nem de muhafaza edilmesini sağlamak, sürüklenmenin azaltılmasına yardımcı olacaktır. Ayrıca, ilk pedin düzgün kurutulması veya kalıptan numune çanağa aktarılması sırasında gözyaşı nın kurutulması durumunda her zaman yedek ped yapılması tavsiye edilir. Ayrıca, düşük otofloresan si kullanmak önemlidir, bakteri kültürleri büyüyen hem de hücreleri görüntülerken ortamdan arka plan floresanenen en aza indirmek için pedleri yapmak için. Zengin ortam genellikle yüksek otofloresansa sahip olduğundan, mikroskopi için minimal ortam kullanılması tavsiye edilir. Düşük yoğunluklu inokül ve Hatta FOV hücrelerinin mekansal dağılımı ile başlayan bu yöntemde önemli faktörlerdir. Özellikle, P. aeruginosa ve S. aureus etkileşimlerini değerlendiren önceki çalışmalarda, bu bakteri daha sonra mevcut diğer türler tarafından tespit edilebilir salgılanan faktörlerin yeterli bir gradyan oluşturmak için izin(Şekil 2B).
Bu yöntemin faydalarına rağmen, fiyatı, düşük iş akışı doğası, floresan kısıtlamaları ve çevre koşullarını kontrol etme de dahil olmak üzere sınırlamalar da vardır. Şekil 3B-3C floresan mikroskopi kullanımının önemli sınırlamalarını göstermektedir. Sonuçlar bölümünde anlatıldığı gibi, floresan görüntüler kısa aralıklarla yakalanırsa fotobeyaztlama ve fototoksisite oluşabilir. Bu iki sonucu önlemek için floresan görüntü aralıkları yeterince uzak ve florositli Florofor'u yeterince görselleştirmek için mümkün olduğunca düşük floresan ışığa maruz kalma süresi ile alınmalıdır. Ayrıca, floresan görüntüleme için aralık belirlenirken, her florofor olgunlaşma süresi dikkate almak önemlidir. Şekil 2, Şekil 3 ve Şekil 4'tegösterilen P. aeruginosa ve S. aureus suşlarında kullanılan floroforlar yaklaşık 20 dakikalık bir olgunlaşma süresine sahiptir ve bu nedenle potansiyel fotobeyazrlama etkileri endişesi olmaksızın her 20 dakikada bir heyecanlanabilir. Bu arada, bu yöntemin bir diğer dezavantajı hücreler yüksek hücre yoğunluğuna ulaştığında geç türler arası etkileşimlerin gözlemlerine izin vermemektir. Tek tek bakteri hücrelerini görselleştirmek için, tek bir odak düzleminde kalmaları gerekir. Ancak, bir kez nüfus yüksek hücre yoğunluğu ulaşır, hücreler birden fazla düzlemde büyümeye başlar.
Bu yöntem, hücre canlılığı (Şekil 4) ve ilgi genlerinin ekspresyonu (veriler gösterilmez) gibi farklı fenotipleri incelemek için değiştirilebilir. Şekil 4, agarose pedlerine propidium iyodür ekleyerek yöntemin bakteriyel canlılığı görselleştirmek için nasıl uyarlandığınıgösteren bir örnek göstermektedir. Bu yöntemin bir diğer uygulaması da floresan muhabirler aracılığıyla başka bir organizmaile birlikte bakterigen/protein ekspresyonunun ölçülmesidir. Örneğin, birden fazla florofor aynı anda farklı gen veya proteinlerin ekspresyonunu incelemek için bir plazmid vektör veya bakteri kromozomu dahil edilebilir. Burada örtüşen uyarma ve emisyon spektrumları olmayan floropororları seçmek önemlidir. Son olarak, post-görüntüleme analizinde bakteri hücresi takibinin kullanılması yönlülüğünü sağlar (Şekil 5), hız ve ivme, diğer ölçümler arasında,24olarak da hesaplanmalıdır.
Genel olarak, daha önce açıklanan monokültür protokollerinden uyarlanan bu coculture görüntüleme yöntemi, birden fazla bakteri türünün eşkültürdeki davranışlarını görselleştirme yeteneğini geliştirir. Bu yöntem, her türün davranışlarını tek hücreli bir şekilde nasıl değiştirdiğini niçin daha iyi anlayacak ve sonuçta bakteri türlerinin polimikrobiyal ortamlarda nasıl etkileştiğine dair yeni bir fikir veren karışık kültür perspektifinden mikropları inceleme fırsatı sunmaktadır.
Açıklamalar
Yazarlar açıklayacak bir şey olmadığını beyan ediyorlar.
Teşekkürler
Bu çalışma Kistik Fibrozis Vakfı Postdoc-to-Fakülte Geçiş Ödülü LIMOLI18F5 (DHL), Kistik Fibrozis Vakfı Junior Faculty Recruitment Award LIMOLI19R3 (DHL) ve NIH T32 Eğitim Hibe 5T32HL007638-34 (ASP) tarafından finanse edilerek desteklenmiştir. Jeffrey Meisner, Minsu Kim ve Ethan Garner'a görüntüleme ve ped yapımı için ilk protokolleri ve tavsiyeleri paylaştıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
Referanslar
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385 (2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232 (2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56 (2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976 (2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365 (2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır