Method Article
単細胞間細菌相互作用の運動的可視化
要約
この生菌細胞イメージングプロトコルは、時間の経過とともに単一細胞レベルで複数の細菌種間の相互作用を可視化することを可能にする。タイムラプスイメージングは、個々の細胞の運動性および生存率を含む多種細菌群集における種間相互作用を尋問するために、単一培養または共培養における各細菌種の観察を可能にする。
要約
多微生物群集は自然界でユビキタスであるが、単細胞レベルでの相互作用の研究は困難である。このように、2つの細菌病原体間の種間相互作用を観察するための顕微鏡ベースの方法が開発された。この方法を用いて、モチルグラム陰性病原体、 緑膿 菌および非可動性グラム陽性病原体との相互作用を問い合う方法を用 いることが、 ここで実証されている。このプロトコルは、カバースリップとアガロースパッドの間の各種を共同接種することで構成され、細胞を単一平面に維持し、空間と時間の両方で細菌の挙動を視覚化することができます。
さらに、ここで示したタイムラプス顕微鏡は、単一培養や他の種との共培養における細菌種運動性の変化を含む、2種以上の細菌種間で起こる初期の相互作用を視覚化するのに理想的である。顕微鏡の設定では限られたサンプル空間の性質上、このプロトコルは、細胞集団が高すぎると細菌種間の後の相互作用を研究するために適用されにくい。しかし、生きた細菌細胞や死んだ細菌細胞のイメージングのための染色の使用、蛍光レポーターによる遺伝子またはタンパク質発現の定量、単一種および多種実験の両方における細菌細胞の動きを追跡するプロトコルのいくつかの異なる用途があります。
概要
多微生物群集は、環境,1、2、3、2および1人間のニッチ34、55の様々なにまたがる4自然界で一般的です。ヒト疾患における最も悪名高い多微生物感染症のいくつかは、歯科バイオフィルム6、慢性創傷77、8、8慢性閉塞性肺疾患9、人工呼吸器関連肺炎10、および遺伝性疾患嚢胞性線維症(CF)11、12を有する個人における11,12呼吸器感染症を含む。これらの感染症は、多くの場合、多様な微生物種で構成されています。しかし、最近では、グラム陽性菌黄色ブドウ球菌とグラム陰性菌シュードモナス・エルギノーサとの相互作用に注目が集まった。これらの生物に対してコイン感染した患者およびインビトロ分析を含む研究は、疾患の進行、微生物の生存、病原性、代謝および抗生物質感受性に深い影響を及ぼす可能性のある競争的および協力的相互作用の両方を明らかにする(Hotterbeekxら201713とリモリとホフマン20193によって詳細にレビュー)。
感染時の種間相互作用への関心の高まりは、多微生物群集行動を研究するための様々な方法をもたらしました。典型的には、これらの研究は、単一培養と共培養の表現型の違いを調査するためにプレートまたはブロスベースのアッセイを利用している。例えば、固体表面上のP.緑素吸草およびS.アウレウスをコキュリングすることは、コロニー表現型、顔料、または多糖産生14、15、1615,16の成長阻害または変化の視覚化14を可能にした。混合種バイオフィルムは、生物または生物的表面上、ならびに液体培養における細菌種の交成も、遺伝子およびタンパク質発現17、18,18に加えて、成長、代謝、抗生物質耐性、競合および生存率の変化の測定を可能にした。これらのバルク培養実験は、P.緑素吸盤とS.アウレウスがコミュニティ規模でどのように影響を与えるかについての洞察を明らかにしているが、単一細胞レベルで起こる相互作用に関する重要な質問に答えることができない。ここで示す方法は、時間の経過とともに共培養されたコミュニティ内の単一細胞の動き、細胞生存率、および遺伝子発現の変化に焦点を当てることによって、種間相互作用を研究するためのアプローチを追加します。
単一細胞相互作用は、細胞のバルクコミュニティで行われる相互作用とは大きく異なる場合があります。単一細胞解析を通じて、コミュニティ内の異質性を定量化して、細胞の空間配置がコミュニティダイナミクスに与える影響や、グループの個々のメンバー内での遺伝子およびタンパク質発現レベルの変化を研究することができます。また、追跡セルは、複数の世代を通じて、単一のセルがどのように移動し、動作するかを把握できます。細胞の動きと遺伝子発現の変化を同時に追跡することで、遺伝子の変動とそれに対応する表現型との間に相関関係を作ることができます。単細胞レベルで個々の細菌種を研究するための以前のプロトコルが記載されている。これらの研究は、単一の平面における経時の生画像細胞を利用し、細胞分裂および抗生物質感受性19,20,20のような表素型を観察するのに有用であった。付加的な生画像顕微鏡は単一細菌種21、22、23,22,23の成長、運動性、表面の植民地化およびバイオフィルム形成を監視するために利用されている。しかし、これらの研究は、単一培養における細菌の生理学を理解するための洞察力を有するが、共培養における複数の細菌種の単細胞挙動を観察するための実験は限られている。
ここでは、単一種のイメージングに使用される以前のプロトコルは、P.緑素吸草症とS.アウレウスの相互作用を研究するために適応されてきた。これらの生物は、その細胞形態に基づいて位相コントラスト下で分化することができる(P.緑分症はバチルス及びS.アウレウスはコッシである)。この方法の開発は、最近、S.アウレウス24の存在下でのP.緑内因性の以前に記述されていない運動性行動の可視化を可能にした。P. aeruginosaは、遠くからS.アウレウスを感知し、S.アウレウス細胞のクラスターに向かって増加し、方向単一細胞の動きに応答することができることが判明した。P.アウレウスに向かう緑素吸い動きはIV型ピリ(TFP)を必要とすることが分かったが、その協調的な伸張と引き込みが筋状運動性25と呼ばれる動きを生み出す毛髪状突起。
これらの研究は、種間の以前の相互作用を尋問するためのこの方法の有用性を示している。しかし、後で相互作用する時点で高い細胞密度でのイメージングは、細胞の単一層を識別できなくなったため困難であり、これは主にポストイメージング解析中に問題を引き起こす。この制限を考えると、この方法は、後の相互作用を代表する高い細胞密度で従来の巨視アッセイをフォローアップできる以前の相互作用に最も適しています。この方法の追加の制限は、一度に1つのサンプルしか画像化できないので、低スループットの性質と、顕微鏡、カメラ、および環境室のコストが含まれます。また、蛍光顕微鏡は、光毒性や光漂白などの細菌細胞にリスクをもたらし、蛍光画像を取得できる頻度を制限します。最後に、この方法で使用されるアガロースパッドは、環境の変化に対して非常に影響を受けやすく、条件が正しくない場合にパッドが収縮または膨張し始めることができることを考えると、温度および湿度などの条件を制御することが重要です。最後に、この方法は宿主環境を模倣するものではありませんが、異なる細菌種が表面でどのように反応するかの手がかりを提供し、環境/宿主状態を模倣するように設計されたアッセイでフォローアップすることができます。
この方法は、単一細胞の動きを追跡する以前の研究とは異なり、細胞はカバースリップとアガロースパッドの間に接種され、細胞を表面に制限する。これにより、単一平面での時間経過に従ったセルトラッキングが可能になります。しかし、細胞が液体26に沈下されたときに観察される過渡的な表面関与のサイクルを制限する。アガロースパッドの下で細菌をイメージングする追加の利点は 、P.緑化 吸引運動性25を調べるために古典的に使用される巨視的なプレートベースのサブ表面接種アッセイを模倣していることである。このアッセイでは、細菌細胞はペトリ皿の底部と寒天の間に接種され、この顕微鏡プロトコルと同様に、接種の点から皿の底を外側に移動する細胞を単一の平面に保ちます。
ここで提示される種間相互作用を視覚化するためのタイムラプス顕微鏡プロトコルは、1)細菌試料およびアガロースパッドを調製し、2)イメージング取得用の顕微鏡設定を選択し、3)画像後分析から構成される。細胞の動きと追跡の詳細な視覚化は位相コントラストによって短時間間隔で画像を集録することによって行うことができる。蛍光顕微鏡は、経時の細胞生存率または遺伝子発現を決定するために利用することもできる。ここでは、アガロースパッドに生用染料を添加して蛍光顕微鏡に適応した例を1つ示す。
プロトコル
注: このプロトコルのすべての供給の完全な説明とカタログ番号は、資料表にあります。
1. M8T最小メディアの作成
- Na2HPO 4・7H2Oの64g、KH222PO4の15g、および2Lボトルに800mLの超純4水(UPW、抵抗率18 MΩ/cm)を溶解して、M8最小塩ベース(5x)の1Lを調製します。pH を 7.6 にする。UPWで1 Lに完全なボリューム。オートクレーブ 45分間
- 1 Lボトルに400mLのUPWに100gのグルコースを溶解して、500mLのグルコース溶液(20%w/v)を調製します。UPWで500 mLに完全なソリューション。オートクレーブ 45分間
- 400 mLのUPWに100 gのトリプトンを溶解して、500 mLのトリプトン溶液(20%w/v)を調製します。UPWで500 mLに完了。オートクレーブ 45分間
- M8+ 10% トリプトン(M8T)の1Lを調製し、200mLのM8最小塩(1x最終)、10mLのグルコース(0.2%最終)、1MLの1mLの1MLを420%のトリプトン(1mM末)に加えて、20%のトリプトン(1%最終)に50mL(1%最終)をUPWの600mLに加えます。UPWで1 Lに完了します。0.2 μmの滅菌フィルターを通して、滅菌500 mLのメディアストレージボトルにフィルターします。
1日目:
2. 細菌性一晩培養物の調製
- P.緑素吸草またはS.アウレウス(適切な場合は抗生物質を含む)の単一コロニーを有するM8T最小培地5mLを接種し、16時間以下のエアー化で37°Cで一晩インキュベートする。
注:細菌病原体 P.緑素吸 体および S.アウレウス は、一般的に慢性感染症から共分離されているため、この方法に使用され、それらの相互作用を研究することは、それらが多微生物感染中の患者の転帰にどのように寄与するかを理解することが重要である。他の細菌種は、研究の焦点に応じて使用することができます。
2日目:
3. 細菌株のサブカルチャー
- サブカルチャー P.緑素吸草症1:500およびS.アウレウス1:1000新鮮なM8Tの5mL(適宜抗生物質を含む)。培養が中間段階(OD 600=〜0.3-0.5)に達600するまで、37°Cでエアー化してインキュベートする。
4. パッド金型用材料の製造
- 平らな端の半分が90°の角度に曲げられるまでブンゼンバーナーで平らで丸い実験室のへらを加熱することによって金属のスパチュラを準備する。別の平らな丸みを帯びた実験室のへらの端を加熱し、わずかに45°Cの角度に最後の10ミリメートルを曲げます。
- 35 mm 皿の中にカビが収まるように、シリコーンモールドの四隅を切り落とします。
- 70%エタノールを加え、ブンゼンバーナーの炎を通してスパチュラとピンセットを殺菌します。
- 70%エタノールで皿とシリコーンモールドを洗浄し、糸くずのないワイプで乾燥させます。
5. アガロースパッドの調製
注:パッドは、このプロトコルで使用される細菌の栄養源としてM8T最小メディアで調製されます。しかし、パッドに使用される栄養素は、異なる生物のために変更することができます。
- M8Tの10mLで2%低溶融アガロースをきれいな50 mLのエルレンマイヤーフラスコに溶かします。フラスコの内容物が沸騰するのを防ぐために、短時間(2〜5s)のマイクロ波を溶液にするまで溶解する。溶けたら、50°Cの水浴で少なくとも15分間冷まします。
- 35mm皿の開口部にシリコーンの切り抜きを合わせて金型を準備し、スパチュラで軽くタップしてシリコーンを皿に固定し、金型と皿の間のすべての気泡を取り除きます。
- 冷めたら、915μLの溶融アガロースを金型に入れます。蓋をアジャルのままにし、パッドを室温で30分間乾燥させます。
- 蓋で皿を覆い、室温でさらに2時間放置します。
- 糸くずのないワイプをしっかりと巻き上げて湿度拭き取りを準備します。滅菌ペトリ皿の中に巻いたワイプを入れ、ワイプ全体に500μLの無菌水を均等に加えます。37°Cまで1時間温める。
- パッドと無菌35mm皿を37°Cに1時間温めます。
細菌細胞の調製と接種パッド
- 各サブ培養のOD600 を測定し 、P.緑素吸塩 をOD600=0.03 に希釈し 、アウレウス を37°Cに予感させたM8T中のOD600=0.10 に希釈する。 P.緑素吸盤 と S.アウレウス を1:1の比率と渦で混ぜます。
注:株が抗生物質を必要とする場合、抗生物質は夜間およびサブカルチャーに添加することができますが、それがコカルチャーの他の種に影響を与える場合は、イメージングのために種を混合するときに追加しないでください。プラスミドの安定性と、共培養中のすべての種に対する抗生物質の影響は、使用されている各生物/プラスミドについて決定する必要があります。 - ピペット1 μLのコカルチャーは、事前に温め、無菌の35mmガラスカバースリップ皿の底を均等に横切ります。
- 滅菌ピンセットを使用して金型からシリコーンカットアウトを取り外します。
- 滅菌スパチュラを使用して皿からパッドを取り外します。
- パッドの端の下でわずかに曲がったへらを滑らせながら、金型を逆さまに保持しながら、滅菌ペトリプレートの蓋に落とします。
注:パッドを押し出さないと、それが裂けないように注意してください。パッドのどちら側が底面かを追跡します。
- パッドの端の下でわずかに曲がったへらを滑らせながら、金型を逆さまに保持しながら、滅菌ペトリプレートの蓋に落とします。
- 90°斜めのへらをパッドの下にスライドさせ、接種されたカバースリップの上に置くことによって、細菌細胞と一緒に皿にパッドを移します。90°の斜めのヘラを使用して、パッドをカバースリップに対してフラッシュし、気泡を軽く押し出します。
- 湿った拭き取りから余分な水分を取り除き、皿の端の周りに置き、パッドに触れないようにします。これで、サンプルのイメージングの準備が整いました。
7. ライブイメージング用の顕微鏡の設定
- 実験セットアップの少なくとも2時間前に37°Cに温かい環境室。
- 明視野および蛍光イメージングのために顕微鏡、コンピュータ、光源を含むすべてのコンポーネントをオンにします。
- イメージングソフトウェアを開き、光源が接続され、動作していることを確認します。
- ケーラー照明27を実行して、すべての画像面を整列させる。
- まず、「ダミー」皿を使用して20倍の目的で焦点を当てるマークされたカバースリップを持って来ます。コンデンサタレットが「開いた」位置に設定されていることを確認します。
注: ケーラーイルミネーションは、イメージプレーンを適切に整列させるために、ユニークな目的/サンプルごとに実行する必要があります。しかし、より低い倍率の「ダミー」皿との焦点とアライメントは、セットアップと実験開始時間の間の時間を制限するために、より高い倍率でライブサンプルにセットアップを促進します。 - コンデンサーに焦点を合わせます。
- フィールドダイヤフラムを閉じます。
メモ:八角形の開口部が表示されます。コンデンサが完全に焦点を合わせなくなると、視野全体(FOV)が暗く表示されます。 - コンデンサのピント合わせノブを、八角形の端がカリカリになるまで回転させます。
注: イメージ プレーンが正しい位置合わせに近づくにつれて、光の強度が増加します。
- フィールドダイヤフラムを閉じます。
- コンデンサを揃えます。
- 位置合わせノブを調整してフィールドコンデンサーを中央に配置します。
注: 八角形は、FOV の中央に中央に配置する必要があります。位置合わせノブは顕微鏡によって異なります。例えば、一部の顕微鏡コンデンサーにはノブがあり、他の顕微鏡にはスクリュードライバーを必要とするネジがあります。
- 位置合わせノブを調整してフィールドコンデンサーを中央に配置します。
- ランプフィラメントに焦点を合わせ、コンデンサの絞りを調整します。
- 位相望遠鏡またはベルトランレンズを光路に入れ、目的の背面焦点面を観察します。
注: 同心円が 2 つあるはずです。 - ベルトランレンズのフォーカスノブを回して、リングが鮮明に見えるようにします。
- ベルトランレンズをライトパスから取り外します。
- 位相望遠鏡またはベルトランレンズを光路に入れ、目的の背面焦点面を観察します。
- 八角形がFOVのすぐ外にあるまで、フィールドダイヤフラムを開きます。
- 100xの目的に変更し、浸漬オイルの滴を追加する前に、一致するフェーズリングを所定の位置にスライドさせ、準備したサンプル皿を上に置きます。
- 細菌サンプル皿で100xの目的でケーラーの照明を行います。
- まず、「ダミー」皿を使用して20倍の目的で焦点を当てるマークされたカバースリップを持って来ます。コンデンサタレットが「開いた」位置に設定されていることを確認します。
- 細かい調整のみを使用して細菌に焦点を当てます。FOV内の細菌が接眼レンズを通して焦点を合わせられたら、顕微鏡のカメラボタンを押してカメラへの光路を切り替えます。
- イメージング ソフトウェアの [フェーズ ] オプションをクリックします。
- ソフトウェアで光源を選択し、使用する光の割合を手動で入力するか、または光のパーセンテージスケールでバーをスライドさせて、放出されるDIA LEDライトの割合を調整します。
- 光源をクリックして、手動で目的の露光時間を入力するか、提供されるドロップダウンメニューから露光時間を選択して、DIA LEDライトの露出時間を調整します。
注意:露光時間は、使用するカメラによって異なります。 - 蛍光を使用する場合は、対象の蛍光チャネルをクリックして、対応する各チャンネル(すなわち、TxRed、GFP)のカメラ設定を調整します。
- 発光する蛍光光の割合を設定し、露光時間を調整します(DIA LEDライトのステップ7.7と7.8で実行)。
- または、[ビジュアリゼーション コントロール] ドロップダウン メニューで他のビット深度オプションのいずれかを選択して、ビット深度を変更してダイナミック レンジを調整します。
- 取得コントロールメニューの XY オプションをクリックして、対象となる XY 位置を選択します。
- ジョイスティックでステージ位置を移動するか、画面上のFOVをクリックしてドラッグし、空のボックスをクリックして特定の位置のXとY座標を保存します。
注:タイムラプス取得には、可能な限り近い3つの異なるXYポジションの選択をお勧めします。
- ジョイスティックでステージ位置を移動するか、画面上のFOVをクリックしてドラッグし、空のボックスをクリックして特定の位置のXとY座標を保存します。
- 取得制御メニューの XY タブにある PFS ボックスをクリックするか、ジョイスティックコントロールパネルの PFS ボタンを押して、完全なフォーカスシステム (PFS) をオンにします。
- 細菌細胞に焦点を合わせるには、微調整ノブを回転させます。
- セルが目的のフォーカス平面に配置されたら、各 XY 位置の PFS ボタンをクリックします。
注: PFS は、タイムラプス実験中に Z 軸のドリフトを補正します。これは、時間の経過とともに細菌細胞の焦点を維持するために必要です.製造者によって報酬制度が異なります。 - 取得制御メニューのオプションから選択して、各チャンネルの取得間隔と周波数(例えば、位相コントラストおよび各フルオロフォア)を含む画像取得条件を選択します。
注:ここで紹介する実験では、位相コントラスト画像は5~10秒間隔で取得され、GFPチャンネルとTxRedチャンネルの蛍光画像は20分ごとに取得されます。 - 顕微鏡と取得の設定が設定されたら、イメージングを開始します。
8. オプション: ライブ/デッドイメージングの変更
- M8Tの10 mLで2%アガロースを溶かし、50°Cの水浴で少なくとも15分間冷まします。
- 溶湯系アガロースにヨウ化プロピジウム1mMを加える。
- 冷却したら、調製された金型に915μLのアガロースを入れます。
- 蓋をアジャルのままにし、パッドを室温で30分間乾燥させます。光から守る。
- 蓋で皿を覆い、室温でさらに2時間放置します。
- 湿度拭き取りを準備します。
- 糸くずのない紙をしっかりと巻き上げる。
- 滅菌ペトリ皿に拭き取り、500μLの無菌水をワイプに加えます。
- 37°Cで1時間インキュベートする。
- 37°Cでパッドと無菌35mm皿を1時間インキュベートします。
- セクション6:細菌細胞の調製および接種パッドに示すように、皿を接種するに進みます。
9. データ分析
- セルの識別
- イメージ ファイルをイメージング ソフトウェアで開き、追跡に使用するフレームのみを含むようにファイルをトリミングし、対象セルにズーム インし、位相コントラスト チャネルにのみ拡大します。
注: トリミングされたファイルは、元のファイルに干渉することなく追跡データを保存できる新しいファイルとして保存できます。 - 解析コントロールメニューで対象地域(ROI)を選択するオプションを選択し、解析に使用する最初のフレーム内の個々の細菌細胞または細胞のクラスターをトレースしてROIを定義します。
注: ROI は手動で定義することも、バイナリとして定義することもできます。- ROI を手動で定義する
- 個々の細菌細胞または細胞のクラスターの周囲をトレースして、ROI を手動で定義します。
注: 解析ソフトウェアでは 、P. 緑素細胞、または他の棒状の細胞は、 楕円 ROI を選択し、細菌細胞のサイズに合わせて調整された楕円を描画することによって手動でトレースできます。または、 ポリゴン ROI オプションを選択して、セルのクラスターなど、従来型以外の ROI をトレースすることもできます。
- 個々の細菌細胞または細胞のクラスターの周囲をトレースして、ROI を手動で定義します。
- バイナリROを特定する
- バイナリ ROI を定義するには、[ バイナリから ROI へのバイナリ] オプションをクリックします。
注: オブジェクトは、位相コントラスト チャネルの明るいピクセルの背景から暗いピクセル化された細菌細胞を分離して、バイナリ レイヤーで定義されます。 - セルをしきい値にするには、分析コントロール メニューの [しきい値 ] オプションを選択します。対象のチャンネルを選択し、蛍光ヒストグラムのバーをスライドさせて、しきい値の間隔値を調整します。
注: ROI のバイナリ オブジェクト識別は、細菌細胞を閾値にすることで蛍光画像で定義することもできます。しきい値は、どの蛍光強度が対象と見なされ、どのような蛍光強度が背景を構成するかを確立します。
- バイナリ ROI を定義するには、[ バイナリから ROI へのバイナリ] オプションをクリックします。
- ROI を手動で定義する
- イメージ ファイルをイメージング ソフトウェアで開き、追跡に使用するフレームのみを含むようにファイルをトリミングし、対象セルにズーム インし、位相コントラスト チャネルにのみ拡大します。
- セルトラッキング
- ROI を手動で追跡するには、イメージング シーケンスの次のフレームを選択し、各 ROI をクリックしてドラッグして元の細菌細胞の新しい位置に合わせて ROI の位置を調整します。
注:細菌細胞の位置が変わっていない場合、ROIを移動する必要はありません。 - セルを追跡するすべての連続フレームで繰り返します。
- セルが分割されると、手順 9.1 で説明したように、ドーターのセルを新しい ROI として定義し、新しく分割されたセルの追跡を開始します。
注: セルがバイナリとして識別される場合は、 トラックバイナリ 機能を使用して、選択したフレームの ROI を自動的に追跡します。 - 選択したすべてのフレームを通してセルを追跡したら、分析するデータをエクスポートします。
- データ・スプレッドシートを開き、解析に必要な測定値(オブジェクト速度、加速度、パスの長さなど)を特定します。
注: 方向を測定する場合は、パス長と線長の測定値が必要です。ライン長さはユークリッド距離、またはトラック原点から S.アウレウス コロニーの端までの直線距離の測定です。パス長は、累積距離、またはすべてのフレームからのトラックセグメントの合計の測定です。方向は、ユークリッド距離の比として計算することができ、D(E)、(ライン長)、累積距離、D(A)、(パス長)を超える。
- ROI を手動で追跡するには、イメージング シーケンスの次のフレームを選択し、各 ROI をクリックしてドラッグして元の細菌細胞の新しい位置に合わせて ROI の位置を調整します。
- 蛍光定量
- ステップ 9.1 で説明されているように、蛍光細菌細胞の ROI を定義します。
- 残りの蛍光フレームで細菌細胞またはクラスターのトレースまたは ROI の移動を繰り返します。
- 生成された表を表ファイルにエクスポートして、蛍光強度を分析します。
- データスプレッドシートで、トレースされた細菌細胞の平均蛍光強度を表す「平均強度」の列を探します。
- 平均強度値をグラフ化して、時間の経過に伴う蛍光の変化を調べています。
注:時間の経過に伴う蛍光の変化は、目的の蛍光標識遺伝子の遺伝子発現の変動を表します。
結果
説明された方法の使用に成功すると、一連のフレームが生成され、種間相互作用が時間の経過とともに観察されるビデオが生成されます。図 1の図は、イメージング用の材料の準備に関する主要な手順を示すビジュアルを提供します。この方法の使用は、単一培養とS.アウレウスとの共培養において異なる行動を示すP.緑分化細胞のデモンストレーションを可能にした。ラフトにグループ化されたままの単一培養中のP.エルギノーサ細胞と比較して、S.アウレウスとの共培養時に、P.エルギノーサは、S.アウレウスコロニーに向けて単細胞運動性を増加させた(図2A-2B)。Figure 2A蛍光標識細菌株はまた細菌種の混合集団を視覚化することを可能にする。GFP標識P.緑素吸い道を用いて、P.緑素吸いの単細胞が運動性を増加させた後、それらはS.アウレウスコロニーを包囲し、最終的に侵入するという観察を可能にした(図2C)。蛍光性標識細胞の利用はまた、初めてS.アウレウスコロニーへのP.エルギノーサ細胞の浸潤を可視化することを可能にする(図2C、下)。
このプロトコルは、種間相互作用を観察するための高品質の画像を生成する一方で、質の悪いフレームシーケンスにつながるいくつかの一般的な問題があります。実験の間の湿度の不整合と誤って乾燥したパッドは、パッドをずらして細胞をFOVから引きずり出した結果、ドリフトを引き起こしてしまう2つの一般的な問題である(図3A)。湿度の変化はアガロースパッドの乾燥に影響を与えます。湿度が上がるとパッドが濡れすぎて、パッドとガラス底皿の底部の間に水分が落ち着きます。水分は、モチル細胞が群がったり泳いだりするのに十分な厚さの液体の層を残し、細菌細胞を単一の平面に保つものではありません。一方、湿度の低下はパッドをより速く乾燥させ、細胞が早い段階で漂流する原因となります。蛍光を伴うこの方法を使用する場合のもう一つの一般的な間違いは、蛍光画像を取得することが多すぎるか、細菌細胞をあまりにも長い間蛍光灯にさらすことです。蛍光画像の短い取得間隔は、特定の波長の高輝度光を有する蛍光体を繰り返し励起する。その後、励起された蛍光体は酸素と反応し、フッ素酸胞の分解を引き起こす。得られた光漂白は、蛍光体の多くが発現し、折り畳まれるまで蛍光を枯渇させるが、細菌細胞自体に害を与えない(図3B)。しかし、蛍光の損失は遺伝子/タンパク質発現の測定を妨げ、フルオロフォアが完全に合成され、再び励起されるまで細胞をマーカーレスのままにします。さらに、励起された蛍光体と相互作用する酸素は、活性酸素種(ROS)を形成することができる。これらのROSラジカルは、細菌細胞に損傷を与え、最終的には毒性を持ち、いくつかの細胞分裂内で細胞死を引き起こした(図3C)。光漂白と光毒性のプロセスは、細胞が最初に蛍光を完全に失い、その後のフレームでは細胞が分裂しなくなり、最終的に死ぬ可能性があると容易に見ることができる(図3B-3C)。-3C実験をセットアップする際の最終的な共通の問題は、FOV当たり細胞数が多すぎるか、細胞が互いに近すぎる(通常は20μm未満)から始まるという点です。最初のフレームの混雑したセルは、相互作用するのではなく、成長するにつれて単に互いに結合する細胞を分割するクラスターを生成します。さらに、近接して始まりすぎる細胞は、他の種が応答できる分泌されたシグナルの勾配を確立するのに十分な時間がない可能性があります(図3D)ののに対し、遠くの細菌細胞は実験の期間中に互いに遭遇する機会がない場合があります。
図4は、アガロースパッドにヨウ化プロピジウムを添加することによって、このプロトコルで細菌細胞の生存率を視覚化する方法の例を示す。ヨウ化プロピジウムは生きた細胞には不透過性であるが、損傷した膜を持つ細胞に入り込み、核酸に結合する可能性がある。ここで中ログGFP標識WT S.アウレウスは、培地単独で、またはP.緑豆に由来する無細胞上清で処理し、治療直後に画像化した。3つの異なるチャンネルが画像化されました:フェーズ、TxRed、GFP。明るい緑色の細胞は、培地のみで処理されたS.アウレウスに見られるようにGFPを積極的に発現する生細胞を示し(図4A)、赤色細胞は、P.緑化細胞上清で処理された後、死んだプロピジウムヨウ化物染色されたS.アウレウス細胞を示す(図4B)。1つのタイムポイントしか示されていないが、この方法は、タイムラプスライブイメージング中の細胞生存率を決定するように適合させることができる。
いくつかのポストイメージング分析を行い、種間相互作用の側面を定量化することができます。例えば、細胞追跡は、S.アウレウスのクラスターに向かう単一細胞の動きであるP.緑素吸い細胞の方向の測定値を提供することができる。個々のP.緑素吸い細胞の動きは、細胞がS.アウレウスクラスターに到達するフレームを通して細胞がいかだを残すフレームから追跡される(図5A)。P.緑素吸いいかだとS.アウレウスクラスター間の距離はユークリッド距離D(E)を提供し、トラックの全長は累積距離を提供する一方、D(A)(図5B)。(A)各セルの方向は、D(E)/D(A)の比(A)として計算されます。共培養実験では、WT P.アリューギノーサは、A.aureus ΔagrBDCAに対して有意に高い指向性を有するWT S.アウレウスに向かって移動し、Agr制御された分泌因子を欠いた変異体であり、以前はS.アウレウス24に対する指向運動性に必要であると判断した(図5C)。
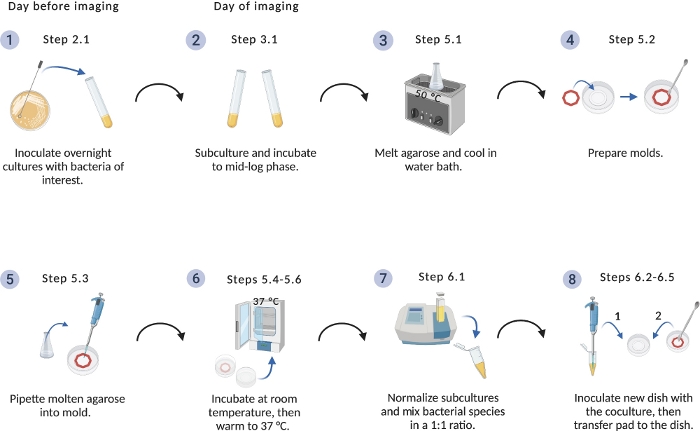
図1:イメージング設定プロトコルの概略図
細菌培養およびアガロースパッドの調製のための重要なステップの概要。BioRender.comで作成されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
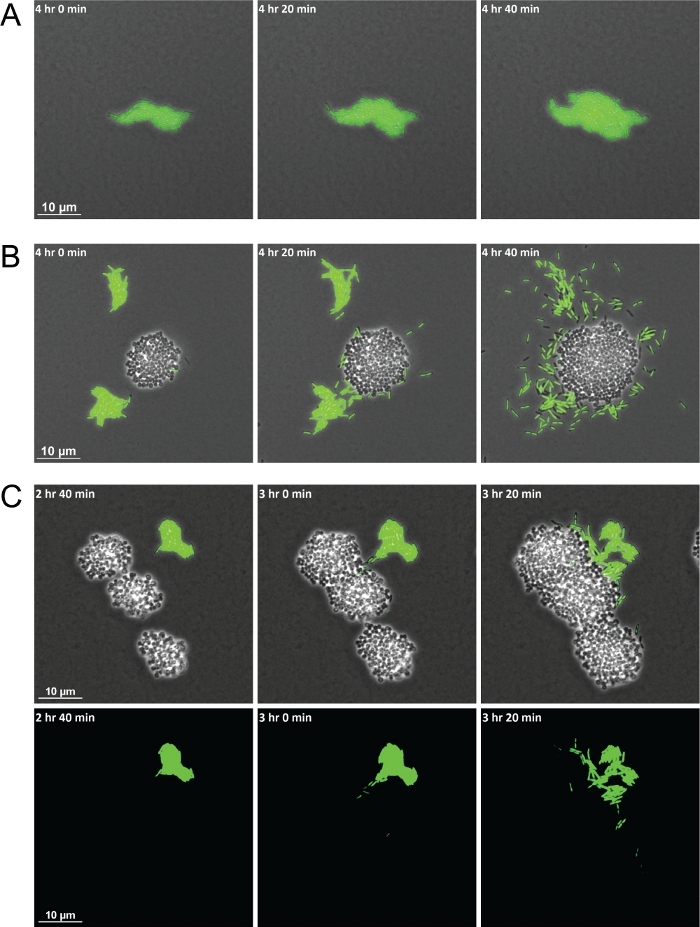
図2:タイムラプス、ライブイメージング顕微鏡は、S.アウレウスと共培養した場合のP.緑素吸い行動の違いを示す。
単一培養(A)およびS.アウレウス(コッチ、無印)との共培養におけるP.緑分(バチル、グリーン)の代表的なスナップショット(B)。(C) 蛍光標識細菌は、Aureusクラスターに侵入する単一細胞の P. 緑素吸い細胞の可視化を可能にする。位相コントラストと GFP チャネル オーバーレイ(上)と GFP チャネル単独(下)この図の大きなバージョンを表示するには、ここをクリックしてください。
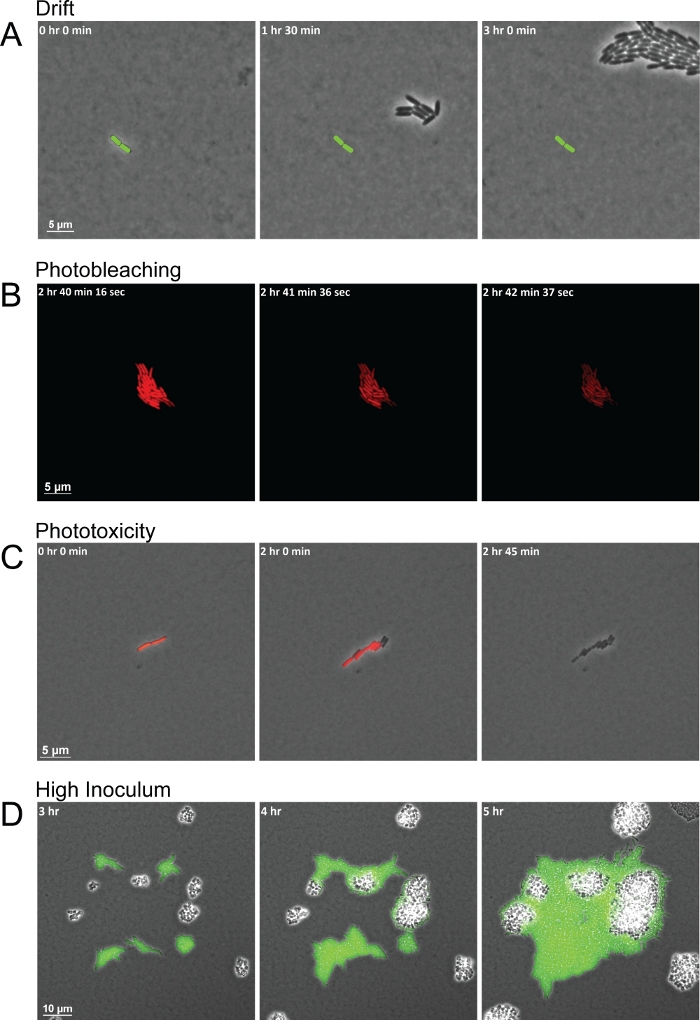
図3:画像取得の不十分さにつながる一般的な画像化の問題の代表的なスナップショット。
(A) 不適切に乾燥したパッドと不整合な湿度は、イメージングの間にFOV全体の細胞の漂流につながります。創業セルの位置は、各フレーム(緑色のロッド)にマークされています。(B)光への曝露から長時間光を消すと、一定期間蛍光の検出可能なレベルが枯渇しますが、細胞を殺すものではありません。(C)頻繁に光を浴びる結果として光毒性が細胞死を招く。光毒性の最初の兆候は、細胞が蛍光を停止し、分裂に失敗したときに見られます。(D) 高い初期接種はFOV内の細胞を群がって、種間相互作用の観察を妨げる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
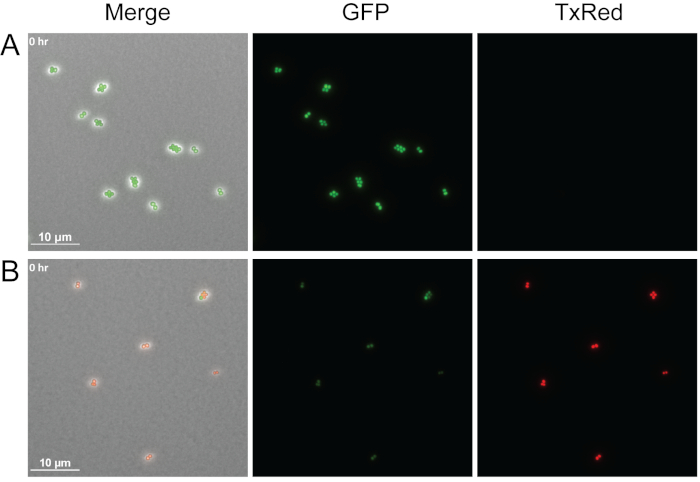
図4:生細胞と死んだ S.アウレウス細胞の 比較
GFPラベルWT S.の代表的なスナップショットは、培地単独(A)または無細胞P.緑豆上清(B)のいずれかで処理されたWT S.アウレウスの代表的なスナップショット。治療後すぐに細胞を画像化した。生細胞(緑色)はGFPを積極的に発現し、ヨウ化プロピジウムを除外し、死細胞(赤色)はGFP蛍光を失い、膜透過化によりヨウ化プロピジウムが細胞に入り、核酸に結合することを可能にする。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5: S. アウレウスとの共培養におけるP. 緑素吸草の細胞追跡解析 .
以前、この方法は、WTまたはΔagrBDCA S.アウレウスとの共培養におけるWT P.緑素吸合の細胞追跡を行う方法を用いた。(A) S. アウレウスΔagrBDCAとの共培養におけるP. 緑素吸い道単細胞の表現.(B) ユークリッド距離 (D(E)) および累積距離 (D(A)) の測定に使用する測定の図式 ((D(E)/D(A) )。(C) WTおよびΔagrBDCA S. アウレウスとの共培養における単一WT. 緑素細胞の指向性測定.この図は、リモリら 201924.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで提示される方法は、単細胞レベルでの細菌種相互作用の生細胞イメージングのためのプロトコルと、細胞追跡および細胞生存率の監視を含む他のアプリケーションの変更について説明する。この方法は、時間の経過とともに他の種との共培養における微生物の単細胞挙動を研究するための新しい道を開きます。具体的には、このプロトコルは、特に運動性のための表面および液体関連の付属物を有する生物を研究する場合に、細菌表面挙動を観察する際に、このコカルチャー法の有用性を示す。例えば、単一の焦点面で細菌の動きを表面に制限することによって、S.アウレウスに応答してP.緑内因症の増加および指向性ピリ媒介運動性を可視化することができる。
前述のように、このイメージング方法で最適な結果を得るには、サンプルの温度と湿度、イメージング機器(目標とステージ)を含むいくつかの条件を考慮する必要があります。その他のヒントとトラブルシューティングについては、補足ファイル 1を参照してください。不十分な乾燥パッドが最も一般的な問題の1つであるため、プロトコルの使用に成功する上で重要なステップは、アガロースパッドの調製です。図3Aに示すように、パッドが十分に長く乾燥していない場合、ドリフトはタイムラプスイメージングの開始時に現れ、乾燥したパッドは収縮し始め、細胞は数時間FOVから画像撮影にドリフトする。ステージトップインキュベーターと湿った糸くずのないワイプを使用して、実験期間中にすべての材料が均一な温度と湿度で事前に温め、維持されていることを確認することで、ドリフトを減らすことができます。また、最初のパッドが適切に乾燥していない場合や、金型からサンプルディッシュへの転送中に涙を流した場合に、バックアップパッドを常に作成することをお勧めします。さらに、細菌培養の成長と、細胞をイメージングする際の培地からのバックグラウンド蛍光を最小限に抑えるためにパッドを作るために、低自己蛍光培地を使用することが重要です。リッチメディアは自家蛍光が高いことが多いため、顕微鏡用に最小限のメディアを使用することをお勧めします。低密度接種から始まり、FOV内の細胞の空間分布もこの方法の重要な要因です。具体的には、P.緑素吸素およびS.アウレウス相互作用を評価する以前の研究において、これは、細菌が存在する他の種によって検出することができる分泌因子の十分な勾配を生成することを可能にした(図2B)。
この方法の利点にもかかわらず、その価格、低スループットの性質、蛍光制限、および環境条件の制御への高い依存性を含む制限もあります。図3B-3Cは、蛍光顕微鏡を用いた主な制限を示す。結果のセクションで説明したように、蛍光画像が短い間隔で撮影された場合、光漂白および光毒性が発生する可能性があります。これら2つの結果を避けるために、蛍光画像の間隔は十分に離れて、蛍光光光の露出時間をできるだけ低くして、蛍光色素を十分に視覚化する必要があります。さらに、蛍光イメージングの間隔を決定する際には、各フルオロフォアの成熟時間を考慮することが重要である。図2、図3および図4に示すP.緑内障およびS.アウレウス株に使用されるフルオロフォアは、例えば、約20分の成熟時間を有し、したがって、潜在的な光漂白効果を気にすることなく20分ごとに励起することができる。一方、この方法のもう一つの欠点は、細胞が高い細胞密度に達すると、後期種間相互作用の観察を可能にしないことである。個々の細菌細胞を可視化するには、単一の焦点面に留まらなければなりません。しかし、母集団が高い細胞密度に達すると、細胞は複数の平面で成長し始めます。
この方法は、細胞生存率(図4)および対象遺伝子の発現(データは示さない)などの異なる表現型を研究するために改変することができる。 図4 は、アガロースパッドにヨウ化プロピジウムを添加することによって細菌の生存率を可視化する方法を適応した方法の一例を示す。この方法のもう一つのアプリケーションは、蛍光レポーターを介して別の生物との共培養における細菌遺伝子/タンパク質発現を測定することです。例えば、複数のフルオロフォアをプラスミドベクターまたは細菌染色体に組み込むことで、異なる遺伝子またはタンパク質の発現を同時に研究することができる。ここでは、励起と発光スペクトルが重なっていない蛍光体を選択することが重要です。最後に、ポストイメージング解析における細菌細胞追跡の使用により、方向性(図5)、速度および加速度、他の測定値の中でも、24も計算される。
全体として、このコカルチャーイメージング法は、先に述べた単一培養プロトコルから適応し、共培養における複数の細菌種の挙動を可視化する能力を高める。この方法は、混合培養の観点から微生物を研究する機会を提供し、各種が単一細胞の方法で行動をどのように変化させるかについての理解を深め、最終的には細菌種がポリ微生物環境でどのように相互作用するかについての新しい洞察を提供する。
開示事項
著者らは、開示するものは何もないと宣言している。
謝辞
この研究は、嚢胞性線維症財団ポスドク間移行賞LIMOLI18F5(DHL)、嚢胞性線維症財団ジュニア教員採用賞LIMOLI19R3(DHL)、NIH T32トレーニンググラント5T32HL007638-34(ASP)からの資金提供によって支えられました。ジェフリー・マイズナー、ミンス・キム、イーサン・ガーナーが最初のプロトコルと、イメージングとパッドの作成に関するアドバイスを共有してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
参考文献
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385(2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232(2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56(2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976(2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365(2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved