Method Article
Visualisation cinétique des interactions bactériennes interspécifiqueuses unicellulaires
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole d’imagerie cellulaire bactérienne vivante permet de visualiser les interactions entre plusieurs espèces bactériennes au niveau unicellulaire au fil du temps. L’imagerie par time-lapse permet d’observer chaque espèce bactérienne en monoculture ou en coculture afin d’interroger les interactions inter-espèces dans les communautés bactériennes multi-espèces, y compris la motilité cellulaire individuelle et la viabilité.
Résumé
Les communautés polymicrobiales sont omniprésentes dans la nature, mais il est difficile d’étudier leurs interactions au niveau unicellulaire. Ainsi, une méthode basée sur la microscopie a été développée pour observer les interactions inter-espèces entre deux pathogènes bactériens. L’utilisation de cette méthode pour interroger les interactions entre un pathogène gramnégatif motile, Pseudomonas aeruginosa et un pathogène gram-positif non-motile, Staphylococcus aureus est démontrée ici. Ce protocole consiste à co-inoculer chaque espèce entre un couvercle et un tampon agarose, qui maintient les cellules dans un seul plan et permet la visualisation des comportements bactériens dans l’espace et le temps.
En outre, la microscopie en time-lapse démontrée ici est idéale pour visualiser les premières interactions qui ont lieu entre deux espèces bactériennes ou plus, y compris les changements dans la motilité des espèces bactériennes en monoculture et en coculture avec d’autres espèces. En raison de la nature de l’espace d’échantillonnage limité dans la configuration de la microscopie, ce protocole est moins applicable pour étudier les interactions ultérieures entre les espèces bactériennes une fois que les populations cellulaires sont trop élevées. Cependant, il existe plusieurs applications différentes du protocole qui comprennent l’utilisation de la coloration pour l’imagerie des cellules bactériennes vivantes et mortes, la quantification de l’expression des gènes ou des protéines par le biais de reporters fluorescents, et le suivi du mouvement des cellules bactériennes dans les deux espèces individuelles et des expériences multi-espèces.
Introduction
Les communautés polymicrobiales sont communes dans la nature, couvrant une variété del’environnement 1,,2,3 et les niches humaines4,5. Certaines des infections polymicrobiales les plus notoires dans la maladie humaine incluent les biofilms dentaires6, les blessures chroniques7,8, et les infections respiratoires chez les personnes atteintes de la maladie pulmonaire obstructive chronique9, pneumonie contamile associée à ventilateur10, et la mucoviscidose de la maladie génétique (CF)11,12. Ces infections sont souvent composées de diverses espèces microbiennes; cependant, un accent récent sur les interactions entre la bactérie Gram-positive Staphylococcus aureus et la bactérie gram-négative Pseudomonas aeruginosa a émergé. Des études comprenant des patients atteints de ces organismes et des analyses in vitro révèlent des interactions compétitives et coopératives qui peuvent avoir des influences profondes et inattendues sur la progression de la maladie, la survie microbienne, la virulence, le métabolisme et la susceptibilité aux antibiotiques (revues en détail par Hotterbeekx et al.2017 13 et Limoli et Hoffman 20193).
L’intérêt croissant pour les interactions inter-espèces pendant l’infection a donné lieu à une variété de méthodes pour étudier les comportements communautaires polymicrobaires. Typiquement, ces études ont utilisé des essais à base de plaque ou de bouillon pour étudier les différences phénotypiques entre la monoculture et la coculture. Par exemple, la coculture P. aeruginosa et S. aureus sur les surfaces solides a permis la visualisation de l’inhibition de la croissance ou des changements dans la production de phénotype, de pigment ou de polysaccharide de colonie14,15,16. Les biofilms d’espèces mixtes, sur des surfaces biotiques ou abiotiques, ainsi que la coculture d’espèces bactériennes en culture liquide ont également permis de mesurer les changements dans la croissance, le métabolisme, la tolérance aux antibiotiques, la concurrence et la viabilité, en plus de l’expression des gènes et des protéines17,18. Bien que ces expériences culturelles en vrac aient révélé comment P. aeruginosa et S. aureus pourraient s’influencer mutuellement à l’échelle communautaire, ils sont incapables de répondre à des questions importantes sur les interactions qui ont lieu au niveau unicellulaire. La méthode présentée ici ajoute aux approches pour l’étude des interactions inter-espèces en se concentrant sur les changements dans le mouvement, la viabilité cellulaire, et l’expression des gènes des cellules uniques au sein d’une communauté coculturée au fil du temps.
Les interactions unicellulaires peuvent différer considérablement des interactions qui ont lieu dans une communauté de cellules en vrac. Grâce à l’analyse unicellulaire, l’hétérogénéité au sein d’une communauté peut être quantifiée pour étudier comment le placement spatial des cellules influence la dynamique de la communauté ou comment les niveaux d’expression des gènes et des protéines changent au sein des membres individuels d’un groupe. Les cellules de suivi peuvent également fournir un aperçu de la façon dont les cellules uniques se déplacent et se comportent au fil du temps, à travers plusieurs générations. En suivant simultanément le mouvement cellulaire et les changements dans l’expression des gènes, des corrélations peuvent être faites entre les fluctuations des gènes et les phénotypes correspondants. Des protocoles antérieurs pour l’étude des espèces bactériennes individuelles au niveau unicellulaire ont été décrits. Ces études tirent parti des cellules d’imagerie vivante au fil du temps dans un seul plan, et ont été utiles pour observer des phénotypes comme la division cellulaire et la susceptibilité aux antibiotiques19,20. D’autres microscopies d’imagerie vivante ont été utilisées pour surveiller la croissance, la motilité, la colonisation de surface et la formation de biofilms d’espèces bactériennes simples21,22,23. Cependant, bien que ces études aient été perspicaces pour comprendre la physiologie des bactéries en monoculture, les expériences pour observer le comportement unicellulaire de plusieurs espèces bactériennes au fil du temps dans la coculture sont limitées.
Ici, les protocoles antérieurs utilisés pour l’imagerie par une seule espèce ont été adaptés pour étudier les interactions entre P. aeruginosa et S. aureus. Ces organismes peuvent être différenciés en contraste de phase en fonction de leurs morphologies cellulaires(P. aeruginosa sont bacillis et S. aureus sont cocci). Le développement de cette méthode a récemment permis la visualisation de comportements de motilité précédemment non décrits de P. aeruginosa en présence de S. aureus24. P. aeruginosa s’est avéré capable de détecter S. aureus à distance et de répondre avec des mouvements monocellulaires accrus et directionnels vers des grappes de cellules de S. aureus. P. aeruginosa mouvement vers S. aureus a été trouvé pour exiger le type IV pili (TFP), projections de cheveux dont l’extension coordonnée et la rétraction générer un mouvement appelé motilité twitching25.
Ces études démontrent l’utilité de cette méthode pour interroger les interactions antérieures entre les espèces. Cependant, l’imagerie à des densités cellulaires élevées à des moments d’interaction ultérieurs est difficile étant donné que les couches uniques de cellules ne peuvent plus être identifiées, ce qui pose principalement des problèmes lors de l’analyse post-imagerie. Compte tenu de cette limitation, la méthode est la mieux adaptée pour les interactions antérieures qui pourraient ensuite être suivies avec des tests macroscopiques traditionnels à des densités cellulaires plus élevées représentatives des interactions ultérieures. Les limites supplémentaires de cette méthode incluent la nature à faible débit, puisqu’un seul échantillon peut être photographié à la fois et le coût du microscope, de la caméra et de la chambre environnementale. En outre, la microscopie de fluorescence pose des risques pour les cellules bactériennes comme la phototoxicité et le photobleaching, limitant ainsi la fréquence à laquelle les images de fluorescence peuvent être acquises. Enfin, les coussinets d’agarose utilisés dans cette méthode sont très sensibles aux changements dans l’environnement, ce qui rend essentiel pour contrôler des conditions comme la température et l’humidité, étant donné que les plaquettes peuvent commencer à rétrécir ou se développer si les conditions ne sont pas correctes. Enfin, bien que cette méthode n’imite pas l’environnement hôte, elle fournit des indices sur la façon dont différentes espèces bactériennes réagissent sur les surfaces, qui peuvent être suivies dans des tests conçus pour imiter les conditions environnementales/hôtes.
Cette méthode diffère des études précédentes de suivi du mouvement unicellulaire, en ce que les cellules sont inoculées entre un couvercle et un tampon agarose, limitant les cellules à la surface. Cela permet le suivi cellulaire au fil du temps dans un seul plan; toutefois, limite les cycles d’engagement transitoire de surface observés lorsque les cellules sont submergées dans le liquide26. Un autre avantage des bactéries d’imagerie sous un tampon d’agarose est qu’il imite les essais d’inoculation sub-surface macroscopiques à base de plaques classiquement utilisés pour examiner P. aeruginosa twitching motilité25. Dans ce test, les cellules bactériennes sont inoculées entre le fond d’une boîte de Pétri et l’agar, en gardant les cellules dans un seul plan comme ils se déplacent à travers le fond du plat vers l’extérieur à partir du point d’inoculation, un peu comme ce protocole de microscopie.
Le protocole de microscopie time-lapse pour visualiser les interactions interspécifères présenté ici se compose de 1) la préparation de l’échantillon bactérien et du tampon d’agarose, 2) la sélection des paramètres de microscope pour l’acquisition d’imagerie et 3) l’analyse post-imagerie. La visualisation détaillée du mouvement et du suivi des cellules peut être effectuée par l’acquisition d’images à de courts intervalles de temps par contraste de phase. La microscopie de fluorescence peut également être utilisée pour déterminer la viabilité cellulaire ou l’expression des gènes au fil du temps. Ici, nous montrons un exemple d’adaptation pour la microscopie de fluorescence par l’ajout de colorants de viabilité aux coussinets d’agarose.
Protocole
REMARQUE : Une description complète et des numéros de catalogue pour toutes les fournitures de ce protocole se trouvent dans le Tableau des matériaux.
1. Préparation des supports minimaux M8T
- Préparer 1 L de base de sels minimes M8 (5x) en dissolvant 64 g de Na2HPO4·7H2O, 15 g de KH2PO4, et 2,5 g de NaCl dans 800 ml d’eau ultrapure (UPW, résistivité 18 MΩ/cm) dans une bouteille de 2 L. pH à 7,6. Volume complet à 1 L avec UPW. Autoclave pendant 45 min.
- Préparer 500 ml d’une solution de glucose (20% w/v) en dissolvant 100 g de glucose dans 400 ml d’UPW dans une bouteille de 1 L. Solution complète à 500 mL avec UPW. Autoclave pendant 45 min.
- Préparer 500 mL d’une solution tryptone (20% w/v) en dissolvant 100 g de tryptone dans 400 mL d’UPW. Compléter à 500 mL avec UPW. Autoclave pendant 45 min.
- Préparer 1 L de M8 + 10% tryptone (M8T) support minimal en ajoutant 200 mL de 5x M8 sels minimes (1x finale), 10 mL de glucose de 20% (20% de glucose (1x 0,2% final), 1 mL de 1 M MgSO4 (1 mM finale), et 50 mL de tryptone (1% final) à 600 mL d’UPW. Compléter à 1 L avec UPW. Filtrer à travers un filtre stérile de 0,2 μm dans une bouteille stérile de stockage multimédia de 500 mL.
Jour 1:
2. Préparation des cultures bactériennes du jour au lendemain
- Inoculer 5 mL de milieubeux minimaux M8T avec une seule colonie de P. aeruginosa ou S. aureus (y compris les antibiotiques le cas échéant) et incuber toute la nuit à 37 °C avec aération pour pas plus de 16 h.
REMARQUE : Les agents pathogènes bactériens P. aeruginosa et S. aureus ont été utilisés pour cette méthode, parce qu’ils sont généralement coésolated des infections chroniques, et l’étude de leurs interactions est importante pour comprendre comment ils contribuent aux résultats des patients pendant les infections polymicroboriaux. D’autres espèces bactériennes pourraient être utilisées en fonction de l’objet de l’étude.
Jour 2:
3. Sous-culture de souches bactériennes
- Sous-culture P. aeruginosa 1:500 et S. aureus 1:1000 en 5 mL de M8T frais (y compris les antibiotiques le cas échéant). Incuber avec aération à 37 °C jusqu’à ce que les cultures atteignent la phase médiane du journal (OD600 = ~0,3 - 0,5).
4. Préparation des matériaux pour les moules de tampon
- Préparer des spatules métalliques en chauffant l’extrémité d’une spatule de laboratoire plate et arrondie à l’aide d’un brûleur Bunsen jusqu’à ce que la moitié de l’extrémité plate puisse être pliée à un angle de 90°. Chauffer l’extrémité d’une autre spatule de laboratoire plate et arrondie et plier légèrement les 10 derniers mm à un angle de 45 °C.
- Couper les quatre coins des moules en silicone de sorte que les moules s’adaptent à l’intérieur d’un plat de 35 mm.
- Stériliser les spatules et une paire de pinces à épiler en ajoutant 70% d’éthanol et en les passant à travers la flamme du brûleur Bunsen.
- Nettoyez le plat et les moules en silicone avec 70 % d’éthanol et séchez-les avec des lingettes sans peluche.
5. Préparation des coussinets d’agarose
REMARQUE : Les plaquettes sont préparées avec le milieu minimal M8T comme source nutritive pour les bactéries utilisées dans ce protocole. Cependant, les nutriments utilisés dans les plaquettes peuvent être modifiés pour différents organismes.
- Faire fondre 2 % d’agarose à faible fusion dans 10 ml de M8T dans une fiole Erlenmeyer propre de 50 ml. Cuire au micro-ondes à intervalles courts (2-5 s) jusqu’à ce que l’agarose soit en solution afin d’éviter que le contenu de la fiole ne bouillonne. Une fois fondu, laisser refroidir dans un bain d’eau de 50 °C pendant au moins 15 min.
- Préparer les moules en alignant la découpe en silicone avec l’ouverture dans le plat de 35 mm et appuyez légèrement à l’aide d’une spatule pour fixer le silicone dans le plat, et pour enlever toutes les bulles d’air entre le moule et le plat.
- Une fois refroidie, la pipette 915 μL d’agarose fondue dans le moule. Laissez le couvercle entrouvert et laissez sécher le tampon à température ambiante pendant 30 min.
- Couvrir le plat avec le couvercle et laisser à température ambiante pendant 2 h supplémentaires.
- Préparer les lingettes d’humidité en roulant étroitement vers le haut d’un essuie-tout sans peluche. Placez l’essuie-tout roulé à l’intérieur d’une boîte de Pétri stérile et ajoutez uniformément 500 μL d’eau stérile sur l’essuie-glace. Chauffer à 37 °C pendant 1 h.
- Chauffer le tampon et un plat stérile de 35 mm à 37 °C pendant 1 h.
6. Préparation de cellules bactériennes et de plaquettes inoculantes
- Mesurer l’OD600 de chaque sous-culture et diluer P. aeruginosa à un OD600 = 0,03 et S. aureus à un OD600 = 0,10 dans M8T préguerre à 37 °C. Mélanger P. aeruginosa et S. aureus dans un rapport de 1:1 et vortex.
REMARQUE : Si les souches nécessitent des antibiotiques, les antibiotiques peuvent être ajoutés à la nuit et à la sous-culture, mais ne devraient pas être ajoutés lors du mélange d’espèces pour l’imagerie si cela affecte les autres espèces de la coculture. La stabilité plasmide et les effets des antibiotiques sur toutes les espèces de la coculture devront être déterminés pour chaque organisme/plasmide utilisé. - Pipette 1 μL de coculture uniformément sur le fond d’un plat de couverture en verre préchauffé et stérile de 35 mm.
- Retirer la découpe en silicone du moule à l’aide de pinces stériles.
- Retirer le tampon du plat à l’aide de spatules stériles.
- Glissez la spatule légèrement pliée sous le bord du tampon, tout en tenant le moule à l’envers, pour l’déposer sur un couvercle stérile de plaque de Petri.
REMARQUE : Prenez soin de ne pas forcer le tampon ou il va déchirer. Gardez une trace de quel côté du pad est le fond.
- Glissez la spatule légèrement pliée sous le bord du tampon, tout en tenant le moule à l’envers, pour l’déposer sur un couvercle stérile de plaque de Petri.
- Transférer le tampon dans le plat avec les cellules bactériennes, en bas du côté vers le bas, en glissant la spatule inclinée de 90° sous le tampon et en le plaçant sur le dessus du couvercle inoculé. Utilisez la spatule inclinée à 90° pour faire rincer le tampon contre le couvercle et appuyez doucement sur les bulles d’air.
- Retirez l’excès d’humidité des lingettes humides puis placez-le autour du bord du plat, en s’assurant qu’il ne touche pas le tampon. L’échantillon est maintenant prêt pour l’imagerie.
7. Mise en place du microscope pour l’imagerie en direct
- Chambre environnementale chaude à 37 °C au moins 2 h avant l’installation expérimentale.
- Allumez tous les composants, y compris le microscope, l’ordinateur et les sources lumineuses pour l’imagerie par champ lumineux et la fluorescence.
- Ouvrez le logiciel d’imagerie et assurez-vous que les sources lumineuses sont connectées et en cours d’exécution.
- Effectuez l’éclairage Köhler27 pour aligner tous les plans d’image.
- Tout d’abord, mettre le couvercle marqué au point avec un objectif 20x à l’aide d’un plat « factice ». Assurez-vous que la tourelle de condensateur est définie sur la position « ouverte ».
REMARQUE : L’éclairage Köhler doit être effectué pour chaque objectif/échantillon unique afin d’aligner correctement les plans d’image. Toutefois, la mise au point et l’alignement avec le plat « factice » sur le grossissement inférieur accélère la mise en place d’échantillons vivants à un grossissement plus élevé afin de limiter le temps entre l’heure de mise en place et l’heure de début de l’expérience. - Concentrez le condenseur.
- Fermez le diaphragme du champ.
REMARQUE : Une ouverture en forme d’octogone doit apparaître. Si le condenseur est complètement flou, tout le champ de vision (FOV) apparaîtra sombre. - Faites pivoter les boutons de mise au point du condenseur jusqu’à ce que les bords de l’octogone soient nets.
REMARQUE : L’intensité lumineuse augmentera à mesure que les plans d’image approcheront l’alignement correct.
- Fermez le diaphragme du champ.
- Aligner le condenseur.
- Centrez le condenseur de champ en ajustant les boutons d’alignement.
REMARQUE : L’octogone doit être centré au milieu du FOV. Les boutons d’alignement diffèrent selon le microscope. Par exemple, certains condensateurs de microscope ont des boutons, tandis que d’autres ont des vis nécessitant un conducteur de vis.
- Centrez le condenseur de champ en ajustant les boutons d’alignement.
- Concentrez le filament de lampe et ajustez l’ouverture du condenseur.
- Placez un télescope de phase ou une lentille Bertrand dans la trajectoire lumineuse pour observer le plan focal arrière de l’objectif.
REMARQUE : Il devrait y avoir deux cercles concentriques. - Tournez le bouton de mise au point de l’objectif Bertrand jusqu’à ce que les anneaux semblent croustillants.
- Retirez l’objectif Bertrand du chemin lumineux.
- Placez un télescope de phase ou une lentille Bertrand dans la trajectoire lumineuse pour observer le plan focal arrière de l’objectif.
- Ouvrez le diaphragme du champ jusqu’à ce que l’octogone soit juste à l’extérieur du FOV.
- Passer à l’objectif 100x et glisser l’anneau de phase correspondant en place avant d’ajouter une goutte d’huile d’immersion, et placer le plat d’échantillon préparé sur le dessus.
- Effectuer l’éclairage Köhler sur l’objectif 100x avec le plat échantillon bactérien.
- Tout d’abord, mettre le couvercle marqué au point avec un objectif 20x à l’aide d’un plat « factice ». Assurez-vous que la tourelle de condensateur est définie sur la position « ouverte ».
- Concentrez-vous sur les bactéries en utilisant l’ajustement fin seulement. Une fois que les bactéries dans le FOV sont concentrés à travers l’oculaire, passer le chemin de la lumière à la caméra en appuyant sur le bouton de la caméra sur le microscope.
- Cliquez sur l’option Phase dans le logiciel d’imagerie.
- Ajuster le pourcentage de lumière LED DIA émise en sélectionnant la source lumineuse dans le logiciel et soit en entrant manuellement le pourcentage de lumière souhaité à utiliser ou en glissant la barre sur l’échelle de pourcentage de lumière.
- Réglez le temps d’exposition à la lumière LED DIA en cliquant sur la source lumineuse et en entrant manuellement le temps d’exposition souhaité ou en sélectionnant un temps d’exposition dans le menu déroulant fourni.
REMARQUE : Le temps d’exposition varie en fonction de l’utilisation de la caméra. - Si vous utilisez la fluorescence, réglez les paramètres de la caméra dans chaque canal correspondant (c.-à-d. TxRed, GFP), en cliquant sur le canal fluorescent d’intérêt.
- Définissez le pourcentage de lumière de fluorescence émise, puis ajustez le temps d’exposition (tel qu’il est effectué aux étapes 7.7 et 7.8 pour la lumière LED DIA).
- Sinon, modifiez la profondeur du bit pour ajuster la plage dynamique en sélectionnant l’une des autres options de profondeur de bit dans le menu déroulant des contrôles de visualisation.
- Choisissez les positions d’intérêt XY en cliquant sur l’option XY dans le menu contrôles d’acquisition.
- Déplacez la position de la scène avec le joy stick, ou en cliquant et en faisant glisser le FOV sur l’écran, puis cliquez sur la zone vide pour enregistrer les coordonnées X et Y d’une position spécifique.
REMARQUE : La sélection de pas plus de trois positions XY différentes, aussi étroites que possible, est recommandée pour l’acquisition en time-lapse.
- Déplacez la position de la scène avec le joy stick, ou en cliquant et en faisant glisser le FOV sur l’écran, puis cliquez sur la zone vide pour enregistrer les coordonnées X et Y d’une position spécifique.
- Activez le système de mise au point parfait (PFS) en cliquant sur la zone PFS de l’onglet XY du menu de contrôle d’acquisition ou en appuyant sur le bouton PFS du panneau de commande joy stick.
- Faites pivoter les boutons d’ajustement fin pour vous concentrer sur les cellules bactériennes.
- Cliquez sur le bouton PFS pour chaque position XY, une fois que les cellules sont dans le plan de mise au point souhaité.
REMARQUE : Le SFP compense la dérive dans l’axe Z lors d’expériences en time-lapse. Ceci est nécessaire pour maintenir l’accent des cellules bactériennes au fil du temps. Différentes manufactures ont des systèmes de compensation différents. - Choisissez les conditions d’acquisition d’image, y compris l’intervalle d’acquisition et la fréquence de chaque canal (p. ex., contraste de phase et chaque fluorophore) en sélectionnant parmi les options du menu contrôles d’acquisition.
REMARQUE : Pour les expériences présentées ici, les images de contraste de phase sont acquises à intervalles tous les 5-10 s tandis que les images de fluorescence dans les canaux GFP et TxRed sont acquises toutes les 20 minutes. - Commencez l’imagerie une fois que le microscope et les paramètres d’acquisition sont configurés.
8. Facultatif : Modifications pour l’imagerie vivante/morte
- Faire fondre 2 % d’agarose dans 10 mL de M8T et laisser refroidir dans un bain d’eau de 50 °C pendant au moins 15 min.
- Ajouter 1 mM d’iodure de propidium à l’agarose fondue.
- Une fois refroidi, la pipette 915 μL d’agarose dans le moule préparé.
- Laissez le couvercle entrouvert et laissez sécher le tampon à température ambiante pendant 30 min. Protégez-vous de la lumière.
- Couvrir le plat avec le couvercle et laisser à température ambiante pendant 2 h supplémentaires.
- Préparer les lingettes d’humidité.
- Rouler un papier sans peluche essuyez fermement.
- Placer l’essuie-glace dans une boîte de Pétri stérile et ajouter 500 μL d’eau stérile à l’essuie-glace.
- Incuber à 37 °C pendant 1 h.
- Incuber le tampon et un plat stérile de 35 mm à 37 °C pendant 1 h.
- Procéder à l’inoculation du plat comme indiqué à la section 6 : Préparation des cellules bactériennes et des coussinets d’inoculation.
9. Analyse des données
- Identification des cellules
- Ouvrez le fichier image dans le logiciel d’imagerie et rognez le fichier pour inclure uniquement les images à utiliser pour le suivi, zoomer sur les cellules d’intérêt, et uniquement dans le canal de contraste de phase.
REMARQUE : Le fichier rogné peut être enregistré sous la forme d’un nouveau fichier dans lequel les données de suivi peuvent être stockées sans interférer avec le fichier d’origine. - Sélectionnez l’option pour choisir les régions d’intérêt (ROI) dans le menu contrôles d’analyse et définissez les ORI en traçant des cellules bactériennes individuelles ou des grappes de cellules dans le premier cadre à utiliser pour l’analyse.
REMARQUE : Les ORI peuvent être définis manuellement ou comme binaires.- Définir manuellement le retour sur investissement
- Tracer le périmètre de chaque cellule bactérienne individuelle ou des grappes de cellules pour définir manuellement les ORI.
REMARQUE : Dans le logiciel d’analyse, P. aeruginosa,ou d’autres cellules en forme de tige, peut être tracé manuellement en sélectionnant le roi Ellipse et en dessinant une ellipse ajustée à la taille de la cellule bactérienne. Alternativement, l’option roi polygone peut être sélectionnée pour tracer des ROI de forme non traditionnelle, telles que des amas de cellules.
- Tracer le périmètre de chaque cellule bactérienne individuelle ou des grappes de cellules pour définir manuellement les ORI.
- Identifier les VOI binaires
- Cliquez sur l’option Binaire à ROI afin de définir les VOI binaires.
REMARQUE : Les objets sont définis dans une couche binaire basée sur la séparation des cellules bactériennes pixelisées plus foncées de l’arrière-plan pixelisé plus léger dans le canal de contraste de phase. - Pour mettre à terme les cellules, sélectionnez l’option Seuil dans le menu contrôles d’analyse. Sélectionnez le canal d’intérêt et faites glisser les barres dans l’histogramme de fluorescence pour ajuster les valeurs d’intervalle de seuil.
REMARQUE : L’identification des objets binaires pour les VOI peut également être définie dans les images fluorescentes en mettant à l’avant les cellules bactériennes. Le seuil établit quelles intensités de fluorescence sont considérées comme des objets et quelles intensités de fluorescence constituent l’arrière-plan.
- Cliquez sur l’option Binaire à ROI afin de définir les VOI binaires.
- Définir manuellement le retour sur investissement
- Ouvrez le fichier image dans le logiciel d’imagerie et rognez le fichier pour inclure uniquement les images à utiliser pour le suivi, zoomer sur les cellules d’intérêt, et uniquement dans le canal de contraste de phase.
- Suivi cellulaire
- Pour suivre manuellement les VOI, sélectionnez le cadre suivant dans la séquence d’imagerie et ajustez la position des ROV en cliquant et en faisant glisser chaque roi pour s’aligner sur la nouvelle position de la cellule bactérienne d’origine.
REMARQUE : Si les cellules bactériennes n’ont pas changé de position, les ROI n’ont pas besoin d’être déplacés. - Répétez dans toutes les images séquentielles pour lesquelles les cellules doivent être suivies.
- Au fur et à mesure que les cellules se divisent, définissez les cellules filles comme de nouveaux ROI, comme décrit à l’étape 9.1, et commencez à suivre les cellules nouvellement divisées.
REMARQUE : Si les cellules sont identifiées comme binaires, utilisez la fonction Track Binaries pour suivre automatiquement les VOI dans les images sélectionnées. - Une fois que les cellules ont été suivies à travers tous les cadres sélectionnés, exportez les données à analyser.
- Ouvrez la feuille de calcul de données et identifiez les mesures requises pour l’analyse (c.-à-d. la vitesse de l’objet, l’accélération ou la longueur du chemin d’accès).
REMARQUE : Dans le cas de la mesure de la direction, les mesures de longueur et de longueur de la ligne sont nécessaires. La longueur de la ligne est une mesure de la distance eucliide, ou la distance droite entre l’origine de la voie et le bord de la colonie de S. aureus. La longueur du chemin d’accès est une mesure de la distance accumulée, ou la somme des segments de piste de tous les cadres. La direction peut être calculée comme un rapport de la distance Eucidienne, D(E), (Longueur de la ligne), sur la distance accumulée, D(A), (Longueur du chemin).
- Pour suivre manuellement les VOI, sélectionnez le cadre suivant dans la séquence d’imagerie et ajustez la position des ROV en cliquant et en faisant glisser chaque roi pour s’aligner sur la nouvelle position de la cellule bactérienne d’origine.
- Quantification de la fluorescence
- Définir les ROV pour les cellules bactériennes fluorescentes telles que décrites à l’étape 9.1.
- Répétez le traçage ou le mouvement des ORI pour les cellules bactériennes ou les grappes dans les cadres fluorescents restants.
- Exportez la table générée vers un fichier de feuilles de calcul pour analyse de l’intensité fluorescente.
- Dans la feuille de calcul des données, recherchez la colonne avec « Intensité moyenne » qui représente l’intensité moyenne de fluorescence pour le(s) roi(s) bactérien(s) tracé.
- Graphiquez les valeurs d’intensité moyenne pour examiner les changements dans la fluorescence au fil du temps.
REMARQUE : Les changements dans la fluorescence au fil du temps représentent la fluctuation de l’expression génique pour le gène d’intérêt fluorescent.
Résultats
L’utilisation réussie de la méthode décrite se traduira par une série d’images qui génèrent une vidéo dans laquelle les interactions inter-espèces peuvent être observées au fil du temps. Le schéma de la figure 1 fournit un visuel pour mettre en évidence les étapes clés de la préparation des matériaux pour l’imagerie. L’utilisation de cette méthode a permis la démonstration de cellules P. aeruginosa présentant différents comportements en monoculture par rapport à la coculture avec S. aureus. Par rapport aux cellules P. aeruginosa en monoculture qui restent regroupées en radeaux, lorsqu’en coculture avec S. aureus, P. aeruginosa a augmenté la motilité unicellulaire vers les colonies de S. aureus (Figure 2A-2B). Les souches bactériennes étiquetées fluorescentement permettent également de visualiser les populations mixtes d’espèces bactériennes. L’utilisation de P. aeruginosa étiqueté GFP a permis l’observation qu’après l’augmentation de la motilité des cellules individuelles de P. aeruginosa, elles entoureront et finiront par envahir les colonies de S. aureus (Figure 2C). L’utilisation de cellules marquées fluorescentes permet également la visualisation de l’invasion des cellules de P. aeruginosa dans les colonies de S. aureus pour la première fois (figure 2C, en bas).
Bien que le protocole donne des images de haute qualité pour l’observation des interactions inter-espèces, il existe plusieurs problèmes communs qui peuvent conduire à des séquences de cadre de mauvaise qualité. L’humidité incohérente pendant la durée de l’expérience et les coussinets mal séchés sont deux problèmes courants qui conduisent à la dérive résultant du déplacement du pad et le glissement des cellules avec elle hors de la FOV (Figure 3A). Les changements d’humidité affectent la sécheresse des coussinets d’agarose. L’augmentation de l’humidité rend les coussinets trop humides, ce qui permet à l’humidité de s’installer entre le tampon et le fond du plat à fond de verre. L’humidité laisse une couche de liquide assez épaisse pour que les cellules motiles essaiment ou nagent à travers et ne garde pas les cellules bactériennes dans un seul plan. Pendant ce temps, les diminutions de l’humidité assèchent le tampon plus rapidement, ce qui provoque la dérive précoce des cellules. Une autre erreur commune lors de l’utilisation de cette méthode avec la fluorescence est l’acquisition d’images fluorescentes trop fréquemment ou d’exposer les cellules bactériennes à la lumière fluorescente pendant trop longtemps. De courts intervalles d’acquisition pour les images fluorescentes excitent à plusieurs reprises les fluorophores avec une lumière de haute intensité d’une longueur d’onde spécifique. Les fluorophores excités réagissent alors avec l’oxygène, causant la dégradation du fluorophore. Le photobleaching résultant épuise la fluorescence jusqu’à ce qu’une plus grande partie du fluorophore puisse être exprimée et pliée, mais ne nuit pas aux cellules bactériennes elles-mêmes (figure 3B). La perte de fluorescence, cependant, interfère avec les mesures de l’expression gène/protéine, laissant les cellules sans marqueur jusqu’à ce que le fluorophore puisse être entièrement synthétisé et excité à nouveau. De plus, l’oxygène qui interagit avec les fluorophores excités peut former des espèces réactives d’oxygène (ROS). Ces radicaux ros endommagent alors les cellules bactériennes, devenant finalement toxiques et ayant pour résultat la mort cellulaire dans quelques divisions cellulaires (figure 3C). Les processus de photobleaching et de phototoxicité peuvent être facilement vus car les cellules perdront d’abord leur fluorescence complètement, et dans les cadres suivants, les cellules cesseront de se diviser et peuvent éventuellement mourir (Figure 3B-3C). Un dernier problème commun lors de la mise en place de l’expérience est de commencer avec trop de cellules par FOV ou avec des cellules trop proches les unes des autres, qui est généralement moins de 20 μm l’une de l’autre. Les cellules surpeuplées du premier cadre donneront des grappes de cellules qui se divisent et qui se fondent les unes dans les autres au fur et à mesure qu’elles grandissent plutôt que d’interagir. En outre, les cellules qui commencent trop près à proximité peuvent ne pas avoir suffisamment de temps pour établir un gradient de signaux sécrétés auxquels les autres espèces peuvent répondre (figure 3D) alors que les cellules bactériennes éloignées peuvent ne pas avoir la chance de se rencontrer dans la durée de l’expérience.
La figure 4 montre un exemple de la façon dont la viabilité des cellules bactériennes peut être visualisée avec ce protocole en ajoutant de l’iodure propidium aux coussinets d’agarose. L’iodure propidium est imperméable aux cellules vivantes, mais peut pénétrer dans les cellules avec des membranes endommagées et se lier aux acides nucléiques. Ici, le WT S. aureus étiqueté gfp à mi-log a été traité avec des médias seuls ou avec un supernatant sans cellule dérivé de P. aeruginosa et photographié immédiatement après le traitement. Trois canaux différents ont été photographiés : Phase, TxRed et GFP. Les cellules vertes brillantes indiquent que les cellules vivantes expriment activement le GFP comme on le voit pour le S. aureus traité uniquement avec des supports (figure 4A),et les globules rouges indiquent les cellules mortes de S. aureus tachées d’iodure de propidium, après avoir été traitées avec le supernatant P. aeruginosa (Figure 4B). Bien qu’un seul point de temps soit montré, cette méthode peut être adaptée pour déterminer la viabilité cellulaire lors de l’imagerie en direct en time-lapse.
Plusieurs analyses post-imagerie peuvent être effectuées pour quantifier certains aspects des interactions entre les espèces. Par exemple, le suivi cellulaire peut fournir des mesures pour la direction des mouvements de cellules uniques de P. aeruginosa vers un groupe de S. aureus. Les mouvements des cellules individuelles de P. aeruginosa sont suivis à partir du cadre une cellule quitte le radeau à travers le cadre dans lequel la cellule atteint l’amas de S. aureus (Figure 5A). La distance entre le radeau P. aeruginosa et l’amas de S. aureus fournit la distance euclidienne, D(E), tandis que les longueurs totales de la piste fournissent la distance accumulée, D(A) (Figure 5B). La direction de chaque cellule est calculée comme un rapport de D(E)/D(A). Dans les expériences de coculture, WT P. aeruginosa s’est déplacé vers WT S. aureus avec une orientation significativement plus élevée que vers S. aureus ΔagrBDCA, un mutant dépourvu de facteurs sécrétés réglementés par Agr, précédemment jugé nécessaire pour la motilité directionnelle envers S. aureus24 (Figure 5C).
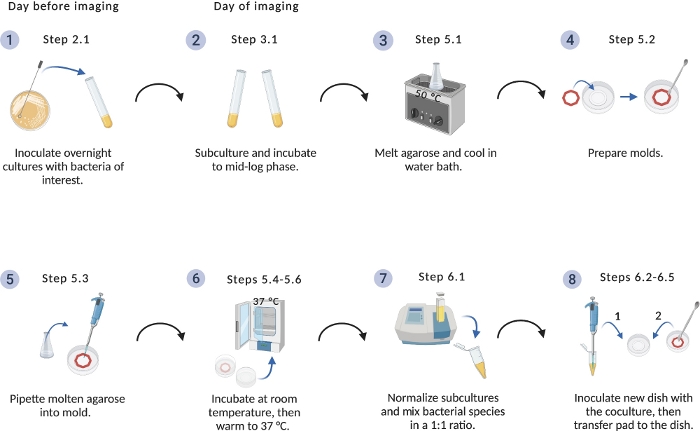
Figure 1 : Schéma du protocole d’installation d’imagerie.
Vue d’ensemble des étapes critiques pour la préparation des cultures bactériennes et des coussinets d’agarose. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
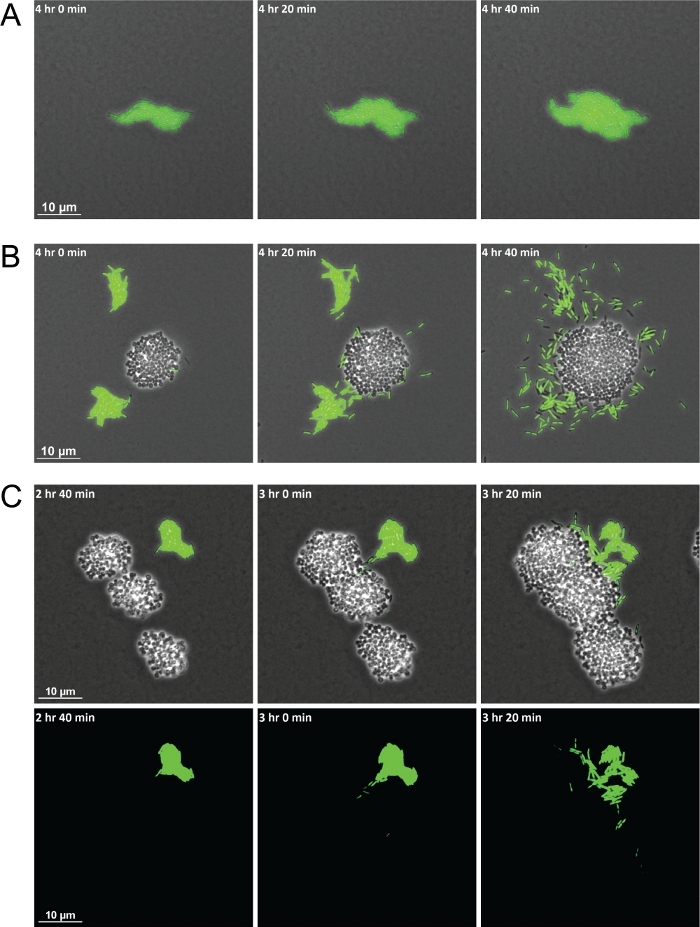
Figure 2 : La microscopie en accéléré et en direct montre des différences dans le comportement de P. aeruginosa lorsqu’il est coculturé avec S. aureus.
Snap shots représentatifs de P. aeruginosa (bacille, vert) en monoculture (A) et en coculture avec S. aureus (cocci, non marqué) (B). (C) Les bactéries étiquetées fluorescentes permettent la visualisation des cellules uniques de P. aeruginosa qui envahissent les grappes de S. aureus. Contraste de phase et superposition de canal GFP (en haut) et canal GFP seul (en bas). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
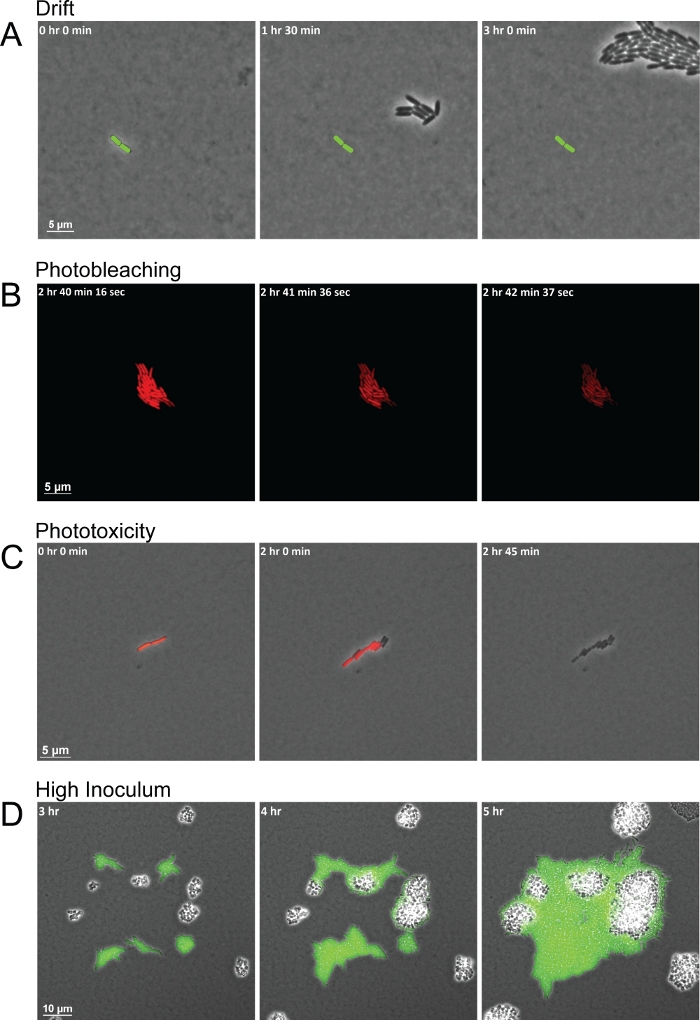
Figure 3 : Des prises de vue instantanées représentatives de problèmes d’imagerie courants qui mènent à une mauvaise acquisition d’image.
(A) Les coussinets mal séchés et l’humidité incohérente conduisent à la dérive des cellules à travers le FOV pendant la durée de l’imagerie. La position de la cellule fondatrice est marquée dans chaque cadre (tige verte). (B) Le photobleaching de l’exposition à la lumière pendant trop longtemps épuisera les niveaux détectables de fluorescence pendant une période de temps, mais ne tue pas les cellules. (C) La phototoxicité résultant de l’exposition fréquente à la lumière conduit à la mort cellulaire. Les premiers signes de phototoxicité sont observés lorsque les cellules cessent de fluorer et ne parviennent pas à se diviser. (D) Cellules de foules initiales élevées dans le FOV et empêche l’observation des interactions inter-espèces. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
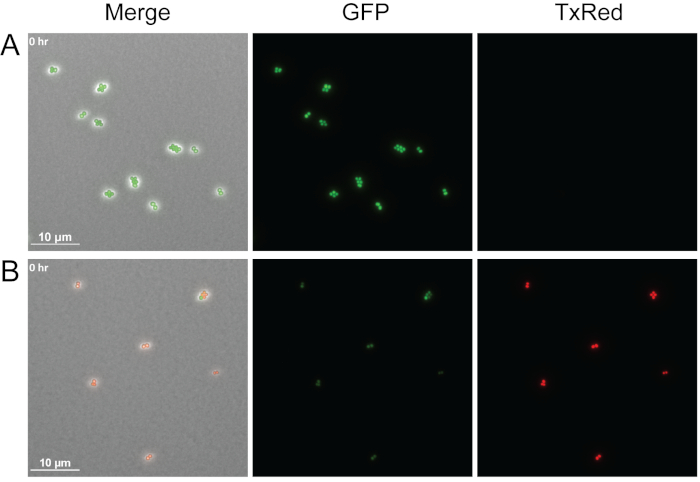
Figure 4 : Comparaison des cellules vivantes par rapport aux cellules mortes de S. aureus.
Plans instantanés représentatifs pour WT S. aureus étiqueté GFP traités avec soit un seul milieu (A) ou sans cellules P. aeruginosa supernatant (B). Les cellules ont été immédiatement image après traitement. Les cellules vivantes (vertes) expriment activement le GFP et excluent l’iodure de propidium, tandis que les cellules mortes (rouges) perdent la fluorescence de GFP et la perméabilisation de membrane permet à l’iodure de propidium d’entrer dans les cellules et de lier les acides nucléiques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Analyse de suivi cellulaire de P. aeruginosa en coculture avec S. aureus.
Auparavant, cette méthode a été utilisée pour effectuer le suivi cellulaire de WT P. aeruginosa en coculture avec WT ou ΔagrBDCA S. aureus. (A) Représentation des traces monocellulaires P. aeruginosa dans une coculture avec S. aureus ΔagrBDCA. (B) Schéma pour la distance euclidienne (D(E)) et la distance accumulée (D(A)) ) mesures utilisées pour déterminer la direction ((D(E)/D(A)). (C) Mesures de direction des cellules wt p. aeruginosa simples en coculture avec WT et ΔagrBDCA S. aureus. Ce chiffre a été modifié par Limoli et coll. 201924. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Fichier supplémentaire. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les méthodes présentées ici décrivent un protocole pour l’imagerie à cellules vivantes des interactions des espèces bactériennes au niveau unicellulaire avec des modifications pour d’autres applications, y compris le suivi cellulaire et la viabilité des cellules. Cette méthode ouvre de nouvelles avenues pour étudier les comportements unicellulaires des micro-organismes en coculture avec d’autres espèces au fil du temps. Plus précisément, le protocole démontre l’utilité de cette méthode de coculture dans l’observation des comportements de surface bactérienne, en particulier lors de l’étude des organismes qui ont à la fois des appendices de surface et associés à des liquides pour la motilité. Par exemple, en limitant le mouvement bactérien à une surface dans un seul plan de mise au point, la motilité pili-mediated accrue et directionnelle de P. aeruginosa en réponse à S. aureus peut être visualisée.
Comme nous l’avons mentionné précédemment, l’obtention de résultats optimaux grâce à cette méthode d’imagerie exige l’examen de plusieurs conditions, y compris la température et l’humidité de l’échantillon et des instruments d’imagerie (c.-à-d. les objectifs et l’étape). Pour plus de conseils et de dépannage, voir le fichier supplémentaire 1. Une étape critique dans l’utilisation réussie du protocole est la préparation des coussinets d’agarose, car les garnitures de séchage inadéquates sont l’un des problèmes les plus communs. Comme le montre la figure 3A, si les plaquettes ne sont pas séchées assez longtemps, la dérive apparaît au début de l’imagerie time-lapse, tandis que les plaquettes qui sont séchées trop longtemps commencent à rétrécir et les cellules dérivent hors de la FOV quelques heures dans l’imagerie. S’assurer que tous les matériaux sont préchauffés et entretenus à température et humidité uniformes pendant toute la durée de l’expérience, grâce à l’utilisation d’un incubateur de scène et de lingettes sans peluche humide, aidera à réduire la dérive. Il est également conseillé qu’un tampon de secours est toujours fait dans le cas où le premier tampon n’est pas séché correctement ou des larmes lors du transfert du moule à l’échantillon plat. En outre, il est important d’utiliser un milieu à faible autofluorescence, à la fois pour la croissance des cultures bactériennes et pour la fabrication des plaquettes afin de minimiser la fluorescence de fond du milieu lors de l’imagerie des cellules. Il est recommandé d’utiliser un milieu minimal pour la microscopie, puisque les médias riches ont souvent une autofluorescence élevée. En commençant par un inoculum de faible densité et même la distribution spatiale des cellules dans le FOV sont également des facteurs clés dans cette méthode. Plus précisément, dans des études antérieures évaluant les interactions P. aeruginosa et S. aureus, cela a permis à la bactérie de générer un gradient suffisant de facteurs sécrétés qui peuvent ensuite être détectés par les autres espèces présentes (figure 2B).
Malgré les avantages de cette méthode, il y a aussi des limites, notamment son prix, sa nature à faible débit, ses restrictions de fluorescence et sa forte dépendance à l’égard du contrôle des conditions environnementales. La figure 3B-3C montre les principales limites de l’utilisation de la microscopie par fluorescence. Comme nous l’avons vu dans la section des résultats, si les images fluorescentes sont capturées à intervalles courts, le photobleaching et la phototoxicité peuvent se produire. Afin d’éviter ces deux résultats, les intervalles d’image fluorescents doivent être pris assez loin l’un de l’autre et avec un temps d’exposition à la lumière fluorescente aussi faible que possible pour visualiser encore adéquatement le fluorophore. En outre, lors de la détermination de l’intervalle pour l’imagerie par fluorescence, il est important de tenir compte du temps de maturation de chaque fluorophore. Les fluorophores utilisés dans les souches P. aeruginosa et S. aureus indiquées à la figure 2, figure 3 et figure 4, par exemple, ont un temps de maturation d’environ 20 minutes et peuvent donc être excités toutes les 20 minutes sans se soucier des effets de photobleaching potentiels. Pendant ce temps, un autre inconvénient de cette méthode est qu’elle ne permet pas d’observer les interactions interspécifiques tardives une fois que les cellules atteignent une densité cellulaire élevée. Afin de visualiser les cellules bactériennes individuelles, ils doivent rester dans un seul plan de mise au point. Cependant, une fois que la population atteint une densité cellulaire élevée, les cellules commencent à se développer dans plus d’un plan.
Cette méthode peut être modifiée pour étudier différents phénotypes tels que la viabilité cellulaire (figure 4)et l’expression de gènes d’intérêt (données non montrées). La figure 4 montre un exemple de la façon dont la méthode a été adaptée pour visualiser la viabilité bactérienne en ajoutant de l’iodure de propidium aux coussinets d’agarose. Une autre application de cette méthode consiste à mesurer l’expression bactérienne des gènes et des protéines en coculture avec un autre organisme par l’intermédiaire de reporters fluorescents. Par exemple, plusieurs fluorophores peuvent être incorporés dans un vecteur plasmide ou le chromosome bactérien pour étudier simultanément l’expression de différents gènes ou protéines. Ici, il est important de sélectionner les fluorophores qui n’ont pas de spectres d’excitation et d’émission qui se chevauchent. Enfin, l’utilisation du suivi cellulaire bactérien dans l’analyse post-imagerie permet de calculer la directionnalité (figure 5),la vitesse et l’accélération, entre autres mesures,24.
Dans l’ensemble, cette méthode d’imagerie de coculture adaptée des protocoles de monoculture précédemment décrits améliore la capacité de visualiser les comportements de plusieurs espèces bactériennes en coculture. Cette méthode offre la possibilité d’étudier les microbes d’un point de vue de culture mixte, ce qui permettra d’améliorer la compréhension de la façon dont chaque espèce modifie ses comportements d’une manière unicellulaire, en fin de compte fournir un nouvel aperçu de la façon dont les espèces bactériennes interagissent dans les environnements polymicrobations.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont rien à divulguer.
Remerciements
Ce travail a été appuyé par le financement du Prix de transition postdoc-faculté de la Fondation de la fibrose kystique LIMOLI18F5 (DHL), du Prix de recrutement junior des professeurs de la Fondation de la fibrose kystique LIMOLI19R3 (DHL) et de la Bourse de formation T32 des NIH 5T32HL007638-34 (ASP). Nous remercions Jeffrey Meisner, Minsu Kim et Ethan Garner d’avoir partagé les protocoles initiaux et les conseils pour l’imagerie et la fabrication de plaquettes.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
Références
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385 (2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232 (2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56 (2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976 (2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365 (2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon