Method Article
التصور الحركي لتفاعلات البكتيريا بين الخلايا المفردة
In This Article
Summary
يسمح بروتوكول تصوير الخلايا البكتيرية الحية هذا بالتصور للتفاعلات بين أنواع بكتيرية متعددة على مستوى الخلية الواحدة بمرور الوقت. يسمح التصوير الفاصل الزمني بمراقبة كل نوع بكتيري في زراعة أحادية أو تربية نقّاء لاستجواب التفاعلات بين الأنواع في المجتمعات الجرثومية متعددة الأنواع، بما في ذلك حركية الخلايا الفردية وقابلية البقاء.
Abstract
المجتمعات متعددة الميكروبات في كل مكان في الطبيعة، ولكن دراسة تفاعلاتها على مستوى الخلية الواحدة أمر صعب. وهكذا، تم تطوير طريقة تستند إلى المجهر لمراقبة التفاعلات بين الأنواع بين اثنين من مسببات الأمراض البكتيرية. استخدام هذه الطريقة لاستجواب التفاعلات بين مسببات المرض الغرام السالبة، Pseudomonas aeruginosa وغير motile الغرام إيجابية الممرض، هو موضح هنا. يتكون هذا البروتوكول من التلقيح المشترك لكل نوع بين غطاء ومنصة agarose ، والتي تحافظ على الخلايا في مستوى واحد ويسمح بالتصور من السلوكيات البكتيرية في كل من المكان والزمان.
وعلاوة على ذلك، فإن المجهر الفاصل الزمني الذي يظهر هنا مثالي لتصور التفاعلات المبكرة التي تحدث بين نوعين أو أكثر من الأنواع البكتيرية، بما في ذلك التغيرات في حركة الأنواع البكتيرية في الزراعة الأحادية وتربية الأحياء مع الأنواع الأخرى. نظرا لطبيعة مساحة العينة المحدودة في إعداد المجهر، وهذا البروتوكول هو أقل قابلية للتطبيق لدراسة التفاعلات في وقت لاحق بين الأنواع البكتيرية مرة واحدة في مجموعات الخلايا مرتفعة جدا. ومع ذلك ، هناك العديد من التطبيقات المختلفة للبروتوكول والتي تشمل استخدام تلطيخ لتصوير الخلايا البكتيرية الحية والميتة ، وتحديد كمي من الجينات أو البروتين التعبير من خلال المراسلين الفلورسنت ، وتتبع حركة الخلايا البكتيرية في كل من الأنواع الفردية وتجارب متعددة الأنواع.
Introduction
المجتمعات متعددة الميكروبات شائعة في الطبيعة، وتمتد على مجموعة متنوعة من البيئية1و2و3 و المنافذ البشرية4،5. بعض من التهابات بوليكروبات الأكثر شهرة في الأمراض البشرية وتشمل الأغشية الحيوية الأسنان6, الجروح المزمنة7,8, والتهابات الجهاز التنفسي في الأفراد الذين يعانون من مرض الانسداد الرئوي المزمن9, التنفس الصناعي المرتبطة الالتهاب الرئوي10, والتليف الكيسي المرض الوراثي (CF)11,12. وغالبا ما تتكون هذه العدوى من أنواع ميكروبية متنوعة. ومع ذلك، فقد برز تركيز حديث على التفاعلات بين البكتيريا المكورات العنقودية الأوريوسية الإيجابية للجرام وبكتيريا Pseudomonas aeruginosa السلبية للجرام. وتكشف الدراسات التي تشمل المرضى المصابين بهذه الكائنات الحية والتحليلات المختبرية عن التفاعلات التنافسية والتعاونية التي يمكن أن يكون لها تأثيرات عميقة وغير متوقعة على تطور المرض، والبقاء على قيد الحياة الميكروبي، والفوعة، والتمثيل الغذائي، وقابلية المضادات الحيوية (استعرضت بالتفصيل من قبل ثيرتبيكيكس وآخرون 201713 وليمولي وهوفمان 20193).
وقد أدى الاهتمام المتزايد في التفاعلات بين الأنواع أثناء العدوى إلى مجموعة متنوعة من الطرق لدراسة سلوكيات المجتمع متعدد الميكروبات. عادة، استخدمت هذه الدراسات الوحايس القائمة على لوحة أو مرق للتحقيق في الاختلافات الظاهري بين الزراعة الأحادية وتربية التكث. على سبيل المثال، coculturing P. aeruginosa وS. aureus على الأسطح الصلبة سمحت للتصور من تثبيط النمو أو التغيرات في النمط الظاهري مستعمرة، الصباغ، أو إنتاج السكريات14،15،16. الأنواع الحيوية المختلطة، على الأسطح الحيوية أو اللاأحيائية، وكذلك الأنواع البكتيرية coculturing في الثقافة السائلة كما مكن قياس التغيرات في النمو، والتمثيل الغذائي، والتسامح المضادات الحيوية، والمنافسة والاستمرارية، بالإضافة إلى الجينات والبروتين التعبير17،18. في حين كشفت هذه التجارب الثقافة السائبة نظرة ثاقبة كيف P. aeruginosa وS. aureus قد تؤثر على بعضها البعض على نطاق المجتمع, أنها غير قادرة على الإجابة على أسئلة هامة حول التفاعلات التي تحدث على مستوى خلية واحدة. الأسلوب المعروض هنا يضيف إلى نهج لدراسة التفاعلات بين الأنواع من خلال التركيز على التغيرات في الحركة، وقابلية الخلية للحياة، والتعبير الجيني للخلايا الفردية داخل مجتمع مشترك مع مرور الوقت.
يمكن أن تختلف التفاعلات أحادية الخلية بشكل كبير عن التفاعلات التي تحدث في مجتمع الخلايا السائبة. ومن خلال التحليل أحادي الخلية، يمكن قياس التغايرية داخل المجتمع المحلي كمياً لدراسة كيفية تأثير الموضع المكاني للخلايا على ديناميات المجتمع المحلي أو كيف تتغير مستويات التعبير الجيني والبروتيني داخل فرادى أعضاء المجموعة. يمكن أن توفر خلايا التتبع أيضًا نظرة ثاقبة على كيفية تحرك الخلايا الفردية وسلوكها بمرور الوقت ، من خلال أجيال متعددة. من خلال تتبع حركة الخلايا والتغيرات في التعبير الجيني في وقت واحد، يمكن إجراء الارتباطات بين تقلبات الجينات والأنماط الظاهرية المقابلة. وقد تم وصف البروتوكولات السابقة لدراسة الأنواع البكتيرية الفردية على مستوى الخلية الواحدة. هذه الدراسات الاستفادة من خلايا التصوير الحي مع مرور الوقت في مستوى واحد، وكانت مفيدة لمراقبة الأنماط الظاهرية مثل انقسام الخلايا والمضادات الحيوية التعرض19,20. وقد استخدمت إضافية المجهر التصوير الحي لرصد النمو، والحركة، واستعممار السطح وتشكيل بيو فيلم من الأنواع البكتيرية واحدة21،22،23. ومع ذلك ، في حين أن هذه الدراسات كانت ثاقبة لفهم فسيولوجيا البكتيريا في الزراعة الأحادية ، فإن تجارب مراقبة سلوك الخلايا الواحدة لأنواع بكتيرية متعددة مع مرور الوقت في الزراعة المشتركة محدودة.
هنا، تم تكييف البروتوكولات السابقة المستخدمة للتصوير من نوع واحد لدراسة التفاعلات بين P. aeruginosa وS. aureus. ويمكن تمييز هذه الكائنات تحت النقيض من المرحلة على أساس morphologies الخلية(P. aeruginosa هي عصيات وS. aureus هي cocci). تطوير هذا الأسلوب مؤخرا تمكين التصور من السلوكيات الحركة غير الموصوفة سابقا من P. aeruginosa في وجود S. aureus24. P. aeruginosa وجد أن تكون قادرة على استشعار S. aureus من مسافة بعيدة والاستجابة مع زيادة واتجاه حركات خلية واحدة نحو مجموعات من الخلايا S. aureus. P. aeruginosa الحركة نحو S. aureus وجدت أن تتطلب نوع الرابع بيلي (TFP), الشعر مثل التوقعات التي تمديد منسقة والتراجع توليد حركة تسمى الارتعاش25حركة .
وتبين هذه الدراسات فائدة هذه الطريقة لاستجواب التفاعلات السابقة بين الأنواع. ومع ذلك، فإن التصوير بكثافة الخلايا العالية عند نقاط وقت التفاعل اللاحقة أمر صعب بالنظر إلى أنه لم يعد من الممكن تحديد طبقات واحدة من الخلايا، مما يطرح في الغالب مشكلات أثناء تحليل ما بعد التصوير. وبالنظر إلى هذا القيد، فإن الطريقة هي الأنسب للتفاعلات في وقت سابق التي يمكن بعد ذلك متابعة مع المقايسات العيانية التقليدية في أعلى كثافات الخلية ممثلة للتفاعلات في وقت لاحق. وتشمل القيود الإضافية لهذه الطريقة طبيعة منخفضة الإنتاجية، حيث يمكن تصوير عينة واحدة فقط في كل مرة وتكلفة المجهر والكاميرا وغرفة البيئة. وعلاوة على ذلك، يشكل المجهر الفلوري مخاطر على الخلايا البكتيرية مثل السمية الضوئية وphotobleaching، وبالتالي الحد من التردد الذي يمكن الحصول على الصور الفلورية. وأخيراً، فإن منصات الأاغروز المستخدمة في هذه الطريقة معرضة بشدة للتغيرات في البيئة، مما يجعل من الأهمية بمكان التحكم في ظروف مثل درجة الحرارة والرطوبة، بالنظر إلى أن الوسادات يمكن أن تبدأ في الانكماش أو التوسع إذا كانت الظروف غير صحيحة. وأخيراً، في حين أن هذه الطريقة لا تحاكي البيئة المضيفة، إلا أنها توفر أدلة حول كيفية استجابة الأنواع البكتيرية المختلفة على الأسطح، والتي يمكن متابعتها في مقايسات مصممة لمحاكاة الظروف البيئية/المضيفة.
هذه الطريقة تختلف عن الدراسات السابقة تتبع حركة الخلية المفردة، في أن يتم تلقيح الخلايا بين غطاء و لوحة agarose، تقييد الخلايا إلى السطح. وهذا يتيح تتبع الخلايا عبر الوقت في مستوى واحد; ومع ذلك، يحد من دورات الاشتباك السطحي العابر لوحظ عندما يتم غمر الخلايا في السائل26. فائدة إضافية من البكتيريا التصوير تحت لوحة agarose هو أنه يحاكي المجهرية لوحة على أساس اختبار تحت السطح يستخدم كلاسيكيا لفحص P. aeruginosa ارتعاش25حركة . في هذا الفحص ، يتم تلقيح الخلايا البكتيرية بين الجزء السفلي من طبق بيتري والأجار ، مع الحفاظ على الخلايا في مستوى واحد أثناء تحركها عبر الجزء السفلي من الطبق إلى الخارج من نقطة التطعيم ، مثل بروتوكول المجهر هذا.
بروتوكول المجهر الفاصل الزمني لتصور التفاعلات بين الأنواع المعروضة هنا يتكون من 1) إعداد عينة بكتيرية و وسادة agarose، 2) اختيار إعدادات المجهر للحصول على التصوير و 3) بعد التصوير التحليل. ويمكن تنفيذ تصور مفصل لحركة الخلية وتتبعها عن طريق الحصول على الصور على فترات زمنية قصيرة من قبل النقيض من المرحلة. ويمكن أيضا أن تستخدم المجهر الفلوريس لتحديد صلاحية الخلية أو التعبير الجيني مع مرور الوقت. هنا، نعرض مثالاً واحداً على التكيف مع المجهر المفلور من خلال إضافة الأصباغ الصالحة للحياة إلى منصات agarose.
Protocol
ملاحظة: يمكن العثور على وصف كامل وأرقام الكتالوج لكافة الإمدادات في هذا البروتوكول في جدول المواد.
1. إعداد وسائل الإعلام M8T الحد الأدنى
- إعداد 1 L من M8 الحد الأدنى من قاعدة الأملاح (5x) عن طريق حل 64 غرام مننا 2HPO4·7H2O, 15 غرام من KH2PO4,و 2.5 ز ناول في 800 مل من الماء فائقة الخطورة (UPW, resistivity 18 MΩ/سم) في زجاجة 2 لتر. إلى 7.6 pH. حجم كامل إلى 1 L مع UPW. أوتوكلاف لمدة 45 دقيقة.
- إعداد 500 مل من محلول الجلوكوز (20٪ ث / الخامس) عن طريق حل 100 غرام من الجلوكوز في 400 مل من UPW في زجاجة 1 لتر. حل كامل ل500 مل مع UPW. أوتوكلاف لمدة 45 دقيقة.
- إعداد 500 مل من محلول تريبتون (20٪ ث / الخامس) عن طريق حل 100 غرام من التربتون في 400 مل من UPW. كاملة إلى 500 مل مع UPW. أوتوكلاف لمدة 45 دقيقة.
- إعداد 1 L من M8 + 10٪ tryptone (M8T) الحد الأدنى من وسائل الإعلام عن طريق إضافة 200 مل من أملاح 5x M8 الحد الأدنى (1x النهائي)، 10 مل من 20٪ الجلوكوز (1 0.2% نهائي)، 1 مل من 1 م مغسو4 (1 mM النهائي)، و 50 مل من 20٪ tryptone (1٪ النهائي) إلى 600 مل من UPW. كاملة إلى 1 لتر مع UPW. تصفية من خلال مرشح معقم 0.2 ميكرومتر في زجاجة تخزين وسائط 500 مل عقيمة.
اليوم 1:
2. إعداد الثقافات بين عشية وضحاها البكتيرية
- تلقيح 5 مل من وسائل الإعلام M8T الحد الأدنى مع مستعمرة واحدة من P. aeruginosa أو S. aureus (بما في ذلك المضادات الحيوية عند الاقتضاء) واحتضان بين عشية وضحاها في 37 درجة مئوية مع تهوية لمدة لا تزيد عن 16 ساعة.
ملاحظة: تم استخدام مسببات الأمراض البكتيرية P. aeruginosa و S. aureus لهذه الطريقة، لأنها عادة coisolated من الالتهابات المزمنة، ودراسة تفاعلاتها مهم لفهم كيفية مساهمتها في نتائج المرضى خلال التهابات بوليكروكال. ويمكن استخدام أنواع بكتيرية أخرى اعتمادا على تركيز الدراسة.
اليوم الثاني:
3. ثقافة فرعية من السلالات البكتيرية
- ثقافة فرعية P. aeruginosa 1:500 و S. aureus 1:1000 في 5 مل من M8T الطازجة (وتشمل المضادات الحيوية عند الاقتضاء). احتضان مع تهيّم في 37 درجة مئوية حتى الثقافات تصل إلى منتصف مرحلة السجل (OD600 = ~ 0.3 - 0.5).
4. إعداد المواد لقوالب وسادة
- إعداد ملاعق معدنية عن طريق تسخين نهاية شقة، ملعقة مختبر مدورة مع ناسخ بونسن حتى نصف نهاية مسطحة يمكن أن تكون عازمة على زاوية 90 درجة. سخني نهاية ملعقة معملية مسطحة مستديرة أخرى وثني قليلاً لآخر 10 ملم إلى زاوية 45 درجة مئوية.
- قطع الزوايا الأربع لقوالب السيليكون بحيث تناسب القوالب داخل طبق 35 ملم.
- تعقيم ملعقة وزوج من ملاقط بإضافة 70٪ الإيثانول وتمريرها من خلال شعلة الشعلة Bunsen.
- تنظيف القوالب طبق والسيليكون مع 70٪ الإيثانول وتجفيفها مع مناديل خالية من الوبر.
5. إعداد منصات agarose
ملاحظة: يتم إعداد الوسادات مع الوسائط الدنيا M8T كمصدر للمغذيات للبكتيريا المستخدمة في هذا البروتوكول. ومع ذلك، يمكن تعديل المواد الغذائية المستخدمة في منصات لمختلف الكائنات الحية.
- تذوب 2٪ أغاروز منخفضة الذوبان في 10 مل من M8T في قارورة 50 مل Erlenmeyer نظيفة. الميكروويف في فترات قصيرة (2-5 s) حتى agarose هو في حل من أجل منع محتويات القارورة من الغليان. بمجرد ذوبانها، والسماح تبرد في حمام مائي 50 درجة مئوية لمدة 15 دقيقة على الأقل.
- إعداد قوالب من خلال مواءمة انقطاع السيليكون مع فتحة في طبق 35 مم والاستفادة بخفة مع ملعقة لتأمين السيليكون إلى الطبق، وإزالة جميع فقاعات الهواء بين القالب والطبق.
- مرة واحدة باردة، ماصة 915 ميكرولتر من agarose المنصهر في القالب. اترك الغطاء مفتوحاً ودع الوسادة تجف في درجة حرارة الغرفة لمدة 30 دقيقة.
- يُغطّى الطبق بالغطاء ويُترك في درجة حرارة الغرفة لمدة 2 ساعة إضافية.
- إعداد مناديل الرطوبة عن طريق المتداول بإحكام حتى مسح خالية من الوبر. ضع المسح المدلفن داخل طبق بيتري معقمة وأضف بالتساوي 500 ميكرولتر من الماء المعقم عبر المسح. دافئة إلى 37 درجة مئوية لمدة 1 ساعة.
- سخني الوسادة وطبق معقمة 35 ملم إلى 37 درجة مئوية لمدة ساعة.
6. إعداد الخلايا البكتيرية ومنصات التلقيح
- قياس600 OD من كل ثقافة فرعية وتمييع P. aeruginosa إلى OD600 = 0.03 و S. aureus إلى OD600 = 0.10 في M8T مسبقا إلى 37 درجة مئوية. مزيج P. aeruginosa وS. aureus في نسبة 1:1 ودوامة.
ملاحظة: إذا كانت السلالات تتطلب المضادات الحيوية، يمكن إضافة المضادات الحيوية إلى الاستزراع الليلي والزواحي، ولكن لا ينبغي إضافتها عند خلط الأنواع للتصوير إذا كان يؤثر على الأنواع الأخرى في زراعة الأجناس. وسوف تحتاج إلى تحديد الاستقرار plasmid وآثار المضادات الحيوية على جميع الأنواع في تربية الأحياء في كل كائن حي / plasmid المستخدمة. - ماصة 1 μL من تربية الأزهار بالتساوي عبر الجزء السفلي من قبل الدافئة، المعقمة 35 ملم الزجاج الأغطية الطبق.
- إزالة انقطاع السيليكون من القالب باستخدام ملاقط عقيمة.
- إزالة لوحة من الطبق باستخدام ملاعق العقيمة.
- زلة ملعقة عازمة قليلا تحت حافة لوحة، في حين عقد القالب رأسا على عقب، لإسقاطه على غطاء لوحة بيتري العقيمة.
ملاحظة: الحرص على عدم فرض الوسادة أو سوف مزق. تتبع أي جانب من لوحة هو الجزء السفلي.
- زلة ملعقة عازمة قليلا تحت حافة لوحة، في حين عقد القالب رأسا على عقب، لإسقاطه على غطاء لوحة بيتري العقيمة.
- نقل لوحة إلى الطبق مع الخلايا البكتيرية، أسفل الجانب إلى أسفل، عن طريق تحريك ملعقة زاوية 90 درجة تحت لوحة ووضعها على رأس الغطاء ملقح. استخدام ملعقة زاوية 90 درجة لجعل وسادة تدفق ضد غطاء والضغط بلطف من أي فقاعات الهواء.
- إزالة الرطوبة الزائدة من مناديل رطبة ثم وضع حول حافة الطبق، والتأكد من أنه لا تلمس لوحة. العينة جاهزة الآن للتصوير.
7. إعداد المجهر للتصوير الحي
- غرفة دافئة البيئية إلى 37 درجة مئوية على الأقل 2 ساعة قبل إعداد التجريبية.
- قم بتشغيل جميع المكونات بما في ذلك المجهر والكمبيوتر ومصادر الضوء للتصوير في البراق والفلوريس.
- افتح برنامج التصوير وتأكد من أن مصادر الضوء متصلة وتعمل.
- أداء Köhler الإضاءة27 لمحاذاة جميع الطائرات صورة.
- أولاً، جلب غطاء ملحوظ في التركيز مع هدف 20x باستخدام طبق "وهمية". تأكد من أن برج المكثف هو تعيين إلى "فتح" الموقف.
ملاحظة: ينبغي إجراء إضاءة كوهلر لكل هدف/عينة فريدة من نوعها لمحاذاة مستويات الصورة بشكل صحيح. ومع ذلك، التركيز والمحاذاة مع طبق "وهمية" على انخفاض التكبير يعجل إعداد على عينات حية في التكبير أعلى للحد من الوقت بين إعداد وتجربة وقت البدء. - ركزي المكثف
- أغلق الحجاب الحاجز الحقلي.
ملاحظة: يجب أن تظهر فتحة على شكل مثمن. إذا كان المكثف خارج التركيز تمامًا ، فسيظهر حقل الرؤية بأكمله (FOV) داكنًا. - قم بتدوير المقابض المكثفة التي تركز على المقابض حتى تصبح حواف المثمنة واضحة.
ملاحظة: ستزداد شدة الضوء مع اقتراب مستويات الصورة من المحاذاة الصحيحة.
- أغلق الحجاب الحاجز الحقلي.
- محاذاة المكثف.
- مركز مكثف الميدان عن طريق ضبط المقابض الانحياز.
ملاحظة: يجب أن يكون محور المثمن إلى منتصف FOV. تختلف المقابض المحاذية حسب المجهر. على سبيل المثال، بعض المكثفات المجهر لها المقابض، في حين أن البعض الآخر مسامير تتطلب سائق المسمار.
- مركز مكثف الميدان عن طريق ضبط المقابض الانحياز.
- تركيز خيوط المصباح وضبط الفتحة المكثف.
- وضع تلسكوب المرحلة أو عدسة برتراند في مسار الضوء لمراقبة الطائرة الخلفية البؤري من الهدف.
ملاحظة: يجب أن يكون هناك دائرتين متحدة المركز. - بدوره مقبض التركيز عدسة برتراند حتى تبدو حلقات هش.
- إزالة عدسة برتراند من مسار الضوء.
- وضع تلسكوب المرحلة أو عدسة برتراند في مسار الضوء لمراقبة الطائرة الخلفية البؤري من الهدف.
- فتح الحجاب الحاجز الحقل حتى المثمن هو خارج للتو من FOV.
- تغيير الهدف 100x وشريحة حلقة مرحلة مطابقة في مكان قبل إضافة قطرة من زيت الغمر، ووضع طبق عينة أعدت على القمة.
- أداء Köhler الإضاءة على الهدف 100x مع طبق عينة البكتيريا.
- أولاً، جلب غطاء ملحوظ في التركيز مع هدف 20x باستخدام طبق "وهمية". تأكد من أن برج المكثف هو تعيين إلى "فتح" الموقف.
- التركيز على البكتيريا باستخدام التعديل غرامة فقط. بمجرد تركيز البكتيريا في FOV من خلال العدسة ، قم بتبديل مسار الضوء إلى الكاميرا عن طريق الضغط على زر الكاميرا على المجهر.
- انقر فوق الخيار المرحلة في برنامج التصوير.
- ضبط النسبة المئوية للضوء الصمام DIA المنبعثة عن طريق اختيار مصدر الضوء في البرنامج وإما إدخال يدويا النسبة المئوية المطلوبة من الضوء لاستخدامها أو انزلاق شريط على مقياس النسبة المئوية للضوء.
- ضبط الوقت التعرض للضوء ديا LED عن طريق النقر على مصدر الضوء وإما إدخال يدويا وقت التعرض المطلوب أو اختيار وقت التعرض من القائمة المنسدلة المقدمة.
ملاحظة: يختلف وقت التعرض حسب الكاميرا المستخدمة. - إذا كان استخدام الفلوريسين، ضبط إعدادات الكاميرا في كل قناة المقابلة (أي TxRed، GFP)، عن طريق النقر على قناة الفلورسنت من الفائدة.
- تعيين النسبة المئوية للضوء المفلور المنبعث، ثم ضبط وقت التعرض (كما تم تنفيذها في الخطوتين 7.7 و7.8 لضوء LED DIA).
- بدلاً من ذلك، قم بتغيير عمق البت لضبط النطاق الديناميكي عن طريق تحديد أحد خيارات عمق البت الأخرى في القائمة المنسدلة عناصر التحكم المرئية.
- اختر مواضع XY ذات الأهمية بالنقر على خيار XY في قائمة عناصر التحكم في الاستحواذ.
- نقل موقف المرحلة مع عصا الفرح، أو عن طريق النقر على سحب FOV على الشاشة، وانقر على مربع فارغ لحفظ إحداثيات س و ص من موقف معين.
ملاحظة: يوصى باختيار ما لا يزيد عن ثلاثة مواقع XY مختلفة، أقرب ما يمكن، للحصول على الفاصل الزمني.
- نقل موقف المرحلة مع عصا الفرح، أو عن طريق النقر على سحب FOV على الشاشة، وانقر على مربع فارغ لحفظ إحداثيات س و ص من موقف معين.
- قم بتشغيل نظام التركيز البؤري المثالي (PFS) إما بالنقر فوق مربع PFS في علامة التبويب XY في قائمة التحكم في الاكتساب أو الضغط على زر PFS في لوحة التحكم joy stick.
- تدوير المقابض ضبط غرامة للتركيز على الخلايا البكتيرية.
- انقر فوق زر PFS لكل موضع س ص، مرة واحدة الخلايا في المستوى المطلوب من التركيز.
ملاحظة: PFS يعوض عن الانجراف في المحور Z أثناء تجارب الفاصل الزمني. وهذا ضروري للحفاظ على تركيز الخلايا البكتيرية مع مرور الوقت. لدى المصنوعات المختلفة أنظمة تعويض مختلفة. - اختيار شروط الحصول على الصور بما في ذلك فترة الاكتساب والتردد لكل قناة (على سبيل المثال، على النقيض من المرحلة وكل فلوري) عن طريق الاختيار من الخيارات في قائمة عناصر التحكم في الاستحواذ.
ملاحظة: بالنسبة للتجارب المعروضة هنا، يتم الحصول على صور التباين في المرحلة على فترات كل 5-10 s بينما يتم الحصول على صور الفلوريس في قنوات GFP و TxRed كل 20 دقيقة. - ابدأ التصوير بمجرد إعداد إعدادات المجهر والاستحواذ.
8. اختياري: تعديلات للتصوير الحي / الميت
- تذوب 2٪ agarose في 10 مل من M8T والسماح تبرد في 50 درجة مئوية حمام مائي لمدة 15 دقيقة على الأقل.
- إضافة 1 مللي أم من يوديد بروبديسيوم إلى agarose المنصهر.
- مرة واحدة تبريد، ماصة 915 ميكرولتر من agarose في القالب المعدة.
- اترك الغطاء ajar واسمحوا وسادة الجافة في درجة حرارة الغرفة لمدة 30 دقيقة. حماية من الضوء.
- يُغطّى الطبق بالغطاء ويُترك في درجة حرارة الغرفة لمدة 2 ساعة إضافية.
- إعداد مناديل الرطوبة.
- لفة ورقة خالية من الوبر مسح بإحكام.
- ضع المسح في طبق بيتري معقمة وإضافة 500 ميكرولتر من الماء المعقم إلى المسح.
- احتضان في 37 درجة مئوية لمدة 1 ساعة.
- احتضان لوحة وطبق معقمة 35 ملم في 37 درجة مئوية لمدة 1 ساعة.
- المضي قدما في تلقيح الطبق كما هو مبين في القسم 6: إعداد الخلايا البكتيرية ومنصات التلقيح.
9 - تحليل البيانات
- تعريف الخلايا
- افتح ملف الصورة في برنامج التصوير واحصد الملف ليتضمن فقط الإطارات التي سيتم استخدامها للتتبع، والتكبير إلى الخلايا التي تهمك، وفقط في قناة تباين المرحلة.
ملاحظة: يمكن حفظ الملف المقصوص كملف جديد حيث يمكن تخزين بيانات التعقب دون التداخل مع الملف الأصلي. - حدد الخيار لاختيار المناطق ذات الأهمية (ROI) في قائمة عناصر التحكم في التحليل وتحديد ROIs عن طريق تتبع الخلايا البكتيرية الفردية أو مجموعات من الخلايا في الإطار الأول لاستخدامها للتحليل.
ملاحظة: يمكن تعريف ROIs يدوياً أو الثنائيات.- تعريف عائد الاستثمار يدوياً
- تتبع محيط كل خلية بكتيرية أو مجموعات من الخلايا لتحديد يدوياً ROIs.
ملاحظة: في برنامج التحليل، P. aeruginosa، أو غيرها من الخلايا على شكل قضيب، يمكن تتبع يدويا عن طريق اختيار العائد على الاستثمار قطع ناقص ورسم القطع الناقص تعديلها إلى حجم الخلية البكتيرية. بدلاً من ذلك، يمكن تحديد خيار عائد الاستثمار المضلع لتتبع ROIs غير التقليدية الشكل، مثل مجموعات الخلايا.
- تتبع محيط كل خلية بكتيرية أو مجموعات من الخلايا لتحديد يدوياً ROIs.
- تحديد ROIs ثنائي
- انقر على خيار ثنائي إلى عائد الاستثمار من أجل تعريف ROIs ثنائي.
ملاحظة: يتم تعريف الكائنات في طبقة ثنائية استناداً إلى فصل الخلايا البكتيرية المنقطة الداكنة عن الخلفية الخفيفة في قناة تباين المرحلة. - لعتبة الخلايا، حدد الخيار العتبة في قائمة عناصر التحكم بالتحليل. حدد قناة الاهتمام وقم بتمرير الأشرطة في الرسم البياني للفلورسل لضبط قيم الفاصل الزمني للعتبة.
ملاحظة: يمكن أيضا تعريف كائن ثنائي لـ ROIs يمكن تعريفها في الصور الفلورية عن طريق العتبة الخلايا البكتيرية. تحدد العتبة أي شدة الفلوريسين تعتبر أشياءً وما هي شدة الفلورس التي تشكل الخلفية.
- انقر على خيار ثنائي إلى عائد الاستثمار من أجل تعريف ROIs ثنائي.
- تعريف عائد الاستثمار يدوياً
- افتح ملف الصورة في برنامج التصوير واحصد الملف ليتضمن فقط الإطارات التي سيتم استخدامها للتتبع، والتكبير إلى الخلايا التي تهمك، وفقط في قناة تباين المرحلة.
- تتبع الخلية
- لتتبع ROIs يدوياً، حدد الإطار التالي في تسلسل التصوير وضبط موضع ROIs بالنقر على كل عائد استثمار وسحبه للمحاذاة مع الموضع الجديد للخلية البكتيرية الأصلية.
ملاحظة: إذا لم تتغير الخلايا البكتيرية الموقف، لا تحتاج إلى نقل ROIs. - كرر في كافة الإطارات المتتابعة التي يتم تعقب الخلايا.
- كما تقسيم الخلايا، تعريف الخلايا بنات كما ROIs جديدة، كما هو موضح في الخطوة 9.1، والبدء في تتبع الخلايا المقسمة حديثا.
ملاحظة: إذا تم تعريف الخلايا على أنها ثنائيات، استخدم الدالة تعقب الثنائيات لتعقب ROIs تلقائياً في إطارات محددة. - بمجرد أن يتم تعقب الخلايا من خلال جميع الإطارات المحددة، قم بتصدير البيانات ليتم تحليلها.
- افتح جدول البيانات وحدد القياسات المطلوبة للتحليل (أي سرعة الكائن أو التسارع أو طول المسار).
ملاحظة: في حالة القياس على التوجيه، يلزم قياس طول المسار وطول الخط. طول الخط هو قياس المسافة الاقليدية، أو المسافة المستقيمة من أصل المسار إلى حافة مستعمرة S. aureus. طول المسار هو قياس المسافة المتراكمة، أو مجموع قطع المسار من كافة الإطارات. يمكن حساب التوجيه كنسبة من المسافة الإقليدية، D(E)، (طول الخط)، على المسافة المتراكمة، D(A)، (طول المسار).
- لتتبع ROIs يدوياً، حدد الإطار التالي في تسلسل التصوير وضبط موضع ROIs بالنقر على كل عائد استثمار وسحبه للمحاذاة مع الموضع الجديد للخلية البكتيرية الأصلية.
- القياس الكمي للفلور
- تعريف ROIs للخلايا البكتيرية الفلورية كما هو موضح في الخطوة 9.1.
- تكرار تتبع أو حركة ROIs للخلايا البكتيرية أو المجموعات في الإطارات الفلورية المتبقية.
- تصدير الجدول الذي تم إنشاؤه إلى ملف جدول بيانات لتحليل كثافة الفلورسنت.
- في جدول البيانات، ابحث عن العمود الذي يحتوي على "متوسط الكثافة" والذي يمثل متوسط كثافة الفلورسينس لـ ROI للخلية البكتيرية التي تم تتبعها.
- رسم بياني لقيم "كثافة الوسط" للنظر في التغييرات في الفلوريسنس بمرور الوقت.
ملاحظة: تمثل التغيرات في الفلوريسنس مع مرور الوقت تقلب التعبير الجيني للجين المسمى بالفلورسنت الذي يثير الاهتمام.
النتائج
سيؤدي الاستخدام الناجح للأسلوب الموصوف إلى سلسلة من الإطارات التي تولد فيديو يمكن فيه ملاحظة التفاعلات بين الأنواع بمرور الوقت. التخطيطي في الشكل 1 يوفر مرئيا لتسليط الضوء على الخطوات الرئيسية التي ينطوي عليها إعداد المواد للتصوير. وقد سمح استخدام هذه الطريقة مظاهرة من الخلايا Aeruginosa P. عرض سلوكيات مختلفة في أحادية الثقافة مقابل في تربية الأحياء مع S. aureus. بالمقارنة مع الخلايا P. aeruginosa في أحادية الثقافة التي لا تزال مجمعة في الطوافات، عندما في تربية الأحياء مع S. aureus، P. aeruginosa زادت حركة خلية واحدة نحو مستعمرات S. aureus (الشكل 2A-2B-2B). كما تسمح السلالات البكتيرية المسماة بفلورسنت تصور مجموعات مختلطة من الأنواع البكتيرية. باستخدام GFP المسمى P. aeruginosa سمح الملاحظة أنه بعد P. aeruginosa الخلايا المفردة زيادة في الحركة، وأنها سوف تحيط وغزو في نهاية المطاف S. aureus المستعمرات (الشكل 2C). كما يسمح استخدام الخلايا ذات العلامة الفلورية أيضاً بالتصور من غزو الخلايا P. aeruginosa إلى مستعمرات S. aureus للمرة الأولى(الشكل 2C، أسفل).
بينما ينتج البروتوكول صور عالية الجودة لمراقبة التفاعلات بين الأنواع، هناك العديد من المشاكل الشائعة التي يمكن أن تؤدي إلى تسلسل الإطارات ذات الجودة الرديئة. الرطوبة غير متناسقة على مدى مدة التجربة ومنصات المجففة بشكل غير صحيح هما مشكلتان شائعتان تؤديان إلى الانجراف الناتج عن تحول الوسادة وسحب الخلايا معها خارج FOV (الشكل 3A). التغيرات في الرطوبة تؤثر على جفاف منصات agarose. زيادة الرطوبة يجعل منصات الرطب جدا، مما يسمح للرطوبة لتسوية بين لوحة وأسفل طبق الزجاج القاع. الرطوبة يترك طبقة من السائل سميكة بما يكفي لخلايا موتية سرب أو السباحة من خلال ولا تبقي الخلايا البكتيرية في مستوى واحد. وفي الوقت نفسه، وانخفاض في الرطوبة تجف الوسادة أسرع، مما يؤدي الخلايا إلى الانجراف في وقت مبكر. خطأ شائع آخر عند استخدام هذه الطريقة مع الفلوريسنس هو الحصول على الصور الفلورية بشكل متكرر جدا أو تعريض الخلايا البكتيرية للضوء الفلورسنت لفترة طويلة جدا. فترات اقتناء قصيرة للصور الفلورية تثير الفلوروفورات بشكل متكرر مع ضوء عالي الكثافة من طول موجي محدد. ثم يتفاعل الفلوروفهور المتحمس مع الأكسجين ، مما يسبب تدهور الفلوروفور. يستنفد الضوبل الضوئي الناتج الفلوريسنس حتى يمكن التعبير عن المزيد من الفلوروفور وطويته ، ولكنه لا يضر الخلايا البكتيرية نفسها (الشكل 3B). فقدان الفلوريسنس، ومع ذلك، لا تتداخل مع قياسات التعبير الجيني / البروتين، وترك الخلايا بلا علامات حتى يمكن توليفها تماما fluorophore ومتحمس مرة أخرى. وعلاوة على ذلك، يمكن للأكسجين التفاعل مع الفلوروفوريس متحمس تشكيل أنواع الأكسجين التفاعلي (ROS). هذه الجذور ROS ثم تلف الخلايا البكتيرية، في نهاية المطاف تصبح سامة، مما أدى إلى موت الخلايا داخل عدد قليل من الانقسامات الخلية (الشكل 3C). يمكن أن ينظر بسهولة إلى عمليات photobleaching وphototoxicity الخلايا سوف تفقد أولا الفلوريسانس تماما، وفي إطارات لاحقة، والخلايا سوف تتوقف عن تقسيم وربما يموت في نهاية المطاف (الشكل 3B-3C). واحدة قضية مشتركة نهائية عند إعداد التجربة تبدأ مع خلايا كثيرة جدا لكل FOV أو مع الخلايا قريبة جدا من بعضها البعض، والتي هي عموما أقل من 20 ميكرومتر بعيدا. سوف الخلايا المزدحمة في الإطار الأول تسفر عن مجموعات من تقسيم الخلايا التي تندمج ببساطة في بعضها البعض لأنها تنمو بدلا من التفاعل. بالإضافة إلى ذلك، قد لا يكون لدى الخلايا التي تبدأ قريبة جداً من القرب الوقت الكافي لإنشاء تدرج من الإشارات المفرزة التي يمكن للأنواع الأخرى أن تستجيب لها(الشكل 3D)في حين أن الخلايا البكتيرية البعيدة قد لا تتاح لها الفرصة لمواجهة بعضها البعض خلال مدة التجربة.
ويبين الشكل 4 مثالاً على كيفية تصور قابلية الخلية البكتيرية للتطبيق مع هذا البروتوكول بإضافة يوديد البروديم إلى منصات agarose. يوديد بروبيديوم هو منيعة للخلايا الحية، ولكن يمكن أن تدخل الخلايا مع الأغشية التالفة وربط الأحماض النووية. هنا تم التعامل مع منتصف سجل GFP المسمى WT S. aureus مع وسائل الإعلام وحدها أو مع ناظر الخلايا الخالية المستمدة من P. aeruginosa وصورت مباشرة بعد العلاج. تم تصوير ثلاث قنوات مختلفة: المرحلة، TxRed وGFP. الخلايا الخضراء الزاهية تشير إلى الخلايا الحية التي تعبر بنشاط عن GFP كما هو الحال بالنسبة لS. aureus تعامل فقط مع وسائل الإعلام (الشكل 4A) ، والخلايا الحمراء تشير إلى الخلايا الميتة بروودينيوم iodide الملطخة بالخلايا الأوريوس ، بعد أن تعامل مع P. aeruginosa supernatant (الشكل 4B). في حين يتم عرض نقطة زمنية واحدة فقط، يمكن تكييف هذه الطريقة لتحديد صلاحية الخلية أثناء التصوير الحي الفاصل الزمني.
يمكن إجراء العديد من التحليلات بعد التصوير لتحديد جوانب التفاعل بين الأنواع. على سبيل المثال، يمكن أن تتبع الخلية توفير قياسات لتوجيهة P. aeruginosa حركات خلية واحدة نحو مجموعة من S. aureus. يتم تعقب حركات خلايا Aeruginosa الفردية من الإطار خلية يترك الطوافة من خلال الإطار الذي الخلية تصل إلى الكتلة S. aureus (الشكل 5A). المسافة بين طوف P. aeruginosa وS. aureus الكتلة توفير المسافة إقليديان، D(E)،في حين أن أطوال المسار الكلي توفر المسافة المتراكمة، D(A) (الشكل 5B). يتم حساب توجيه كل خلية كنسبة من D(E)/ D(A). في تجارب الثقافة المشتركة، تحرك WT P. aeruginosa نحو WT S. aureus مع توجيه أعلى بكثير من نحو S. aureus ΔagrBDCA، وهو متحول يفتقر إلى عوامل سرية AGR- المنظمة، التي سبق أن تم تحديدها لتكون ضرورية حركية الاتجاه نحو S. aureus24 (الشكل 5C).
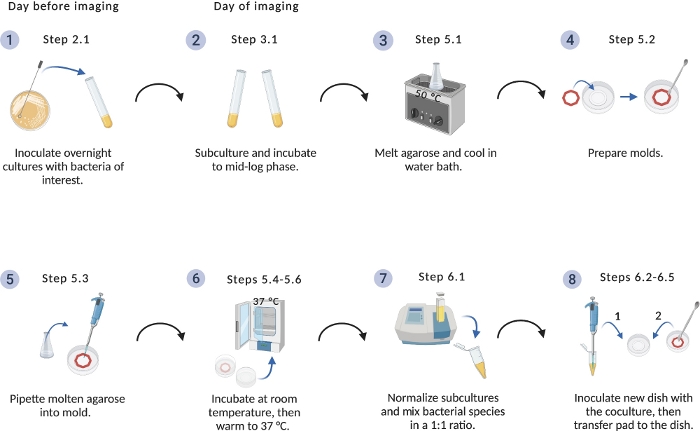
الشكل 1: تخطيطي من بروتوكول إعداد التصوير.
نظرة عامة على الخطوات الحاسمة لإعداد الثقافات البكتيرية ومنصات agarose. تم إنشاؤه باستخدام BioRender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
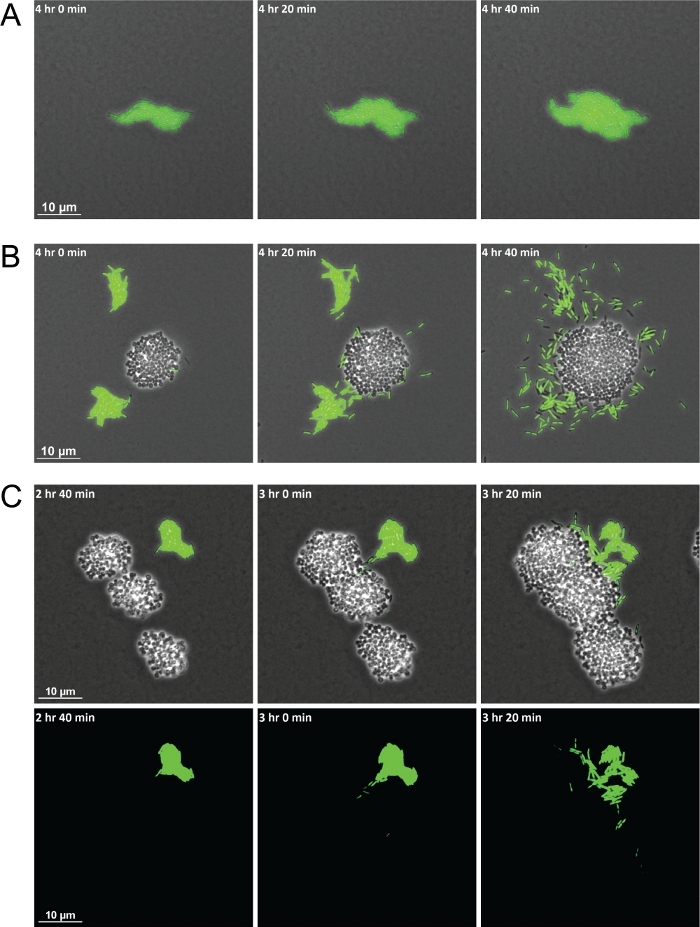
الشكل 2: الفاصل الزمني، والمجهر التصوير الحي يظهر الاختلافات في السلوك P. aeruginosa عندما cocultured مع S. aureus.
لقطات مبكرة تمثيلية من P. aeruginosa (عصيات، الأخضر) في أحادية الثقافة (A) وفي تربية الثقافات مع S. aureus (cocci, unmarked) (B). (C)Fluorescently المسمى البكتيريا تسمح للتصور من P. aeruginosa خلايا واحدة غزو مجموعات S. aureus. المرحلة التباين وتراكب قناة GFP (أعلى) وقناة GFP وحدها (أسفل). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
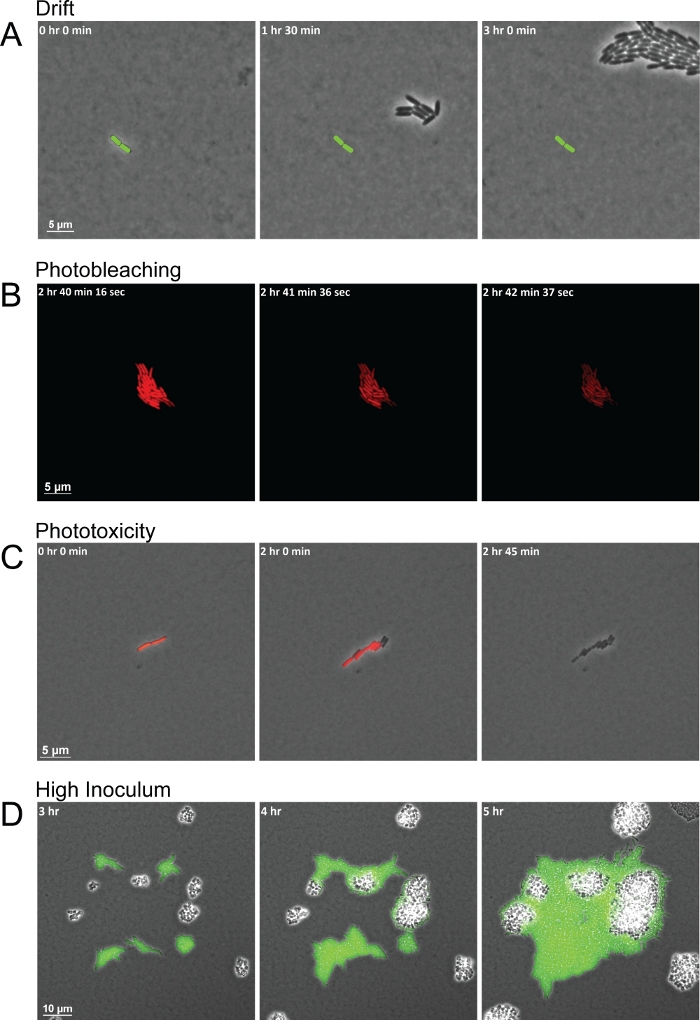
الشكل 3: لقطات مفاجئة تمثيلية لقضايا التصوير الشائعة التي تؤدي إلى ضعف الحصول على الصور.
(A) منصات المجففة بشكل غير صحيح والرطوبة غير متناسقة تؤدي إلى الانجراف من الخلايا عبر FOV على مدى مدة التصوير. يتم وضع علامة على موضع الخلية المؤسسة في كل إطار (قضيب أخضر). (ب) سوف يستنفد الضوبلاخ من التعرض للضوء لفترة طويلة جداً مستويات قابلة للكشف من الفلورسنس لفترة من الزمن، ولكنه لا يقتل الخلايا. (C)الضوئية نتيجة للتعرض المتكرر للضوء يؤدي إلى موت الخلايا. تظهر العلامات الأولى للإكسيكائية الضوئية عندما تتوقف الخلايا عن التألق وتفشل في الانقسام. (D) ارتفاع الأولي inoculum حشود الخلايا في FOV ويمنع مراقبة التفاعلات بين الأنواع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
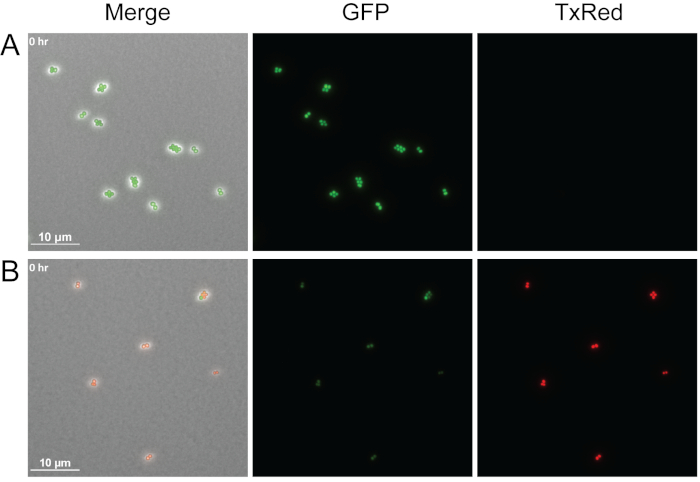
الشكل 4: مقارنة الخلايا الحية مقابل الخلايا الميتة S. aureus.
لقطات مبكرة تمثيلية لـ WT S. aureus المسمى GFP تعامل مع أي وسيط بمفرده (A) أو خال من الخلايا P. aeruginosa supernatant (B). تم تصوير الخلايا على الفور بعد العلاج. الخلايا الحية (الخضراء) التعبير بنشاط GFP واستبعاد يوديد بروبديسيوم، في حين الخلايا الميتة (أحمر) تفقد الفلورسينس GFP والغشاء Permeabilization يسمح يوديد بروبيديوم لدخول الخلايا وربط الأحماض النووية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحليل تتبع الخلايا P. aeruginosa في تربية الأحياء مع S. aureus.
سابقا، تم استخدام هذه الطريقة لتنفيذ تتبع الخلية من WT P. aeruginosa في تربية الأحياء مع إما WT أو ΔagrBDCA S. aureus. (أ) تمثيل P. aeruginosa مسارات خلية واحدة في تربية الأحياء مع S. aureus ΔagrBDCA. (ب)التخطيطي لمسافة الإقليديان (D(E)) والمسافة المتراكمة (D(A)) القياسات المستخدمة لتحديد التوجيه ((D(E)/ D(A)). (C) قياسات توجيه واحد WT P. aeruginosa الخلايا في تربية الأحياء مع WT و ΔagrBDCA S. aureus. تم تعديل هذا الرقم من ليمولي وآخرون 201924. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تصف الأساليب المعروضة هنا بروتوكولاً للتصوير بالخلايا الحية لتفاعلات الأنواع البكتيرية على مستوى الخلية الواحدة مع تعديلات لتطبيقات أخرى بما في ذلك تتبع الخلايا ومراقبة صلاحية الخلايا. هذه الطريقة تفتح آفاقا جديدة لدراسة السلوكيات وحيدة الخلية من الكائنات الحية الدقيقة في تربية الأحياء مع الأنواع الأخرى مع مرور الوقت. وعلى وجه التحديد، يوضح البروتوكول فائدة طريقة الاستزراع المشترك هذه في مراقبة سلوكيات السطح البكتيرية، خاصة عند دراسة الكائنات الحية التي لها كل من الزوائد المرتبطة بالسطح والسائل للحركية. على سبيل المثال، من خلال الحد من حركة البكتيريا إلى سطح في مستوى واحد من التركيز، يمكن تصور الحركة المتزايدة والاتجاهية بوساطة بيلي P. aeruginosa استجابة لS. aureus.
وكما ذكر سابقاً، فإن تحقيق النتائج المثلى باستخدام طريقة التصوير هذه يتطلب النظر في عدة شروط، بما في ذلك درجة الحرارة والرطوبة في العينة وأدوات التصوير (أي الأهداف والمرحلة). لمزيد من التلميحات واستكشاف الأخطاء وإصلاحها، راجع الملف الإضافي 1. خطوة حاسمة في الاستخدام الناجح للبروتوكول هو إعداد منصات agarose، كما منصات التجفيف غير كافية هي واحدة من المشاكل الأكثر شيوعا. كما هو مبين في الشكل 3A، إذا لم يتم تجفيف منصات طويلة بما فيه الكفاية ، والانجراف يظهر في بداية التصوير الفاصل الزمني ، في حين أن منصات التي يتم تجفيفها لفترة طويلة جدا بداية لتقليص والخلايا الانجراف من FOV بضع ساعات في التصوير. إن ضمان أن جميع المواد يتم تسخينها مسبقاً وصيانتها في درجة حرارة ورطوبة موحدة على مدى مدة التجربة، من خلال استخدام حاضنة المرحلة العليا ومناديل رطبة خالية من الوبر، سيساعد على تقليل الانجراف. وينصح أيضا أن يتم دائما وسادة احتياطية في حالة عدم تجفيف الوسادة الأولى بشكل صحيح أو الدموع أثناء نقل من القالب إلى طبق العينة. بالإضافة إلى ذلك، من المهم استخدام متوسطة منخفضة الأومفلوروس، سواء لنمو الثقافات البكتيرية أو لصنع منصات من أجل تقليل الفلورس الخلفية من الوسط عند تصوير الخلايا. فمن المستحسن استخدام الحد الأدنى من وسائل الإعلام للمجهر، منذ وسائل الإعلام الغنية غالبا ما يكون ذات الفلوروست عالية. بدءا من inoculum منخفض الكثافة وحتى التوزيع المكاني للخلايا في FOV هي أيضا العوامل الرئيسية في هذه الطريقة. على وجه التحديد، في الدراسات السابقة تقييم P. aeruginosa و S. Aureus التفاعلات، وهذا سمح للبكتيريا لتوليد تدرج كاف من العوامل التي يفرز يمكن الكشف عنها بعد ذلك من قبل الأنواع الأخرى الموجودة(الشكل 2B).
وعلى الرغم من فوائد هذه الطريقة، هناك أيضا قيود تشمل سعرها، وطبيعة الإنتاجية المنخفضة، والقيود على الفلور، والاعتماد الكبير على السيطرة على الظروف البيئية. ويبين الشكل 3B-3C القيود الرئيسية لاستخدام المجهر المفلور. كما هو مُناقش في قسم النتائج، إذا تم التقاط الصور الفلورية في فترات قصيرة، يمكن أن يحدث الوبلاخ الضوئي وxicity الضوئية. من أجل تجنب هاتين النتيجتين، ينبغي أن تؤخذ فترات صورة الفلورسنت بعيدا بما فيه الكفاية وبصرف النظر مع أقل وقت التعرض للضوء الفلورسنت ممكن لتصور ما زال بشكل كاف الفلوروفور. بالإضافة إلى ذلك، عند تحديد الفاصل الزمني للتصوير المفلور، من المهم النظر في وقت النضج لكل فلوري. الفلوروفورس المستخدمة في سلالات P. aeruginosa و S. aureus هو مبين في الشكل 2، الشكل 3 والشكل 4، على سبيل المثال ، يكون وقت النضج من حوالي 20 دقيقة ، وبالتالي يمكن أن تكون متحمسة كل 20 دقيقة دون القلق من الآثار المحتملة photobleaching. وفي الوقت نفسه، عيب آخر من هذه الطريقة هو أنه لا يسمح لملاحظات التفاعلات بين الأنواع المتأخرة مرة واحدة الخلايا تصل إلى كثافة خلايا عالية. من أجل تصور الخلايا البكتيرية الفردية، يجب أن تبقى في مستوى واحد من التركيز. ومع ذلك، بمجرد أن يصل عدد السكان إلى كثافة الخلايا العالية، تبدأ الخلايا في النمو في أكثر من طائرة واحدة.
يمكن تعديل هذه الطريقة لدراسة الأنماط الظاهرية المختلفة مثل جدوى الخلية(الشكل 4)والتعبير عن الجينات ذات الاهتمام (البيانات غير مبينة). ويبين الشكل 4 مثالاً على كيفية تكييف الطريقة لتصور الجدوى البكتيرية بإضافة يوديد البروديم إلى منصات agarose. تطبيق آخر لهذه الطريقة هو قياس التعبير الجيني البكتيري / البروتين في تربية الحيوانات مع كائن آخر من خلال المراسلين الفلورسنت. على سبيل المثال، يمكن دمج الفلوروفهورات المتعددة في متجه بلازميد أو كروموسوم بكتيري لدراسة التعبير عن جينات أو بروتينات مختلفة في وقت واحد. ومن المهم هنا اختيار الفلوروفورات التي لا تحتوي على ثيرات متداخلة وأطياف انبعاث. وأخيرا ، فإن استخدام تتبع الخلايا البكتيرية في تحليل ما بعد التصوير تمكن من اتجاه (الشكل 5) ، والسرعة والتسارع ، من بين قياسات أخرى ، ليتم حسابها وكذلك24.
بشكل عام ، تعزز طريقة تصوير الثقافة المشتركة هذه المقتبسة من بروتوكولات الزراعة الأحادية الموصوفة سابقًا القدرة على تصور سلوكيات الأنواع البكتيرية المتعددة في زراعة التكثّر. توفر هذه الطريقة الفرصة لدراسة الميكروبات من منظور متعدد الثقافات ، مما سيزيد من فهم كيفية تغيير كل نوع من سلوكياته بطريقة خلية واحدة ، مما يوفر في نهاية المطاف نظرة جديدة على كيفية تفاعل الأنواع البكتيرية في بيئات بوليكرو.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل من خلال تمويل من مؤسسة التليف الكيسي ما بعد الدكتوراه إلى كلية انتقال جائزة ليمولي18F5 (DHL)، والتليف الكيسي مؤسسة صغار أعضاء هيئة التدريس جائزة التوظيف LIMOLI19R3 (DHL)، وNIH T32 منحة التدريب 5T32HL007638-34 (ASP). نشكر جيفري مايسنر، مينسو كيم، وإيثان غارنر على مشاركة البروتوكولات الأولية والمشورة للتصوير وصنع منصات.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
References
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385(2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232(2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56(2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976(2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365(2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved