Method Article
Кинетическая визуализация одноклеточных межвидовые бактериальные взаимодействия
В этой статье
Резюме
Этот протокол визуализации живых бактериальных клеток позволяет визуализировать взаимодействия между несколькими бактериальными видами на одноклеточном уровне с течением времени. Промежуток времени визуализации позволяет для наблюдения каждого бактериального вида в монокультуре или кокультуры для допроса межвидовые взаимодействия в многовидовом бактериальных сообществ, в том числе отдельных клеток подвижности и жизнеспособности.
Аннотация
Полимикробные сообщества широко распространены в природе, однако изучение их взаимодействия на одноклеточном уровне затруднено. Так, был разработан метод на основе микроскопии для наблюдения за межвидовыми взаимодействиями между двумя бактериальными патогенами. Здесь продемонстрировано использование этого метода для допроса взаимодействий между пестрым грам-отрицательным патогеном Pseudomonas aeruginosa и немостойким грамположительно-положительным патогеном, золотистым стафилококком. Этот протокол состоит из совместного инокуляции каждого вида между крышкой и агарозной площадкой, которая поддерживает клетки в одной плоскости и позволяет визуализировать бактериальное поведение как в пространстве, так и во времени.
Кроме того, продемонстрирована здесь промежуток времени микроскопия идеально подходит для визуализации ранних взаимодействий, которые происходят между двумя или более бактериальных видов, в том числе изменения в подвижности бактериальных видов в монокультуре и в совместной культуре с другими видами. Из-за характера ограниченного пространства образца в установке микроскопии, этот протокол менее применим для изучения более поздних взаимодействий между бактериальными видами, как только популяции клеток слишком высоки. Тем не менее, Есть несколько различных применений протокола, которые включают в себя использование окрашивания для визуализации живых и мертвых бактериальных клеток, количественная оценка гена или экспрессии белка через флуоресцентные репортеры, и отслеживание движения бактериальных клеток в обоих отдельных видов и многовидовых экспериментов.
Введение
Полимикробные сообщества распространены в природе,охватывающих различные экологические 1,,2,,3 ичеловеческие ниши 4,,5. Некоторые из самых известных полимикробных инфекций в болезничеловека включают стоматологические биопленки 6,хронические раны 7,8, и респираторных инфекций у лиц с хроническойобструктивной болезнью легких 9, аппаратискусственной вентиляции легких пневмонии 10, и генетическое заболевание муковисцидоз (CF)11,12. Эти инфекции часто состоят из различных видов микробов; Однако в последнее время основное внимание уделяется взаимодействию между грамположительной бактерией Staphylococcus aureus и грам-отрицательной бактерией Pseudomonas aeruginosa. Исследования, в том числе пациентов coinfected с этими организмами и в пробирке анализы показывают, как конкурентные и совместные взаимодействия, которые могут иметь глубокое и неожиданное влияние на прогрессирование заболевания, микробное выживание, вирулентность, метаболизм, и антибиотик восприимчивость (подробно рассмотрены Hotterbeekx и др. 201713 и Лимоли и Хоффман 20193).
Растущий интерес к межвидовому взаимодействию во время инфекции дал различные методы для изучения поведения полимикробного сообщества. Как правило, эти исследования использовали пластины или бульон основе анализов для изучения фенотипических различий между монокультурой и кокультурой. Например, кокулирование P. aeruginosa и S. aureus на твердых поверхностях позволило визуализировать ингибирование роста или изменения в генотипе колонии, пигменте илипроизводстве полисахаридов 14,,15,,16. Смешанные виды биопленок, на биотических или абиотических поверхностях, а также coculturing бактериальных видов в жидкой культуре также позволило измерения изменений в росте, метаболизм, толерантность к антибиотикам, конкуренция и жизнеспособность, в дополнение к генной и белковойэкспрессии 17,18. Хотя эти массовые культурные эксперименты показали понимание того, как P. aeruginosa и S. aureus могут влиять друг на друга в масштабах сообщества, они не в состоянии ответить на важные вопросы о взаимодействиях, которые происходят на одноклеточном уровне. Представленный здесь метод дополняет подходы к изучению межвидовых взаимодействий, сосредоточив внимание на изменениях в движении, жизнеспособности клеток и экспрессии генов отдельных клеток в кокультурном сообществе с течением времени.
Одноклеточные взаимодействия могут сильно отличаться от взаимодействий, которые происходят в сообществе ячеек. С помощью одноклеточного анализа неоднородность в сообществе может быть количественно оценена для изучения того, как пространственное размещение клеток влияет на динамику сообщества или как уровни экспрессии генов и белков меняются в отдельных членах группы. Отслеживание ячеек может также дать представление о том, как одиночные клетки перемещаются и ведут себя с течением времени, через несколько поколений. Отслеживая движение клеток и изменения в экспрессии генов одновременно, можно сделать корреляцию между колебаниями генов и соответствующими фенотипами. Описаны предыдущие протоколы изучения отдельных видов бактерий на одноклеточном уровне. Эти исследования используют живые клетки изображения с течением времени в одной плоскости, и были полезны для наблюдения фенотипов, как делениеклеток и чувствительность к антибиотикам 19,20. Дополнительная живая микроскопия была использована для мониторинга роста, подвижности, колонизации поверхности и формирования биопленки отдельных бактериальныхвидов 21,,22,,23. Однако, в то время как эти исследования были проницательными для понимания физиологии бактерий в монокультуре, эксперименты по наблюдению одноклеточного поведения нескольких бактериальных видов с течением времени в кокультуре ограничены.
Здесь предыдущие протоколы, используемые для одно вида изображения были адаптированы для изучения взаимодействий между P. aeruginosa и S. aureus. Эти организмы могут быть дифференцированы в фазовом контрасте на основе их морфологии клеток(P. aeruginosa являются бациллы и S. aureus являются cocci). Разработка этого метода недавно позволила визуализировать ранее неописанные подвижности поведения P. aeruginosa в присутствии S. aureus24. Было установлено, что P. aeruginosa способен чувствовать S. aureus на расстоянии и реагировать с увеличением и направленной одноклеточных движений к скоплениям S. aureus клеток. P. aeruginosa движение в сторону S. aureus было установлено, требуют типа IV pili (TFP), волосы, как прогнозы, чьи скоординированные расширение и опровержение генерировать движение называется подергиванияподвижность 25.
Эти исследования демонстрируют полезность этого метода для допроса более ранних взаимодействий между видами. Тем не менее, визуализация при высокой плотности клеток в более поздних точках времени взаимодействия затруднена, учитывая, что одиночные слои клеток больше не могут быть идентифицированы, что в основном создает проблемы во время пост-изображения анализа. Учитывая это ограничение, метод лучше всего подходит для более ранних взаимодействий, которые затем могут сопровождаться традиционными макроскопическими анализами при более высокой плотности клеток, репрезентативными для более поздних взаимодействий. Дополнительные ограничения этого метода включают в себя низкую пропускную способность природы, так как только один образец может быть изображен в то время, и стоимость микроскопа, камеры и экологической камеры. Кроме того, флуоресцентная микроскопия создает риски для бактериальных клеток, таких как фототоксичность и фотопотливость, что ограничивает частоту флуоресценции изображения могут быть приобретены. Наконец, агарозные прокладки, используемые в этом методе, очень восприимчивы к изменениям в окружающей среде, что делает его критическим для контроля условий, таких как температура и влажность, учитывая, что колодки могут начать сокращаться или расширяться, если условия не являются правильными. Наконец, хотя этот метод не имитирует окружающую среду хозяина, он дает подсказки о том, как различные бактериальные виды реагируют на поверхностях, которые могут быть продолжены в анализах, предназначенных для имитации условий окружающей среды/хозяина.
Этот метод отличается от предыдущих исследований отслеживания одноклеточного движения, в том, что клетки прививаются между крышкой и агарозой площадку, ограничивая клетки на поверхность. Это позволяет отслеживать ячейки с течением времени в одной плоскости; однако, ограничивает циклы временного поверхностного взаимодействия наблюдается, когда клетки погружены в жидкость26. Дополнительным преимуществом изображений бактерий под агарозной площадкой является то, что она имитирует макроскопические пластины на основе подповерхно-поверхностных анализов прививки классически используется для изучения P. aeruginosa подергиванияподвижность 25. В этом анализе, бактериальные клетки прививаются между дном чашки Петри и агара, сохраняя клетки в одной плоскости, как они перемещаются по нижней части блюда наружу от точки прививки, так же, как этот протокол микроскопии.
Протокол замедленной микроскопии для визуализации межвидового взаимодействия, представленный здесь, состоит из 1) подготовки бактериального образца и агарозной площадки, 2) выбора параметров микроскопа для получения изображений и 3) поствизионного анализа. Детальная визуализация движения клеток и отслеживания может быть выполнена путем получения изображений с короткими временными интервалами путем фазового контраста. Микроскопия флуоресценции также может быть использована для определения жизнеспособности клеток или экспрессии генов с течением времени. Здесь мы покажем один пример адаптации к микроскопии флуоресценции за счет добавления красителей жизнеспособности к прокладкам агарозы.
протокол
ПРИМЕЧАНИЕ: Полное описание и номера каталогов для всех материалов в этом протоколе можно найти в таблице материалов.
1. Подготовка минимальных средств массовой информации M8T
- Приготовьте 1 л минимальной соляной базы M8 (5x) путем растворения 64 г Na2HPO4 7H2O, 15 г KH2PO4и 2,5 г NaCl в 800 мл ультрачистой воды (UPW, резистория 18 МЗ/см) в бутылке 2 л. рН до 7,6. Полный объем до 1 л с UPW. Автоклав за 45 мин.
- Приготовьте 500 мл раствора глюкозы (20% ж/в) путем растворения 100 г глюкозы в 400 мл UPW в бутылке 1 л. Полное решение до 500 мл с UPW. Автоклав за 45 мин.
- Приготовьте 500 мл триптонового раствора (20% ж/в) путем растворения 100 г триптона в 400 мл UPW. Комплект до 500 мл с UPW. Автоклав за 45 мин.
- Приготовьте 1 л минимального мультимедиа M8 и 10% триптона (M8T), добавив 200 мл минимальных солей 5x M8 (1x final), 10 мл 20% глюкозы (1x final), 10 мл 20% глюкозы (1x final), 10 мл 20% глюкозы (1 л 0,2% финал), 1 мл 1 M MgSO4 (1 мМ финал), и 50 мл 20% триптон (1% финал) до 600 мл UPW. Комплект до 1 л с UPW. Фильтр через стерильный фильтр емкостью 0,2 мкм в стерильную бутылку для хранения мультимедиа объемом 500 мл.
День 1:
2. Подготовка бактериальных ночных культур
- Прививка 5 мл минимальных средств массовой информации M8T с одной колонией P. aeruginosa или S. aureus (включая антибиотики, когда это необходимо) и инкубировать на ночь при 37 градусов по Цельсию с аэрацией не более 16 ч.
ПРИМЕЧАНИЕ: Бактериальные патогены P. aeruginosa и S. aureus были использованы для этого метода, потому что они обычно coisolated от хронических инфекций, и изучение их взаимодействия важно понять, как они способствуют исходы пациентов во время полимикробных инфекций. Другие бактериальные виды могут быть использованы в зависимости от фокуса исследования.
День 2:
3. Субкультура бактериальных штаммов
- Субкультура P. aeruginosa 1:500 и S. aureus 1:1000 в 5 мл свежих M8T (включают антибиотики, когда это необходимо). Инкубация с аэрацией при 37 градусов по Цельсию до тех пор, пока культуры не достигнут фазы среднего журнала (OD600 и 0,3 - 0,5).
4. Подготовка материалов для колодки формы
- Подготовка металлических шпателей путем нагрева конца квартиры, округлые лабораторные шпателем с горелкой Bunsen до половины плоского конца могут быть согнуты под углом 90 ". Нагрейте конец другого плоского, округлого лабораторного шпателя и слегка согните последние 10 мм под углом 45 градусов по Цельсию.
- Отрежьте четыре угла силиконовых форм так, чтобы формы вписываются в блюдо диаметром 35 мм.
- Стерилизовать шпатели и пару пинцетов, добавив 70% этанола и передавая их через пламя горелки Bunsen.
- Очистите блюдо и силиконовые формы с 70% этанола и высушите их без ворса салфетки.
5. Подготовка агарозных прокладок
ПРИМЕЧАНИЕ: Прокладки готовятся с минимальными средствами массовой информации M8T в качестве питательного источника для бактерий, используемых в этом протоколе. Тем не менее, питательные вещества, используемые в колодки могут быть изменены для различных организмов.
- Растопить 2% низкоплавильной агарозы в 10 мл M8T в чистой колбе 50 мл Erlenmeyer. Микроволновая печь в короткие промежутки времени (2-5 с) до тех пор, пока агароза находится в растворе, чтобы предотвратить содержимое колбы от кипения. После того, как расплавленный, дайте остыть в 50 градусов по Цельсию водяной бане, по крайней мере 15 мин.
- Подготовка формы путем выравнивания силиконовой вырез с отверстием в 35 мм блюдо и нажмите слегка шпателем, чтобы обеспечить силикон к блюду, и удалить все пузырьки воздуха между плесенью и блюдом.
- После охлаждения, пипетка 915 йл расплавленной агары в форму. Оставьте крышку приоткрытой и дайте площадке высохнуть при комнатной температуре в течение 30 минут.
- Накройте блюдо крышкой и оставьте при комнатной температуре еще на 2 ч.
- Подготовка влажности салфетки, плотно свертывая ворсинки без салфетки. Поместите свернутую салфетку внутрь стерильной чашки Петри и равномерно добавьте 500 йл стерильной воды через салфетку. Тепло до 37 градусов по Цельсию в течение 1 ч.
- Разогреть подушечку и стерильное блюдо 35 мм до 37 градусов по Цельсию в течение 1 ч.
6. Подготовка бактериальных клеток и инокулирующих прокладок
- Измерьте OD600 каждой субкультуры и разбавите P. aeruginosa до OD600 и S. aureus до OD600 и 0.10 в M8T, предварительно вооперированном до 37 градусов по Цельсию. Смешайте P. aeruginosa и S. aureus в соотношении 1:1 и вихрь.
ПРИМЕЧАНИЕ: Если штаммы требуют антибиотиков, антибиотики могут быть добавлены в ночь и субкультуры, но не должны быть добавлены при смешивании видов для визуализации, если она влияет на другие виды в кокультуре. Для каждого используемого организма/плазмида необходимо определить стабильность плазмида и воздействие антибиотиков на все виды в кокультуре. - Pipette 1 йл кокультуры равномерно по дну предварительно разогретой, стерильной 35 мм стеклянной крышки блюдо.
- Удалите силиконовый вырез из формы с помощью стерильных пинцетов.
- Удалите площадку из блюда с помощью стерильных шпателем.
- Скольжение слегка изогнутый шпатель под краем колодки, держа плесень вверх дном, чтобы бросить его на стерильную крышку пластины Петри.
ПРИМЕЧАНИЕ: Позаботьтесь, чтобы не заставить площадку, или он будет рип. Следите за тем, какая сторона колодки находится внизу.
- Скольжение слегка изогнутый шпатель под краем колодки, держа плесень вверх дном, чтобы бросить его на стерильную крышку пластины Петри.
- Передача площадку к блюду с бактериальными клетками, снизу вниз, путем скольжения 90 "угловой шпатель под площадку и поместив его на верхней части привитых крышки. Используйте 90 "угловой шпатель, чтобы сделать площадку флеш против крышки и осторожно выжимать любые пузырьки воздуха.
- Удалить избыток влаги из влажных салфеток затем разместить по краю блюда, убедившись, что он не касается площадку. Образец готов к визуализации.
7. Настройка микроскопа для живой визуализации
- Теплая экологическая камера до 37 градусов по Цельсию по крайней мере 2 ч до экспериментальной настройки.
- Включите все компоненты, включая микроскоп, компьютер и источники света для изображения яркого поля и флуоресценции.
- Откройте программное обеспечение для визуализации и убедитесь, что источники света подключены и работают.
- Выполните освещение Кёлер27, чтобы выровнять все плоскости изображений.
- Во-первых, принести отмеченные coverslip в центре внимания с 20x цель с помощью "пустышка" блюдо. Убедитесь, что конденсаторная башня установлена в "открытом" положении.
ПРИМЕЧАНИЕ: Освещение Кёлер должно быть выполнено для каждой уникальной цели/образца для правильного выравнивания плоскостей изображения. Тем не менее, фокус и выравнивание с "пустышка" блюдо на более низком увеличении ускоряет настройку на живых образцов при более высоком увеличении, чтобы ограничить время между настройкой и время начала эксперимента. - Сосредоточьте конденсатор.
- Закройте полевой диафрагмой.
ПРИМЕЧАНИЕ: Должна появиться восьмиугольная диафрагма. Если конденсатор полностью не в фокусе, все поле зрения (FOV) будет казаться темным. - Поверните конденсатор фокусировки ручки до восьмиугольник края четкие.
ПРИМЕЧАНИЕ: Интенсивность света будет увеличиваться по мере приближения плоскостей изображения к правильному выравниванию.
- Закройте полевой диафрагмой.
- Выровняй конденсатор.
- Центр конденсатор поля путем регулировки выравнивания ручки.
ПРИМЕЧАНИЕ: Восьмиугольник должен быть по центру к середине FOV. Выравнивающие ручки отличаются в зависимости от микроскопа. Например, некоторые конденсаторы микроскопа имеют ручки, в то время как другие имеют винты, требующие винт водителя.
- Центр конденсатор поля путем регулировки выравнивания ручки.
- Сосредоточьте ламповую нить и отрегулируйте диафрагму конденсата.
- Поместите фазовой телескоп или объектив Бертрана в световой путь, чтобы наблюдать за задней фокусной плоскости цели.
ПРИМЕЧАНИЕ: Там должно быть два концентрических круга. - Включите ручку фокусировки объектива Bertrand до тех пор, пока кольца не будут выглядеть хрустящими.
- Снимите объектив Бертрана со световой дорожки.
- Поместите фазовой телескоп или объектив Бертрана в световой путь, чтобы наблюдать за задней фокусной плоскости цели.
- Откройте диафрагму поля до тех пор, пока восьмиугольник не будет находится за пределами FOV.
- Измените цель 100x и сдвиньте соответствующее кольцо фазы на место, прежде чем добавить каплю масла погружения, и поместите подготовленный образец блюда на вершине.
- Выполните освещение Кёлер на 100x цели с бактериальным блюдом образца.
- Во-первых, принести отмеченные coverslip в центре внимания с 20x цель с помощью "пустышка" блюдо. Убедитесь, что конденсаторная башня установлена в "открытом" положении.
- Сосредоточьтесь только на бактериях, использующих тонкую регулировку. После того, как бактерии в FOV сосредоточены через окуляр, переключить световой путь к камере, нажав кнопку камеры на микроскоп.
- Нажмите опцию Фазы в программном обеспечении для визуализации.
- Отрегулируйте процент DIA светодиодный свет, испускаемый путем выбора источника света в программном обеспечении и либо вручную ввода желаемого процента света, который будет использоваться или скольжения бар по шкале светового процента.
- Отрегулируйте время воздействия светодиодного света DIA, нажав на источник света и либо вручную введя желаемое время экспозиции, либо выбрав время экспозиции из предоставленного меню высадки.
ПРИМЕЧАНИЕ: Время экспозиции будет варьироваться в зависимости от используемой камеры. - При использовании флуоресценции отрегулируйте настройки камеры в каждом соответствующем канале (т.е. TxRed, GFP), нажав на флуоресцентный канал интереса.
- Установите процент излучаемого света флуоресценции, затем отрегулируйте время экспозиции (как выполняется в шагах 7.7 и 7.8 для DIA LED света).
- Кроме того, измените глубину бита, чтобы настроить динамический диапазон, выбрав один из других вариантов глубины бита в меню визуализации.
- Выберите позиции, представляющие интерес для XY, нажав на опцию XY в меню управления приобретением.
- Переместите положение сцены с палкой радости, или, нажав и перетаскивая FOV на экране, и нажмите на пустую коробку, чтобы сохранить X и Y координаты определенной позиции.
ПРИМЕЧАНИЕ: Выбор не более трех различных позиций XY, как можно ближе друг к другу, рекомендуется для приобретения замедленного действия.
- Переместите положение сцены с палкой радости, или, нажав и перетаскивая FOV на экране, и нажмите на пустую коробку, чтобы сохранить X и Y координаты определенной позиции.
- Включите идеальную систему фокусировки (PFS), либо нажав на поле PFS на вкладке XY меню управления приобретением или нажав кнопку PFS на панели управления джойстиком радости.
- Поверните ручки тонкой регулировки, чтобы сосредоточиться на бактериальных клетках.
- Нажмите кнопку PFS для каждой позиции XY, как только ячейки находятся в нужной плоскости фокусировки.
ПРИМЕЧАНИЕ: PFS компенсирует дрейф в оси З во время экспериментов замедленного действия. Это необходимо для поддержания фокуса бактериальных клеток с течением времени. Различные производители имеют различные системы компенсации. - Выберите условия приобретения изображения, включая интервал приобретения и частоту для каждого канала (например, контраст фазы и каждый фторфор), выбрав из вариантов в меню управления приобретением.
ПРИМЕЧАНИЕ: Для экспериментов, представленных здесь, фазовые контрастные изображения приобретаются с интервалом каждые 5-10 с, в то время как флуоресцентные изображения в каналах GFP и TxRed приобретаются каждые 20 минут. - Начните визуализацию после настройки микроскопа и приобретения.
8. Необязательно: Модификации для живой / мертвой визуализации
- Растопить 2% агарозы в 10 мл M8T и дать остыть в 50 градусов по Цельсию водяной бане, по крайней мере 15 мин.
- Добавьте 1 мМ йодида пропидия в расплавленную агарозу.
- После охлаждения, пипетка 915 йл агарозы в подготовленной форме.
- Оставьте крышку приоткрытой и дайте площадке высохнуть при комнатной температуре в течение 30 минут. Защитите от света.
- Накройте блюдо крышкой и оставьте при комнатной температуре еще на 2 ч.
- Подготовка влажности салфетки.
- Ролл без ворса бумаги протрите плотно.
- Поместите салфетку в стерильную чашку Петри и добавьте в салфетку 500 мл стерильной воды.
- Инкубационный при 37 градусов по Цельсию в течение 1 ч.
- Инкубировать подушечку и стерильную 35-мм тарелку при 37 градусов по Цельсию за 1 ч.
- Приступить к прививке блюдо, как указано в разделе 6: Подготовка бактериальных клеток и инокулирующих прокладок.
9. Анализ данных
- Идентификация ячеек
- Открытый файл изображения в программном обеспечении изображения и обрезать файл только включить кадры, которые будут использоваться для отслеживания, увеличено до клеток, представляющих интерес, и только в фазовом контрастном канале.
ПРИМЕЧАНИЕ: Обрезанный файл может быть сохранен в качестве нового файла, в котором данные отслеживания могут храниться без вмешательства в исходный файл. - Выберите вариант выбора областей, представляющих интерес (ROI) в меню управления анализом, и определите ИИ, отслеживая либо отдельные бактериальные клетки, либо кластеры клеток в первом кадре, которые будут использоваться для анализа.
ПРИМЕЧАНИЕ: ROIs можно определить вручную или как дыни.- Ручное определение рентабельности инвестиций
- Отслеживайте периметр каждой отдельной бактериальной клетки или кластеров клеток, чтобы вручную определить ИИ.
ПРИМЕЧАНИЕ: В программном обеспечении анализа, P. aeruginosa, или других стержневидных клеток, можно вручную проследить, выбрав Ellipse ROI и рисунок эллипса скорректированы на размер бактериальной клетки. Кроме того, опция roi Polygon может быть выбрана для отслеживания нетрадиционных ИИ, таких как кластеры ячеек.
- Отслеживайте периметр каждой отдельной бактериальной клетки или кластеров клеток, чтобы вручную определить ИИ.
- Определить бинарные ИИ
- Нажмите на опцию Binary to ROI, чтобы определить бинарные ИИ.
ПРИМЕЧАНИЕ: Объекты определяются в двоичном слое, основанном на отделении темных пикселизированных бактериальных клеток от более светло-пикселизированного фона в фазовом контрастном канале. - Для порога ячеек выберите параметр Порог в меню управления анализом. Выберите канал интереса и сдвиньте бары в гистограмме флуоресценции, чтобы настроить значения интервала порога.
ПРИМЕЧАНИЕ: Двоичная идентификация объектов для ИП также может быть определена на флуоресцентных изображениях путем порога бактериальных клеток. Порог устанавливает, какие интенсивности флуоресценции считаются объектами и какие интенсивности флуоресценции составляют фон.
- Нажмите на опцию Binary to ROI, чтобы определить бинарные ИИ.
- Ручное определение рентабельности инвестиций
- Открытый файл изображения в программном обеспечении изображения и обрезать файл только включить кадры, которые будут использоваться для отслеживания, увеличено до клеток, представляющих интерес, и только в фазовом контрастном канале.
- Отслеживание ячеев
- Чтобы вручную отслеживать ИИ, выберите следующий кадр в последовательности изображений и отрегулируйте положение ИИ, нажав и перетащив каждую рентабельность инвестиций, чтобы выровнять с новым положением исходной бактериальной клетки.
ПРИМЕЧАНИЕ: Если бактериальные клетки не изменили положение, ROIs не должны быть перемещены. - Повторите во всех последовательных кадрах, для которых клетки должны быть отслеированы.
- По мере разделения клеток определите клетки дочери как новые ИИ, описанные в шаге 9.1, и начните отслеживать недавно разделенные клетки.
ПРИМЕЧАНИЕ: Если ячейки идентифицируются как дьяные файлы, используйте функцию Track Binaries для автоматического отслеживания ИИ в выбранных кадрах. - После отслеживания ячеек через все выбранные кадры экспортируют данные для анализа.
- Откройте таблицу данных и определите измерения, необходимые для анализа (т.е. скорость объекта, ускорение или длина пути).
ПРИМЕЧАНИЕ: В случае измерения направленности необходимы измерения длины пути и длины линии. Длина линии является измерением эвклидийского расстояния, или прямого расстояния от происхождения трека до края колонии S. aureus. Длина пути – это измерение накопленного расстояния или суммы сегментов трека со всех кадров. Направленность может быть рассчитана как соотношение эвклидийского расстояния, D(E), (Длина линии), над накопленным расстоянием, D(A), (Длина пути).
- Чтобы вручную отслеживать ИИ, выберите следующий кадр в последовательности изображений и отрегулируйте положение ИИ, нажав и перетащив каждую рентабельность инвестиций, чтобы выровнять с новым положением исходной бактериальной клетки.
- Количественная оценка флуоресценции
- Определите ROIs для флуоресцентных бактериальных клеток, как описано в шаге 9.1.
- Повторите отслеживание или движение ИП для бактериальных клеток или кластеров в оставшихся флуоресцентных кадрах.
- Экспорт сгенерированную таблицу в файл электронной таблицы для анализа флуоресцентной интенсивности.
- В таблице данных ищите столбец с "Средней интенсивностью", который представляет среднюю интенсивность флуоресценции для отслеживаемой бактериальной клетки (ы) рентабельности инвестиций.
- На графике значения среднего интенсивности, чтобы посмотреть на изменения флуоресценции с течением времени.
ПРИМЕЧАНИЕ: Изменения в флуоресценции с течением времени представляют собой колебания экспрессии генов для флуоресцентно помечены ген интереса.
Результаты
Успешное использование описанного метода приведет к серии кадров, которые генерируют видео, в котором межвидовые взаимодействия могут наблюдаться с течением времени. Схема на рисунке 1 обеспечивает визуальный выделить ключевые шаги, связанные с подготовкой материалов для изображений. Использование этого метода позволило продемонстрировали P. aeruginosa клетки, проявляли различное поведение в монокультуре по сравнению с в совместной культуре с S. aureus. По сравнению с клетками P. aeruginosa в монокультуре, которые остаются сгруппированными в плоты, когда в совместной культуре с S. aureus, P. aeruginosa увеличилась одноклеточная подвижность к колониям S. aureus (рисунок 2A-2B). Флуоресцентно помеченные бактериальные штаммы также позволяют визуализировать смешанные популяции бактериальных видов. Использование GFP-маркировано P. aeruginosa позволило замечание, что после P. aeruginosa одиночные клетки увеличиваются в подвижности, они будут окружать и в конечном итоге вторгнуться S. aureus колоний (Рисунок 2C). Использование флуоресцентно-маркирующих клеток также позволяет визуализировать вторжение клеток P. aeruginosa в колонии S. aureus впервые(рисунок 2C, дно).
В то время как протокол дает высококачественные изображения для наблюдения за межвидового взаимодействия, Есть несколько общих проблем, которые могут привести к плохому качеству последовательности кадров. Несогласованная влажность в течение всего эксперимента и неправильно высушенные прокладки являются двумя общими проблемами, которые приводят к дрейфу в результате смещения колодки и перетаскивания ячеек с ней из FOV(рисунок 3A). Изменения влажности влияют на сухость агарозных прокладок. Повышенная влажность делает прокладки слишком влажными, позволяя влаге оседать между площадкой и дном стеклянного дна. Влага оставляет слой жидкости достаточно толстой для того, чтобы подвижные клетки роились или проплымал, и не хранит бактериальные клетки в одной плоскости. Между тем, снижение влажности высыхает площадку быстрее, что вызывает клетки дрейфовать на ранней стадии. Другой распространенной ошибкой при использовании этого метода с флуоресценцией является приобретение флуоресцентных изображений слишком часто или подвергая бактериальных клеток флуоресцентного света слишком долго. Короткие интервалы приобретения флуоресцентных изображений неоднократно возбуждают флюорофоры с высокой интенсивностью света определенной длины волны. Возбужденные флюорофоры затем реагируют с кислородом, вызывая деградацию флюорофора. Полученное фотоотлив истощает флуоресценцию до тех пор, пока больше флюорофора не может быть выражено и сложено, но не вредит самим бактериальнымклеткам (рисунок 3B). Потеря флуоресценции, однако, мешает измерениям экспрессии гена/белка, оставляя клетки без маркеров до тех пор, пока флюорофор не будет полностью синтезирован и возбужден снова. Кроме того, кислород, взаимодействующий с возбужденными фторфорами, может образовывать реактивные виды кислорода (ROS). Эти радикалы ROS затем повреждения бактериальных клеток, в конечном счете, становится токсичным и приводит к гибели клеток в течение нескольких деления клеток(рисунок 3C). Процессы фотоотчивания и фототоксичности можно легко увидеть, как клетки сначала потеряют свою флуоресценцию полностью, а в последующих кадрах клетки перестанут делиться и в конечном итоге могутпогибнуть (рисунок 3B-3C). Последняя общая проблема при настройке эксперимента начинается со слишком большого количеством ячеек на FOV или с ячейками слишком близко друг к другу, что, как правило, меньше, чем 20 мкм друг от друга. Переполненные ячейки в первом кадре будут приносить кластеры деления ячеек, которые просто сливаются друг с другом по мере их роста, а не взаимодействуют. Кроме того, клетки, которые начинаются слишком близко в непосредственной близости, возможно, не имеют достаточно времени, чтобы установить градиент секретных сигналов, на которые другиевиды могут реагировать (рисунок 3D), в то время как отдаленные бактериальные клетки не могут иметь возможность столкнуться друг с другом в течение всего эксперимента.
Рисунок 4 показывает пример того, как жизнеспособность бактериальных клеток может быть визуализирована с помощью этого протокола, добавив пропидий йодид в агарозные прокладки. Иодид пропидия непроницаем для живых клеток, но может проникать в клетки с поврежденными мембранами и связываться с нуклеиновые кислоты. Здесь середине журнала GFP помечены WT S. aureus лечили со средствами массовой информации в одиночку или с клеточной супернатант, полученных из P. aeruginosa и изображены сразу после лечения. Были изображены три различных канала: Phase, TxRed и GFP. Яркие зеленые клетки указывают на живые клетки, активно выражают GFP, как видно для S. aureus, обработанных только средствами массовой информации(рисунок 4A), а красные клетки указывают на мертвые пропидий йодид-окрашенные S. aureus клетки, после лечения с P. aeruginosa supernatant (Рисунок 4B). Хотя показана только одна точка времени, этот метод может быть адаптирован для определения жизнеспособности клеток во время замедленной живой визуализации.
Для количественной оценки аспектов межвидового взаимодействия может быть проведено несколько поствизионных анализов. Например, отслеживание клеток может обеспечить измерения направленности движений одноклеточных P. aeruginosa к скоплению S. aureus. Движения отдельных клеток P. aeruginosa отслеживаются из кадра, клетка покидает плот через раму, в которой клетка достигает кластера S. aureus (рисунок 5A). Расстояние между плотом P. aeruginosa и кластером S. aureus обеспечивает euclidian расстояние, D(E), в то время как общая длина трассы обеспечивает накопленное расстояние, D(A) (Рисунок 5B). Направленность каждой ячейки рассчитывается как соотношение D(E)/D(A). В кокультурных экспериментах WT P. aeruginosa двигался в сторону WT S. aureus со значительно более высокой направленностью, чем к S. aureus agrBDCA, мутанту, не имеющим регулируемых Agr-регулируемых секретных факторов, ранее определяемых как необходимых для направленной подвижности к S. aureus24 (рисунок 5C).
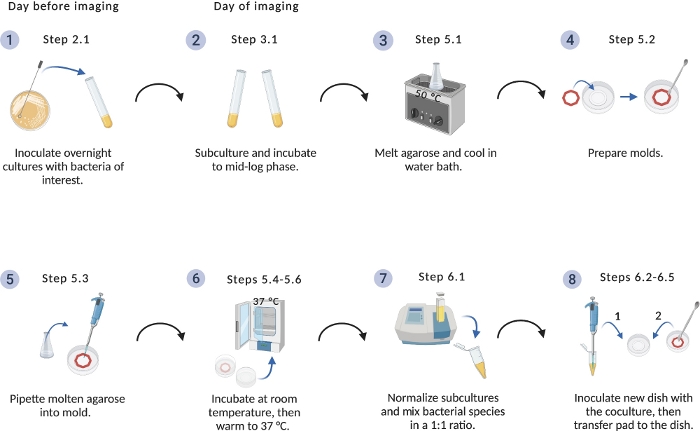
Рисунок 1: Схема протокола установки изображений.
Обзор критических шагов по подготовке бактериальных культур и агарозных прокладок. Создано с BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
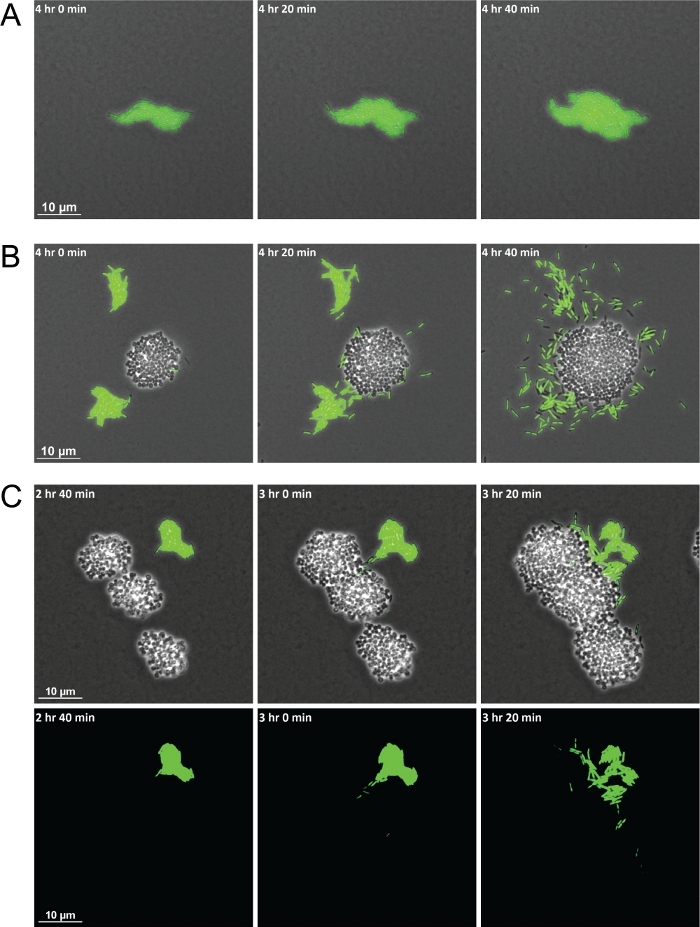
Рисунок 2: Промежуток времени, живая микроскопия показывает различия в поведении P. aeruginosa при совместной культуре с S. aureus.
Представитель оснастки выстрелы P. aeruginosa (бациллы, зеленый) вмонокультуре( ) и в совместной культуре с S. aureus (cocci, без опознавательныхзнаков)( B ). (C)Флуоресцентно помеченные бактерии позволяют визуализировать P. aeruginosa одиночных клеток, вторгающихся в кластеры S. aureus. Фазовая контрастность и наложение канала GFP (вверху) и канал GFP в одиночку (внизу). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
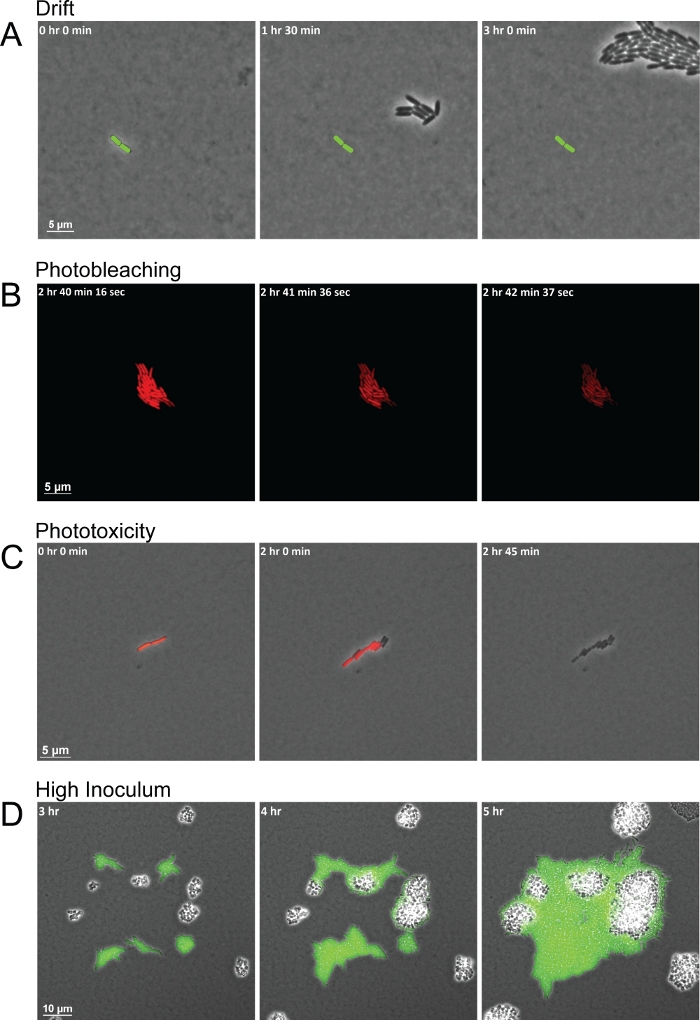
Рисунок 3: Представитель оснастки выстрелы общих вопросов визуализации, которые приводят к плохому приобретению изображения.
(A)Неправильно высушенные прокладки и непоследовательная влажность приводят к дрейфу клеток по всему FOV в течение всего срока изображения. Положение ячейки-основателя отмечено в каждом кадре (зеленый стержень). (B) Фотоотдача от воздействия света слишком долго будет истощать обнаруживаемые уровни флуоресценции в течение определенного периода времени, но не убивает клетки. (C)Фототоксичность в результате частого воздействия света приводит к гибели клеток. Первые признаки фототоксичности видны, когда клетки перестают флуоресцирование и не делятся. (D) Высокий первоначальный inoculum толпы клеток в FOV и предотвращает наблюдение межвидовых взаимодействий. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
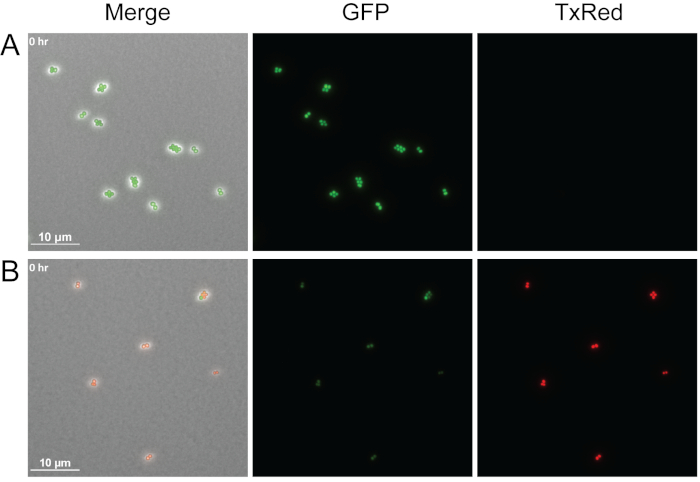
Рисунок 4: Сравнение живых и мертвых клеток S. aureus.
Представитель оснастки выстрелы для GFP помечены WT S. aureus лечение либо со средним водиночку( ) или без клеток P. aeruginosa supernatant (B). Клетки были немедленно изображены после лечения. Живые клетки (зеленые) активно выражают GFP и исключают йодид пропидия, в то время как мертвые клетки (красный) теряют флуоресценцию GFP и мембранную промеабилизацию позволяет иодиду пропидия проникать в клетки и связывать нуклеиновые кислоты. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Анализ отслеживания клеток P. aeruginosa в совместной культуре с S. aureus.
Ранее этот метод использовался метод для выполнения отслеживания клеток WT P. aeruginosa в совместной культуре с WTили agrBDCA S. aureus. (A)Представление одноклеточных треков P. aeruginosa в совместной культуре с S. aureus agrBDCA. (B) Схема для эвклидийского расстояния (D(E)и накопленного расстояния (D(A)) измерений, используемых для определения направленности ((D(E)/D(A)). (C) Направленные измерения одиночных клеток WT P. aeruginosa в совместной культуре с WT иagrBDCA S. aureus. Эта цифра была изменена с Limoli et al. 201924. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный файл. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Представленные здесь методы описывают протокол для живоклеточной визуализации взаимодействий бактериальных видов на одноклеточном уровне с модификациями для других приложений, включая отслеживание клеток и мониторинг жизнеспособности клеток. Этот метод открывает новые возможности для изучения одноклеточного поведения микроорганизмов в совместной культуре с другими видами с течением времени. В частности, протокол демонстрирует полезность этого метода совместной культуры в наблюдении за поведением бактериальной поверхности, особенно при изучении организмов, которые имеют как поверхностные, так и связанные с жидкостью придатки для подвижности. Например, ограничивая бактериальное движение на поверхности в одной плоскости фокусировки, можно визуализировать повышенную и направленную пили-опосредованную подвижность P. aeruginosa в ответ на S. aureus.
Как упоминалось ранее, достижение оптимальных результатов с помощью этого метода визуализации требует рассмотрения нескольких условий, включая температуру и влажность образца и приборов визуализации (т.е. целей и стадии). Дополнительные советы и устранение неполадок можно найти в дополнительном файле 1. Важным шагом в успешном использовании протокола является подготовка агарозных прокладок, так как недостаточно сухие прокладки являются одной из наиболее распространенных проблем. Как показано на рисунке 3A, если колодки не высохли достаточно долго, дрейф появляется в начале промежуток времени изображения, в то время как колодки, которые сушатся слишком долго начинают сокращаться и клетки дрейфуют из FOV несколько часов в изображении. Обеспечение того, чтобы все материалы предварительно нагревались и поддерживались при равномерной температуре и влажности в течение всего эксперимента, с помощью инкубатора с верхней ступенью и влажных салфеток, поможет уменьшить дрейф. Также рекомендуется, что резервная колодка всегда делается в случае, если первая колодка не высушена должным образом или слезы во время передачи из формы в образец блюда. Кроме того, важно использовать среду с низким уровнем аутофторесценции, как для выращивания бактериальных культур, так и для создания прокладок, чтобы свести к минимуму фоновую флуоресценцию среды при визуализации клеток. Рекомендуется использовать минимальные средства массовой информации для микроскопии, так как богатые средства массовой информации часто имеют высокую аутофторесценцию. Начиная с инокулума низкой плотности и даже пространственного распределения клеток в FOV также являются ключевыми факторами в этом методе. В частности, в предыдущих исследованиях оценки P. aeruginosa и S. aureus взаимодействий, это позволило бактериям генерировать достаточный градиент секретных факторов, которые затем могут быть обнаружены другими видами настоящее время (Рисунок 2B).
Несмотря на преимущества этого метода, существуют также ограничения, включая его цену, низкую пропускную способность, ограничения флуоресценции и высокую зависимость от контроля за состоянием окружающей среды. Рисунок 3B-3C показывает основные ограничения использования флуоресцентной микроскопии. Как говорится в разделе результатов, если флуоресцентные изображения захвачены в короткие промежутки времени, может произойти фотоотбел и фототоксичность. Для того, чтобы избежать этих двух результатов, флуоресцентные интервалы изображения должны быть приняты достаточно далеко друг от друга и с как низким флуоресцентным время воздействия света, насколько это возможно, чтобы по-прежнему адекватно визуализировать флюорофор. Кроме того, при определении интервала для флуоресценции изображений, важно учитывать время созревания каждого флюорофора. Флюорофоры, используемые в штаммах P. aeruginosa и S. aureus, показанных на рисунке 2, рисунке 3 и рисунке 4,например, имеют время созревания около 20 минут и поэтому могут быть возбуждены каждые 20 минут, не заботясь о потенциальных эффектах фотоотравления. Между тем, еще одним недостатком этого метода является то, что он не позволяет наблюдения поздних межвидовых взаимодействий, как только клетки достигают высокой плотности клеток. Для визуализации отдельных бактериальных клеток, они должны оставаться в одной плоскости фокусировки. Однако, как только популяция достигает высокой плотности клеток, клетки начинают расти в более чем одной плоскости.
Этот метод может быть изменен для изучения различных фенотипов, таких как жизнеспособностьклеток (рисунок 4) и экспрессия генов, представляющих интерес (данные не показаны). На рисунке 4 показан пример того, как метод был адаптирован для визуализации бактериальной жизнеспособности путем добавления йодида пропидия в агарозные прокладки. Другим применением этого метода является измерение экспрессии бактериального гена/белка в совместной культуре с другим организмом с помощью флуоресцентных репортеров. Например, несколько флюорофоров могут быть включены в плазмидный вектор или бактериальную хромосому для одновременного изучения экспрессии различных генов или белков. Здесь важно выбрать фторфоры, которые не имеют перекрывающихся возбуждающих и эмиссионных спектров. Наконец, использование отслеживания бактериальных клеток в пост-изображении анализа позволяет направленности(рисунок 5), скорость и ускорение, среди других измерений, которые будут рассчитаны, атакже 24.
В целом, этот метод визуализации кокультуры, адаптированный из ранее описанных протоколов монокультуры, повышает способность визуализировать поведение нескольких видов бактерий в кокультуре. Этот метод дает возможность изучать микробы с точки зрения смешанной культуры, что позволит лучше понять, как каждый вид изменяет свое поведение в одноклеточной манере, в конечном счете обеспечивая новое понимание того, как бактериальные виды взаимодействуют в полимикробной среде.
Раскрытие информации
Авторы заявляют, что им нечего раскрывать.
Благодарности
Эта работа была поддержана финансированием от муковисцидоза Фонд Postdoc-к-факультету Переход премии LIMOLI18F5 (DHL), муковисцидоз Фонд junior Faculty Recruitment Award LIMOLI19R3 (DHL), и NIH T32 Учебный грант 5T32HL007638-34 (ASP). Мы благодарим Джеффри Мейснера, Минсу Кима и Итана Гарнера за обмен первоначальными протоколами и советами по визуализации и созданию колодок.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
Ссылки
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385(2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232(2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56(2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976(2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365(2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены