Method Article
단세포 종 간 세균성 상호 작용의 운동 시각화
요약
이 살아있는 세균성 세포 화상 진찰 프로토콜은 시간이 지남에 따라 단세포 수준에서 다중 세균성 종 사이 상호 작용의 시각화를 허용합니다. 시간 경과 화상 진찰은 개별 세포 운동성 및 생존성을 포함하여 다종 세균성 지역 사회에서 종 간 상호 작용을 심문하기 위하여 단배문화 또는 공동 문화에서 각 세균성 종의 관찰을 허용합니다.
초록
다편성 지역 사회는 본질적으로 유비쿼터스, 그러나 단 세포 수준에서 그들의 상호 작용을 공부하는 것은 어렵습니다. 따라서, 현미경-시경법-두 세균성 병원체 간의 종 간 상호 작용을 관찰하기 위한 개발되었다. 이 방법의 사용은 운동성 그램 음성 병원체, 슈도모나스 아에루기노사 및 비 운동성 그램 양성 병원체, 황색포도상구균 사이의 상호 작용을 심문하는 것으로 여기에서 입증된다. 이 프로토콜은 단일 평면에서 세포를 유지하고 공간과 시간 모두에서 세균 성 행동을 시각화 할 수있는 커버 슬립과 아가로즈 패드 사이의 각 종을 공동 접종으로 구성됩니다.
더욱이, 여기에서 입증된 시간 경과 현미경 검사는 단배와 다른 종과의 공존에 있는 세균성 종 운동성의 변경을 포함하여 2개 이상의 세균성 종 사이에서 일어나는 초기 상호 작용을 시각화하는 데 이상적입니다. 현미경 설정에 있는 제한된 견본 공간의 특성 때문에, 이 프로토콜은 세포 인구가 너무 높으면 세균성 종 사이 나중에 상호 작용을 공부하기 위하여 보다 적게 적용됩니다. 그러나, 살아있는 세균세포를 화상 진찰하기 위한 염색의 사용, 형광 기자를 통한 유전자 또는 단백질 발현의 정량화, 단일 종 및 다종 실험 모두에서 세균세포 움직임을 추적하는 프로토콜의 몇몇 다른 응용이 있다.
서문
다편균 공동체는 자연에서 흔히 볼 수 있으며, 다양한 환경1,,2,,3 및 인간틈새4,5에걸쳐 있습니다. 인간 질환에서 가장 악명 높은 폴리균 감염 중 일부는 만성 폐쇄성 폐질환9,환기기 관련폐렴(10),및,유전질환 낭포성 섬유증(CF)11,12를가진 개인의 치과용 생물막6,만성 상처7,8,호흡기 감염등을포함한다. 이 감염은 수시로 다양한 미생물 종으로 이루어질 것입니다; 그러나, 그람 양성 박테리아 황색포도상구균과 그람 음성 박테리아 슈도모나스 aeruginosa 사이 상호 작용에 최근 초점이 나타났습니다. 이러한 유기체와 시험관 내 분석에 감염된 환자를 포함한 연구는 질병 진행, 미생물 생존, 독성, 신진 대사 및 항생제 감수성에 심오하고 예기치 않은 영향을 미칠 수있는 경쟁적이고 협력적인 상호 작용을 모두 보여줍니다 (Hotterbeekx 외. 201713 및 리몰리와 호프만 20193)에의해 자세히 검토됨).
감염 도중 종 간 상호 작용에 있는 증가하는 관심은 polymicrobial 지역 사회 행동을 공부하기 위한 다양한 방법을 산출했습니다. 전형적으로, 이러한 연구는 단일 문화와 공동 문화 사이의 현상적 차이를 조사하기 위해 플레이트 또는 국물 기반 의 학적 연구를 이용했다. 예를 들어, 고체 표면에 P. aeruginosa 및 S. 아우레우스를 응배하여 식민지 표현형, 안료 또는 다당류 생산14,,15,,16의성장 억제 또는 변화의 시각화를 허용했다. 혼합종 생물막은 생물학적 또는 무생물 표면에 뿐만 아니라 액체 배양에서 세균종을 배분할 뿐만 아니라 유전자 및 단백질발현(17,18)에18더하여 성장, 대사, 항생제 내성, 경쟁 및 생존가능성의 변화를 측정할 수 있게 되었다. 이러한 대량 문화 실험은 P. aeruginosa와 S. 아우레우스가 지역 사회 규모에 서로 영향을 미칠 수있는 방법에 대한 통찰력을 공개했지만, 그들은 단일 세포 수준에서 일어나는 상호 작용에 대한 중요한 질문에 대답 할 수 없습니다. 여기에서 제시된 방법은 시간이 지남에 따라 공동 문화 지역 사회 내의 단일 세포의 이동, 세포 생존 가능성 및 유전자 발현의 변화에 초점을 맞추어 종 간 상호 작용을 연구하기위한 접근 방식에 추가됩니다.
단일 세포 상호 작용은 세포의 대량 커뮤니티에서 일어나는 상호 작용과 크게 다를 수 있습니다. 단일 세포 분석을 통해, 지역 사회 내의 이질성은 세포의 공간 배치가 지역 사회 역학에 어떻게 영향을 미치는지 또는 유전자 및 단백질 발현 수준이 그룹의 개별 구성원 내에서 어떻게 변화하는지 연구하기 위하여 정량화될 수 있습니다. 추적 셀은 또한 여러 세대를 통해 시간이 지남에 따라 단일 세포가 이동하고 동작하는 방법에 대한 통찰력을 제공 할 수 있습니다. 세포 이동및 유전자 발현의 변화를 동시에 추적함으로써 유전자 변동과 해당 표현형 사이에 상관관계가 있을 수 있습니다. 단세포 수준에서 개별 세균성 종을 연구하기 위한 이전 프로토콜이 기술되었습니다. 이러한 연구는 한 평면에서 시간이 지남에 따라 살아있는 이미징 세포를 활용하고 세포 분열 및 항생제 감수성19,,20과같은 표현형을 관찰하는 데 유용하다. 추가 적인 살아있는 화상 진찰 현미경 검사는 단일 세균성,종21,22,,23의성장, 운동성, 표면 식민지 화 및 생물막 형성을 감시하기 위하여 이용되고 있습니다. 그러나, 이러한 연구는 단일 문화에서 박테리아의 생리학을 이해에 대 한 통찰력 이었지만, 공동 문화에서 시간이 지남에 따라 여러 박테리아 종의 단일 세포 행동을 관찰 하기 위한 실험은 제한.
여기서, 단일 종 화상 진찰에 사용된 이전 프로토콜은 P. aeruginosa와 S. 아우레우스사이 상호 작용을 공부하기 위하여 적응되었습니다. 이러한 유기체는 세포 형태에 기초하여 위상 대조하에서 분화될 수있다(P. aeruginosa는 바실리이고 S. 아우레우스는 cocci). 이 방법의 개발은 최근 S. 아우레우스(24)의 존재에서 P. aeruginosa의 이전에 설명되지 않은 운동성 행동의 시각화를가능하게했다. P. aeruginosa는 멀리서 S. 아우레우스를 감지하고 S. 아우레우스 세포의 클러스터를 향한 증가및 방향단 한세포 운동으로 반응할 수 있는 것으로 나타났습니다. P. aeruginosa 운동은 S. 아우레우스를 향한 운동형 IV pili(TFP)를 요구하는 것으로 나타났으며, 모발과 같은 프로젝션은 확장및 후퇴를 조정하여 경련 운동성(25)이라고 불리는 움직임을 생성한다.25
이 연구 결과는 종 사이 초기 상호 작용을 심문하기 위한 이 방법의 유용성을 보여줍니다. 그러나, 나중에 상호 작용 시간 점에 높은 세포 밀도에서 화상 진찰은 세포의 단 하나 층이 더 이상 확인할 수 없다는 것을 감안할 때 어렵습니다, 이는 주로 화상 진찰 후 분석 도중 문제점을 제기합니다. 이러한 제한을 감안할 때 이 방법은 나중에 상호 작용을 대표하는 더 높은 세포 밀도에서 기존의 거시적 분석 분석으로 후속 조치를 따를 수 있는 이전 상호 작용에 가장 적합합니다. 이 방법의 추가 제한은 저처리량 특성을 포함, 하나의 샘플은 한 번에 하나의 샘플과 현미경의 비용 때문에, 카메라, 및 환경 챔버. 더욱이, 형광 현미경 검사는 광독성 및 광표백 같이 세균성 세포에 리스크를 제기합니다, 그러므로 형광 심을 취득할 수 있는 주파수를 제한합니다. 마지막으로, 이 방법에 사용되는 아가로즈 패드는 환경의 변화에 매우 취약하여 조건이 올바르지 않으면 패드가 수축하거나 팽창하기 시작할 수 있다는 점을 감안할 때 온도 및 습도와 같은 조건에 대해 제어하는 것이 중요합니다. 마지막으로,이 방법은 호스트 환경을 모방하지 않지만, 그것은 다른 세균성 종이 표면에 반응하는 방법에 대한 단서를 제공합니다, 이는 환경 / 호스트 조건을 모방하도록 설계된 에세이에서 후속 할 수있다.
이 방법은 세포가 커버슬립과 아가로즈 패드 사이에 접종되어 세포를 표면으로 제한하는 단일 세포 움직임을 추적하는 이전 연구와 다릅니다. 이렇게 하면 단일 평면에서 시간이 지남에 따라 셀 추적이 가능합니다. 그러나, 세포가액체(26)에침수될 때 관찰된 일시적인 표면 참여의 주기를 제한한다. 아가로즈 패드 하에서 이미징 박테리아의 추가 이점은 P. aeruginosa 경련운동성을검사하는 데 고전적으로 사용되는 거시적 플레이트 기반 의 하위 표면 접종 분석은 모방한다는 것입니다. 이 분석에서 세균 세포는 페트리 접시의 바닥과 천 사이에 접종되어 이 현미경 프로토콜과 마찬가지로 접종 지점에서 바깥쪽으로 이동하는 동안 세포를 단일 평면에 보관합니다.
여기에 제시된 종간 상호 작용을 시각화하기 위한 시간 경과 현미경 프로토콜은 1) 세균성 시료 및 아가로즈 패드를 준비하는 것으로 구성되며, 2) 이미징 수집을 위한 현미경 설정을 선택하고 3) 이미징 후 분석. 세포 이동 및 추적의 상세한 시각화는 위상 대비에 의해 짧은 시간 간격으로 이미지를 수집하여 수행 할 수 있습니다. 형광 현미경 검사는 또한 시간이 지남에 따라 세포 생존성 또는 유전자 발현을 결정하기 위하여 이용될 수 있습니다. 여기서, 우리는 아가로즈 패드에 생존 성염료를 첨가하여 형광 현미경 검사법을 용색하는 한 가지 예를 보여준다.
프로토콜
참고: 이 프로토콜의 모든 소모품에 대한 전체 설명 및 카탈로그 번호는 재료 표에서 찾을 수 있습니다.
1. M8T 최소 미디어 준비
- 2L병에 는 Na2HPO4·7H 2 O 15g, KH2PO415g, 800mL의 2.5g NaCl을 2L 병에 녹여 M8 최소 염베이스(5배)의 L 1L을 준비한다.2 pH에서 7.6까지. UPW를 사용하여 1 L에 볼륨을 완성하십시오. 45분 동안 오토클레이브.
- 1 L 병에 UPW의 400 mL에서 포도당 100 g을 용해하여 포도당 용액 500mL (20 % w /v)를 준비하십시오. UPW를 사용하여 500 mL에 완벽한 솔루션. 45분 동안 오토클레이브.
- UPW의 400mL에서 트립톤 100g을 용해하여 트립톤 용액 500mL(20%w/v)를 준비합니다. UPW로 500mL로 완료하십시오. 45분 동안 오토클레이브.
- M8 + 10% 트라이프톤(M8T) 최소 미디어 1L을 5x M8 최소 염(1x 결승), 20% 포도당 10mL(0.2% 결승), 1mL 1mL(1mM MM 결승), 20% 50mL(최종 1mM 최종) 60mL(최종 1%)를 추가하여 최소 미디어를 준비한다.4 UPW로 1 L로 완료하십시오. 멸균 500 mL 미디어 저장 병에 0.2 μm 멸균 필터를 통해 필터링합니다.
1일차:
2. 세균성 하룻밤 배양 준비
- P. aeruginosa 또는 S. 아우레우스 (적절한 경우 항생제 포함)의 단일 콜로니와 M8T 최소 미디어의 5 mL을 접종하고 16 h 이상 에 대한 폭이 37 ° C에서 하룻밤 배양.
참고: 세균성 병원균 P. aeruginosa 및 S. 아우레우스는 이 방법을 위해 사용되었습니다, 그(것)들은 일반적으로 만성 감염에서 상호 분리되기 때문에, 그들의 상호 작용을 공부하는 것은 다편성 감염 도중 참을성 있는 결과에 기여하는 방법을 이해하는 것이 중요합니다. 다른 세균성 종은 연구의 초점에 따라 사용될 수 있었습니다.
2일차:
3. 세균균의 하위 배양
- 서브컬쳐 P. aeruginosa 1:500 및 S. 아우레우스 1:1000 신선한 M8T의 5 mL에서 (적절한 경우 항생제 포함). 배양이 중간 로그 단계에 도달할 때까지 37°C에서 폭기로 배양한다(OD600 = ~0.3 - 0.5).
4. 패드 금형 재료 준비
- 평평한 끝의 절반이 90° 각도로 구부러질 때까지 분젠 버너로 평평한 둥근 실험실 주걱의 끝을 가열하여 금속 주걱을 준비합니다. 다른 평평한 둥근 실험실 주걱의 끝을 가열하고 마지막 10mm를 45 °C 각도로 약간 구부립니다.
- 실리콘 몰드의 네 모서리를 잘라 내어 금형이 35mm 접시 안에 들어갈 수 있도록 합니다.
- 70%에탄올을 추가하고 분젠 버너의 불꽃을 통과하여 주걱과 핀셋 한 켤레를 살균합니다.
- 접시와 실리콘 몰드를 70% 에탄올로 청소하고 보풀이 없는 물티슈로 말리십시오.
5. 아가로즈 패드 준비
참고: 패드는 이 프로토콜에 사용되는 박테리아의 영양공급원으로 M8T 최소 매체로 제조됩니다. 그러나 패드에 사용되는 영양소는 다른 유기체에 대해 수정될 수 있습니다.
- 깨끗한 50mL 에렌마이어 플라스크에 M8T 의 10mL에 2 % 저용 아가로즈를 녹입니다. 플라스크의 내용이 끓지 않도록 용액이 될 때까지 짧은 간격(2-5s)으로 전자레인지에 전자레인지를 사용한다. 녹으면 50 °C 의 수조에서 적어도 15 분 동안 식힙니다.
- 실리콘 컷아웃을 35mm 접시의 개구부와 정렬하여 금형을 준비하고 주걱으로 가볍게 탭하여 접시에 실리콘을 고정하고 금형과 접시 사이의 모든 기포를 제거합니다.
- 일단 식으면, 용융 아가로의 파이펫 915 μL이 금형에 들어갑니다. 뚜껑을 열고 실온에서 30분 동안 패드를 건조시키십시오.
- 뚜껑으로 접시를 덮고 실온에서 2 시간 더 둡니다.
- 보풀이 없는 물티슈를 단단히 굴려 습도 물티슈를 준비합니다. 압연 닦은 닦은 닦은 닦은 것을 멸균 페트리 접시 안에 넣고 닦아 에 멸균 물 500 μL을 고르게 넣습니다. 1 시간 동안 37 °C로 따뜻하게합니다.
- 패드와 멸균 35mm 접시를 37°C로 1시간 동안 데워보시면 됩니다.
6. 세균 세포 및 접종 패드의 준비
- 각 하위 배양의 OD600을 측정하고 P. aeruginosa를 OD600 = 0.03 및 S. 아우레우스로 희석하여 37°C로 예동된 M8T에서 OD600 = 0.10으로 희석한다. P. 아루기노사와 S. 아우레우스를 1:1 비율과 소용돌이에 섞는다.
참고: 균주가 항생제를 요구하는 경우, 항생제는 하룻밤 및 하위 문화에 추가 될 수 있지만, 공동 문화의 다른 종에 영향을 미치는 경우 이미징을위한 종을 혼합 할 때 추가해서는 안됩니다. 플라스미드 안정성과 공동 문화의 모든 종에 대한 항생제의 효과는 사용되는 각 유기체 / 플라스미드에 대해 결정해야합니다. - 프리 온드, 멸균 35mm 유리 커버슬립 접시의 바닥을 가로질러 균등하게 공동 배양의 파이펫 1 μL.
- 멸균 핀셋을 사용하여 금형에서 실리콘 컷아웃을 제거합니다.
- 멸균 주걱을 사용하여 접시에서 패드를 제거합니다.
- 패드 의 가장자리 아래에 약간 구부러진 주걱을 미끄러, 거꾸로 금형을 유지하면서, 멸균 페트리 플레이트 뚜껑에 드롭.
참고 : 패드를 강제로 꺼내거나 찢어지지 않도록주의하십시오. 패드의 어느 쪽이 바닥인지 추적합니다.
- 패드 의 가장자리 아래에 약간 구부러진 주걱을 미끄러, 거꾸로 금형을 유지하면서, 멸균 페트리 플레이트 뚜껑에 드롭.
- 패드 아래에 90° 각진 주걱을 슬라이딩하고 접종 된 커버 슬립 위에 배치하여 박테리아 세포, 아래쪽 아래와 접시에 패드를 전송합니다. 90° 각진 주걱을 사용하여 패드가 커버슬립에 플러시되도록 하고 기포를 부드럽게 내보냅니다.
- 촉촉한 물티슈에서 여분의 수분을 제거한 다음 접시 가장자리 주위에 놓고 패드를 만지지 않도록 하십시오. 샘플은 이제 이미징을 위한 준비가 되었습니다.
7. 라이브 이미징용 현미경 설정
- 실험 설정 전에 적어도 2 시간 까지 37 °C에 환경 챔버를 따뜻하게.
- 밝은 필드와 형광 이미징을 위한 현미경, 컴퓨터 및 광원을 포함한 모든 구성 요소를 켭니다.
- 이미징 소프트웨어를 열고 광원이 연결되어 있고 실행되고 있는지 확인합니다.
- Köhler조명(27)을 수행하여 모든 이미지 평면을 정렬합니다.
- 먼저 "더미" 접시를 사용하여 20배 의 목표로 표시된 커버슬립을 집중시다. 응축기 포탑이 "열린" 위치로 설정되어 있는지 확인합니다.
참고: Köhler 조명은 이미지 평면을 올바르게 정렬하기 위해 각 고유 의 목표/샘플에 대해 수행해야 합니다. 그러나, 낮은 배율에 "더미"접시와 초점과 정렬은 설정 및 실험 시작 시간 사이의 시간을 제한하기 위해 더 높은 배율에서 라이브 샘플에 셋업을 가속화한다. - 응축기에 초점을 맞춥니다.
- 필드 다이어프램을 닫습니다.
참고: 팔각형 모양의 조리개가 나타나야 합니다. 응축기가 완전히 초점이 없는 경우 전체 시야(FOV)가 어둡게 나타납니다. - 팔각형 가장자리가 바삭할 때까지 응축기 초점 노브를 회전합니다.
참고: 이미지 평면이 올바른 정렬에 접근할 때 라이트 강도가 증가합니다.
- 필드 다이어프램을 닫습니다.
- 응축기정렬합니다.
- 정렬 노브를 조정하여 필드 응축기의 중심을 이수합니다.
참고: 팔각형은 FOV의 중간에 중심이 되어야 합니다. 정렬 노브는 현미경에 따라 다릅니다. 예를 들어, 일부 현미경 콘덴서에는 노브가 있고 다른 현미경 콘덴서는 나사 드라이버가 필요한 나사가 있습니다.
- 정렬 노브를 조정하여 필드 응축기의 중심을 이수합니다.
- 램프 필라멘트에 초점을 맞추고 응축기 조리개를 조정합니다.
- 위상 망원경이나 버트랜드 렌즈를 빛의 경로에 배치하여 목표의 뒤쪽 초점 평면을 관찰합니다.
참고: 두 개의 동심원이 있어야 합니다. - 반지가 선명해 보일 때까지 버트 랜드 렌즈 초점 노브를 켭니다.
- 라이트 경로에서 버트 랜드 렌즈를 제거합니다.
- 위상 망원경이나 버트랜드 렌즈를 빛의 경로에 배치하여 목표의 뒤쪽 초점 평면을 관찰합니다.
- 팔각형이 FOV 바로 바깥에 있는 때까지 필드 다이어프램을 엽니다.
- 100x 목표로 변경하고 침지 오일 한 방울을 추가하기 전에 일치하는 위상 링을 제자리에 밀어 넣고 준비된 샘플 접시를 위에 놓습니다.
- 세균 샘플 접시로 100배 목표에 Köhler 조명을 수행합니다.
- 먼저 "더미" 접시를 사용하여 20배 의 목표로 표시된 커버슬립을 집중시다. 응축기 포탑이 "열린" 위치로 설정되어 있는지 확인합니다.
- 미세 조정만을 사용하여 박테리아에 초점을 맞춥니다. FOV의 박테리아가 접안을 통해 집중되면 현미경의 카메라 버튼을 눌러 광 경로를 카메라로 전환합니다.
- 이미징 소프트웨어에서 위상 옵션을 클릭합니다.
- 소프트웨어에서 광원을 선택하고 사용하려는 빛의 백분율을 수동으로 입력하거나 광 백분율 척도에서 막대를 슬라이딩하여 방출되는 DIA LED 라이트의 백분율을 조정합니다.
- 광원을 클릭하고 원하는 노출 시간을 수동으로 입력하거나 제공된 드롭다운 메뉴에서 노출 시간을 선택하여 DIA LED 광 노출 시간을 조정합니다.
참고: 노출 시간은 사용 중인 카메라에 따라 달라집니다. - 형광을 사용하는 경우 관심있는 형광 채널을 클릭하여 각 해당 채널(예: TxRed, GFP)의 카메라 설정을 조정합니다.
- 방출되는 형광광의 백분율을 설정한 다음 노출 시간을 조정합니다(DIA LED 라이트의 경우 7.7 단계 및 7.8 단계에서 수행된 경우).
- 또는 시각화 컨트롤 드롭다운 메뉴에서 다른 비트 깊이 옵션 중 하나를 선택하여 동적 범위를 조정하기 위해 비트 깊이를 변경합니다.
- 인수 컨트롤 메뉴에서 XY 옵션을 클릭하여 관심 있는 XY 위치를 선택합니다.
- 조이스틱으로 스테이지 위치를 이동하거나 화면에서 FOV를 클릭하고 드래그하여 빈 상자를 클릭하여 특정 위치의 X 및 Y 좌표를 저장합니다.
참고: 시간 경과 획득에 대해 가능한 한 세 가지 다른 XY 포지션을 선택하는 것이 좋습니다.
- 조이스틱으로 스테이지 위치를 이동하거나 화면에서 FOV를 클릭하고 드래그하여 빈 상자를 클릭하여 특정 위치의 X 및 Y 좌표를 저장합니다.
- 획득 제어 메뉴의 XY 탭에서 PFS 상자를 클릭하거나 조이스틱 컨트롤 패널의 PFS 버튼을 눌러 완벽한 초점 시스템(PFS)을 켭니다.
- 세균 세포에 초점을 미세 조정 노브를 회전.
- 셀이 원하는 초점 평면에 있으면 각 XY 위치에 대한 PFS 버튼을 클릭합니다.
참고: PFS는 시간 경과 실험 중에 Z 축의 드리프트를 보정합니다. 이것은 시간이 지남에 따라 세균성 세포의 초점을 유지하기 위해 필요합니다. 제조 업체는 다른 보상 시스템을 가지고 있습니다. - 획득 컨트롤 메뉴의 옵션에서 선택하여 각 채널(예: 위상 대비 및 각 플루오로포어)에 대한 획득 간격 및 빈도(예: 위상 대비 및 각 불소호)를 포함한 이미지 수집 조건을 선택합니다.
참고: 여기에 제시된 실험의 경우, 위상 대비 이미지는 5-10초마다 간격으로 획득되며 GFP 및 TxRed 채널의 형광 이미지는 20분마다 획득됩니다. - 현미경 및 획득 설정이 설정되면 이미징을 시작합니다.
8. 선택 사항: 라이브/데드 이미징 수정
- M8T 의 10mL에 2 % 아가로즈를 녹여 50 °C 수조에서 적어도 15 분 동안 식힙니다.
- 용융 아가로즈에 프로피듐 요오드 1 m를 추가합니다.
- 냉각되면 준비된 금형에서 아가로즈의 파이펫 915 μL이 냉각되었습니다.
- 뚜껑을 닫고 실온에서 30분 동안 패드를 건조시키십시오. 빛으로부터 보호하십시오.
- 뚜껑으로 접시를 덮고 실온에서 2 시간 더 둡니다.
- 습도 물티슈를 준비합니다.
- 보풀이 없는 종이를 단단히 닦아냅니다.
- 닦은 닦은 페트리 접시에 넣고 500 μL의 멸균 물을 닦아 넣습니다.
- 1 h에 대한 37 °C에서 인큐베이션.
- 패드와 멸균 35mm 접시를 37°C에서 1시간 동안 배양합니다.
- 6절에 표시된 대로 접시를 접종하기 위해 진행: 세균 성 세포의 준비 및 접종 패드.
9. 데이터 분석
- 세포 식별
- 이미징 소프트웨어에서 이미지 파일을 열고 파일을 자르기만 사용하여 추적에 사용할 프레임만 포함하고 관심 있는 셀에 확대하며 위상 대비 채널에서만 확대됩니다.
참고: 자른 파일은 원래 파일을 방해하지 않고 추적 데이터를 저장할 수 있는 새 파일로 저장할 수 있습니다. - 분석에 사용할 첫 번째 프레임에서 개별 세균 세포 또는 셀 클러스터를 추적하여 분석 컨트롤 메뉴에서 관심 영역(ROI)을 선택하고 ROI를 정의하는 옵션을 선택합니다.
참고: ROI는 수동으로 또는 바이너리로 정의할 수 있습니다.- ROI를 수동으로 정의
- 각 개별 세균 세포 또는 세포의 클러스터의 둘레를 추적하여 ROI를 수동으로 정의합니다.
참고: 분석 소프트웨어에서, P. aeruginosa,또는 다른 막대 모양의 세포는, 타원 ROI를 선택하고 세균 세포의 크기에 조정된 타원을 그리는 하여 수동으로 추적될 수 있다. 대안적으로 다각형 ROI 옵션을 선택하여 셀 클러스터와 같은 비전통적인 모양의 ROI를 추적할 수 있습니다.
- 각 개별 세균 세포 또는 세포의 클러스터의 둘레를 추적하여 ROI를 수동으로 정의합니다.
- 이진 ROI 식별
- 이진 ROI를 정의하려면 이진에서 ROI 로 키옵션을 클릭합니다.
참고: 객체는 위상 대비 채널에서 밝은 픽셀화된 배경으로부터 어두운 픽셀화된 세균 세포의 분리에 기초하여 이진 층으로 정의됩니다. - 셀의 임계값을 설정하려면 분석 컨트롤 메뉴에서 임계값 옵션을 선택합니다. 관심 있는 채널을 선택하고 형광 히스토그램에서 막대를 밀어 임계값 간격 값을 조정합니다.
참고: ROI에 대한 이진 물체 식별은 세균 세포를 임계값화하여 형광 이미지에서 정의될 수도 있습니다. 임계값은 어떤 형광 강도가 개체로 간주되고 어떤 형광 강도가 배경을 구성하는지 설정합니다.
- 이진 ROI를 정의하려면 이진에서 ROI 로 키옵션을 클릭합니다.
- ROI를 수동으로 정의
- 이미징 소프트웨어에서 이미지 파일을 열고 파일을 자르기만 사용하여 추적에 사용할 프레임만 포함하고 관심 있는 셀에 확대하며 위상 대비 채널에서만 확대됩니다.
- 셀 트래킹
- ROI를 수동으로 추적하려면 이미징 서열에서 다음 프레임을 선택하고 각 ROI를 클릭하고 드래그하여 원래 세균 세포의 새로운 위치에 맞게 ROI의 위치를 조정합니다.
참고: 세균 세포가 위치를 변경하지 않은 경우 ROI를 이동할 필요가 없습니다. - 셀을 추적할 모든 순차적 프레임에서 반복합니다.
- 세포가 분열됨에 따라 딸 세포를 9.1 단계에서 설명한 대로 새로운 ROI로 정의하고 새로 분할된 세포를 추적하기 시작합니다.
참고: 셀이 바이너리로 식별되는 경우 트랙 Binaries 함수를 사용하여 선택한 프레임에서 ROI를 자동으로 추적합니다. - 선택한 모든 프레임을 통해 셀을 추적한 후 분석할 데이터를 내보냅니다.
- 데이터 스프레드시트를 열고 분석에 필요한 측정(예: 오브젝트 속도, 가속 또는 경로 길이)을 식별합니다.
참고: 지시도 측정의 경우 경로 길이 및 선 길이 측정이 필요합니다. 선 길이는 유클리디의 거리 또는 트랙 원점에서 S. 아우레우스 식민지 가장자리까지의 직선 거리의 측정입니다. 경로 길이는 누적된 거리 또는 모든 프레임의 트랙 세그먼트 합계를 측정한 값입니다. 지향성은 유클리디안 거리,D(E)및 (선 길이), 누적된 거리,D(A)및 (경로 길이)의 비율로 계산될 수 있다.
- ROI를 수동으로 추적하려면 이미징 서열에서 다음 프레임을 선택하고 각 ROI를 클릭하고 드래그하여 원래 세균 세포의 새로운 위치에 맞게 ROI의 위치를 조정합니다.
- 형광 정량화
- 9.1 단계에서 설명된 형광 세균 세포에 대한 ROI를 정의합니다.
- 나머지 형광 프레임에서 세균 세포 또는 클러스터에 대한 ROI의 추적 또는 움직임을 반복합니다.
- 생성된 테이블을 스프레드시트 파일로 내보내 형광 강도 분석을 합니다.
- 데이터 스프레드시트에서 추적된 세균 세포(들) ROI의 평균 형광 강도를 나타내는 "평균 강도"를 가진 컬럼을 찾습니다.
- 평균 강도 값을 그래프로 하여 시간이 지남에 따라 형광의 변화를 살펴봅니다.
참고: 시간이 지남에 따라 형광의 변화는 형광으로 표시된 관심 유전자에 대한 유전자 발현의 변동을 나타냅니다.
결과
설명된 방법을 성공적으로 사용하면 시간이 지남에 따라 종 간 상호 작용을 관찰할 수 있는 비디오를 생성하는 일련의 프레임이 생성됩니다. 도 1의 회로도는 이미징을 위한 재료 준비와 관련된 주요 단계를 강조하는 시각적 개체를 제공합니다. 이 방법의 사용은 S. 아우레우스와의 공동 문화에서 대 단문화에서 다른 행동을 나타내는 P. aeruginosa 세포의 데모를 허용했습니다. 뗏목에서 그룹화된 단배식의 P. 아루기노사 세포와 비교하여, S. 아우레우스와공존할 때, P. aeruginosa는 S. 아우레우스 콜로니(그림2A-2B)를향한 단세포 운동성을 증가시켰습니다.Figure 2A 형광으로 표지된 세균균은 또한 세균종의 혼합 된 인구를 시각화 할 수 있습니다. GFP 라벨P. aeruginosa를 사용하여 P. aeruginosa 단일 세포가 운동성이 증가 한 후, 그들은 포위하고 결국 S. 아우레우스 식민지(도 2C)를침공 할 것이라는 관측을 허용했다. 형광 표시 세포의 활용은 또한 처음으로 S. aureus 콜로니로 P. aeruginosa 세포 침략의 시각화를 허용(도 2C,하단).
프로토콜은 종 간 상호 작용을 관찰하기 위한 고품질 이미지를 생성하지만 품질이 좋지 않은 프레임 시퀀스를 유발할 수 있는 몇 가지 일반적인 문제가 있습니다. 실험 기간 동안 일관되지 않은 습도와 잘못 건조된 패드는 패드 이동및 그것으로 세포를 FOV(도3A)에서끌어내어 표류하는 두 가지 일반적인 문제입니다. 습도의 변화는 아가로즈 패드의 건조에 영향을 미칩니다. 습도가 증가하면 패드가 너무 젖어 있어 패드와 유리 바닥 접시 의 바닥 사이에 수분이 정착할 수 있습니다. 수분은 모틸 세포가 무리를 지어 또는 수영을 할 수있을만큼 두꺼운 액체 층을 남기고 세균 세포를 단일 평면에 보관하지 않습니다. 한편, 습도의 감소는 패드를 더 빨리 건조, 세포가 초기에 표류하는 원인이. 형광을 가진 이 방법을 사용할 때 또 다른 일반적인 실수는 너무 자주 형광 심상을 얻거나 너무 오래 형광광에 세균세포를 노출하는 것입니다. 형광 이미지에 대한 짧은 획득 간격은 특정 파장의 고강도 빛으로 형광을 반복적으로 흥분시킵니다. 흥분된 형광은 산소와 반응하여 형광의 분해를 일으킵니다. 생성된 광표백은 형광을 더 많이 발현및 접을 수 있을 때까지 형광을 고갈시키지만 세균 세포 자체에 해를 끼치지않습니다(도 3B). 그러나 형광의 손실은 유전자/단백질 발현의 측정을 방해하며, 형광이 완전히 합성되고 다시 흥분될 때까지 세포를 마커가 없는 상태로 둡니까. 더욱이, 흥분된 형광과 상호 작용하는 산소는 반응성 산소 종(ROS)을 형성할 수 있다. 이러한 ROS 라 디 칼 다음 세균 세포를 손상, 궁극적으로 독성 되 고 몇 세포 분열 내에서 세포 죽음의 결과(그림 3C). 광표백 및 광독성의 과정은 세포가 먼저 형광을 완전히 잃어버리기 때문에 쉽게 볼 수 있으며, 후속 프레임에서는 세포가 분할을 중단하고 결국 죽을 수있습니다(그림 3B -3C).-3C 실험을 설정할 때 한 가지 마지막 일반적인 문제는 FOV 당 너무 많은 세포또는 세포가 서로 너무 가깝게 시작하여 일반적으로 20 μm 미만입니다. 첫 번째 프레임에 있는 혼잡한 세포는 상호 작용보다는 성장함에 따라 단순히 서로 병합되는 셀분할의 클러스터를 생성합니다. 또한, 근접에서 너무 가깝게 시작되는 세포는 다른 종들이 반응할 수 있는 분비된 신호의 그라데이션을 확립하기에 충분한 시간이 없을 수있지만(그림 3D)먼 세균 세포는 실험 기간 내에 서로 마주볼 기회가 없을 수 있다.
도 4는 아가로즈 패드에 프로피듐 요오드를 추가하여 이 프로토콜로 세균 세포 생존성을 시각화할 수 있는 방법의 예를 나타낸다. 프로피듐 요오드는 살아있는 세포에 불투과성이지만 손상된 막을 가진 세포를 입력하고 핵산에 결합 할 수 있습니다. 여기서 중간 로그 GFP 라벨 WT S. 아우레우스는 단독으로 미디어 또는 P. aeruginosa에서 파생된 세포없는 슈퍼네티얼으로 처리되었고 치료 직후 에루기노사를 이미지화하였다. 세 개의 서로 다른 채널이 이미지되었습니다: 단계, TxRed 및 GFP. 밝은 녹색 세포는 P. aeruginosa 상피(도 4B)로치료된 후 죽은 예의 요오드 스테인드 S. 아우레우스 세포를 나타내는Figure 4A S. 아우레우스에 대해 볼 수 있는 것으로 GFP를 능동적으로 발현하는 살아있는 세포를 나타낸다. 단 하나의 시간 점이 표시되는 동안, 이 방법은 시간 경과 라이브 이미징 도중 세포 생존가능성을 결정하기 위하여 적응될 수 있습니다.
여러 번의 이미징 후 분석은 종 간 상호 작용의 측면을 정량화하기 위해 수행 될 수 있습니다. 예를 들어, 세포 추적은 S. 아우레우스 클러스터를 향한 P. aeruginosa 단일 세포 운동의 지시성에 대한 측정을 제공할 수 있다. 개별 P. aeruginosa 세포의 움직임은 세포가 S. 아우레우스 클러스터(도 5A)에도달하는 프레임을 통해 뗏목을 떠나는 프레임에서 추적됩니다. P. aeruginosa 뗏목과 S. 아우레우스 클러스터 사이의 거리는 유클리디아 거리, D(E)를제공하며, 총 트랙 길이는 축적된 거리,D(A) (도 5B)를제공한다. 각 셀의 방향성은D(E)/D(A)의비율로 계산됩니다.(A) 동문화 실험에서 WT P. aeruginosa는 A. 아우레우스 ΔagrBDCA를향해보다 훨씬 높은 지향성을 가진 WT S. 아우레우스쪽으로 이동, 이전에 S. 아우레우스(그림 5C)를향한 방향 운동성에 필요하다고 결정했다.
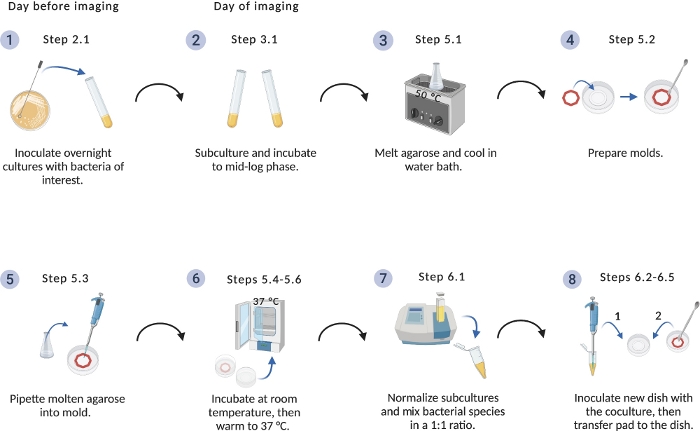
그림 1: 이미징 설정 프로토콜의 회로도.
세균 배양 및 아가로즈 패드의 준비를위한 중요한 단계의 개요. BioRender.com 함께 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
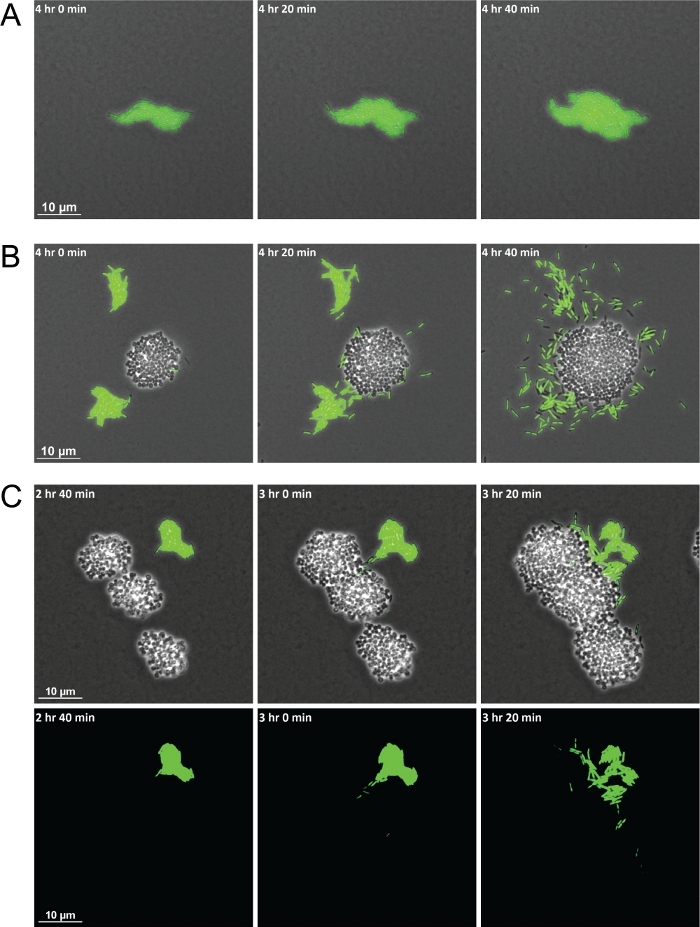
그림 2: 타임랩스, 라이브 이미징 현미경 검사는 S. 아우레우스와 교배할 때 P. aeruginosa 행동에 있는 다름을 보여줍니다.
P. aeruginosa의 대표적인 스냅 샷 (바실리, 녹색) 단문화(A)및 S. 아우레우스 (cocci, 마크가 없는)와 공동 문화에서(B). (C)형광 표지된 박테리아는 S. 아우레우스 클러스터를 침범하는 P. aeruginosa 단일 세포의 시각화를 허용합니다. 위상 대비 및 GFP 채널 오버레이(상단) 및 GFP 채널(맨 아래). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
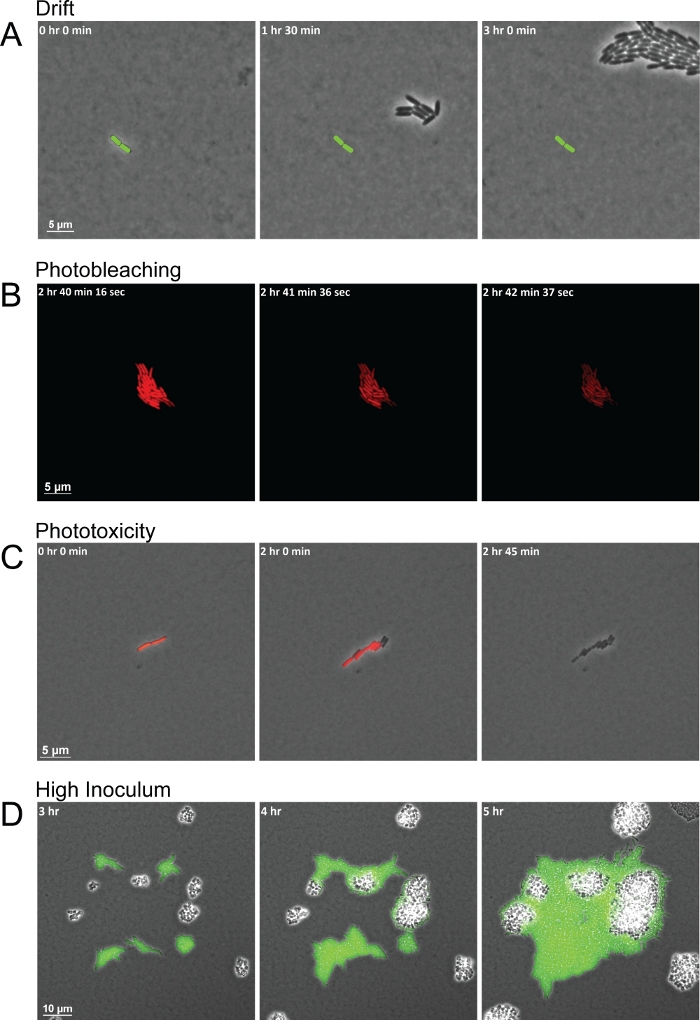
그림 3: 이미지 수집불량으로 이어지는 일반적인 이미징 문제의 대표적인 스냅 샷입니다.
(A)부적절하게 말린 패드와 일관되지 않은 습도는 이미징 기간 동안 FOV를 통해 세포의 표류로 이어집니다. 창립 셀의 위치는 각 프레임(녹색 막대)에 표시됩니다. (B)너무 오랫동안 빛에 노출에서 광표백은 시간의 기간 동안 형광의 검출 가능한 수준을 고갈하지만, 세포를 죽이지 않습니다. (C)광독성은 빛에 자주 노출되어 세포사멸을 초래한다. 광독성의 첫 징후는 세포가 형광을 멈추고 분열하지 못할 때 보입니다. (D)FOV에서 높은 초기 접종은 세포를 군중과 종 간 상호 작용의 관찰을 방지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
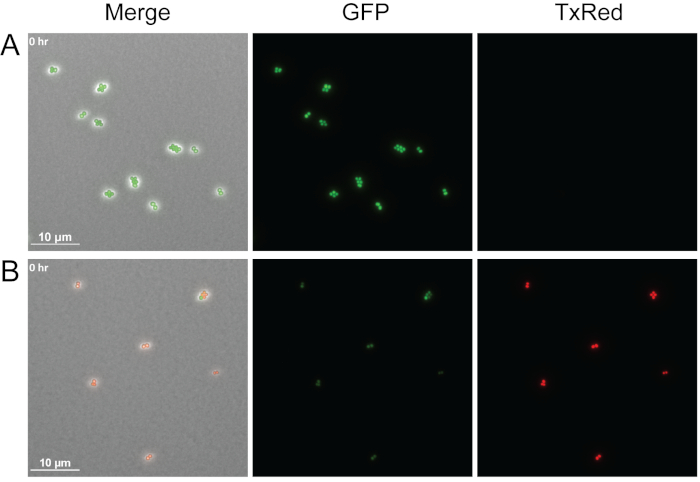
그림 4: 죽은 S. 아우레우스 세포대 살아있는 비교.
GFP 라벨WT S. 아우레우스에 대한 대표적인 스냅 샷은 중간 단독으로 처리(A)또는 세포없는 P. aeruginosa 상체(B). 세포는 치료 후 즉시 이미지화되었다. 살아있는 세포(green)는 GFP를 능동적으로 발현하고 프로피듐 요오드를 배제하고, 죽은 세포(적)는 GFP 형광및 막 투메아빌화를 잃으면 요오드제세포가 세포에 들어가 핵산을 결합할 수 있게 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: S. 아우레우스와공동 문화에서 P. aeruginosa의 세포 추적 분석 .
이전에는 WT 또는 ΔagrBDCA S. 아우레우스와함께 공동 배양에서 WT P. aeruginosa의 세포 추적을 수행하는 방법이 사용되었다. (A) S. 아우레우스 ΔagrBDCA와함께 문화에서 P. aeruginosa 단일 셀 트랙의 표현. (B)유클리디안 거리(D)(E)에 대한 회로도 및 축적된 거리(D(A) 측정을 위한 회로도(D)(E)/D(A))를 결정한다.(E)(A)(E)(A) (C)WT 및 ΔagrBDCA S. 아우레우스와함께 배양되는 단일 WT P. aeruginosa 세포의 방향 측정. 이 수치는 Limoli 등에서 수정되었습니다. 201924. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 제시된 방법은 세포 추적 및 감시 세포 생존가능성을 포함하여 그밖 응용을 위한 수정을 가진 단세포 수준에서 세균성 종 상호 작용의 살아있는 세포 화상 진찰을 위한 프로토콜을 기술합니다. 이 방법은 시간이 지남에 따라 다른 종과 공존하는 미생물의 단일 세포 행동을 연구하기위한 새로운 길을 열어줍니다. 특히, 이 프로토콜은 특히 운동성 표면 및 액체 관련 부속물을 모두 갖는 유기체를 연구할 때 세균 표면 거동을 관찰하는 이 동배 방법의 유용성을 보여줍니다. 예를 들어, 단일 초점 평면에서 세균 운동을 표면으로 제한함으로써, S. 아우레우스에 대한 응답으로 P. aeruginosa의 증가및 방향 성 필리 매개 운동성을 시각화할 수 있다.
앞서 언급했듯이, 이 이미징 방법을 사용하여 최적의 결과를 얻으려면 샘플 및 이미징 기기의 온도 및 습도(즉, 목표 및 단계)를 포함한 여러 조건을 고려해야 합니다. 더 많은 팁과 문제 해결을 보려면 보충 파일 1을참조하십시오. 부적절하게 건조 패드가 가장 일반적인 문제 중 하나이기 때문에 프로토콜의 성공적인 사용에 중요한 단계는 아가로즈 패드의 준비입니다. 도 3A에도시된 바와 같이, 패드가 충분히 오래 건조되지 않으면, 드리프트는 타임랩스 이미징의 시작 부분에 나타나는 반면, 너무 오래 건조된 패드는 수축하기 시작하고 세포가 FOV에서 몇 시간 동안 이미징으로 표류합니다. 모든 재료가 실험 기간 동안 균일한 온도와 습도에서 사전 데워지고 유지되도록 하여 스테이지 탑 인큐베이터와 습기가 없는 보풀이 없는 물티슈를 사용하여 드리프트를 줄이는 데 도움이 됩니다. 또한 금형에서 시료 접시로 옮기는 동안 첫 번째 패드가 제대로 건조되지 않거나 눈물을 흘리는 경우 백업 패드가 항상 만들어지는 것이 좋습니다. 또한, 세균 배양을 성장시키고 세포를 이미징할 때 배지에서 배경 형광을 최소화하기 위해 패드를 만들기 위해 저자동 발광 배지를 사용하는 것이 중요합니다. 풍부한 매체는 종종 높은 자동 형광을 가지고 있기 때문에, 현미경 검사법에 대한 최소한의 미디어를 사용하는 것이 좋습니다. 낮은 밀도 무분비및 FOV에서 세포의 공간 분포로 시작하는 것은 또한 이 방법의 핵심 요소입니다. 구체적으로, P. aeruginosa 및 S. 아우레우스 상호 작용을 평가하는 사전 연구에서, 이것은 박테리아가 존재하는 다른 종에 의해 검출될 수 있는 분비된 인자의 충분한 그라데이션을 생성하는 것을 허용하였다(도2B).
이 방법의 이점에도 불구하고 가격, 낮은 처리량 특성, 형광 제한 및 환경 조건 제어에 대한 높은 의존도를 포함하여 제한도 있습니다. 도3B-3C는 형광 현미경 검사법을 사용하는 주요 한계를 보여준다. Figure 3B 결과 섹션에서 설명한 바와 같이, 형광 이미지가 짧은 간격으로 캡처되면, 광표백 및 광독성이 발생할 수 있습니다. 이 두 가지 결과를 피하기 위해 형광 화상 간격은 형광을 충분히 분리하고 형광광을 가능한 한 낮게 촬영하여 형광을 적절히 시각화해야합니다. 추가적으로, 형광 화상 진찰을 위한 간격을 결정할 때, 각 형광의 성숙 시간을 고려하는 것이 중요합니다. 피규어 2, 도 3 및 도 4에도시된 P. aeruginosa 및 S. 아우레우스 균주에 사용되는 형광은 약 20분의 성숙 시간을 가지므로 잠재적인 광표백 효과에 대한 우려 없이 20분마다 흥분할 수 있다. 한편, 이 방법의 또 다른 단점은 세포가 높은 세포 밀도에 도달하면 후기 종 간 상호 작용의 관찰을 허용하지 않는다는 것입니다. 개별 세균세포를 시각화하기 위하여는, 그(것)들은 초점의 단 하나 평면에 남아 있어야 합니다. 그러나, 일단 인구가 높은 세포 밀도에 도달하면, 세포는 하나 이상의 평면에서 성장하기 시작합니다.
이 방법은 세포 생존가능성(도4)및 관심 유전자의 발현(도시되지 않은 데이터)과 같은 상이한 표현형을 연구하도록 수정될 수 있다. 도 4는 아가로즈 패드에 프로피듐 요오드를 추가하여 세균생존가능성을 시각화하기 위해 방법이 어떻게 적응되었는지를 보여주는 예이다. 이 방법의 또 다른 응용 프로그램은 형광 기자를 통해 다른 유기체와 공동 문화에서 세균 성 유전자 / 단백질 발현을 측정하는 것입니다. 예를 들어, 다중 형광은 플라스미드 벡터 또는 세균성 염색체로 통합되어 다른 유전자 또는 단백질의 발현을 동시에 연구할 수 있다. 여기서 중복되는 여기와 방출 스펙트럼이 없는 형광을 선택하는 것이 중요합니다. 마지막으로, 이미징 후 분석에서 세균세포 추적을 사용하면 방향성(도5),속도 및 가속, 다른 측정 중에서도24도계산할 수 있다.
전반적으로, 이전에 설명된 단일문화 프로토콜에서 적응된 이 공동배양 화상 진찰 방법은 공동 문화에서 다중 세균종의 행동을 시각화하는 기능을 향상시킵니다. 이 방법은 혼합 배양 관점에서 미생물을 연구할 수 있는 기회를 제공하며, 이는 각 종들이 단일 세포 방식으로 행동을 어떻게 변화시키는지에 대한 이해를 증가시켜 궁극적으로 세균성 종들이 다편 환경에서 어떻게 상호 작용하는지에 대한 새로운 통찰력을 제공합니다.
공개
저자는 공개 할 것이 없다고 선언합니다.
감사의 말
이 작품은 낭포성 섬유증 재단 포스트독 -교부 전환 상 LIMOLI18F5 (DHL), 낭포성 섬유증 재단 주니어 교수 모집 상 LIMOLI19R3 (DHL), NIH T32 교육 보조금 5T32HL007638-34 (ASP)의 자금 지원을 받았습니다. 제프리 마이스너, 김민수, 에단 가너에게 영상과 패드 제작에 대한 초기 프로토콜과 조언을 공유해 주신 것에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Agarose pads | |||
| 35 mm Glass Bottom Dish with 20 mm Micro-well #1.5 Cover Glass | Cellvis | D35-20-1.5-N | One for agarose pad molds, one for experiment |
| KimWipes | Kimberly-Clark Professional | 06-666A | |
| Low-Melt Agarose | Nu-Sieve GTG/Lonza | 50081 | For making agarose pads |
| Round-Bottom Spatulas | VWR | 82027-492 | |
| Round-Tapered Spatulas | VWR | 82027-530 | |
| Silicon Isolators, Press-to-Seal, 1 well, D diameter 2.0 mm 20 mm, silicone/adhesive | Sigma-Aldrich | S6685-25EA | For agarose pad molds |
| Sterile Petri Plates, 85 mm | Kord-Valmark /sold by RPI | 2900 | |
| Tweezers | VWR | 89259-944 | |
| M8T Minimal Media | |||
| D (+) Glucose | RPI | G32045 | |
| KH2PO4 | RPI | P250500 | |
| MgSO4 | Sigma-Aldrich | 208094 | |
| NaCl | RPI | S23025 | |
| Na2HPO4.7H2O | Sigma-Aldrich | 230391 | |
| Tryptone | BD Biosciences | DF0123173 | |
| Microscope | |||
| Andor Sona 4.2B-11 | Andor | 77026135 | Camera. 4.2 Megapixel Back-illuminated sCMOS, 11 μm pixel, 95% QE, 48 fps, USB 3.0, F-mount. |
| Filter Cube GFP | Nikon | 96372 | Filter cube |
| Filter Cube TxRed | Nikon | 96375 | Filter cube |
| H201-NIKON-TI-S-ER | Okolab | 77057447 | Stagetop incubator |
| Nikon NIS-Elements AR with GA3 and 2D and 3D tracking | Nikon | 77010609, MQS43110, 77010603, MQS42950 | Software for data analysis |
| Nikon Ti2 Eclipse | Nikon | Model Ti2-E | Microscope |
| CFI Plan Apo ƛ20x objective (0.75NA) | Nikon | MRD00205 | Objective |
| CFI Plan Apo ƛ100x oil Ph3 DM objective (1.45NA) | Nikon | MRD31905 | Objective |
| ThermoBox with built-in fan heaters | Tokai Hit | TI2TB-E-BK | Enclosure |
| Bacterial Strains | |||
| Pseudomonas aeruginosa PA14 (WT) | PMID: 7604262 | Non-mucoid prototroph | |
| Pseudomonas aeruginosa PA14 (WT) pSMC21 (Ptac-GFP) | PMID: 9361441 | ||
| Pseudomonas aeruginosa PAO1 (WT) pPrpoD-mKate2 | PMID: 26041805 | ||
| Staphylococcus aureus USA300 LAC (WT) | PMID: 23404398 | USA300 CA-Methicillin resistant strain LAC without plasmids | |
| Staphylococcus aureus USA300 LAC (WT) pCM29 (sarAP1-sGFP) | PMID: 20829608 | ||
| Staphylococcus aureus USA300 LAC ΔagrBDCA | PMID: 31713513 | ||
| Viability Stain | |||
| Propidium Iodide | Invitrogen | L7012 | LIVE/DEAD™ BacLight™ Bacterial Viability Kit |
참고문헌
- Lamichhane, J. R., Venturi, V. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6, 385(2015).
- Cursino, L., et al. Identification of an operon, Pil-Chp, that controls twitching motility and virulence in Xylella fastidiosa. Molecular Plant-Microbe Interactions. 24 (10), 1198-1206 (2011).
- Limoli, D. H., Hoffman, L. R. Help, hinder, hide and harm: what can we learn from the interactions between Pseudomonas aeruginosa and Staphylococcus aureus during respiratory infections. Thorax. 74, 684-692 (2019).
- Gabrilska, R. A., Rumbaugh, K. P. Biofilm models of polymicrobial infection. Future Microbiology. 10 (12), 1997-2015 (2015).
- Nobile, C. J., Mitchell, A. P. Microbial biofilms: e pluribus unum. Current Biology. 17 (10), 349-353 (2007).
- Marino, P. J., et al. Community analysis of dental plaque and endotracheal tube biofilms from mechanically ventilated patients. Journal of Critical Care. 39, 149-155 (2017).
- Frank, D. N., et al. Microbial diversity in chronic open wounds. Wound Repair and Regeneration. 17, 163-172 (2009).
- Fazli, M., et al. Nonrandom distribution of Pseudomonas aeruginosa and Staphylococcus aureus in chronic wounds. Journal of Clinical Microbiology. 47 (12), 4084-4089 (2009).
- Shimizu, K., et al. Pathogens in COPD exacerbations identified by comprehensive real-time PCR plus older methods. International Journal of Chronic Obstructive Pulmonary Disease. 10, 2009-2016 (2015).
- Behnia, M., Logan, S. C., Fallen, L., Catalano, P. Nosocomial and ventilator-associated pneumonia in a community hospital intensive care unit: a retrospective review and analysis. BMC Research Notes. 7, 232(2014).
- Maliniak, M. L., Stecenko, A. A., McCarty, N. A. A longitudinal analysis of chronic MRSA and Pseudomonas aeruginosa co-infection in cystic fibrosis: a single-center study. Journal of Cystic Fibrosis. 15 (3), 350-356 (2016).
- Limoli, D. H., et al. Staphylococcus aureus and Pseudomonas aeruginosa co-infection is associated with cystic fibrosis-related diabetes and poor clinical outcomes. European Journal of Clinical Microbiology & Infectious Diseases. 35 (6), 947-953 (2016).
- Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. In vivo and in vitro interactions between Pseudomonas aeruginosa and Staphylococcus spp. Frontiers in Cellular and Infection Microbiology. 7 (106), (2017).
- Smith, K., et al. Aspergillus fumigatus enhances elastase production in Pseudomonas aeruginosa co-cultures. Medical Mycology. 53, 645-655 (2015).
- Michelson, C. F., et al. Staphylococcus aureus alters growth activity, autolysis, and antibiotic tolerance in a human host-adapted Pseudomonas aeruginosa lineage. Journal of Bacteriology. 196 (22), 3903-3911 (2014).
- Ngamdee, W., et al. Competition between Burkholderia pseudomallei and B. thailandensis. BMC Microbiology. 15, 56(2015).
- Heir, E., Møretrø, T., Simessen, A., Langsrud, S. Listeria monocytogenes strains show larger variations in competitive growth in mixed culture biofilms and suspensions with bacteria from food processing environments. International Journal of Food Microbiology. 275, 46-55 (2018).
- Lutz, C., Thomas, T., Steinberg, P., Kjelleberg, S., Egan, S. Effect of interspecific competition on trait variation in Phaeobacter inhibens biofilms. Environmental Microbiology. 18 (5), 1635-1645 (2016).
- Meisner, J., et al. FtsEX is required for CwlO peptidoglycan hydrolase activity during cell wall elongation in Bacillus subtilis. Molecular Microbiology. 89 (6), 1069-1083 (2013).
- Coates, J., et al. Antibiotic-induced population fluctuations and stochastic clearance of bacteria. eLife. 7, 32976(2018).
- Korber, D. R., Lawrence, J. R., Sutton, B., Caldwell, D. E. Effect of laminar flow velocity on the kinetics of surface recolonization by Mot+ and Mot- Pseudomonas fluorescens. Microbial Ecology. 18, 1-19 (1989).
- Lawrence, J. R., Korber, D. R., Caldwell, D. E. Behavioral analysis of Vibrio parahaemolyticus variants in high- and low- viscosity microenvironments by use of digital image processing. Journal of Bacteriology. 174 (17), 5732-5739 (1992).
- Lawrence, J. R., Wolfaardt, G. M., Korber, D. R. Determination of diffusion coefficients in biofilms by confocal laser microscopy. Applied and Environmental Microbiology. 60 (4), 1166-1173 (1994).
- Limoli, D. H., et al. Interspecies interactions induce exploratory motility in Pseudomonas aeruginosa. eLife. 8, 47365(2019).
- Burrows, L. Pseudomonas aeruginosa twitching motility: type IV pili in action. Annual Review of Microbiology. 66 (1), 493-520 (2012).
- Lee, C. K., et al. Multigenerational memory and adaptive adhesion in early bacterial biofilm communities. PNAS. 115 (17), 4471-4476 (2018).
- Tolosa, A., et al. Enhanced field-of-view integral imaging display using multi-Köhler illumination. Optical Society of America. 22 (26), 31853-31863 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유