Method Article
Primer Nöral Kök ve Progenitor Hücrelerinin Hücre Yüzey Belirteçlerinin Sialoglycan'ın Metabolik Etiketlemesi ile Belirlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan bir in vitro nöral-endotel co-kültür sistemi ve biyoortogonal fonksiyonel gruplar ile sialoglycan metabolik birleşme birleştiren bir protokoldür primer nöral kök ve döl hücreleri genişletmek ve yüzey etiket hücre yüzey belirteçlerinin görüntüleme veya kütle spektrometresi analizi için siyaloglycoproteinler.
Özet
Nöral kök ve progenitor hücreleri (NSPCs) beynin karmaşık yapıları ve fonksiyonları için hücresel temelidir. Onlar vivo özel nişler bulunmaktadır ve izole edilebilir ve in vitrogenişletilmiş , beyin hasarı onarmak için hücre nakli için önemli bir kaynak olarak hizmet vermektedir. Ancak, NSPCs heterojen ve açıkça moleküler düzeyde tanımlanmış ya da belirli hücre yüzey belirteçleri eksikliği nedeniyle saflaşmış değildir. Daha önce bildirilen protokol, primer NSPC'lerin yüzey siyaloglycoproteom'unun belirlenmesi için nöral-endotel ortak kültür sistemini metabolik glikan etiketleme yöntemiyle birleştirir. NSPC-endotel ortak kültür sistemi kendi kendine yenileme ve birincil NSPCCs in vitrogenişlemesi sağlar , NSPCCs yeterli sayıda üreten. Kültürlü NSPCs Sialoglycans ile doğal olmayan bir sialic asit metabolik muhabir kullanılarak etiketlenir biyoortogononal fonksiyonel gruplar. Kendi kendini yenileyen NSPC'lerden siyaloglycoproteome'yi karşılayarak endotel ortak kültüründe genişleyen ve nöral kültürü farklılaştıran bir membran proteinlerinin listesini tanımlıyoruz. Ayrıntılı olarak, protokol içerir: 1) bir NSPC-endotel ortak kültür ve NSPC ayırt edici kültür kurulumu; 2) azidosugar per-O-acetylated N-azidoacetylmannosamine (Ac4ManNAz) ile etiketleme; ve 3) kitle spektrometresi analizi için nöral kültürden nöral kültür veya protein çıkarma fiksasyonu sonra görüntüleme için modifiye sialoglycan biotin konjugasyonu. Daha sonra, NSPC ile zenginleştirilmiş yüzey işaretleyici adayları, hem genişletilmiş NSPC hem de farklılaştırılmış sinir kültürlerinden kütle spektrometresi verilerinin karşılaştırmalı analizi ile seçilir. Bu protokol, başlangıç maddelerinde düşük miktarda ki membran proteinlerinin tanımlanması nda son derece hassastır ve uygun modifikasyonlarla diğer sistemlerde marker keşfine uygulanabilir.
Giriş
Nöral kök hücreler, kök hücre havuzunu korumak ve nöronlar ve glia içine ayırt etmek için kendini yenileyebilen çok güçlü bir hücre popülasyonu olarak tanımlanır. Onlar sinir sisteminde önemli hücre tipleri ve hastalıklı ve yaralı beyinlere hücre nakli yoluyla rejeneratif tıpta büyük terapötik potansiyel sunabilir1,2. Gelişme ilerledikçe, nöral kök hücre popülasyonu heterojen olur3,4, ve beyindeki nöral kök hücrelerin oranı giderek azalır5. Genel olarak konuşursak, embriyonik nöral kök hücreler ve diğer nöral progenitor hücreleri, topluca nöral kök ve progenitor hücreleri denir (NSPCs), germinal bölgelerde yer almaktadır, ventriküler bölge, ventriküler bölge, ve farelerde subventriküler bölge6. Embriyonik beyinde, nöral kök hücreler doğrudan veya dolaylı olarak ara progenitor hücreleri (IPCs) aracılığıyla nöronlar oluşturmak ve dış subventriküler bölge progenitors aracılığıyla bazı türlerde (oRGs)7,8. Spesifik moleküler imza, morfoloji, kök hücre niş konumu ve farklılaşma potansiyeli tüm beyin organogenez ve klinik uygulamalarda her alt tipin rolünü belirlemek9. Ancak, şu anda kullanılabilir hücre yüzeyi belirteçleri, bu alt tiplerin anlaşılmasını ve kullanımını sınırlayarak, farklı NSPC'lerin alt türlerini kesin olarak ayırt edemez ve arındıramaz.
Birincil NSPC'lerin yüzey işaretleyicilerinin tanımlanması üç ana engelle sınırlıdır. Bunlardan ilki dokudaki sınırlı hücre li sayıdır ve hücre yüzeyi protein örneklerini ortak kütle spektrometresi analizi için hazırlamayı zorlaştırır. İkinci sınırlama, alt tipe özgü membran protein verileri üretmek için saf hücre alt tiplerini üretmedeki zorlukdur. Son olarak, üçüncü zorluk, hücre yüzeyproteinlerinin tüm hücre proteinlerindeki düşük oranıdır, bu da kütle spektrometresi analizi ile algılama hassasiyetlerini engellemektedir.
Bu sorunların üstesinden gelmek için, siyonlycoproteinleri metabolik olarak etiketleyerek primer NSPC'lerde hücre yüzeyproteinlerini seçici olarak zenginleştirmek ve tanımlamak için kemoproteomik bir yaklaşım geliştirdik10. Yeterli sayıda NSPC oluşturmak için, permeable destek kullanarak fare beyin endotel hücre hatları ile birlikte nspcs birlikte tokuş ederek, in vitro farklılaşmamış devletlerde birincil embriyonik NSPCs genişletmek ve korumak için kurulmuş bir protokol yararlandı matris insert(örneğin, transwell) sistem11. Buna karşılık, ENDOTEL HÜCRELERI olmadan tek başına kültürlü NPSCs diferansiye döloluşturmak 11,12. Böylece, bu iki kültür sisteminden alınan protein örnekleri, NSPC'lerde ve farklılaştırılmış nöronlarda farklı olarak ifade edilen proteinleri tanımlamak için karşılaştırmalı olarak analiz edilebilir. Çoğu hücre yüzey proteinleri siyalik asit13tarafından modifiye edilir gibi , doğal olmayan siyalik asit öncüsü analog N-azidoacetylmannosamine-tetraacylated (Ac4ManNAz) içsel metabolik yolu kaçırmak için kullanıldı böylece endojen, yeni sentezlenmiş siyaloglikanlar azido grupları ile etiketlenir, kimyasal sapı üreten14. Azido-alkyne aracılı biyoortogonoal reaksiyonlar sayesinde, hangi sialoglycans için biotin conjugate, hücre yüzey proteinleri görselleştirilmiş ve bir streptavidin-çiftli florofor veya matris14ile proteomik tanımlama için zenginleştirilmiş olabilir.
Burada, NSPCs yüzey sialoglycoproteome yüzey sialoglycoproteome boyama gerçekleştirmek bir endotel co-kültür ve olmayan bir co-kültür sisteminde hücreleri ayırt. Ayrıca proteomik karşılaştırma için iki kültür sisteminde yüzey siyaloglycoproteme'yi seçici olarak arındırıyoruz. Protokolümüz, geleneksel santrifüj tabanlı hücre yüzeyi saflaştırma protokolleri15ile karşılaştırıldığında, belirli etiket çekimi ve afinite ile yüzey protein çıkarma prosedürleriazaltarak ekstraksiyon etkinliğini artırır Arıtma. Bu arada, sialylation çoğunlukla hücre yüzeyi proteinleri olur öncül dayalı hücre yüzeyi proteinlerinin ekstraksiyon saflığı artırır. Endotel faktörleri genişletilmiş NSPC'lerin farklılaşmasını tamamen engelleyemese de, ortak kültür ve farklılaştırılmış kültür arasındaki karşılaştırmalı çalışma, kök hücre ile zenginleştirilmiş yüzey proteinlerini FACS16tarafından saflaştırılmış NPCs gelen proteinleri analiz. Bu yaklaşımın uygun modifikasyonlarla diğer sistemlerdeki yüzey proteinlerinin çalışmalarına uygulanabileceğine inanıyoruz.
Protokol
Bu çalışmada kullanılan tüm hayvan protokolleri Tsinghua Üniversitesi IACUC (Kurumsal Hayvan Bakım ve Kullanım Komitesi) tarafından onaylanmış ve IACUC kurallarına uygun olarak gerçekleştirilmiştir. Tsinghua Üniversitesi'ndeki laboratuvar hayvanı tesisi AAALAC (Uluslararası Laboratuvar Hayvan Bakımı Değerlendirme ve Akreditasyon Derneği) tarafından akredite edilmiştir. Embriyoların evrelemesinde, tanımlanan vajinal fişin orta sıembriyonik gün 0.5 (E0.5) olarak hesaplandı.
NOT: Tüm hücreler 37 °C ve %5 CO2koşullarında hücre kuluçka makinesinde kültürlenir.
1. Geçirilebilir Destek Uçlarında Fare Endotel Kültürünün Hazırlanması
NOT: BEND3 hücreleri üreticinin talimatlarına göre korunur.
- 500 mL DMEM içine 50 mL FBS ve 5 mL penisilin-streptomisin ekleyerek BEND3 hücre ortamını (BM) hazırlayın ve iyice karıştırın.
- Çanaktan orta yıkayın ve bir kez 1 mL PBS ile BEND3 hücre kültürünü yıkayın. Hücrelere %0,25 Tripsin-EDTA 1 mL ekleyin ve hücreleri 37 °C'de 4 dakika kuluçkaya yatırın.
- Hücreleri tamamen ayırmak için Tripsin-EDTA ve pipet yavaşça aşağı nötralize etmek için hücrelere BM 1 mL ekleyin. Hücre süspansiyonunu yeni bir 15 mL konik tüpe ve 400 x g'de5 dk oda sıcaklığında (RT) santrifüj ile pelete aktarın.
- Tüpten süpernatant aspire ve taze BM 9 mL hücreleri yeniden askıya, sonra bir geçirgen destek eklemek içine hücre süspansiyon 1 mL ekleyin. Matrisin alt odasında her kuyu başına 2 mL daha taze BM ekleyin. Hücreleri bir gün kültüre almaya devam edin.
2. Mouse Primer Kortikal NSPCs Kültürünün Hazırlanması
-
Kültür plakası hazırlanması, papain sindirim ortamı ve kortikal yapışık kültür ortamı (AM)
- 6 kuyulu plakalara 1 mL PLL çözeltisi ekleyerek poli-L-lizin (PLL) içeren 6 kuyulu plakalar. Daha sonra, 30 dakika boyunca RT plakaları kuluçkaya yatırın.
- PLL çözeltisini 15 mL konik bir tüpe aktarın. Tabakları 3 kez çift distile su ile yıkayın. Plakaları hava kurutun ve kullanıma kadar bir kenara koyun.
- 5 mL DMEM'e 50 U papain, 50 μL L-glutamin ve 50 00 mg/mL asetil-L-sistein ekleyerek papain sindirim ortamını hazırlayın. Orta ortamı kısa bir süre karıştırın ve enzim aktivasyonu için 30 dk boyunca 37 °C'ye ısıtın.
- Kortikal hücre yapışık kültür ortamını (AM) hazırlayın: 500 μL L-glutamin, 500 μL sodyum pirüuvat, 500 μL 100 mg/mL N-asetil-L-Sistein, 500 μL N2, B27'nin 1 mL'si ve 5 μL'si 100 μg/mL bFGF'yi 50 mM DML'ye ekleyin. Orta yı iyice karıştırın ve kullanmadan önce 37 °C'ye ısıtın.
-
Primer serebral kortikal hücrelerin hazırlanması ve sonraki kaplama
- Servikal çıkış ile E10.5 zamanlı hamile fare kurban.
NOT: E10.5'te, hücrelerin çoğunluğu serebral kortekste NSPC'ler çoğalır ve in vitro büyük döl klonları ortaya çıkar. - Karın kısmını %75 etanol ile sterilize edin. Orta çizginin sağ tarafı boyunca deri ve altta yatan kas keserek karın açmak için ince makas ve mikro tırtıklı forceps kullanın. Tırtıklı forceps ile yavaşça karın boşluğundan rahim çıkarın ve ince makas ile karın boşluğundan kesip.
- 10 cm Petri kabında rahmi 40 mL önceden soğutulmuş HBSS ile yıkayın. Daha sonra rahmi 10 cm'lik yeni bir Petri kabına aktarın ve 40 mL önceden soğutulmuş HBSS ile tekrar yıkayın.
- Rahmi 40 mL önceden soğutulmuş HBSS ile 10 cm'lik yeni bir Petri kabına aktarın. Rahim ve amniyotik membran dan embriyolar çıkarın, sonra Kuyumcular microforceps ile gövdeleri kapalı embriyoların başlarını kesti.
- Kafaları 40 mL önceden soğutulmuş HBSS ile yıkayın ve kafaları 40 mL önceden soğutulmuş HBSS ile yeni bir 10 cm Petri kabına aktarın. Beyinleri kaplayan deri ve kıkırdağı soymak için Kuyumcular mikrokosepleri kullanın, sonra serebral korteksleri kesip önceden soğutulmuş HBSS ile 15 mL konik tüp içinde toplayın.
- 4 °C'de 3 dk ve 300 x g'dasantrifüj ile kortikasyonlar pelet. Tüpten supernatant aspire, sonra aktif papain sindirim orta ve 15 μL ekleyin 4 mg/mL DNase I doku pelet içine.
- Hafif girdap ile doku pelet kısa bir süre resuspend. 30 dk için 37 °C'de doku kuluçka. Bu süre zarfında, kısa girdap her 10 dakikada bir doku gevşetin.
NOT: Sindirim sonunda, tüp hiçbir görünür doku parçaları olmalıdır. - 4 °C ve 450 x g'da10 dk santrifüj ile kortikal hücreler pelet . Tüpten süpernatant aspire ve önceden soğutulmuş DMEM ile hücre pelet yıkayın. Bu adımı bir kez tekrarlayın.
NOT: Sindirim ve yıkama sırasında, güçlü bir kesme kuvveti ile hücrelere zarar önlemek için dokular ve hücre pelet kabaca pipet değil dikkatli olun. - Tüpten süpernatant aspire sonra tüp içine önceden soğutulmuş HBSS 1.5 mL ekleyin. Kortikal hücre peletini nazik pipetleme ile tek bir hücreye ayırın. Hemositometreli hücre numarasını say.
- 6-iyi plakalar içine iyi başına 2 mL ve 2 x 104 kortikal hücreleri ekleyin. 37 °C ve %5 CO2'de hücreleri tabağa bağlamak için 3 saat kuluçkaya yatırın.
- Servikal çıkış ile E10.5 zamanlı hamile fare kurban.
3. Nöral-endotel Ortak Kültür ve Ac4ManNAz Etiketleme Sisteminin Kurulumu
- Kesici uçlarda BEND3 hücrelerini kaplamadan bir gün sonra, önce alt odadaki ortayı, sonra kesici uçları hafifçe aspire edin. Önceden ısıtılmış DMEM ile kesici uçların yüzünü 3 kez yıkayın. Önceden ısıtılmış DMEM ile durulayarak kesici uçların dış yüzeyini yıkayın.
- Bir kesici uça önceden ısıtılmış 1 mL'lik ekleyin ve kesici uçları birincil kortikal hücrelerle kuyulara aktarın. Ortak kültürü 37 °C'de ve %5 CO2'de 12 saat kuluçkaya yatırın.
- 200 mM'lik bir stok konsantrasyonu elde etmek için Ac4ManNAz'ı DMSO'da çözün. Nöral-endotel ortak kültürünü kurduktan sonra 12 saat, alt oda başına 1 μL Ac4ManNAz stokve ko-kültüre kesici uç başına 0,5 μL stok ekleyin. Orta iyi karıştırmak için hemen ve yavaşça plakaları sallayın. Kontrol hücreleri için eşit miktarda DMSO ekleyin.
- Kültür 37 °C ve% 5 CO2başka bir 5 gün için hücreleri . AM'yi 10x bFGF ile yeniden besleme ortamı (RM) olarak hazırlayın. Bu süre zarfında, endotel ve sinir hücrelerini her gün beslemek için kesici uç başına 100 μL ve alt oda başına 200 μL RM ekleyin. Yeniden besleme sırasında, kültüre Ac4ManNAz veya DMSO sağlamayın.
4. Genişletilmiş Primer NSPC'lerde ve Diferansiye Nöronlarda Siyaloglycoproteinlerin İmmünofloresan Boyanışı
- BTTAA-CuSO4 kompleks 1 30x stok içeren 1.5 mM CuSO4 ve 9 mM BTTAA çift distile su hazırlayın. PBS'de 50 μM biotin-alkin, 2,5 mM sodyum askorbat ve 1x BTTAA-CuSO4 kompleksi içeren taze biotin konjuge tampon 1 hazırlayın.
- Eklerin ortak kültür plakalarından çıkarılmasını. Alt kuyulardan kültür ortamıaspire ve önceden ısıtılmış PBS ile bir kez nöral hücreleri yıkayın.
- PBS'yi kuyulardan aspire edin. Hücrelere her biri için %4 önceden soğutulmuş %4 paraformaldehit PBS çözeltisi ekleyin ve RT'deki hücreleri 10 dakika boyunca düzeltin. Daha sonra hücreleri önceden soğutulmuş PBS ile 3 kez yıkayın.
- Kuyulardan PBS aspire ve hücrelere iyi iyi başına taze hazırlanmış biotin konjuge tampon 1 1 mL ekleyin. HÜCRELERI 10 dakika boyunca RT'de kuluçkaya yatırın.
- Kuyulardan reaksiyon tamponu aspire edin. Hücreleri PBS ile 3 kez yıkayın. %1 FBS ve 1 μg/mL Alexa Fluor 647-streptavidin içeren boyama tamponu hazırlayın. Hücrelere iyi başına 1 mL boyama tampon ekleyin ve 30 dakika boyunca RT hücreleri kuluçka.
- Önceden soğutulmuş PBS ile kuyulardan ve yıkanmış hücrelerden 3 kez boyama tamponu aspire edin. PBS'de %5 BSA ve %0,3 non-iyonik deterjan-100 içeren engelleme tamponu hazırlayın. Hücrelere iyi başına 1 mL engelleme tamponu ekleyin ve 10 dakika boyunca RT'de kuluçkaya yatırın.
- Anti-nestin ve anti-β-tubulin III antikorlarını sırasıyla 1:20 ve 1:1000 oranlarında bloke tamponu içine seyrelterek birincil antikor çözeltisi hazırlayın. Kuyulardan engelleme tamponu çıkarın ve hücrelere her kuyu başına 1 mL primer antikor çözeltisi ekleyin. Hücreleri bir gecede 4 °C'de kuluçkaya yatırın.
- Ana antikor solüsyonu kuyulardan çıkarın. Önceden soğutulmuş PBS ile hücreleri 3 kez yıkayın. Alexa Fluor 488 keçi anti-fare IgG1, Alexa Fluor 546 keçi anti-fare IgG2b seyreltme ve DAPI birlikte 1:1.000 bir seyreltme tampon engelleme içine ikincil bir antikor çözeltisi hazırlayın. PBS'yi kuyulardan aspire edin ve hücrelere her kuyu başına 1 mL sekonder antikor çözeltisi ekleyin. HÜCRELERI 2 saat boyunca RT'de kuluçkaya yatırın.
- Kuyulardan antikor solüsyonu aspire ve önceden soğutulmuş PBS ile hücreleri 3 kez yıkayın. Daha sonra, hücreler görüntü yakalama için hazırdır.
5. Genişletilmiş Primer NSPC'lerden ve Farklılaştırılmış Nöronlardan Sialoglycoproteinlerin Saflaştırılması
- BTTAA-CuSO4 kompleks 2 1.5 mM CuSO4 ve 3 mM BTTAA içeren çift distile suda hazırlayın. Protein resuspension tamponuna %4 SDS ve 10 mM EDTA içeren çift distile suda hazırlayın; protein resuspension tampon B içeren 150 mM NaCl, 50 mM trietanolamine, ve 1% polioksietilen oleyl eter (örneğin, Brij97) pH 7.4 ile çift distile su. Kullanmadan önce, tam protein resuspension tampon hazırlamak için arabellek A:tampon B = 1:8 (vol/vol) karıştırın. PBS'de %2 SDS içeren protein yıkama tamponu 1 hazırlayın; protein yıkama tamponu 2 içeren 8 M üre 250 mM amonyum bikarbonat (ABC); ve pbs 2.5 M NaCl içeren protein yıkama tampon 3.
- Eklerin ortak kültür plakalarından çıkarılmasını. Alt kuyulardan kültür ortamıaspire ve önceden soğutulmuş PBS ile bir kez nöral hücreleri yıkayın.
- PBS'yi kuyulardan aspire edin ve plakalara her kuyu başına 200 μL önceden soğutulmuş RIPA tamponu ekleyin. Plakaları 5 dk. 1,5 mL tüpler halinde protein lisisini toplayın. 4 °C'de 10 dk ve 12.000 x gsantrifüj ile hücre enkazPelet .
- Supernatant'ı yeni 1,5 mL tüplere aktarın. BCA kiti ile protein konsantrasyonu üreticinin talimatlarına göre belirleyin. Protein konsantrasyonu 1 mg/mL'ye ayarlayın.
- 100 μM alkine-biotin, 2,5 mM sodyum askorbat ve 1x BTTAA-CuSO4 kompleks 2 ila 1 mL protein lisyonu ekleyin ve çözeltiyi iyice karıştırın. Karışımı RT'de 1 saat kuluçkaya yatırın.
- Reaksiyon çözeltisini 50 mL konik bir tüpte önceden soğutulmuş metanolün 20 mL'sine aktarın. Proteinleri çökeltmek için bir gecede -30 °C'de iyice karıştırın ve kuluçkaya yatırın.
- Pelet protein 4 °C ve 4.500 x g15 dakika için santrifüj ile çökelti . Protein peletini 20 mL önceden soğutulmuş metanol ile iki kez yıkayın. Tüpten süpernatant aspire. Protein peletini 4 mL protein resuspension tamponu ile yeniden askıya alın ve protein süspansiyonu yeni bir 15 mL konik tüpe aktarın.
- Streptavidin boncuk50 μL alın ve PBS ile 3 kez yıkayın. Yıkanmış boncukları protein süspansiyonuna ekleyin. Çözeltiyi 4 °C'de, dikey bir rotatörde 20 rpm dönüş hızında 3 saat eve inküler.
- Boncukları 6 çeşit tamponla sırayla yıkayın: protein yıkama tamponu 1, protein yıkama tamponu 2, protein yıkama tamponu 3, 0,5 M ABC, 0,25 M ABC ve 0,05 M ABC.
- Yıkadıktan sonra boncukları 20 μL PBS ile yeniden askıya alın ve boncukları 1,5 mL'lik yeni bir tüpe aktarın. Boncukların içine 20 μL 2x protein yükleme tamponu ekleyin ve 95 °C'de 10 dakika tedavi edin. Protein örnekleri daha sonra SDS-PAGE tabi ve coomassie parlak mavi R-250 üreticinin talimatlarına göre lekeli olmalıdır. Kütle spektrometresi analizi için Coomassie parlak mavi R-250 tarafından belirtildiği gibi jel proteinleri kesin.
Sonuçlar
Primer embriyonik NSPC'lerin in vitro genleşme ve metabolik etiketleme için tüm prosedür 6 gün sürer(Şekil 1A). BEND3 hücre hattının kalitesi ve yeni izole edilmiş birincil NSPC'ler başarılı bir deneyin anahtarıdır. BEND3 hücreleri, NSPC'lerin kendini yenilemesini ve çoğalmasını teşvik eden çözünür faktörlerin kaynağıdır. Bu BEND3 hücreleri herhangi bir kontaminasyon ücretsiz ve nöral hücrelerle co-culturing önce minimal hücre ölümü ile aktif olarak bölmek emin olmalıdır. Birincil NSPC'ler ayrışma sırasında aşırı hasarı önlemek için dikkatle hazırlanmalıdır. Hasarlı NSPM'ler hala büyüyebilir ve farklılaşabilir; ancak, onlar da köklüğünü korumak ve genişletmek için endotel uyaranlara yanıt mümkün değildir. Protokol birincil kültür ortamına antibiyotik eklenmesini önermediği için hücre culturing sırasında aseptik olması için ekstra dikkatli olunmalıdır.
Başarılı endotel ortak kültürü NSPC'leri büyük, yaprak benzeri klonlar oluşturmaya yönlendirecektir. Bu özellikli klon şekilleri gün 4 belirgin hale gelir ve 6. Klonların içinde, hücreler birbirleriyle yakın temas halindedirler. NSPC marker Nestin ve nöronal marker β-tubulin III karşı antikorlar ile immünboyboyama klon, hücrelerin çoğu Nestin+ NSPCs ve çok az β-tubulin III+ nöronal hücreler olduğunu ortaya çıkarmalıdır. Buna karşılık, non-co-kültür sisteminde oluşan klonda Nestin+ hücreleri ve β-tubulin III+ nöronal hücrelerin yüzdesi hemen hemen aynıdır(Şekil 1B, 1D, ve 1E).
Kimyasal muhabir, Ac4ManNAz, bir metabolik analog ve içsel protein siallasyon yolu içine dahil edilebilir. Ac yüksek dozlarda4ManNAz hücreler için toksik. Her bir hücre türü için, Ac4ManNAz'ın etiketleme konsantrasyonu önemli sitotoksisite olmadan en yüksek etiketleme verimliliğini elde etmek için önceden test edilmelidir. Burada, primer NSPC için Ac4ManNAz'ın optimize edilmiş etiketleme konsantrasyonu 100 μM'dir. Hücre ölümünün hücresel ve nükleus morfolojisi ile endike olarak değerlendirilmesi, bu etiketleme konsantrasyonunun belirgin sitotoksik etkilere neden olmadığını ve NSPC'leri(Şekil 1C ve 1D)verimli bir şekilde etiketleyebilme. Hem endotel ortak kültür hem de eş-kültür dışı sistemde NSPC'lerin klonal morfolojisi, kendini yenileme ve farklılaşma potansiyeli etkilenmez(Şekil 1C, 1D, ve 1E).
Ac4ManNAz tarafından NSPCs başarılı etiketleme azide ve alkyne arasında bir biyoortogonal reaksiyon aracılık bir kültüre biotin konjuge sonra incelenebilir. Ac4ManNAz etiketli kültürdeki her hücre Alexa Fluor 647-streptavidin ile boyanmış ve görselleştirilmiştir. DMSO kontrol grubunda Alexa Fluor 647-streptavidin boyama için hiçbir hücre pozitif değildir. Buna ek olarak, biotin konjugasyonu ve streptavidin boncuk arınması ile Ac4ManNAz etiketli kültürden hazırlanan protein örnekleri SDS-PAGE jellerinde güçlü Coomassie parlak mavi boyama sinyali göstermektedir. Bu arada, DMSO kontrol grubundan protein örnekleri ile yüklü şeritlerde sadece arka plan ve nonspesifik bağlama sinyalleri boyama vardı. Bu aynı zamanda Ac4ManNAz (Şekil 1F)tarafından NSPC'lerin etkin etiketleme gösterir.
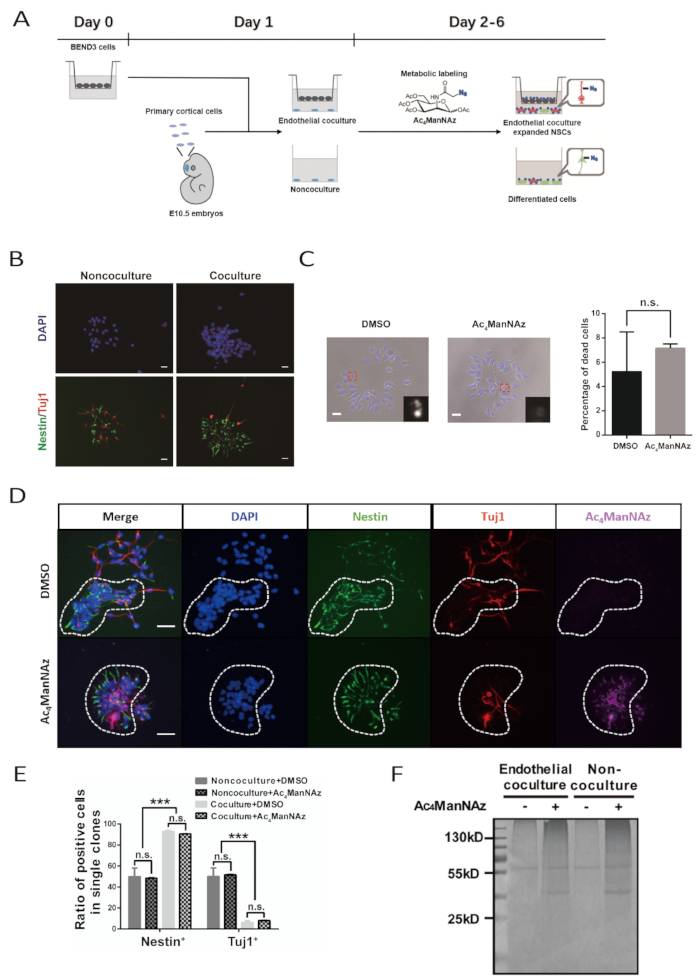
Şekil 1 : Endotel ortak kültür sistemi ve metabolik siyaloglikan etiketleme ile desteklenen primer NSPC'ler için hücre yüzey belirteçlerinin belirlenmesi. (A) Protokol için iş akışının şeması. Bu rakam Bai ve ark değiştirilmiştir. 10. BEND3 hücreleri D0'daki matris uçlarına yerleştirilir. Primer kortikal NSPC'lerin hazırlanması ve ortak kültür sisteminin kurulması D1'de gerçekleştirilir. Kültürün metabolik etiketlemesi D2'den D6'ya kadar sürer. Kültür besleme D3 ve D5'te yapılır. (B) Endotel hücreleri olsun veya olmasın 5 günlük kültürden sonra primer NSPC'ler tarafından oluşturulan klonlar için immünofloresan görüntüler. Ölçek çubuğu, Ac4ManNAz veya DMSO ile 5 günlük bir kültürden sonra birincil NSPC'ler tarafından oluşturulan klonlar için 20 m. (C) parlak alan görüntülerini gösterir. Çekirdekler DAPI tarafından sayıldı. Ölçek çubuğu 20 μm'yi gösterir. Hata çubuğu SEM (n.s. = önemli değil) gösterir. (D) NSPC için immünofloresan görüntüler Ac4ManNAz veya DMSO ile endotel co-kültür klonları oluşturdu. Kesikli daire tek bir sinirsel klon çizer. Ölçek çubuğu, NSPC'lerin 50 μm. (E) Endotel eş-kültür ve ac4ManNAz etiketleme veya DMSO kontrolü ile eş-kültür dışı sistemde NSPC'ler tarafından oluşturulan klonlarda farklılaştırılmış nöronların sayısallaştırılmasını gösterir. Hata çubuğu SEM (***p < 0.0005; n.s. = önemli değil) gösterir. (F) Endotel ortak kültür ve non-co-kültür sisteminde Ac4ManNAz veya DMSO ile etiketlenmiş sinir hücrelerinden streptavidin boncukları ile saflaştırılmış proteinlerin coomassie parlak mavi boyama. Kontrol etiketleme gruplarındaki 55 kD bant nonspesifik bağlayıcı proteinleri temsil eder. (B, C, E ve F) bu protokole uygun olarak Bai ve ark.'dan uyarlanmıştır. 10. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yüzey işaretleri genellikle etiket ve in vitro ve in vivo17,18belirli hücre tipleri arındırmak için kullanılır. Yüzey belirteçlerinin keşfi, bir kök hücre popülasyonunun normal veya patolojik dokulardan ve kültür yemeklerinden seçici olarak zenginleştirilen moleküler araçlar sağlayarak, arınmış bir hücre sunarak yenileyici tıp ve kök hücre araştırmalarına büyük katkıda bulunur. biyolojik özelliklerin klinik kullanımı veya incelenmesi için kaynak. Ancak, nöral kök hücre araştırmaları için yüzey belirteçleri geliştirmede ilerleme birincil dokulardan kök hücrelerin izole zorluk nedeniyle yavaş olmuştur. Burada açıklanan protokol basitleştirilmiş bir in vitro platforma dayanmaktadır. Endotel eş-kültürü tarafından genişletilmiş birincil NSPC'leri farklılaştırıcı bir nöral kültürle karşılaştırarak, genişletilmiş NSPC'lerde farklı olarak ifade edilen proteinler vurgulanır ve daha fazla tanımlamaya olanak sağlar. Protokolümüz aynı zamanda biyoortogonal gruplarla sialoglikan etiketlemek için içsel metabolik yolu kaçırarak hücre yüzeyi proteinlerini arındırmak için alternatif bir strateji sağlar. Hücre yüzeyi proteinlerinin arındırılabilmesi için geleneksel protokollerle karşılaştırıldığında, bu protokolün avantajları iki özel özellik ile desteklenir: 1) hücre yüzeyi proteinleri üzerindeki sialylation prevalansı hücre yüzeyi proteomunun maksimum kapsama alanını sağlar, ve 2) biyoortogonoal grup ve ligands arasındaki reaksiyon özgüllüğü elde edilen yüzey proteom saflık verir. Böylece protokolümüz daha az başlangıç malzemesi olması durumunda daha hassas bir proteomik analiz le sonuçlanmaktadır. Birincil NSPC yüzey belirteçlerinde bu protokolün fizibilitesini gösterdik. İn vitro kök hücrelerin genişletilmesi nde uygun değişiklikler ile, bu kemoproteomic yaklaşım diğer kök hücre türlerinin yüzey belirteçleri belirlenmesi ile uyumlu olabilir. Bu Ac4ManNAz per-O-acetylated olarak yapay S-glikozilasyona yol açabilir dikkat çekicidir. Anormal olmayan doğal olmayan şekerlerin kullanımı obje oluşumunu önleyebilir ve canlı hücrelerde metabolik glikan etiketlemenin özgüllüğünü ve geçerliliğini artırabilir19.
Primer kortikal nöral progenitor hücrelerinin ve endotel hücrelerinin hazırlanması protokolün kritik adımlarıdır. İlk olarak, embriyonik kortikal dokular sindirilirken, sindirim süresi, enzim miktarı ve kullanım gücü dikkatle kontrol edilmelidir. Aşırı sindirim ve mekanik kesme kuvvetleri hücre hayatta kalma ve büyüme için sinyal transdüksiyon aracılık plazma membran ve hücre yüzey reseptörlerinin bütünlüğüne zarar verecek ve onlar da uyarılması için NSPCs duyarlılığı rahatsız edecek endotel hücreleri ve kendi kendini yenileme yeteneği. Uygun sindirim elde etmek için, deneyciler papain tam olarak etkinleştirmek ve doku blokları kaybolur en kısa sürede sindirim durdurmak gerekir. İkinci olarak, BEND3 hücreleri salgıyı desteklemek için sağlıklı bir durumda muhafaza edilmelidir. Daha az geçitli BEND3 hücre toplu işlerinin kullanılması ve %100 birleştiğinden önce hücrelerin geçişi önerilir. Bu hücre döngüsü arrest ve yaşlanma sırasında geçen veya hücreler arasında aşırı kalabalık temas birikmiş DNA hasarı nedeniyle yaşlanmayı önleyecektir.
Yüksek iş elde etme teknolojisi, özellikle proteom analizi yapamayacak kadar küçük miktarlarda in vivo olarak bulunan doku kök hücreleri de dahil olmak üzere hücre tipleri için RNA ekspresyonunu analiz ederek hücre yüzeyi belirteçlerinin tanımlanmasını artırır. kütle spektrometresi. RNA-seq analizi özellikle NSPCs ifade genleri tanımlayabilirsiniz rağmen, gerçekten protein ekspresyonu düzeylerini yansıtmayabilir, RNA ekspresyonu her zaman protein ekspresyonu ile tutarlı değildir çünkü20. Buna ek olarak, yüzey belirteçleri olarak çalışabilen protein dışı biyomoleküller transkripsiyonel çalışmalarla tespit edilemezler. Örneğin, oligosakkarit Lewis X yaygın insan embriyonik kök hücreleri ve NSPCs etiketlemek için kullanılan tanınmış bir yüzey üreticisi, birden fazla protein ile ilişkili olsa bile21. Bu nedenle, doğrudan kütle spektrometresi analizi henüz ikame değildir ve kütle spektrometresi analizini daha uygulanabilir ve uygun hale getirebilecek yöntemlerin geliştirilmesi gelecekteki çalışmalar için büyük ilgi çekicidir.
Sialylation ek olarak, post-translational protein modifikasyonları diğer türleri değiştirilmiş proteinlerin fonksiyonlarının düzenlenmesinde önemli bir rol oynamaktadır. Bu modifikasyonlar konformasyon, yarılanma ömrü ve hücre altı lokalizasyonu22,23gibi protein özelliklerini etkiler. Çeşitli protein modifikasyonları hücre tipi özgüllüğüvar 24,25,26. Kimyasal araç kutusunun büyüyen içeriği ile, daha fazla modifikasyon türleri kimyasal muhabirleri ile metabolik etiketleme için uygun27. Bu nedenle, burada açıklanan kimyasal yaklaşım kök hücreler ve farklılaşmış hücreler arasındaki protein modifikasyonu diğer farklılıkları incelemek için kullanılabilir, kök hücre özellikleri ve farklılaşma bakımı arkasındaki moleküler mekanizmaları gösteren Düzenleme.
Açıklamalar
Yazarların ifşa atacak bir şeyi yok.
Teşekkürler
Şekil 1B, 1C, 1E ve 1F Bai'den üretilir ve ark . 10.000 Kraliyet Kimya Derneği'nin izniyle. X.C.'nin laboratuvarındaki Yi Hao'ya figür düzenlemesi için teşekkür ederiz. Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (No. 91753206 Q. S. ve X. C., No. 31371093 Q. S. ve No. 21425204 ve 21672013 x. C.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BEND3 | ATCC | CRL-229 | |
| DMEM | Gibco | 11960044 | |
| L-glutamine | Gibco | 25030081 | 1% |
| Sodium pyruvate | Sigma | P5280 | 1% |
| N2 supplement | Gibco | 17502048 | 1 to 100 |
| N-acetyl-L-cysteine | Sigma | A7250 | 1 mM |
| Papain | Worthington | LS003726 | 10 U/mL |
| B27 supplement | Gibco | 17504044 | 1 to 50 |
| Poly-L-lysine | Sigma | P4707 | |
| Basic Fibroblast growth factor | Gibco | PHG0261 | 10 ng/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 1% |
| Fetal bovine serum | Gibco | 10099141 | 10% |
| HBSS | Gibco | 14175095 | |
| Tripsin-EDTA, 0.25% | Gibco | 25200056 | |
| DPBS | Gibco | 14190094 | |
| Transwell | Corning | 3450 | |
| Paraformaldehyde | Sigma | 158127 | 4% |
| Sucrose | Sangon | A100335 | |
| DAPI | Gibco | 62248 | |
| RIPA buffer | Thermo Scientific | 89900 | |
| SDS-PAGE loading buffer 2x | Solarbio | P1018 | |
| 6-well plate | Corning | 3335 | |
| Tris-Glycine protein gel | invitrogen | xp00100box | |
| Mouse monoclonal anti-Nestin | Developmental Study Hybridoma Bank | Rat-401 | 1 to 20 |
| Mouse monoclonal anti-beta-tubulin III | Sigma | T8860 | 1 to 1,000 |
| Alexa Fluor 488 goat anti-mouse IgG1 | invitrogen | A-21121 | 1 to 1,000 |
| Alexa Fluor 546 goat anti-mouse IgG2b | invitrogen | A-21143 | 1 to 1,000 |
| Albumin Bovine V | Amresco | 0332 | |
| Triton X-100 | Amresco | 0694 | |
| BCA assay kit | Thermo Scientific | 23225 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Brij97 | Aladdin | B129088 | |
| CuSO4 | Sigma | 209198 | |
| Alkyne-biotin | Click Chemistry Tools | TA105 | |
| BTTAA | Click Chemistry Tools | 1236 | |
| Ac4ManNAz | Click Chemistry Tools | 1084 | 100 µM |
| 9AzSia | synthesized in lab | ||
| Sodium ascorbate | Sigma | A4034 | |
| Methanol | Sigma | 34860 | |
| EDTA | Sangon | A100322 | |
| NaCl | Sangon | A100241 | |
| SDS | Sangon | A100227 | |
| Alexa Flour 647-conjugated streptavidin | invitrogen | S21374 | 1 to 1,000 |
| Triethanolamine | Sigma | V900257 | |
| Dynabeads M-280 Streptavidin | invitrogen | 60210 | |
| Ammonium bicarbonate | Sigma | 9830 | |
| Coomassie Brilliant Blue R-250 | Thermo Scientific | 20278 | |
| Isoflurane | RWD Life Science Co. | 970-00026-00 | |
| DNase I | Sigma | DN25 | 12 µg/mL |
| Urea | Sigma | U5378 |
Referanslar
- Weissman, I. L. Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution. Cell. 100, 157-168 (2000).
- Gage, F. H., Temple, S. Neural Stem Cells: Generating and Regenerating the Brain. Neuron. 80, 588-601 (2013).
- Gal, J. S. Molecular and Morphological Heterogeneity of Neural Precursors in the Mouse Neocortical Proliferative Zones. Journal of Neuroscience. 26, 1045-1056 (2006).
- Kawaguchi, A., et al. Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis. Development. 135, 3113-3124 (2008).
- Temple, S. The development of neural stem cells. Nature. 414, 112-117 (2001).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139, 1535-1546 (2012).
- Kriegstein, A., Alvarez-Buylla, A. The Glial Nature of Embryonic and Adult Neural Stem Cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Wang, X., Tsai, J. W., LaMonica, B., Kriegstein, A. R. A new subtype of progenitor cell in the mouse embryonic neocortex. Nature Neuroscience. 14, 555-561 (2011).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Bai, Q. R., Dong, L., Hao, Y., Chen, X., Shen, Q. Metabolic glycan labeling-assisted discovery of cell-surface markers for primary neural stem and progenitor cells. Chemical Communications. 54, 5486-5489 (2018).
- Shen, Q., et al. Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science. 304, 1338-1340 (2004).
- Qian, X., et al. Timing of CNS cell generation: a programmed sequence of neuron and glial cell production from isolated murine cortical stem cells. Neuron. 28, 69-80 (2000).
- Varki, A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins. Nature. 446, 1023-1029 (2007).
- Cheng, B., Xie, R., Dong, L., Chen, X. Metabolic Remodeling of Cell-Surface Sialic Acids: Principles, Applications, and Recent Advances. ChemBioChem. 17, 11-27 (2016).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Schmidt, J. R., et al. Pilot Study on Mass Spectrometry-Based Analysis of the Proteome of CD34+CD123+ Progenitor Cells for the Identification of Potential Targets for Immunotherapy in Acute Myeloid Leukemia. Proteomes. 6, (2018).
- Crisan, M., Dzierzak, E. The many faces of hematopoietic stem cell heterogeneity Development. Development. 144, 4195-4195 (2017).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proceedings of the National Academy of Sciences of the United States of America. 97, 14720-14725 (2000).
- Qin, W., et al. Artificial Cysteine S-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angewandte Chemie International Edition. , (2018).
- Gry, M., et al. Correlations between RNA and protein expression profiles in 23 human cell lines. BMC Genomics. 10, 365(2009).
- Hennen, E., et al. A LewisX Glycoprotein Screen Identifies the Low Density Lipoprotein Receptor-related Protein 1 (LRP1) as a Modulator of Oligodendrogenesis in Mice. Journal of Biological Chemistry. 288, 16538-16545 (2013).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7, 473-483 (2006).
- O’Brian, C. A., Chu, F. ReviewPost-translational disulfide modifications in cell signaling—role of inter-protein, intra-protein, S-glutathionyl, and S-cysteaminyl disulfide modifications in signal transmission. Free Radical Research. 39, 471-480 (2005).
- Williamson, A. J. K., Whetton, A. D. The requirement for proteomics to unravel stem cell regulatory mechanisms. Journal of Cellular Physiology. 226, 2478-2483 (2011).
- Christensen, B., et al. Cell Type-specific Post-translational Modifications of Mouse Osteopontin Are Associated with Different Adhesive Properties. Journal of Biological Chemistry. 282, 19463-19472 (2007).
- Yanagisawa, M., Yu, R. K. The expression and functions of glycoconjugates in neural stem cells. Glycobiology. 17, 57R-74R (2007).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır