Method Article
通过Sialoglycan的代谢标记识别主要神经干细胞和祖细胞的细胞表面标记
* 这些作者具有相同的贡献
摘要
这里介绍的是一个协议,结合了体外神经内皮共培养系统和代谢结合的异形理念功能组,以扩大主神经干和祖细胞,并标记其表面用于细胞表面标记的成像或质谱分析的紫锥蛋白。
摘要
神经干细胞和祖细胞(NSPCs)是大脑复杂结构和功能的细胞基础。它们位于体内的专门利基,可以在体外分离和扩展,作为细胞移植修复脑损伤的重要资源。然而,NSPCs是异构的,在分子水平上没有明确定义或由于缺乏特定的细胞表面标记而纯化。先前报道的该协议将神经内皮共培养系统与代谢甘油标记方法相结合,以识别初级NSPCs的表面脂质蛋白酶。NSPC-内皮共培养系统允许在体外自我更新和扩展初级NSPCs,产生足够数量的NSPCs。 培养的NSPC中的Sialoglycan使用非天然的亚西酸代谢报告器进行标记生物正交功能组。通过比较自更新的NSPC中的异二蛋白酶,在内皮共培养中扩展,具有不同的神经培养,我们确定了在NSPCs中丰富的膜蛋白列表。协议详细涉及:1)NSPC内生共文化与NSPC区分文化;2) 标记与阿齐多糖每O-乙酰化N-乙酰氨基苯甲胺(Ac4曼纳兹);3)生物锡结合到改性双发胶,用于在神经培养固定后进行成像,或从神经培养中提取蛋白质进行质谱分析。然后,通过对扩展NSPC和分化神经培养的质谱数据的比较分析,选取了NSPC富集表面标记候选物。该协议对识别起始材料中低丰度膜蛋白具有高度敏感性,可应用于其他系统具有适当修改的标记发现
引言
神经干细胞被定义为一个多能细胞群,可以自我更新,以维持干细胞库,分化成神经元和胶质。它们是神经系统中的主要细胞类型,通过细胞移植到病变和受伤的大脑1,2,在再生医学中可能提供巨大的治疗潜力。随着发育的进行,神经干细胞群成为异质的3、4,神经干细胞在大脑中的比例逐渐下降5。一般来说,胚胎神经干细胞和其他神经祖细胞,统称为神经干细胞和祖细胞(NSPCs),位于小鼠6的生殖区、心室区和下室区。在胚胎大脑中,神经干细胞通过中间祖细胞(IPC)直接或间接地产生神经元,在某些物种中,通过外部潜区祖体(oRGs)7、8产生神经元。特定的分子特征、形态、干细胞利基的位置和分化潜力都决定了每个亚型在脑器官生成和临床应用中的作用9。然而,目前可用的细胞表面标记不能明确区分和纯化NSPCs的不同亚型,从而限制了对这些亚型的理解和利用。
主要NSPCs表面标记的识别受到三个主要障碍的限制。第一个是组织中NSPCs的细胞数量有限,因此很难制备细胞表面蛋白样本进行常见的质谱分析。第二个限制是难以生成纯细胞亚型,以生成亚型特异性膜蛋白数据。最后,第三个挑战是细胞表面蛋白在全细胞蛋白中的比例低,这妨碍了通过质谱分析的检测灵敏度。
为了克服这些问题,我们开发了一种化学蛋白质组的方法,通过代谢标记的西洛基蛋白质10来选择性地丰富和识别初级NSPC中的细胞表面蛋白。为了产生足够数量的NSPC,我们利用已建立的协议在体外扩大和维护未分化状态的初级胚胎NSPCs,使用可渗透支持与小鼠大脑内皮细胞系共同培养NSPC矩阵插入(例如,透井)系统11。相反,没有内皮细胞单独培养的核动力源产生分化的后代11,12。因此,可以相对分析来自这两个培养系统的蛋白质样本,以识别在NSPCs和分化神经元中不同表达的蛋白质。由于大多数细胞表面蛋白被硅酸13修饰,非天然的硅酸前体模拟N-azido乙酰氨基胺四合化(Ac4ManNAz)被用来劫持内在代谢途径,以便内源性,新的合成的硅石糖被标记为阿齐多组,产生化学手柄14。通过阿齐多-烷基介导的生物正交反应,将生物素与硅脂酶结合,细胞表面蛋白可以通过链球蛋白耦合荧光素或基质14进行可视化和富集,用于蛋白质组鉴定。
在这里,我们执行SDS-PAGE凝胶染色分析表面链胶蛋白酶从NSPC扩展在内皮共培养和区分细胞在非共培养系统中。我们还有选择地在两个培养系统中纯化表面的同步蛋白酶,以便进行蛋白组比较。与传统的离心基细胞表面纯化方案15相比,我们的方案通过特定的标记结合和亲和力减少表面蛋白提取程序,从而提高了提取效率净化。同时,在细胞表面蛋白主要发生细胞表面蛋白的前提下,提高了细胞表面蛋白的提取纯度。虽然内皮因子不能完全阻止扩大的NSPC的分化,但共同培养和分化培养之间的比较研究提供了一种方便的方法来精确定位干细胞富集的表面蛋白,而无需分析由FACS16纯化的NPC蛋白质。我们相信这种方法可以应用于研究其他系统的表面蛋白与适当的修改。
研究方案
本研究中使用的所有动物规程均经清华大学IACUC(机构动物护理和使用委员会)批准,并按照IACUC的准则执行。清华大学实验室动物设施已获得AAALAC(国际实验室动物护理评估与认证协会)的认可。对于胚胎的分期,鉴定的阴道塞的中天被计算为胚胎日0.5(E0.5)。
注:所有细胞在37°C和5%CO2条件下在细胞培养箱中培养。
1. 在渗透支持插件中制备小鼠内皮培养物
注:BEND3 电池根据制造商的说明进行维护。
- 通过在500 mL的DMEM中加入50mL的FBS和5mL的青霉素-链霉素,制备BEND3细胞培养基(BM),并混合均匀。
- 从培养皿中吸出培养基,用1mL的PBS洗涤BEND3细胞培养。在细胞中加入1 mL的0.25%胰蛋白酶-EDTA,并在37°C下孵育细胞4分钟。
- 在细胞中加入1 mL的BM,以中和胰蛋白酶-EDTA,并轻轻上下移液,使细胞完全分离。将细胞悬浮液转移到新的15 mL锥形管中,并在室温(RT)下离心5分钟,400 x g。
- 从管中吸出上清液,用9 mL的新鲜BM重新悬浮细胞,然后将1mL的细胞悬浮液加入一个可渗透的支撑插件中。在矩阵的底部腔室每口井再添加 2 mL 的新鲜 BM。继续培养单元格一天。
2. 准备小鼠主皮质 NSPC 培养
-
培养板、木瓜消化培养基和皮质粘附培养基(AM)的制备
- 将每孔 1 mL 的 PLL 溶液加入 6 孔板,将 6 孔板与聚L-莱辛 (PLL) 涂覆。然后,在RT孵育板30分钟。
- 将 PLL 溶液转移到 15 mL 锥形管中。用双蒸馏水洗板3次。将盘子晾干,放在一边,直到使用。
- 通过在5mL的DMEM中加入50U的木瓜素、50μL的L-谷氨酰和50μL的100mg/mL乙酰-L-半胱氨酸,制备木瓜蛋白消化培养基。将培养基短暂混合,将其加热至37°C,30分钟,用于酶活化。
- 制备皮质细胞附着培养基(AM):加入500μL的L-谷氨酰胺、500μL的丙酸钠、500μL的100mg/mL N-乙酰L-半胱氨酸、500 μL的N2、1mL的B27和5μL的100μg/mL bFGF到50mM的DMEM中。在使用前将介质混合好,将其加热至 37°C。
-
原发性脑皮质细胞的制备和随后的电镀
- 因宫颈错位而牺牲E10.5时间怀孕小鼠。
注:在E10.5,大多数细胞在大脑皮层中增殖NSPC,产生体外后代的大克隆。 - 用75%乙醇消毒腹部。使用精细剪刀和微锯齿钳沿中间线的右侧切割皮肤和基础肌肉,以打开腹部。用锯齿状钳子轻轻地将子宫从腹腔中取出,用细剪刀将其从腹腔中切出。
- 在10厘米培养皿中用40 mL的预冷冻HBSS清洗子宫。然后,将子宫转移到一个新的10厘米培养皿中,然后用40 mL的预冷冻HBSS再次洗涤。
- 将子宫转移到一个新的10厘米培养皿与40mL的预冷冻HBSS。从子宫和羊膜中取出胚胎,然后用珠宝微钳将胚胎的头部从躯干上切下。
- 用 40 mL 的预冷冻 HBSS 清洗头部,并将头转移到带有 40 mL 预冷冻 HBSS 的新 10 厘米培养皿中。使用珠宝商微钳剥离覆盖大脑的皮肤和软骨,然后切断脑皮,并收集他们在15 mL锥形管与预冷却的HBSS。
- 在4°C和300 x g下,通过离心将皮质颗粒3分钟。从管中吸出上清液,然后将活性木瓜蛋白消化培养基和15μL的4mg/mL DNase I加入组织颗粒中。
- 通过温和的涡旋短暂地重新悬浮组织颗粒。在37°C下孵育组织30分钟。在此期间,每10分钟短暂涡旋,松开组织。
注:在消化结束时,管子中不应有可见的组织片。 - 在4°C和450 x g下,通过离心将皮质细胞进行10分钟的细胞。从管中吸出上清液,用预冷却的DMEM清洗细胞颗粒。重复此步骤一次。
注:在消化和洗涤过程中,注意不要粗略移移组织和细胞颗粒,以避免用强大的剪切力破坏细胞。 - 从管中吸出上清液,然后将1.5 mL的预冷却HBSS加入管中。用温和的移液将皮质细胞颗粒分离成单个细胞。使用血细胞计计算细胞数。
- 将 2 mL 的 AM 和 2 x 104皮质细胞每孔加入 6 孔板中。在37°C和5%CO2孵育板3小时,让细胞附着在板上。
- 因宫颈错位而牺牲E10.5时间怀孕小鼠。
3. 神经内皮共培养和Ac4ManNAz标签系统的设置
- 在插入物中电镀 BEND3 电池一天后,先轻轻吸进底部腔室中的介质,然后插入。使用预加热的 DMEM 清洗刀片的外带 3 次。使用预加热的 DMEM 冲洗刀片的外表面。
- 将 1 mL 的预加热 AM 加入一个插入件中,然后将插入物转移到具有主皮质细胞的井中。在37°C和5%CO2下孵育共培养12小时。
- 在 DMSO 中溶解 Ac4ManNAz,达到 200 mM 的库存浓度。设置神经内皮共培养后12小时,每底部腔室添加1μL的Ac4ManNAz股票,每插入至共培养物中加入0.5μL的库存。立即摇动板并轻轻混合介质。对于控制单元,添加相等的 DMSO 体积。
- 在37°C和5%CO2下再培养细胞5天。将 AM 与 10x bFGF 作为再进给介质 (RM) 进行准备。在此期间,每插入100μL的RM和每底部腔室200μL的RM,每隔一天重新喂食内皮和神经细胞。在重新喂食期间,请勿向培养区提供 Ac4ManNAz 或 DMSO。
4. 扩大原发性NSPC和分化神经元中亚洛木蛋白的免疫荧光染色
- 在双蒸馏水中制备 BTTA-CuSO4复合 1 30x 库存,含有 1.5 mM CuSO4和 9 mM BTTAA。在PBS中制备含有50μM生物素-烷基、2.5 mM抗坏血酸钠和1xBTTAA-CuSO4复合物的新鲜生物素结合缓冲液1。
- 从共培养板上拆下刀片。从底部井中吸出培养基,用预加热的PBS清洗神经细胞一次。
- 从井中吸出PBS。将每口井中预冷冻的4%甲醛PBS溶液加入1mL,在RT处固定10分钟。然后,用预冷冻的PBS清洗细胞3次。
- 从井中吸出PBS,将1mL新鲜制备的生物锡结合缓冲液每孔1分加入细胞。在RT孵育细胞10分钟。
- 从井中吸出反应缓冲液。用PBS清洗细胞3次。准备含有1%FBS和1μg/mL Alexa氟647-链球菌素的染色缓冲液。将每口井的染色缓冲液加入1 mL,并在RT下孵育细胞30分钟。
- 用预冷的PBS从井中吸出染色缓冲液和洗涤细胞3次。在PBS中制备含有5%BSA和0.3%非离子洗涤剂-100的阻断缓冲液。将每口井的1 mL阻塞缓冲液加入细胞,并在RT孵育10分钟。
- 将反nestin和β-tubulin III抗体分别稀释到阻断缓冲液中,其比率分别为1:20和1:1,000,制备初级抗体溶液。从井中取出阻塞缓冲液,并将每口井的1 mL原抗体溶液加入细胞。在4°C孵育细胞过夜。
- 从井中取出原抗体溶液。用预冷冻的PBS清洗细胞3次。通过稀释 Alexa Fluor 488 山羊抗小鼠 IgG1、Alexa Fluor 546 山羊抗小鼠 IgG2b 和 DAPI 一起以 1:1,000 的稀释作用,将辅助抗体溶液制备成阻塞缓冲液。从井中吸出PBS,并将每口井中加入1 mL二级抗体溶液。在RT下孵育细胞2小时。
- 从井中吸出抗体溶液,用预冷却的PBS清洗细胞3次。之后,单元格已准备好进行图像捕获。
5. 从扩大的初级NSPC和分化神经元中纯化的西洛克淋球蛋白
- 在双蒸馏水中制备 BTTA-CuSO4复合 2 15x 库存,含有 1.5 mM CuSO4和 3 mM BTTAA。在双蒸馏水中制备含有4%SDS和10 mM EDTA的蛋白质再悬浮缓冲液A;含有150 mM NaCl、50 mM三乙醇胺和1%聚乙烯油性乙醚(如Brij97)的双蒸馏水中含有pH7.4的蛋白质再悬浮缓冲液B。使用前,混合缓冲液A:缓冲液B= 1:8(vol/vol)以制备完整的蛋白质再悬浮缓冲液。在PBS中制备含有2%SDS的蛋白质洗涤缓冲液1;250 mM碳酸氢铵(ABC)中含有8M尿素的蛋白质洗涤缓冲液2;和蛋白质洗涤缓冲液3含有2.5M NaCl在PBS。
- 从共培养板上拆下刀片。从底部井中吸出培养基,用预冷却的PBS清洗神经细胞一次。
- 从孔中吸出PBS,并将每孔200μL的预冷却RIPA缓冲液加入板中。在冰上孵育板5分钟,将蛋白质解液收集到1.5 mL管中。在4°C和12,000 x g下离心,将细胞碎片离心10分钟。
- 将上清液转移到新的 1.5 mL 管中。根据制造商的说明,使用 BCA 试剂盒确定蛋白质浓度。将蛋白质浓度调整至1mg/mL。
- 加入100μM烷基-生物素、2.5 mM抗坏血酸钠和1xBTTAA-CuSO4复合2至1mL的蛋白质解液,并混合好溶液。在 RT 孵育混合物 1 小时。
- 将反应溶液转移到50 mL锥形管中20 mL的预冷冻甲醇中。混合良好,在-30°C孵育过夜,以沉淀蛋白质。
- 在4°C和4,500 x g下,通过离心沉淀15分钟沉淀蛋白质。用20 mL的预冷冻甲醇清洗蛋白质颗粒两次。从管子中吸出上清液。用4 mL的蛋白质再悬浮缓冲液重新悬浮蛋白质颗粒,并将蛋白质再悬浮转移到新的15 mL锥形管中。
- 取50μL的链球菌珠,用PBS洗涤3次。将洗涤过的珠子加入蛋白质再悬浮。以 20 rpm 的转速在 4°C 下在垂直旋转器上孵育溶液 3 小时。
- 用6种缓冲液依次清洗珠子:蛋白质洗涤缓冲液1、蛋白质洗涤缓冲液2、蛋白质洗涤缓冲液3、0.5M ABC、0.25M ABC和0.05 M ABC。
- 洗涤后,用 20 μL 的 PBS 重新悬浮珠子,并将珠子转移到新的 1.5 mL 管中。将20μL的2倍蛋白质加载缓冲液加入珠子中,在95°C下治疗10分钟。然后,蛋白质样品应接受SDS-PAGE,并根据制造商的说明,用库马西亮蓝色R-250染色。切割凝胶中的蛋白质,如库马西亮蓝色R-250所示,用于质谱分析。
结果
原发性胚胎NSPC的体外扩张和代谢标记整个过程需要6天(图1A)。BEND3细胞系和新鲜分离的初级NSPCs的质量是成功实验的关键。BEND3细胞是可溶性因子的来源,可溶性因子刺激NSPCs的自我更新和增殖。在与神经细胞共同培养之前,应确保BEND3细胞没有任何污染,并且以最小的细胞死亡积极分裂。主 NSPC 必须仔细准备,以避免在分离过程中造成过度损坏。受损的国家自保方案仍可能增长和分化;然而,他们不能很好地对内皮刺激作出反应,以保持茎和扩张。在细胞培养过程中,应格外小心无菌,因为协议并不建议在主要培养基中添加抗生素。
成功的内皮共培养将导致NSPC形成大型的、类似纸张的克隆。这种特征克隆形状在第 4 天变得明显,在第 6 天非常典型。在克隆中,细胞彼此保持密切接触。用抗体对NSPC标记Nestin和神经元标记β-图布林III进行免疫染色应表明,在克隆中,大多数细胞是Nestin+ NSPCs,很少是β-图布林III+神经元细胞。相比之下,在非共培养系统中形成的克隆中形成的Nestin®细胞和β-图布林III+神经元细胞的百分比几乎相同(图1B、1D和1E)。
化学报告器,Ac4ManNAz,是一种代谢模拟,可以纳入内在蛋白质的发化途径。高剂量的Ac4ManNAz对细胞有毒。对于每种特定类型的细胞,应预先测试 Ac4ManNAz 的标签浓度,以实现最高的标记效率,而不会造成明显的细胞毒性。在这里,原发NSPCAc4ManNAz的优化标记浓度为100μM。 细胞和核形态表明的细胞死亡组合评价表明,这种标记浓度不会引起明显的细胞毒性作用,并且能够有效地标记 NSPC (图 1C和1D)。内皮共培养和非共体系统中NSPC的克隆形态、自我更新和分化潜力不受影响(图1C、1D和1E)。
Ac4ManNAz 成功标记 NSPC 后,可结合生物子蛋白与由阿齐德和烷基苯之间的生物正交反应介导的培养体。Ac4ManNAz 标记培养物中的每个细胞都使用 Alexa Fluor 647-链球菌素进行染色和可视化。在 DMSO 对照组中,没有细胞对 Alexa Fluor 647-链球菌染色呈阳性反应。此外,通过生物蛋白结合和链球蛋白珠子纯化从Ac4ManNAz标记培养物制备的蛋白质样本在SDS-PAGE凝胶中显示出强烈的Coomassie明亮的蓝色染色信号。同时,在装有DMSO对照组蛋白质样本的通道中,只有染色背景和非特异性结合信号。这也表明 Ac4ManNAz 对 NSPC 进行有效标记(图 1F)。
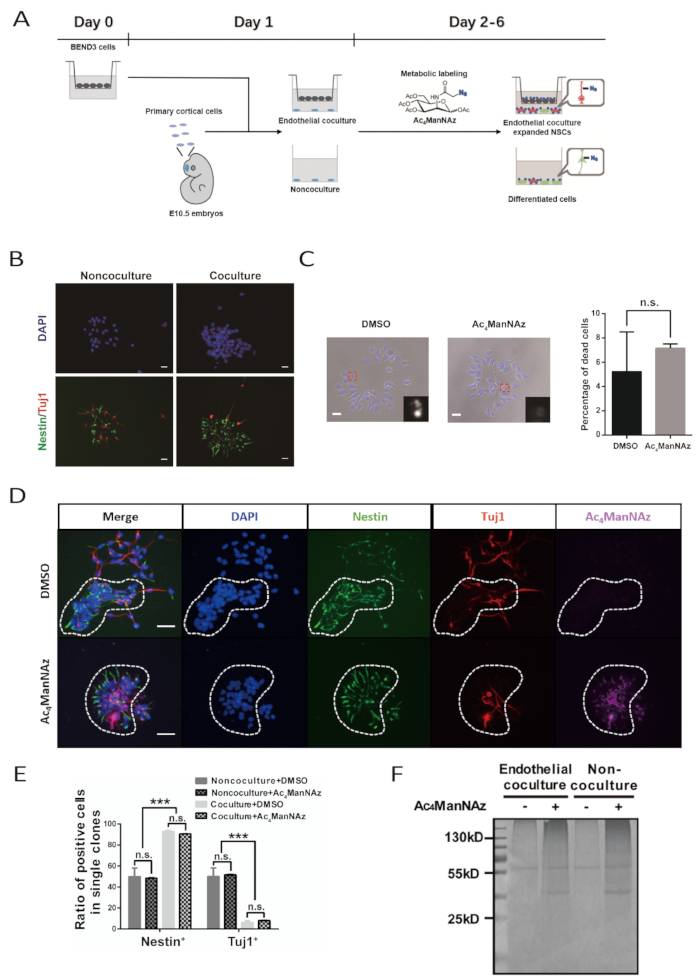
图 1:通过内皮共培养系统和代谢性双发性脂蛋白标记辅助的初级NSPCs细胞表面标记的识别。(A) 协议工作流的架构。这个数字已由白等人修改。10.BEND3细胞被播种到D0上的基质插入中。在D1上进行了初级皮质NSPC的制备和共培养系统的建立。培养的代谢标记从 D2 持续到 D6。在 D3 和 D5 上进行培养重新喂养。(B) 在有或没有内皮细胞的5天培养后,由原发性NSPCs形成的克隆的免疫荧光图像。比例条表示使用 Ac4ManNAz 或 DMSO 在 5 天培养后由主 NSPC 形成的克隆的 20 μm.(C) 亮场图像。核被DAPI反染。刻度条指示 20 μm。错误栏指示 SEM(n.s. = 不显著)。(D) NSPC的免疫荧光图像在与Ac4ManNAz或DMSO的内皮共培养中形成克隆。虚线圆表示单个神经克隆。刻度条表示在内皮共培养和非共培养系统中通过Ac4ManNAz标记或DMSO控制的克隆中,NSPCs和分化神经元的50 μm.(E)定量。错误条指示 SEM(\p < 0.0005;n.s. = 不显著)。(F) 在内皮共培养和非共培养系统中,从神经细胞中标有Ac4ManNAz或DMSO的神经细胞中,用链球蛋白珠子纯化蛋白质的粘液蓝色染色。对照标签组中的55 kD带代表非特异性结合蛋白。与本议定书对应的(B、C、E和F)已由Bai等人改编。10.请点击此处查看此图的较大版本。
讨论
表面标记通常用于标记和纯化体外和体内的特定细胞类型17、18。表面标记物的发现为再生医学和干细胞研究做出了巨大贡献,它提供了分子工具,从正常或病理组织和培养皿中选择性地丰富干细胞群,提供纯化细胞用于临床或研究生物特性的资源。然而,由于难以将干细胞与原发性组织分离,神经干细胞研究的表面标记物开发进展缓慢。此处描述的协议基于简化的体外平台。通过将内皮共培养的初级NSPC与不同的神经培养进行比较,在扩大的NSPCs中不同表达的蛋白质被突出显示,并允许进一步识别。我们的方案还提供了一个替代策略来纯化细胞表面蛋白,通过劫持内在代谢途径来标记与生物正交组分离。与纯化细胞表面蛋白的传统方案相比,该协议的优点有两个具体特征:1) 细胞表面蛋白上的同步化的流行确保了细胞表面蛋白体的最大覆盖范围,2) 生物正交组与其配体之间的反应特异性使获得表面蛋白酶的纯度。因此,我们的协议在起始材料较少的情况下进行更敏感的蛋白组分析。我们已经证明了该协议在主要NSPC表面标记中的可行性。通过对体外扩张干细胞进行适当修改,这种化学蛋白酶学方法可以与其他干细胞类型的表面标记物兼容。值得注意的是,由于Ac4ManNAz是每O-乙酰化,它可能导致人工S-糖基化。使用非乙酰化非天然糖可以避免伪影的形成,提高活细胞中代谢甘油标签的特异性和有效性。
制备原发性神经祖细胞和内皮细胞是该协议的关键步骤。首先,在消化胚胎皮质组织时,必须仔细控制消化时间、酶量和处理强度。过度的消化和机械剪切力会损害血浆膜和细胞表面受体的完整性,这些受体会调节信号转导,促进细胞生存和生长,并且还会干扰NSPCs对刺激的响应能力。内皮细胞及其自我更新能力。为了达到适当的消化,实验者必须完全激活木瓜,并在组织块消失后立即停止消化。其次,BEND3细胞必须保持健康状态,以支持分泌。建议使用具有较少通道的BEND3细胞批次,并在细胞达到100%汇合之前通过它们。这将防止细胞周期抑制和由通过过程中积累的DNA损伤或细胞之间过度接触造成的衰老。
高通量测序技术通过分析RNA表达来促进细胞表面标记的识别,特别是对于包括组织干细胞在内的细胞类型,这些细胞在体内通常存在的数量太小,无法通过质谱。即使RNA-seq分析可以识别在NSPCs中具体表达的基因,它可能不会真正反映蛋白质表达水平,因为RNA表达并不总是与蛋白质表达20一致。此外,非蛋白质生物分子可以作为表面标记物,不能通过转录组研究来检测。例如,寡糖Lewis X是一个著名的表面制造商,广泛用于标记人类胚胎干细胞和NSPCs,即使它可能与多种蛋白质21相关。因此,直接质谱分析尚不能成用,开发使质谱分析更加可行、更方便的方法,对于今后的研究具有十分重要的意义。
除了异化外,其他类型的翻译后蛋白质修饰在调节修饰性蛋白质的功能方面起着重要作用。这些修饰影响蛋白质特性,如构象、半寿命和亚细胞定位22,23。几种蛋白质修饰有细胞类型特异性24,25,26。随着化学工具箱内容的不断增加,更多的修饰类型与化学记者的代谢标签。因此,本文描述的化学方法可用于研究干细胞和分化细胞之间蛋白质修饰的其他差异,从而说明维持干细胞特性和分化背后的分子机制调节。
披露声明
作者没有什么可透露的。
致谢
图 1B、1C、1E 和 1F 从白等.10得到英国皇家化学学会的许可。我们感谢X.C.实验室的易浩进行人物编辑。这项工作得到中国国家自然科学基金(第91753206至Q.S.和X.C.,第31371093至Q.S.和21425204和21672013至X.C.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| BEND3 | ATCC | CRL-229 | |
| DMEM | Gibco | 11960044 | |
| L-glutamine | Gibco | 25030081 | 1% |
| Sodium pyruvate | Sigma | P5280 | 1% |
| N2 supplement | Gibco | 17502048 | 1 to 100 |
| N-acetyl-L-cysteine | Sigma | A7250 | 1 mM |
| Papain | Worthington | LS003726 | 10 U/mL |
| B27 supplement | Gibco | 17504044 | 1 to 50 |
| Poly-L-lysine | Sigma | P4707 | |
| Basic Fibroblast growth factor | Gibco | PHG0261 | 10 ng/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 1% |
| Fetal bovine serum | Gibco | 10099141 | 10% |
| HBSS | Gibco | 14175095 | |
| Tripsin-EDTA, 0.25% | Gibco | 25200056 | |
| DPBS | Gibco | 14190094 | |
| Transwell | Corning | 3450 | |
| Paraformaldehyde | Sigma | 158127 | 4% |
| Sucrose | Sangon | A100335 | |
| DAPI | Gibco | 62248 | |
| RIPA buffer | Thermo Scientific | 89900 | |
| SDS-PAGE loading buffer 2x | Solarbio | P1018 | |
| 6-well plate | Corning | 3335 | |
| Tris-Glycine protein gel | invitrogen | xp00100box | |
| Mouse monoclonal anti-Nestin | Developmental Study Hybridoma Bank | Rat-401 | 1 to 20 |
| Mouse monoclonal anti-beta-tubulin III | Sigma | T8860 | 1 to 1,000 |
| Alexa Fluor 488 goat anti-mouse IgG1 | invitrogen | A-21121 | 1 to 1,000 |
| Alexa Fluor 546 goat anti-mouse IgG2b | invitrogen | A-21143 | 1 to 1,000 |
| Albumin Bovine V | Amresco | 0332 | |
| Triton X-100 | Amresco | 0694 | |
| BCA assay kit | Thermo Scientific | 23225 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Brij97 | Aladdin | B129088 | |
| CuSO4 | Sigma | 209198 | |
| Alkyne-biotin | Click Chemistry Tools | TA105 | |
| BTTAA | Click Chemistry Tools | 1236 | |
| Ac4ManNAz | Click Chemistry Tools | 1084 | 100 µM |
| 9AzSia | synthesized in lab | ||
| Sodium ascorbate | Sigma | A4034 | |
| Methanol | Sigma | 34860 | |
| EDTA | Sangon | A100322 | |
| NaCl | Sangon | A100241 | |
| SDS | Sangon | A100227 | |
| Alexa Flour 647-conjugated streptavidin | invitrogen | S21374 | 1 to 1,000 |
| Triethanolamine | Sigma | V900257 | |
| Dynabeads M-280 Streptavidin | invitrogen | 60210 | |
| Ammonium bicarbonate | Sigma | 9830 | |
| Coomassie Brilliant Blue R-250 | Thermo Scientific | 20278 | |
| Isoflurane | RWD Life Science Co. | 970-00026-00 | |
| DNase I | Sigma | DN25 | 12 µg/mL |
| Urea | Sigma | U5378 |
参考文献
- Weissman, I. L. Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution. Cell. 100, 157-168 (2000).
- Gage, F. H., Temple, S. Neural Stem Cells: Generating and Regenerating the Brain. Neuron. 80, 588-601 (2013).
- Gal, J. S. Molecular and Morphological Heterogeneity of Neural Precursors in the Mouse Neocortical Proliferative Zones. Journal of Neuroscience. 26, 1045-1056 (2006).
- Kawaguchi, A., et al. Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis. Development. 135, 3113-3124 (2008).
- Temple, S. The development of neural stem cells. Nature. 414, 112-117 (2001).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139, 1535-1546 (2012).
- Kriegstein, A., Alvarez-Buylla, A. The Glial Nature of Embryonic and Adult Neural Stem Cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Wang, X., Tsai, J. W., LaMonica, B., Kriegstein, A. R. A new subtype of progenitor cell in the mouse embryonic neocortex. Nature Neuroscience. 14, 555-561 (2011).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Bai, Q. R., Dong, L., Hao, Y., Chen, X., Shen, Q. Metabolic glycan labeling-assisted discovery of cell-surface markers for primary neural stem and progenitor cells. Chemical Communications. 54, 5486-5489 (2018).
- Shen, Q., et al. Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science. 304, 1338-1340 (2004).
- Qian, X., et al. Timing of CNS cell generation: a programmed sequence of neuron and glial cell production from isolated murine cortical stem cells. Neuron. 28, 69-80 (2000).
- Varki, A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins. Nature. 446, 1023-1029 (2007).
- Cheng, B., Xie, R., Dong, L., Chen, X. Metabolic Remodeling of Cell-Surface Sialic Acids: Principles, Applications, and Recent Advances. ChemBioChem. 17, 11-27 (2016).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Schmidt, J. R., et al. Pilot Study on Mass Spectrometry-Based Analysis of the Proteome of CD34+CD123+ Progenitor Cells for the Identification of Potential Targets for Immunotherapy in Acute Myeloid Leukemia. Proteomes. 6, (2018).
- Crisan, M., Dzierzak, E. The many faces of hematopoietic stem cell heterogeneity Development. Development. 144, 4195-4195 (2017).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proceedings of the National Academy of Sciences of the United States of America. 97, 14720-14725 (2000).
- Qin, W., et al. Artificial Cysteine S-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angewandte Chemie International Edition. , (2018).
- Gry, M., et al. Correlations between RNA and protein expression profiles in 23 human cell lines. BMC Genomics. 10, 365(2009).
- Hennen, E., et al. A LewisX Glycoprotein Screen Identifies the Low Density Lipoprotein Receptor-related Protein 1 (LRP1) as a Modulator of Oligodendrogenesis in Mice. Journal of Biological Chemistry. 288, 16538-16545 (2013).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7, 473-483 (2006).
- O’Brian, C. A., Chu, F. ReviewPost-translational disulfide modifications in cell signaling—role of inter-protein, intra-protein, S-glutathionyl, and S-cysteaminyl disulfide modifications in signal transmission. Free Radical Research. 39, 471-480 (2005).
- Williamson, A. J. K., Whetton, A. D. The requirement for proteomics to unravel stem cell regulatory mechanisms. Journal of Cellular Physiology. 226, 2478-2483 (2011).
- Christensen, B., et al. Cell Type-specific Post-translational Modifications of Mouse Osteopontin Are Associated with Different Adhesive Properties. Journal of Biological Chemistry. 282, 19463-19472 (2007).
- Yanagisawa, M., Yu, R. K. The expression and functions of glycoconjugates in neural stem cells. Glycobiology. 17, 57R-74R (2007).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。