Method Article
Identificando marcadores de superfície celular da haste neural primária e células progenitoras por rotulagem metabólica de Sialoglycan
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui apresentamos um protocolo que combina um sistema de cocultura neural-endotelial in vitro e incorporação metabólica de sialoglicano com grupos funcionais bioortogonais para expandir as células primárias de tronco neural e progenitoras e rotular sua superfície sialoglycoproteínas para a análise da imagem latente ou da massa-espectrometria de marcadores da superfície da pilha.
Resumo
A haste neural e as células progenitoras (NSPCs) são a base celular para as complexas estruturas e funções do cérebro. Eles estão localizados em nichos especializados in vivo e podem ser isolados e expandidos in vitro, servindo como um importante recurso para o transplante de células para reparar danos cerebrais. No entanto, os NSPCs são heterogêneos e não claramente definidos no nível molecular ou purificados devido à falta de marcadores específicos de superfície celular. O protocolo apresentado, que foi relatado previamente, combina um sistema neural-endothelial da cocultura com um método metabólico da rotulagem do glicana para identificar o sialoglycoproteome de superfície de nspcs preliminares. O sistema de cocultura NSPC-endotelial permite a autorenovação e expansão de NSPCs primários in vitro, gerando um número suficiente de nspcs. os Sialoglicanos em nspcs cultivados são rotulados usando um repórter metabólico de ácido siálico não natural com grupos funcionais bioortogonais. Comparando o sialoglycoproteome dos NSPCs Self-renovando expandidos em uma cocultura endothelial com diferenciação da cultura neural, nós identificamos uma lista de proteínas da membrana que são enriquecidas em NSPCs. Em detalhe, o protocolo envolve: 1) set-up de uma cocultura NSPC-endotelial e de uma cultura de diferenciação de NSPC; 2) rotulagem com azidoaçúcar por-O-acetilado N-azidoacetilmannosamina (AC4Mannaz); e 3) conjugação de biotina ao sialoglicíno modificado para imagem após fixação da cultura neural ou extração protéica da cultura neural para análise de espectrometria de massas. Em seguida, os candidatos a marcadores de superfície enriquecidos com NSPC são selecionados por análise comparativa de dados de espectrometria de massas tanto do NSPC expandido quanto de culturas neurais diferenciadas. Este protocolo é altamente sensível para identificar proteínas da membrana da baixa abundância nos materiais de partida, e pode ser aplicado à descoberta do marcador em outros sistemas com modificações apropriadas
Introdução
Células-tronco neurais são definidas como uma população de células multipotentes que podem se autorenovar para manter uma piscina de células-tronco e diferenciar-se em neurônios e glia. Eles são os principais tipos de células no sistema nervoso e podem oferecer grande potencial terapêutico na medicina regenerativa através da transplantação celular em cérebros doentes e feridos1,2. Como o desenvolvimentoprossegue, apopulação de células-tronco neural torna-se heterogênea3,4, ea proporção de células-tronco neurais no cérebro diminui gradualmente5. De modo geral, células-tronco neurais embrionárias e outras células progenitoras neurais, denominadas coletivamente de tronco neural e células progenitoras (nspcs), estão localizadas nas zonas germinais, na zona ventricular e na zona zona em camundongos6. No cérebro embrionário, as células-tronco neurais geram neurônios direta ou indiretamente através de células progenitoras intermediárias (ipcs), e em algumas espécies através dos progenitores da zona zona externa (orgs)7,8. A assinatura molecular específica, a morfologia, a localização no nicho de células-tronco e o potencial de diferenciação determinam o papel de cada subtipo na organogênese cerebral e nas aplicações clínicas9. No entanto, os marcadores de superfície de célula atualmente disponíveis não podem discriminar inequivocamente e purificar diferentes subtipos de NSPCs, limitando a compreensão e a utilização desses subtipos.
A identificação de marcadores de superfície primários de NSPCs é limitada por três grandes obstáculos. O primeiro é o número limitado de células NSPCs no tecido, dificultando a preparação de amostras de proteínas de superfície celular para análise de espectrometria de massas comum. A segunda limitação é a dificuldade na produção de subtipos de células puras para a geração de dados de proteínas de membrana subtipo-específicos. Finalmente, o terceiro desafio é a baixa proporção de proteínas de superfície celular em proteínas de células inteiras, o que dificulta suas sensibilidades de detecção por espectrometria de massas.
Para superar estes problemas, nós desenvolvemos uma aproximação chemoproteomic para enriquecer seletivamente e identificar proteínas de superfície da pilha em nspcs preliminares pela rotulagem metabolicamente as sialoglycoproteínas10. Para gerar um número suficiente de NSPCs, aproveitamos um protocolo estabelecido para expandir e manter NSPCs embrionários primários em Estados indiferenciados in vitro, por coculturando NSPCs com linhas celulares endoteliais cerebrais do camundongo usando um suporte permeável sistema de inserção da matriz (por exemplo, transwell)11. Em contrapartida, as npscs cultivadas isoladamente sem células endoteliais geram Progênese diferenciada11,12. Assim, amostras de proteínas desses dois sistemas de cultura podem ser analisadas comparativamente para identificar proteínas diferencialmente expressas em NSPCs e neurônios diferenciados. Como a maioria das proteínas de superfície celular são modificadas por ácido siálico13, não natural ácido siálico precursor analógico N-azidoacetilmannosamina-tetraacylated (AC4Mannaz) foi usado para seqüestrar a via metabólica intrínseca de modo que endógena, recém- sialoglicanos sintetizados são marcados com grupos azido, gerando um punho químico14. Com as reações do azido-alkyne-negociadas, que conjugar a biotina aos sialoglycans, as proteínas de superfície da pilha podem ser visualizadas e enriquecidas para a identificação proteômica com um fluoróforo streptavidin-acoplado ou uma matriz14.
Aqui, nós realizamos a mancha da análise do gel de SDS-PAGE do sialoglycoproteome de superfície dos NSPCs expandidos em uma cocultura endotelial e em pilhas diferenciando-se em um sistema da não-cocultura. Nós igualmente seletivamente purificar o sialoglycoproteome de superfície nos dois sistemas da cultura para a comparação proteômica. Nosso protocolo, comparado com os protocolos tradicionais da purificação de superfície da pilha da centrifugação-baseada15, aumenta a eficácia da extração reduzindo os procedimentos de extração da proteína de superfície com a conjugação e a afinidade específicas do Tag Purificação. Entretanto, aumenta a pureza da extração de proteínas de superfície da pilha baseadas na premissa que o sialylation acontece na maior parte nas proteínas de superfície da pilha. Embora os fatores endothelial não possam completamente obstruir a diferenciação de NSPCs expandidos, o estudo comparativo entre uma cocultura e uma cultura diferenciada fornece um método conveniente para identificar proteínas de superfície pilha-enriquecidas da haste sem a necessidade de analisar proteínas de NPCs purificadas por FACS16. Acreditamos que essa abordagem pode ser aplicada a estudos de proteínas superficiais em outros sistemas com as modificações apropriadas.
Protocolo
Todos os protocolos animais utilizados neste estudo foram aprovados pelo IACUC (Comitê institucional de cuidados e uso de animais) da Universidade de Tsinghua e realizados de acordo com as diretrizes do IACUC. A instalação de laboratório de animais na Universidade de Tsinghua foi credenciada pela AAALAC (Associação para avaliação e acreditação de laboratório de cuidados com animais internacionais). Para o estadiamento dos embriões, o meio-dia do tampão vaginal identificado foi calculado como dia embrionário 0,5 (E 0,5).
Nota: Todas as células são cultivadas na incubadora de células em condições de 37 ° c e 5% CO2.
1. preparação da cultura endotelial do camundongo em inserções de suporte permeável
Nota: As células BEND3 são mantidas de acordo com as instruções do fabricante.
- Prepare o meio de célula BEND3 (BM) adicionando 50 mL de FBS e 5 mL de penicilina-estreptomicina em 500 mL de DMEM e misture bem.
- Aspirar o meio do prato e lave a cultura das células BEND3 com 1 mL de PBS uma vez. Adicionar 1 mL de 0,25% de Trypsin-EDTA nas células e incubar as células durante 4 min a 37 ° c.
- Adicionar 1 mL de BM nas células para neutralizar Trypsin-EDTA e pipeta para cima e para baixo suavemente para dissociar completamente as células. Transfira a suspensão celular para um novo tubo cônico de 15 mL e pellet por centrifugação à temperatura ambiente (RT) por 5 min a 400 x g.
- Aspirar o sobrenadante do tubo e suspender as células com 9 mL de BM fresco, em seguida, adicione 1 mL de suspensão celular em uma inserção de suporte permeável. Adicione mais 2 mL de BM fresco por poço na câmara inferior da matriz. Continue a cultura das células por um dia.
2. preparação de mouse primário cortical NSPCs cultura
-
Preparação da placa de cultura, meio de digestão de papaína e meio de cultura cortical aderente (AM)
- Cubra 6 placas de poço com poli-L-lisina (PLL) adicionando 1 mL de solução de PLL por poço em placas de 6 poços. Em seguida, incubar as placas em RT por 30 min.
- Transfira a solução PLL para um tubo cônico de 15 mL. Lave as placas 3 vezes com água destilada dupla. Airdry as placas e colocá-los de lado até o uso.
- Prepare o meio de digestão de papaína adicionando 50 U de papaína, 50 μL de L-glutamina e 50 μL de 100 mg/mL de acetil-L-cisteína em 5 mL de DMEM. Misture o meio brevemente e aqueça-o ao ° c 37 por 30 minutos para a ativação da enzima.
- Prepare o meio de cultura aderente da célula cortical (AM): Adicione 500 μL de L-glutamina, 500 μL de piruvato de sódio, 500 μL de 100 mg/mL de N-acetil-L-cisteína, 500 μL de N2, 1 mL de B27 e 5 μL de 100 μg/mL de bFGF em 50 mL de DMEM. Misture bem o meio e aqueça-o a 37 ° c antes de usar.
-
Preparação de células corticais cerebrais primárias e posterior chapeamento
- Sacrifique um rato grávida cronometrado E 10.5 por luxação cervical.
Nota: Na E 10.5, a maioria das células está proliferando NSPCs no córtex cerebral, dando origem a grandes clones de Progênese in vitro. - Esterilizar o abdômen em 75% etanol. Use tesouras finas e fórceps micro-Serrated para abrir o abdômen cortando a pele e o músculo subjacente ao longo do lado direito da linha média. Retire o útero da cavidade abdominal suavemente com pinça serrilhada e cortá-lo a partir da cavidade abdominal com tesouras finas.
- Lave o útero com 40 mL de HBSS pré-refrigerados em um prato de Petri de 10 cm. Em seguida, transfira o útero para um novo prato de Petri de 10 cm e lave-o novamente com 40 mL de HBSS pré-refrigerados.
- Transfira o útero para um novo prato de Petri de 10 cm com 40 mL de HBSS pré-refrigerados. Retire os embriões do útero e da membrana amniótica, em seguida, cortar as cabeças dos embriões fora dos troncos com micropinça Jewelers.
- Lave as cabeças com 40 mL de HBSS pré-refrigerados e transfira as cabeças para um novo prato de Petri de 10 cm com 40 mL de HBSS pré-refrigerados. Use micropinça Jewelers para descascar a pele e cartilagem cobrindo os cérebros, em seguida, cortar os córtices cerebrais fora e coletá-los em um tubo cônico de 15 mL com HBSS pré-refrigerados.
- Pellet os córtices por centrifugação por 3 min a 4 ° c e 300 x g. Aspirar o sobrenadante do tubo, em seguida, adicione o meio de digestão de papaína ativada e 15 μL de 4 mg/mL de DNase I na pelota do tecido.
- Resuspend a pelota do tecido momentaneamente pelo vortexing delicado. Incubar o tecido a 37 ° c durante 30 min. Durante este tempo, afrouxe o tecido pelo vortexing breve cada 10 minutos.
Nota: No final da digestão, não deve haver partes visíveis do tecido no tubo. - Pellet as células corticais por centrifugação por 10 min a 4 ° c e 450 x g. Aspirar o sobrenadante do tubo e lavar o pellet celular com DMEM pré-resfriado. Repita este passo uma vez.
Nota: Durante a digestão e lavagem, tome cuidado para não pipeta os tecidos e a pelota da pilha aproximadamente para evitar danificar as pilhas com uma força de corte forte. - Aspirar o sobrenadante do tubo, em seguida, adicione 1,5 mL de HBSS pré-refrigerados no tubo. Dissociar a pelota cortical da pilha em únicas pilhas com pipetagem delicada. Conte o número da célula com um hemociômetro.
- Adicionar 2 mL de AM e 2 x 104 células corticais por poço em placas de 6 poços. Incubar a placa a 37 ° c e 5% CO2 para 3 h para deixar as células anexadas à placa.
- Sacrifique um rato grávida cronometrado E 10.5 por luxação cervical.
3. set-up da co-cultura neural-endothelial e do sistema de rotulagem da C.a.4Mannaz
- Um dia após o chapeamento BEND3 células nas inserções, gentilmente aspirar o meio na câmara inferior primeiro, em seguida, as inserções. Lave o inscreve das pastilhas 3 vezes com DMEM pré-aquecido. Lave a superfície exterior das pastilhas enxaguando com DMEM pré-aquecido.
- Adicione 1 mL de AM pre-aquecido em uma inserção, a seguir transfira as inserções nos poços com pilhas corticais preliminares. Incubar a cocultura a 37 ° c e 5% CO2 por 12 h.
- Dissolva a C.a.4Mannaz em DMSO para conseguir uma concentração de estoque de 200 milímetros. 12 h após a criação da cocultura neural-endotelial, adicione 1 μL de estoque de AC4Mannaz por câmara inferior e 0,5 μL de estoque por pastilha na cocultura. Agitar as placas imediatamente e suavemente para misturar o meio bem. Para as células de controle, adicione o volume igual de DMSO.
- Cultive as células por mais 5 dias a 37 ° c e 5% CO2. Prepare o am com 10x bFGF como o meio de realimentação (RM). Durante este tempo, adicione 100 μL de RM por pastilha e 200 μL de RM por câmara inferior para refeed as células endoteliais e neurais todos os dias. Durante a refeeding, não forneça a C.a.4Mannaz ou o DMSO na cultura.
4. coloração imunofluorescente de Sialoglicoproteínas em NSPCs primários expandidos e neurônios diferenciados
- Preparar BTTAA-CuSO4 complexo 1 30x estoque contendo 1,5 mm CuSO4 e 9 mm bttaa em água destilada dupla. Prepare recém-tampão conjugado com biotina 1 contendo 50 μM de biotina-alquíne, ascorbato de sódio de 2,5 mM e complexo 1x BTTAA-CuSO4 em PBS.
- Retire as pastilhas das placas de cocultura. Aspirar o meio de cultura dos poços inferiores e lavar as células neurais uma vez com PBS pré-aquecido.
- Aspirar a PBS dos poços. Adicione 1 mL de solução de PBS paraformaldeído pré-refrigerado a 4% por poço nas células e fixe as células em RT durante 10 min. Em seguida, lave as células 3 vezes com PBS pré-resfriado.
- Aspirar PBS dos poços e adicionar 1 mL de tampão recém-preparado biotina-conjugada 1 por poço nas células. Incubar as células em RT por 10 min.
- Aspirar o tampão de reacção dos poços. Lave as células 3 vezes com PBS. Prepare o tampão de coloração contendo 1% FBS e 1 μg/mL Alexa fluor 647-streptavidin. Adicionar 1 mL de tampão de coloração por poço nas células e incubar as células em RT por 30 min.
- Aspirar o tampão de coloração dos poços e células lavadas 3 vezes com PBS pré-resfriado. Prepare o tampão de bloqueio contendo 5% de BSA e 0,3% detergente não iônico-100 em PBS. Adicionar 1 mL de tampão de bloqueio por poço nas células e incubar em RT por 10 min.
- Prepare uma solução preliminar do anticorpo diluindo os anticorpos do anti-Nestin e do anti-β-tubulin III junto no amortecedor de obstrução nas proporções de 1:20 e de 1:1000, respectivamente. Retire o tampão de bloqueio dos poços e adicione 1 mL de solução de anticorpos primários por poço nas células. Incubar as células a 4 ° c durante a noite.
- Retire a solução de anticorpos primários dos poços. Lave as células 3 vezes com PBS pré-resfriado. Prepare uma solução de anticorpos secundários diluindo Alexa fluor 488 cabra anti-mouse IgG1, Alexa fluor 546 cabra IgG2b, e DAPI juntos no bloqueio de buffer em uma diluição de 1:1000. Aspirar a PBS dos poços e adicionar 1 mL de solução de anticorpos secundários por poço em células. Incubar as células em RT por 2 h.
- Aspirar a solução de anticorpos dos poços e lavar as células 3 vezes com PBS pré-resfriado. Depois, as células estão prontas para captura de imagem.
5. purificação de Sialoglicoproteínas de NSPCs primários expandidos e neurônios diferenciados
- Preparar BTTAA-CuSO4 Complex 2 15x estoque contendo 1,5 mm CuSO4 e 3 mm bttaa em água destilada dupla. Prepare o tampão de ressuscipensão A contendo 4% de SDS e 10 mM de EDTA em água destilada dupla; tampão de ressuscipensão proteica B contendo 150 mM de NaCl, Trietanolamina de 50 mM e éter de polioxietileno a 1% (por exemplo, Brij97) em água destilada dupla com pH 7,4. Antes de usar, misture o buffer a: buffer B = 1:8 (Vol/Vol) para preparar o amortecedor completo da ressuscipensão da proteína. Prepare o tampão de lavagem da proteína 1 que contem 2% SDS em PBS; tampão de lavagem da proteína 2 que contem a ureia de 8 M no bicarbonato do amónio de 250 milímetros (ABC); e tampão de lavagem de proteínas 3 contendo 2,5 M de NaCl em PBS.
- Retire as pastilhas das placas de cocultura. Aspirar o meio de cultura dos poços inferiores e lavar as células neurais uma vez com PBS pré-resfriado.
- Aspirar a PBS dos poços e adicionar 200 μL de tampão RIPA pré-refrigerado por poço nas placas. Incubar as placas no gelo por 5 min. colete a Lise proteica em tubos de 1,5 mL. Pellet os restos de células por centrifugação por 10 min a 4 ° c e 12.000 x g.
- Transfira o sobrenadante para os novos tubos de 1,5 mL. Determine a concentração da proteína com o jogo de BCA de acordo com as instruções do fabricante. Ajuste a concentração proteica para 1 mg/mL.
- Adicionar 100 μM de alquine-biotina, 2,5 mM de ascorbato de sódio e 1x BTTAA-CuSO4 Complex 2 a 1 ml de Lise proteica e misture bem a solução. Incubar a mistura em RT por 1 h.
- Transfira a solução de reacção para 20 mL de metanol pré-refrigerado num tubo cônico de 50 mL. Misture bem e incubar a-30 ° c durante a noite para precipitar as proteínas.
- Pellet a proteína precipitados por centrifugação por 15 min a 4 ° c e 4.500 x g. Lave o pellet de proteínas duas vezes com 20 mL de metanol pré-resfriado. Aspirar o sobrenadante do tubo. Resuspend a pelota da proteína com 4 ml do amortecedor da ressuscipensão da proteína e transfira o ressuspensão da proteína em um tubo cônico de 15 ml novo.
- Tomar 50 μL de grânulos de streptavidina e lavá-los 3 vezes com PBS. Adicione os grânulos lavados no Resuspension da proteína. Incubar a solução a 4 ° c por 3 h em um rotador vertical a uma velocidade de rotação de 20 rpm.
- Lave as contas sequencialmente com 6 tipos de buffers: tampão de lavagem de proteínas 1, tampão de lavagem de proteínas 2, tampão de lavagem de proteínas 3, 0,5 M ABC, 0,25 M ABC e 0, 5 M ABC.
- Após a lavagem, Ressuspender os grânulos com 20 μL de PBS e transferir os grânulos para um novo tubo de 1,5 mL. Adicionar 20 μL de tampão de carga de proteína 2x nos grânulos e tratar a 95 ° c durante 10 min. As amostras de proteínas devem então ser submetidas a SDS-PAGE e manchadas com o azul brilhante R-250 de Coomassie de acordo com as instruções do fabricante. Corte as proteínas em gel como indicado pela Coomassie azul brilhante R-250 para análise de espectrometria de massas.
Resultados
Todo o procedimento para expansão in vitro e rotulagem metabólica de NSPCs embrionários primários demora 6 dias (Figura 1a). A qualidade da linha celular BEND3 e os NSPCs primários recém-isolados são fundamentais para uma experiência bem-sucedida. As células BEND3 são a fonte de fatores solúveis que estimulam a autorenovação e a proliferação de NSPCs. Deve-se garantir que as células BEND3 estejam livres de qualquer contaminação e se dividam ativamente com a morte celular mínima antes de coculturar com células neurais. Os NSPCs primários devem ser cuidadosamente preparados para evitar o excesso de dano durante a dissociação. NSPCs danificados ainda podem crescer e diferenciar; no entanto, eles não são capazes de responder a estímulos endoteliais bem para manter o células e expandir. Deve-se tomar cuidado extra para ser asséptico durante a cultura da célula, pois o protocolo não sugere a adição de antibióticos ao meio de cultivo primário.
A cocultura endotelial bem-sucedida levará os NSPCs a formar clones grandes e semelhantes a folhas. Tais formas de clone caracterizado tornam-se evidentes no dia 4 e são muito típicas no dia 6. Dentro dos clones, as células mantêm contato estreito entre si. Imunocoloração com anticorpos contra o marcador NSPC Nestin e o marcador neuronal β-tubulina III deve revelar que no clone, a maioria das células são Nestin+ nspcs e muito poucos são β-tubulina III+ células neuronais. Em contrapartida, o percentual de células Nestin + e β-tubulina III+ células neuronais em clone formado em sistema não cocultura são quase os mesmos (Figura 1b, 1De 1e).
O repórter químico, AC4Mannaz, é um análogo metabólico e pode ser incorporado na via de sialilação de proteínas intrínsecas. Altas doses de AC4Mannaz são tóxicas para as células. Para cada tipo específico de célula, a concentração de rotulagem da C.a.4Mannaz deve pre-ser testada para conseguir a eficiência de rotulagem a mais elevada sem Cytotoxicity significativo. Aqui, a concentração de rotulagem otimizada de AC4Mannaz para nspc primário é 100 μm. avaliação combinatória da morte celular indicada pela morfologia celular e núcleos sugere que esta concentração de rotulagem não causa efeitos citotóxicos óbvios e é capaz de etiquetar eficientemente NSPCs (Figura 1C e 1D). A morfologia clonal, a autorenovação e o potencial de diferenciação de NSPCs na cocultura endotelial e no sistema não cocultura não são afetados (Figura 1C, 1De 1e).
A rotulagem bem sucedida de nspcs por AC4Mannaz pode ser examinada após conjugando a biotina a uma cultura negociada por uma reação do entre o azida e o alkyne. Cada célula no AC4Mannaz-rotulado cultura é manchado e visualizado com Alexa fluor 647-streptavidin. Nenhuma célula é positiva para Alexa fluor 647-streptavidin manchando no grupo de controle DMSO. Além disso, amostras de proteínas preparadas a partir do AC4Mannaz-rotulado cultura por biotina conjugação e estreptavidina grânulos de purificação mostrar forte Coomassie azul brilhante mancha sinal em GÉIS de SDS-PAGE. Enquanto isso, havia apenas manchas de fundo e sinais de ligação não específicos nas faixas carregadas com amostras de proteínas do grupo controle DMSO. Isso também indica a rotulagem eficiente de NSPCs por AC4Mannaz (Figura 1F).
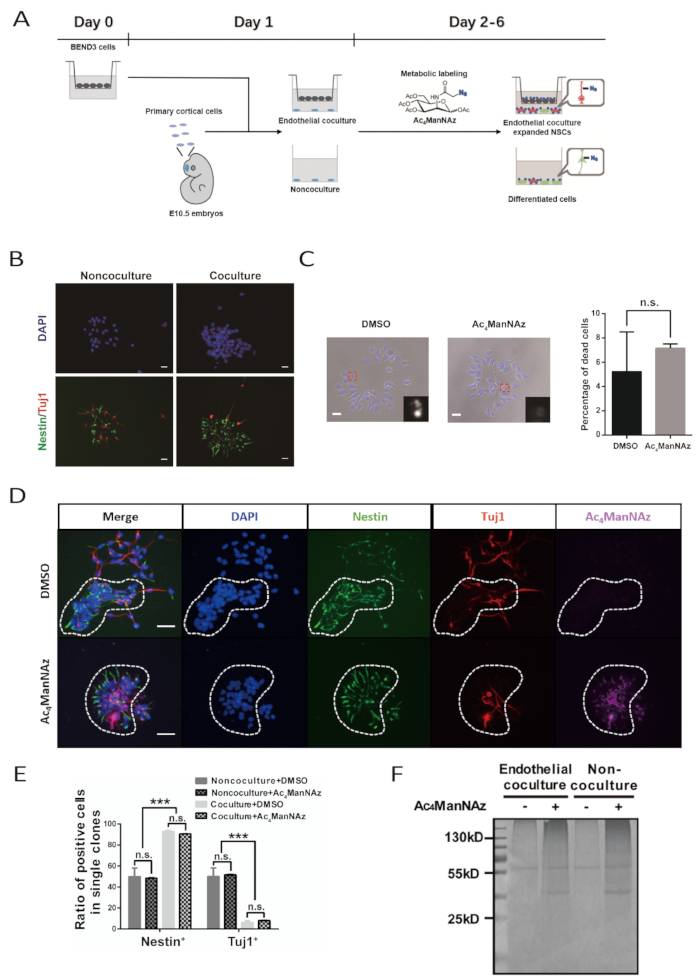
Figura 1 : Identificação de marcadores de superfície celular para NSPCs primários assistidos pelo sistema de cocultura endotelial e rotulagem de sialoglicanos metabólicos. (A) esquema do fluxo de trabalho para o protocolo. Este número foi modificado de Bai et al. 10. as células BEND3 são semeadas em inserções de matriz em D0. A preparação de NSPCs corticais primários e o sistema de cocultura são realizados em D1. A rotulagem metabólica da cultura dura de D2 a D6. A realimentação da cultura é carreg em D3 e em d5. (B) as imagens imunofluorescentes para clones formados por NSPCs primários após a cultura de 5 dias com ou sem células endoteliais. A barra de escala indica 20 μm. (C) imagens de campo brilhante para clones formados por NSPCs primários após uma cultura de 5 dias com AC4Mannaz ou DMSO. Os núcleos foram contracorados pela DAPI. A barra de escala indica 20 μm. A barra de erro indica SEM (n.s. = não significativo). (D) as imagens imunofluorescentes para NSPC formaram clones na cocultura endotelial com AC4Mannaz ou DMSO. O círculo tracejado demarca um único clone neural. A barra de escala indica 50 μm. (E) quantificação de NSPCs e neurônios diferenciados em clones formados por NSPCs em cocultura endotelial e sistema não cocultura com rotulagem de AC4Mannaz ou controle DMSO. A barra de erro indica SEM (* * * p < 0, 5; n.s. = não significativo). (F) coloração azul brilhante Coomassie de proteínas purificadas por grânulos de estreptavidina de células neurais rotuladas com AC4Mannaz ou DMSO em cocultura endotelial e sistema não cocultura. A banda 55 kD nos grupos de rotulagem de controlo representa proteínas de ligação não específicas. (B, C, e e F) correspondentes a este protocolo foram adaptados de Bai et al. 10. please estalam aqui para ver uma versão maior desta figura.
Discussão
Os marcadores de superfície são comumente usados para rotular e purificar ostipos de célulasespecíficas in vitro e in vivo17,18. Descoberta de marcadores de superfície contribui grandemente para a medicina regenerativa e pesquisas de células-tronco, fornecendo ferramentas moleculares para enriquecer seletivamente uma população de células-tronco de tecidos normais ou patológicos e pratos de cultura, oferecendo uma célula purificada recurso para uso clínico ou estudo de propriedades biológicas. Entretanto, o progresso em desenvolver marcadores de superfície para a pesquisa neural da pilha de haste foi lento devido à dificuldade em isolar pilhas de haste dos tecidos preliminares. O protocolo aqui descrito baseia-se numa plataforma simplificada in vitro. Comparando os NSPCs preliminares expandidos por uma cocultura endothelial a uma cultura neural de diferenciação, as proteínas expressas diferencialmente em NSPCs expandidos são destacadas e permitem a identificação mais adicional. Nosso protocolo também fornece uma estratégia alternativa para purificar proteínas de superfície celular por seqüestro da via metabólica intrínseca para rotular sialoglicano com grupos bioortogonais. Comparado com os protocolos tradicionais para purificante proteínas de superfície da pilha, as vantagens deste protocolo são underfixados por duas características específicas: 1) a predominância do sialylation em proteínas de superfície da pilha assegura a cobertura máxima do Proteome da superfície da pilha, e 2) a especificidade da reação entre o grupo do e seus ligantes concede a pureza do Proteome de superfície adquirido. Assim, nosso protocolo resulta em uma análise proteômica mais sensível no caso de menos materiais de partida. Nós demonstramos a viabilidade deste protocolo em marcadores de superfície preliminares de NSPCs. Com as modificações apropriadas em expandir as pilhas de haste in vitro, esta aproximação chemoproteomic pode ser compatível com identificação de marcadores de superfície de outros tipos da pilha de haste. É notável que como Ac4ManNAz é por-O-acetilated poderia conduzir ao S-glycosylation artificial. O uso de açúcares não acetilados não naturais pode evitar a formação de artefatos e melhorar a especificidade e validade da rotulagem metabólica de glicanos em células vivas19.
A preparação de pilhas de progenitor neural cortical preliminar e de pilhas endothelial é etapas críticas do protocolo. Primeiro, ao digerir os tecidos corticais embrionários, o tempo de digestão, a quantidade de enzima e a força de manuseio devem ser cuidadosamente controlados. A digestão excessiva e as forças de corte mecânicas prejudicarão a integridade da membrana plasmática e dos receptores de superfície celular que mediam a transdução de sinal para a sobrevivência e o crescimento celular, e eles também irão perturbar a responsividade dos NSPCs à estimulação da células endoteliais e sua capacidade de autorenovação. Para conseguir a digestão apropriada, os experimentadores devem ativar o papaína inteiramente e parar a digestão assim que os blocos do tecido desapareçam. Em segundo lugar, BEND3 células devem ser mantidas em um estado saudável para suportar a secreção. Recomenda-se usar lotes de células BEND3 com menos passagens e passar as células antes que atinjam 100% de confluência. Isto impedirá a apreensão e a senescência do ciclo de pilha causadas pelo dano do ADN acumulado durante o de ou pelo contato superlotado entre pilhas.
A tecnologia de sequenciamento de alta taxa de transferência aumenta a identificação de marcadores de superfície celular através da análise da expressão de RNA, especialmente para tipos celulares, incluindo células-tronco de tecido, que muitas vezes estão presentes in vivo em quantidades muito pequenas para realizar análises de proteoma por espectrometria de massas. Mesmo que a análise do RNA-Seq possa identificar os genes expressados especificamente nos NSPCs, pode não refletir verdadeiramente níveis da expressão da proteína, porque a expressão do RNA não é sempre consistente com a expressão20da proteína. Além disso, as biomoléculas não proteicas que podem funcionar como marcadores de superfície não são capazes de ser detectadas por estudos transcriptomicos. Por exemplo, Oligosaccharide Lewis X é um fabricante de superfície bem conhecido amplamente utilizado para rotular células-tronco embrionárias humanas e NSPCs, mesmo que possa ser associado com múltiplas proteínas21. Portanto, a análise de espectrometria de massas direta ainda não é substituível, e o desenvolvimento de métodos que podem tornar a análise de espectrometria de massas mais viável e conveniente é de grande interesse para estudos futuros.
Além do que o sialylation, outros tipos de modificações borne-translational da proteína jogam um papel importante em funções de regulamento de proteínas modificadas. Essas modificações afetam as propriedades proteicas, como a conformação, a semivida e a localização subcelular22,23. Várias modificações protéicas têm especificidade do tipo celular24,25,26. Com os índices crescentes da caixa de ferramentas química, mais tipos da modificação são passíveis à rotulagem metabólica com repórteres químicos27. Daqui, a aproximação química descrita aqui pode ser usada estudando outras diferenças na modificação da proteína entre pilhas de haste e pilhas diferenciadas, ilustrando os mecanismos moleculars atrás da manutenção de propriedades da pilha de haste e da diferenciação Regulamento.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Figura 1b, 1C, 1e e 1F são reproduzidos a partir de Bai et al . 10 de com permissão da sociedade real de química. Agradecemos Yi Hao no laboratório de X. C. para edição de figura. Este trabalho é apoiado pela Fundação Nacional de ciências naturais da China (no. 91753206 para Q. S. e X. C., no. 31371093 para Q. S., e nos. 21425204 e 21672013 para X. C.).
Materiais
| Name | Company | Catalog Number | Comments |
| BEND3 | ATCC | CRL-229 | |
| DMEM | Gibco | 11960044 | |
| L-glutamine | Gibco | 25030081 | 1% |
| Sodium pyruvate | Sigma | P5280 | 1% |
| N2 supplement | Gibco | 17502048 | 1 to 100 |
| N-acetyl-L-cysteine | Sigma | A7250 | 1 mM |
| Papain | Worthington | LS003726 | 10 U/mL |
| B27 supplement | Gibco | 17504044 | 1 to 50 |
| Poly-L-lysine | Sigma | P4707 | |
| Basic Fibroblast growth factor | Gibco | PHG0261 | 10 ng/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 1% |
| Fetal bovine serum | Gibco | 10099141 | 10% |
| HBSS | Gibco | 14175095 | |
| Tripsin-EDTA, 0.25% | Gibco | 25200056 | |
| DPBS | Gibco | 14190094 | |
| Transwell | Corning | 3450 | |
| Paraformaldehyde | Sigma | 158127 | 4% |
| Sucrose | Sangon | A100335 | |
| DAPI | Gibco | 62248 | |
| RIPA buffer | Thermo Scientific | 89900 | |
| SDS-PAGE loading buffer 2x | Solarbio | P1018 | |
| 6-well plate | Corning | 3335 | |
| Tris-Glycine protein gel | invitrogen | xp00100box | |
| Mouse monoclonal anti-Nestin | Developmental Study Hybridoma Bank | Rat-401 | 1 to 20 |
| Mouse monoclonal anti-beta-tubulin III | Sigma | T8860 | 1 to 1,000 |
| Alexa Fluor 488 goat anti-mouse IgG1 | invitrogen | A-21121 | 1 to 1,000 |
| Alexa Fluor 546 goat anti-mouse IgG2b | invitrogen | A-21143 | 1 to 1,000 |
| Albumin Bovine V | Amresco | 0332 | |
| Triton X-100 | Amresco | 0694 | |
| BCA assay kit | Thermo Scientific | 23225 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Brij97 | Aladdin | B129088 | |
| CuSO4 | Sigma | 209198 | |
| Alkyne-biotin | Click Chemistry Tools | TA105 | |
| BTTAA | Click Chemistry Tools | 1236 | |
| Ac4ManNAz | Click Chemistry Tools | 1084 | 100 µM |
| 9AzSia | synthesized in lab | ||
| Sodium ascorbate | Sigma | A4034 | |
| Methanol | Sigma | 34860 | |
| EDTA | Sangon | A100322 | |
| NaCl | Sangon | A100241 | |
| SDS | Sangon | A100227 | |
| Alexa Flour 647-conjugated streptavidin | invitrogen | S21374 | 1 to 1,000 |
| Triethanolamine | Sigma | V900257 | |
| Dynabeads M-280 Streptavidin | invitrogen | 60210 | |
| Ammonium bicarbonate | Sigma | 9830 | |
| Coomassie Brilliant Blue R-250 | Thermo Scientific | 20278 | |
| Isoflurane | RWD Life Science Co. | 970-00026-00 | |
| DNase I | Sigma | DN25 | 12 µg/mL |
| Urea | Sigma | U5378 |
Referências
- Weissman, I. L. Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution. Cell. 100, 157-168 (2000).
- Gage, F. H., Temple, S. Neural Stem Cells: Generating and Regenerating the Brain. Neuron. 80, 588-601 (2013).
- Gal, J. S. Molecular and Morphological Heterogeneity of Neural Precursors in the Mouse Neocortical Proliferative Zones. Journal of Neuroscience. 26, 1045-1056 (2006).
- Kawaguchi, A., et al. Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis. Development. 135, 3113-3124 (2008).
- Temple, S. The development of neural stem cells. Nature. 414, 112-117 (2001).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139, 1535-1546 (2012).
- Kriegstein, A., Alvarez-Buylla, A. The Glial Nature of Embryonic and Adult Neural Stem Cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Wang, X., Tsai, J. W., LaMonica, B., Kriegstein, A. R. A new subtype of progenitor cell in the mouse embryonic neocortex. Nature Neuroscience. 14, 555-561 (2011).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Bai, Q. R., Dong, L., Hao, Y., Chen, X., Shen, Q. Metabolic glycan labeling-assisted discovery of cell-surface markers for primary neural stem and progenitor cells. Chemical Communications. 54, 5486-5489 (2018).
- Shen, Q., et al. Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science. 304, 1338-1340 (2004).
- Qian, X., et al. Timing of CNS cell generation: a programmed sequence of neuron and glial cell production from isolated murine cortical stem cells. Neuron. 28, 69-80 (2000).
- Varki, A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins. Nature. 446, 1023-1029 (2007).
- Cheng, B., Xie, R., Dong, L., Chen, X. Metabolic Remodeling of Cell-Surface Sialic Acids: Principles, Applications, and Recent Advances. ChemBioChem. 17, 11-27 (2016).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Schmidt, J. R., et al. Pilot Study on Mass Spectrometry-Based Analysis of the Proteome of CD34+CD123+ Progenitor Cells for the Identification of Potential Targets for Immunotherapy in Acute Myeloid Leukemia. Proteomes. 6, (2018).
- Crisan, M., Dzierzak, E. The many faces of hematopoietic stem cell heterogeneity Development. Development. 144, 4195-4195 (2017).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proceedings of the National Academy of Sciences of the United States of America. 97, 14720-14725 (2000).
- Qin, W., et al. Artificial Cysteine S-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angewandte Chemie International Edition. , (2018).
- Gry, M., et al. Correlations between RNA and protein expression profiles in 23 human cell lines. BMC Genomics. 10, 365(2009).
- Hennen, E., et al. A LewisX Glycoprotein Screen Identifies the Low Density Lipoprotein Receptor-related Protein 1 (LRP1) as a Modulator of Oligodendrogenesis in Mice. Journal of Biological Chemistry. 288, 16538-16545 (2013).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7, 473-483 (2006).
- O’Brian, C. A., Chu, F. ReviewPost-translational disulfide modifications in cell signaling—role of inter-protein, intra-protein, S-glutathionyl, and S-cysteaminyl disulfide modifications in signal transmission. Free Radical Research. 39, 471-480 (2005).
- Williamson, A. J. K., Whetton, A. D. The requirement for proteomics to unravel stem cell regulatory mechanisms. Journal of Cellular Physiology. 226, 2478-2483 (2011).
- Christensen, B., et al. Cell Type-specific Post-translational Modifications of Mouse Osteopontin Are Associated with Different Adhesive Properties. Journal of Biological Chemistry. 282, 19463-19472 (2007).
- Yanagisawa, M., Yu, R. K. The expression and functions of glycoconjugates in neural stem cells. Glycobiology. 17, 57R-74R (2007).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados