Method Article
تحديد علامات سطح الخلية من الجذعية العصبية الأولية والخلايا السلف عن طريق وضع العلامات الأيضية من Sialoglycan
* These authors contributed equally
In This Article
Summary
يقدم هنا هو البروتوكول الذي يجمع بين في المختبر العصبية بطانة نظام الثقافة المشتركة والدمج الأيضي للسيالوجيكان مع المجموعات الوظيفية bioorthogonal لتوسيع الجذعية العصبية الأولية والخلايا السلف وتسمية سطحها البروتينات السيالوجية للتصوير أو تحليل الطيف الكتلي لعلامات سطح الخلية.
Abstract
الجذعية العصبية والخلايا السلف (NSPCs) هي الأساس الخلوي للهياكل المعقدة ووظائف الدماغ. وهي تقع في محاريب متخصصة في الجسم الحي ويمكن عزلها وتوسيعها في المختبر، بمثابة مورد مهم لزراعة الخلايا لإصلاح تلف الدماغ. ومع ذلك، فإن الـ NSPCs غير متجانسة وغير محددة بوضوح على المستوى الجزيئي أو يتم تنقيتها بسبب عدم وجود علامات سطح الخلية المحددة. البروتوكول المقدم، الذي تم الإبلاغ عنه سابقاً، يجمع بين نظام الثقافة المشتركة العصبية البطانة مع طريقة وضع العلامات على الغليكان الأيضي لتحديد سطح sialoglycoproteome من NSPCs الأولية. يسمح نظام الثقافة المشتركة NSPC-endothelial بالتجديد الذاتي وتوسيع المراكز الوطنية للدعم والتغذية الأولية في المختبر،مما يولد عدداً كافياً من الـ NSPCs. المجموعات الوظيفية البيوثوغنالية. من خلال مقارنة sialoglycoproteome من NSPCs التجديد الذاتي توسعت في ثقافة مشتركة بطانة مع الثقافة العصبية المختلفة، ونحن تحديد قائمة من البروتينات الغشاء التي يتم إثراء في NSPCs. وينطوي البروتوكول بالتفصيل على ما يلي: (1) إنشاء ثقافة مشتركة بين البطانة والبطانة الوطنية وثقافة مختلفة؛ (2) إنشاء ثقافة مشتركة بين البطانة والبطانة الوطنية؛ (2) إنشاء ثقافة مشتركة بين البطانة والبطانة الوطنية؛ (3) إنشاء ثقافة مشتركة بين البطانة والبطانة الوطنية؛ (3) إنشاء ثقافة مشتركة بين البطانة والبطانة الوطنية؛ (3) إنشاء ثقافة مشتركة بين البطان 2) وضع العلامات مع azidosugar لكل O-أسيتيل N-azidoacetylmannosamine (Ac4ManNAz)؛ و 3) البيوتين الاقتران إلى sialoglycan المعدلة للتصوير بعد تثبيت الثقافة العصبية أو استخراج البروتين من الثقافة العصبية لتحليل الطيف الكتلي. ثم يتم اختيار المرشحين علامة سطح المخصب NSPC عن طريق التحليل المقارن لبيانات قياس الطيف الكتلي من كل من NSPC الموسعة والثقافات العصبية المتمايزة. هذا البروتوكول حساس للغاية لتحديد بروتينات الغشاء ذات الوفرة المنخفضة في مواد البداية، ويمكن تطبيقه على اكتشاف العلامات في أنظمة أخرى مع التعديلات المناسبة
Introduction
يتم تعريف الخلايا الجذعية العصبية على أنها مجموعة خلايا متعددة القوى التي يمكن تجديدها ذاتيا للحفاظ على تجمع الخلايا الجذعية والتفريق في الخلايا العصبية وغليا. وهي أنواع الخلايا الرئيسية في الجهاز العصبي ويمكن أن توفر إمكانات علاجية كبيرة في الطب التجديدي من خلال زرع الخلايا في العقول المريضة والمصابة1،2. مع تقدم التنمية ، يصبح عدد الخلايا الجذعية العصبية غيرمتجانسة 3،4، وتنخفض نسبة الخلايا الجذعية العصبية في الدماغ تدريجيا5. بشكل عام، توجد الخلايا الجذعية العصبية الجنينية وغيرها من الخلايا السلف العصبية، وتسمى مجتمعة الجذعية العصبية والخلايا السلف (NSPCs)، في المناطق الإنباتية، والمنطقة البطينية، والمنطقة التحتية في الفئران6. في الدماغ الجنيني، تولد الخلايا الجذعية العصبية الخلايا العصبية بشكل مباشر أو غير مباشر من خلال خلايا السلف المتوسطة (IPCs)، وفي بعض الأنواع من خلال الذرية المنطقة الفرعية الخارجية (oRGs)7،8. التوقيع الجزيئي المحدد، مورفولوجيا، الموقع في محراب الخلايا الجذعية، وإمكانات التمايز كلها تحدد دور كل نوع فرعي في تكوين الأعضاء في الدماغ والتطبيقات السريرية9. ومع ذلك، فإن علامات سطح الخلية المتاحة حاليالا يمكن أن تميز بشكل لا لبس فيه وتنقية أنواع فرعية مختلفة من NSPCs، مما يحد من فهم واستخدام هذه الأنواع الفرعية.
ويحد من تحديد العلامات السطحية الأولية للمراكز الوطنية للدعم في مجال الحماية ثلاث عقبات رئيسية. الأول هو عدد الخلايا المحدودة من NSPCs في الأنسجة، مما يجعل من الصعب إعداد عينات بروتين سطح الخلية لتحليل قياس الطيف الكتلي المشترك. والقيد الثاني هو صعوبة إنتاج أنواع فرعية من الخلايا النقية لتوليد بيانات بروتين الغشاء الخاص بالنوع الفرعي. وأخيرا، فإن التحدي الثالث هو انخفاض نسبة البروتينات السطحية للخلايا في بروتينات الخلايا بأكملها، مما يعوق حساسياتها الكشف عن طريق تحليل قياس الطيف الكتلي.
للتغلب على هذه المشاكل، قمنا بتطوير نهج كيميائي لتخصيب وتحديد البروتينات السطحية للخلايا بشكل انتقائي في NSPCs الأولية عن طريق وضع العلامات الأيضية للبروتينات sialoglycoproteins10. لتوليد عدد كاف من النقاط الاستراتيجية الوطنية، استفدنا من بروتوكول راسخ لتوسيع والحفاظ على الـ NSPCs الجنينية الأولية في الدول غير المتمايزة في المختبر، من خلال المشاركة في زراعة NSPCs مع خطوط الخلايا البطانية الدماغ الماوس باستخدام دعم نفاذية مصفوفة إدراج(على سبيل المثال، transwell) نظام11. وعلى النقيض من ذلك، فإن NPSCs المستزرعة وحدها دون الخلايا البطانية تولد ذرية مختلفة11،12. وهكذا، يمكن تحليل عينات البروتين من هذين النظامين الثقافة نسبيا لتحديد البروتينات التي يتم التعبير عنها بشكل تفاضلي في NSPCs والخلايا العصبية المتمايزة. كما يتم تعديل معظم البروتينات السطحية الخلية من قبل حمض السياليك13، غير طبيعي حمض السياليك السلائف التناظرية N-azidoacetylmannosamine-tetraacylated (Ac4ManNAz) تم استخدامها لاختطاف المسار الأيضي المتأصلة بحيث الذاتية ، حديثا يتم تسمية sialoglycans توليفها مع مجموعات azido، وتوليد مقبض كيميائي14. من خلال التفاعلات الحيوية الأزيدو-الألكيين بوساطة، والتي تترافق الكائنات الحية إلى السيالوجيكانات، يمكن تصور البروتينات السطحية للخلايا وإثرائها لتحديد البروتيوميك من خلال فلوروفور أو مصفوفة14.
هنا، نقوم بتلطيخ تحليل هلام SDS-PAGE للسطح sialoglycoproteome من NSPCs الموسعة في ثقافة مشتركة بطانة وخلايا مختلفة في نظام غير ثقافة مشتركة. نحن أيضا تنقية انتقائية سطح sialoglycoproteome في نظامين الثقافة للمقارنة البروتيومية. بروتوكولنا، مقارنة مع التقليدية المستندة إلى الطرد المركزي خلية سطح البروتوكولاتتنقية 15،يزيد من فعالية استخراج عن طريق الحد من إجراءات استخراج البروتين السطحي من خلال اقتران علامة محددة وتقارب تنقيه. وفي الوقت نفسه، فإنه يزيد من نقاء استخراج البروتينات سطح الخلية على أساس فرضية أن sialylation يحدث في الغالب في البروتينات سطح الخلية. على الرغم من أن العوامل البطانية لا يمكن أن تمنع تماما التفريق بين NSPCs الموسعة، فإن الدراسة المقارنة بين الثقافة المشتركة والثقافة المتمايزة توفر طريقة ملائمة لتحديد البروتينات السطحية الغنية بالخلايا الجذعية دون الحاجة إلى تحليل البروتينات من NPCs تنقية من قبل FACS16. ونحن نعتقد أن هذا النهج يمكن تطبيقه على دراسات البروتينات السطحية في أنظمة أخرى مع التعديلات المناسبة.
Protocol
تمت الموافقة على جميع البروتوكولات الحيوانية المستخدمة في هذه الدراسة من قبل IACUC (اللجنة المؤسسية لرعاية الحيوانات واستخدامها) من جامعة Tsinghua وتنفيذها وفقا للمبادئ التوجيهية للIACUC. وقد تم اعتماد مرفق الحيوانات المختبرية في جامعة تسينغهوا من قبل رابطة تقييم واعتماد مختبر رعاية الحيوانات الدولية). لمراحل الأجنة، تم حساب منتصف اليوم من القابس المهبلي المحدد على أنه يوم جنيني 0.5 (E0.5).
ملاحظة: يتم زراعة جميع الخلايا في حاضنة الخلية في ظل ظروف 37 درجة مئوية و 5٪ CO2.
1. إعداد ثقافة البطانة الماوس في إدراج دعم نفاذية
ملاحظة: يتم الحفاظ على خلايا BEND3 وفقا لتعليمات الشركة المصنعة.
- إعداد BEND3 خلية متوسطة (BM) عن طريق إضافة 50 مل من FBS و 5 مل من البنسلين-ستربيتوميسين في 500 مل من DMEM ومزيج جيدا.
- يستنشق الوسط من الطبق ويغسل ثقافة الخلايا BEND3 مع 1 مل من PBS مرة واحدة. إضافة 1 مل من 0.25٪ تريبسين-EDTA في الخلايا وحضانة الخلايا لمدة 4 دقائق في 37 درجة مئوية.
- إضافة 1 مل من BM في الخلايا لتحييد التربسين-EDTA والماصة صعودا وهبوطا بلطف لتفكك الخلايا تماما. نقل تعليق الخلية في أنبوب مخروطي جديد 15 مل وبيليه عن طريق الطرد المركزي في درجة حرارة الغرفة (RT) لمدة 5 دقائق في 400 × ز.
- يستنشق supernatant من الأنبوب وإعادة تعليق الخلايا مع 9 مل من BM الطازجة، ثم إضافة 1 مل من تعليق الخلية في إدراج دعم نفاذية واحدة. إضافة آخر 2 مل من BM الطازجة لكل بئر في الغرفة السفلى من المصفوفة. الاستمرار في ثقافة الخلايا ليوم واحد.
2. إعداد الماوس الابتدائية القشرية NSPCs الثقافة
-
إعداد لوحة الثقافة، والباباين الهضم المتوسطة، والقشرية أتباع الثقافة المتوسطة (AM)
- طبقة 6-لوحات جيدا مع بولي-L-يسين (PLL) عن طريق إضافة 1 مل من محلول PLL في جيدا في لوحات 6 جيدا. ثم، احتضان لوحات في RT لمدة 30 دقيقة.
- نقل الحل PLL في أنبوب مخروطي 15 مل. غسل لوحات 3 مرات مع الماء المقطر مزدوجة. تجفيف الأطباق ووضعها جانبا حتى استخدامها.
- إعداد وسط هضم البابين عن طريق إضافة 50 U من البابين، 50 درجة مئوية من L-الجلوتامين، و 50 ميكرولتر من 100 ملغ / مل أسيتيل-L-سيستين في 5 مل من DMEM. اخلطي المتوسط لفترة وجيزة وسخنيه إلى 37 درجة مئوية لمدة 30 دقيقة لتنشيط الإنزيم.
- إعداد الخلية القشرية التمسك الثقافة المتوسطة (AM): إضافة 500 ميكرولتر من L-الجلوتامين، 500 ميكرولتر من بيروفات الصوديوم، 500 ميكرولتر من 100 ملغ / مل N-أسيتيل-L-سيستين، 500 ميكرولتر من N2، 1 مل من B27، و 5 ميكرولتر من 100 ميكروغرام / مل bFGF في 50 مل من DMEM. يُمزج المزيج المتوسط جيداً ويُسخّن إلى 37 درجة مئوية قبل الاستخدام.
-
إعداد الخلايا القشرية الدماغية الأولية والطلاء اللاحق
- التضحية بفأر حامل E10.5 موقوتة عن طريق خلع عنق الرحم.
ملاحظة: في E10.5، تنتشر غالبية الخلايا NSPCs في القشرة الدماغية، مما يؤدي إلى استنساخ كبيرة من ذرية في المختبر. - تعقيم البطن بنسبة 75٪ الإيثانول. استخدام مقص غرامة وملقط مسننة صغيرة لفتح البطن عن طريق قطع الجلد والعضلات الكامنة على طول الجانب الأيمن من الخط الأوسط. إزالة الرحم من تجويف البطن بلطف مع ملقط مسننة وقطع من تجويف البطن مع مقص غرامة.
- اغسل الرحم بـ 40 مل من HBSS قبل التبريد في طبق بيتري 10 سم. ثم نقل الرحم إلى طبق بيتري جديد 10 سم وغسله مرة أخرى مع 40 مل من HBSS المبردة مسبقا.
- نقل الرحم إلى طبق بيتري جديد 10 سم مع 40 مل من HBSS المبردة مسبقا. إزالة الأجنة من الرحم والغشاء السلوي، ثم قطع رؤوس الأجنة قبالة من جذوع مع microforceps المجوهرات.
- اغسل الرؤوس بـ 40 مل من HBSS pre-chills ونقل الرؤوس إلى طبق بيتري جديد 10 سم مع 40 مل من HBSS قبل المبردة. استخدام microforceps المجوهرات لقشر الجلد والغضاريف التي تغطي العقول، ثم قطع القشريات الدماغية قبالة وجمعها في أنبوب مخروطي 15 مل مع HBSS قبل المبردة.
- بيليه القشرية عن طريق الطرد المركزي لمدة 3 دقائق في 4 درجة مئوية و 300 × ز. يستنشق supernatant من الأنبوب، ثم إضافة تنشيط الباباين الهضم المتوسطة و 15 درجة مئوية من 4 ملغ / مل DNase الأول في بيليه الأنسجة.
- إعادة تعليق بيليه الأنسجة لفترة وجيزة عن طريق دوامة لطيف. حضانة الأنسجة في 37 درجة مئوية لمدة 30 دقيقة. خلال هذا الوقت، تخفيف الأنسجة عن طريق دوامة قصيرة كل 10 دقيقة.
ملاحظة: في نهاية عملية الهضم ، يجب ألا تكون هناك قطع أنسجة مرئية في الأنبوب. - بيليه الخلايا القشرية عن طريق الطرد المركزي لمدة 10 دقائق في 4 درجة مئوية و 450 × ز. يستنشق supernatant من الأنبوب وغسل بيليه الخلية مع DMEM المبردة مسبقا. كرر هذه الخطوة مرة واحدة.
ملاحظة: أثناء الهضم والغسيل، وتوخي الحذر من ماصة الأنسجة وخلية بيليه تقريبا لتجنب الإضرار الخلايا مع قوة قص قوية. - قم بإستقان الـ supernatant من الأنبوب ثم أضف 1.5 مل من HBSS المبردة مسبقًا إلى الأنبوب. فصل بيليه الخلية القشرية في خلايا واحدة مع الأنابيب لطيف. عد رقم الزنزانة بمقياس الهيموكيتومات.
- إضافة 2 مل من AM و 2 × 104 الخلايا القشرية في جيدا في لوحات 6 جيدا. احتضان لوحة في 37 درجة مئوية و 5٪ CO2 لمدة 3 ساعة للسماح للخلايا نعلق على لوحة.
- التضحية بفأر حامل E10.5 موقوتة عن طريق خلع عنق الرحم.
3. إنشاء العصبية بطانة الثقافة المشتركة وAc4ManNAz نظام وضع العلامات
- يوم واحد بعد طلاء BEND3 الخلايا في إدراج، يستنشق بلطف المتوسطة في الغرفة السفلى أولا، ثم إدراج. اغسل يُغلى الإدراج 3 مرات مع DMEM المُسخّن مسبقاً. اغسل السطح الخارجي للإدراج عن طريق الفرّة مع DMEM الدافئة مسبقاً.
- إضافة 1 مل من AM pre-warmed في إدراج واحد، ثم نقل إدراج في الآبار مع الخلايا القشرية الأولية. احتضان الثقافة المشتركة في 37 درجة مئوية و 5٪ CO2 لمدة 12 ساعة.
- حل Ac4ManNAz في DMSO لتحقيق تركيز المخزون من 200 mM. 12 ح بعد إعداد العصبية بطانة الثقافة المشتركة، إضافة 1 درجة مئوية من Ac4ManNAz الأسهم لكل غرفة أسفل و 0.5 درجة مئوية من المخزون لكل إدراج في الثقافة المشتركة. تُرج الأطباق على الفور وبلطف لخلط المتوسطة جيداً. بالنسبة لخلايا التحكم، أضف وحدة تخزين متساوية من DMSO.
- زراعة الخلايا لمدة 5 أيام أخرى في 37 درجة مئوية و 5٪ CO2. إعداد AM مع 10x bFGF كوسيلة إعادة التغذية (RM). خلال هذا الوقت، إضافة 100 درجة مئوية من RM لكل إدراج و 200 درجة مئوية من RM لكل غرفة أسفل لإعادة تغذية الخلايا البطانية والعصبية كل يوم. أثناء ال [رفيد], لا يزوّد [أك]4[منز] أو [دمسو] داخل الثقافة.
4. تلطيخ الفلورسنت المناعي من البروتينات السيالوجية في NSPCs الأولية الموسعة والخلايا العصبية المتمايزة
- إعداد BTTAA-CuSO4 مجمع 1 30X الأسهم التي تحتوي على 1.5 MM CuSO4 و 9 M BTTAA في الماء المقطر المزدوج. إعداد جديد البيوتين المترافق العازلة 1 التي تحتوي على 50 ميكرومتر البيوتين الألكيين، 2.5 مليون متر أسكوربات الصوديوم، و 1X BTTAA-CuSO4 مجمع في PBS.
- قم بإزالة الإدراجات من لوحات الثقافة المشتركة. يستنشق وسط الثقافة من الآبار السفلية ويغسل الخلايا العصبية مرة واحدة مع PBS قبل تسخينها.
- إستنشق الـ(بي بي إس) من الآبار إضافة 1 مل من قبل المبردة 4٪ بارافورماللديهايد PBS الحل في جيدا في الخلايا وإصلاح الخلايا في RT لمدة 10 دقيقة. ثم، وغسل الخلايا 3 مرات مع PBS المبردة مسبقا.
- يستنشق PBS من الآبار وإضافة 1 مل من المخزن المؤقت الملتصق بالبيوتين الطازج 1 لكل بئر في الخلايا. حضانة الخلايا في RT لمدة 10 دقائق.
- يستنشق العازلة رد الفعل من الآبار. غسل الخلايا 3 مرات مع PBS. إعداد العازلة تلطيخ تحتوي على 1٪ FBS و 1 ميكروغرام / مل اليكسا فلور 647-streptavidin. إضافة 1 مل من وصمة عار العازلة في جيدا في الخلايا وحضانة الخلايا في RT لمدة 30 دقيقة.
- قم بإستئني المخزن المؤقت التلطيخ من الآبار والخلايا المغسولة 3 مرات مع PBS المبردة مسبقاً. إعداد العازلة حظر تحتوي على 5٪ BSA و 0.3٪ المنظفات غير الأيونية-100 في PBS. إضافة 1 مل من حظر العازلة في جيدا في الخلايا وحضانة في RT لمدة 10 دقيقة.
- إعداد حل الأجسام المضادة الأولية عن طريق تخفيف الأجسام المضادة للعش والمضادة لبيتا توبولين الثالث معا في العازلة حظر بنسب 1:20 و 1:1000، على التوالي. إزالة المخزن المؤقت حظر من الآبار وإضافة 1 مل من محلول الأجسام المضادة الأساسية لكل بئر في الخلايا. حضانة الخلايا في 4 درجة مئوية بين عشية وضحاها.
- إزالة الحل الأساسي الأجسام المضادة من الآبار. غسل الخلايا 3 مرات مع PBS المبردة مسبقا. إعداد حل الأجسام المضادة الثانوية عن طريق تخفيف اليكسا فلور 488 الماعز المضادة للماوس IgG1، اليكسا فلور 546 الماعز المضادة للماوس IgG2b، وDAPI معا في حظر العازلة في تخفيف 1:1000. يستنشق PBS من الآبار وإضافة 1 مل حل الأجسام المضادة الثانوية لكل بئر في الخلايا. حضانة الخلايا في RT لمدة 2 ساعة.
- قم بإستئني محلول الأجسام المضادة من الآبار واغسل الخلايا 3 مرات مع PBS المبردة مسبقاً. بعد ذلك، تكون الخلايا جاهزة لالتقاط الصور.
5. تنقية البروتينات Sialoglyco من NSPCs الأولية الموسعة والخلايا العصبية المتمايزة
- إعداد BTTAA-CuSO4 مجمع 2 15X الأسهم التي تحتوي على 1.5 mM CuSO4 و 3 M M BTTAA في الماء المقطر مزدوجة. إعداد البروتين إعادة تعليق العازلة A تحتوي على 4٪ SDS و 10 MM EDTA في الماء المقطر مزدوجة؛ البروتين إعادة تعليق العازلة B تحتوي على 150 مل كلوريد الفينيل، 50 mM ثلاثي إيثانولامين، و 1٪ بوليأوكسي إيثيلين أوليل الأثير (على سبيل المثال، Brij97) في الماء المقطر مزدوجة مع درجة الحموضة 7.4. قبل الاستخدام، قم بخلط المخزن المؤقت A:buffer B = 1:8 (vol/vol) لإعداد المخزن المؤقت لإعادة تعليق البروتين الكامل. إعداد البروتين غسل العازلة 1 التي تحتوي على 2٪ SDS في PBS. بروتين غسل العازلة 2 التي تحتوي على 8 M اليوريا في 250 mM بيكربونات الأمونيوم (ABC)؛ والبروتين غسل العازلة 3 التي تحتوي على 2.5 M NaCl في PBS.
- قم بإزالة الإدراجات من لوحات الثقافة المشتركة. يستنشق وسط الثقافة من الآبار السفلية ويغسل الخلايا العصبية مرة واحدة مع PBS المبردة مسبقا.
- قم بإستئني الـ PBS من الآبار وأضف 200 ميكرولتر من المخزن المؤقت RIPA المبرد مسبقًا لكل بئر في الأطباق. احتضان لوحات على الجليد لمدة 5 دقائق. بيليه الحطام الخلية عن طريق الطرد المركزي لمدة 10 دقيقة في 4 درجة مئوية و 12،000 × ز.
- نقل supernatant إلى أنابيب جديدة 1.5 مل. تحديد تركيز البروتين مع مجموعة BCA وفقا لتعليمات الشركة المصنعة. ضبط تركيز البروتين إلى 1 ملغ / مل.
- إضافة 100 م ألكيين البيوتين، 2.5 مليون متر أسكوربات الصوديوم، و 1X BTTAA-CuSO4 مجمع 2 إلى 1 مل من تحلل البروتين وخلط الحل جيدا. احتضان المزيج في RT لمدة 1 ساعة.
- نقل حل رد الفعل في 20 مل من الميثانول المبردة مسبقا في أنبوب مخروطي 50 مل. يُخلط المزيج جيداً ويُحضن عند -30 درجة مئوية بين عشية وضحاها للتعجيل بالبروتينات.
- بيليه البروتين يعجل بالطرد المركزي لمدة 15 دقيقة في 4 درجة مئوية و 4500 × ز. اغسل يبيليه البروتين مرتين مع 20 مل من الميثانول المبردة مسبقا. يستنشق الـ"سوبرناينت" من الأنبوب إعادة تعليق بيليه البروتين مع 4 مل من البروتين إعادة تعليق العازلة ونقل البروتين تعليق في أنبوب مخروطي جديد 15 مل.
- خذ 50 ميكرولتر من حبات streptavidin وغسلها 3 مرات مع PBS. إضافة الخرز غسلها في إعادة تعليق البروتين. احتضان الحل في 4 درجة مئوية لمدة 3 ساعة على الدوار الرأسي بسرعة دوران 20 دورة في الدقيقة.
- غسل الخرز بالتتابع مع 6 أنواع من المخازن المؤقتة: البروتين غسل العازلة 1، البروتين غسل العازلة 2، البروتين غسل العازلة 3، 0.5 M ABC، 0.25 M ABC و 0.05 M ABC.
- بعد الغسيل، إعادة تعليق الخرز مع 20 درجة مئوية من PBS ونقل الخرز إلى أنبوب جديد 1.5 مل. إضافة 20 درجة مئوية من 2X البروتين تحميل العازلة في الخرز وعلاج في 95 درجة مئوية لمدة 10 دقيقة. ثم يجب أن تخضع عينات البروتين إلى SDS-PAGE وملطخة مع Coomassie الأزرق الرائع R-250 وفقا لتعليمات الشركة المصنعة. قطع البروتينات في هلام كما هو مبين من قبل Coomassie الأزرق اللامع R-250 لتحليل الطيف الكتلي.
النتائج
الإجراء الكامل للتوسع في المختبر ووضع العلامات الأيضية من NSPCs الجنينية الأولية يستغرق 6 أيام(الشكل 1A). جودة خط الخلية BEND3 وNSPCs الأولية المعزولة حديثا هي المفتاح لتجربة ناجحة. خلايا BEND3 هي مصدر العوامل القابلة للذوبان التي تحفز التجديد الذاتي وانتشار الشركات غير القابلة للذوبان. وينبغي التأكد من أن الخلايا BEND3 خالية من أي تلوث وتقسيم بنشاط مع الحد الأدنى من موت الخلايا قبل المشاركة في زراعة الخلايا العصبية. ويجب أن تكون المراكز الوطنية للدعم في مجال النُسَّم الأولية مستعدة بعناية لتجنب الأضرار الزائدة أثناء التفكك. وقد لا تزال المراكز الوطنية للدعم في المناطق النضوية المتضررة تنمو وتفرق؛ ومع ذلك، فإنها ليست قادرة على الاستجابة للمحفزات البطانية جيدا للحفاظ على الجذعية والتوسع. وينبغي توخي الحذر الإضافي ليكون مطهرا أثناء زراعة الخلايا، لأن البروتوكول لا يقترح إضافة المضادات الحيوية إلى وسط الثقافة الأولية.
وستؤدي الثقافة المشتركة البطانية الناجحة إلى تشكيل الشركات الصغيرة والشعوب غير الناجحة في شكل مستنسخات كبيرة تشبه الورق. هذه الأشكال استنساخ مميزة تصبح واضحة في اليوم 4 ونموذجية جدا في اليوم 6. داخل الحيوانات المستنسخة، تحافظ الخلايا على اتصال وثيق مع بعضها البعض. مناعة مع الأجسام المضادة ضد علامة NSPC Nestin وعلامة الخلايا العصبية β-tubulin الثالث ينبغي أن تكشف عن أن في استنساخ, معظم الخلايا هي نيستين+ NSPCs وعدد قليل جدا هي β-tubulin الثالث+ الخلايا العصبية. وعلى النقيض من ذلك، فإن النسبة المئوية لخلايا Nestin+ وβ-tubulin III+ الخلايا العصبية في استنساخ شكلت في نظام الثقافة غير المشتركة هي نفسها تقريبا (الشكل 1B، 1D،و 1E).
المراسل الكيميائي، Ac4ManNAz، هو التناظرية الأيضية ويمكن دمجها في مسار sialylation البروتين المتأصلة. جرعات عالية من Ac4ManNAz سامة للخلايا. لكل نوع محدد من الخلايا، يجب أن يتم اختبار تركيز وضع العلامات Ac4ManNAz مسبقًا لتحقيق أعلى كفاءة في وضع العلامات دون سمية خلوية كبيرة. هنا، تركيز وضع العلامات الأمثل من Ac4ManNAz لNSPC الأولية هو 100 μM. التقييم الجمعي لوفيات الخلايا المشار إليها من قبل مورفولوجيا الخلوية والنووية يشير إلى أن هذا التركيز وضع العلامات لا يسبب آثار سامة للخلايا واضحة وغير قادرة على تسمية بكفاءة NSPCs(الشكل 1C و 1D). لا تتأثر المورفولوجيا الكلونية، والتجديد الذاتي، والتمايز من NSPCs في كل من البطانية المشتركة في الثقافة ونظام الثقافة غير المشتركة(الشكل 1C، 1D،و 1E).
يمكن فحص العلامات الناجحة للـ NSPCs من قبل Ac4ManNAz بعد اقتران البيوتين بثقافة توسطت فيها تفاعل حيوي بين الأزيد وألكيين. كل خلية في ثقافة Ac4ManNAz المسمى ملطخة وتصور مع اليكسا فلور 647-streptavidin. لا توجد خلية إيجابية لأليكسا فلور 647-streptavidin تلطيخ في مجموعة التحكم DMSO. وبالإضافة إلى ذلك، فإن عينات البروتين التي أعدت من Ac4ManNAz المسمى الثقافة من قبل الاقتران البيوتين وتطهير الخرز streptavidin تظهر قوية كوماسي إشارة تلطيخ زرقاء رائعة في المواد الهلامية SDS-PAGE. وفي الوقت نفسه، لم يكن هناك سوى خلفية تلطيخ وإشارات ملزمة غير محددة في الممرات المحملة بعينات البروتين من مجموعة التحكم DMSO. وهذا يشير أيضا إلى كفاءة وضع العلامات على NSPCs من قبل Ac4ManNAz(الشكل 1F).
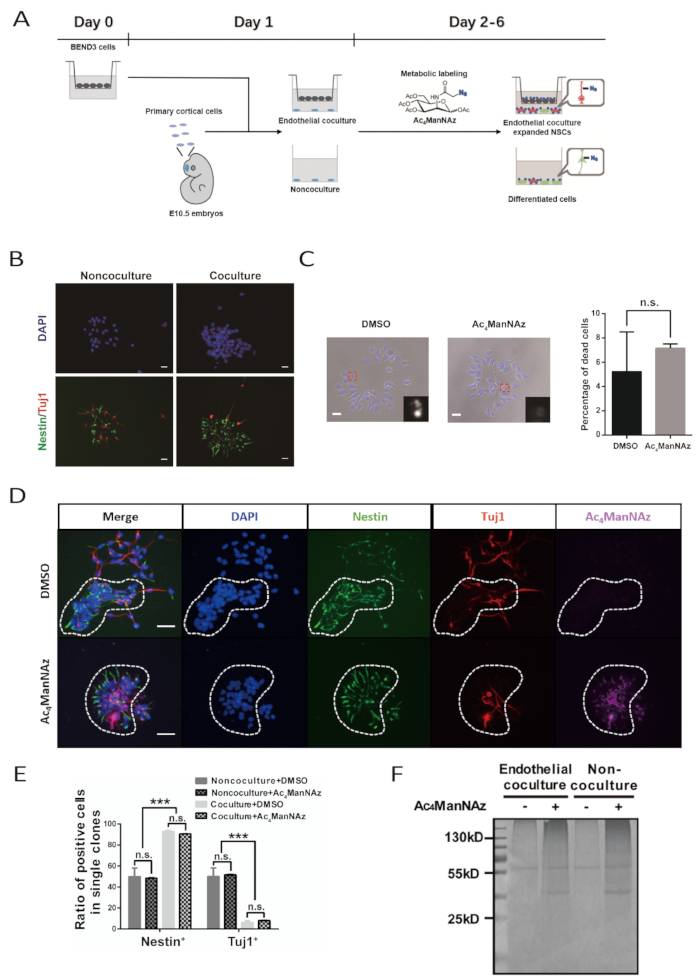
الشكل 1 تحديد علامات سطح الخلية للمركبات المضادة للخلايا والمياه الأولية بمساعدة نظام الثقافة المشتركة البطانية ووضع العلامات السيالوجية الأيضية. (أ) مخطط سير العمل للبروتوكول. وقد تم تعديل هذا الرقم من باي وآخرون. 10.يتم زرع الخلايا BEND3 في إدراج مصفوفة على D0. ويتم إعداد المراكز الصحية الوطنية القشرية الأولية واقامة نظام للثقافة المشتركة على D1. وضع العلامات الأيضية للثقافة يستمر من D2 إلى D6. يتم إعادة تغذية الثقافة على D3 و D5. (ب) الصور الفلورية المناعية للمستنسخين التي شكلتها المراكز الوطنية للاستنساخ الأولية بعد زراعة لمدة 5 أيام مع الخلايا البطانية أو بدونها. يشير شريط المقياس إلى 20 درجة (C) صور حقل مشرق للمستنسخين التي شكلتها NSPCs الأولية بعد ثقافة 5 أيام مع Ac4ManNAz أو DMSO. كانت النوى ملطخة من قبل DAPI. يشير شريط المقياس إلى 20 ميكرومتر. يشير شريط الخطأ SEM (n.s. = غير هام). (د) الصور الفلورسنت المناعية لـ NSPC شكلت استنساخات في الثقافة المشتركة البطانية مع Ac4ManNAz أو DMSO. دائرة متقطعة يرسم استنساخ عصبي واحد. يشير شريط المقياس إلى 50 ميكرومتر (E) القياس الكمي للمركبات العصبية الوطنية والخلايا العصبية المتمايزة في الحيوانات المستنسخة التي شكلتها NSPCs في البطانية المشتركة في الثقافة غير الثقافية ونظام الثقافة المشتركة مع Ac4ManNAz وضع العلامات أو التحكم DMSO. يشير شريط الخطأ إلى SEM (***p < 0.0005; n.s. = غير هام). (F) كوماسي تلطيخ الأزرق اللامع من البروتينات التي تنقيها حبات streptavidin من الخلايا العصبية المسمى مع Ac4ManNAz أو DMSO في البطانية المشتركة الثقافة ونظام غير التشارك في الثقافة. يمثل النطاق 55 كيلو D في مجموعات وضع العلامات على الرقابة بروتينات ملزمة غير محددة. (باء وجيم وهاء وواو) المقابلة لهذا البروتوكول قد تم تكييفها من باي وآخرون. 10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وتستخدم عادة علامات السطح لتسمية وتنقية أنواع محددة من الخلايا في المختبر وفي الجسم الحي17،18. اكتشاف علامات السطح يساهم إلى حد كبير في الطب التجديدي وأبحاث الخلايا الجذعية من خلال توفير الأدوات الجزيئية لإثراء انتقائي لسكان الخلايا الجذعية من الأنسجة العادية أو المرضية وأطباق الثقافة، وتقديم خلية نقية الموارد للاستخدام السريري أو دراسة الخصائص البيولوجية. ومع ذلك، كان التقدم في تطوير علامات السطح لبحوث الخلايا الجذعية العصبية بطيئا بسبب صعوبة في عزل الخلايا الجذعية من الأنسجة الأولية. ويستند البروتوكول الموصوف هنا على منصة مبسطة في المختبر. ومن خلال مقارنة المراكز الوطنية للدعم في مجال النقاط الاستراتيجية الأولية التي توسعت بثقافة مشتركة بطانية بثقافة عصبية مفاضلة، يتم تسليط الضوء على البروتينات المعبر عنها بشكل تفاضلي في المراكز الوطنية الموسعة للدعم والسماح بمزيد من التحديد. كما يوفر بروتوكولنا استراتيجية بديلة لتنقية البروتينات السطحية للخلايا عن طريق اختطاف المسار الأيضي الجوهري لتسمية السيالوجيكان مع المجموعات البيولوجية. بالمقارنة مع البروتوكولات التقليدية لتنقية البروتينات السطحية الخلية، وترتكز مزايا هذا البروتوكول من قبل اثنين من السمات المحددة: 1) انتشار السيلية على البروتينات سطح الخلية يضمن التغطية القصوى للبروتيوم سطح الخلية، و 2) خصوصية رد الفعل بين المجموعة bioorthogonal وligands لها يمنح نقاء بروتيوم السطح المكتسبة. وهكذا، ينتج بروتوكولنا عن تحليل بروتيومميك أكثر حساسية في حالة المواد التي تبدأ أقل. وقد أثبتنا جدوى هذا البروتوكول في العلامات السطحية الأولية للمراكز الوطنية للدعم في مجال الحماية. مع التعديلات المناسبة على توسيع الخلايا الجذعية في المختبر، وهذا النهج الكيميائي يمكن أن تكون متوافقة مع تحديد علامات السطح من أنواع الخلايا الجذعية الأخرى. ومن الجدير بالذكر أنه كما Ac4ManNAz هو في O-acetylated يمكن أن يؤدي إلى S-glycosylation الاصطناعية. استخدام السكريات غير الطبيعية غير الأسيتيل يمكن تجنب تشكيل القطع الأثرية وتحسين خصوصية وصحة وضع العلامات الغليكان الأيضي في الخلايا الحية19.
إعداد الخلايا السلف العصبية القشرية الأولية والخلايا البطانية هي خطوات حاسمة من البروتوكول. أولا، عند هضم الأنسجة القشرية الجنينية، يجب التحكم بعناية في وقت الهضم، وكمية الإنزيم، وقوة المناولة. الهضم المفرط وقوى القص الميكانيكية سوف تضر سلامة غشاء البلازما ومستقبلات سطح الخلية التي تتوسط انتقال إشارة لبقاء الخلية والنمو، وأنها سوف تخل أيضا استجابة NSPCs لتحفيز الخلايا البطانية وقدرتها على التجديد الذاتي. لتحقيق الهضم السليم، يجب على التجارب تنشيط البابين بالكامل ووقف الهضم بمجرد اختفاء كتل الأنسجة. ثانيا، يجب الحفاظ على خلايا BEND3 في حالة صحية لدعم إفراز. من المستحسن استخدام دفعات الخلايا BEND3 مع عدد أقل من الممرات ومرور الخلايا قبل أن تصل إلى التقاء 100٪. وهذا من شأنه أن يمنع اعتقال دورة الخلية والحساسية الناجمة عن تلف الحمض النووي المتراكمة أثناء الغمر أو بسبب الاتصال المكتظ بين الخلايا.
ارتفاع الإنتاجية تسلسل التكنولوجيا يعزز تحديد علامات سطح الخلية من خلال تحليل التعبير RNA، وخاصة بالنسبة لأنواع الخلايا بما في ذلك الخلايا الجذعية الأنسجة، والتي غالبا ما تكون موجودة في الجسم الحي بكميات صغيرة جدا لإجراء تحليل بروتيوم من قبل قياس الطيف الكتلي. على الرغم من أن تحليل RNA-seq يمكن تحديد الجينات التي تم التعبير عنها على وجه التحديد في NSPCs، فإنه قد لا يعكس حقا مستويات التعبير البروتين، لأن التعبير RNA لا يتسق دائما مع التعبير البروتين20. وبالإضافة إلى ذلك، الجزيئات الحيوية غير البروتينية التي يمكن أن تعمل كعلامات السطح غير قادرة على الكشف عن هاذين من قبل الدراسات النسخية. على سبيل المثال، oligosaccharide لويس X هو صانع سطح معروف يستخدم على نطاق واسع لتسمية الخلايا الجذعية الجنينية البشرية وNSPCs، على الرغم من أنه يمكن أن يرتبط مع بروتينات متعددة21. ولذلك، فإن تحليل قياس الطيف الكتلي المباشر ليس بعد قابلاً للاستبدال، كما أن تطوير الأساليب التي يمكن أن تجعل تحليل قياس الطيف الكتلي أكثر جدوى وملاءمة أمر ذو أهمية كبيرة بالنسبة للدراسات المقبلة.
بالإضافة إلى التسياليس، تلعب أنواع أخرى من تعديلات البروتين بعد الترجمة دورًا مهمًا في تنظيم وظائف البروتينات المعدلة. هذه التعديلات تؤثر على خصائص البروتين مثل المطابقة، نصف العمر، والتعريب تحت الخلية22،23. العديد من التعديلات البروتين ية خصوصية نوع الخلية24،25،26. مع المحتويات المتنامية من الأدوات الكيميائية، وأنواع التعديل أكثر قابلة لوضع العلامات الأيضية مع الصحفيين الكيميائية27. وبالتالي، يمكن استخدام النهج الكيميائي الموصوف هنا لدراسة الاختلافات الأخرى في تعديل البروتين بين الخلايا الجذعية والخلايا المتمايزة، مما يوضح الآليات الجزيئية وراء الحفاظ على خصائص الخلايا الجذعية والتمايز تنظيم.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
الشكل 1 باء و 1 جيم و 1 هاء و 1 واو مستنسخة من باي وآخرون . 10 سنوات بإذن من الجمعية الملكية للكيمياء. نشكر يي هاو في مختبر X.C. لتحرير الرقم. ويدعم هذا العمل المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 91753206 إلى Q. S. وX.C., No. 31371093 to Q.S., and Nos. 21425204 and 21672013 to X. C.).
Materials
| Name | Company | Catalog Number | Comments |
| BEND3 | ATCC | CRL-229 | |
| DMEM | Gibco | 11960044 | |
| L-glutamine | Gibco | 25030081 | 1% |
| Sodium pyruvate | Sigma | P5280 | 1% |
| N2 supplement | Gibco | 17502048 | 1 to 100 |
| N-acetyl-L-cysteine | Sigma | A7250 | 1 mM |
| Papain | Worthington | LS003726 | 10 U/mL |
| B27 supplement | Gibco | 17504044 | 1 to 50 |
| Poly-L-lysine | Sigma | P4707 | |
| Basic Fibroblast growth factor | Gibco | PHG0261 | 10 ng/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 1% |
| Fetal bovine serum | Gibco | 10099141 | 10% |
| HBSS | Gibco | 14175095 | |
| Tripsin-EDTA, 0.25% | Gibco | 25200056 | |
| DPBS | Gibco | 14190094 | |
| Transwell | Corning | 3450 | |
| Paraformaldehyde | Sigma | 158127 | 4% |
| Sucrose | Sangon | A100335 | |
| DAPI | Gibco | 62248 | |
| RIPA buffer | Thermo Scientific | 89900 | |
| SDS-PAGE loading buffer 2x | Solarbio | P1018 | |
| 6-well plate | Corning | 3335 | |
| Tris-Glycine protein gel | invitrogen | xp00100box | |
| Mouse monoclonal anti-Nestin | Developmental Study Hybridoma Bank | Rat-401 | 1 to 20 |
| Mouse monoclonal anti-beta-tubulin III | Sigma | T8860 | 1 to 1,000 |
| Alexa Fluor 488 goat anti-mouse IgG1 | invitrogen | A-21121 | 1 to 1,000 |
| Alexa Fluor 546 goat anti-mouse IgG2b | invitrogen | A-21143 | 1 to 1,000 |
| Albumin Bovine V | Amresco | 0332 | |
| Triton X-100 | Amresco | 0694 | |
| BCA assay kit | Thermo Scientific | 23225 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Brij97 | Aladdin | B129088 | |
| CuSO4 | Sigma | 209198 | |
| Alkyne-biotin | Click Chemistry Tools | TA105 | |
| BTTAA | Click Chemistry Tools | 1236 | |
| Ac4ManNAz | Click Chemistry Tools | 1084 | 100 µM |
| 9AzSia | synthesized in lab | ||
| Sodium ascorbate | Sigma | A4034 | |
| Methanol | Sigma | 34860 | |
| EDTA | Sangon | A100322 | |
| NaCl | Sangon | A100241 | |
| SDS | Sangon | A100227 | |
| Alexa Flour 647-conjugated streptavidin | invitrogen | S21374 | 1 to 1,000 |
| Triethanolamine | Sigma | V900257 | |
| Dynabeads M-280 Streptavidin | invitrogen | 60210 | |
| Ammonium bicarbonate | Sigma | 9830 | |
| Coomassie Brilliant Blue R-250 | Thermo Scientific | 20278 | |
| Isoflurane | RWD Life Science Co. | 970-00026-00 | |
| DNase I | Sigma | DN25 | 12 µg/mL |
| Urea | Sigma | U5378 |
References
- Weissman, I. L. Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution. Cell. 100, 157-168 (2000).
- Gage, F. H., Temple, S. Neural Stem Cells: Generating and Regenerating the Brain. Neuron. 80, 588-601 (2013).
- Gal, J. S. Molecular and Morphological Heterogeneity of Neural Precursors in the Mouse Neocortical Proliferative Zones. Journal of Neuroscience. 26, 1045-1056 (2006).
- Kawaguchi, A., et al. Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis. Development. 135, 3113-3124 (2008).
- Temple, S. The development of neural stem cells. Nature. 414, 112-117 (2001).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139, 1535-1546 (2012).
- Kriegstein, A., Alvarez-Buylla, A. The Glial Nature of Embryonic and Adult Neural Stem Cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Wang, X., Tsai, J. W., LaMonica, B., Kriegstein, A. R. A new subtype of progenitor cell in the mouse embryonic neocortex. Nature Neuroscience. 14, 555-561 (2011).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Bai, Q. R., Dong, L., Hao, Y., Chen, X., Shen, Q. Metabolic glycan labeling-assisted discovery of cell-surface markers for primary neural stem and progenitor cells. Chemical Communications. 54, 5486-5489 (2018).
- Shen, Q., et al. Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science. 304, 1338-1340 (2004).
- Qian, X., et al. Timing of CNS cell generation: a programmed sequence of neuron and glial cell production from isolated murine cortical stem cells. Neuron. 28, 69-80 (2000).
- Varki, A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins. Nature. 446, 1023-1029 (2007).
- Cheng, B., Xie, R., Dong, L., Chen, X. Metabolic Remodeling of Cell-Surface Sialic Acids: Principles, Applications, and Recent Advances. ChemBioChem. 17, 11-27 (2016).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Schmidt, J. R., et al. Pilot Study on Mass Spectrometry-Based Analysis of the Proteome of CD34+CD123+ Progenitor Cells for the Identification of Potential Targets for Immunotherapy in Acute Myeloid Leukemia. Proteomes. 6, (2018).
- Crisan, M., Dzierzak, E. The many faces of hematopoietic stem cell heterogeneity Development. Development. 144, 4195-4195 (2017).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proceedings of the National Academy of Sciences of the United States of America. 97, 14720-14725 (2000).
- Qin, W., et al. Artificial Cysteine S-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angewandte Chemie International Edition. , (2018).
- Gry, M., et al. Correlations between RNA and protein expression profiles in 23 human cell lines. BMC Genomics. 10, 365(2009).
- Hennen, E., et al. A LewisX Glycoprotein Screen Identifies the Low Density Lipoprotein Receptor-related Protein 1 (LRP1) as a Modulator of Oligodendrogenesis in Mice. Journal of Biological Chemistry. 288, 16538-16545 (2013).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7, 473-483 (2006).
- O’Brian, C. A., Chu, F. ReviewPost-translational disulfide modifications in cell signaling—role of inter-protein, intra-protein, S-glutathionyl, and S-cysteaminyl disulfide modifications in signal transmission. Free Radical Research. 39, 471-480 (2005).
- Williamson, A. J. K., Whetton, A. D. The requirement for proteomics to unravel stem cell regulatory mechanisms. Journal of Cellular Physiology. 226, 2478-2483 (2011).
- Christensen, B., et al. Cell Type-specific Post-translational Modifications of Mouse Osteopontin Are Associated with Different Adhesive Properties. Journal of Biological Chemistry. 282, 19463-19472 (2007).
- Yanagisawa, M., Yu, R. K. The expression and functions of glycoconjugates in neural stem cells. Glycobiology. 17, 57R-74R (2007).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved