Method Article
Sialoglycan의 신진 대사 표지에 의하여 1 차적인 신경 줄기 및 전구 세포의 세포 표면 마커를 확인
* 이 저자들은 동등하게 기여했습니다
요약
여기에 제시된 프로토콜은 체외 신경 내피 공동 배양 시스템과 sialoglycan의 대사 통합을 생체 장태 작용기와 결합하여 1 차적인 신경 줄기 및 전구 세포를 확장하고 그들의 표면에 레이블을 붙이는 프로토콜입니다 세포 표면 마커의 화상 진찰 또는 질량 분광분석을 위한 sialoglycoproteins.
초록
신경 줄기와 전구 세포 (NSPC)는 뇌의 복잡한 구조와 기능에 대한 세포 기초입니다. 그들은 생체 내에서 전문 틈새 에 위치 하 고 분리 하 고 생체 외에서확장 될 수 있습니다., 뇌 손상을 복구 하는 세포 이식에 대 한 중요 한 자원 으로 봉사. 그러나, NSPC는 이질적이며 분자 수준에서 명확하게 정의되지 않거나 특정 세포 표면 마커의 부족으로 인해 정제된다. 이전에 보고된 프로토콜은, 1 차적인 NSPC의 표면 sialoglycoproteome를 확인하기 위하여 신진 대사 글리칸 표지 방법과 신경 내피 공동 배양 시스템을 결합합니다. NSPC-내피동 공동 배양 시스템은 체외에서1차 NSPC의 자가 갱신 및 확장을 허용하며, 충분한 수의 NSPC를 생성합니다. 생체 오르토고그나 작용그룹. 신경 배양과 분화한 신경 배양과 내피 공동 배양에서 확장된 자가 갱신 NSPC의 sialoglycoproteome를 비교하여, 우리는 NSPC에서 풍부하게 되는 막 단백질의 목록을 확인합니다. 구체적으로, 프로토콜은 다음과 관련된다: 1) NSPC 내피 공동 문화 및 NSPC 차별화 문화의 설정; 2) 아세틸화 N-아지도아세틸만노사민 당 아지도슈가체(Ac4ManNAz)로 라벨링; 및 3) 비오토틴 컨쥬게이션은 질량 분석 분석을 위한 신경 배양 또는 단백질 추출의 고착 후 이미징을 위한 변형된 시로글리칸이다. 이어서, NSPC 농축 표면 마커 후보기는 확장된 NSPC 및 차별화된 신경 배양 모두에서 질량 분석 데이터의 비교 분석에 의해 선택된다. 이 프로토콜은 시작 물질에서 낮은 풍부의 막 단백질을 식별하기 위해 매우 민감하며 적절한 수정을 통해 다른 시스템에서 마커 발견에 적용 할 수 있습니다.
서문
신경 줄기 세포는 줄기 세포 풀을 유지하고 뉴런과 glia로 분화하기 위하여 자기 갱신할 수 있는 다능한 세포 인구로 정의됩니다. 그(것)들은 신경계에 있는 중요한 세포 모형이고 병에 걸린 및 상해한 두뇌로 세포 이식을 통해 재생 의학에 있는 중대한 치료 잠재력을 제안할 수 있습니다1,2. 발달이 진행됨에 따라, 신경 줄기 세포 집단은 이질적인된다 3,4,뇌의 신경 줄기 세포의 비율은 점차 감소5. 일반적으로 말하자면, 배아 신경 줄기 세포 및 다른 신경 전구 세포는, 총칭하여 신경 줄기 및 전구 세포(NSPC)라고 불리며, 마우스6의발아 지역, 심실 영역 및 심실 영역에 위치한다. 배아 뇌에서, 신경 줄기 세포는 중간 전구 세포 (IPC)를 통해 직간접적으로 뉴런을 생성하고, 일부 종에서는 외부 심실 영역 전구 (oRGs)7,8. 특정 분자 시그니처, 형태, 줄기 세포 틈새 시장 내의 위치, 및 분화 전위는 모두 뇌 조직 발생 및 임상 응용 분야에서 각 아류형의 역할을 결정한다9. 그러나 현재 사용 가능한 세포 표면 마커는 NSPC의 다른 아류형을 명백하게 구별하고 정화할 수 없으므로 이러한 하위 유형에 대한 이해와 활용을 제한할 수 있습니다.
기본 NSPC 표면 마커의 식별은 세 가지 주요 장애물에 의해 제한됩니다. 첫 번째는 조직에 있는 NSPC의 제한된 세포 수입니다, 일반적인 질량 분석 분석을 위한 세포 표면 단백질 견본을 준비하는 것을 어렵게 만듭니다. 두 번째 제한은 아류형 특이적 막 단백질 데이터를 생성하기 위한 순수 세포 아류형을 생성하는 데 어려움이 있다는 것입니다. 마지막으로, 세 번째 과제는 전체 세포 단백질에서 세포 표면 단백질의 낮은 비율이며, 이는 질량 분석 분석에 의한 검출 감도를 저해합니다.
이러한 문제를 극복하기 위해, 우리는 sialoglycoproteins10을신진 대사로 표지함으로써 1 차적인 NSPC에 있는 세포 표면 단백질을 선택적으로 풍부하게 하고 확인하기 위하여 화학proteomic 접근을 개발했습니다. 충분한 수의 NSPC를 생성하기 위해, 우리는 투과성 지원을 사용하여 마우스 뇌 내피 세포주와 NSPC를 공동 배양함으로써 시험관 내 미분화 상태에서 1 차 배아 NSPC를 확장하고 유지하기 위해 확립 된 프로토콜을 활용했습니다. 매트릭스 삽입(예를 들어, 트랜스 웰) 시스템11. 대조적으로, 내피 세포 없이 단독으로 배양된 NSCs는 분화된 자손을생성한다11,12. 따라서, 이 2개의 배양 시스템에서 단백질 견본은 NSPC 및 분화한 뉴런에서 차별적으로 발현되는 단백질을 확인하기 위하여 비교적으로 분석될 수 있습니다. 대부분의 세포 표면 단백질은 시알산13에의해 변형되기 때문에, 부자연스러운 시알산 전구체 아날로그 N-아지도아세틸만사민-테트라아실화(Ac4ManNAz)는 내인성, 새로 내인성, 새로 내인성 대사 경로를 납치하는 데 사용되었다. 합성된 시로그리칸은 아지도 그룹으로 표시되어 화학적손잡이(14)를생성한다. 아지도-알키네 매개 생체 부착 바이오오르토고날 반응을 통해, 이는 비오틴을 시로그칸으로 컨쥬게이스화하고, 세포 표면 단백질은 스트렙타비딘 결합 플루오로포르(14)를 통해 프로테오믹 식별을 위해 가시화및 농축될 수 있다.
여기서, 우리는 비-코배양 시스템에서 내피 공동 배양 및 분화 세포에서 확장된 NSPC로부터의 표면 sialoglycoproteome의 SDS-PAGE 겔 분석의 염색을 수행한다. 우리는 또한 proteomic 비교를 위한 2개의 배양 시스템에서 표면 sialoglycoproteome를 선택적으로 정화합니다. 우리의 프로토콜은 기존의 원심분리 기반 세포 표면 정화 프로토콜(15)과비교하여 특정 태그 컨쥬게이션 및 친화성을 통해 표면 단백질 추출 절차를 감소시킴으로써 추출 효능을 증가시킵니다. 정화. 한편, 시알릴레이션이 주로 세포 표면 단백질에서 발생한다는 전제하에 세포 표면 단백질의 추출 순도를 증가시킨다. 내피 인자가 확장 된 NSPC의 분화를 완전히 차단할 수는 없지만, 공동 배양과 분화 배양 사이의 비교 연구는 줄기 세포가 풍부한 표면 단백질을 필요없이 정확하게 찾아낼 수있는 편리한 방법을 제공합니다. FACS16에의해 정제 된 NPC에서 단백질을 분석합니다. 우리는 이 접근이 적당한 수정을 가진 그밖 시스템에 있는 표면 단백질의 연구 결과에 적용될 수 있다고 믿습니다.
프로토콜
이 연구에 사용된 모든 동물 프로토콜은 칭화 대학의 IACUC(기관 동물 관리 및 사용 위원회)에 의해 승인되었으며 IACUC의 지침에 따라 수행되었습니다. 칭화대학의 실험실 동물 시설은 AAALAC(실험실 동물 보호 국제 평가 및 인증 협회)의 인증을 받았습니다. 배아의 발판을 위해, 확인된 질 플러그의 정오는 배아일 0.5(E0.5)로 계산되었다.
참고: 모든 세포는 37°C 및 5%CO2의조건하에서 세포 인큐베이터에서 배양된다.
1. 투과성 지원 삽입에서 마우스 내피 문화의 준비
참고: BEND3 셀은 제조업체의 지침에 따라 유지됩니다.
- FBS 50 mL과 페니실린 스트렙토마이신 5 mL을 DMEM 500 mL에 추가하여 BEND3 세포 배지 (BM)를 준비하고 잘 섞습니다.
- 접시에서 배지를 흡인하고 BEND3 세포 배양을 PBS 1 mL로 1회 세척한다. 0.25% 트립신-EDTA의 1 mL을 세포에 넣고 37°C에서 4분 동안 세포를 배양합니다.
- Bm 1 mL을 세포에 추가하여 트립신-EDTA를 중화시키고 부드럽게 위아래로 피펫을 사용하여 세포를 완전히 해리시딩합니다. 400 x g에서5 분 동안 실온 (RT)에서 원심 분리에 의해 새로운 15 mL 원엽 튜브 및 펠릿으로 세포 현탁액을 옮긴다.
- 튜브에서 상류를 흡인하고 신선한 BM의 9 mL로 세포를 다시 중단 한 다음 1 mL의 세포 현탁액을 하나의 투과성 지지서에 추가합니다. 매트릭스의 하단 챔버에 잘 당 신선한 BM의 또 다른 2 mL을 추가합니다. 하루 동안 세포를 배양하십시오.
2. 마우스 기본 피질 NSPC 문화의 준비
-
배양판, 파파인 소화배지 및 피질 부착 배양 배지(AM)의 제조
- 6웰 플레이트에 1mL의 PLL 용액을 추가하여 폴리-L-리신(PLL)으로 6웰 플레이트를 코팅합니다. 그런 다음 RT에서 플레이트를 30 분 동안 배양합니다.
- PLL 용액을 15mL 원엽 튜브로 옮김. 이중 증류수로 플레이트를 3회 세척합니다. 접시를 공기건조시키고 사용할 때까지 따로 두십시오.
- 파파인 50 U, L-글루타민 50 μL, 100 mg/mL 아세틸-L-시스테인 5 mLDMEM에 50 μL을 추가하여 파파인 소화 배지를 준비합니다. 배지를 간략하게 혼합하고 효소 활성화를 위해 30분 동안 37°C로 데우다.
- 피질 세포 부착 배양 배지(AM) 준비): L-글루타민 500 μL, 피루바트 나트륨 500 μL, 100 mg/mL N-아세틸-L-시스테인 500 μL, N2의 500 μL, B27의 1 mL, 5 μL의 100 μG/mL을 GL 에 추가합니다. 매체를 잘 섞고 사용하기 전에 37°C로 데우면 됩니다.
-
1 차적인 대뇌 피질 세포의 준비 및 후속 도금
- 자궁 경부 탈구에 의해 E10.5 시간 임신 마우스를 희생.
참고: E10.5에서, 세포의 대다수는 대뇌 피질에 있는 NSPC를 증식하고, 시험관에서 자손의 큰 클론을 초래합니다. - 복부를 75 % 에탄올로 살균하십시오. 미세 한 가위와 미세 톱니 모양의 집게를 사용하여 중간 선의 오른쪽을 따라 피부와 기본 근육을 절단하여 복부를 엽니 다. 톱니 모양의 집게로 복강에서 자궁을 부드럽게 제거하고 미세 한 가위로 복강에서 잘라냅니다.
- 10cm 페트리 접시에 미리 차가운 HBSS 40 mL로 자궁을 씻으세요. 그런 다음 자궁을 새로운 10cm 페트리 접시로 옮기고 40 mL의 미리 차가운 HBSS로 다시 씻습니다.
- 40 mL의 미리 차가운 HBSS와 새로운 10cm 페트리 접시에 자궁을 전송합니다. 자궁과 양막에서 배아를 제거 한 다음 보석으로 트렁크에서 배아의 머리를 잘라냅니다.
- 40 mL의 미리 차가운 HBSS로 머리를 씻고 40mL의 미리 차가운 HBSS로 머리를 새로운 10cm 페트리 접시로 옮김. 주얼러 마이크로포스프를 사용하여 뇌를 덮는 피부와 연골을 벗겨낸 다음 대뇌 피질 피질을 잘라내고 미리 차가운 HBSS가 있는 15mL 원추형 튜브에서 수집합니다.
- 4 °C 및 300 x g에서3 분 동안 원심 분리에 의해 피신자 펠트. 튜브에서 상류자를 흡인한 다음 활성화된 파파인 소화 배지와 15 μL의 4 mg/mL DNase I를 조직 펠릿에 추가합니다.
- 부드러운 소용돌이에 의해 잠시 조직 펠릿을 다시 일시 중단. 37 °C에서 30 분 동안 조직을 배양하십시오. 이 시간 동안 10 분마다 짧은 소용돌이로 조직을 느슨하게하십시오.
참고: 소화가 끝나면 튜브에 눈에 보이는 조직 조각이 없어야합니다. - 4 °C 및 450 x g에서10 분 동안 원심 분리에 의해 피질 세포를 펠렛. 튜브에서 상류를 흡인하고 미리 냉각 된 DMEM으로 세포 펠릿을 씻습니다. 이 단계를 한 번 반복합니다.
참고: 소화와 세척 하는 동안, 강한 전단 힘으로 세포를 손상 하지 않도록 대략 조직 및 세포 펠 릿을 피펫 하지 않도록 주의. - 튜브에서 상류를 흡인한 다음 미리 냉각된 HBSS 1.5 mL을 튜브에 추가합니다. 부드러운 파이펫팅으로 피질 세포 펠릿을 단일 세포로 해리하십시오. 혈세포계로 셀 번호를 계산합니다.
- 오전 2mL, 잘 당 2 x 104 개의 피질 세포를 6 웰 플레이트에 추가하십시오. 37°C및 5%CO2에서 플레이트를 3시간 동안 배양하여 세포가 플레이트에 부착하도록 하였다.
- 자궁 경부 탈구에 의해 E10.5 시간 임신 마우스를 희생.
3. 신경 내피 공동 문화 및 Ac4ManNAz 라벨링 시스템 설정
- 인서트에 BEND3 세포를 도금한 후, 먼저 바닥 챔버에 배지를 부드럽게 흡인한 다음 인서트를 삽입합니다. 미리 데운 DMEM으로 인서트를 3회 세척합니다. 미리 데운 DMEM으로 헹구어 인서츠의 외부 표면을 세척합니다.
- 미리 데운 AM 1 mL을 하나의 인서트에 추가한 다음, 1차 피질 세포로 인서트를 우물로 옮김을 옮김을 옮김을 옮김을 넣습니다. 12시간 동안 37°C 및 5%CO2에서 공동 배양체를 배양한다.
- 200 mM의 재고 농도를 달성하기 위해 DMSO에서 Ac4ManNAz를 용해하십시오. 12 시간 신경 내피 공동 배양을 설정 한 후, 바닥 챔버 당 Ac4ManNAz 스톡 1 μL을 추가하고 삽입 당 0.5 μL의 스톡을 공동 배양에 추가합니다. 접시를 즉시 부드럽게 흔들어 중간 을 잘 섞습니다. 컨트롤 셀의 경우 동일한 볼륨의 DMSO를 추가합니다.
- 37°C 및 5%CO2에서5일 동안 세포를 배양한다. 재공급 매체(RM)로서 10x bFGF로 오전을 준비합니다. 이 시간 동안, 삽입 당 RM의 100 μL을 추가하고 내피 및 신경 세포를 격일로 재공급하기 위해 바닥 챔버 당 RM의 200 μL을 추가합니다. 재공급 중에 Ac4ManNAz 또는 DMSO를 배양에 공급하지 마십시오.
4. 확장된 1차 NSPC 및 분화된 뉴런에서 시로골단백질의 면역형광 염색
- 이중 증류수에서 1.5 mM CuSO4 및 9 mM BTTAA를 포함하는 BTTA-CuSO4 복합 단지 1 30x 재고를 준비하십시오. 50 μM 비오틴-알킨, 2.5 mM 나트륨 아스코르브산, 1x BTTAA-CuSO 4 복합체를 함유한 갓 비오틴 컨쥬게이드 완충액1을 PBS에 준비합니다.
- 공동 배양 플레이트에서 인서트를 제거합니다. 배양 배지를 바닥 우물로부터 흡인하고 미리 온난한 PBS로 신경 세포를 한 번 세척한다.
- 우물에서 PBS를 흡인합니다. 미리 냉각된 4% 파라포름알데히드 PBS 용액 1 mL을 세포에 잘 넣고 RT에서 세포를 10분 동안 고정시다. 그런 다음 미리 냉각된 PBS로 세포를 3회 세척합니다.
- 우물에서 PBS를 흡인하고 새로 제조된 비오틴 컨쥬게이스 버퍼 1 mL을 세포에 잘 당 1mL를 첨가한다. 10 분 동안 RT에서 세포를 배양하십시오.
- 웰에서 반응 버퍼를 흡인합니다. PBS로 세포를 3 회 씻으하십시오. 1% FBS 및 1 μg/mL 알렉사 플루어 647-스트렙타비딘을 함유하는 염색 완충제를 준비한다. 세포에 잘 당 염색 버퍼의 1 mL를 추가하고 30 분 동안 RT에서 세포를 인큐베이션.
- 미리 냉각된 PBS로 웰 및 세척된 세포로부터 염색 완충제를 3회 흡인한다. PBS에서 5% BSA 및 0.3% 비이온성 세제-100을 함유하는 차단 버퍼를 준비한다. 잘 세포에 잘 당 차단 버퍼의 1 mL를 추가하고 10 분 동안 RT에서 배양.
- 항네스팅 및 항β-tubulin III 항체를 각각 1:20 및 1:1,000의 비율로 차단 완충제로 함께 희석시킴으로써 1차 항체 용액을 준비한다. 웰에서 차단 버퍼를 제거하고 세포에 잘 당 1 mL의 기본 항체 용액을 추가합니다. 세포를 밤새 4°C에서 배양합니다.
- 웰에서 1 차 항체 용액을 제거하십시오. 미리 냉각된 PBS로 세포를 3회 세척합니다. 알렉사 플루어 488 염소 항 마우스 IgG1, 알렉사 플루어 546 염소 안티 마우스 IgG2b, 및 DAPI를 1:1,000의 희석시 차단 완충액으로 함께 희석시킴으로써 이차 항체 용액을 준비한다. 우물에서 PBS를 흡인하고 세포에 잘 당 1 mL 이차 항체 용액을 추가합니다. 2 시간 동안 RT에서 세포를 배양하십시오.
- 우물에서 항체 용액을 흡인하고 미리 냉각 된 PBS로 세포를 3 회 세척하십시오. 그런 다음 셀이 이미지 캡처에 사용할 수 있습니다.
5. 확장된 1차 NSPC 및 분화 뉴런에서 Sialoglycoproteins의 정화
- 이중 증류수에서 1.5 mM CuSO4 및 3 mM BTTAA를 포함하는 BTTAA-CuSO4 복합 단지 2 15x 주식을 준비하십시오. 이중 증류수에서 4% SDS 및 10 mM EDTA를 함유하는 단백질 재현탁액 완충액 A를 준비; pH 7.4를 가진 이중 증류수에서 150 mM NaCl, 50 mM 트리에탄올아민 및 1% 폴리옥시에틸렌 올레에테르(예를 들어, Brij97)를 함유하는 단백질 재현탁액 완충제 B. 사용하기 전에 완충제 A:완충액 B = 1:8(vol/vol)을 혼합하여 전체 단백질 재서스펜션 버퍼를 준비한다. PBS에서 2% SDS를 함유하는 단백질 세척 완충제 1을 준비; 250 mM암모늄 중탄산염(ABC)에서 8M 우레아를 함유하는 단백질 세척완충제; 및 PBS에서 2.5 M NaCl을 함유하는 단백질 세척 완충제 3.
- 공동 배양 플레이트에서 인서트를 제거합니다. 배양 배지를 바닥 우물로부터 흡인하고 미리 냉각된 PBS로 신경 세포를 한 번 세척한다.
- 우물에서 PBS를 흡인하고 플레이트에 잘 당 미리 냉각 RIPA 버퍼의 200 μL을 추가합니다. 접시를 얼음에 5 분 동안 배양. 단백질 용해를 1.5 mL 튜브로 수집합니다. 4 °C 및 12,000 x g에서10 분 동안 원심 분리에 의해 세포 파편을 펠렛.
- 상급체를 새로운 1.5 mL 튜브로 옮김. 제조업체의 지침에 따라 BCA 키트로 단백질 농도를 결정합니다. 단백질 농도를 1 mg/mL로 조정합니다.
- 100 μM 알킨-비오틴, 2.5 mM 아스코르브산 나트륨, 1x BTTAA-CuSO4 복합체 2 -1 mL의 단백질 용해를 넣고 용액을 잘 섞습니다. 1 시간 동안 RT에서 믹스를 배양하십시오.
- 반응 용액을 50 mL 원추형 튜브에서 미리 냉각된 메탄올 20 mL로 옮니다. 잘 섞어서 -30°C에서 밤새 배양하여 단백질을 침전시합니다.
- 펠렛 단백질은 4 °C 및 4,500 x g에서 15 분 동안 원심 분리에 의해 침전됩니다. 미리 차가운 메탄올 20 mL로 단백질 펠릿을 두 번 씻으십시오. 튜브에서 상월체를 흡인합니다. 단백질 재현탁액 완충액 4mL로 단백질 펠릿을 다시 중단하고 단백질 재현탁액을 새로운 15 mL 원점 튜브로 옮김을 옮김을 옮김을 옮김.
- 스트렙타비딘 구슬 50 μL을 가지고 PBS로 3 번 씻으십시오. 씻은 구슬을 단백질 재서스펜션에 넣습니다. 20 rpm의 회전 속도로 수직 회전자에서 4 °C에서 3 시간 동안 용액을 배양하십시오.
- 단백질 세척 완충제 1, 단백질 세척 완충제 2, 단백질 세척 완충제 3, 0.5 M ABC, 0.25 M ABC 및 0.05 M ABC : 6 가지 유형의 완충으로 비드를 순차적으로 씻는다.
- 세척 후, 20 μL의 PBS로 구슬을 다시 중단하고 구슬을 새로운 1.5 mL 튜브로 옮김. 20 μL의 단백질 로딩 버퍼를 구슬에 넣고 95°C에서 10분 동안 치료합니다. 단백질 샘플은 SDS-PAGE를 실시하고 제조업체의 지침에 따라 Coomassie 화려한 파란색 R-250으로 염색해야합니다. 질량 분석 분석을 위해 Coomassie 브릴리언트 블루 R-250으로 표시된 대로 젤로 단백질을 잘라냅니다.
결과
1 차적인 배아 NSPC의 시험관 내 확장 및 대사 표지에 대한 전체 절차는 6 일 걸립니다(그림 1A). BEND3 세포주 및 갓 분리된 1차 NSPC의 품질은 성공적인 실험의 핵심입니다. BEND3 세포는 NSPC의 자기 갱신 그리고 증식을 자극하는 수용성 요인의 근원입니다. BEND3 세포는 어떤 오염도 없고 신경 세포와 공동 배양하기 전에 최소한의 세포 사멸로 활발하게 분할된다는 것을 보장해야 합니다. 1차 NSPC는 해리 시 과도한 손상을 방지하기 위해 신중하게 준비해야 합니다. 손상된 NPC는 여전히 성장하고 차별화 할 수 있습니다. 그러나, 그들은 줄기를 유지 하 고 확장 내 피 자극에 잘 응답 할 수 없습니다. 프로토콜이 1 차 적인 배양 매체에 항생제의 추가를 건의하지 않기 때문에, 세포 배양 도중 무균되기 위하여 추가 주의를 취해야 합니다.
성공적인 내피 공동 문화는 NSPC가 큰 시트 와 같은 클론을 형성하도록 이끌 것입니다. 이러한 특징적인 복제 모양은 4일째에 분명하게 드러나며 6일째에 매우 일반적입니다. 클론 내에서 세포는 서로 밀접한 접촉을 유지합니다. NSPC 마커 네스테인 및 뉴런 마커 β-tubulin III에 대하여 항체를 가진 면역염색은 클론에서, 세포의 대부분은 네스테틴+ NSPC이고 거의 β-tubulin III+ 신경 세포이다는 것을 밝혀야 한다. 대조적으로, 비-공동 배양 시스템에서 형성된 클론에서 네스테인+ 세포 및 β-tubulin III+ 뉴런 세포의 백분율은 거의 동일하다(도1B, 1D,및 1E).
화학 리포터, Ac4ManNAz는 대사 유사체이며 본질적인 단백질 시알레이션 경로에 통합될 수 있습니다. Ac4ManNAz의 고용량은 세포에 독성이 있습니다. 세포의 각 특정 유형에 대해, Ac4ManNAz의 라벨링 농도는 유의한 세포 독성 없이 가장 높은 라벨링 효율을 달성하기 위해 사전 시험되어야 한다. 여기서, 1차 NSPC에 대한 Ac4ManNAz의 최적화된 라벨링 농도는 100 μM이다. NSPC에 효율적으로 레이블을 지정할 수있습니다(그림 1C 및 1D). 내피 공동 배양 및 비 공동 배양 시스템 모두에서 NSPC의 클론 형태, 자기 갱신 및 분화 전위는 영향을 받지않는다(도 1C, 1D,및 1E).
Ac4ManNAz에 의한 NSPC의 성공적인 라벨링은 아지드와 알키네 사이의 생체 부착 반응에 의해 매개된 배양에 비오틴을 컨쥬게이팅한 후에 검사될 수 있다. Ac4ManNAz 표지 배양내의 모든 세포는 알렉사 플루어 647-스트렙타비딘으로 염색되고 시각화됩니다. 어떤 세포도 DMSO 대조군에서 알렉사 플루어 647-스트렙타비드인 염색에 대해 양성이다. 또한, 비오틴 컨쥬게이션 및 스트렙타비딘 비드 정제에 의해 Ac4ManNAz 표지 배양물로부터 제조된 단백질 샘플은 SDS-PAGE 겔에서 강력한 쿠마시 브릴리언트 블루 염색 신호를 보여준다. 한편, DMSO 대조군으로부터의 단백질 샘플로 적재된 차선에는 염색 배경 및 비특이적 결합 신호만 있었다. 이는 또한 Ac4ManNAz(그림1F)에의한 NSPC의 효율적인 라벨링을 나타낸다.
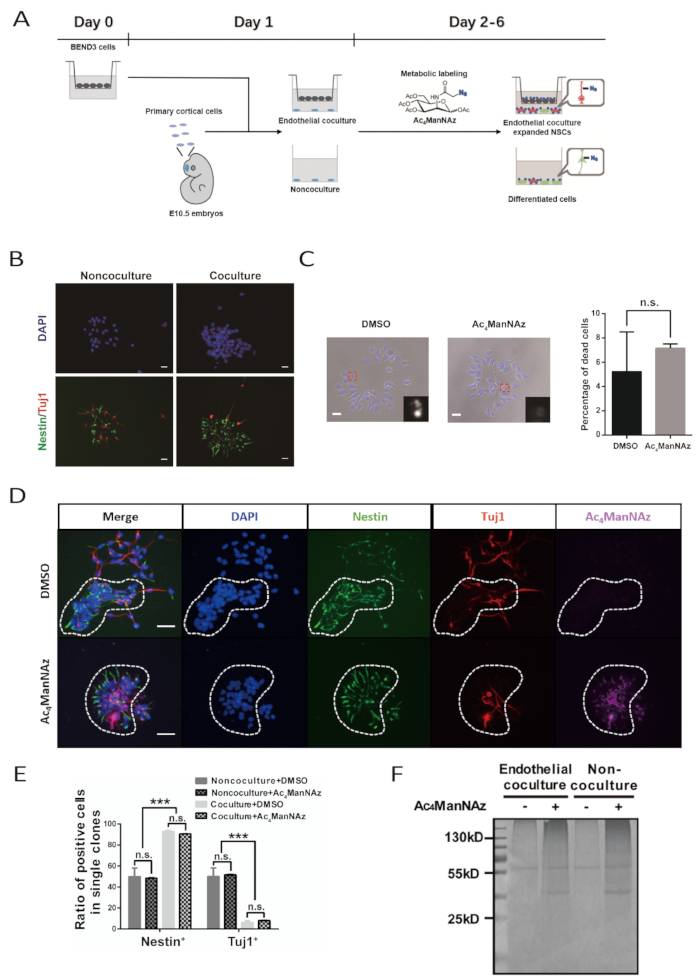
그림 1 : 내피 동배 시스템 및 대사 시로글리칸 라벨링에 의해 보조되는 1차 NSPC용 세포 표면 마커 식별. (A) 프로토콜에 대한 워크플로의 회로도입니다. 이 수치는 바이 외에서 수정되었습니다. 10. BEND3 셀은 D0의 매트릭스 인서트에 시드됩니다. 1 차적인 피질 NSPC의 준비 및 공동 문화 시스템의 설치는 D1에 수행됩니다. 배양의 신진 대사 라벨은 D2에서 D6까지 지속됩니다. 배양 재공급은 D3 및 D5에서 수행된다. (B) 내피 세포의 유무에 관계없이 5일 배양 후 1차 NSPC에 의해 형성된 클론에 대한 면역형광 이미지. 배율 막대는 Ac4ManNAz 또는 DMSO를 사용하는 5일 배양 후 기본 NSPC에 의해 형성된 클론에 대한 20 μm. (C) 밝은 필드 이미지를 나타냅니다. 핵은 DAPI에 의해 반화되었다. 축척 막대는 20 μm를 나타냅니다. 오류 표시줄은 SEM(n.s. = 중요하지 않음)을 나타냅니다. (d) NSPC에 대한 면역형광 이미지는 Ac4ManNAz 또는 DMSO와 내피 공동 배양에서 클론을 형성하였다. 파선 원은 단일 신경 복제본을 구분합니다. 스케일 바는 Ac4ManNAz 라벨링 또는 DMSO 대조군을 가진 내피 공동 배양 및 비-공동 배양 시스템에서 NSPC에 의해 형성된 클론에서 NSPC 및 분화된 뉴런의 50 μm. (E) 정량화를 나타낸다. 오류 표시줄은 SEM(***p< 0.0005; n.s. = 중요하지 않음)을 나타냅니다. (F) 쿠마시 브릴리언트 블루 염색단백질은 내피 공동배양 및 비코배양 시스템에서 Ac4ManNAz 또는 DMSO로 표지된 신경세포로부터 스트렙타비딘 비드에 의해 정제된다. 대조군 라벨링 군에서 의 55 kD 대역은 비특이적 결합 단백질을 나타낸다. (B, C, E 및 F)는 바이 외로부터 적응되었다. 10. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
표면 마커는 일반적으로 시험관 내 및 생체 내 특정 세포 유형을 라벨화하고 정화하는 데 사용되며17,18. 표면 마커의 발견은 정상 또는 병리학 조직 및 배양 접시에서 줄기 세포 집단을 선택적으로 풍부하게하는 분자 도구를 제공함으로써 재생 의학 및 줄기 세포 연구에 크게 기여하고 정제 된 세포를 제공합니다. 생물학적 특성의 임상 적 사용 또는 연구를위한 자원. 그러나, 신경 줄기 세포 연구를 위한 표면 마커 개발에 있는 진행은 1 차적인 조직에서 줄기 세포를 분리에 있는 어려움 때문에 느렸습니다. 여기서 설명된 프로토콜은 단순화된 체외 플랫폼을 기반으로 합니다. 내피 동문화에 의해 확장된 1차 NSPC를 분화신경 배양에 비교함으로써, 확장된 NSPC에서 분과적으로 발현되는 단백질이 강조되고 추가 식별이 가능합니다. 우리의 프로토콜은 또한 생체 대각선 그룹으로 sialoglycan를 표시하는 본질적인 신진 대사 통로를 납치해서 세포 표면 단백질을 정화하는 대체 전략을 제공합니다. 세포 표면 단백질을 정화하기 위한 전통적인 프로토콜과 비교하여, 이 프로토콜의 장점은 두 가지 특정 특징으로 뒷받침됩니다: 1) 세포 표면 단백질에 대한 시알릴레이션의 보급은 세포 표면 단백질의 최대 커버리지를 보장하며, 및 2) 생체장고나와 이의 리간드 사이의 반응 특이성은 획득된 표면 프로테오메의 순도를 부여한다. 따라서, 우리의 프로토콜은 덜 시작 물질의 경우 더 민감한 프로테오믹 분석을 초래한다. 우리는 1 차적인 NSPC 표면 마커에서 이 프로토콜의 타당성을 입증했습니다. 시험관내 줄기세포 확장에 대한 적절한 수정으로, 이 화학요법 접근법은 다른 줄기 세포 유형의 표면 마커 를 식별하는 것과 호환될 수 있다. Ac4ManNAz가 O-아세틸화되어 있어 인공 S-글리코실화로 이어질 수 있다는 점은 주목할 만합니다. 부자연스럽지 않은 부자연성 당의 사용은 유물 형성을 피하고 살아있는 세포에서 대사 글리칸 라벨링의 특이성 및 타당성을 향상시킬 수있다 19.
1 차적인 피질 신경 전구 세포 및 내피 세포의 준비는 프로토콜의 중요한 단계입니다. 첫째, 배아 피질 조직을 소화 할 때 소화 시간, 효소의 양 및 취급 강도를 신중하게 제어해야합니다. 과도한 소화 및 기계적 전단력은 세포 생존과 성장을위한 신호 변환을 중재하는 플라즈마 멤브레인 및 세포 표면 수용체의 무결성을 손상시키며 NSPC의 반응성을 방해합니다. 내피 세포와 자기 갱신 능력. 적절한 소화를 달성하기 위해 실험자는 파파인을 완전히 활성화하고 조직 블록이 사라지자마자 소화를 중단해야합니다. 둘째, BEND3 세포는 분비를 지지하기 위해 건강한 상태로 유지되어야 한다. 100% 합류에 도달하기 전에 더 적은 통로를 가진 BEND3 세포 배치를 사용하고 세포를 통과하는 것이 좋습니다. 이것은 세포 사이 과밀한 접촉 도중 축적된 DNA 손상에 기인한 세포 주기 체포 그리고 노화를 방지할 것입니다.
높은 처리량 시퀀싱 기술은 RNA 발현을 분석하여 세포 표면 마커의 식별을 향상시킵니다, 특히 조직 줄기 세포를 포함하여 세포 모형을 위해, 수시로 단백질 분석을 능력을 발휘하기 위하여 너무 작은 양에 있는 생체 내에서 나타나 질량 분석. RNA-seq 분석은 NSPC에서 구체적으로 발현되는 유전자를 식별할 수 있더라도, RNA 발현이 항상 단백질 발현20과일치하지 않기 때문에 단백질 발현 수준을 진정으로 반영하지 않을 수 있다. 또한, 표면 마커로서 작동할 수 있는 비단백질 생체분자는 전사학 연구에 의해 검출될 수 없다. 예를 들어, 올리고당 루이스 X는 다중 단백질21과연관될 수 있음에도 불구하고 인간 배아 줄기 세포 및 NSPC에 라벨을 붙이는 데 널리 사용되는 잘 알려진 표면 제조기이다. 따라서 직접 질량 분석 분석은 아직 대체할 수 없으며 질량 분석 분석을 보다 실현 가능하고 편리하게 만들 수 있는 방법의 개발은 향후 연구에 큰 관심을 불러 큽니다.
시알릴화 이외에, 번역 후 단백질 수정의 그밖 모형은 수정한 단백질의 기능을 통제에 있는 중요한 역할을 합니다. 이러한 변형은 형태, 반감기 및 세포외국소화22,23과같은 단백질 특성에 영향을 미친다. 몇몇 단백질 변형은 세포 유형 특이성24,25,26. 화학 툴박스의 내용이 증가함에 따라, 더 많은 변형 유형이 화학기자(27)와함께 대사 라벨링에 적합하다. 따라서 여기에 설명된 화학적 접근법은 줄기 세포와 분화 세포 사이의 단백질 변형에 대한 다른 차이점을 연구하는 데 사용될 수 있으며, 줄기 세포 특성 및 분화 유지의 뒤에 분자 메커니즘을 보여줍니다. 규제.
공개
저자는 공개 할 것이 없습니다.
감사의 말
그림 1B, 1C, 1E 및 1F는 바이에서 재현 외 . 10개 왕립 화학 협회의 허가를 받아야 합니다. X씨연구소의 이하오씨님에게 그림 편집에 감사드립니다. 이 작품은 중국 국립 자연 과학 재단 (Q. S. 및 X.C.에 91753206, Q.S.에 31371093, 번호 21425204 및 21672013 X.C.)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| BEND3 | ATCC | CRL-229 | |
| DMEM | Gibco | 11960044 | |
| L-glutamine | Gibco | 25030081 | 1% |
| Sodium pyruvate | Sigma | P5280 | 1% |
| N2 supplement | Gibco | 17502048 | 1 to 100 |
| N-acetyl-L-cysteine | Sigma | A7250 | 1 mM |
| Papain | Worthington | LS003726 | 10 U/mL |
| B27 supplement | Gibco | 17504044 | 1 to 50 |
| Poly-L-lysine | Sigma | P4707 | |
| Basic Fibroblast growth factor | Gibco | PHG0261 | 10 ng/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 1% |
| Fetal bovine serum | Gibco | 10099141 | 10% |
| HBSS | Gibco | 14175095 | |
| Tripsin-EDTA, 0.25% | Gibco | 25200056 | |
| DPBS | Gibco | 14190094 | |
| Transwell | Corning | 3450 | |
| Paraformaldehyde | Sigma | 158127 | 4% |
| Sucrose | Sangon | A100335 | |
| DAPI | Gibco | 62248 | |
| RIPA buffer | Thermo Scientific | 89900 | |
| SDS-PAGE loading buffer 2x | Solarbio | P1018 | |
| 6-well plate | Corning | 3335 | |
| Tris-Glycine protein gel | invitrogen | xp00100box | |
| Mouse monoclonal anti-Nestin | Developmental Study Hybridoma Bank | Rat-401 | 1 to 20 |
| Mouse monoclonal anti-beta-tubulin III | Sigma | T8860 | 1 to 1,000 |
| Alexa Fluor 488 goat anti-mouse IgG1 | invitrogen | A-21121 | 1 to 1,000 |
| Alexa Fluor 546 goat anti-mouse IgG2b | invitrogen | A-21143 | 1 to 1,000 |
| Albumin Bovine V | Amresco | 0332 | |
| Triton X-100 | Amresco | 0694 | |
| BCA assay kit | Thermo Scientific | 23225 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Brij97 | Aladdin | B129088 | |
| CuSO4 | Sigma | 209198 | |
| Alkyne-biotin | Click Chemistry Tools | TA105 | |
| BTTAA | Click Chemistry Tools | 1236 | |
| Ac4ManNAz | Click Chemistry Tools | 1084 | 100 µM |
| 9AzSia | synthesized in lab | ||
| Sodium ascorbate | Sigma | A4034 | |
| Methanol | Sigma | 34860 | |
| EDTA | Sangon | A100322 | |
| NaCl | Sangon | A100241 | |
| SDS | Sangon | A100227 | |
| Alexa Flour 647-conjugated streptavidin | invitrogen | S21374 | 1 to 1,000 |
| Triethanolamine | Sigma | V900257 | |
| Dynabeads M-280 Streptavidin | invitrogen | 60210 | |
| Ammonium bicarbonate | Sigma | 9830 | |
| Coomassie Brilliant Blue R-250 | Thermo Scientific | 20278 | |
| Isoflurane | RWD Life Science Co. | 970-00026-00 | |
| DNase I | Sigma | DN25 | 12 µg/mL |
| Urea | Sigma | U5378 |
참고문헌
- Weissman, I. L. Stem Cells: Units of Development, Units of Regeneration, and Units in Evolution. Cell. 100, 157-168 (2000).
- Gage, F. H., Temple, S. Neural Stem Cells: Generating and Regenerating the Brain. Neuron. 80, 588-601 (2013).
- Gal, J. S. Molecular and Morphological Heterogeneity of Neural Precursors in the Mouse Neocortical Proliferative Zones. Journal of Neuroscience. 26, 1045-1056 (2006).
- Kawaguchi, A., et al. Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis. Development. 135, 3113-3124 (2008).
- Temple, S. The development of neural stem cells. Nature. 414, 112-117 (2001).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139, 1535-1546 (2012).
- Kriegstein, A., Alvarez-Buylla, A. The Glial Nature of Embryonic and Adult Neural Stem Cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Wang, X., Tsai, J. W., LaMonica, B., Kriegstein, A. R. A new subtype of progenitor cell in the mouse embryonic neocortex. Nature Neuroscience. 14, 555-561 (2011).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Bai, Q. R., Dong, L., Hao, Y., Chen, X., Shen, Q. Metabolic glycan labeling-assisted discovery of cell-surface markers for primary neural stem and progenitor cells. Chemical Communications. 54, 5486-5489 (2018).
- Shen, Q., et al. Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science. 304, 1338-1340 (2004).
- Qian, X., et al. Timing of CNS cell generation: a programmed sequence of neuron and glial cell production from isolated murine cortical stem cells. Neuron. 28, 69-80 (2000).
- Varki, A. Glycan-based interactions involving vertebrate sialic-acid-recognizing proteins. Nature. 446, 1023-1029 (2007).
- Cheng, B., Xie, R., Dong, L., Chen, X. Metabolic Remodeling of Cell-Surface Sialic Acids: Principles, Applications, and Recent Advances. ChemBioChem. 17, 11-27 (2016).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Schmidt, J. R., et al. Pilot Study on Mass Spectrometry-Based Analysis of the Proteome of CD34+CD123+ Progenitor Cells for the Identification of Potential Targets for Immunotherapy in Acute Myeloid Leukemia. Proteomes. 6, (2018).
- Crisan, M., Dzierzak, E. The many faces of hematopoietic stem cell heterogeneity Development. Development. 144, 4195-4195 (2017).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proceedings of the National Academy of Sciences of the United States of America. 97, 14720-14725 (2000).
- Qin, W., et al. Artificial Cysteine S-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angewandte Chemie International Edition. , (2018).
- Gry, M., et al. Correlations between RNA and protein expression profiles in 23 human cell lines. BMC Genomics. 10, 365(2009).
- Hennen, E., et al. A LewisX Glycoprotein Screen Identifies the Low Density Lipoprotein Receptor-related Protein 1 (LRP1) as a Modulator of Oligodendrogenesis in Mice. Journal of Biological Chemistry. 288, 16538-16545 (2013).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7, 473-483 (2006).
- O’Brian, C. A., Chu, F. ReviewPost-translational disulfide modifications in cell signaling—role of inter-protein, intra-protein, S-glutathionyl, and S-cysteaminyl disulfide modifications in signal transmission. Free Radical Research. 39, 471-480 (2005).
- Williamson, A. J. K., Whetton, A. D. The requirement for proteomics to unravel stem cell regulatory mechanisms. Journal of Cellular Physiology. 226, 2478-2483 (2011).
- Christensen, B., et al. Cell Type-specific Post-translational Modifications of Mouse Osteopontin Are Associated with Different Adhesive Properties. Journal of Biological Chemistry. 282, 19463-19472 (2007).
- Yanagisawa, M., Yu, R. K. The expression and functions of glycoconjugates in neural stem cells. Glycobiology. 17, 57R-74R (2007).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유