Method Article
Sıçan kemik Iliği Osteoclast precursors yalıtım, arıtma ve farklılaşma
Bu Makalede
Özet
Osteokuzlar, hematopoetik kök hücrelerin monosit-makrophaj soylarından elde edilen dokuya özgü makrophaj polykaryonlarındadır. Bu protokol, kemik iliği hücrelerinin nasıl yalıtılmasını açıklar, böylece geleneksel yöntemlerde bulunan kazaların riskini azaltarak büyük miktarlarda osteocsürer elde edilir.
Özet
Osteositler, monosit veya makrophaj öncülerinin birleşerek oluşturduğu monoksit-makrophaj sırının büyük, multinükleated ve kemik-resorbing hücrelerdir. Aşırı kemik reorpsiyonu osteolitik hastalıklara yol açan en önemli hücresel mekanizmalardan biridir, osteoporoz dahil, periodontitis, ve periprotez Osteoliz. Osteocsürer ana fizyolojik fonksiyon hem hidroksiatit mineral bileşeni ve kemik organik matris absorbe, kemik yüzeyinde karakteristik reorpsiyon görünümünü üreten. Vücudun diğer hücrelerine kıyasla nispeten az osteocsürer, özellikle yetişkin kemiklerde. Son çalışmalar her zaman bir sorun olmuştur daha az zaman, daha olgun osteocsürer elde etmek için nasıl odaklanmıştır. İzolasyon ve kültür tekniklerinde çeşitli iyileştirmeler daha olgun osteocsürer elde etmek için laboratuvarlarda geliştirdik. Burada, özel ve basit bir cihaz kullanarak, daha az zaman içinde kemik iliği yalıtır ve geleneksel prosedür ile karşılaştırıldığında daha az çaba ile bir yöntem tanıtmak. Yoğunluk degrade santrifüjleme kullanımı ile, biz klasik yöntemlerle tanımlanır sıçan kemik iliği, tam farklılaşmış osteocsürer büyük miktarda elde.
Giriş
Kemik homeostazisi, kemik-reorbing osteoksürer ve kemik oluşturan osteoblastlar1ile düzenlenmiş karmaşık bir fizyolojik süreçtir. Osteoblastlar ve osteocsürer ile aracılı osteoblastik ve osteoklastik aktivite arasında bir denge, sırasıyla, kemik sağlığı ve homeostaz korumak için son derece önemlidir, çünkü kemik homeostazı perturbations kemik hastalıklarına yol açabilir, böyle anormal kemik büyümesi veya kemik yoğunluğu kaybı olarak. Benzersiz kemik-reorpsiyon hücreleri olarak, osteocsürer anormal kemik imha ile ilgili hastalıklarda önemlidir, osteoporoz dahil, periodontitis, ve periprotez Osteoliz2,3.
Osteoklast kültürünün gelişimi ağırlıklı olarak iki aşamaya ayrılır. Boyde et al.4 ve Chambers ve al.5 tarafından kurulan Yöntemler 1980 ' lerde ilk aşamadan oluşuyor. Hızlı remodeling dönemi olan yenidoğan hayvanların kemiklerinden nispeten bol miktarda osteocsürer elde ettiler. Osteocsürer, özel bir ortamda kemikleri birleştirerek ve karıştırarak serbest bırakılır. Ancak, bu yöntem tarafından elde edilen hücreler miktarı ve saflık düşüktür. İkinci aşama, kemik iliği6' dan elde edilen hematopoetik soy hücrelerini kullanarak, osteoklast oluşumunun uzun menzilli kültürlerinin gelişmedir. Sitokinler, 1α gibi, 25-dihidroxyvitamin D3, prostaglandin E2 (PGE-2), ve Paratiroid hormonu (PTH), hangi kültür ortamına eklenir, osteoblastlar sistemi aracılığıyla hareket/stromal hücreler osteoklast oluşumu uyarmak için7,8 . Ancak, bu yöntemle elde edilen osteocsürer saflık ve miktarı modern moleküler biyoloji araştırmalarının ihtiyaçlarını karşılamaz. Sonra, makrofaj koloni uyarıcı faktörü (M-CSF) ve reseptör aktivatörü nükleer Factor-κB ligand (rankl) keşfi daha kolay osteoclastogenesis yapmak9,10,11, ve M-CSF ve kullanma yöntemi RANKL doğrudan osteoklast oluşumu uyarmak için yaygın olarak dünya çapında kullanılır. Ancak, hala iyileştirilmesi gereken metodoloji bazı detaylar vardır.
Şu anda, en sık kullanılan osteoklast kültür yöntemi, Marino ve al.12 ve Pei et al.13tarafından açıklandığı gibi, genellikle kemik çevresindeki çevreleyen doku kaldırılması gerektirir ve ile iliği boşluğu temizlemek için sterilize iğne kullanır tamamlanmış medya. Bu süreçte bazı dezavantajları vardır, (1) kemik etrafında çevreleyen doku kaldırılması çok zaman ve büyük cerrahi tekniği gerektirir, (2) kemikler kırılgan ve kemik iliği çıkışı yol açabilir, (3) kemik iliği boşluğu olabilir floş için çok küçük ve (4) iğne sopa yaralanma riski vardır. Bu sorunlardan kaçınmak için, kemik iliği yerine kemik iliğinin kemikleri içeren tüpleri santrifüjler. Burada, daha az zamanda ve geleneksel prosedür ile karşılaştırıldığında daha az çaba ile kemik iliği yalıtır istikrarlı ve güvenli bir yöntem tanıtmak. Yoğunluk degrade santrifüjleme kullanımı ile birlikte, tam farklılaşmış osteocsürer in vitro büyük miktarlarda elde.
Protokol
Burada tarif edilen hayvanları içeren tüm yöntemler, Nanjing Çin Tıp Üniversitesi 'nin kurumsal hayvan bakımı ve kullanım Komitesi (ıayuc) tarafından onaylanmıştır.
1. Kurulum
- Birkaç boyuna kesilmiş 1 mL pipet uçları (1 cm) ve birkaç 1,5 mL mikrosantrifüjü tüpleri hazırlayın. Pipet uçları ve mikrosantrifüjlerin tüplerini 103 kPa ve 121 °C ' de 20 dakika boyunca koyun ve steril olduklarından emin olun.
- Yalıtım prosedürü sırasında izole dokularda korumak için bir kutu buz ve çeşitli steril yemekler hazırlayın.
2. kültür orta hazırlanması
- Tam kültür ortamını hazırlayın. Penisilin/streptomisin% 1 ' inin son çözeltisi ve% 10 fetal sığır serumu (FBS) içeren asgari esansiyel orta Alfa (α-MEM) kullanın.
- 0,22 μm filtre kullanarak 2,1 adımda medyayı filtreleyin.
- Kemik iliği indüksiyon ortamını hazırlayın. Çözümün 50 mL için, 10.000 ng/mL (malzeme tablosu) konsantrasyonunda 125 μL m-CSF eklemek için, tam kültür ortamının (adım 2,2 ' den) 49,875 ml 'ye kadar 25 ng/ml m-CSF ' i son bir çözüm haline getirmek.
- Osteoklast indüksiyon ortamını hazırlayın. Çözümün 50 mL için, 10.000 ng/mL (malzeme tablosu) konsantrasyonu 500 ΜL rankl eklemek Için 49,5 ml kemik iliği indüksiyon Orta (adım 2,3) son bir çözüm yapmak için 25 ng/ml M-csf ve 100 ng/ml rankl.
3. kemik Miliği-türetilen hücrelerin yalıtımı
-
Ötenazi
- Dört Sprague Dawley fareler CO tarafından euthanize2 inhalasyon servikal dislocation izledi, ve onları batırmak 75% etanol 1 dakika.
Not: Hayvanların aynı cinsiyet ve benzer bir yaş olduğundan emin olun. 2 ila 3 haftalık hayvanlar tavsiye edilir. İki fareler Santrifüjlü Yöntem için hazırlanır, diğer ikisi ise geleneksel yöntem içindir.
- Dört Sprague Dawley fareler CO tarafından euthanize2 inhalasyon servikal dislocation izledi, ve onları batırmak 75% etanol 1 dakika.
-
Geleneksel Yöntem
- Hayvanları bir dezenfektan tahtasında bir fitil konumuna yerleştirin. Steril makas kullanarak, cilt soyma için Proksimal femur küçük bir kesi (yaklaşık 1 cm) olun.
- Uyluk ve tibias dışarı dışarı incelemek. Kaval ve uyluk dikkatle ve nazikçe izole etmek için kalça, diz ve ayak bileği eklem çevresindeki bilateral bağlantı parçalarını kes. Kemik çevresindeki dokuların bir kısmını keser; dikkatli olun. Tüm süreç boyunca kaval ve uyluk kırmayın.
- Temizlenmiş kemikleri tam kültür ortamının 5 mL 'ye sahip bir çanak içine yerleştirin. Uzun kemiği steril makas ile kesip, iliği boşluğu beyaz olana kadar 10 mL komple medya ile iliği boşluğunu dikkatle temizlemek için 1 mL şırınga iğnesi kullanın.
- Hücre süspansiyonunu adım 3.2.3 'den 50 mL tüpüne aktarın ve ardından kalan dokusu kaldırmak için 70 μm filtreyle filtreleyin.
- Hücre süspansiyona 5 mL kırmızı kan hücresi lizis tamponu (malzeme tablosu) ekleyin. Hücreleri buz üzerinde 8 dakika boyunca inküyün. Sonra, hücre Pelet verim için 5 dakika 250 x g hücreleri Santrifüjü.
- Orta dışarı aspirate ve tam medya 10 ml hücreleri pelletini. Bir hemasitometre kullanarak hücreleri saymak ve bu bölümdeki adımlarda harcanan süreyi hesaplayın (Bölüm 3,2).
-
Geliştirilmiş Yöntem
- Hayvanları bir dezenfektan tahtasında bir fitil konumuna yerleştirin. Cildi soyma için steril makas ile Proksimal femur küçük bir kesi (yaklaşık 1 cm) olun.
- Uyluk ve tibias dışarı dışarı incelemek. Düzgün kemik etrafında dokularının parçası kesilmiş (tamamen kaldırmak için gerek yok). Tüm süreç boyunca kaval ve uyluk kırmayın.
- Fosfat-tamponlu tuz (PBS) 12 ml ile kaval ve uyluk durulayın ve yarısını onları kesti. Snipped kaval ve uyluk bir 1 ml pipet ucu (adım 1,1), daha sonra bir mikrosantrifüjlü tüp içine koymak ve 4 °c ' de 45 s için 1.000 x g 'de 3x santrifüjlenmiş yerleştirin.
- Santrifüjden sonra, kemiği içeren Pipet ucunu çıkarın ve kemik iliğini tüpte bırakın. Mikrosantrifüj tüpüne tam medya 200 μL ekleyin ve iliği iyice parçalayın.
- Hücre süspansiyon adım 3.3.4 bir 50 mL tüp aktarmak ve sonra, kalan doku kaldırmak için bir 70 μm süzgeci ile filtre.
- Bir hemocytometer kullanarak hücreleri saymak ve bu bölümdeki adımlarda harcanan süreyi hesaplayın (Bölüm 3,3).
4. yoğunluk degrade santrifüjleme ile arıtma
- Hücre süspansiyonunu adım 3.2.6 veya adım 3.3.5 α-MEM ile 2 mL 'ye ayarlayın.
- Bir steril silisleşmiş santrifüj Tüp hazırlayın ve 8 ml hücre ayırma çözeltisi (malzeme tablosu) tüp ekleyin.
- Hücre ayırma çözümü için adım 4,1 hücredeki süspansiyon ekleyin. Pipet ucunu tüpün iç yüzeyine uyur ve iç yüzeye 45 ° tutun. Süspansiyonu ekledikten sonra hücrelerin tabakası ile ayırma çözeltisi arasında açık bir sınır görünecektir.
Not: Operasyon büyük bakım gerektirir ve yavaş yapılması gerekir. - Katmanlı solüsyonu 30 dakika boyunca 500 x g 'de yatay santrifüjde santrifüjle yapın. Santrifüjden sonra, yukarıdan aşağıya doğru hedef hücreleri içeren bulutlu ikinci katmandan aspirasyon yapın.
Not: Santrifüjden önce santrifüj hızlandırmayı ve yavaşlamayı iptal edin. Santrifüjleme sonrası altı kat vardır; ilk katman seyreltilen tabakasıdır, ikinci katman monosit tabakasıdır, üçüncü katman mononükleer hücrelerin tabakasıdır, dördüncü katman şeffaf ayrım sıvı bir katmandır, beşinci granül hücre tabakası ve altıncı katman kırmızı hücredir Katman. - Hedef hücreleri yeni bir tüpe aktarın. Hücreleri 3x yıkamak için PBS 5 mL ekleyin. Her yıkamadan sonra, 250 x g 'de hedef hücreleri santrifüjle 5 dakika boyunca hücre Pelet verim.
- Kemik iliği indüksiyon orta ile hücre Pelet resuspend ve bir hemocytometer kullanarak hücreleri saymak. Ekleme 5 – 8 mL kemik iliği indüksiyon orta adım 2,3 son hücre çözümü elde etmek için 300.000 hücreler/mL. 24-kuyu plakasının her bir kuyusu için 1 mL ekleyin.
5. Kültür ve farklılaşma
- 37 °C ' de 24 saat boyunca hücreleri inküt ettikten sonra, orta seviyede yavaşça aspirasyon yapın ve her bir kuyu için 1 mL osteoklast indüksiyon ortamını ekleyin. Plakayı yavaşça karıştırın ve 37 °C ' de bir kuluçe yerleştirin.
- Osteoklast indüksiyon orta her 48 h değiştirin. Bunu yaparken, değiştirmek 0,8 kuyu orta ml ve hafifçe plaka kışkırtmak.
Not: Büyük, motil ve multinükleated osteoksürer, genellikle 4 – 6 gün etrafında, ters bir mikroskop altında iyi gözlemlenmelidir.
6. tartrat dirençli asit fosfataz boyama
Not: Bu İndüksiyon (Bölüm 5) başarılı olursa multinucleate osteocsürer 4 – 6 gün sonra mevcut olacaktır.
- 4 mL% 37 formaldehit, 32,5 mL aseton ve 12,5 mL 'yi bir sitrat çözeltisi ile birleştirerek, fixatif solüsyonu hazırlayın. Fixatif solüsyonu 4 °C ' de saklayın.
- Tartrat dirençli asit fosfataz (Trap) leke çözeltisi (malzeme tablosu) 50 μL sodyum nitrite, 50 μL hızlı Garnet GBC baz çözeltisi, 50 μL naftol as-bı fosfat çözeltisi, 200 μL bir asetat çözeltisi ve 100 μL ekleyerek hazırlayın 37 °C ' ye prewarmed olan 4,55 mL deiyonize su içine tartrat solüsyonu. Daha sonra, 1 dakika boyunca inversiyon hafifçe karıştırın ve 2 dakika stand izin.
- Osteocsürer başarılı indüksiyon sonra, orta Aspire, ve yavaşça PBS ile 3 kuyuları yıkayın.
- Sabitleme çözümünü oda sıcaklığına (RT) getirin. 30 s için kuyulara 2 mL fixatif çözüm ekleyin ve hücrelerin kurumasına izin vermez.
- Fixatif çözeltisi Aspire, 37 °c ' ye prewarmed olan deiyonize su ile 3x yıkayın ve sonra su Aspire.
- 37 °C ' de 1 saat için 2 mL TRAP leke çözeltisi ekleyin ve numuneyi karanlıkta tutun.
- 1 saat sonra, leke Aspire, ve yavaşça 37 °c prewarmed deiyonize su ile örnek yıkayın, ve sonra, su Aspire.
- Bir hematoksinlin çözeltisi içinde 1 dakika hücreleri karşı. Boyamadan sonra, hematoksilen çözeltisi Aspire ve hafifçe deiyonize su ile hücreleri 3x yıkayın.
- Aydınlık alan mikroskobu kullanarak görüntü osteocsürer, ve üç veya daha fazla çekirdekler ile Trap+ hücreler mor görünecektir.
7. toluidine mavi boyama kullanarak kemik Reorpsiyon assay
-
Kemik dilimleri ön tedavisi
- Mikroelektrik testere ile uzunlamasına eksen boyunca 2 cm kalınlığında dilimleri içine taze sığır femoral kemik korteks kes. Sonra, kesme ve 80 μm içine sert doku öğütücüler ile dilimleri eziyet.
- Dilimleri deiyonize su ile bir kabı ve 100 Hz ultrason 1 h için yıkayın ve 3x tekrarlayın.
- Dilimleri 2 h için% 75 alkole batırın. Sonra, alkol Aspire ve temiz bir platformda 1 saat için ultraviyole ışık için dilimleri her yan açığa.
- Hücreleri dikmeden önce, en az 2 h için kültür ortamında dilimleri batırın.
-
Toluidin mavi boyama
- Önceden işlenmiş kemik dilimleri 24 kuyu plakasına yerleştirin. 4,6 adımda belirtildiği gibi hücreleri bitki ve Bölüm 5 ' te belirtildiği gibi hücreleri teşvik.
- Osteocsürer (4 – 6 gün sonra) görünümünden sonra, dilimleri 1 mL 0,25 M amonyum hidroksit ile yıkayın ve 5 dakika boyunca her biri kemik dilimleri üzerinde rezorpsiyon çukurları analizine izin vermek için canlı hücreleri kaldırmak için 3x 'i sonlayın. Daha sonra, amonyum hidroksit çıkarın ve 2 dakika için dilim başına 1% 1 ml (WT/Vol) toluidin mavi çözüm ile dilimleri leke.
- Dilimleri PBS ile yıkayın. Rastgele beş görünümü seçin ve bir görüntü analiz yazılımı kullanarak reorpsiyon alanının yarı niceliksel analizini gerçekleştirin.
8. tarama Elektron Mikroskopisi
- 1 mL 2,5% glutaraldehit ile adım 7.2.1 kemik dilimleri önek RT 2 h için dilim başına, ve daha sonra, her biri 1 M amonyum hidroksit ile 3 dakika için dilimleri 3x sonikat hücreleri kaldırmak ve amonyum hidroksit kaldırmak için.
- PBS ile her biri 12 dakikalık kemik dilimleri 3x yıkayın.
- RT 2 h için% 1 osmik asit ile kemik dilimleri düzeltin.
- Etanol gradyan dehidrasyon gerçekleştirin, ile 50%, 70%, 80%, 90%, ve 95% etanol, için 15 her gradyan için dakika, ve daha sonra, 15 dakika boyunca isoamill asetat ile etanol değiştirin.
- Kat altın Paladyum ile dilimleri, ve daha sonra, elektron mikroskobu tarama ile analiz.
9. kalsitonin reseptörün immünofluorescence boyama
Not: Bu indüksiyon başarılı olursa multinucleate osteocsürer 4 – 6 gün sonra mevcut olacaktır (Bölüm 5).
- Orta dışarı aspirate ve hafifçe PBS ile iyi 3x yıkayın.
- Hücreleri 4 °C ' ye önceden soğutulan% 4 paraformaldehit ile 10 dakika boyunca düzeltin.
- Buz üzerinde 30 dakika için iyi başına 0,3% noniyonik yüzey madde ile 1 mL PBS ekleyin. Daha sonra, PBS 'yi% 0,3 Noniyonik yüzeyden Aspire ve buzda 30 dakika boyunca% 5 FBS ile 1 ml PBS ekleyin.
- PBS 'den aspirate ve membranları Anti-kalsitonin reseptörü (Anti-CTR) ile PBS 'de 4 °C ' de bir gece içinde 1:100 seyreltme ile inküyin.
- Solüsyonu aspirate ve membranları Alexa-488-Conjugated Anti-Rabbit IgG antikorları ile 1:1000 ' de PBS 'de 1 saat RT 'de seyreltme.
- Çözeltinin aspirate ve hafifçe PBS ile hücreleri 3x yıkayın. Hoechst 33342 ile çekirdekleri counterstain RT 3 dk için leke.
- Çözelti aspirate ve hafifçe PBS ile hücreleri 3x yıkayın. Floresans microskopi ile to yoğunluğuna uyun.
Sonuçlar
Protokolün amacı, çok sayıda osteoklast öncülerini rahat bir şekilde izole etmek ve arındırmak ve osteocsürer 'i başarılı bir şekilde teşvik etmektir. M-CSF ve RANKL ile tamamlayıcı olarak, dev osteocsürer gün 5 – 6 görüldü. Osteoksürer oluşumu, TRAP boyama ile başarıyla tespit edilmiştir (Şekil 1a). Büyük ve mor hücreler birden fazla çekirdeklerle TRAP-pozitif hücreler olarak kabul edildi (genellikle ≥ üç çekirdekler). Bu yöntem sayesinde, 24-kuyu plakasında (Şekil 1B), osteoklast başına 30 çekirdekte kadar içeren 800 osteocsürer elde etmek için tipik bir yöntemdir. Geleneksel yöntemle karşılaştırıldığında, geliştirilmiş yöntem tüm yalıtım ilerlemesine yaklaşık 20 dakika kadar kaydedilir (Şekil 1C).
Kemik reorpsiyonu etkinliğini değerlendirmek için kemik dilimleri kullanarak tipik in vitro yöntemdir. Toluidin mavi boyama yoluyla, reorpsiyon alanı açık yeşil (Şekil 2a) olarak görselleştirildi ve hesaplanır. Kemik çukurları yapısı ve özellikleri tarama elektron mikroskobu ile açıkça gözlenmiştir (Şekil 2B).
Osteoklast-specific hücre işaretleyicilerinin biri olan to, osteoksürer tanımlamak ve kemik osteoksürer oluşumunu incelemek için önemlidir. CTR 'nin pozitif ifadesi osteocsürer 'i açıkça tanımlar ve bunları makrophaj polykaryonlardan ayırır. TO, immünofluorescence tarafından tespit edildi. Yeşil renk to ifadesi ve mavi çekirdekleri (Şekil 3) belirtti.
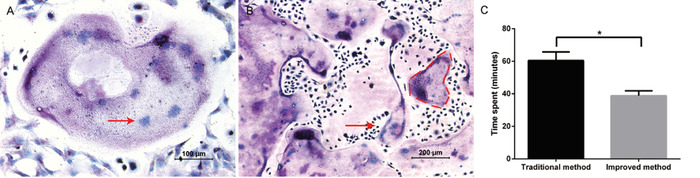
Şekil 1: kemik iliği türevi hücrelerden Osteoclastogenesis. (A) Trap boyama temsilcisi görüntüsü. 10X büyütmede aydınlık alan mikrograf, Trap pozitif olan ve 20X büyütmede gözlenen birden fazla dev, multinükleated osteocsürer gösterir. Multinükleated osteoklast içindeki çekirdeğin bir örneği kırmızı oka göre gösterilir. (B) 10X büyütmede aydınlık alan mikrograf çok sayıda trap-pozitif osteocsürer olduğunu kanıtlıyor. Büyük, multinükleated osteoklast bir örnek kırmızı kesikli çizgi tarafından özetlenmiştir. (C) iki yalıtım yönteminde harcanan zamanın karşılaştırılması. Tüm operasyonlar aynı deney grubu tarafından yapılmıştır. Veriler ± standart sapma anlamına gelir. * P < 0,05, n = 3. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
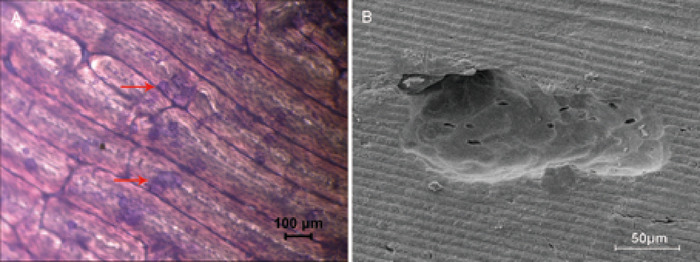
Şekil 2: kemik dilimleri tarafından kemik reorpsiyon asder. (A) 4 x büyütmede aydınlık alan micrografı kemik reorpsiyon alanı gösterir, toluidin mavi leke tarafından lekelenmiş ışık yeşil, ve yuvarlak, oval-, ya da sosis şeklinde. Kemik reorpsiyon alanının bir örneği kırmızı ok ile gösterilir. (B) 500x büyütme sırasında tarama elektron mikroskobu ile gözlenen reorpsiyon çukurları. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3: immünofluorescence lekeleme kullanarak osteocwhile 'DAKI CTR ifadesinin karakterize edilmesi. Panel, hücrelerin etrafında net bir CTR sinyali gösterir. (A) CTR-pozitif hücreler. (B) çekirdekler. (C) birleştirilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Kemik emici hastalıkların mekanizmalarını anlamanıza ve yeni terapötik ajanlar geliştirmesine yardımcı olabilecek kemik metabolizmasını incelemek isteyen herhangi bir araştırmacı için osteocsürer in vitro elde etme ve çalışma becerisi, önemli ve temel bir beceridir. Bu çalışmada, önceki yöntemlere dayalı bazı değişikliklerle ilgili bir protokol tanımlanmıştır.
Kemik iliği elde etmek için pipet uçları ve mikrosantrifüj tüpleri kullanarak, büyük ölçüde kemik iliği ve geleneksel yöntemlerle karşılaştırıldığında laboratuar personelinin iş yükü elde etme çalışma süresini azalttı. Bu arada, yöntem kemik iliği kaybı veya iğne sopa hasarı riskini önler. Bir önceki çalışmada, kemik iliği türevi hücreler izolasyondan hemen sonra kaplama12,13. Yerleşim katsayıları farklılıklarına göre kemik iliği monosit seçmek için yoğunluk gradyan santrifüjleme kullanılmıştır. Yoğunluk degrade santrifüjleme sürecinde, sınırları net kılmak için hücre ayırma ortamının eklenmesi duvar boyunca yavaşça ve dikkatlice yapılmalıdır. Ancak, teknik santrifüjün işlevi ile sınırlıdır ve bu ivme ve yavaşlama parametreleri ile ayarlanmış olup olmadığını. Tohumlama yoğunluğu osteocsürer ekimi için anahtar durumdur. Birkaç kez, protokol hatalı bir tohumlama yoğunluğu nedeniyle hücreleri kaplama başarısız oldu. Bu nedenle, 24-kuyu plakası başına yaklaşık 300.000 hücre Bu protokolde tavsiye edilir. Bu protokol aynı zamanda sıçan veya diğer hayvanların (örneğin, fare, tavşan ve tavuk) kemik iliği türevi hücrelerin çeşitli elde etmek için uygundur.
Osteocsürer aktivitesini değerlendirmek için en klasik yöntem reorpsiyon çukur tahlil olduğunu. Kaynakları yaygın olarak kullanılabilir olduğu için sığır kemik korteks genellikle reorpsiyon çukur tahlil için kullanılır. Modern bir dilimleme sistemi yardımıyla, ince kemik dilimleri daha kolay elde edebilirsiniz. Reorpsiyon çukur tahlil üç faktör vardır. Dilimler içinde başarılı bir şekilde resıkpsiyon çukur oluşturmak için, dilimler protokolde defatting için açıklandığı gibi kesinlikle tedavi edilmelidir. Buna ek olarak, sıçan osteocsürer biraz asidik ortamda reorpsiyon çukurları oluşturmak için aktive edilir, ve rezorpsiyon fonksiyonu temelde "Shut Down" pH 7,2 yukarıda düştüğünde14,15. Bu nedenle, deneylerin ilerlemesi sırasında kuluçinörün kapısını sıklıkla açmasının pH ve pCO2 değerlerinin bozulmasına neden olabilir, hatta osteocsürer16' nın rezorpsiyon fonksiyonunu etkileyen dikkat çekicidir. Son olarak, kemik dilimleri kuyuların altında kalması gerekir ve taşınmamalıdır veya tahrişi önlemek için, orta değiştirirken kadar float.
CTR, aynı zamanda Paratiroid hormonu ve sır reseptörleri17içeren 7-transmembran G-protein-birleşen reseptörlerin Sınıf II alt ailesinin bir üyesidir. TUZAK boyama ve reorpsiyon çukur tahlil yanı sıra, osteocsürer Morfoloji ve fonksiyon ile tanımlanır, ve CTR-pozitif immunolojide osteocsürer tanımlar. Şimdi, ayrıca akin halkası floresan boyama kullanabilirsiniz ve osteocsürer tanımlamak için süpernatant piridinolin bileşikleriyle çapraz bağlanarak ölçmek.
Farklı araştırmacılar deneysel teknikleri ile farklı benzerlikleri ve kemik iliği hücrelerin toplam miktarı belli olmasına rağmen, biz daha kısa sürede kemik iliği hücreleri elde, nispeten, ve sonunda, tam olarak büyük miktarlarda elde sıçan kemik iliği farklılaşmış osteocsürer.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Çin Ulusal Doğal Bilim Vakfı (81473692) tarafından Yong ma için desteklenmektedir. Yazarlar Çin tıp Nanjing Üniversitesi Klinik Tıp Ilk Koleji Tıp Araştırma Merkezi tüm personel teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
Referanslar
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır