Method Article
쥐 골 골에서의 파 골 세포 전 구체의 분리, 정제 및 분화
요약
파 골 세포는 조 혈 간세포의 대 식 세포 혈통에서 유래한 조직 특유의 대 식 세포 폴 리 에틸렌 이다. 이 프로토콜은 기존의 방법에서 발견 되는 사고의 위험을 줄이면서 많은 양의 파 골 세포를 얻을 수 있도록 골 수 셀을 분리 하는 방법을 설명 합니다.
초록
파 골 세포는 거 대 하 고, 다 핵 이며, 단 핵 구 또는 대 식 세포 전 구체의 융합에 의해 형성 되는 모노 이트-대 식 세포의 혈통을 뼈-의존 한다. 과도 한 뼈 재흡수는 골 수 질환을 선도 하는 가장 중요 한 세포 메커니즘 중 하나입니다, 골다공증을 포함 하 여, 치 주 염, 그리고 주위 인공 골 분해. 파 골 세포의 주요 생리 적 기능은 하이드 록 시 아파 타이트 미네랄 성분과 뼈의 유기 매트릭스를 모두 흡수 하 여 뼈 표면에 특징적인 재흡수 모양을 생성 하는 것입니다. 본문에 다른 세포에 비해 상대적으로 적은 파 골 균이 있다, 특히 성인 뼈에. 최근 연구는 더 짧은 시간에 더 성숙한 파 골 세포를 얻는 방법에 초점을 맞추고 있다,이는 항상 문제가 있었다. 분리 및 배양 기술의 몇몇 개선은 더 성숙한 파 골 세포를 얻기 위하여 실험실에서 개발 되었습니다. 여기에서는 특수 하 고 간단한 장치를 사용 하 여 기존 절차에 비해 적은 시간에 골 수를 분리 하는 방법을 소개 합니다. 밀도 구배 원심 분리를 사용 하 여, 우리는 고전적인 방법으로 확인 되는 쥐 골 수에서 완전히 분화 된 파 골 세포의 다량을 얻습니다.
서문
뼈 항상성은 뼈에 의해 조절 되는 복잡 한 생리 적 과정 이다-파 골 세포와 골 형성 조 골 술1. 골 아 세포 및 파 골 세포를 통해 매개 된 조 골 및 파 골의 활성 사이의 균형은 각각 뼈 건강 및 항상성 유지에 매우 중요 하며, 뼈 항상성에서의 섭 동이 뼈 질환으로 이어질 수 있기 때문에 비정상적인 뼈 성장 또는 뼈 밀도의 손실. 독특한 뼈-재흡수 세포로 서, 파 골 균은 골다공증, 치 주 염 및 인공 골 분해2,3을 포함 한 비정상적인 뼈 파괴와 관련 된 질병에 중요 합니다.
파 골 세포 배양의 개발은 주로 두 단계로 나뉜다. 보이 드 외4 와 챔버 스 외5 는 1980 년대 첫 번째 스테이지로 구성 된 방법. 그 (것) 들은 급속 한 개장 기간 인 신생 동물의 뼈에서 상대적으로 풍부한 파 골 세포를 얻었습니다. 파 골 세포는 특별 한 배지에서 뼈를 조각 내 고 교 반하여 방출 됩니다. 그러나,이 방법에 의해 얻어진 세포는 양과 순도가 낮다. 두 번째 단계는 골 수가6에서 유래한 조 혈 계보 세포를 이용 하 여 파 골 균 형성의 장거리 배양을 개발 하는 것 이었다. 1 α, 25-디 하이드 록 시 비타민 D3, 프로 스타 글란 딘 E2 (pge-2) 및 부 갑 상선 호르몬 (PTH)과 같은 배양 배지에 첨가 된 골 아 세포의 시스템을 통해 서 작용 하 여 파 골 형성을 자극 하는,8 . 그러나,이 방법에 의해 얻어진 파 골 세포의 순도 및 양은 현대의 분자 생물학 연구의 요구를 충족 시킬 수 없다. 이어서, 대 식 세포 콜로 니 자극 인자 (M-csf) 및 핵 인자-κ b 리간드 (rankl)를 위한 수용 체 활성 제를 발견 하 여 골 세포 형성을 용이 하 게 하는9,10,11및 M-csf를 사용 하는 방법 및 파 골 세포 형성을 직접적으로 자극 하는 RANKL은 전 세계적으로 널리 사용 되 고 있다. 그러나, 개선 해야 할 방법론에는 여전히 몇 가지 세부 사항이 있습니다.
현재 가장 일반적으로 사용 되는 파 골 세포 배양 법은 마 리노 외 (12 ) 및 페이 알13에 의해 기술 된 바와 같이, 종종 뼈 주위의 주위 조직을 제거 하 고 살 균 된 바늘을 사용 하 여 골 수를 세척 하는 것이 필요 완료 된 미디어. 이 과정에는 (1) 뼈 주위의 주위 조직을 제거 하는 것이 많은 시간과 훌륭한 외과 기술이 필요 하다는 사실을 포함 하 여, (2) 뼈가 깨지기 쉬우며 골 수 유출을 초래할 수 있다는 사실 (3)이 있습니다. 너무 작은 플러시, 그리고 (4) 바늘 스틱 부상의 위험이 있다. 이러한 문제를 방지 하기 위해 골 수를 바늘로 내뿜는 대신 골 수에 대 한 뼈가 들어 있는 튜브를 원심 분리 합니다. 여기에서는 전통적인 절차에 비해 적은 시간과 노력으로 골 수를 분리 하는 안정적이 고 안전한 방법을 소개 합니다. 밀도 구배 원심 분리의 사용과 함께, 우리는 시험관 내에서 완전히 분화 된 파 골 세포의 다량을 얻습니다.
프로토콜
여기에 설명 된 동물을 포함 하는 모든 방법은 중국 의학의 난징 대학의 기관 동물 관리 및 사용 위원회 (IACUC)에 의해 승인 됩니다.
1. 설정
- 여러 방향으로 절단 1Ml의 피 펫 팁 (1cm)과 여러 1.5 mL 마이크로 원심 분리기 튜브를 준비 합니다. 20 분 동안 103 kPa 및 121 ° c에서 파이 펫 팁과 마이크로 원심 분리기 튜브를 넣고 멸 균 되었는지 확인 합니다.
- 격리 절차 동안 고립 된 조직을 보존 하기 위해 얼음과 여러 살 균 요리 상자를 준비 하십시오.
2. 배양 배지의 제조
- 완전 한 배양 배지를 준비 한다. 페니실린/streptomycin 1%의 최종 용액과 10%의 소 태아 혈 청 (FBS)을 포함 하는 최소 필수 매체 알파 (α-MEM)를 사용 하십시오.
- 0.22 μ m 필터를 사용 하 여 2.1 단계에서 미디어를 필터링 합니다.
- 골 골 유도 배지를 준비 한다. 용액 50 ml의 경우 µ의 mcsf를 1만 ng/m l (재료 표)의 농도로 추가 하 여 전체 배양 액의 49.875 mL에 125 넣고 (단계 2.2에서) 25 ng/ml-CSF의 최종 용액을 만듭니다.
- 파 골 세포 유도 배지를 준비 한다. 용액 50 ml의 경우, 1만 ng/m l (재료 표)의 농도로 µ l의 rankl을 추가 하 여 골 수 유도 매체의 49.5 mL (단계 2.3에서)를 500 첨가 하 여 25 ng/ml-CSF 및 100 ng/ml rankl의 최종 용액을 만듭니다.
3. 골 골 유래 세포의 분리
-
안락사
- 자 궁 경부 탈 구가 이어지는 CO2 흡입에 의해 4 개의 스와 규 다 들 래 쥐를 안락사 시키고, 1 분 동안 75% 에탄올에 담가 둔다.
참고: 동물이 같은 섹스와 비슷한 나이의 있는지 확인 합니다. 2 ~ 3 주에 해당 하는 동물은 권장 됩니다. 두 마리의 쥐는 원심 법을 위해 준비 되 고, 다른 두 마리는 전통적인 방법에 대 한 것 이다.
- 자 궁 경부 탈 구가 이어지는 CO2 흡입에 의해 4 개의 스와 규 다 들 래 쥐를 안락사 시키고, 1 분 동안 75% 에탄올에 담가 둔다.
-
전통적인 방법
- 동물 들을 소독 보드 위에 놓고, 부정사 위치에 두십시오. 무 균가 위를 사용 하 여 피부를 벗기기 위해 근 위 대 퇴 골에 작은 절 개 (약 1cm)를 만듭니다.
- 열과 티 바이어스를 분해 합니다. 고관절, 무릎, 발목 관절 주위의 양측 연결 부품을 잘라 신중 하 고 부드럽게 티 바이어스와 페 머를 분리 합니다. 뼈 주위의 조직의 일부를 잘라; 철저 하 게. 전체 과정에서 티 바이어스와 열을 파괴 하지 마십시오.
- 깨끗 한 뼈를 완전 한 배양 액의 5Ml를 가진 접시에 넣습니다. 멸 균가 위로 긴 뼈를 자르고 1 mL 주사기 바늘을 사용 하 여 골 수 구멍이 흰색으로 바뀔 때까지 10ml의 완전 한 배지로 조심 스럽게 세척 합니다.
- 3.2.3 단계에서 세포 현 탁 액을 50 mL 튜브로 이송 한 다음, 70 μ m 스 트레이너로 필터링 하 여 나머지 조직을 제거 하였다.
- 세포 현 탁 액에 적혈구 용 해 완충 액 (표) 5 mL를 추가 합니다. 얼음에서 8 분 동안 세포를 배양 합니다. 이어서, 세포를 250 x g 에서 5 분간 원심 분리 하 여 세포 펠 렛을 얻었다.
- 배지를 흡입 하 고 전체 배지 10ml의 세포를 소생 시킵니다. 혈 세포 측정기를 사용 하 여 셀을 계산 하 고이 섹션에서 단계에 소요 된 시간을 계산 (섹션 3.2).
-
개선 된 방법
- 동물 들을 소독 보드 위에 놓고, 부정사 위치에 두십시오. 피부를 벗 겨 내는 멸 균가 위 대 퇴 골에 작은 절 개 (약 1cm)를 만듭니다.
- 열과 티 바이어스를 분해 합니다. 뼈 주위의 조직 부분을 제대로 차단 합니다 (완전히 제거 할 필요가 없음). 전체 과정에서 티 바이어스와 열을 파괴 하지 마십시오.
- 인산 완충 식 염 수 12ml(PBS)를 사용 하 여 티 바이어스와 페 리머를 헹 구 고 반으로 자릅니다. 잘라 tibias와 페 릭을 1Ml의 피 펫 팁에 넣고 (1.1 단계부터),이는 마이크로 원심 분리기 튜브에 넣고 4°c에서 45 초 동안 1000 x g 에서 3 배 원심 분리 합니다.
- 원심 분리 후 뼈가 들어 있는 피 펫 팁을 제거 하 고 골 골을 튜브에 남겨 둡니다. 완전 한 미디어의 200 μ l를 마이크로 원심 분리기 튜브에 넣고 파이 펫 팅을 반복 하 여 골 수를 철저히 분해 합니다.
- 3.3.4 단계에서 세포 현 탁 액을 50 mL 튜브로 전송한 다음, 70 μ m 스 트레이너로 필터링 하 여 나머지 조직을 제거 하였다.
- 혈 세포 측정기를 사용 하 여 셀 수를 계산 하 고이 섹션의 단계에 소요 된 시간을 계산 합니다 (절 3.3).
4. 밀도 구배 원심 분리에의 한 정화
- Α-MEM을 사용 하 여 3.2.6 단계 또는 3.3.5 단계에서 셀 서 스 펜 션을 2 mL로 조정 합니다.
- 멸 균 실리 케이트 된 원심 관 1 개를 준비 하 고 튜브에 세포 분리 용액 (재료 표)을 8 mL 첨가 한다.
- 4.1 단계에서 세포 현 탁 액을 세포 분리 용액에 추가 한다. 피 펫 팁을 튜브의 내부 표면에 부착 하 고 45 °를 내부 표면에 유지 합니다. 현 탁 액을 추가한 후, 세포와 분리 용액의 층 사이에 명확한 한계가 나타난다.
참고: 작업에는 큰 주의가 필요 하며 천천히 수행 해야 합니다. - 30 분 동안 500 x g 에서 수평 원심 분리기로 계층화 된 용액을 원심 분리기. 원심 분리 후, 대상 세포가 포함 된 흐린 두 번째 층을 위에서 아래로 흡 인 합니다.
참고: 원심 분리기의 가속 및 감속을 취소 합니다. 원심 분리 후 6 개의 층이 있다; 상기 제 1 층은 희석제 층이 고, 상기 제 2 층은 단 핵 세포 층이 고, 상기 제 3 층은 상기 1 층의 상기 투명 분리 액 층이 고, 상기 4 층은 상기과 립 세포 층이 고, 제 6 층은 적색 세포 레이어. - 대상 셀을 새 튜브로 전송 합니다. 5 mL의 PBS를 추가 하 여 셀 3 개를 세척 합니다. 각 세척 후, 표적 세포를 250 x g 에서 5 분간 원심 분리 하 여 세포 펠 렛을 얻었다.
- 골 수 유도 매 질로 세포 펠 렛을 소생 하 고 혈 세포 측정기를 사용 하 여 셀을 셉니다. 2.3 단계에서 골 수 유도 배지 5 ~ 8 mL를 추가 하 여 30만 세포/m l의 최종 세포 용액을 얻었다. 24 웰 플레이트의 각 웰에 1 mL를 추가 합니다.
5. 문화와 차별화
- 세포를 24 시간 동안 37 ° c에서 배양 한 후, 배지를 부드럽게 흡입 하 고 각 웰에 파 골 세포 유도 배지의 1 mL를 첨가 한다. 플레이트를 부드럽게 교 교 하 고 37 ° c에서 인큐베이터에 넣습니다.
- 파 골 세포 유도 배지 마다 48 h를 변경 한다. 그렇게 하는 동안, 매체의 0.8 mL를 우물에 갈아 서 부드럽게 플레이트를 교 교 합니다.
참고: 크고, 모 기와 다 핵 파 골 세포는 일반적으로 4 ~ 6 일 주위에 도립 현미경으로 잘 관찰 되어야 합니다.
6. 타르트 레이트 내성 산 성 인산 가수분해 효소 염색
참고: Multinucleate 파 골 세포는 4 ~ 6 일 후에 유도 (5 절)가 성공 하면 존재할 것입니다.
- 37% 포름알데히드, 32.5 mL의 아세톤 및 시트르산 용액 12.5 mL의 4 mL을 결합 하 여 고정 용액을 준비 합니다. 픽스 쳐 솔루션을 4°c에 보관 하십시오.
- 50 µ L의 아질 산 나트륨을 첨가 하 여, 50 인산 염 용액의 50 µ l, 아세테이트 용액의 200 µ L 및 100 µ l를 추가 하 여 타 액 질 내 수성 (트랩) 얼룩 용액 (재료 표)을 제조 한다 타르 레이트 용액을 탈 이온 수 4.55 mL로 넣고 37 ° c로가 온 한다. 그런 다음 1 분간 반전 시켜 부드럽게 섞어 2 분간 방치 합니다.
- 파 골 세포를 성공적으로 유도 한 후 배지를 흡입 하 고 PBS로 우물 3 배를 부드럽게 씻 습니다.
- 고정 용액을 실 온 (RT)에 가져온다. 30 초 동안 우물에 2 mL의 고정 용액을 넣고 세포가 건조 되는 것을 허용 하지 않습니다.
- 고정 용액을 흡 인 하 고, 37 ° c로 미리 데워 진 탈 이온 수로 3 배 부드럽게 씻은 다음, 물을 흡입 합니다.
- 37 ° c에서 1 시간 동안 2 mL의 트랩 얼룩 용액을 넣고 어두운 곳에서 시료를 보관 하십시오.
- 1 시간 후, 얼룩을 흡 인 하 고, 37 ° c로 미리 데워 진 탈 이온 수로 샘플을 부드럽게 씻은 다음, 물을 흡입 합니다.
- 헤 마 톡 실린 용액에서 1 분 동안 세포를 중화 시켰다. 염색 후, 헤 마 톡 실린 용액을 흡 혈 하 고 세 배 세포를 탈 이온 수로 부드럽게 씻 습니다.
- 명시 야 현미경으로 이미지 파 골 세포를 사용 하 고, 3 개 이상의 핵을 가진 함정+ 세포는 보라색으로 나타납니다.
7. Toluidine 청색 염색을 이용한 골 재흡수 분석
-
뼈 조각의 전처리
- 마이크로 전기 톱에 의해 종 축을 따라 2cm 두께의 조각으로 신선한 소 대 퇴 골 피 질을 잘라. 그런 다음 단단한 조직 분쇄기로 슬라이스를 자르고 갈아 80 µm.
- 1 시간 동안 탈 이온 수와 100 Hz 초음파로 비 커의 슬라이스를 씻고 3 배를 반복 합니다.
- 2 시간 동안 75% 알코올에 슬라이스를 담가. 그런 다음 알코올을 흡입 하 고 깨끗 한 플랫폼에서 1 h에 대 한 조각의 각 측면을 자외선에 노출 시킵니다.
- 세포를 심기 전에 적어도 2 시간 동안 배양 배지에 조각을 담가 둔다.
-
Toluidine 블루 염색
- 24 웰 플레이트에 전처리 된 뼈 슬라이스를 놓습니다. 4.6 단계에서 언급 한 바와 같이 세포를 식물로 하 고 제 5 항에 언급 된 바와 같이 세포를 유도 한다.
- 파 골 세포가 나타난 후 (4 ~ 6 일 후), 0.25 M의 수산화 암모늄 1 mL를 사용 하 여 슬라이스를 세척 하 고 각각 5 분 동안 3 배를 초음파 처리 하 여 뼈 조각에 재흡수 구 덩이를 분석 할 수 있도록 살아있는 세포를 제거 합니다. 이어서, 수산화 암모늄을 제거 하 고 슬라이스 당 1Ml(wt/vol) toluidine 청색 용액 1 mL을 2 분 동안 조각 염색 한다.
- PBS로 슬라이스를 씻으십시오. 무작위로 5 개의 뷰를 선택 하 고 이미지 분석 소프트웨어를 사용 하 여 재흡수 영역에 대 한 반정량 분석을 수행 합니다.
8. 주사 전자 현미경
- 7.2.1 단계에서 뼈 슬라이스를 2 시간 동안 슬라이스 당 2.5% 알데하이드의 1 mL의 접두사에 접두사로 사용 하 고, 각각 1m 수산화 암모늄을 사용 하 여 3 분 동안 조각 3x을 초음파 처리 하 여 세포를 제거 하 고 수산화 암모늄을 제거 한다.
- 뼈 슬라이스 3 배를 각각 PBS로 12 분 동안 씻으십시오.
- RT에서 2 시간 동안 1% osmic 산으로 뼈 슬라이스를 고정 합니다.
- 에탄올 구배를 50%, 70%, 80%, 90% 및 95% 에탄올을 모든 그라데이션에 대해 15 분 동안 수행 하 고 에탄올을 15 분 동안 isoamyl 아세테이트로 교체 하십시오.
- 금 팔라듐으로 슬라이스를 코팅 한 다음 주사 전자 현미경으로 분석 하십시오.
9. 칼 시 토 닌 수용 체의 면역 형광 염색
참고: Multinucleate 파 골 세포는 유도가 성공 하면 4 ~ 6 일 후에 존재할 것입니다 (제 5 항).
- 매체를 흡입 하 고 부드럽게 PBS와 함께 잘 세 배를 씻어.
- 4% 파라 포 름 알 데히드로 10 분간 세포를 고정 하 고 4°c로 냉각 시켰다.
- 얼음에서 30 분 동안 0.3% 비 이온 성 계면 활성 제로 1 mL의 PBS를 첨가 하십시오. 그런 다음 0.3% 비 이온 성 계면 활성 제를 사용 하 여 PBS를 흡입 하 고 1 mL의 PBS를 5% FBS 얼음에 30 분 동안 첨가 합니다.
- PBS를 흡 인 하 고 4°c에서 하룻밤 동안 PBS에서 1:100 희석 한 항 칼 시 토 닌 수용 체 (안티 CTR)로 멤브레인을 배양 합니다.
- 용액을 흡입 하 고, 알 렉 사-488-공액 항 토끼 IgG 항 체와 함께 멤브레인을 배양 하 여 RT에서 1 시간 동안 PBS에서 1000 희석 한다.
- 용액을 흡입 하 고 PBS로 세 배 셀을 부드럽게 씻으십시오. RT에서 3 분 동안 Hoechst 33342 얼룩과 핵을 상쇄.
- 용액을 흡입 하 고 PBS로 세 배 셀을 부드럽게 씻으십시오. 형광 현미경으로 CTR의 강도를 관찰 합니다.
결과
이 프로토콜의 목적은 다 수의 파 골 세포 전 구체를 편리 하 게 분리 및 정제 하 고 파 골 세포를 성공적으로 유도 하는 것 이었다. M-CSF와 RANKL으로 보충 하 여 5 ~ 6 일에 거 대 한 파 골 세포를 볼 수 있었습니다. 파 골 세포의 형성은 트랩 염색에 의해 성공적으로 규명 되었다 (도 1a). 크고 보라색 세포는 여러 핵 (일반적으로 ≥ 3 개의 핵)을 가진 함정 양성 세포로 간주 되었습니다. 이 방법을 통해, 24 웰 플레이트 (도 1b)에서 파 골 세포 당 최대 30 개의 핵을 함유 하는 800 파 골 세포를 얻는 것이 전형적 이었다. 기존의 방법과 비교 하 여, 개선 된 방법은 전체 분리 진행에 약 20 분을 저장 하였다 (도 1c).
골 재흡수의 활동을 평가 하기 위하여 뼈 조각을 사용 하는 것은 시험관 내 방법에서 전형적입니다. Toluidine 블루 염색을 통해 흡수 영역을 연한 녹색 (그림 2a)으로 시각화 하 고 계산 하였다. 골 구 덩이의 구조와 특성은 주사 전자 현미경에 의해 명확히 관찰 되었다 (그림 2b).
파 골 세포 특이 셀 마커 중 하나인 CTR은 파 골 세포를 식별 하 고 뼈에서 파 골 세포의 형성을 연구 하는 데 중요 합니다. CTR의 긍정적 인 표현은 파 골 세포를 명확 하 게 식별 하 고 대 식 세포 폴 리 론과 구별 합니다. CTR은 면역 형광 검사 분석에 의해 검출 되었다. 녹색은 CTR과 청색의 발현을 표시 하 여 핵을 나타냅니다 (그림 3).
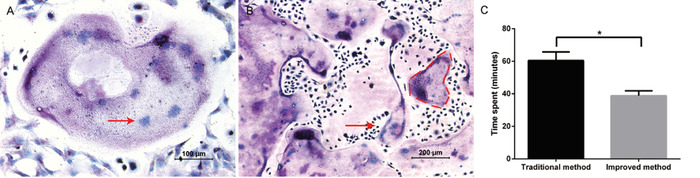
그림 1: 골 골에서 유래 된 세포에서의 조 혈 기원. (A) 함정 염색의 대표 이미지. 10 배 확대의 명시 야 현미경 사진은 함정 양성이 고 20x 배율로 관찰 된 여러 거 대 한 다 핵 파 골 세포를 보여줍니다. 다 핵 파 골 세포 내 핵의 예는 적색 화살표로 표시 된다. (B) 10 배 확대에서의 명시 야 현미경 사진이 다 수의 트랩 양성 파 골 세포가 존재 함을 증명 한다. 큰, 다 핵 파 골 세포의 예는 적색 파선에 의해 윤곽을 이루고 있다. (C) 두 격리 방법에 소요 된 시간의 비교. 모든 작업은 동일한 실험 집단에 의해 수행 되었다. 데이터는 평균 ± 표준 편차를 나타낸다. * P < 0.05, n=3 이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
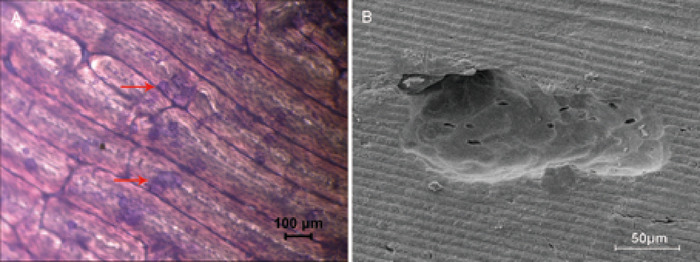
그림 2: 뼈 조각에 의해 뼈 재흡수 분석. (A) 4 배 확대에서의 명시 야 현미경 사진은 골 흡수 영역을 보여 주며, toluidine 청색 얼룩에 의해 연한 녹색으로 염색 되 고 원형, 타원형 또는 소시지 모양입니다. 뼈 흡수 영역의 예는 빨간색 화살표로 표시 됩니다. (B) 500x 배율로 주사 전자 현미경으로 관찰 된 재흡수 구 덩이. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

도 3: 면역 형광 염색을 이용 하 여 파 골 세포에서의 CTR 발현의 특성화. 패널은 세포 주위의 명확한 CTR 신호를 보여줍니다. (A) CTR 양성 세포. (B) 핵. (C) 병합 됨. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
시험관 내에서 파 골 세포를 얻고 연구 하는 능력은 뼈를 흡수 하는 질병의 메커니즘을 이해 하 고 새로운 치료제를 개발 하는 데 도움이 될 수 있는 골 대사를 연구 하고자 하는 모든 연구자에 게 중요 하 고 근본적인 기술입니다. 본 연구는 이전 방법에 기초 하 여 일부 수정과 프로토콜을 설명 했다.
골 수를 얻기 위해 피 펫 팁과 마이크로 원심 분리기 튜브를 사용 함으로써, 그것은 크게 전통적인 방법에 비해 골 수와 실험실 인력의 작업 부하를 얻는 작업 시간을 감소. 그동안,이 방법은 골 수가 손실 또는 바늘 스틱 부상의 위험을 방지. 이전 연구에서, 골 것 유래 세포는12,13의 분리 직후에 도금 되었다. 밀도 구배 원심 분리는 정산 계수의 차이에 따라 골 수 단 핵 구를 선택 하 여 사용 하였다. 밀도 구배 원심 분리의 과정에서, 세포 분리 매체의 첨가는 경계를 명확 하 게 하기 위해 벽을 따라 조심 스럽게 신중 하 게 수행 되어야 한다. 그러나, 기술은 원심 분리기의 기능과 가속도 및 감속의 매개 변수로 설정 되었는지 여부에 따라 제한 됩니다. 시 딩 밀도는 파 골 세포의 배양을 위한 핵심 조건입니다. 여러 번, 세포를 도금 할 때 부적절 한 시 딩 밀도로 인해 프로토콜이 실패 했습니다. 따라서 24 웰 플레이트 당 약 30만 세포가 잘이 프로토콜에 권장 됩니다. 이 프로토콜은 쥐 또는 다른 동물 (예: 마우스, 토끼 및 닭고기)에서 다양 한 종류의 골 수 유래 세포를 획득 하는 데에도 적합 합니다.
파 골 세포의 활동을 평가 하는 가장 고전적인 방법은 재흡수 pit 분석입니다. 소 뼈 피 질은 일반적으로 소스를 사용할 수 있기 때문에 재흡수 pit 분석에 사용 됩니다. 현대 절편 시스템의 도움으로, 우리는 더 쉽게 얇은 뼈 조각을 얻을 수 있습니다. 재흡수 구 분석은 세 가지 요인이 있다. 성공적으로 조각에서 재흡수 피트를 생성 하려면, 조각은 프로토콜의 피부 탈지에 대해 설명 된 대로 엄격 하 게 처리 해야 합니다. 또한, 쥐 파 골 세포는 약간 산 성 환경에서 재흡수 피트를 형성 하기 위해 활성화 되 고, 흡수 기능은 본질적으로 "종료" pH가 위로 올라간다 때 7.214,15. 따라서, 실험의 진행 중에 인큐베이터의 문을 자주 개방 하는 것은 pH 및 pCO2 값의 섭 동으로 이어질 수 있고, 파 골 세포의 재흡수 기능에도 영향을 미치는 것으로 주목할 만하다.16. 마지막으로, 뼈 조각은 우물의 바닥에 남아 있어야 하며, 자극을 피하기 위해 매체를 변경할 때 이동 하거나 떠 서는 안됩니다.
CTR은 부 갑 상선 호르몬 및 분 지 수용 체 (17)를 포함 하는 7-막 투과 G-단백질 결합 수용 체의 클래스 II 서브 패밀리의 한 구성원 이다. 함정 염색과 재흡수 구 분석 뿐만 아니라, 파 골 세포는 형태학과 기능에 의해 확인 되 고, CTR 양성은 면역학의 파 골 세포를 식별 합니다. 이제, 우리는 또한 액 틴 고리의 형광 염색을 사용 하 고 상 등 액에서 피리 딘 가교 결합을 측정 하 여 파 골 세포를 동정 할 수 있다.
비록 다른 연구원은 실험 기술 및 골 수도에 있는 세포의 총계를 가진 다른 각 인이 확실 합니다, 우리는 짧은 시간에 골 수가 세포를, 상대적으로, 그리고 끝에, 충분히 장악 했습니다 쥐 골 골에서 분화 된 파 골 세포.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 중국 국립 자연과학 재단 (81473692)에서 용 마에 의해 지원 되었다. 저자는 중국 의학의 난징 대학에서 임상 의학의 첫 번째 대학의 의료 연구 센터의 모든 직원을 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
참고문헌
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유