Method Article
Isolement, purification et différenciation des précurseurs d’Ostéoclast de la moelle osseuse de rat
Dans cet article
Résumé
Les ostéoclastes sont des polycaryons macrophages spécifiques aux tissus dérivés de la lignée monocyte-macrophages des cellules souches hématopoïétiques. Ce protocole décrit comment isoler les cellules de la moelle osseuse afin que de grandes quantités d’ostéoclastes soient obtenues tout en réduisant le risque d’accidents que l’on retrouve dans les méthodes traditionnelles.
Résumé
Les ostéoclastes sont de grandes cellules multinucléées et de résorbage osseux de la lignée monocyte-macrophages qui sont formées par la fusion de monocytes ou de précurseurs de macrophages. La résorption osseuse excessive est l’un des mécanismes cellulaires les plus significatifs conduisant à des maladies ostéolytiques, y compris l’ostéoporose, la parodontite et l’ostéolyse périprosthétique. La principale fonction physiologique des ostéoclastes est d’absorber à la fois la composante minérale de l’hydroxyapatite et la matrice organique de l’OS, générant l’aspect de la résorption caractéristique sur la surface des os. Il ya relativement peu d’ostéoclastes par rapport à d’autres cellules dans le corps, en particulier dans les os adultes. Des études récentes ont porté sur la façon d’obtenir des ostéoclastes plus matures en moins de temps, ce qui a toujours été un problème. Plusieurs améliorations dans les techniques d’isolement et de culture se sont développées dans les laboratoires afin d’obtenir des ostéoclastes plus matures. Ici, nous introduisons une méthode qui isole la moelle osseuse en moins de temps et avec moins d’effort par rapport à la procédure traditionnelle, à l’aide d’un dispositif spécial et simple. Avec l’utilisation de la centrifugation par gradient de densité, nous obtenons de grandes quantités d’ostéoclastes entièrement différenciés de la moelle osseuse de rat, qui sont identifiés par des méthodes classiques.
Introduction
L’homéostasie osseuse est un processus physiologique complexe qui est régulé par des ostéoblastes de résorbage osseux et des ostéoclastes formant des os1. Un équilibre entre l’activité ostéoblastique et l’ostéoclaste induite par les ostéobenzènes et les ostéoclastes, respectivement, est très essentiel pour maintenir la santé osseuse et l’homéostasie, car les perturbations de l’homéostasie osseuse peuvent entraîner des maladies osseuses, telles comme une croissance osseuse anormale ou une perte de densité osseuse. En tant que cellules uniques de résorption osseuse, les ostéoclastes sont importantes dans les maladies liées à la destruction osseuse anormale, y compris l’ostéoporose, la parodontite et l’ostéolyse périprosthétique2,3.
Le développement d’une culture ostéosclast est principalement divisé en deux étapes. Les méthodes établies par Boyde et coll.4 et Chambers et coll.5 composaient la première étape dans les années 1980. Ils ont obtenu des ostéoclastes relativement abondantes à partir des os des animaux nouveau-nés, qui est la période de remodelage rapide. Les ostéoclastes sont libérés par la fragmentation et l’agitation des os dans un milieu spécial. Cependant, les cellules obtenues par cette méthode sont faibles en quantité et en pureté. La deuxième étape a été le développement de cultures à longue distance de formation d’ostéoclast, utilisant des cellules de lignée hématopoïétique dérivées de la moelle osseuse6. Les cytokines, telles que la 1 α, la 25-dihydroxyvitamine D3, la prostaglandine E2 (PGE-2) et l’hormone parathyroïde (PTH), qui sont ajoutées dans le milieu de culture, agissent par l’intermédiaire du système des cellules ostéoblastes/stromales pour stimuler la formation d’ostéoclast7,8 . Cependant, la pureté et la quantité d’ostéoclastes obtenues par cette méthode ne peuvent pas répondre aux besoins de la recherche moderne en biologie moléculaire. Ensuite, la découverte du facteur stimulant des colonies de macrophages (M-CSF) et de l’activateur du récepteur pour le ligand nucléaire de facteur-κB (RANKL) rend l’ostéoclastogenèse plus facile9,10,11, et la méthode d’utilisation de m-CSF et RANKL pour stimuler directement la formation d’ostéosclast est largement utilisé dans le monde entier. Cependant, il y a encore quelques détails dans la méthodologie qui doivent être améliorés.
Actuellement, la méthode de culture d’ostéoclast la plus couramment utilisée, telle que décrite par Marino et al.12 et PEI et al.13, nécessite souvent l’enlèvement du tissu environnant autour de l’os et utilise une aiguille stérilisée pour rincer la cavité médullaire avec les médias complétés. Il y a quelques inconvénients à ce processus, y compris le fait que (1) l’enlèvement du tissu environnant autour de l’OS nécessite beaucoup de temps et une grande technique chirurgicale, (2) les os sont fragiles et peuvent conduire à l’écoulement de la moelle osseuse, (3) la cavité de la moelle osseuse pourrait être trop petit pour rincer, et (4) il y a un risque de blessure de bâton d’aiguille. Pour éviter ces problèmes, nous centrifuger les tubes contenant les os pour la moelle osseuse au lieu de l’aiguille-rinçage de la moelle osseuse. Ici, nous introduisons une méthode stable et sûre qui isole la moelle osseuse en moins de temps et avec moins d’effort comparé à la procédure traditionnelle. Avec l’utilisation de la centrifugation par gradient de densité, nous obtenons de grandes quantités d’ostéoclastes entièrement différenciés in vitro.
Protocole
Toutes les méthodes impliquant les animaux décrits ici sont approuvées par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’Université de médecine chinoise de Nanjing.
1. Configuration de l’installation
- Préparer plusieurs pointes de pipette de 1 mL (1 cm) et plusieurs tubes de microcentrifugation de 1,5 mL de façon longitudinale. Mettre les pointes de pipette et les tubes de microcentrifugation à 103 kPa et 121 ° c pendant 20 min et s’assurer qu’ils sont stériles.
- Préparez une boîte de glace et plusieurs plats stériles pour préserver les tissus isolés pendant la procédure d’isolement.
2. préparation du milieu de culture
- Préparez le milieu de culture complet. Utiliser le milieu minimal essentiel alpha (α-MEM) qui contient une solution finale de 1% de pénicilline/streptomycine et 10% de sérum bovin fœtal (FBS).
- Filtrer le support à partir de l’étape 2,1 à l’aide d’un filtre 0,22 μM.
- Préparez le milieu d’induction de la moelle osseuse. Pour 50 mL de la solution, ajouter 125 μL de M-CSF à une concentration de 10 000 ng/mL (table des matières) à 49,875 ml de milieu de culture complet (à partir de l’étape 2,2) pour faire une solution finale de 25 ng/ml m-CSF.
- Préparez le milieu d’induction ostéosclast. Pour 50 mL de la solution, ajouter 500 μL de RANKL à une concentration de 10 000 ng/mL (table des matières) à 49,5 ml de milieu d’induction de la moelle osseuse (à partir de l’étape 2,3) pour faire une solution finale de 25 ng/ml de M-CSF et de 100 ng/ml de RANKL.
3. isolement des cellules dérivées de Mmoelle osseuse
-
euthanasie
- Euthanasier quatre rats Sprague Dawley par inhalation de CO2 suivis d’une dislocation cervicale et les immerger dans de l’éthanol à 75% pendant 1 min.
Remarque: Assurez-vous que les animaux sont du même sexe et d’un âge similaire. Les animaux âgés de 2 à 3 semaines sont recommandés. Deux rats sont préparés pour la méthode centrifuge, tandis que les deux autres sont pour la méthode traditionnelle.
- Euthanasier quatre rats Sprague Dawley par inhalation de CO2 suivis d’une dislocation cervicale et les immerger dans de l’éthanol à 75% pendant 1 min.
-
Méthode traditionnelle
- Placer les animaux sur une carte de désinfection en position décubitus dorsal. Faire une petite incision (environ 1 cm) au fémur proximale pour peler la peau, en utilisant des ciseaux stériles.
- Disséquez les fémurs et les tibias. Coupez les parties de connexion bilatérales autour des articulations de la hanche, du genou et de la cheville pour isoler les tibias et les fémurs avec précaution et douceur. Coupez une partie des tissus autour de l’OS; être approfondie. Ne pas briser les tibias et les fémurs pendant tout le processus.
- Placer les os nettoyés dans un plat avec 5 mL du milieu de culture complet. Coupez l’os long avec des ciseaux stériles et utilisez une aiguille de seringue de 1 mL pour rincer soigneusement la cavité de la moelle avec 10 mL de support complet jusqu’à ce que la cavité de la moelle devienne blanche.
- Transférer la suspension cellulaire de l’étape 3.2.3 à un tube de 50 mL, puis la filtrer avec une passoire de 70 μm pour enlever le tissu restant.
- Ajouter 5 mL de tampon de lyse des globules rouges (table des matières) à la suspension cellulaire. Incuber les cellules pendant 8 min sur la glace. Ensuite, Centrifugez les cellules à 250 x g pendant 5 min pour produire le culot de la cellule.
- Aspirer le milieu et Resuspendre les cellules dans 10 mL de support complet. Comptez les cellules à l’aide d’un hémocytomètre et calculez le temps passé sur les étapes de cette section (section 3,2).
-
Méthode améliorée
- Placer les animaux sur une carte de désinfection en position décubitus dorsal. Faire une petite incision (environ 1 cm) au fémur proximale avec des ciseaux stériles pour peler la peau.
- Disséquez les fémurs et les tibias. Coupez correctement la partie des tissus autour de l’OS (pas besoin d’enlever complètement). Ne pas briser les tibias et les fémurs pendant tout le processus.
- Rincez les tibias et les fémurs avec 12 mL de solution saline tamponnée au phosphate (PBS) et coupez-les en deux. Placer les tibias et les fémurs reniflés dans un embout de pipette de 1 mL (à partir de l’étape 1,1), qui est ensuite mis dans un tube à microcentrifugation et est centrifugé 3x à 1 000 x g pour 45 s à 4 ° c.
- Après centrifugation, retirer la pointe de la pipette contenant l’os et laisser la moelle osseuse dans le tube. Ajouter 200 μL de support complet dans le tube de microcentrifugation et répéter le pipetage pour désintégrer la moelle à fond.
- Transférer la suspension cellulaire de l’étape 3.3.4 à un tube de 50 mL, puis la filtrer avec une passoire de 70 μm pour enlever le tissu restant.
- Comptez les cellules à l’aide d’un hémocytomètre et calculez le temps passé sur les étapes de cette section (section 3,3).
4. purification par centrifugation par gradient de densité
- Ajustez la suspension de la cellule de l’étape 6 à 2 mL avec α-MEM.
- Préparer un tube centrifuge silicifié stérile et ajouter 8 mL de la solution de séparation des cellules (table des matières) au tube.
- Ajoutez la suspension de cellule de l’étape 4,1 à la solution de séparation de cellules. Collez l’embout de la pipette sur la surface interne du tube et conservez un 45 ° à la surface intérieure. Après avoir ajouté la suspension, une limite claire apparaîtra entre la couche des cellules et la solution de séparation.
Remarque: L’opération nécessite beaucoup de soin et doit être exécutée lentement. - Centrifuger la solution stratifiée dans une centrifugeuse horizontale à 500 x g pendant 30 min. Après centrifugation, aspirer la deuxième couche trouble, qui contient les cellules cibles, de haut en bas.
Remarque: Annuler l’accélération et la décélération de la centrifugeuse avant la centrifugation. Il y a six couches après centrifugation; la première couche est la couche de diluant, la deuxième couche est la couche de monocytes, la troisième couche est la couche de cellules mononucléaires, la quatrième couche est la séparation transparente liquide une couche, la cinquième est la couche de cellules granulaire, et la sixième couche est la cellule rouge couche. - Transférez les cellules cibles vers un nouveau tube. Ajouter 5 mL de PBS pour laver les cellules 3x. Après chaque lavage, Centrifugez les cellules cibles à 250 x g pendant 5 min pour produire le culot de la cellule.
- Resuspendre le culot cellulaire avec un milieu d’induction de la moelle osseuse et compter les cellules à l’aide d’un hémocytomètre. Ajouter 5 à 8 mL de milieu d’induction de la moelle osseuse à partir de l’étape 2,3 pour obtenir une solution cellulaire finale de 300 000 cellules/mL. Ajouter 1 mL à chaque puits d’une plaque de 24 puits.
5. culture et différenciation
- Après incubation des cellules à 37 ° c pendant 24 h, aspirer doucement le milieu et ajouter 1 mL du milieu d’induction ostéosclast à chaque puits. Agiter doucement la plaque et la mettre dans un incubateur à 37 ° c.
- Changez le milieu d’induction d’ostéosclast tous les 48 h. En procédant ainsi, changer 0,8 mL du milieu dans le puits et agiter doucement la plaque.
Remarque: Des ostéoclastes larges, motiles et multinucléées doivent être observées dans le puits sous un microscope inversé, généralement autour des jours 4 à 6.
6. coloration de la phosphatase acide résistante au tartrate
Remarque: Les ostéoclastes multinucléés seront présents après 4 à 6 jours si l’induction (section 5) est réussie.
- Préparer la solution fixateur en combinant 4 ml de 37% de formaldéhyde, 32,5 ml d’acétone et 12,5 ml d’une solution de citrate. Conserver la solution fixateur à 4 ° c.
- Préparer la solution de coloration à la phosphatase acide (TRAP) résistante au tartrate (table des matières) en ajoutant 50 μl de nitrite de sodium, 50 μl de solution de base Fast Garnet gbc, 50 μl de solution de phosphate de naphtol As-BI, 200 μL d’une solution d’acétate et 100 μL d’un solution de tartrate dans 4,55 mL d’eau désionisée qui est préchauffée à 37 ° c. Ensuite, mélanger doucement par inversion pendant 1 min, et laisser reposer pendant 2 min.
- Après l’induction réussie des ostéoclastes, aspirer le milieu, et laver doucement les puits 3x avec PBS.
- Apportez la solution fixateur à la température ambiante (RT). Ajouter 2 ml de solution fixateur dans les puits pendant 30 s et ne pas laisser sécher les cellules.
- Aspirer la solution fixateur, la laver délicatement 3x avec de l’eau désionisée qui est préchauffée à 37 ° c, puis, aspirer l’eau.
- Ajouter 2 mL de solution de teinture TRAP pendant 1 h à 37 ° c et garder l’échantillon dans l’obscurité.
- Après 1 h, aspirer la tache et laver doucement l’échantillon avec de l’eau désionisée qui est préchauffée à 37 ° c, puis aspirer l’eau.
- Contre-tacher les cellules pendant 1 min dans une solution d’hématoxyline. Après coloration, aspirer la solution d’hématoxyline et laver doucement les cellules 3x avec de l’eau désionisée.
- Les ostéoclastes d’image utilisant la microscopie fond clair, et les cellules Trap+ avec trois noyaux ou plus apparaîtront en violet.
7. essai de résorption osseuse utilisant la coloration bleue de toluidine
-
Prétraitement des tranches d’OS
- Coupez le cortex osseux fémoral des bovins frais en tranches d’une épaisseur de 2 cm le long de l’axe longitudinal par une scie MICROÉLECTRIQUE. Ensuite, coupez et Broyez les tranches avec des broyeurs de tissus durs en 80 μm.
- Laver les tranches dans un bécher avec de l’eau désionisée et 100 Hz à l’échographie pendant 1 h, et répéter 3x.
- Immerger les tranches dans 75% d’alcool pendant 2 h. Ensuite, aspirer l’alcool et exposer chaque côté des tranches à la lumière ultraviolette pendant 1 h sur une plate-forme propre.
- Avant de planter les cellules, immerger les tranches dans le milieu de culture pendant au moins 2 h.
-
Coloration bleu de toluidine
- Placer les tranches d’os prétraitées dans la plaque de 24 puits. Planter les cellules comme indiqué à l’étape 4,6 et induire les cellules comme indiqué dans la section 5.
- Après l’apparition des ostéoclastes (après 4 – 6 jours), laver les tranches avec 1 ml d’hydroxyde d’ammonium 0,25 M, et les sonication 3x pendant 5 min chacun pour enlever les cellules vivantes pour permettre l’analyse des fosses de résorption sur les tranches d’os. Ensuite, retirer l’hydroxyde d’ammonium et colorer les tranches avec 1 mL de 1% (WT/vol) de solution de bleu de toluidine par tranche pendant 2 min.
- Lavez les tranches avec du PBS. Sélectionner au hasard cinq vues et effectuer une analyse semi-quantitative de la zone de résorption à l’aide d’un logiciel d’analyse d’image.
8. microscopie électronique à balayage
- Préfixez les tranches d’os de l’étape 7.2.1 avec 1 mL de 2,5% de glutaraldéhyde par tranche pendant 2 h à RT, puis, sonicez les tranches 3x pendant 3 min chacune avec 1 M d’hydroxyde d’ammonium pour enlever les cellules et enlever l’hydroxyde d’ammonium.
- Lavez les tranches d’os 3x pendant 12 min chacune avec PBS.
- Fixer les tranches d’OS avec 1% d’acide osmique pendant 2 h à RT.
- Effectuer une déshydratation par gradient d’éthanol, avec 50%, 70%, 80%, 90% et 95% d’éthanol, pendant 15 min pour chaque gradient, puis remplacer l’éthanol par de l’acétate d’isoamyle pendant 15 min.
- Enduire les tranches de palladium d’or, puis analyser par microscopie électronique à balayage.
9. coloration de l’immunofluorescence du récepteur de la calcitonine
Remarque: Les ostéoclastes multinucléés seront présents après 4 à 6 jours si l’induction réussit (section 5).
- Aspirer le médium et laver doucement le puits 3x avec PBS.
- Fixer les cellules pendant 10 min avec 4% de paraformaldéhyde, qui est prérefroidi à 4 ° c.
- Ajouter 1 mL de PBS avec 0,3% de tensioactif nonionique par puits pendant 30 min sur la glace. Ensuite, aspirer le PBS avec 0,3% de surfactant nonionique et ajouter 1 mL de PBS avec 5% de FBS par puits pendant 30 min sur la glace.
- Aspirer le PBS et incuber les membranes avec un récepteur anti-calcitonine (anti-CTR) à une dilution 1:100 dans le PBS à 4 ° c pendant la nuit.
- Aspirer la solution et incuber les membranes avec des anticorps IgG anti-lapin conjugués Alexa-488 à une dilution de 1:1000 dans le PBS pendant 1 h à RT.
- Aspirer la solution et laver doucement les cellules 3x avec PBS. Contre-tache les noyaux avec la tache de 33342 de Hoechst pendant 3 min à RT.
- Aspirer la solution et laver doucement les cellules 3x avec PBS. Observez l’intensité du CTR par microscopie à fluorescence.
Résultats
Le but du protocole était d’isoler et de purifier un grand nombre de précurseurs d’ostéoclast commodément et d’induire les ostéoclastes avec succès. En complétant avec M-CSF et RANKL, des ostéoclastes géants ont été observés les jours 5 à 6. La formation d’ostéoclastes a été identifiée avec succès par la coloration TRAP (figure 1a). Les cellules grandes et violettes ont été considérées comme des cellules à piège positif avec plusieurs noyaux (typiquement ≥ trois noyaux). Par cette méthode, il était typique d’obtenir 800 ostéoclastes, contenant jusqu’à 30 noyaux par ostéoclast, dans une plaque de 24 puits (figure 1b). Par rapport à la méthode traditionnelle, la méthode améliorée a économisé environ 20 min dans l’ensemble de la progression de l’isolement (figure 1c).
L’utilisation de tranches d’OS pour évaluer l’activité de la résorption osseuse est une méthode in vitro typique. Par coloration au bleu de toluidine, la zone de résorption a été visualisée en vert clair (figure 2a) et a été calculée. La structure et les caractéristiques des fosses osseuses ont été clairement observées par microscopie électronique à balayage (figure 2b).
Le CTR, l’un des marqueurs de cellules spécifiques à l’ostéoclaste, est essentiel pour identifier les ostéoclastes et étudier la formation d’ostéoclastes dans l’OS. L’expression positive du CTR identifie clairement les ostéoclastes et les distingue des polycaryons du macrophages. Le CTR a été détecté par les dosages d’immunofluorescence. La couleur verte indiquait l’expression du CTR et le bleu indiquait les noyaux (figure 3).
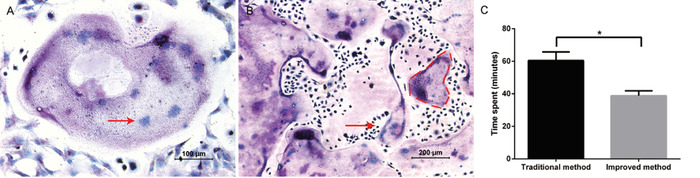
Figure 1: ostéoclastogenèse des cellules dérivées de la moelle osseuse. A) image représentative de la coloration Trap. Le Micrographe fond clair à grossissement 10x démontre plusieurs ostéoclastes géants multinucléés qui sont positifs au piège et ont été observés à un grossissement de 20 x. Un exemple de noyau dans un ostéoclast multinucléé est montré par la flèche rouge. (B) le Micrographe fond clair à grossissement 10x prouve qu’un grand nombre d’ostéoclastes positifs au piège étaient présents. Un exemple de grand ostéoclaste multinucléé est décrit par la ligne pointillée rouge. C) Comparaison du temps passé sur les deux méthodes d’isolement. Toutes les opérations ont été effectuées par le même groupe d’expérimentateurs. Les données représentent les moyennes ± écart-type. * P < 0,05, n = 3. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
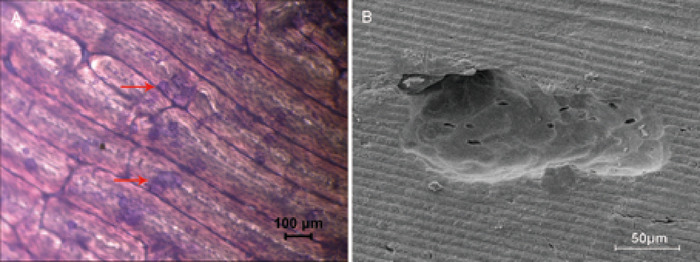
Figure 2: essais de résorption osseuse par tranches d’os. (A) le Micrographe fond clair à grossissement 4x démontre la zone de résorption osseuse, est teinté vert clair par la tache bleue de toluidine, et est rond-, ovale-ou en forme de saucisse. Un exemple de la zone de résorption osseuse est montré par la flèche rouge. B) les fosses de résorption observées avec la microscopie électronique à balayage à un grossissement de 500x. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: caractérisation de l’expression CTR dans les ostéoclastes à l’aide de la coloration par immunofluorescence. Le panneau affiche un signal CTR clair autour des cellules. A) cellules positivesduCTR. B) noyaux. (C) fusionné. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La capacité d’obtenir et d’étudier les ostéoclastes in vitro est une compétence critique et fondamentale pour tout chercheur souhaitant étudier le métabolisme osseux, qui peut aider à comprendre les mécanismes des maladies absorbant les os et à développer de nouveaux agents thérapeutiques. La présente étude décrivait un protocole avec quelques modifications fondées sur des méthodes antérieures.
En utilisant des pointes de pipette et des tubes de microcentrifugation pour obtenir la moelle osseuse, elle a largement réduit le temps de fonctionnement de l’obtention de la moelle osseuse et la charge de travail du personnel de laboratoire par rapport aux méthodes traditionnelles. En attendant, la méthode évite le risque de perte de moelle osseuse ou de blessure au bâton d’aiguille. Dans une étude précédente, les cellules dérivées de la moelle osseuse ont été plaquées immédiatement après l’isolement12,13. La centrifugation par gradient de densité a été utilisée pour sélectionner les monocytes de moelle osseuse en fonction des différences dans les coefficients de tassement. Dans le processus de centrifugation par gradient de densité, l’addition des milieux de séparation des cellules doit être effectuée doucement et soigneusement le long du mur, afin de rendre les limites claires. Cependant, la technique est limitée par la fonction de la centrifugeuse et par le fait qu’elle soit mise en place avec les paramètres d’accélération et de décélération. La densité de semis est la condition clé pour la culture des ostéoclastes. Plusieurs fois, le protocole a échoué en raison d’une densité de semis incorrecte lors du placage des cellules. Ainsi, environ 300 000 cellules par puits de 24 puits sont recommandées dans ce protocole. Ce protocole est également approprié pour l’obtention de divers types de cellules dérivées de la moelle osseuse chez des rats ou d’autres animaux (p. ex., souris, lapin et poulet).
La méthode la plus classique pour évaluer l’activité des ostéoclastes est le dosage des fosses de résorption. Le cortex osseux bovin est couramment utilisé pour le dosage des fosses de résorption parce que ses sources sont largement disponibles. Avec l’aide d’un système de coupe moderne, nous pouvons obtenir plus facilement des tranches d’os minces. Le dosage des fosses de résorption a trois facteurs. Pour générer avec succès une fosse de résorption dans les tranches, les tranches doivent être traitées strictement comme décrit pour le dégraissage dans le protocole. En outre, les ostéoclastes de rat sont activés pour former des fosses de résorption dans un environnement légèrement acide, et la fonction de résorption sera essentiellement «arrêté» lorsque le pH monte au-dessus de 7,214,15. Ainsi, il est à noter que l’ouverture de la porte de l’incubateur fréquemment pendant la progression des expériences peut conduire à des perturbations des valeurs du pH et du BCP2 , influençant même la fonction de résorption des ostéoclastes16. Enfin, les tranches d’os doivent rester au fond des puits et ne doivent pas être déplacées ou flotter vers le haut en changeant le milieu, afin d’éviter l’irritation.
Le CTR est un membre de la sous-famille de classe II des récepteurs couplés à la protéine G-7 transmembranaires qui contiennent également l’hormone parathyroïde et les récepteurs de la sécrétine17. En plus de la coloration TRAP et du dosage des fosses de résorption, les ostéoclastes sont identifiés par la morphologie et la fonction, et le CTR-positif identifie les ostéoclastes en immunologie. Maintenant, nous pouvons également utiliser la coloration fluorescente de l’anneau d’actine et de mesurer les croisements de pyridinoline dans le surnageant pour identifier les ostéoclastes.
Bien que différents chercheurs aient des familiarités différentes avec les techniques expérimentales et la quantité totale de cellules dans la moelle osseuse est certain, nous avons obtenu des cellules de moelle osseuse dans un temps plus court, relativement, et à la fin, a obtenu de grandes quantités de complètement d’ostéoclastes différenciés de la moelle osseuse de rat.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la National Natural Science Foundation de la Chine (81473692) à Yong ma. Les auteurs remercient tout le personnel du centre de recherche médicale du premier collège de médecine clinique à l’Université de la médecine chinoise de Nanjing.
matériels
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
Références
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon