Method Article
大鼠骨髓破骨衣原体的分离、纯化及鉴别
摘要
破骨细胞是来源于造血干细胞单核巨噬细胞谱系的组织特异性巨噬细胞多核细胞。该方案描述了如何分离骨髓细胞, 以便获得大量的破骨细胞, 同时降低传统方法中发现的事故风险。
摘要
骨细胞是大的, 多核的, 和骨吸收细胞的单核细胞巨噬细胞谱系, 形成的单核细胞或巨噬细胞前体的融合。过度的骨吸收是导致溶骨性疾病的最重要的细胞机制之一, 包括骨质疏松症、牙周炎和假体周围骨溶解。破骨细胞的主要生理功能是吸收羟基磷灰石矿物成分和骨的有机基质, 在骨骼表面产生典型的吸收外观。与体内其他细胞相比, 破骨细胞相对较少, 尤其是在成人骨骼中。最近的研究集中在如何在更短的时间内获得更成熟的破骨细胞, 这一直是一个问题。为了获得更成熟的破骨细胞, 实验室在分离和培养技术方面有了一些改进。在这里, 我们介绍了一种方法, 分离骨髓在更短的时间和更少的努力, 与传统的程序相比, 使用一个特殊和简单的设备。利用密度梯度离心技术, 我们从大鼠骨髓中获得了大量完全分化的破骨细胞, 并采用经典方法进行鉴定。
引言
骨稳态是一个复杂的生理过程, 是由骨吸收破骨细胞和成骨细胞1调节。在成骨细胞和破骨细胞活动之间的平衡, 分别通过成骨细胞和破骨细胞介导, 是非常重要的, 以维持骨骼健康和稳态, 因为在骨稳态的摄动可能会导致骨骼疾病, 如骨生长异常或骨密度下降。破骨细胞作为独特的骨吸收细胞, 在与异常骨破坏相关的疾病中非常重要, 包括骨质疏松症、牙周炎和假体周围骨溶解2,3。
破骨细胞培养的发展主要分为两个阶段。Boyde 等人和chambers等人确定的方法构成了1980年代的第一阶段。他们从新生动物的骨骼中获得了相对丰富的破骨细胞, 这是一个快速的重塑期。骨细胞克隆通过在特殊培养基中的碎裂和搅拌来释放。然而, 这种方法获得的细胞数量和纯度都很低。第二阶段是利用从骨髓6中提取的造血谱系细胞, 发展成骨细胞的长程培养。细胞因子, 如1α、25-二羟基维生素 d3、前列腺素 e2 (pge-2) 和甲状旁腺激素 (pth), 加入培养基, 通过成骨细胞/基质细胞系统作用,刺激破骨细胞形成 7,8.然而, 该方法获得的破骨细胞的纯度和数量不能满足现代分子生物学研究的需要。然后, 巨噬细胞集落刺激因子 (m-csf) 和受体激活剂的发现核因子-b 配体 (rankl) 使骨细胞生成更容易 9,10,11, 并使用 m-csf 和RANKL 直接刺激破骨细胞的形成在世界范围内得到了广泛的应用。然而, 方法中仍有一些细节需要改进。
目前, 最常用的破骨细胞培养方法, 如 Marino等人12和pei 等 13所述, 通常需要切除骨周围的周围组织, 并使用消毒针冲洗骨髓腔。完成的媒体。这个过程有一些缺点, 包括 (1) 切除周围的组织周围的组织需要大量的时间和伟大的手术技术, (2) 骨骼是脆弱的, 可以导致骨髓流出, (3) 骨髓腔可能是太小, 不能冲洗, (4) 有针头受伤的风险。为了避免这些问题, 我们离心管含有骨髓的骨头, 而不是针头冲洗骨髓。在这里, 我们介绍了一种稳定和安全的方法, 分离骨髓在更短的时间和更少的努力相比, 传统的程序。结合密度梯度离心, 我们在体外获得大量完全分化的破骨细胞.
研究方案
这里描述的所有涉及动物的方法都得到了南京中医药大学动物护理和使用机构委员会 (IACUC) 的批准。
1. 设置
- 准备几个纵向切割的1毫升移液器吸头 (1 厘米) 和几个 1.5 mL 微离心管。将移液器吸头和微型离心管放在103千帕和121°c 处 20分钟, 并确保它们是无菌的。
- 准备一盒冰和几个无菌的盘子, 以保存隔离的组织在隔离过程中。
2. 培养基的制备
- 准备完整的培养基。使用最小必要的培养基α-α (Α-mem), 其中含有1% 的青霉素/链霉素和10% 的胎牛血清 (FBS) 的最终溶液。
- 使用0.22μm 过滤器对步骤2.1 中的介质进行筛选。
- 准备骨髓诱导介质。对于50毫升的溶液, 在浓度为 10, 000 Ng/ml (材料表) 的情况下, 将125μl 的 m-csf 添加到49.75ml 的完整培养基 (从步骤2.2 开始) 中, 最终解决 25 ngml M-CSF。
- 准备破骨细胞诱导培养基。对于50毫升的溶液, 在浓度为 10, 000 NG/ml (材料表) 的情况下, 在 29.5 ml 的骨髓诱导介质 (从步骤2.3 开始) 中加入500μl 的 rankl, 以最终解决 25 ngml m-csf 和 100 ngml RANKL。
3. 骨髓源性细胞的分离
-
安乐 死
- 通过吸入co2使四只 sprague dawley 大鼠安乐死, 然后进行宫颈脱位, 并将其浸入75% 乙醇中1分钟。
请注意:确保动物的性别和年龄相似。建议2至3周大的动物。两只大鼠为离心法做好了准备, 另外两只大鼠则为传统方法做好了准备。
- 通过吸入co2使四只 sprague dawley 大鼠安乐死, 然后进行宫颈脱位, 并将其浸入75% 乙醇中1分钟。
-
传统方法
- 将动物放在消毒剂板上, 处于仰角位置。在股骨近端做一个小切口 (约1厘米), 用无菌剪刀剥去皮肤。
- 解剖出股骨和胫骨。切割髋关节、膝盖和踝关节周围的双侧连接部分, 以小心、温和地隔离胫骨和股骨。切断骨骼周围的部分组织;是彻底的。在整个过程中不要骨折的胫骨和股骨。
- 将清洁后的骨骼放入一个有5毫升的完整培养基的盘子中。用无菌剪刀切断长骨, 用1毫升注射器针用10毫升的培养基小心冲洗骨髓腔, 直到骨髓腔变白。
- 将细胞悬浮液从步骤转移到 3.2.3 50 毫升管, 然后用70μm 的过滤器对其进行过滤, 以去除剩余的组织。
- 在细胞悬浮液中加入5毫升的红细胞裂解缓冲液 (材料表)。在冰上培养细胞8分钟。然后, 在 250 x g的情况下离心细胞 5分钟, 以产生细胞颗粒。
- 将培养基吸走, 并在10毫升的完整培养基中重新悬浮细胞。使用血细胞计计算细胞, 计算在本节中的步骤上花费的时间 (第3.2 节)。
-
改进的方法
- 将动物放在消毒剂板上, 处于仰角位置。用无菌剪刀在股骨近端做一个小切口 (约1厘米), 使皮肤去皮。
- 解剖出股骨和胫骨。正确地切断骨骼周围的组织部分 (不需要完全切除)。在整个过程中不要骨折的胫骨和股骨。
- 用12毫升磷酸盐缓冲盐水 (PBS) 冲洗胫骨和股骨, 并将其切成两半。将被剪断的倾角和股骨放入1毫升移液器尖端 (从步骤 1.1) 中, 然后放入微离心管中, 在4°c 下, 以 1, 000 x g 的速度离心 3x 45秒。
- 离心后, 取出含有骨的移液器尖端, 并将骨髓留在试管中。将200Μl 的完整介质加入微离心管, 并重复移液, 彻底分解骨髓。
- 将细胞悬浮液从步骤转移到 3.3.4 50 毫升管, 然后用70μm 的过滤器对其进行过滤, 以去除剩余的组织。
- 使用血细胞计计算细胞数, 并计算在本节中的步骤上花费的时间 (第3.3 节)。
4. 密度梯度离心纯化
- 使用Α-mL 将细胞悬浮液从步骤3.2.6 或步骤3.3.5 调整到2毫升。
- 准备一根无菌硅化离心管, 并在管中加入8毫升的细胞分离液 (材料表)。
- 将步骤4.1 中的细胞悬浮液添加到细胞分离溶液中。将移液器尖端贴在管内的内表面, 并保持在内表面的45°。添加悬浮液后, 单元格层和分离溶液之间会出现明显的限制。
请注意:手术需要非常小心, 需要慢慢进行。 - 在 500 x克的水平离心机中离心层状溶液30分钟。离心后, 从上到下吸气, 从上到下吸气, 其中包含目标细胞。
请注意:在离心前取消离心机的加速和减速。离心后有六层;第一层是稀释剂层, 第二层是单核细胞层, 第三层是单核细胞层, 第四层是透明分离液一层, 第五层是颗粒状细胞层, 第六层是红细胞层。 - 将目标细胞转移到新的试管中。添加5毫升的 PBS 来清洗细胞3倍。每次清洗后, 离心目标细胞在 250 x g 5分钟, 以产生细胞颗粒。
- 用骨髓诱导培养基重新注射细胞颗粒, 并用血细胞计计数细胞。从步骤2.3 中加入5-8 毫升骨髓诱导培养基, 得到 300, 000 细胞的最终细胞溶液。在24井板的每口井中添加1毫升。
5. 文化与差异化
- 在37°c 孵育细胞24小时后, 轻轻吸气, 并在每口井中加入1毫升的破骨细胞诱导培养基。轻轻搅拌板, 并将其放入37°c 的孵化器中。
- 每48小时改变一次破骨细胞诱导培养基。在这样做的时候, 在井中更换 0.8 mL 的介质, 轻轻搅拌板。
请注意:在倒置显微镜下, 应在井内观察到大的、运动的和多核的破骨细胞, 通常在第4-6天左右。
6. 耐酒石酸磷酸酶染色
请注意:如果诱导成功 (第5节), 4-6天后将出现多核破骨细胞。
- 将4毫升的37% 甲醛、32.5 mL 的丙酮和12.5 毫升的柠檬酸溶液结合起来, 制备固溶体溶液。将固定溶液存放在4°c。
- 加入50μl 亚硝酸钠、50μl 快速石榴石 gbc 基溶液、50μl 的环甘醇 as-bi 溶液、200μl 的醋酸溶液和μl 的醋酸溶液, 并添加μl 的亚硝酸钠, 制备耐腐蚀酸磷酸酶 (trap) 染色溶液 (材料表)。将酒石酸溶液经预热至37°c 的去离子水中, 加入4.55 毫升。然后, 轻轻地混合, 倒置 1分钟, 让它站立2分钟。
- 成功诱导破骨细胞后, 从培养基上吸气, 用 PBS 轻轻清洗3x 井。
- 将固定溶液带到室温 (RT)。在井中加入2毫升固定溶液, 持续 30秒, 不允许细胞干燥。
- 吸气固定溶液, 用预热至37°c 的去离子水轻轻清洗 3倍, 然后吸水。
- 在37°c 下加入2毫升的 TRAP 染色溶液 1小时, 并将样品保持在黑暗中。
- 1小时后, 吸气, 用预热至37°c 的去离子水轻轻清洗样品, 然后吸水。
- 在血红素溶液中对细胞进行10分钟的反污。染色后, 吸入血红素溶液, 用去离子水轻轻清洗细胞3倍。
- 使用明亮场显微镜的图像破骨细胞和具有三个或三个以上细胞核的 trap + 细胞将出现紫色。
7. 使用替利定蓝染色进行骨吸附法测定
-
骨片的预处理
- 用微电锯沿纵轴将新鲜的牛股骨皮层切割成2厘米厚的切片。然后, 用硬组织磨床将切片切割并研磨成80微米。
- 用去离子水和 100 Hz 超声波清洗烧杯中的切片 1小时, 并重复3倍。
- 将切片浸入75% 的酒精中2小时。然后, 吸掉酒精, 并在一个干净的平台上将切片的每一侧暴露在紫外线下1小时。
- 在种植细胞之前, 将切片浸入培养基中至少2小时。
-
甲苯胺蓝染色
- 将经过预处理的骨片放入24孔板。种植步骤4.6 中提到的细胞, 并诱导第5节中提到的细胞。
- 破骨细胞出现后 (4-6天), 用1毫升 0.25 M 氢氧化铵清洗切片, 并将其每次 3x 3x, 以去除活细胞, 从而分析骨片上的吸收坑。然后, 取出氢氧化铵, 用1毫升的1毫升 (wt/vol) 每片甲苯胺蓝溶液染色2分钟。
- 用 PBS 清洗切片。随机选择五个视图, 并使用图像分析软件对吸收区域进行半定量分析。
8. 扫描电子显微镜
- 在 RT 用1毫升每片2.5% 的戊二醛对7.2.1 的步进骨片进行前缀, 然后用 1 M 氢氧化铵将切片用 3 x 状3分状 3分钟, 将其取出细胞并去除氢氧化铵。
- 用 PBS 将骨片清洗 3x, 每次12分钟。
- 用1% 的渗透酸固定骨片2小时。
- 在每个梯度15分钟内, 用50%、70%、80%、90% 和95% 乙醇进行乙醇梯度脱水, 然后将乙醇与醋酸异戊酯代替15分钟。
- 用金钯涂上切片, 然后用扫描电镜进行分析。
9. 降钙素受体的免疫荧光染色
请注意:如果诱导成功, 4-6天后将出现多核破骨细胞 (第5节)。
- 从介质上吸气, 用 PBS 轻轻清洗3x 井。
- 用4% 的甲醛固定细胞 10分钟, 预涂至4°C。
- 在冰上加入1毫升的 PBS, 每口井增加0.3% 的非离子表面活性剂, 在冰上工作30分钟。然后, 用0.3% 的非离子表面活性剂吸气, 在冰上加入1毫升的 PBS, 每口每口有5% 的 FBS, 在冰上工作30分钟。
- 在4°c 的 PBS 中, 用抗降钙素受体 (抗 ctr) 在1:100 稀释后, 将膜从 PBS 中吸走, 并在4°c 时孵育膜。
- 在 PBS 中的1:1000 稀释后, 用亚历克 s-488 共轭的抗家兔 IgG 抗体孵育膜1小时。
- 将溶液吸走, 用 PBS 轻轻清洗细胞3倍。用 Hoechst 33342 染色去除细胞核3分钟。
- 吸掉溶液, 用 PBS 轻轻清洗细胞3倍。用荧光显微镜观察 CTR 的强度。
结果
该方案的目的是方便地分离和纯化大量破骨细胞前体, 成功诱导破骨细胞。通过对 M-CSF 和 RANKL 的补充, 在第5-6 天看到了巨大的破骨细胞。通过 TRAP 染色成功地鉴定了破骨细胞的形成 (图 1a)。大细胞和紫色细胞被认为是具有多个细胞核 (通常≥3个核) 的 trap 阳性细胞。通过这种方法, 典型的获得800个破骨细胞, 每个破骨细胞含有多达30个细胞核, 在一个24孔板 (图 1B)。与传统方法相比, 改进后的方法在整个隔离过程中节省了约 20分钟 (图 1c)。
用骨片评估骨吸收活性是典型的体外方法。通过甲苯胺蓝染色, 将吸收区可视化为浅绿色 (图 2a) 并进行计算。扫描电子显微镜可以清楚地观察到骨坑的结构和特征 (图 2B)。
CTR 是破骨细胞特异性细胞标志物之一, 对于鉴定破骨细胞和研究骨破骨细胞的形成至关重要。CTR 的阳性表达清楚地识别破骨细胞, 并将其与巨噬细胞多核细胞区分开来。免疫荧光检测检测 CTR。绿色表示 CTR 的表达, 蓝色表示细胞核 (图 3)。
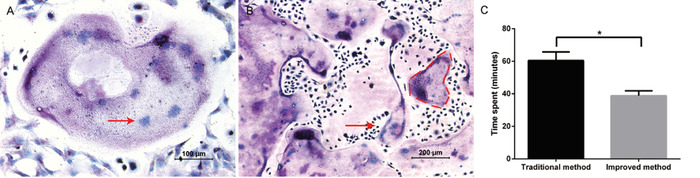
图 1: 骨髓源性细胞成骨.(A) TRAP 染色的代表性图像。在10倍放大时的明亮场显微镜显示多个巨大的多核破骨细胞是 trp 阳性, 并在20x 放大时观察到。一个多核破骨细胞内的细胞核的例子是由红色箭头显示的。(B) 10倍放大时的明亮场显微镜证明存在大量的 trp 阳性破骨细胞。红色虚线概述了一个大型的多核破骨细胞的例子。(C) 在两种隔离方法上花费的时间比较。所有的手术都是由同一批实验者进行的。数据表示均为标准偏差。*P < 0.05, n = 3。请点击这里查看此图的较大版本.
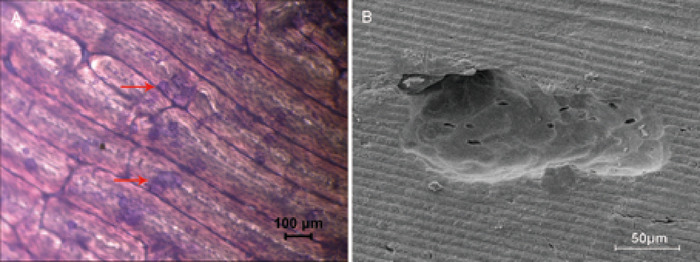
图 2: 骨片骨吸收检测.(A) 4倍放大的明亮场显微镜显示骨吸收区, 被甲苯胺蓝色染色染成浅绿色, 呈圆形、圆形或香肠状。一个骨吸收区的例子显示在红色箭头。(B) 用扫描电子显微镜在500x 放大倍率下观察到的吸收坑。请点击这里查看此图的较大版本.

图 3: 免疫荧光染色在破骨细胞中表达的 CTR 特征。面板在细胞周围显示清晰的 CTR 信号。(A) ctr 阳性细胞。(B) 核心。(C) 合并。请点击这里查看此图的较大版本.
讨论
对于任何希望研究骨代谢的研究人员来说, 体外获得和研究破骨细胞的能力是一项关键和基本的技能, 这可能有助于了解骨吸收不良的机制, 并开发出新的治疗药物。本研究描述了一种基于以往方法的协议, 并进行了一些修改。
与传统方法相比, 采用移液器吸头和微离心管获得骨髓, 大大缩短了获得骨髓的手术时间和实验室人员的工作量。同时, 该方法避免了骨髓丢失或针杆损伤的风险。在之前的一项研究中, 骨髓衍生细胞在分离12、13 后立即被镀。根据沉降系数的差异, 采用密度梯度离心法选择骨髓单核细胞。在密度梯度离心过程中, 必须沿着墙体轻轻、小心地添加细胞分离介质, 以明确边界。然而, 该技术受到离心机功能的限制, 是否具有加速和减速的参数。播种密度是培养破骨细胞的关键条件。多次, 该协议失败, 由于不正确的播种密度, 当电镀细胞。因此, 本协议建议每个24井板井大约有 300, 000个细胞。该方案也适用于获取大鼠或其他动物 (如小鼠、兔子和鸡) 中各种骨髓源性细胞。
评估破骨细胞活性的最经典方法是吸收坑法。牛骨皮质是常用的吸收坑检测, 因为它的来源是广泛可用的。借助现代切片系统, 我们可以更容易地获得薄薄的骨片。吸收坑检测有三个因素。要在切片中成功生成一个吸收坑, 必须严格按照协议中所述的方式处理切片进行拆分。此外, 大鼠破骨细胞被激活, 在略带酸性的环境中形成吸收坑, 当 ph 值超过 7.214,15 时, 吸收功能基本上会 "关闭"。因此, 值得注意的是, 在实验过程中频繁打开孵化器的门可能会导致 ph 值和 Pco2 值的扰动, 甚至影响破骨细胞16的吸收功能.最后, 骨片应保持在井底, 在更换介质时不应移动或漂浮, 以避免刺激。
CTR 是 7-跨膜 g-蛋白偶联受体的 II 类亚系的成员之一, 也含有甲状旁腺激素和分泌物受体 17。除了 TRAP 染色和吸收坑检测外, 破骨细胞还通过形态和功能进行鉴定, ctr 阳性在免疫学中鉴定破骨细胞。现在, 我们还可以使用荧光染色肌动蛋白环和测量吡啶在上清液中的交联, 以确定破骨细胞。
尽管不同的研究人员对实验技术有不同的熟悉程度, 骨髓中的细胞总量也是肯定的, 但我们在较短的时间内获得了骨髓细胞, 相对地, 最终获得了大量的完整从大鼠骨髓中分化成骨细胞。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家自然科学基金 (81473692) 对马勇的支持。作者感谢南京中医药大学第一临床医学院医学研究中心的全体工作人员。
材料
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
参考文献
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。