Method Article
Isolamento, purificação e diferenciação de precursores de osteoclast da medula óssea de ratos
Neste Artigo
Resumo
Os osteoclastos são polykaryons tecido-específicos do macrófago derivados da linhagem do monocyte-macrófago de pilhas de haste hematopoietic. Este protocolo descreve como isolar pilhas da medula de modo que as grandes quantidades de osteoclastos sejam obtidas ao reduzir o risco de acidentes encontrados em métodos tradicionais.
Resumo
Os osteoclastos são grandes, multinucleados, e células de reabsorção óssea da linhagem monócitos-macrófago que são formadas pela fusão de monócitos ou precursores de macrófago. O reabsorção excessivo do osso é um os mecanismos celulares os mais significativos que conduzem às doenças osteolytic, incluindo a osteoporose, o periodontitis, e o osteolysis periprotético. A principal função fisiológica dos osteoclastos é absorver tanto o componente mineral de hidroxiapatita quanto a matriz orgânica do osso, gerando a aparência característica de reabsorção na superfície dos ossos. Existem relativamente poucos osteoclastos em comparação com outras células do corpo, especialmente em ossos adultos. Estudos recentes têm se concentrado em como obter mais osteoclastos maduros em menos tempo, o que sempre foi um problema. Várias melhorias nas técnicas de isolamento e cultura desenvolveram-se em laboratórios, a fim de obter mais osteoclastos maduros. Aqui, apresentamos um método que isola a medula óssea em menos tempo e com menos esforço em comparação com o procedimento tradicional, utilizando um dispositivo especial e simples. Com o uso da centrifugação do inclinação da densidade, nós obtemos grandes quantidades de osteoclastos inteiramente diferenciados da medula do osso do rato, que são identificados por métodos clássicos.
Introdução
A homeostase óssea é um processo fisiológico complexo que é regulado por osteoclastos de reabsorção óssea e osteoblastos de formação óssea1. Um equilíbrio entre a atividade osteoblástica e osteoclástica mediada por osteoblastos e osteoclastos, respectivamente, é altamente essencial para manter a saúde óssea e a homeostase, pois as perturbações na homeostase óssea podem levar a doenças ósseas, tais como crescimento ósseo anormal ou perda da densidade óssea. Como células únicas de reabsorção óssea, os osteoclastos são importantes em doenças relacionadas à destruição óssea anormal, incluindo osteoporose, periodontite e osteólise periprotética2,3.
O desenvolvimento de uma cultura osteoclast é dividido principalmente em dois estágios. Os métodos estabelecidos por Boyde et al.4 e Chambers et al.5 compuseram a primeira etapa na década de 1980. Obtiveram osteoclastos relativamente abundantes dos ossos de animais recém-nascidos, que é o período de remodelação rápido. Os osteoclastos são liberados fragmentando e agitando os ossos em um meio especial. No entanto, as células obtidas por este método são baixas em quantidade e pureza. O segundo estágio foi o desenvolvimento de culturas de longa distância de formação de osteoclast, utilizando células de linhagem hematopoiéticas derivadas da medula óssea6. Citocinas, como 1α, 25-dihidroxivitamina D3, prostaglandina E2 (PGE-2) e hormônio paratireóide (PTH), que são adicionadas ao meio de cultura, atuam através do sistema de osteoblastos/células estromais para estimular a formação de osteoclast7,8 . Entretanto, a pureza e a quantidade de osteoclastos obtidos por este método não podem encontrar as necessidades da pesquisa moderna da biologia molecular. Então, a descoberta do fator deestimulação do macrófago (M-CSF) e do activador do receptor para o ligante do fator-κB nuclear (RANKL) faz a osteoclastogênese mais fácil9,10,11, e o método de usar M-CSF e RANKL para estimular diretamente osteoclast formação é amplamente utilizado em todo o mundo. No entanto, ainda existem alguns detalhes na metodologia que precisam ser melhoradas.
Atualmente, o método de cultura osteoclast mais comumente utilizado, como descrito por Marino et al.12 e Pei et al.13, muitas vezes requer a remoção do tecido circundante ao redor do osso e usa uma agulha esterilizada para liberar a cavidade da medula com mídia concluída. Há algumas desvantagens para este processo, incluindo o fato de que (1) a remoção do tecido circundante ao redor do osso requer muito tempo e grande técnica cirúrgica, (2) os ossos são frágeis e podem levar à saída da medula óssea, (3) a cavidade da medula óssea pode ser demasiado minúsculo para nivelar, e (4) há um risco de ferimento da vara da agulha. Para evitar estes problemas, nós centrifugamos os tubos contendo os ossos para a medula óssea em vez de agulha-liberando a medula óssea. Aqui, apresentamos um método estável e seguro que isola a medula óssea em menos tempo e com menos esforço em comparação com o procedimento tradicional. Juntamente com o uso da centrifugação de gradiente de densidade, obtemos grandes quantidades de osteoclastos totalmente diferenciados in vitro.
Protocolo
Todos os métodos que envolvem os animais aqui descritos são aprovados pelo Comitê institucional de cuidados e uso de animais (IACUC) da Universidade de medicina chinesa de Nanjing.
1. configuração
- Prepare várias pontas de pipeta de 1 mL longitudinalmente cortadas (1 cm) e vários tubos de microcentrífuga de 1,5 mL. Põr as pontas da pipeta e os tubos do microcentrifugador em 103 kPa e em 121 ° c por 20 minutos e assegure-se de que estejam estéreis.
- Prepare uma caixa de gelo e vários pratos estéreis para preservar os tecidos isolados durante o procedimento de isolamento.
2. preparação do meio de cultura
- Prepare o meio de cultura completo. Use alfa médio essencial mínimo (α-MEM) que contenha uma solução final de 1% de penicilina/estreptomicina e 10% de soro bovino fetal (FBS).
- Filtre a mídia da etapa 2,1 usando um filtro de 0,22 μm.
- Prepare o meio de indução da medula óssea. Para 50 mL da solução, adicione 125 μL de M-CSF em uma concentração de 10.000 ng/mL (tabela de materiais) a 49,875 ml do meio de cultura completo (da etapa 2,2) para fazer uma solução final de 25 ng/ml m-CSF.
- Prepare o meio de indução osteoclast. Para 50 mL da solução, adicione 500 μL de RANKL a uma concentração de 10.000 ng/mL (tabela de materiais) a 49,5 ml de meio de indução da medula óssea (a partir do passo 2,3) para fazer uma solução final de 25 ng/ml M-CSF e 100 ng/ml de RANKL.
3. isolamento de células derivadas de medula óssea
-
Eutanásia
- Eutanizar quatro ratos Sprague Dawley por inalação de CO2 seguido de luxação cervical, e mergulhe-os em 75% de etanol por 1 min.
Nota: Garantir que os animais são do mesmo sexo e de uma idade semelhante. São recomendados animais com 2 a 3 semanas de idade. Dois ratos são preparados para o método centrífugo, enquanto os outros dois são para o método tradicional.
- Eutanizar quatro ratos Sprague Dawley por inalação de CO2 seguido de luxação cervical, e mergulhe-os em 75% de etanol por 1 min.
-
Método tradicional
- Coloque os animais em uma placa desinfetante em uma posição supina. Faça uma pequena incisão (aproximadamente 1 cm) no fêmur proximal para descascar a pele, usando tesouras estéreis.
- Dissecar os fêmures e as Tibias. Corte as partes bilaterais da conexão em torno do quadril, do joelho, e das junções de tornozelo para isolar com cuidado e delicadamente os tíbias e os fêmures. Corte parte dos tecidos ao redor do osso; ser minucioso. Não fracturas nas tíbias e fêmures durante todo o processo.
- Coloque os ossos limpos em um prato com 5 mL do meio de cultura completo. Corte o osso longo com tesouras estéreis e use uma agulha de seringa de 1 mL para nivelar a cavidade da medula com cuidado com 10 mL de meios completos até que a cavidade da medula se transforme branca.
- Transfira a suspensão da célula do passo 3.2.3 para um tubo de 50 mL e, em seguida, filtre-a com um filtro de 70 μm para remover o tecido remanescente.
- Adicione 5 mL de tampão de lise de glóbulos vermelhos (tabela de materiais) à suspensão celular. Incubar as células por 8 min no gelo. Em seguida, Centrifugue as células em 250 x g por 5 min para produzir o pellet celular.
- Aspirar fora do meio e ressuscite as células em 10 mL de mídia completa. Conte as células usando um hemociômetro e calcule o tempo gasto nas etapas desta seção (seção 3,2).
-
Método melhorado
- Coloque os animais em uma placa desinfetante em uma posição supina. Faça uma pequena incisão (aproximadamente 1 cm) no fêmur proximal com tesoura estéril para descascar a pele.
- Dissecar os fêmures e as Tibias. Cortar corretamente a parte dos tecidos ao redor do osso (não há necessidade de remover completamente). Não fracturas nas tíbias e fêmures durante todo o processo.
- Enxague as tíbias e os fêmures com 12 ml de solução salina tampão fosfato (PBS) e corte-os ao meio. Coloc as tíbias e os fêmures cortou em uma ponta da pipeta de 1 ml (da etapa 1,1), que é põr então em um tubo do microcentrifugador e é centrifugada 3x em 1.000 x g para 45 s em 4 ° c.
- Após a centrifugação, retire a ponta da pipeta que contém o osso e deixe a medula óssea no tubo. Adicione 200 μL de suportes completos no tubo de microcentrífuga e repita a pipetagem para desintegrar a medula cuidadosamente.
- Transfira a suspensão da célula do passo 3.3.4 para um tubo de 50 mL e, em seguida, filtre-a com um filtro de 70 μm para remover o tecido remanescente.
- Conte as células usando um Hemocytometer e calcule o tempo gasto nas etapas desta seção (seção 3,3).
4. purificação por gradiente de densidade de centrifugação
- Ajuste a suspensão da célula da etapa 3.2.6 ou etapa 3.3.5 para 2 mL com α-MEM.
- Prepare um tubo centrífugo silicificado estéril e adicione 8 mL da solução de separação de células (tabela de materiais) ao tubo.
- Adicione a suspensão da célula da etapa 4,1 à solução de separação de células. Adira a ponta da pipeta à superfície interna do tubo e mantenha um 45 ° à superfície interna. Depois de adicionar a suspensão, um limite claro aparecerá entre a camada das células e a solução de separação.
Nota: A operação requer muito cuidado e precisa ser realizada lentamente. - Centrifugue a solução mergulhada em um centrifugador horizontal em 500 x g por 30 minutos. Após a centrifugação, aspirar a segunda camada nublado, que contém as células-alvo, de cima para baixo.
Nota: Cancele a aceleração e a desaceleração da centrífuga antes da centrifugação. Há seis camadas após a centrifugação; a primeira camada é a camada diluente, a segunda camada é a camada de monócitos, a terceira camada é a camada de células mononucleares, a quarta camada é a separação transparente líquido uma camada, o quinto é a camada de célula granular, e a sexta camada é a célula vermelha Camada. - Transfira as células alvo para um novo tubo. Adicionar 5 mL de PBS para lavar as células 3x. Após cada lavagem, Centrifugue as células alvo em 250 x g por 5 min para produzir o pellet celular.
- Ressuscitem o pellet celular com meio de indução da medula óssea e contam as células usando um hemociômetro. Adicionar 5 – 8 mL de meio de indução da medula óssea a partir do passo 2,3 para obter uma solução celular final de 300.000 células/mL. Adicione 1 mL a cada poço de uma placa de 24 poços.
5. cultura e diferenciação
- Após a incubação das células a 37 ° c por 24 h, aspirar suavemente para fora do meio e adicionar 1 mL do meio de indução osteoclast a cada poço. Agitar suavemente a placa e colocá-la numa incubadora a 37 ° c.
- Mude o meio de indução do osteoclast cada 48 h. Ao fazê-lo, mude 0,8 mL do meio no poço e agite suavemente a placa.
Nota: Os osteoclastos grandes, motile, e multinucleadas devem ser observados no poço um microscópio invertido, tipicamente em torno dos dias 4 – 6.
6. coloração fosfatase ácida resistente ao tartarato
Nota: Os osteoclastos multinucleados estarão presentes após 4 – 6 dias se a indução (seção 5) for bem-sucedida.
- Prepare a solução fixativa combinando 4 mL de 37% de formaldeído, 32,5 mL de acetona e 12,5 mL de uma solução de citrato. Guarde a solução fixativa a 4 ° c.
- Prepare a solução de coloração de fosfatase ácida resistente ao tartarato (TRAP) (tabela de materiais) adicionando 50 μL de nitrito de sódio, 50 μL de solução base Fast Garnet gbc, 50 μL de solução de fosfato de naftol como-BI, 200 μL de solução de acetato e 100 μl de solução de tartarato em 4,55 mL de água desionizada que é pré-aquecido a 37 ° c. Em seguida, misture suavemente por inversão por 1 min, e deixá-lo ficar por 2 min.
- Após a indução bem sucedida de osteoclastos, aspiram fora do meio, e lave delicadamente os poços 3x com PBS.
- Leve a solução fixativa à temperatura ambiente (RT). Adicionar 2 mL de solução fixativa para os poços para 30 s, e não permitir que as células para secar.
- Aspirar a solução fixador, lave-o delicadamente 3x com água deionizada que é pré-aquecido a 37 ° c, e então, aspirar a água.
- Adicionar 2 mL de solução de mancha TRAP durante 1 h a 37 ° c e manter a amostra no escuro.
- Após 1 h, aspirar a mancha, e lave delicadamente a amostra com água deionizada que é pré-aquecido a 37 ° c, e então, aspirar a água.
- Counterstain as pilhas por 1 minuto em uma solução do hematoxilina. Após a coloração, aspirar a solução de hematoxilina e lavar suavemente as células 3x com água desionizada.
- A imagem osteoclastos usando a microscopia do brightfield, e o TRAP+ Cells com três ou mais núcleos parecerá roxo.
7. ensaio do resorption do osso usando a mancha do azul do toluidine
-
Pré-tratamento das fatias ósseas
- Corte o córtex ósseo femoral bovino fresco em fatias grossas de 2 cm ao longo do eixo longitudinal por Serra microelétrica. Em seguida, corte e moer as fatias com trituradores de tecido duro em 80 μm.
- Lave as fatias em um copo com água deionizada e 100 Hz ultra-som para 1 h, e repita 3x.
- Mergulhe as fatias em álcool 75% por 2 h. Em seguida, aspirar o álcool e expor cada lado das fatias de luz ultravioleta para 1 h em uma plataforma limpa.
- Antes de plantar as células, mergulhe as fatias no meio de cultura por pelo menos 2 h.
-
Coloração azul de toluidina
- Coloque as fatias ósseas pré-tratadas na placa de 24 poços. Plante as células como mencionado na etapa 4,6 e induzir as células como mencionado na seção 5.
- Após o aparecimento de osteoclastos (após 4 – 6 dias), lave as fatias com 1 ml de hidróxido de amônio 0,25 M, e proceda-os 3x por 5 min cada para remover as células vivas para permitir a análise dos poços de reabsorção nas fatias ósseas. Em seguida, retire o hidróxido de amónio e manchar as fatias com 1 mL de solução azul de toluidina a 1% (WT/vol) por fatia durante 2 min.
- Lave as fatias com PBS. Selecione aleatoriamente cinco visualizações e realize uma análise semiquantitativa da área de reabsorção usando um software de análise de imagem.
8. microscopia eletrônica de varredura
- Prefixar as fatias ósseas da etapa 7.2.1 com 1 ml de glutaraldeído a 2,5% por fatia por 2 h em RT e, em seguida, proceda as fatias 3x por 3 min cada com 1 M de hidróxido de amônio para remover as células e remover o hidróxido de amônio.
- Lave as fatias de osso 3x por 12 min cada com PBS.
- Fixar as fatias ósseas com 1% de ácido osmico por 2 h em RT.
- Realizar desidratação de gradiente de etanol, com 50%, 70%, 80%, 90% e 95% etanol, por 15 min para cada gradiente, e, em seguida, substituir o etanol com acetato de isoamilo por 15 min.
- Cubra as fatias com paládio de ouro e, em seguida, analise por microscopia eletrônica de varredura.
9. coloração de imunofluorescência do receptor de calcitonina
Nota: Os osteoclastos multinucleados estarão presentes após 4 – 6 dias se a indução for bem-sucedida (seção 5).
- Aspirar fora do meio e lave suavemente o poço 3x com PBS.
- Fixar as células por 10 min com 4% paraformaldeído, que é pré-arrefecido a 4 ° c.
- Adicione 1 mL de PBS com 0,3% de surfactante não iônico por poço por 30 min no gelo. Em seguida, aspirar a PBS com surfactante não iônico 0,3% e adicionar 1 mL de PBS com 5% FBS por poço por 30 min no gelo.
- Aspirar fora do PBS e incubar as membranas com o receptor da anticalcitonina (anti-CTR) em uma diluição 1:100 em PBS em 4 ° c durante a noite.
- Aspirar fora da solução, e incubar as membranas com os anticorpos do anti-coelho de Alexa-488-conjugated IgG em uma diluição 1:1000 no PBS por 1 h em RT.
- Aspirar a solução e lave suavemente as células 3x com PBS. Contratura os núcleos com Hoechst 33342 mancha por 3 min em RT.
- Aspirar fora da solução, e lave delicadamente as pilhas 3x com PBS. Observar a intensidade da CTR por microscopia de fluorescência.
Resultados
A finalidade do protocolo era isolar e purificar grandes números de precursores do osteoclast convenientemente e induzir osteoclastos com sucesso. Suplementando com o M-CSF e o RANKL, os osteoclastos gigantes foram vistos nos dias 5 – 6. A formação de osteoclastos foi identificada com sucesso pela coloração TRAP (Figura 1a). As pilhas grandes e roxas foram consideradas como pilhas armadilha-positivas com núcleos múltiplos (tipicamente ≥ três núcleos). Através deste método, foi típico obter 800 osteoclastos, contendo até 30 núcleos por osteoclast, em uma placa de 24 poços (Figura 1b). Comparado ao método tradicional, o método melhorado salvou aproximadamente 20 min em todo o andamento do isolamento (Figura 1C).
O uso de fatias ósseas para avaliar a atividade da reabsorção óssea é o método típico in vitro. Através da coloração azul de toluidina, a área de reabsorção foi visualizada como verde claro (Figura 2a) e foi calculada. A estrutura e as características dos poços ósseos foram claramente observadas pela microscopia eletrônica de varredura (Figura 2b).
O CTR, um dos marcadores osteoclast-específicos da pilha, é crítico para identificar osteoclastos e para estudar a formação dos osteoclastos no osso. A expressão positiva da CTR identifica claramente os osteoclastos e os distingue dos políkaryons de macrófago. A CTR foi detectada pelos ensaios de imunofluorescência. A cor verde indicou a expressão de CTR e o azul indicou os núcleos (Figura 3).
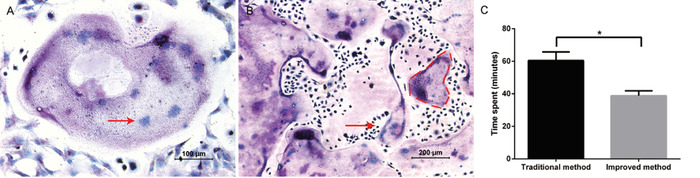
Figura 1: Osteoclastogênese de células derivadas da medula óssea. A) imagem representativa da coloração Trap. O micrografia do brightfield na ampliação 10x demonstra os osteoclastos gigantes, multinucleadas múltiplos que são armadilha-positivas e foram observados na ampliação 20x. Um exemplo de um núcleo dentro de um osteoclast multinucleado é mostrado pela seta vermelha. (B) a micrografia brightfield na ampliação 10x prova que um grande número osteoclastos armadilha-positivos estava atual. Um exemplo de um osteoclast grande, multinucleadas é esboçado pela linha tracejada vermelha. (C) comparação do tempo gasto nos dois métodos de isolamento. Todas as operações foram realizadas pelo mesmo grupo de experimentadores. Os dados representam os meios ± desvio padrão. * P < 0, 5, n = 3. Por favor clique aqui para ver uma versão maior desta figura.
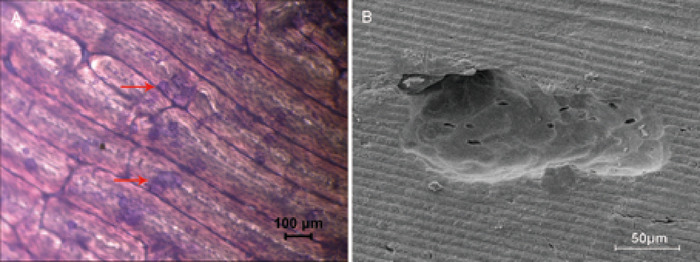
Figura 2: ensaios de reabsorção óssea por fatias ósseas. (A) o Micrografia de brightfield na ampliação 4x demonstra a área do reabsorção do osso, é verde claro manchado pela mancha azul do toluidina, e é redondo, oval-, ou salsicha-dado forma. Um exemplo da área de reabsorção óssea é mostrado pela seta vermelha. (B) pontuações de reabsorção observadas com microscopia eletrônica de varredura a uma ampliação de 500x. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: caracterização da expressão da CTR nos osteoclastos utilizando coloração por imunofluorescência. O painel mostra um sinal de CTR claro em torno das células. (A) células CTR-positivas. (B) núcleos. (C) mescladas. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
A capacidade de obter e estudar osteoclastos in vitro é uma habilidade crítica e fundamental para qualquer pesquisador que deseje estudar o metabolismo ósseo, o que pode ajudar a compreender os mecanismos de doenças absorventes de ossos e desenvolver novos agentes terapêuticos. O presente estudo descreveu um protocolo com algumas modificações com base em métodos anteriores.
Usando pontas da pipeta e os tubos do microcentrifugador para obter a medula, reduziu pela maior parte o tempo da operação de obter a medula e a carga de trabalho do pessoal do laboratório comparado aos métodos tradicionais. Enquanto isso, o método evita o risco de perda de medula óssea ou ferimento da vara da agulha. Em estudo prévio, as células derivadas da medula óssea foram banhadas imediatamente após o isolamento12,13. A centrifugação de gradiente de densidade foi utilizada para selecionar os monócitos da medula óssea de acordo com as diferenças nos coeficientes de assentamento. No processo de centrifugação de gradiente de densidade, a adição dos meios de separação celular deve ser realizada suavemente e cuidadosamente ao longo da parede, a fim de tornar as fronteiras claras. Entretanto, a técnica é limitada pela função do centrifugador e em se está ajustada acima com os parâmetros da aceleração e da retardação. A densidade de semeadura é a condição chave para o cultivo de osteoclastos. Várias vezes, o protocolo falhou devido a uma densidade de semeadura inadequada ao chapeamento das células. Assim, aproximadamente 300.000 pilhas por a placa de 24 poços bem são recomendadas neste protocolo. Este protocolo também é adequado para a obtenção de vários tipos de células derivadas da medula óssea em ratos ou outros animais (por exemplo, rato, coelho e frango).
O método mais clássico para avaliar a atividade dos osteoclastos é o ensaio de poço de reabsorção. O córtex ósseo bovino é comumente usado para o ensaio de poço de reabsorção, pois suas fontes estão amplamente disponíveis. Com a ajuda de um sistema de corte moderno, podemos obter fatias finas de osso mais facilmente. O ensaio do poço de reabsorção tem três fatores. Para gerar um poço de reabsorção com sucesso nas fatias, as fatias devem ser tratadas estritamente como descrito para desengordurante o protocolo. Além disso, os osteoclastos de ratos são ativados para formar poços de reabsorção em um ambiente levemente ácido, e a função de reabsorção será essencialmente "fechada" quando o pH sobe acima de 7,214,15. Assim, destaca-se que a abertura da porta da incubadora freqüentemente durante o andamento dos experimentos pode levar a perturbações dos valores de pH e pCO2 , mesmo influenciando a função de reabsorção dos osteoclastos16. Finalmente, as fatias do osso devem permanecer na parte inferior dos poços e não devem ser movidas ou flutuam acima ao mudar o meio, a fim evitar a irritação.
A CTR é um membro da subfamília classe II dos receptores acoplados à proteína G de 7 transmembranas que também contêm os receptores da hormona paratireóide e secretina17. Assim como a mancha da armadilha e o ensaio do poço do reabsorção, os osteoclastos são identificados pela morfologia e pela função, e o CTR-positivo identifica osteoclastos na imunologia. Agora, nós podemos igualmente usar a mancha fluorescente do anel do actina e as ligações cruzadas da piridinolina da medida no sobrenadante para identificar osteoclastos.
Embora diferentes pesquisadores tenham diferentes familiaridades com técnicas experimentais e a quantidade total de células na medula óssea é certa, obtivemos células da medula óssea em um tempo mais curto, relativamente, e no final, obteve grandes quantidades de totalmente osteoclastos diferenciados da medula óssea do rato.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de ciências naturais da China (81473692) para Yong ma. Os autores agradecem a todos os funcionários do centro de investigação médica da primeira faculdade de medicina clínica na Universidade de Nanjing de medicina chinesa.
Materiais
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
Referências
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados