Method Article
ラット骨髄からの破骨細胞前駆体の分離・精製・分化
要約
破骨細胞は、造血幹細胞の単球-マクロファージ系統に由来する組織特異的なマクロファージ polykaryons である。このプロトコルは、従来の方法で見られる事故のリスクを低減しながら、大量の破骨細胞が得られるように骨髄セルを分離する方法を説明する。
要約
破骨細胞は、単球またはマクロファージ前駆体の融合によって形成される単球-マクロファージ系統の大規模、多核、および骨瘢痕である。過度の骨吸収は、骨粗鬆症、歯周炎、periprosthetic 骨溶解を含む溶骨性疾患につながる最も重要な細胞機構である。破骨細胞の主な生理機能は、骨のヒドロキシアパタイトミネラル成分と有機マトリックスの両方を吸収し、骨の表面に特徴的な吸収外観を発生させることである。身体の他の細胞と比較して、特に成人の骨において比較的少数の骨細胞がある。最近の研究では、より短時間でより成熟した破骨細胞を得る方法に着目してきましたが、これは常に問題となっています。分離性および培養技術のいくつかの改善は、より成熟した破骨細胞を得るために実験室で開発した。ここでは、従来の手順と比較して、より少ない時間で、より少ない労力で骨髄を分離する方法を、特別でシンプルな装置を使用して導入します。密度勾配遠心分離の使用により、我々は、古典的方法によって同定されるラット骨髄からの完全に分化した破骨細胞を大量に得る。
概要
骨恒常性は、骨瘢痕破骨細胞および骨形成性骨芽細胞1によって調節される複雑な生理的過程である。骨芽細胞および破骨細胞を介して媒介される骨芽と osteoclastic 活動との間のバランスは、それぞれ、骨の健康と恒常性を維持するために非常に重要であり、このような骨格恒常性の摂動は骨疾患につながる可能性があるため、異常な骨の成長または骨密度の損失として.ユニークな骨吸収細胞としては、骨粗しょう症、歯周炎、periprosthetic 骨溶解2,3などの異常骨折に関連する疾患に重要です。
破骨細胞の培養の開発は、主に2つの段階に分けられる。Boyde et al.4およびチェンバース et al.5によって確立された方法は、1980年代の第一段階を構成した。彼らは急速なリモデリング期間である新生動物の骨から比較的豊富な破骨細胞を得た。破骨細胞は、特殊な培地で骨を攪拌して断片化することによって放出される。しかし、この方法によって得られる細胞は、量および純度が低い。第2段階では、骨髄破骨細胞由来の造血器系統を用いて、細胞骨格形成の長期培養物の開発を行いました。サイトカインは、例えば、1α、25−ジヒドロキシビタミン D3、プロスタグランジン E2 (pge2)、および副甲状腺ホルモン (PTH)、培養培地に添加された、破骨細胞/ストロマセルの系を通じて作用して、細胞芽層形成を刺激する7,8.しかしながら、この方法によって得られた破骨細胞の純度と量は、現代の分子生物学研究のニーズを満たすことができない。次いで、核因子-κ b リガンド (RANKL) のためのマクロファージコロニー刺激因子 (M − csf) および受容体活性化剤の発見は、osteoclastogenesis をより容易にし、そして、M − CSF を使用する方法および破骨細胞の形成を直接刺激する RANKL は、世界中で広く使用されている。しかし、改善する必要がある方法論にはまだいくつかの詳細があります。
現在、最も一般的に使用されている破骨細胞培養法は、マリノ et al.12および Pei et al.13で説明したように、しばしば骨の周りの周囲の組織の除去を必要とし、滅菌された針を使用して骨髄腔をフラッシュする完成したメディア。(1) 骨の周りの周囲の組織の除去が多くの時間と偉大な外科的技術を必要とするという事実を含め、このプロセスにはいくつかの欠点があり、(2) 骨が壊れやすく、骨髄流出につながる可能性がある、(3) 骨髄腔はフラッシュするには小さすぎると、(4) 針のスティック傷害の危険性があります。これらの問題を回避するために、骨髄を針で洗い流す代わりに、骨髄用の骨を含むチューブを遠心分離します。ここでは、従来の手順と比較して、より短時間でより少ない労力で、骨髄を分離する安定した安全な方法を紹介します。遠心分離の密度勾配の使用とともに、我々は、インビトロで大量に分化した破骨細胞を得る。
プロトコル
ここに記載されている動物を含むすべての方法は、南京中国医学大学の制度的動物ケアと使用委員会 (IACUC) によって承認します。
1. セットアップ
- いくつかの縦方向のカット 1 mL ピペットチップ (1cm) といくつかの 1.5 mL マイクロ遠心チューブを準備します。ピペットの先端およびマイクロ遠心の管を20分の 103 kPa および121° c で置き、生殖不能であることを保障しなさい。
- 氷の箱といくつかの滅菌皿を準備して、隔離手順中に隔離された組織を保存します。
2. 培養培地の調製
- 完全培養培地を準備する。ペニシリン/ストレプトマイシンの 1% および 10% 牛胎児血清 (FBS) の最終的な解決を含んでいる最低の必須の中型のアルファ (α MEM) を使用しなさい。
- 0.22 μ m フィルタを使用して、ステップ2.1 からメディアをフィルタリングします。
- 骨髄誘導培地を準備します。50 mL の溶液の場合、1万 ng/mL の濃度 (材料の表) に125μ l を加え、完全培養培地 (ステップ2.2 から) の 49.875 mL に 25 Ng/Ml の m − csf の最終的な溶液を作る。
- 破骨細胞誘導培地を準備する。50 mL の溶液の場合、1万 ng/mL の濃度 (材料のテーブル) に RANKL の500μ l を加えて、骨髄誘導培地 (ステップ2.3 から) の 49.5 mL に 25 Ng/Ml の M − CSF および 100 Ng/ml RANKL の最終的な溶液を作る。
3. 骨 mMarrow 由来細胞の単離
-
安楽死
- Euthanize 吸入によって4つのスプレイグスプラーグラットに続いて頚部脱臼が続き、75% エタノールで1分間浸す。
注:動物が同じ性別で同じ年齢のものであることを確認してください。生後 2 ~ 3 週間の動物をお勧めします。2匹のラットは遠心法のために準備され、他の2匹は従来の方法のためのものである。
- Euthanize 吸入によって4つのスプレイグスプラーグラットに続いて頚部脱臼が続き、75% エタノールで1分間浸す。
-
従来の方法
- 仰向けの姿勢で消毒板に動物を置きます。滅菌はさみを使用して、皮膚の皮をむくために近位大腿骨に小さな切開 (約 1cm) を作ります。
- 大腿骨と脛骨を解剖する。股関節、膝、足首関節の周りの二国間接続部品を切断し、脛骨と大腿骨を慎重かつ穏やかに分離します。骨の周りの組織の一部をカット;徹底的に。全体のプロセスの間に脛骨と大腿骨を骨折しないでください。
- 洗浄された骨を 5 mL の完全な培養培地の皿に入れます。滅菌はさみで長い骨を切り落とし、1 mL の注射針を使用して、骨髄腔が白くなるまで 10 mL の完全な培地で慎重に骨髄腔を洗い流す。
- ステップ3.2.3 から 50 mL チューブに細胞懸濁液を移し、次いで、70μ m ストレーナーで濾過し、残りの組織を除去する。
- 5 mL の赤血球溶解バッファー (材料表) を細胞懸濁液に加える。氷の上で8分間細胞をインキュベートします。次いで、250 x gの細胞を5分間遠心分離し、細胞ペレットを得た。
- 培地を除去し、10 mL の完全な媒体で細胞を再懸濁します。血球計数器を使用してセルをカウントし、このセクション (セクション 3.2) からのステップに費やされた時間を計算します。
-
改善方法
- 仰向けの姿勢で消毒板に動物を置きます。皮膚の皮をむくために無菌はさみで近位大腿骨で小さな切開 (約 1cm) を作る。
- 大腿骨と脛骨を解剖する。適切に骨の周りの組織の部分を遮断する (完全に除去する必要はありません)。全体のプロセスの間に脛骨と大腿骨を骨折しないでください。
- 脛骨と大腿骨を 12 mL のリン酸緩衝生理食塩水 (PBS) ですすぎ、それらを半分に切断します。送る脛骨と大腿骨を 1 mL のピペットチップ (ステップ1.1 から) に入れ、それをマイクロ遠心チューブに投入し、4° c で 45 s の 1000 x gで遠心分離します。
- 遠心分離後、骨を含むピペットチップを除去し、骨髄をチューブに残す。マイクロ遠心チューブに完全なメディアの200μ l を追加し、ピペッティングを繰り返して、骨髄を徹底的に崩壊させます。
- ステップ3.3.4 から 50 mL チューブに細胞懸濁液を移し、次いで、70μ m ストレーナーで濾過し、残りの組織を除去する。
- 血球計数器を使用してセルをカウントし、このセクション (セクション 3.3) からのステップに費やされた時間を計算します。
4. 密度勾配遠心分離による精製
- Α MEM を用いてステップ3.2.6 またはステップ3.3.5 から 2 mL に細胞懸濁液を調整する。
- 1つの滅菌 silicified 遠心チューブを準備し、8 mL の細胞分離溶液 (材料のテーブル) をチューブに追加します。
- ステップ4.1 からの細胞懸濁液を細胞分離溶液に加える。ピペットチップをチューブの内面に付着させ、内面に45°を保ちます。懸濁液を加えた後、細胞の層と分離溶液との間に明確な限界が現れる。
注:操作は細心の注意を必要とし、ゆっくりと実行する必要があります。 - 500 x gの水平遠心分離機で30分間、層状溶液を遠心分離します。遠心分離後、標的細胞を含む白濁第2層を上から下へ吸引する。
注:遠心分離の前に遠心分離機の加減速をキャンセルする。遠心分離後6層があります。第1の層は、希釈層であり、第2の層は、単球層であり、第3の層は、単核細胞の層であり、第4の層は、透明な分離液体1つの層であり、第5の層は、粒状の細胞層であり、第6階層は赤色細胞である層。 - ターゲットセルを新しいチューブに移動します。PBS を 5 mL 追加して細胞を3x 洗浄する。各洗浄後、250 x gの標的細胞を5分間遠心分離し、細胞ペレットを得た。
- 再懸濁は骨髄誘導培地で細胞ペレットを採取し、血球計数器を用いて細胞を計数する。ステップ2.3 から5– 8 mL の骨髄誘導培地を添加し、30万細胞/ml の最終細胞溶液を得た。24ウェルプレートの各ウェルに1Ml を加えます。
5. 文化と分化
- 37° c で24時間インキュベートした後、徐々に培地を外に吸引し、それぞれの井戸に破骨細胞誘導培地の1ml を加えます。軽くプレートを攪拌し、37° c のインキュベーターに入れます。
- 48毎に破骨細胞誘導培地を変更する。そうしながら、ウェル内の培地の 0.8 mL を変更し、プレートをやさしく攪拌。
注:大、運動性、および多核破骨細胞は、通常、2〜6日前後に倒立顕微鏡下で十分に観察されるべきである。
6. 酒石酸塩耐性酸ホスファターゼ染色
注:Multinucleate 破骨細胞は、誘導 (第5項) が成功した場合、4 ~ 6 日後に存在する。
- 4 mL の 37% ホルムアルデヒド、32.5 mL のアセトン、および 12.5 mL のクエン酸塩溶液を組み合わせることにより、定着性溶液を調製します。固定液を4° c で保存します。
- 50μ l の亜硝酸ナトリウム、50μ l の高速ガーネット・ GBC の塩基液、50μ l のナフトールリン酸溶液、200μ l の酢酸塩溶液、および100μ l を添加することにより、酒石酸塩耐性酸性ホスファターゼ (TRAP) 染色溶液 (材料表) を準備します酒石酸塩溶液を37° c に prewarmed た脱イオン水の 4.55 mL に。その後、1分間の反転によって穏やかに混合し、それが2分間放置してみましょう。
- 破骨細胞の誘導が成功した後、培地を外に吸い出し、PBS でウェル3倍を優しく洗浄する。
- 定着液を室温 (RT) に戻します。30秒間ウェルに 2 mL の定着性溶液を加え、細胞を乾燥させない。
- 固定液を吸引し、37° c に prewarmed した脱イオン水で軽く洗ってから、水を吸引します。
- 37° c で1時間 2 mL のトラップステインソリューションを追加し、サンプルを暗所に保ちます。
- 1時間後、染色液を吸引し、37° c に prewarmed した脱イオン水でサンプルをやさしく洗い、その後、水を吸引します。
- ヘマトキシリン溶液中で1分間細胞を対比染色。染色後、ヘマトキシリン溶液を吸引し、イオン交換水で細胞3x をやさしく洗浄する。
- 明視野顕微鏡を用いた画像破骨細胞、及び3つ以上の核を有する TRAP+セルは紫色に見えるであろう。
7. トルイジンブルー染色を用いた骨吸収アッセイ
-
骨スライスの前処理
- 新鮮なウシ大腿骨の皮質を microelectric によって長手方向の軸に沿って2cm 厚のスライスに切ります。次に、硬質組織粉砕機でスライスを80μ m に切断して粉砕する。
- 1時間の脱イオン水と 100 Hz 超音波でビーカーにスライスを洗浄し、3x を繰り返します。
- 2時間の 75% のアルコールにスライスを浸します。その後、アルコールを吸引除去し、きれいなプラットフォーム上で1時間紫外線にスライスの各側を露出させます。
- 細胞を植える前に、少なくとも2時間培養培地にスライスを浸します。
-
トルイジンブルー染色
- 前処理された骨スライスを24ウェルプレートに置きます。ステップ4.6 で述べたように細胞を植え、セクション5で述べたように細胞を誘導する。
- 破骨細胞 (4 ~ 6 日後) の出現後、1ml の0.25 メートルの水酸化アンモニウムでスライスを洗い、それぞれ5分間3x 超音波処理して、骨スライス上の再吸収ピットの分析を可能にするために生きている細胞を除去する。その後、水酸化アンモニウムを除去し、2分間1スライスあたり 1% の 1Ml (wt/vol) トルイジンブルー溶液でスライスを染色します。
- PBS でスライスを洗います。5つのビューをランダムに選択し、画像解析ソフトウェアを使用して再吸収領域の semiquantitative 解析を実行します。
8. 走査型電子顕微鏡
- ステップ7.2.1 のボーンスライスに、RT で2時間 2.5% グルタルアルデヒドの 1 mL を使用し、その後、1 M の水酸化アンモニウムを使用してそれぞれ3分間、超音波処理のスライスを入れて、細胞を除去し、水酸化アンモニウムを除去します。
- PBS で12分ごとに骨スライスを3倍洗浄します。
- RT で 2 h の 1% osmic 酸で骨スライスを固定します。
- エタノール勾配脱水は、50%、70%、80%、90%、95% エタノールを用いて、全ての勾配に対して15分間、次いで、エタノールを15分間 isoamyl 酢酸塩と交換する。
- スライスを金パラジウムでコーティングし、その後、走査型電子顕微鏡によって分析する。
9. カルシトニン受容体の免疫蛍光染色
注:Multinucleate 破骨細胞は、誘導が成功した場合、4 ~ 6 日後に存在する (第5項)。
- 培地から吸引し、PBS で十分に3倍のウェルを洗浄します。
- 4% のパラホルムアルデヒドで10分間細胞を固定し、4° c に脱ます。
- 氷上で30分間、0.3% の非イオン性界面活性剤を用いて PBS 1ml を加えます。その後、0.3% の非イオン性界面活性剤で PBS を吸引し、氷上で30分あたり 5% の FBS で PBS を 1 mL 加えます。
- PBS を吸引し、PBS の1:100 希釈で抗カルシトニン受容体 (抗 CTR) で膜を一晩4° c でインキュベートします。
- 溶液を吸引除去し、RT での PBS-488-コンジュゲート抗ウサギ IgG 抗体を 1: 1000 希釈で、1h についての膜をインキュベートします。
- 溶液から吸引し、細胞を PBS でゆっくりと3x 洗浄します。RT で3分間ヘキスト33342染色で核を対比染色します。
- 溶液から吸引し、PBS で細胞3x を優しく洗い流す。蛍光顕微鏡による CTR の強さを観察しなさい。
結果
このプロトコルの目的は、多数の破骨細胞前駆体を簡便に分離して浄化し、破骨細胞を正常に誘導することであった。M − CSF および RANKL を補うことにより、巨大破骨細胞が 5 ~ 6 日目に見られた。破骨細胞の形成はトラップ染色によって首尾よく同定された (図 1a)。大規模で紫色の細胞は、複数の核 (典型的には≥3つの核) を持つ TRAP 陽性細胞とみなされていました。この方法により、破骨細胞あたり30個の核を含む800破骨細胞を24ウェルプレートに得ることが典型的であった (図 1b)。従来の方法と比較して、改良された方法は、全体の分離の進行において約20分を節約した (図 1c)。
骨吸収の活性を評価するためにボーンスライスを使用することは、典型的な in vitro 法である。トルイジンブルー染色により、吸収領域を薄緑色 (図 2a) で可視化し、算出した。骨ピットの構造と特徴は、走査型電子顕微鏡によって明らかに観察された (図 2b)。
この CTR は、破骨細胞特異的マーカーの1つで、破骨細胞を同定し、骨の破骨細胞の形成を研究するために重要である。CTR のポジティブな表現は、破骨細胞を明確に識別し、マクロファージ polykaryons と区別する。CTR は免疫蛍光アッセイによって検出された。緑色は CTR の表現を示し, 青は原子核を示した (図 3)。
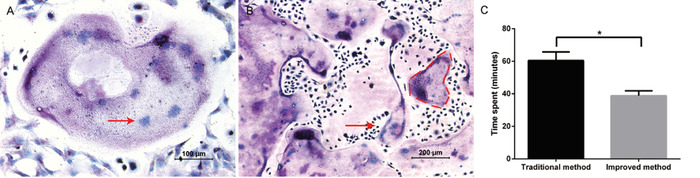
図 1: 骨髄由来細胞からの Osteoclastogenesis(A) トラップ染色の代表的な画像。10倍の倍率で明視野顕微鏡は、トラップ陽性であり、20倍の倍率で観察された複数の巨大な、多核破骨細胞を示しています。多核破骨細胞内の核の一例は、赤い矢印で示されている。(B) 10x 倍率の明視野顕微鏡は、多数の TRAP 陽性破骨細胞が存在していたことを証明している。大きな、多核破骨細胞の例は、赤い破線で概説されています。(C) 2 つの分離方法に費やされた時間の比較。すべての操作は、同じグループの実験者によって実行されました。データは、平均値±標準偏差を表します。*P < 0.05、 n = 3 である。この図の大規模なバージョンを表示するには、ここをクリックしてください。
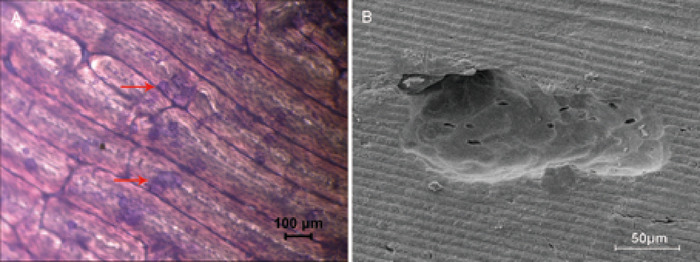
図 2: 骨スライスによる骨吸収アッセイ。(A) 4 倍倍率での明視野顕微鏡は骨吸収領域を示し、トルイジンブルーステインによって薄緑色に染色され、丸型、楕円形、またはソーセージ型である。骨吸収領域の一例を赤い矢印で示す。(B) 500 分倍率で走査型電子顕微鏡で観察した再吸収ピット。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 3: 免疫蛍光染色を用いた破骨細胞における CTR 発現の特徴付けパネルには、セルの周りに明確な CTR シグナルが表示されます。(A) CTR 陽性の細胞。(B) 核。(C) がマージされます。この図の大規模なバージョンを表示するには、ここをクリックしてください。
ディスカッション
インビトロで破骨細胞を得、研究する能力は、骨代謝を研究したい研究者にとって重要かつ基礎的な技術であり、骨吸収疾患のメカニズムを理解し、新しい治療薬を開発するのに役立つ可能性がある。本研究は、以前の方法に基づくいくつかの変更を伴うプロトコルについて説明した。
マイクロ遠心を使用することにより、骨髄を取得するためにピペットの先端および管を用いることによって、従来の方法と比較される骨髄および実験室の人員の作業負荷を得ることの操作の時間を主に減らした。一方、この方法は、骨髄損失または針スティック傷害のリスクを回避する。以前の研究では、骨髄由来細胞を単離12,13の直後に播種した。遠心分離の密度勾配は、決済係数の違いに応じて骨髄単球を選択するために使用した。密度勾配遠心分離の過程で、細胞分離培地の添加は、境界を明確にするために、壁に沿って穏やかかつ慎重に行われなければならない。しかし、この技術は、遠心分離機の機能および加減速のパラメータで設定されているかどうかによって制限される。播種密度は、破骨細胞の培養における重要な条件である。数回、細胞をめっきするときに不適切な播種密度のためにプロトコルが失敗しました。したがって、このプロトコルでは、24ウェルプレートウェルあたり約30万のセルが推奨されます。このプロトコルはまた、ラットまたは他の動物 (例えば、マウス、ウサギ、およびニワトリ) における骨髄由来細胞の様々な種類を得るために適切である。
破骨細胞の活性を評価する最も古典的な方法は、再吸収ピットアッセイである。牛骨の皮質は源が広く利用できるので再吸収のピットの試金のために一般に使用される。現代区分システムの助けによって、私達はより容易に薄い骨のスライスを得ることができる。再吸収ピットアッセイには3つの因子がある。スライス中の再吸収ピットを正常に生成するために、スライスは、プロトコルにおける脱脂について説明されるように厳密に扱われなければならない。さらに、ラット破骨細胞は、わずかに酸性環境で再吸収ピットを形成するために活性化され、そして再吸収機能は、pH が 7.214,15以上に上がると、本質的に「シャットダウン」します。したがって、実験の進行中にインキュベーターのドアを頻繁に開くことは、pH および pCO2値の摂動につながり得ることが注目され、破骨細胞16の再吸収機能にも影響を及ぼす可能性がある。最後に、骨のスライスは、ウェルの底部に残っている必要があり、刺激を避けるために、媒体を変更するときに移動したり、フロートアップするべきではありません。
CTR はまた、副甲状腺ホルモンおよびセクレチン受容体17を含む7回膜貫通型 G タンパク質共役受容体のクラス II サブファミリーの1つのメンバーである。トラップ染色や吸収ピットアッセイと同様に、破骨細胞は形態と機能によって同定され、CTR 陽性は免疫破骨細胞を特定します。現在では、アクチン環の蛍光染色を使用し、上清の pyridinoline 架橋を測定して破骨細胞を同定することもできます。
異なる研究者は、実験技術と異なる気づいを持っていますが、骨髄の細胞の総量は確かですが、我々はより短い時間で骨髄細胞を得ました、比較的、そして最終的には、完全に大量に得られたラット骨髄から分化した破骨細胞
開示事項
作者は何も開示することはありません。
謝辞
この作品は、中国の国立自然科学財団 (81473692) にヨン・マによって支えられました。著者は、南京中国医学大学の臨床医学の最初の大学の医学研究センターのすべてのスタッフに感謝します.
資料
| Name | Company | Catalog Number | Comments |
| Acid Phosphatase, Lekocyte (TRAP) kit | Sigma-Aldrich | 387A | |
| Automatic Hard Tissue Slicer | Lecia | RM2265 | |
| Bovine femoral bone | Purchased by ourselves | ||
| Cell Incubator | Heraus | BB16/BB5060 | |
| Fetal Bovine Serum | Sarana | s-fbs-au-015 | |
| Goat Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150077 | |
| Hard Tissue Grinders | Lecia | SP-2600 | |
| Histopaque Kit | TianJing Haoyang | TBD2013DR | Silicified centrifugal tube amd cell separation solution |
| Hochest33342 | Sigma-Aldrich | B2261 | |
| Inverted Phase Contrast Microscope | Olympus | CKX31 | |
| Inverted Fluorescence Microscope | Lecia | DMI-3000 | |
| MEM, no Glutamine | Gibco | 11090-081 | |
| Penicillin-Streptomycin, Liquid | Gibco | 15140122 | |
| Rabbit Anti-Calcitonin receptor | Bioss | bs-0124R | |
| Recombinant Rat M-CSF | PeproTech | 400-28 | |
| Recombinant Rat sRANK Ligand | PeproTech | 400-30 | |
| Red Blood Cell Lysis Buffer | Absin | abs47014932 | |
| Scanning Electron Microscopy | FEI | Quanta 200 | |
| Toluidine Blue | Sigma-Aldrich | 89649 |
参考文献
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Kular, J., Tickner, J., Chim, S. M., Xu, J. K. An overview of the regulation of bone remodelling at the cellular level. Clinical Biochemistry. 45 (12), 863-873 (2012).
- Park, S. J., et al. Apoptosis of the reduced enamel epithelium and its implications for bone resorption during tooth eruption. Journal Of Molecular Histology. 44 (1), 65-73 (2013).
- Boyde, A., Ali, N. N., Jones, S. J. Resorption of dentine by isolated osteoclasts in vitro. British Dental Journal. 156 (6), 216-220 (1984).
- Chambers, T. J., Revell, P. A., Fuller, K., Athanasou, N. A. Resorption of bone by isolated rabbit osteoclasts. Journal of Cell Science. 66, 383-399 (1984).
- Takahashi, N., et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrinology. 122 (4), 1373-1382 (1988).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Suda, T., Takahashi, N., Martin, T. J. Modulation of osteoclast differentiation. Endocrine Reviews. 13 (1), 66-80 (1992).
- Yoshida, H., et al. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature. 345 (6274), 442-444 (1990).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of The National Academy of Sciences of The United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Marino, S., Logan, J. G., Mellis, D., Capulli, M. Generation and culture of osteoclasts. BoneKEy Reports. 3, 570 (2014).
- Pei, J. R., et al. Fluoride decreased osteoclastic bone resorption through the inhibition of NFATc1 gene expression. Environmental Toxicology. 29 (5), 588-595 (2014).
- Arnett, T. R., Dempster, D. W. Effect of pH on bone resorption by rat osteoclasts in vitro. Endocrinology. 119 (1), 119-124 (1986).
- Arnett, T. R., et al. Hypoxia is a major stimulator of osteoclast formation and bone resorption. Journal of Cellular Physiology. 196 (1), 2-8 (2003).
- Orriss, I. R., Arnett, T. R. Rodent osteoclast cultures. Methods in Molecular Biology. 816, 103-117 (2012).
- Quinn, J. M., et al. Calcitonin receptor antibodies in the identification of osteoclasts. Bone. 25 (1), 1-8 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved