Method Article
Sistein Thiols rekombinant proteinler Vitro siteye özgü Glikozilasyon için hedefleme
Bu Makalede
Özet
Biyokimyasal ve yapısal analizleri glikozile proteinlerin homojen örnekleri nispeten büyük miktarda gerektirir. Burada, reaktif Cys thiols hedefleyerek bakterilerden saflaştırılmış rekombinant proteinlerin siteye özgü Glikozilasyon için verimli bir kimyasal yöntem mevcut.
Özet
Stromal etkileşim molekülü-1 (STIM1) bir türüdür-ben transmembran protein bulunan endoplazmik retikulum (ER) ve plazma membran (AM). ER-resident STIM1 am Orai1 kanalları bağışıklık yanıtı sürücüler asıl Ca2 + sinyal gönderme işlemi olan işletilen kalsiyum (Ca2 +) girişi saklamak olarak bilinen bir süreç içinde etkinlik düzenlemektedir. STIM1 Ca2 + algılama etki molekülün içinde iki luminal Asn sitelerdeki post-translational N- glikozilasyon uğrar. Ancak, biyokimya, biyofizik, ve N- glikozile STIM1 yapısı biyolojik etkileri kötü kolaylıkla homojen N- glikozile protein yüksek seviyede elde etmek için son zamanlarda bir yetersizlik nedeniyle kadar anladım. Burada, hangi temel N- glikozilasyon protein yapısı ve etkileri mekanizmasını anlamak için ilgili belirli protein sitelere glikoz moieties verdiği bir vitro kimyasal yaklaşım uygulanması açıklanmaktadır. Çözüm Nükleer manyetik rezonans spektroskopisi kullanılarak değişiklik her iki verimliliğini yanı sıra tek bir örnek glikoz ekli yapısal sonuçlarını değerlendirmek. Bu yaklaşım kolayca doğada bulunan sayısız glikozile proteinler çalışmaya adapte edilebilir.
Giriş
İşletilen kalsiyum (Ca2 +) depolamak girişidir (SOCE) hangi tarafından bağışıklık hücreleri almak Ca2 + sitozol ekstraselüler uzaya üzerinden büyük yol. T lenfositler, plazma zarı (PM) yer alan T hücre reseptör protein tirozin kinaz ( 1,2,3' te gözden) etkinleştirmek antijenleri bağlayın. Bir fosforilasyon çağlayan fosfolifaz-γ (PLCγ) hangi daha sonra diacylglycerol ve inositol 1,4,5-trisphosphate (IP3 membran phosphatidylinositol 4,5-bisphosphate (PIP2) hidroliz aracılık eder aktivasyonu yol açar ). IP3 konsantrasyon degrade acil servis üzerinden aşağı akmaya böylece bu reseptör kanal açma ve Ca2 + izin IP3 için (IP3R) üzerinde reseptörleri endoplazmik retikulum (ER) bağlayan bir küçük diffusible elçisidir Lümen ( 4' te gözden) sitozol için. Reseptör birleştiğinde gr protein ve tirozin kinaz reseptörleri başka bir heyecanlı ve telaşlı hücre türleri sorumlu çeşitli IP3 aynı üretim ve IP3Rs aktivasyonu için sinyal.
Sonlu Ca2 + depolama kapasitesini ER, IP3nedeniyle-aracılı yayın ve sonuç artış sitozolik Ca2 + sadece geçici; Bununla birlikte, bu tükenmesi ER luminal Ca2 + derinden stromal etkileşim molekülü-1 (STIM1), bir tür etkiler-ben transmembran (TM) protein çoğunlukla üzerinde ER membran 5,6,7bulundu. STIM1 bir EF-el çift ve steril α-motifi (EFSAM) oluşan bir Lümen odaklı Ca2 + algılama etki alanı içerir. Üç sitozolik odaklı dolandı-coil etki alanı EFSAM ( 8' gözden) tek TM etki alanı tarafından ayrılır. ER luminal Ca2 + tükenmesi, yapısal düzenlemeler TM ve kıvrılmış-coil etki alanları 10neden bir istikrarsızlık birleştiğinde Oligomerizasyonda 7,9 EFSAM uğrar. Bu yapısal değişiklikler yayınlanmasından sonuçlanan bir bindirme STIM1 ER-PM kavşak 11,12,13,14 PM phosphoinositides 15, ile etkileşimleri aracılığıyla 16 ve Orai1 alt birimleri 17,18. Orai1 forma Ca2 + kanal 19,20,21,22araya PM alt birimleri proteinlerdir. STIM1-Orai1 etkileşimleri ER-PM kavşaklar, Ca2 + yüksek konsantrasyonda üzerinden sitozol içine hareketini sağlayan bir açık Ca2 + aktif yayın Ca2 + (CRAC) kanal uyum kolaylaştırmak Ekstrasellüler boşluk. Bağışıklık hücreleri içinde sürekli sitozolik Ca2 + yükselmeler CRAC kanalları üzerinden Ca2 +- calmodulin/kalsinörin bağımlı dephosphorylation daha sonra çekirdek girer nükleer faktör aktive T-hücrelerinin neden ve T-hücre harekete geçirmek 1,3teşvik genlerin transkripsiyon yönetmelik başlar. Agonist kaynaklı luminal Ca tükenmesi2 + ER via STIM1 23,24 ve elde edilen sürekli sitozolik Ca2 + yükseklik tarafından CRAC kanal etkinleştirme işlemi toplu olarak SOCE 25olarak adlandırılır. SOCE T-hücreleri hayati rol tarafından ağır kombine immün yetmezlik sendromları 3,19,26, STIM1 ve Orai1 kalıtsal mutasyonların neden olabilir gösteren çalışmalar belirgindir 27. EFSAM başlatır SOCE ER luminal Ca2 + tükenmesi kaybı ile Ca2 + koordinasyon kurallı EF-el, sonuçta kendi kendine Derneği istikrarsızlık birleştiğinde 7, önde gelen algılama sonra 28,29.
Glikozilasyon kovalent eki ve işleme oligosakkarit yapıları, olarak da bilinen glukanlardir, ER ve Golgi ( 30,32,33gözden) çeşitli biyosentetik adımlarda var. Glikozilasyon Ökaryotlar iki baskın tür vardır: N-bağlantılı ve O-bağlı, belirli amino asit ve bağlantı köprüleme atom bağlı olarak. N- glikozilasyon, glukanlardir Asn yan zinciri Amid için eklenir ve çoğu durumda, inisiyasyon adım serviste oluşur polipeptid zinciri Lümen 34taşır. Glikoz (Glc), mannoz (adam) ve N- peptidoglikan (GlcNAc) (yani Glc3Man9GlcNAc2) acil servise oluşur On dört-şeker çekirdek yapısı transferini N- glikozilasyon, ilk adımdır membran lipid oligosaccharyltransferase 35,36tarafından. Daha fazla adımlar, bölünme veya glikoz artıkları, transfer gibi acil serviste belirli glycosidases ve glycosyltransferases tarafından katalize. Acil servis bırakın ve Golgi hareket bazı proteinler daha fazla işlenmiş 37olabilir. Glukanlardir, genellikle Ser veya Thr artıkları, yan zinciri hidroksil grubu için ek O- glikozilasyon başvurduğu ve bu değişiklik tamamen Golgi kompleksi 33,34oluşur. Kadar yapılabilir N- peptidoglikan, fucose, galaktoz birkaç O- glycan yapıları ve sialik asit her yaşam ile sırayla 33ekledi.
Hiçbir belirli sıra adl tip-in O- glikozilasyon, için önkoşul olarak tanımlanan süre ortak bir fikir birliği sırası Nile ilişkili olduğu düşünülmektedir-bağlantılı değişiklik: Asn-X-Ser/Thr/nerede X-ebilmek var olmak herhangi bir amino asit Cys, Pro 33. STIM1 EFSAM iki bu fikir birliği N- glikozilasyon sitelerin içerir: Asn131-Trp132-Thr133 ve Asn171-Thr172-Thr173. Gerçekten de, önceki çalışmalar EFSAM N- glikozile 38,39,40,41Asn131 ve Asn171 memeli hücrelerinde olabilir göstermiştir. Ancak, N- glikozilasyon SOCE üzerinde sonuçları önceki çalışmalarda uyumsuz olmuştur, düşündüren bastırılmış, potentiated veya hiçbir etkisi bu translasyonel modifikasyon tarihinde SOCE harekete geçirmek 38, tarafından"xref" = > 39,40,41. Böylece, EFSAM N- glikozilasyon temel biyofiziksel, biyokimyasal ve yapısal sonuçları üzerinde araştırma bu değişiklik düzenleyici etkileri kavrama için hayati önem taşımaktadır. Bu vitro deneyler homojen proteinler yüksek düzeyde gereksinimini nedeniyle kovalent glikoz moieties için EFSAM eklemek için site seçici bir yaklaşım uygulandı. İlginçtir, Asn131 ve Asn171 glikozilasyon içinde EFSAM çekirdek yakınsama ve SOCE STIM1-aracılı 42teşvik biyofiziksel özellikleri geliştirmek yapısal değişiklikler nedeniyle.
Cys thiols kimyasal bağlanma glikosil gruplarının köklü tarafından ilk protein işlevi 43 siteye özgü glikozilasyon etkilerini anlamak için bu enzim-Alerjik yaklaşımın gösterdi seminal bir çalışma oldu , 44. son zamanlarda ve saygı ile STIM1, Asn131 ve Asn171 artıkları için Cys mutasyona uğramış ve glucose-5-(methanethiosulfonate) [glucose-5-(MTS)] kovalent glikoz için ücretsiz thiols 42bağlamak için kullanıldı. Burada, biz sadece mutagenesis site belirli Cys artıkları değişiklik için birleştirmek için kullanır ama çözüm Nükleer manyetik rezonans (NMR) spektroskopisi hızla değişiklik verimliliği ve yapısal değerlendirmek için de geçerlidir bu yaklaşım tarif tedirginlikler glikozilasyon bir sonucu olarak. Özellikle, bu genel metodoloji ya O- etkileri çalışmaya kolayca uyarlanabilir veya N- glikozilasyon herhangi recombinantly protein üretilen.
Protokol
1. Polimeraz zincir tepkimesi (PCR)-site yönettiği mutagenesis Cys birleşme bir bakteriyel evde beslenen hayvan-28a ifade vektör içine aracılı.
- 260 0,020 (μg/mL) cm -1 ultraviyole (UV) nesli katsayısı kullanarak evde beslenen hayvan-28a vektör (Yani çift iplikçikli DNA) konsantrasyonu belirlemek nm.
- Sentez böyle her Cys mutasyon için tamamlayıcı mutajenik astar bir çift ben) tamamlayıcı ilk Bankası uyuşmazlığı ve 15 nukleotid sonra şablonu için tamamlayıcı önce şablon için en az 15 nükleotit son temel uyumsuzluğu, II) toplam astar uzunluğu 45 nukleotid ve III fazla değil) bir guanin veya sitozin her astar (tablo 1) ilk ve son nükleotit konumunda yer alır. Astar sentez 0.025 μmol ölçek ve kartuş arıtma kullanarak yapılır olun.
- Yüksek sadakat DNA polimeraz, kullanarak iki 20 µL PCR reaksiyon karışımları ayarla: bir ileri astar ve ikinci içeren ters astar içeren. Son 1 x PCR arabellek 1.5 mM MgCl 2, 0.2 mM dNTPs, 0.5 mikron astar, 0.4 μL DMSO, konsantrasyonları içeren her karışım hazırlamak 1,25 ng/μL şablon DNA, 0,02 U/μL yüksek sadakat DNA polimeraz.
- Termal döngüsü bir üç adım iletişim kuralı kullanılarak ayrı karışımları: 30 98 ° C (denaturing) s, 53-56 ° C 30 (TAV), s 30 s kilobase(kb) -1 (uzantısı) şablonunun DNA için 72 ° C. Sıcaklık programı 5 döngüleri için yineleyin ve son 72 ° C uzantısı adım 7.5 dakika süreyle ekleme
- Sonra ilk PCR ile ileriye ve geriye doğru astar ayrı borular içinde ürünler tek tüp (yani 40 μL toplam) içine birleştirmek ve 1.4. adımda açıklandığı gibi aynı Bisiklete binme parametrelerini kullanarak bir ek 20 döngü için PCR reaksiyon devam.
- Electrophorese 15 μL %1 (w/v) özel PCR reaksiyon karışımı jel 0.5 x Tris, Asetik asit, etilen diamin tetra Asetik asit (EDTA) arabellek (TAE) çalıştıran kullanarak. Denetimleri şablon DNA PCR tarafından güçlendirilmiş değil eşit miktarda ve marker bantları hem büyük hem de beklenen PCR ürünü boyutu daha az içeren başvuru DNA merdivenin bir aliquot electrophorese.
- 120 V 40 dk Elektroforez sonra suda 0.5 μg/mL arasında etidyum bromür ve sallamak için oda sıcaklığında 30 dk içeren jel daldırın. Tam uzunlukta şablonu güçlendirilmiş mutajenik astar tarafından bir artış güçlendirilmiş grubun denetim şablonu grup UV ışığı altında karşılaştırıldığında göreli etidyum bromür floresan yoğunluğu içinde onaylamak (302 nm).
- Yok amplifikasyon belirgindir, PCR tavlama sıcaklığı arasında 53-56 ° C sıcaklık aralığı 0.5 ° C artışlarla ayarladıktan sonra yineleyin.
- Şablon mutajenik astar tarafından amplifikasyon onayı kalan ~ 25 μL PCR reaksiyon karışımdan metillenmiş şablon DNA sindirmek için DpnI restriksiyon enzimi ile tedavi. DpnI 0.5 µL (10 adet) 1 × DpnI reaksiyon arabellek son bir konsantrasyon başı 25 μL PCR reaksiyon karışımı kullanın. 37 ° C'de 2,5 h için kuluçkaya
- Şablon sindirim, takip Ekle ~ 5-10 μL ısı 100 µL sindirilir karışıma, şok bir 1,75 mL microcentrifuge tüp yetkili DH5α Esherichia coli hücrelerde. Hücre DNA karışımı 60 dakika süreyle buz üzerinde kuluçkaya Kuru sıcak blokta
- ısı şok microcentrifuge tüp 45 için 42 ° C'de hücre DNA karışımı s. 3 dakika buzda karışımı kuluçka sonra oda sıcaklığında Luria-Bertani suyu (LB) 900 μL hücrelere ekleme ve toplam hücre süspansiyon steril 14 mL yuvarlak alt tüp içine transfer.
- Sürekli 190 devir / dakikada sallayarak ile hücre süspansiyon 90 dk 37 ° C'de kuluçkaya.
- Daha sonra geri içine bir 1,75 mL microcentrifuge tüp ve oda sıcaklığında 5 min için 10.000 x g, santrifüj hücre süspansiyon transfer.
- Santrifüjü sonra süpernatant ile 900 μL kaldırmak ve nazik LB. kalan 100 μL içinde pipetting tarafından bakteri hücreleri resuspend
- Sonuç konsantre hücre süspansiyon ifade vektör (Yani 60 μg/mLKanamycin) için seçici olan antibiyotik içeren bir LB-agar plaka üzerine aktarın. Aseptik süspansiyon agar plaka üzerinde eşit olarak yayılmış ve ~ 16 h 37 için kuluçkaya ° C.
- Ertesi gün 5 mL sıvı lb antiobiotic seçim basınç (Yani 60 μg/mL sefaloridin) içeren bir koloni plaka aşılamak. Sıvı kültür gecede 37 ° C'de sabit 37, sallayarak ile büyümek ° C.
- İzole ve yayılan plazmid alkalin lizis yordamı 45 üzerinde dayalı bir ticari olarak mevcut kit kullanarak E. coli hücrelerden arındırmak.
- Faiz mutasyon mevcut ve uygun okuma çerçevesi Sanger DNA sıralama plazmid 46 tarafından onaylayın.
2. Üniforma 15 BL21 ΔE3 Escherichia coli ifadede N etiketli protein.
Not: farklı rekombinant proteinler farklı ifade koşulları gerektirir. Aşağıdaki ifade insan STIM1 EFSAM protein için en iyi duruma getirilmiş bir işlemdir.
- BL21 ΔE3 kodon (+) ısı şok yetkili hücrelere Cys mutasyonlar (yani evde beslenen hayvan-28a-EFSAM) barındıran ifade vektör dönüştürmek ve plakası 1.9-1.14 adımlarda açıklandığı gibi antibiyotik seçimi basınç içeren LB-agar plakaları) ile değişiklikleri takip: doğrudan plaka ~ 1000 μL toplam hücre süspansiyon microcentrifuge tüp hücrelerde Santrifüjü tarafından konsantre gerek kalmadan LB-agar tabakta dışında 150 μL aliquot.
- Ertesi gün, aseptik aktarım bir koloni 200 mL Erlenmeyer lb uygun antibiyotik (Yani 60 μg/mL sefaloridin için evde beslenen hayvan-28a-EFSAM) ile takıma 20 mL içeren şişesi içine. Bu sıvı starter kültür gecede (yani ~ 16 h) 37 ° c de sabit sallayarak ile büyümek ~ 190 rpm.
- Adım 2.2 olarak aynı gün, M9 hazırlamak için 15 protein N etiketli ifade ısıyla tarafından orta M9 1 litre arabellek tuzları (42 mM Na 2 HPO 4, 22 mM KH 2 PO 4, 8,6 mM NaCl, pH 7,4) bir 4 L Erlenmeyer şişesi. Serin bir kez, %20 (w/v) D-glikoz, 1 M CaCl 2, 1 M Tiamin, 1 M MgSO 4, 1 mg/mL biotin ve 0.2 g/mL 15 N-NH 4 Cl karışımı içine 1 L steril M9 tuz solüsyonu 0,2 mikron steril enjektör filtre aracılığıyla filtre böylece Bu bileşenler son konsantrasyonları vardır %0,2 (w/v) D-glikoz, 100 mikron CaCl 2, 50 mikron Tiamin, 1 mM MgSO 4, 1 μg/mL biotin ve 1 mg/mL 15 N-NH 4 CL
- Ertesi gün, aseptik 20 mL gecede sıvı starter kültür 50 mL steril konik tüp ve santrifüj 2.400 × g hücreleri cips için 15 dakika için de içine transfer.
- Elde edilen hücre Pelet M9 en az orta 10 ml LB orta decanting sonra resuspend ve resuspended Pelet karışımı içine 1 L M9 en az orta antibiyotik (Yani 60 μg/mL sefaloridin) ile transfer.
- ~0.6-0,8 M9 en az orta bakteriyel starter kültür 37 ° C ve 600 nm (OD600) ulaştığı, optik yoğunluk kadar sallayarak ~ 190 rpm sabit içeren 1 litre büyümek.
- Specfified OD600 aralığı ulaşıldığında, izopropil β-D-1-thiogalactopyranoside (IPTG) protein ifade ikna etmek için 200 mikron ekleyin.
- ~ 16 h (Yani gece) ~ 190 rpm sabit sallayarak ile ortam sıcaklığı protein ifade için hücreleri kuluçka IPTG eklenmesinden sonra devam.
- Ertesi gün aralıklarla ~ 10.000 × g, 4 ° C'de 30 dakika süreyle, bakterilerin hasat
- LB dikkatle boşaltmak ve hücre Pelet 50 mL konik tüp içine aktarın. -80 ° C'de Pelet arıtma kadar mağaza.
3. E. coli rekombinant protein saflaştırma.
Not: farklı rekombinant proteinler ayrı arıtma yordamlar gerektirir. İletişim kuralı için 6 ve #215 aşağıdadır; O'nun öğesini EFSAM arıtma dahil--dan evde beslenen hayvan-28a yapı ifade organları.
- El ile 6 M guanidin-HCl, 20 mM Tris-HCl (pH 8) içinde donmuş bakteri hücre Pelet homojenize ve 5 mM β-mercaptoethanol motorlu 10 mL transfer pipet kullanarak. Guanidin-HCl 5 mL ıslak cep Pelet bu adım için de başına yaklaşık 40 mL ekleyin.
- Aşağıdaki bir 90 dk kuluçka hibridizasyon fırında sürekli rotasyon ile ortam sıcaklığı, santrifüj kapasitesi ~ 15.000 × g, çözünür protein çözünmez hücre artıkları (Yani pelet) ayırmak 40 dk 8 ° C karisimin karışımı (yani süpernatant).
- (V/v) Ni 2 + % 50 µL eklemek 750-nitrilotriacetic asit özel boncuk lysate Bulamaç için açıklık ve inversiyon hibridizasyon fırında ile oda sıcaklığında başka bir 90 dakika için kuluçkaya.
- Daha sonra bağlı Ni 2 + için özel boncuk bir yerçekimi akışı protein arıtma sütununda toplayarak 6 × O'nun öğesini protein yakalamak. Lysate üzerinden tamamen 3.5 adıma geçmeden önce sütun akmaya izin.
- 10 mL 6 M üre, 20 mM Tris-HCl pH 8 ve 5 mM β-mercaptoethanol ile üç kez toplanan boncuk yıkayın. Tüm 10 mL sütunun sonraki her 10 mL önce geçer emin olmak yıkama
- Elute 2 mL kesirler 6 M üre, 20 mM Tris-HCl pH 8, kullanarak bir dizi proteinler 300 mM imidazole ve 5 mM β-mercaptoethanol 90 s kuluçka süresi arasında kesirler ile. Tüm 2 mL sütun her sonraki elüsyon adım önce geçtiği olun.
- Bu aşamada faiz protein Laemmli 47 yöntemini kullanarak Coomassie mavi lekeli Sodyum Lauryl Sülfat polyacrylamide Jel Elektroforez (SDS-sayfa) tarafından eluted kesirler mevcut olduğunu onaylayın. Protein boyutu, miktarı ve saflık bir karşılaştırma her ikisi de olan standart molekül ağırlığı marker bantları karşı değerlendirmek daha az ve beklenen molekül ağırlığı daha büyük ilgi proteinin.
- Diyaliz membran 3.500 Da Moleküler ağırlığı kesme içine eluted protein kesirler havuz ve 1 L refolding tampon (20 mM Tris, 300 mM NaCl, 1 mM DTT, 5 mM CaCl 2, pH 8) 4 ° C'de kuluçkaya arabellek magneti tarafından karıştırılır iken bir gecede c karıştırıcı.
- ~ 16 h refolding zaman, sonra ~ 1 U Trombin mg protein doğrudan diyaliz çanta için ücret ekleyin ve ek ~ 24 h için 4 ° C'de kuluçkaya
- 6 × ölçüde onun etiketi bölünme hangi polyacrylamide kullanarak jelleri (SDS-sayfa) denaturing electrophoresed önce ve sonra kuluçka Trombin ile diyaliz çantasından alınan ~ 15 μL protein aliquots, Coomassie-mavi boyama doğrulayın Laemmli 47 yöntemi. Cleaved 6 × molekül ağırlığı için onun etiketi karşılık gelen göç ~ 2 kDa vardiyada gözlem yapılırsa, 3.11 adıma geçer; Coomassie-mavi boyama tarafından algılanabilir bir kısmını sindirilmemiş protein kalıntıları, ~0.2 U Trombin mg protein başına doğrudan diyaliz çanta ekleyin ve ek ~ 24 h için 4 ° C'de kuluçkaya
- Kullanımı daha fazla protein arındırmak boyutu dışlama veya iyon Kromatografi. İçin anyon Satım Kromatografi, EFSAM protein çözüm diyaliz çanta ve konsantre kaldırmak ~ 10 kat Ultrafiltrasyon santrifüj yoğunlaştırıcı bir 10.000 Da molekül ağırlığı ile kesme kullanarak. Daha sonra çözüm yeniden seyreltik ~ 20-fold NaCl ücretsiz tampon (20 mM Tris, 5 mM CaCl 2, 1 mM DTT, pH 8).
- Prepacked anyon Satım sütun 3.11. adımda anlatılan NaCl ücretsiz tampon 10 sütun hacimleri ile equilibrate. Dropwise bir şekilde ve sürekli çözüm sütun çıkmadan streams neden kaçınmak şırınga baskıların sütun ile çözüme iterek hava hava kabarcığı yok içeren bir radarı-kilit şırınga yüklenen arabellek kullanarak equilibrate. Güçlü anyon değiştirici (örneğin kuaterner amonyum fonksiyonel gruplar ile çapraz özel) kullanın.
- NaCl ücretsiz tampon (Adım 3.11) sütuna içine 3.12 adımda anlatıldığı gibi seyreltilmiş protein çözüm yükleyin.
- Elute proteinler arasında bir degrade [yani 0 - %60 (v/v)] NaCl artan arabellek (20 mM Tris, 1 M NaCl, 5 mM CaCl 2, 1 mM DTT, pH 8) iki pompa hızlı protein sıvı Kromatografi (FPLC) sistemi kullanarak. ~1-1.5 mL kesirleri toplamak ve UV 280 nm Absorbans kullanarak protein elüsyon profili izlemek için FPLC sistemi ve bir akış oranı 0.5 mL/dak
- Elüsyon tepeler ve protein saflık Coomassie mavi lekeli SDS-sayfa tarafından Laemmli 47 yöntemini kullanarak jelleri yanı sıra ilgi protein içeren kesirleri tanımlama.
- Havuzu kesirler gösterilen > % 95'i (yani sadece bir tek protein grup Coomassie-mavi jelleri lekeli gösteren kesirler olarak alınan) bir Diyaliz çanta ve deneysel arabellek 3.8 adımda anlatıldığı gibi diyaliz tarafından ilgi Exchange'e.
4. Kimyasal bağlanma diyaliz tarafından protein glikoz-5-MTS.
N-(β-D-glucopyranosyl)-n- hazırla 55 mM bir hisse senedi çözüm '-[2-methanethiosulfonyl) etil] 10 mg bileşim % 100 (v/v) DMSO 500 μl içinde eriterek tarafından üre (glikoz-5-MTS). Kullanılmayan glikoz-5-MTS-20 DMSO içinde çözündürüldükten saklamak ° C.
- Hazırlama protein örnek değişiklik 1 L içine ~ 60 mikron protein dialyzing 1,5 mL tarafından değişiklik için arabellek 20 mM BEZLERİ, 150 mM NaCl, 5 mM CaCl 2 ve 0,1 mM TCEP, pH 8.3 uydurdum. Değiştirilen protein boyutundan daha küçük bir Diyaliz membran molekül ağırlığı kesme kullanın (örneğin 3.500 Da kesme ~ 17.500 Da EFSAM için kullanın).
- Sonra 24 h 4 ° C'de microcentrifuge tüpüne diyaliz çantasından örnek aktarın. 2 mM son bir konsantrasyon DMSO çözündürüldükten glikoz-5-MTS ekleyin.
- Örnek, ortam sıcaklığında 1 h için karanlıkta kuluçkaya. 1 h kuluçka döneminde çözüm tüp nazik dokunarak her 10 dk. mix
- Daha sonra yeniden Döviz protein içine adım 4.2 veya santrifüj Ultrafiltrasyon tarafından açıklandığı gibi diyaliz 4 ° C'de tarafından hiçbir indirgeyici içeren son deneysel arabellek. Ultrafiltrasyon yordamı için ~1.5 mL protein örnek için konsantre < 0.5 mL ve daha sonra deneysel arabelleği ile aynı yoğunlaştırıcı sulandırmak. Toplam döviz 30 × 30 × 30 en az olması bu konsantrasyon-seyreltme iki ek kez tekrarlayın 27,000-fold =. EFSAM için 20 mM Tris, 150 mM NaCl, 5 mM CaCl 2, pH 7.5 deneysel tampon olarak kullanın.
- Örnek diyaliz veya Ultrafiltrasyon değişimi adım 4.2 ve 4.5, sırasıyla, 25 mM amonyum bikarbonat veya 25 mM amonyum asetat açıklandığı gibi electrospray iyonlaşma kütle spektrometresi için hazırlayın. Diyaliz kullanılıyorsa, herhangi bir kalıntı NaCl ve CaCl 2 tuzları kaldırmak için en az üç kez alışverişi sağlamak.
- Belirlemek doğru kitle (yani ± 1 Da) protein electrospray iyonlaşma kullanarak ilgi kütle spektrometresi 48 , 49. Cys thiol 281.3 Da protein eklemek için methanethiosulfonate kimyasal üzerinden her kovalent glikoz katkısı bekliyoruz kitle (yani glikoz-5-MTS için 360.4 Da eklemek ve 2 bırakarak grup böylece sırasında kovalent 79.1 Da CH 3 için çıkarmak ek).
5. Çözüm NMR modif değerlendirilmesiication verimliliği ve yapısal tedirginlikler.
- Emin olun değiştirilmiş konsantrasyonu protein > glikoz ek ve son arabellek exchange sonra 100 mikron. EFSAM için protein konsantrasyonu 280 UV yok olma katsayısı kullanarak tahmin 1.54 (mg mL - 1) cm - 1 nm.
- Ek protein çözüm 60 mikron ile titremeden ve nabız kalibrasyon ve % 10 (v/v) D 4,4-dimethyl-4-silapentane-1-sulfonic asitin (DSS) 2 O sinyal kilidi için. Yüksek sinyal gürültü kullanımı 600 μL örnekleri için 5 mm NMR frekans eşlemeli tüpler, takılı içine bir çift rezonans HCN kriyojenik sonda ile donatılmış bir en az 600 MHz Spektrometre.
- Daha önce ayrıntılı 50 , 51, sıcaklık, 1 H ve 15 N süpürme genişlikleri, geçici ve artış olarak standart 1 H - 15 N HSQC spectra toplamak belirli örnek için uygun ayarları. EFSAM spectra, kullanımı 20 ° C, 256 1 H geçişler için 64 15 N boyut artışlarla ve 1 H ve 15 N 8.000 ve 1800 Hz olarak ayarlanmasına genişlikleri süpürme.
- Glikozile protein spektrum edinimi ekleyin dithiothreitol (DTT) NMR örnek 15 mM son bir konsantrasyon için 1 M stoktan. DTT disülfür aracılı eki azaltma tarafından protein glikoz yan kaldırır.
- Bir ikinci 1 H - 15 N HSQC glikoz eki tarafından neden değişiklik verimliliği ve yapısal tedirginlikler değerlendirmek için bir başvuru spektrum sağlayan bu azaltılmış/değiştirilmemiş koşullar altında elde.
- Daha önce 52 detaylı olarak NMRPipe kullanarak NMR verileri işlemek. En az işleme veri dönüştürme, aşamalı, solvent bastırma, Fourier dönüşümü ve spectra ürününün ilk görsel öğe içerdiğinden emin olun.
- Değerlendirin değişiklik verimliliği ölçme Amid en yüksek yoğunluklarda ve CARA 53 tarihinde NEASY eklentisi kullanarak değiştirilmiş ve azaltılmış spectra kimyasal shift değerleri tarafından. Glikoz ikisinde bağlı ve spectra azaltılmış Cys Amid en yüksek yoğunluğu değerlendirmek için emin olun. Cys Amid güvenilir bir şekilde her iki spectra bulunamıyor, bir okuma artıkları Cys için bitişik yoğunluklarda kullanın.
- Verimliliği Cys-modified spektrum üzerinden Amid yoğunluğu olarak bölünmüş (yani DTT tedavi) Cys-azaltılmış spektrum üzerinden Amid yoğunluğunu tarafından Calculate 100 ile çarpılır:
 , nerede ben M Cys-modified spektrumda Amid yoğunluğunu ve ben R Cys-azaltılmış spektrumda Amid yoğunluğunu. Alternatif olarak, kaba etkinliği birkaç Amid tepeler üzerinde değerlendirmek:
, nerede ben M Cys-modified spektrumda Amid yoğunluğunu ve ben R Cys-azaltılmış spektrumda Amid yoğunluğunu. Alternatif olarak, kaba etkinliği birkaç Amid tepeler üzerinde değerlendirmek:
 , verimliliği i her biri için hesaplanan ayrı ayrı tespit verimliliği nerede kalıntı, ben ve n sayısıdır toplam hesaplamada kullanılan artıkları.
, verimliliği i her biri için hesaplanan ayrı ayrı tespit verimliliği nerede kalıntı, ben ve n sayısıdır toplam hesaplamada kullanılan artıkları. - Kimyasal shift tedirginlikler (CSP) 15 N ve 1 H boyutu her tepe gözlenen ve daha büyük 15 N kimyasal üst karakter aralığı kullanmak için normalize iki spectra kimyasal shift farklılıkları üzerinden hesaplamak Denklem takip:
 , nerede ΔH proton boyut ppm değişimdir ve ΔN azot boyut ppm değişimdir.
, nerede ΔH proton boyut ppm değişimdir ve ΔN azot boyut ppm değişimdir.
Sonuçlar
Bu yaklaşımın ilk adım mutagenesis glikoz-5-MTS EFSAM kullanılarak değiştirilebilir olabilir Cys artıkları için aday glikozilasyon kalıntılarının yok endojen Cys artıkları, hiçbir özel hususlar öncesinde yapılması gereken bu yüzden gerektirir mutagenesis. Ancak, yerel Cys artıkları açıklanan kimya gerçekleştirmeden önce değiştirilebilir sigara artıkları mutasyona gerekir. En az yerli yapı etkisi için protein ilgi bir küresel dizi hizalaması yapmak öneririz ve diğer kalıntıları olan belirleme en sık endojen Cys pozisyon(lar) bulundu. Cys mutasyon doğal olarak diğer canlılar arasında ortaya çıkan bu artıkları için protein yapısı üzerinde en az etkisi olabilir. Endojen Cys kalıntı kesinlikle korunmuş en yapısal Cys benzer Ser mutasyona öneririz. Şekil 1 unamplified şablon evde beslenen hayvan-28a DNA PCR için kullanılan bir denetim miktardan several-fold daha yüksek yoğunluğu gösteren güçlendirilmiş DNA örneği ile PCR reaksiyon başarısını değerlendirmek tipik bir PCR mutagenesis jel gösterir. Şablon DNA sindirim ve E. coli dönüşmenin plazmid onarım için sonraki adımlar içerir. Plazmid yayılmasında sıralama tarafından mutation(s) ile sıvı kültür, plazmid yalıtım ve sonra mutasyona uğramış vektör protein ifade için kullanılabilecek. Şekil 2A EFSAM NaCl konsantrasyonları artan göre anyon Satım sütundan bir tipik elüsyon profilini gösterir. Şekil 2B EFSAM saflığı Coomassie mavi lekeli SDS-sayfa jeller üzerinde gösterir.
Saf protein aldıktan sonra diyaliz adımlar bir dizi ücretsiz thiol ile MTS reaksiyonu ile glikoz yan eklemek için kullanılır. Şekil 3A normal kurulum bir küçük protein biriminin görüntüsünü diyaliz membran membran klipleri mühürlü ve faiz arabellek içeren büyük bir 1 L kabı içinde bulunan gösterir. Değişiklik başarısını ilk denetimini kütle spektrometresi tarafından gerçekleştirilebilir. Şekil 3B tek bir Cys thiol modifiye EFSAM temsilcisi electrospray kütle spektrumu gösterir. Belirli bir protein için protokol kurulması, değişiklik verimliliği ve yapısal tedirginlikler değerlendirildi tek bir düzgün 15N etiketli örnek. 1H -15N-HSQC spektrum öncesi ve sonrası indirgeyici DTT (şekil 4A) eklenmesiyle elde edilir. Değişiklik verimlilik hesaplamaları Protokolü adım 5.8 (şekil 4B) ayrıntılı olarak değiştirilmiş ve azaltılmış spectra Amid en yüksek yoğunluklarda karşılaştırılması yoluyla yapılabilir. Son olarak, ne zaman kimyasal shift atamaları bir protein, yapısal değişiklikler ile hangi ilişkili detaylı içinde adım 5.9 (şekil 4 c) olarak hesaplanabilir CSP'ler için bilinir.
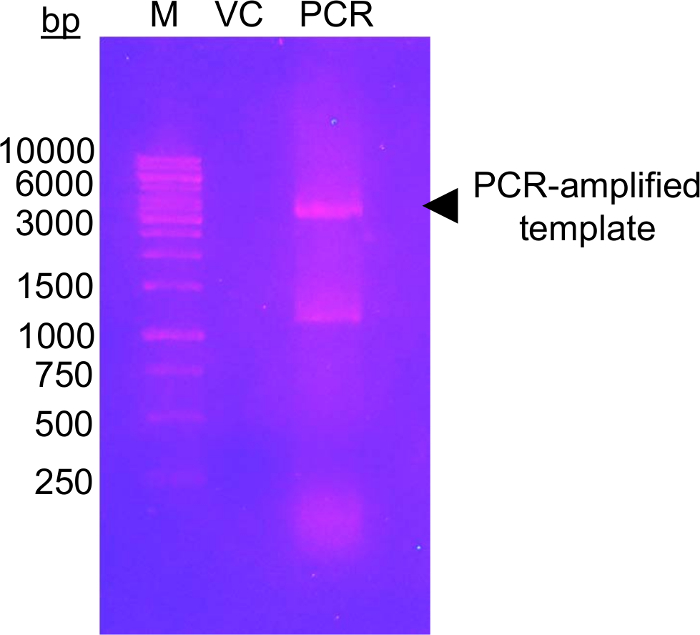
Resim 1: DNA özel jel amplifikasyon onay şablonu vektörünün mutajenik astar ile gösterilen.
Görüntü %1.0 (w/v) özel jel (M), DNA işaretçisiyle gösterir vektör kontrolü (VC) ve PCR güçlendirilmiş şablonu (PCR). DNA Elektroforez 120 V 0.5 x TAE tampon 45 dk için ayrılmış. Toplam 0,5 ng VC yüklendi, eşdeğer şablonu miktarında PCR şeride yüklü. Jel 20 dk önce UV ışık altında görselleştirme için etidyum bromür (~0.5 μg/mL) kullanarak lekeli (302 nm). Jel vektör (siyah ok ucu) beklenen boyutunu yakın güçlendirilmiş DNA yüksek düzeyde gösterir. 1000 ve 1500 bp marker bantları arasında büyük olasılıkla çalışan PCR lane ikinci grupta özellikle güçlendirilmiş bir PCR ürünü temsil eder. Güçlendirilmiş DNA yoğunluk düzeyini başarılı kabul edilebilir için VC Yoğunluk düzeyi daha yüksek olması gerekir. Birkaç diğer DNA boyalar etidyum bromür (örneğin bkz: 57) boyama için daha az mutajenik, daha güvenli alternatifler olarak kullanılabilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
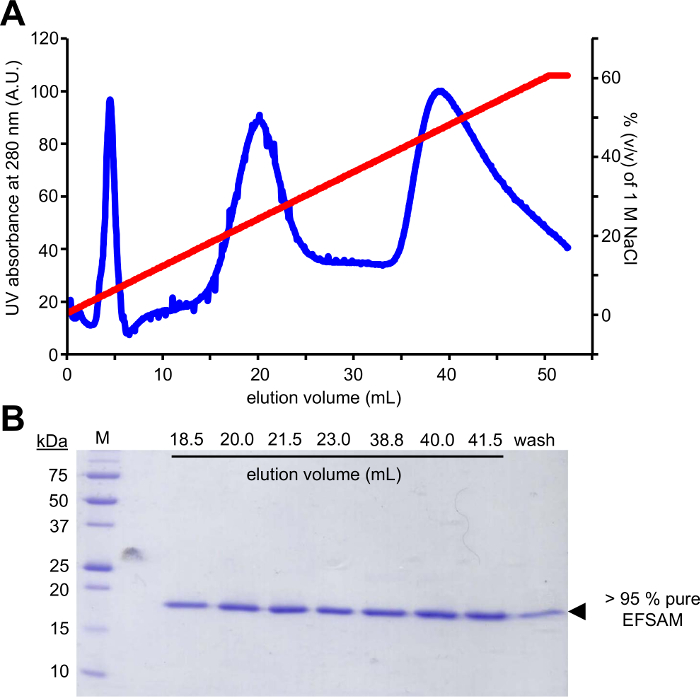
Resim 2: Tipik Kromatografik arıtma ve saflık STIM1 EF-SAM için kontrol edin.
(A) anyon exchange Kromatografi elüsyon profil STIM1 EF-SAM. Sonra el ile bağlama EF-SAM temel pH ve düşük NaCl konsantrasyon bir şırınga ile anyon Satım sütuna (Q FF) ve AKTA FPLC (GE Healthcare) protein NaCl gradyan ile elute için kullanılır. Elüsyon UV 280 nm sinyal 1 M NaCl 0-%60 (v/v) degrade üzerinde kullanarak AKTA tarafından izlenir. (B) Coomassie mavi lekeli SDS-sayfa jöleyi elüsyon kesirler (a). Denaturing protein jel EF-SAM iki büyük tepeler ~ 250 mM ve ~ 450 mM NaCl elutes ortaya koymaktadır. Arıtma Protokolü verimleri > % 95 saf EF-SAM olarak herhangi bir kirletici eksikliği kanıtladığı band Coomassie mavi lekeli jel içinde göstermek yukarıya. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3: Diyaliz Kur ve doğrulayıcı-in vitro protein glikozilasyon.
(A) Cys thiol yolu ile MTS reaktivite glikoz vitro eki için kullanılan tipik diyaliz Kur. Görüntü ~1.5 mL karşı arabelleğe alınmış diyaliz boru içinde bulunan protein gösterir ~ 1 L deneysel arabelleği. Arabellek tam exchange emin olmak için sürekli karıştırılır önemlidir. Görüntü dönen heyecan çubukla zarar ve diyaliz torba batan önlemek için aşırı diyaliz boru için kırpılmış bir microcentrifuge tüp gösterir. (B) Electrospray iyonlaşma kütle spektrumu değiştirilmiş Asn171Cys EF-SAM protein. Kütle spektrometresi değiştirme yordamı başarılı olup olmadığını değerlendirmek için uygun ve doğru bir yaklaşımdır. Tipik bir kitle Kromatografik teorik ve ölçülen kitleler, unmodified ve değiştirilmiş Asn171Cys EF-belirtilen SAM ile gösterilir. Çoğunluk örnek kütle ~1.3 Da beklenen teorik kitle glikoz Birleşik Asn171Cys EF-SAM, içinde olan bir makromolekül karşılık gelir. Veri (B) replotted ve 42değiştirilebilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: Çözüm NMR değişiklik verimliliği ve yapısal tedirginlikler tek bir NMR örnek üzerinden değerlendirilmesi.
(A) 1 H -15N-HSQC spektral ilişkin bir bindirme glikoz Birleşik Asn131Cys EFSAM (kırmızı crosspeaks) önce ve sonra (siyah crosspeaks) 15 mM DTT eklenmesi. Bindirmeyi açıkça birkaç kalıntı özgü Amid kimyasal shift değişiklikleri her iki protein ve yapısal tedirginlikler modifikasyonu gösterge gösterir. Kırmızı bir kutu Asn131Cys Amid konumunu gösterir. (B) vınlamak görünümü Asn131Cys Amid içeren 1H -15N-HSQC bölgesi. Asn131Cys Amid tepe değiştirilmiş spektrumda (benM) yoğunluğu azaltılmış (değiştirilmemiş) spektrum (benR) yoğunluğu (gösterilen) verimlilik hesaplanması için bölünür. Bir hesaplama ortalama verimlilik birkaç etkilenen kalıntılarının verimlilik hata tahmini dahil olmak üzere, daha iyi bir tahmin sağlar. Ortalama verimlilik Asn131Cys 5 artıkları (yani 129-133) tabanlı EFSAM için gösterilir. (C) NORMALIZED kimyasal shift tedirginlikler Asn131Cys EFSAM protein glikoz konjugasyon neden. Sonra indirgeyici ile ilave sadece en yüksek yoğunluk analizi [ (B)gösterilen] tarafından uygun tahmini değişiklik verimlilik sağlar, ama aynı zamanda veri için sağlar HSQC deneyler kümesi daha önce tek bir örnek ve toplanan değişiklik ile ilişkili yapısal değişiklikler değerlendirilmesi. Glikoz konjugasyon konumu 131 lokalize en büyük tedirginlikler neden olur; Ancak, bu analiz sıra yakınlık gösteren bu analiz değeri, yalnızca dayalı beklenmedik olan tedirginlikler ortaya koymaktadır. (C) veri replotted ve 42değiştirilebilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| STIM1 mutasyonbir | Yönb | DNA dizisic | |
| Asn131Cys | İleri | 5'-GTCATCAGAAGTATACTGTTGGACCGTGGATGAGG-3' | |
| Asn131Cys | geriye doğru | 5'-CCTCATCCACGGTCCAACAGTATACTTCTGATGAC-3' | |
| Asn171Cys | İleri | 5'-CCAAGGCTGGCTGTCACCTGCACCACCATGACAGGG-3' | |
| Asn171Cys | geriye doğru | 5'-CCCTGTCATGGTGGTGCAGGTGACAGCCAGCCTTGG-3' | |
| bir STIM1 amino asit numaralandırma NCBI katılım AFZ76986.1 dayalı. | |||
| b 'Ters' astar 'İleri' astar geriye doğru tamamlayıcı dizisine karşılık gelir. | |||
| c Altı çizili kodon üçlüsü Cys mutasyon karşılık gelir. | |||
Tablo 1. Cys mutagenesis içinde evde beslenen hayvan-28a STIM1 EFSAM Asn için örnek Oligonükleotid (astar) serileri oluşturmak.
Tartışmalar
Protein glikozilasyon nerede şekerler kovalent polipeptitler öncelikle amino asit yan zincirlerine bağlantıları aracılığıyla eklenen post-translational bir değişiklik olduğunu. Memeli proteinler en çok % 50'si olan glikozile 54, glikozile proteinler daha sonra biyomoleküler bağlama benzeşme değiştirme gelen etkileri çeşitli bir yelpazede içebileceğiniz, katlama, kanal etkinlik değiştirerek, hedefleme protein etkileyen molekülleri bozulması ve hücresel, devletlerde (33değerlendirme) birkaç isim için. Glikozilasyon memeli Fizyoloji önemli rolü memeli glycan yapıları 33tam çeşitliliği oluşturmak için gelişmiş proteinler birkaç yüz tarafından belirgindir. N- değişmiş ve ile ilişkili O- glikozilasyon desenleri çok sayıda hastalık devletler () artan ve azalan) prostat (artan ve azalan), meme de dahil olmak üzere, karaciğer (artış), yumurtalık (artış), pankreas (artan) ve mide kanserleri (artan) 55. Ayrıca, Tau, huntingtin, glikozilasyon toksisite Alzheimer, Huntington ve Parkinson hastalıkları 56ile ilişkili bu proteinlerin düzenlemek için α-synuclein bulundu ve glikozilasyon doğuştan bozukluk grubu-si olmak be Glikozilasyon 54aracılık enzimler kalıtsal kusur sonucunda tespit edilmiştir. Böylece, glikozilasyon kesin biyofizik, biyokimyasal ve yapısal etkilerini anlama muazzam etkisi protein Yönetmeliği ve sağlık ve hastalık işlevinde anlayışımızı potansiyeline sahiptir.
Memeli glycome içinde bulunan glycan yapılar çeşitliliği yol on şeker yapı taşları fucose, galaktoz, glikoz, N- acetylgalactosamine, N- peptidoglikan, glucuronic asit, iduronic asit, mannoz dahil, sialik asit ve ksiloz 33. N- glikozilasyon kaçınılmaz bir N- peptidoglikan şeker protein doğrudan bağlantılar., O- glikozilasyon--dan birisi- N- acetylgalacotose, N- peptidoglikan, ksiloz, fucose neden, glikoz veya galaktoz kovalent polipeptid için bağlı. Biz bu şekerler hemen protein yüzeye bitişik biyofiziksel ve yapısal özelliklerini nasıl etkilediğini anlamaya başlamak için burada site seçici Cys artıkları ile protein mühendislik thiols şeker eklemek bir yaklaşımı açıklamak sıra. Burada, endogenously glikozile Cys tarafından değiştirilir ve vitro basit bir kimyasal yaklaşım yoluyla değiştirilebilir vardır kalıntıları. Bu şekilde katlanır ve istikrar yanı sıra genel yapısı için toplu değişiklikler yanı sıra belirli her sitede katkısını ve protein işlevi tease için tekli ve çoklu glikozilasyon siteleri tabi.
Son zamanlarda, bu yaklaşım şekilde ayrı ayrı ve üst üste Asn131 ve Asn171 N- glikozilasyon siteleri 42rolünü değerlendirmek için EFSAM ile kullanıldı. Cys mutasyona ve glikoz kovalent eki Asn131 veya Asn171 sitelerine bir azalma Ca2 + bağlama benzeşme ortaya ve istikrar bastırılır. Ne zaman iki site aynı anda glikoz eki, benzeşim bağlama içinde azalır ile modifiye edildi ve istikrar potentiated önde gelen Oligomerizasyonda eğilimi içinde vitrogelişmiş. Yapısal olarak, burada açıklanan yaklaşım Asn131 veya Asn171 değişiklikler karşılıklı SAM etki alanı, hemen EF-el çiftine bitişik bulunan çekirdek α8 sarmal huzursuz gösterdi. Bu yapısal analizi nasıl EF içinde yakınlaşan ve potentiated yapısal değişim için protein glikoz değişiklikler yüzeyi yol expounds-el: SAM arayüzey hangi sonuçta protein oynattığını ve SOCE 42geliştirir.
Nasıl bir yaşam EFSAM yüzeyine yakın etkileri katlama, istikrar ve yapısı, bu yordamı yardım döken ışık kolayca bu site seçici yaklaşım uygulanması daha uzun karbonhidrat acil servise, belirli eklemek için değiştirilmesi sırasında Golgi ve PM orada verilen yerelleştirme (yani farklı olgunluk glikozilasyon Birleşik) olduğunu güvenilir bir kaynak için bu karbonhidrat thiol değişiklik olduğu için ters çevrilebilir kullanarak MTS MTS tercih edilir gibi thiols için bağlayabilirsiniz fonksiyonel grupları içeren bir indirgeyici ve bir başvuru spektrum kolayca elde edilebilir. Bu yaklaşım ayrıca lipitler gibi protein diğer post-translational moieties bağlamak için adapte edilebilir. Aynı zamanda, dikkate alınması gereken bu yaklaşımın bazı sınırlamaları vardır. İlk olarak, mutasyon glikozilasyon sitelerin yapısını, istikrar ve herhangi bir glikoz değişiklik olmadığında da katlanır etkileyebilecek Cys yöntemi kullanır. Benzer şekilde, protein yerli Cys kalıntılarında da glikoz eki glikozile olmayan sitelerde önlemek için mutasyona gerekir. Ayrıca, ek Cys kalıntılarının kez arıtma daha zor hale bakteri nedeniyle Cys crosslinking ve misfolding, dahil vücut oluşumu teşvik etmektedir. Yine de, burada açıklanan bu site seçici Cys-crosslinking yaklaşım belirli glikozilasyon siteleri yüksek düzeyde gerektiren deneylerde yapısal, biyokimya ve biyofizik etkileri dışarı alay kontrollü sağlar homojen protein. Etkileri yapısı üzerinde yerel olmayan Cys artıkları istikrar ve katlama sadece herhangi bir değişiklik bir karşılaştırma için vahşi tipi yokluğunda protein öznitelikleri 42tespit edilebilir. Hangi değişiklik engelleme protein (örneğin Asn-için-Ala) mutant sürümleri hızlı ökaryotik hücrelerde elde işlevsel veriler ile birlikte ele alındığında, şu anda açıklanan yaklaşım protein yapısal mekanizmalarının yeni görüşler ortaya çıkarır yönetmelik translasyonel modifikasyonlar tarafından.
Teşekkürler
Bu araştırma Doğa Bilimleri ve mühendislik Araştırma Konseyi Kanada (PBS için 05239), Kanada Vakfı tarafından desteklenmiştir yenilik/Ontario Araştırma Fonu (PBS için) prostat kanseri Vakfı - babama (PBS) ve Ontario Telus gezintiye mücadele Yüksek Lisans Burs (Y.J.C. ve NS).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
Referanslar
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır