Method Article
استهداف ثيولس سيستين في المختبر جليكوسيليشن الخاصة بالموقع من البروتينات المؤتلف
In This Article
Summary
التحليلات الكيميائية الحيوية والهيكلية للبروتينات الغليكوزيلاتي تتطلب كميات كبيرة نسبيا من عينات متجانسة. وهنا نقدم طريقة كيميائية فعالة جليكوسيليشن الخاصة بالموقع من البروتينات المؤتلف تنقيته من البكتيريا باستهداف رد الفعل Cys ثيولس.
Abstract
تفاعل stromal جزيء-1 (STIM1) نوع--أنا transmembrane البروتين الموجود على هيولى (ER) وأغشية البلازما (بعد الظهر). STIM1 ER-المقيم ينظم نشاط قنوات Orai1 م في عملية تعرف باسم مخزن الإدخال تعمل الكالسيوم (Ca2 +) الذي هو الرئيسي Ca2 + مما يشير إلى العملية التي تقود الاستجابة المناعية. يخضع STIM1 نبوستترانسلاشونال-جليكوسيليشن في موقعين Asn لومينال ضمن Ca2 + الاستشعار عن المجال للجزيء. ومع ذلك، الكيمياء الحيوية، الفيزياء الحيوية، والآثار البيولوجية هيكل من N-الغليكوزيلاتي STIM1 كانت غير مفهومة حتى مؤخرا بسبب عدم القدرة على سهولة الحصول على مستويات عالية من البروتين-الغليكوزيلاتي نمتجانسة. وهنا يصف لنا التنفيذ في المختبر الكيميائي النهج الذي تولي مويتيس الجلوكوز لمواقع البروتين محددة تنطبق على فهم آثار N-جليكوسيليشن الكامنة في بنية البروتين وآلية. استخدام مطيافية الرنين المغناطيسي النووي الحل نقوم بتقييم كفاءة كلا من التعديل، فضلا عن عواقب الهيكلي المرفق الجلوكوز مع عينة واحدة. هذا النهج يمكن تكييفها مع سهولة لدراسة البروتينات الغليكوزيلاتي العديدة الموجودة في الطبيعة.
Introduction
تخزين الكالسيوم تعمل (Ca2 +) إدخال (سوسي) هو الطريق الرئيسية التي تأخذ الخلايا المناعية يصل Ca2 + من الفضاء خارج الخلية إلى سيتوسول. في الخلايا اللمفية تي، ربط مستقبلات خلية تي يقع في غشاء البلازما (م) مولدات المضادات التي تنشيط بروتين تيروزين مؤنزم (استعرض في 1،،من23). سلسلة الفسفرة يؤدي إلى تنشيط phospholipase-γ (PLCγ) الذي يتوسط التحلل المائي لغشاء فوسفاتيديلينوسيتول 4، 5-بيسفوسفاتي (المرحلة2) فيما بعد إلى دياسيلجليسيرول واينوزيتول 1,4,5-تريسفوسفاتي (IP3 ). الملكية الفكرية3 هو رسول ديفوسيبلي صغيرة التي تلزم للملكية الفكرية3 مستقبلات (IP3R) في هيولى (ER) مما فتح هذه القناة مستقبلات وسمحت Ca2 + تدفق أسفل التدرج تركيز لائحة التجويف إلى سيتوسول (استعرض في 4). مستقبلات الإشارات من البروتين ز إلى جانب وتيروزين كيناز مستقبلات في مجموعة متنوعة من الرصاص أنواع منفعل وغير منفعل خلية أخرى لإنتاج نفس IP3 والتنشيط للملكية الفكرية3روبية.
سبب المحدودة Ca2 + السعة التخزينية للائحة، الملكية الفكرية3-الإفراج عن الوساطة والزيادة الناتجة في كاليفورنيا سيتوسوليك2 + فقط عابر؛ ومع ذلك، آثار هذا استنفاد ER لومينال Ca2 + عميقا نوع التفاعل stromal جزيء-1 (STIM1)،--أنا ترانسميمبراني (TM) العثور على البروتين معظمها على غشاء ER 5،،من67. STIM1 يحتوي على المنحى التجويف Ca2 + الاستشعار عن مجال تتكون من زوج EF-اليد والعقيمة α-عزر (أفسام). يتم فصل ثلاثة مجالات لفائف ملفوف المنحى سيتوسوليك من أفسام بالمجال TM واحد (في 8استعراض). عند ER Ca2 + نضوب لومينال، يخضع أفسام9 7،أوليجوميريزاتيون إلى جانب زعزعة الاستقرار التي تسبب ترتيبات هيكلية جديدة من الخرائط المواضيعية والمجالات لفائف ملفوف 10. تتوج هذه التغييرات الهيكلية في تعويض STIM1 في ER-م تقاطعات 11،12،،من1314 من خلال التفاعلات مع فوسفوينوسيتيديس الساعة 15، 16 و Orai1 مفارز 17،18. Orai1 البروتينات هي مفارز م فيها تجميع للنموذج Ca2 + قنوات 19،20،،من2122. تسهيل التفاعلات STIM1-Orai1 في تقاطعات ER-م فتح Ca2 + الإفراج عن تنشيط Ca2 + (قلعة) قناة المطابقة التي تمكن الحركة من Ca2 + في سيتوسول من تركيزات عالية الفضاء خارج الخلية. في الخلايا المناعية، حمل سيتوسوليك المطرد Ca2 + المرتفعات عبر قنوات قلعة Ca2 +-كالمودولين/calcineurin تعتمد ديفوسفوريليشن للعامل النووي من خلايا تي المنشط الذي يدخل بعد ذلك النواة و يبدأ تنظيم النسخي الجينات تعزيز تي خلية التنشيط 1،3. ما يسمى عملية التنشيط قناة قلعة STIM1 23،24 عن طريق فعل مؤثر ER لومينال Ca2 + نضوب والناتجة عن المطرد سيتوسوليك Ca2 + الارتفاع جماعي سوسي 25. يتضح الدور الحيوي الذي تؤديه سوسي في خلايا تي بدراسات تثبت أن الطفرات الموروثة في كل من STIM1 و Orai1 يمكن أن تسبب نقص المناعة المشتركة الشديد المتلازمات 3،،من1926، 27-يبدأ أفسام سوسي بعد الاستشعار ER لومينال Ca2 + استنفاد عبر فقدان Ca2 + التنسيق على يد EF الكنسي، مما يؤدي في نهاية المطاف إلى رابطة الذاتي إلى جانب زعزعة الاستقرار 7، 28،29.
جليكوسيلاتيون هو مرفق التساهمية وتجهيز الهياكل oligosaccharide، ويعرف أيضا باسم جليكانس، من خلال مختلف الخطوات السكروز في ER وغولجي (استعرض في 30،،من3233). هناك نوعين الغالب من جليكوسيلاتيون في حقيقيات النوى: N-مرتبط و يا-مرتبطة، اعتماداً على الأحماض الأمينية المحددة وذرة سد الربط. ترفق أميد سلسلة جانبية من Asn في N-جليكوسيليشن، جليكانس، وفي معظم الحالات، يحدث خطوة البدء لائحة ببتيد سلسلة التحركات في التجويف 34. وتتمثل الخطوة الأولى من N-جليكوسيليشن نقل بنية أساسية أربعة عشر-السكر تتكون من الجلوكوز (الأخضر)، ويطلق (رجل) و نون-أسيتيلجلوكوساميني (جلكناك) (أي الأخضر3رجل9جلكناك2) من ER غشاء الدهن 35،أوليجوساكتشاريلترانسفيراسي36. مزيد من الخطوات، مثل الانقسام أو نقل مخلفات السكر، التي تحفزها لائحة محددة جليكوسيداسيس وجليكوسيلترانسفيراسيس. يمكن أن تكون بعض البروتينات التي تترك لائحة وأن تنتقل غولجي كذلك المجهزة 37. س-جليكوسيلاتيون يشير إلى إضافة جليكانس، عادة إلى مجموعة الهيدروكسيل سلسلة الجانب بقايا سر أو منتدى المجالس الرومانسية، ويحدث هذا التعديل تماما في 33،مجمع غولجي34. وهناك العديد من الهياكل-جليكان سالتي يمكن أن تتكون من N-أسيتيلجلوكوساميني، فوكوسي، واللبن، وإضافة حمض اللعابي مع كل أحادي التسلسل 33.
في حين تم التعرف على لا تسلسل معين كشرط أساسي لأنواع عديدة من س-جليكوسيلاتيون، ارتبط تسلسل آراء مشتركة N-يرتبط التعديل: Asn-X-Ser/الثريونين/Cys، حيث X يمكن أن يكون أي من الأحماض الأمينية ما عدا المحترفين 33. أفسام STIM1 يحتوي على اثنين من هذه المواقع-glycosylation توافق N: Asn131-Trp132-Thr133 و Asn171-Thr172-Thr173. وفي الواقع، أظهرت الدراسات السابقة أن أفسام ن-الغليكوزيلاتي في خلايا الثدييات في Asn131 و Asn171 38،39،،من4041. بيد أن الدراسات السابقة المترتبة على N-جليكوسيليشن على سوسي كانت تتعارض، مما يوحي بقمعها، بوتينتياتيد أو أي تأثير من هذا التعديل بوستترانسلاشونال في، سوسي التنشيط 38= "xref" >40،،3941. وهكذا، البحوث المتعلقة بآثار أفسام N-جليكوسيليشن الفيزيائية-الحيوية والكيمياء الحيوية والهيكلية الكامنة وراء أمر حيوي لفهم الآثار التنظيمية لهذا التعديل. بسبب الحاجة إلى مستويات عالية من البروتينات متجانسة في هذه التجارب في المختبر ، تم تطبيق نهج موقع انتقائي لإرفاق الجلوكوز مويتيس أفسام تساهمي. من المثير للاهتمام، جليكوسيليشن Asn131 و Asn171 بسبب التغييرات الهيكلية التي تتقارب داخل نواة أفسام وتحسين الخصائص الفيزيائية-الحيوية التي تنهض بوساطة STIM1 سوسي 42.
ملحق الكيميائية من جماعات glycosyl ثيولس Cys كانت راسخة بعمل المنوي التي أثبتت فائدة هذا النهج خال من إنزيم لفهم آثار خاصة بالموقع جليكوسيلاتيون على وظيفة البروتين 43 أولاً , 44-في الآونة الأخيرة، وفيما يتعلق STIM1، كانت تحور بقايا Asn131 و Asn171 إلى Cys و glucose-5-(methanethiosulfonate) [glucose-5-(MTS)] وكان يستخدم لربط تساهمي الجلوكوز ثيولس الحرة 42. وهنا، يمكننا وصف هذا النهج الذي لا يستخدم الطفرات لإدراج موقع بقايا Cys محددة لتعديل فحسب، بل ينطبق أيضا على حل مطيافية الرنين المغناطيسي النووي (الرنين المغناطيسي النووي) لسرعة تقييم كفاءة التعديل والهيكلية الاضطرابات نتيجة جليكوسيليشن. جدير بالذكر أن هذه المنهجية العامة يمكن تكييفها بسهولة دراسة آثار أما O-أو N-جليكوسيليشن أي ريكومبينانتلي إنتاج البروتين.
Protocol
1-تفاعل البوليميراز المتسلسل (PCR)-وساطة الطفرات موقع الموجه لإدماج Cys في ناقل تعبير بكتيرية الحيوانات الأليفة-28 ألف-
- تحديد تركيز ناقلات الحيوانات الأليفة-28 ألف (أي دنا الذين تقطعت بهم السبل مزدوجة) باستخدام الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) معامل انقراض سم (ميكروغرام/مل) 0.020 -1 في 260 nm-
- توليف زوج من الإشعال مطفرة مكملة للطفرة Cys كل هذه أن أنا) هناك على الأقل 15 النيوكليوتيدات المكملة للقالب قبل أول قاعدة عدم التطابق ومكملة للقالب بعد 15 النيوكليوتيدات عدم تطابق قاعدة نهائية، ثانيا) طول التمهيدي إجمالي لا يتجاوز 45 النيوكليوتيدات، و ثالثا) يقع على جوانين أو السيتوزين في الموضع النوكليوتيدات الأول والأخير لكل التمهيدي (الجدول 1). ضمان توليف التمهيدي تتم باستخدام تنقية خرطوشة ومقياس 0.025 μmol.
- عالي دقة بوليميريز الحمض النووي، باستخدام إعداد الخلائط رد فعل بكر ميليلتر 20 اثنين: واحدة تتضمن التمهيدي إلى الأمام، والثاني يحتوي على عكس التمهيدي. إعداد كل خليط تحتوي على تركيزات نهائياً من المخزن المؤقت x PCR 1 مع 1.5 مم مجكل 2، دنتبس 0.2 مم، 0.5 ميكرومتر التمهيدي، 0.4 ميكروليتر [دمس]، 1.25 نانوغرام/ميكروليتر قالب الحمض النووي، 0.02 U/ميكروليتر عالية الدقة بوليميراز الدنا. دورة
- حرارياً الخلائط منفصلة باستخدام بروتوكول ثلاث خطوات: 98 درجة مئوية لمدة 30 ق (يشوه)، 53-56 درجة مئوية لمدة 30 ق (الصلب)، 72 درجة مئوية ل 30 s kilobase(kb) -1 (ملحق) قالب الحمض النووي. تكرار البرنامج درجة الحرارة لدورات 5 وإضافة خطوة تمديد النهائي 72 درجة مئوية للحد الأدنى 7.5
- بعد بكر الأولية مع الإشعال إلى الأمام وعكس في أنابيب منفصلة، الجمع بين المنتجات في أنبوب واحد (أي 40 ميكروليتر المجموع) ويستمر تفاعل PCR لدورات 20 إضافية استخدام نفس المعلمات الدراجات كما هو موضح في الخطوة 1، 4-
- اليكتروفوريسي 15 ميكروليتر من خليط رد فعل بكر على 1% (w/v) [اغروس] هلام استخدام 0.5 x Tris، حمض الخليك، الإثيلين diamine رباعي حمض الخليك (يدتا) تشغيل المخزن المؤقت (تاي). كعناصر تحكم، اليكتروفوريسي مبلغ معادل من قالب الحمض النووي الذي زاد ليس ببكر وقاسمه لمرجع سلم الحمض النووي الذي يحتوي على علامة نطاقات أكبر وأقل من حجم المنتج بكر المتوقعة.
- بعد التفريد في 120 الخامس لمدة 40 دقيقة، تغرق الهلام في المياه التي تحتوي على 0.5 ميكروغرام/مل اثيديوم بروميد ويهز لمدة 30 دقيقة في درجة حرارة الغرفة. تأكيد زاد طول القالب قبل الإشعال مطفرة كزيادة في كثافة النسبي اثيديوم بروميد الفلورسنت تضخيم الفرقة الفرقة قالب التحكم تحت ضوء الأشعة فوق البنفسجية بالمقارنة مع (302 نيوتن متر).
- إذا أي تضخيم الواضح، كرر بكر بعد ضبط درجة الحرارة انلينغ بزيادات 0.5 درجة مئوية بين نطاق درجة الحرارة 53-56 درجة مئوية.
- عند تأكيد تضخيم القالب قبل الإشعال مطفرة، علاج ميكروليتر ~ 25 المتبقية من الخليط تفاعل PCR مع إنزيم التقييد دبني لهضم القالب ميثليته الحمض النووي. استخدام دبني في 0.5 ميليلتر (10 وحدات) الواحدة 25 ميكروليتر بكر رد فعل خليط وتركيز نهائي دبني × 1 رد فعل المخزن المؤقت. احتضانها ح 2.5 في 37 درجة مئوية
- بعد الهضم القالب وإضافة ~ 5-10 ميكروليتر من خليط هضمها إلى 100 ميليلتر من الحرارة صدمة الخلايا DH5α كولاي Esherichia المختصة في أنبوب ميكروسينتريفوجي مل 1.75. احتضان خليط الحمض النووي الخلية على الجليد للحد الأدنى 60
- صدمة الحرارة خليط الحمض النووي الخلية في أنبوب ميكروسينتريفوجي في 42 درجة مئوية ل 45 ق على كتلة حرارة جافة. بعد حضانة المخلوط على الجليد لمدة 3 دقائق، إضافة 900 ميكروليتر من درجة حرارة الغرفة لوريا بيرتاني مرق (رطل) إلى الخلايا ونقل تعليق خلية الإجمالي في أنبوب أسفل جولة معقم مل 14-
- احتضان تعليق خلية في 37 درجة مئوية لمدة 90 دقيقة مع الرج المستمر 190 لفة في الدقيقة-
- وفي وقت لاحق، نقل تعليق الخلية مرة أخرى إلى 1.75 مل ميكروسينتريفوجي الأنبوبة وأجهزة الطرد المركزي في 10,000 س ز لمدة 5 دقائق في درجة حرارة الغرفة-
- وبعد الطرد المركزي، إزالة ميكروليتر 900 من المادة طافية وريسوسبيند الخلايا البكتيرية التي بيبيتينج لطيف في ميكروليتر 100 المتبقية من رطل
- نقل تعليق خلية تتركز الناتجة على صفيحة رطل-أجار المحتوية على المضادات الحيوية وانتقائية لناقلات التعبير (أي 60 ميكروغرام/ملكاناميسين). نشر تعليق بالتساوي على اللوحة أجار أسيبتيكالي واحتضانها ح ~ 16 في 37 درجة مئوية.
- في اليوم التالي، تطعيم مستعمرة واحدة من اللوحة إلى 5 مل من السائل LB التي تحتوي على ضغط اختيار أنتيوبيوتيك (أي 60 ميكروغرام/مل كاناميسين). تنمو ثقافة السائل بين عشية وضحاها في 37 درجة مئوية مع الهز المستمر في 37 درجة مئوية.
- عزل وتنقية بلازميد منشور من كولاي الخلايا باستخدام مجموعة أدوات متوفرة تجارياً استناداً إلى الإجراء تحلل القلوية 45-
- تأكيد طفرة الفائدة الحالية وفي إطار القراءة الصحيحة بتسلسل "الحمض النووي سانجر" بلازميد 46-
2. الزي 15 تعبير البروتين المسمى ن في BL21 ΔE3 الإشريكيّة القولونية.
ملاحظة: البروتينات المؤتلف مختلفة تتطلب شروط التعبير المختلفة. ما يلي هو الإجراء الأمثل للتعبير عن البروتين البشري أفسام STIM1-
تحويل ناقلات التعبير إيواء الطفرات Cys (أي الحيوانات الأليفة-28 ألف-أفسام) في ΔE3 BL21 كودون (+) الحرارة صدمة الخلايا المختصة- ولوحة على ألواح رطل-أجار تحتوي على ضغط اختيار المضادات الحيوية كما هو موضح في الخطوات 1، 1، 9-14) عقب التعديلات: لوحة مباشرة قاسمة ميكروليتر 150 من تعليق خلية الإجمالي ميكروليتر ~ 1,000 على لوحة رطل-أجار دون الحاجة إلى التركيز الخلايا في أنبوب ميكروسينتريفوجي بالطرد المركزي-
- في اليوم التالي، نقل أسيبتيكالي مستعمرة واحدة في 200 مل قارورة Erlenmeyer الذي يحتوي على 20 مل رطل وتستكمل مع المضادات الحيوية المناسبة (أي 60 ميكروغرام/مل كاناميسين للحيوانات الأليفة-28 ألف-أفسام). ينمو هذا السائل كاتب الثقافة بين عشية وضحاها (أي ح ~ 16) عند 37 درجة مئوية مع الهز المستمر في ~ 190 لفة في الدقيقة-
- في نفس اليوم كخطوة 2.2، إعداد M9 متوسطة 15 البروتين المسمى ن التعبير بالتعقيم 1 لتر M9 المخزن المؤقت أملاح (أي 42 مم نا 2 هبو 4، 22 مم خ 2 ص 4، 8.6 مم كلوريد الصوديوم، درجة الحموضة 7.4) في قارورة Erlenmeyer ل 4. مجرد بارد، تصفية خليط من 20% (w/v) د-الجلوكوز، كاكل 1 م 2 والثيامين م 1، 1 م MgSO 4، البيوتين 1 ملغ/مل و 0.2 غ/مل 15 N-NH 4 Cl من خلال عامل تصفية المحاقن معقمة ميكرومترات 0.2 في الحل الملح 1 ل M9 العقيمة حيث تركيزات النهائي لهذه المكونات هي 0.2% (w/v) د-الجلوكوز، 100 ميكرومتر كاكل 2, 50 ميكرومتر الثيامين، 1 مم MgSO 4، 1 ميكروغرام/مل البيوتين و 1 ملغ/مل 15 N-NH 4 ألغ
- في اليوم التالي، نقل أسيبتيكالي ثقافة كاتب السائل بين عشية وضحاها مل 20 إلى 50 مل الأنبوبة المخروطية العقيمة وأجهزة الطرد المركزي في × 2,400 ز لمدة 15 دقيقة بيليه الخلايا.
- بعد الصب المتوسطة رطل، ريسوسبيند بيليه الخلية الناتجة في 10 مل من M9 المتوسطة الدنيا وتحويل المزيج بيليه حراكه إلى 1 لتر من M9 متوسط الحد الأدنى مع المضادات الحيوية (أي 60 كاناميسين ميكروغرام/مل).
- تنمو 1 لتر من M9 المتوسطة الدنيا التي تحتوي على ثقافة كاتب البكتيرية في 37 درجة مئوية وثابت ~ 190 في الدقيقة تهتز حتى الكثافة البصرية في 600 نانومتر (OD600) يصل إلى ~0.6-0.8-
- عندما يتم التوصل إلى مجموعة سبيكفيفيد OD600، إضافة 200 ميكرومتر الأيزوبروبيل β-د-1-ثيوجالاكتوبيرانوسيدي (إيبتج) للحث على التعبير البروتين.
- بعد إيبتج علاوة على ذلك، لا تزال تفرخ الخلايا للتعبير البروتين في درجة حرارة الغرفة مع الرج المستمر ~ 190 لفة في الدقيقة ح ~ 16 (أي بين عشية وضحاها)-
- وفي اليوم التالي حصاد البكتيريا بالطرد المركزي في ~ 10,000 × ز، 4 درجة مئوية عن 30 دقيقة
- صب في رطل ونقل بيليه الخلية في أنبوب 50 مل مخروطية الشكل. تخزين بيليه في-80 درجة مئوية حتى تنقية.
3. تنقية البروتين المؤتلف من كولاي.
ملاحظة: البروتينات المؤتلف مختلفة تتطلب إجراءات تنقية متميزة. التالي هو بروتوكول ل 6 آند #215; تنقية أفسام صاحب معلم من الهيئات إدراج أعرب من بناء الحيوانات الأليفة-28 ألف-
- يدوياً تجانسه بيليه الخلية البكتيرية المجمدة في م 6 جوانيداين-HCl، 20 مم تريس-HCl (pH 8) و 5 مم β-ميركابتوثانول باستخدام ماصة نقل يجهز 10 مل. إضافة حوالي 40 مل HCl غوانيدين الواحدة 5 مل بيليه الخلية الرطب لهذه الخطوة. حضانة
- التالية 90 دقيقة في درجة الحرارة المحيطة بالتناوب المستمر في فرن تهجين، الطرد المركزي المخلوط في ~ 15,000 × ز، 8 درجة مئوية لمدة 40 دقيقة لفصل الخلية غير قابلة للذوبان تحت الأنقاض (أي بيليه) من البروتين للذوبان الخليط (أي طافية).
- ميليلتر 750 إضافة 50% (v/v) ني 2 +-[اغروس] حمض نيتروتراياكتيك حبة ملاط إلى توضيح ليساتي واحتضانها لآخر 90 دقيقة في درجة حرارة الغرفة مع انعكاس في فرن تهجين. وفي وقت لاحق، التقاط
- البروتين صاحب معلم 6 × ملزمة ني 2 + بجمع الخرز [اغروس] في عمود تنقية بروتين تدفق جاذبية. السماح ليساتي بالتدفق من خلال العمود تماما قبل الانتقال إلى الخطوة 3.5. أغسل
- الخرز جمع ثلاث مرات مع 10 مل يوريا م 6، 20 مم تريس-HCl pH 8 و 5 مم β-ميركابتوثانول. ضمان أن 10 مل كامل يمر عبر العمود قبل كل 10 مل اللاحقة واشنطن
- الوت البروتينات في سلسلة من الكسور 2 مل باستخدام اليوريا م 6، 20 مم تريس-HCl pH 8، ايميدازول 300 ملم، و 5 مم β-mercaptoethanol مع فترة حضانة s 90 بين الكسور. ضمان أن مل 2 أسرة يمر عبر العمود قبل كل خطوة لاحقة شطف.
- في هذه المرحلة، تؤكد بروتين الفائدة موجود في كسور التيد من كبريتات دوديسيل الصوديوم الملون الأزرق أخذ جل polyacrylamide التفريد (الحزب الديمقراطي الصربي صفحة) باستخدام طريقة لايملي 47. تقييم حجم البروتين، وكمية ونقاء بالمقارنة ضد عصابات علامة الوزن الجزيئي القياسية التي على حد سواء أقل من وأكبر من الوزن الجزيئي المتوقعة من بروتين الفائدة.
- تجمع الكسور بروتين الوتيد في غشاء الديال مع وزن الجزيئي دا 3,500 الانقطاع واحتضان في 1 لتر ريفولدينج المخزن المؤقت (20 ملم تريس، 300 مم كلوريد الصوديوم، 1 مم DTT، 5 ملم كاكل 2، درجة الحموضة 8) في 4 درجات مئوية بين ليلة وضحاها بينما هو يجري حركت المخزن المؤقت قبل ماغنيتي محرض ج.
- بعد ح ~ 16 من الوقت ريفولدينج، إضافة ~ 1 يو ثرومبين كل ملغ بروتين مباشرة إلى حقيبة الغسيل الكلوي واحتضان عند 4 درجة مئوية h. إضافية ~ 24
- التحقق من المدى 6 × له الانقسام العلامة تلطيخ الأزرق أخذ من ~ 15 ميكروليتر البروتين مختبرين مأخوذة من كيس الغسيل الكلوي قبل وبعد الحضانة مع ثرومبين الذي يتم اليكتروفوريسيد على يشوه polyacrylamide الجل (الحزب الديمقراطي الصربي صفحة) باستخدام طريقة لايمملي 47. إذا كان من الملاحظ تحول كاتشين ~ 2 في الهجرة المقابلة للوزن الجزيئي × 6 ملصوق له العلامة، بالمتابعة حتى الخطوة 3.11؛ إذا كان جزء بقايا البروتين عسر الهضم التي يمكن كشفها بواسطة تلطيخ أخذ الأزرق، إضافة ~0.2 يو من ثرومبين كل ملغ بروتين مباشرة إلى حقيبة الغسيل الكلوي واحتضان عند 4 درجة مئوية h. إضافية ~ 24
- استخدام حجم الاستبعاد أو التبادل الأيوني اللوني لزيادة تنقية البروتين. لشاردة تبادل اللوني من أفسام، إزالة الحل البروتين من كيس الغسيل الكلوي وتركز ~ إذ استخدام مركزات الطرد مركزي أولترافيلتريشن مع وزن الجزيئي دا 10,000 الانقطاع. وفي وقت لاحق، إعادة تمييع الحل ~ برنامج في منطقة عازلة خالية من كلوريد الصوديوم (20 مم تريس، 5 مم كاكل 2، 1 مم DTT، درجة الحموضة 8)-
- حجته عمود صرف شاردة شحنت مع 10 العمود حجم المخزن المؤقت خالية من كلوريد الصوديوم الذي هو موضح في الخطوة 3.11. حجته باستخدام المخزن المؤقت تحميله إلى قفل اللوير حقنه تحتوي على لا فقاعات الهواء عن طريق دفع الحل من خلال العمود بطريقة دروبويسي وتجنب الضغوط المحاقن التي تسبب تيارات ثابتة للحل الخروج من العمود. استخدام مبادل شاردة قوية (مثل كروسلينكيد [اغروس] مع المجموعات الوظيفية رباعي الأمونيوم).
- تحميل حل البروتين المخفف إلى عازلة خالية من كلوريد الصوديوم (الخطوة 3.11) على العمود كما هو موضح في الخطوة 3، 12-
- الوت البروتينات في تدرج [أي 0-60% (v/v)] زيادة كلوريد الصوديوم المخزن المؤقت (20 مم تريس، 1 م كلوريد الصوديوم، 5 مم كاكل 2، 1 مم DTT، درجة الحموضة 8) باستخدام نظام بروتين سريعة اثنين-مضخة لوني سائل (فبلك). تعيين نظام فبلك لجمع الكسور مل ~1-1.5 ورصد الشخصية شطف البروتين باستخدام امتصاص الأشعة فوق البنفسجية 280 نانومتر وتدفق معدل 0.5 مل/دقيقة
- التعرف على قمم شطف والكسور التي تحتوي على بروتين الفائدة، فضلا عن الهلام نقاوة البروتين بأخذ الملون الأزرق الحزب الديمقراطي الصربي صفحة باستخدام طريقة لايملي 47.
- الكسور تجمع عرض > 95% (أي تؤخذ كالكسور التي تظهر عصابة بروتين واحد فقط على أخذ الأزرق الملون الجل) في كيس الغسيل الكلوي والصرف في المخزن المؤقت التجريبي للاهتمام بغسيل الكلي كما هو موضح في الخطوة 3، 8-
4. مرفق الكيميائية الجلوكوز-5-MTS للبروتين بالغسيل الكلوي.
حل الأسهم- تحضير 55 مم ن-(β-D-glucopyranosyl) ن '-[2-methanethiosulfonyl) إيثيل] اليوريا (الجلوكوز-5-MTS) بتذويب 10 مغ المجمع في 500 ميكروليتر من 100% (v/v) [دمس]. تخزين غير مستخدمة الجلوكوز-5-MTS solubilized في [دمس] في-20 درجة مئوية.
- تحضير العينة البروتين للتعديل قبل دياليزينج 1.5 مل من البروتين ميكرومتر ~ 60 إلى 1 لتر تعديل المخزن المؤقت تتكون من والمماسح 20 مم, 150 مم كلوريد الصوديوم، 5 كاكل 2 و 0.1 ملم تسيب، الأس الهيدروجيني 8.3. استخدام قطع وزن الجزيئي غشاء الغسيل الكلوي والذي أصغر من حجم البروتين يجري تعديلها (مثل استخدام قطع دا 3,500 أفسام دا ~ 17,500)- ح
- بعد 24 عند 4 درجة مئوية، نقل العينة من كيس الغسيل الكلوي في أنبوب ميكروسينتريفوجي. إضافة solubilized [دمس] الجلوكوز-5-MTS إلى تركيز نهائي من 2 مم-
- احتضان العينة في الظلام ح 1 في درجة حرارة الغرفة. خلال فترة الحضانة ح 1، مزيج الحل عن طريق التنصت لطيف للأنبوب كل دقيقة 10 وفي وقت لاحق، تبادل
- إعادة البروتين في المخزن المؤقت التجريبي النهائي الذي يحتوي على لا عامل تخفيض بالغسيل الكلوي في 4 درجات مئوية كما هو موضح في الخطوة 4، 2 أو بالطرد المركزي أولترافيلتراتيون. لهذا الإجراء ultrafiltration، تركيز العينة البروتين مل ~1.5 إلى < 0.5 مل وتضعف في وقت لاحق بمركَّزات نفسه مع المخزن المؤقت التجريبي. كرر هذه الخطوة تخفيف تركيز مرتين إضافية حيث يكون تبادل إجمالي الحد أدنى من 30 × 30 × 30 = 27,000-fold. أفسام، استخدم 20 مم تريس، 150 مم كلوريد الصوديوم، 5 ملم كاكل 2، الرقم الهيدروجيني 7.5 كالمخزن المؤقت التجريبي.
- تحضير العينة للتأين اليكتروسبراي الطيف الكتلي بتبادل الغسيل الكلوي أو أولترافيلتريشن كما هو موضح في الخطوات 4-2 و 4-5، على التوالي، إلى بيكربونات الأمونيوم 25 مم أو 25 مم خلات الأمونيوم. في حالة استخدام الغسيل الكلوي، ضمان يمكنك تبادل ثلاث مرات على الأقل لإزالة أي بقايا كلوريد الصوديوم وكاكل الأملاح 2-
- تحديد كتلة دقيقة (أي ± 1 دا) من بروتين فائدة استخدام التأين اليكتروسبراي الكتلة قياس الطيف الكتلي 48 ، 49. نتوقع كل الجلوكوز التساهمية بالإضافة إلى ثيول Cys عبر المادة الكيميائية ميثانيثيوسولفوناتي لإضافة 281.3 دا للبروتين الجماهيري (أي إضافة 360.4 دا للسكر-5-MTS واطرح دا 79.1 CH 3 حتى 2 ترك الفريق خلال التساهمية مرفق)-
5. تقييم الحل الرنين المغناطيسي لتعديل تعديل تعديلالاضطرابات الهيكلية والكفاءة إيكاتيون.
بروتين- ضمان تركيز تعديل > 100 ميكرومتر بعد مرفق الجلوكوز والصرف النهائي المخزن المؤقت. أفسام، تقدير تركيز البروتين باستخدام معامل انقراض الأشعة فوق البنفسجية في 280 nm 1.54 (مغ مل – 1) سم – 1-
- تكملة الحل البروتين مع 60 ميكرومتر من حمض 4,4-dimethyl-4-silapentane-1-sulfonic (DSS) لمعايرة الملئ والنبض و 10% (v/v) د 2 س لقفل إشارة. لاستخدام إشارة إلى الضوضاء عالية 600 ميكروليتر العينات في أنابيب مطابقة التردد 5 مم الرنين المغناطيسي، إدراج مطياف 600 ميغاهيرتز الحد أدنى مزودة بمجس مبردة هكن رنين ثلاثية-
- جمع المعيار 1 ح-15 هسقك ن أطياف ك مفصل سابقا 50 ، 51 في درجة الحرارة، 1 ح وعرض اكتساح 15 N، عابرة والزيادة الإعدادات المناسبة للحصول على نموذج معين. أفسام الأطياف، واستخدام 20 درجة مئوية، 256 1 ح العابرين، اكتساح 64 15 ن البعد زيادات و 1 ح و 15 ن عرض تعيين إلى هرتز 8000 و 1,800، على التوالي.
- عقب الحصول على الطيف البروتين الغليكوزيلاتي، إضافة ديثيوثريتول (DTT) للعينة الرنين المغناطيسي من مخزون 1 م لتركيز نهائي من 15 ملم. يزيل DTT moiety الجلوكوز من البروتين بالحد المرفق بوساطة ثنائي كبريتيد.
- الحصول ثانية 1 ح-15 هسقك ن في ظل هذه الظروف تخفيض معدلة، توفير طائفة مرجعية لتقييم تعديل الهيكلية وكفاءة الاضطرابات الناجمة عن المرفق الجلوكوز.
- معالجة البيانات الرنين المغناطيسي باستخدام نمربيبي تفصيلية قبل 52. التأكد من أن معالجة الحد الأدنى يشمل تحويل البيانات والتدريجي وقمع المذيبات، وتحويل فورييه والتصور المبدئي للاطياف.
- تقييم كفاءة التعديل بقياس كثافة الذروة أميد وقيم التحول الكيميائي في أطياف معدلة وانخفاض استخدام البرنامج المساعد نياسي على كارا 53. ضمان لتقييم كثافة الذروة أميد Cys سواء في الجلوكوز المرفقة وخفضت الأطياف. إذا لا تقع أميد Cys موثوق في كل الأطياف، استخدام كثافات بقايا المتاخمة Cys كقراءات.
- حساب كفاءة ككثافة أميد من الطيف تعديل Cys مقسوماً على كثافة أميد من الطيف (أي المعالجة DTT) خفضت Cys، مضروبة في 100:
 ، حيث M هو كثافة أميد في الطيف تعديل Cys و R هو كثافة أميد في الطيف Cys خفضت. وبدلاً من ذلك، تقييم كفاءة يعني على مدى عدة قمم أميد:
، حيث M هو كثافة أميد في الطيف تعديل Cys و R هو كثافة أميد في الطيف Cys خفضت. وبدلاً من ذلك، تقييم كفاءة يعني على مدى عدة قمم أميد:
 ، حيث الكفاءة i هو كفاءة مصممة بشكل منفصل المحسوبة لكل منها بقايا، الأول، و n هو العدد الإجمالي للمخلفات المستخدمة في الحساب.
، حيث الكفاءة i هو كفاءة مصممة بشكل منفصل المحسوبة لكل منها بقايا، الأول، و n هو العدد الإجمالي للمخلفات المستخدمة في الحساب. - حساب اضطرابات التحول الكيميائي (CSP) من الاختلافات الكيميائية تحول بين أطياف اثنين في 15 ن والأبعاد 1 ح لكل ذروة وتطبيع لاستخدام مجموعة أكبر تحول المواد الكيميائية 15 ن المعادلة التالية:
 ، حيث ΔH هو تغيير جزء من المليون في البعد بروتون و ΔN هو التغيير جزء في المليون في البعد النيتروجين.
، حيث ΔH هو تغيير جزء من المليون في البعد بروتون و ΔN هو التغيير جزء في المليون في البعد النيتروجين.
النتائج
الخطوة الأولى من هذا النهج يتطلب الطفرات مخلفات glycosylation المرشح لبقايا Cys التي يمكن أن تكون قابلة للتعديل باستخدام أفسام الجلوكوز-5-mts. قد لا توجد بقايا Cys الذاتية، حيث لا توجد اعتبارات خاصة بحاجة إلى بذل قبل الطفرات. بيد يجب أن تحور أصلي Cys بقايا لبقايا غير قابلة للتعديل قبل إجراء العملية في الكيمياء وصف. إلى الحد الأدنى تأثير البنية الأصلية، فإننا نقترح القيام محاذاة تسلسل عالمي من بروتين الفائدة وتحديد والبقايا الأخرى العثور على معظم الأحيان Cys الذاتية في المواقف. الطفرة Cys لهذه المخلفات الأخرى التي تحدث طبيعيا في الكائنات الحية الأخرى قد أثر أقل على بنية البروتين. إذا كانت دقة هو المحافظة على بقايا Cys الذاتية، نقترح تحور للسر الذي هو الأكثر هيكلياً مشابهة ل Cys. ويبين الشكل 1 هلام الطفرات PCR نموذجي تقييم نجاح رد فعل بكر، مع تضخيم الحمض النووي العينة تثبت لكن كثافة أعلى من مبلغ مراقبة الحيوانات الأليفة-28 ألف قالب unamplified الحمض النووي الذي كان يستخدم لبكر. وتشمل الخطوات التالية قالب الحمض النووي الهضم وتحويلها إلى كولاي لإصلاح بلازميد. بعد نشر بلازميد في ثقافة السائل وعزل بلازميد وتأكيد mutation(s) بالتسلسل، يمكن استخدام ناقلات تحور للتعبير البروتين. يبين الشكل 2 ألف ملف شطف نموذجية من أفسام من العمود تبادل شاردة بالنسبة إلى زيادة تركيز كلوريد الصوديوم. ويبين الشكل 2B نقاء أفسام على أخذ الهلام الحزب الديمقراطي الصربي صفحة ملطخة باللون الأزرق.
بعد الحصول على البروتين النقي، وسلسلة من الخطوات الغسيل الكلوي يستخدم لإرفاق مجموعة الجلوكوز عن طريق رد فعل النظام التجاري المتعدد الأطراف مع ثيول مجاناً. يبين الشكل 3 ألف صورة لإعداد نموذجي لوحدة التخزين صغير البروتين مختومة بالغسيل الكلوي الغشاء بغشاء مقاطع والواردة في كوب 1 لتر كبير يحتوي على المخزن المؤقت للفائدة. فحص أولى لنجاح هذا التعديل يمكن أن يؤديها الكتلي. ويبين الشكل 3B طيف كتلة اليكتروسبراي ممثل من أفسام تعديل في ثيول Cys واحد. في أعقاب إنشاء بروتوكول لبروتين محددة، الاضطرابات الهيكلية وكفاءة التعديل يمكن تقييم من واحد موحد 15عينة المسمى ن. وتكتسب الطيف15N-هسقك 1ح-قبل وبعد إضافة عامل تخفيض القيمة (الشكل 4 أ). يمكن إجراء العمليات الحسابية لكفاءة التعديل عن طريق مقارنة من شدة الذروة أميد في أطياف معدلة وانخفاض كما هو مفصل في البروتوكول خطوة 5.8 (الشكل 4 باء). وأخيراً، عندما معروفة مهام التحول الكيميائي لبروتين، Csp الذي ربط مع التغييرات الهيكلية التي يمكن أن تحسب كخطوة مفصلة في 5.9 (الشكل 4).
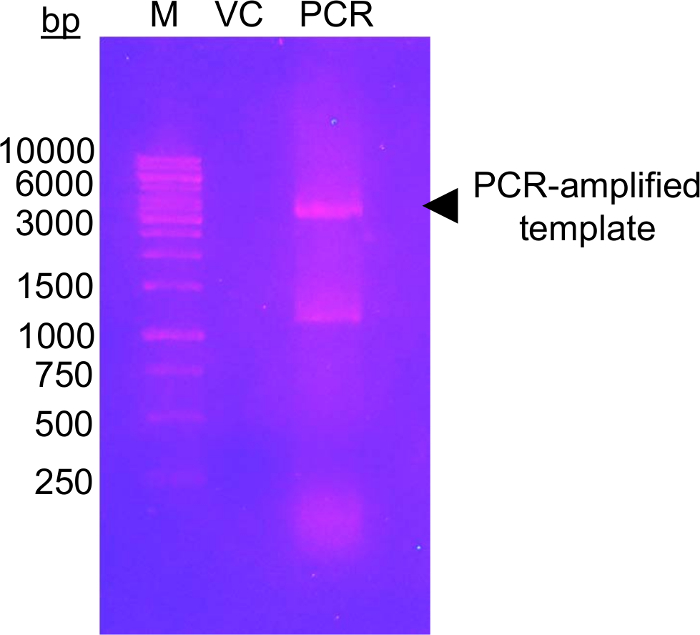
الشكل 1: الحمض النووي [اغروس] هلام عرض الاختيار التضخيم من ناقلات القالب مع الإشعال مطفرة.
الصورة تظهر [اغروس] هلام 1.0% (w/v) مع الحمض النووي علامة (M)، ناقل التحكم (VC) وتضخيم PCR قالب (PCR). تم فصل الحمض النووي بالتفريد في 120 الخامس لمدة 45 دقيقة في المخزن المؤقت x TAE 0.5. إجمالي 0.5 نانوغرام من الاستثمار الرأسمالي تم تحميله، أي ما يعادل مقدار قالب تحميل في حارة PCR. كان الملون الهلام استخدام اثيديوم بروميد (~0.5 ميكروغرام/مل) لمدة 20 دقيقة قبل التصور تحت ضوء الأشعة فوق البنفسجية (302 نيوتن متر). الهلام تدل على مستوى عال من تضخيم الحمض النووي قريبة من الحجم المتوقع لمكافحة ناقلات (السهم الأسود). الفرقة الثانية في حارة PCR يعمل بين 1,000 و 1500 شركة بريتيش بتروليوم ماركر العصابات المحتمل يمثل منتج PCR تضخيم غير على وجه التحديد. مستوى كثافة تضخيم الحمض النووي يجب أن تكون أعلى من مستوى كثافة الرأسمالي تعتبر ناجحة. يمكن استخدام العديد من الأصباغ الحمض النووي الأخرى كأقل البدائل مطفرة، أكثر أماناً لتلطيخ اثيديوم بروميد (انظر على سبيل المثال 57). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
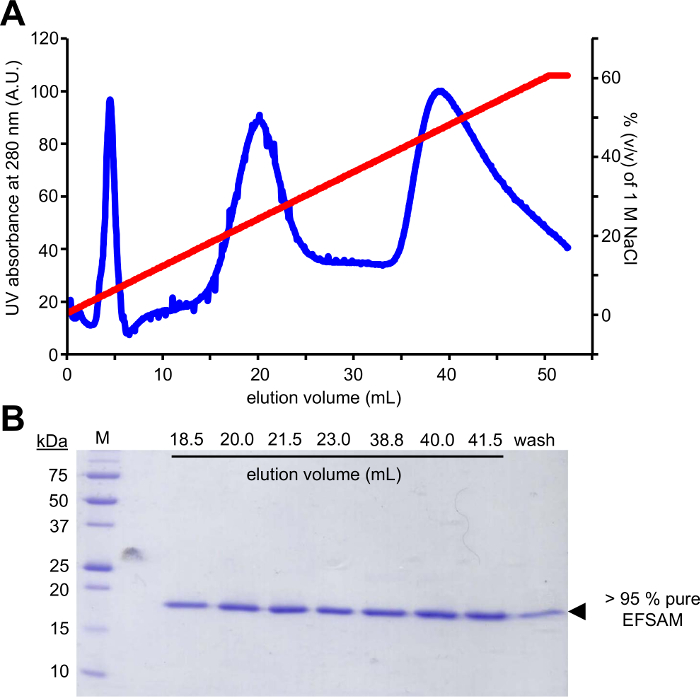
الشكل 2: تنقية الكروماتوغرافي نموذجية ونقاء تحقق للإنكليزية والفرنسية-سام STIM1.
(أ) شاردة تبادل اللوني شطف الشخصية EF-سام STIM1. بعد الربط اليدوي يستخدم EF-سام إلى العمود تبادل شاردة (Q فرنك فرنسي) في الأس الهيدروجيني القاعدي وتركيز كلوريد الصوديوم منخفض مع المحاقن، واكتا فبلك (الرعاية الصحية GE) الوت البروتين مع تدرج كلوريد الصوديوم. ويرصد شطف إكتا استخدام الأشعة فوق البنفسجية 280 nm إشارة عبر تدرج 0-60% (v/v) من كلوريد الصوديوم م 1. (ب) أخذ الملون الأزرق الحزب الديمقراطي الصربي صفحة جل الكسور شطف من (أ). هلام بروتين يشوه يكشف أن الإنكليزية والفرنسية-سام الوتيس في القمم الرئيسية اثنين ~ 250 ملم و ~ 450 ملم كلوريد الصوديوم. البروتوكول تنقية غلة > SAM EF نقية كما يدل على ذلك عدم وجود أي ملوث الفرقة تظهر في الهلام الملون الأزرق أخذ 95%. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3: الإعداد الغسيل الكلوي وتأكيد في المختبر جليكوسيلاتيون البروتين.
(أ) الإعداد الغسيل الكلوي النموذجية المستخدمة في المختبر مرفق الجلوكوز إلى ثيول Cys عبر مفاعليه النظام التجاري المتعدد الأطراف. وتوضح الصورة ~1.5 مل من البروتين الوارد داخل أنابيب الغسيل الكلوي معزولة ضد ~ 1 لتر من المخزن المؤقت التجريبي. من المهم أن المخزن المؤقت هو أثارت باستمرار لضمان صرف كامل. الصورة تظهر أنبوب ميكروسينتريفوجي قص لأنابيب الغسيل الكلوي الزائدة لمنع غرق كيس الغسيل الكلوي وتلف بشريط إثارة الدورية. (ب) اليكتروسبراي الطيف الشامل التأين من البروتين Asn171Cys EF-سام معدلة. الكتلي نهج مناسب ودقيق لتقييم ما إذا كان الإجراء التعديل الناجح. ويرد chromatogram جماعية نموذجية مع الجماهير النظرية ويقاس من غير معدلة وتم التعديل Asn171Cys EF-سام وأشارت إلى. الأغلبية من العينة يناظر الجماهيري جزيء ضخم وداخل ~1.3 دا كتلة النظرية المتوقعة من الجلوكوز مترافق Asn171Cys EF-سام. البيانات الموجودة في (ب) ريبلوتيد وتعديله من 42. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: تقييم الحل الرنين المغناطيسي من الاضطرابات الهيكلية وكفاءة التعديل من عينة واحدة في الرنين المغناطيسي النووي.
(أ) 1 ح-15هسقك ن تراكب الطيفية الجلوكوز مترافق أفسام Asn131Cys قبل (كروسبيكس الأحمر) وبعد (كروسبيكس الأسود) إضافة 15 ملم DTT. التراكب يبين بوضوح العديد من التغييرات التحول الكيميائية الخاصة ببقايا أميد إرشادي لتعديل كلا من الاضطرابات الهيكلية والبروتين. مربع أحمر يظهر موقع أميد Asn131Cys. (ب) عرض Zoomed المنطقة15N-هسقك 1ح-تتضمن أميد Asn131Cys. وتنقسم كثافة ذروة أميد Asn131Cys في الطيف المعدلة (طم) بالكثافة في الطيف (معدلة) انخفاض (أناR) لحساب الكفاءة (كما هو موضح). حساب متوسط كفاءة المخلفات تنفذ عدة يوفر تقدير أفضل للكفاءة، بما في ذلك تقدير خطأ. يتم إظهار كفاءة يعني أفسام Asn131Cys استناداً إلى بقايا 5 (أي 129-133). (ج) Normalized التحول الكيميائي الاضطرابات الناجمة عن تصريف الجلوكوز للبروتين Asn131Cys أفسام. جمعت مجموعة التجارب هسقك على عينة واحدة قبل وبعد المكمل مع عامل تخفيض لا يوفر تقدير مناسب لكفاءة التعديل بواسطة تحليل كثافة الذروة [المبين في الفقرة (ب)] فحسب، بل أيضا توفر البيانات تقييم التغيرات الهيكلية المرتبطة بالتعديل. تصريف الجلوكوز يسبب اضطرابات أكبر المترجمة قرب موقف 131؛ ومع ذلك، يكشف هذا التحليل الاضطرابات التي غير متوقعة فقط استناداً إلى قرب التسلسل، مما يشير إلى القيمة الموجودة في هذا التحليل. ريبلوتيد البيانات في (ج) وتعديل من 42. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| STIM1 الطفرة | الاتجاهب | تسلسل الحمض النوويج | |
| Asn131Cys | إلى الأمام | 5-جتكاتكاجاجتاتاكTGTتجاككجتجاتجاج-3 ' | |
| Asn131Cys | عكس | 5-ككتكاتككاكجتككاهيئة مكافحة الفسادجتاتاكتكتجاتجاك-3 ' | |
| Asn171Cys | إلى الأمام | 5-ككاجكتجكتجتكاككTGCأككاككاتجاكاجج-3 ' | |
| Asn171Cys | عكس | 5-كككتجتكاتجتغتالائتلافجتجاكاجككاجككتج-3 ' | |
| أ STIM1 من الأحماض الأمينية ترقيم استناداً إلى انضمام نكبي AFZ76986.1. | |||
| ب ويناظر التمهيدي 'عكس' تسلسل تكملة عكس التمهيدي 'إلى الأمام'. | |||
| ج ويناظر الثلاثي كودون المسطر الطفرة Cys. | |||
الجدول 1. إنشاء تسلسلات اليغنوكليوتيد (التمهيدي) مثال ل Asn الطفرات Cys داخل أفسام STIM1 الحيوانات الأليفة-28 ألف.
Discussion
جليكوسيليشن البروتين تعديل بوستترانسلاشونال حيث تساهمي المرفقة السكريات البروتينية أساسا عن طريق الروابط إلى سلاسل الحمض الأميني الجانبية. ما يصل إلى 50% بروتينات الثدييات هي الغليكوزيلاتي 54، حيث أن البروتينات الغليكوزيلاتي فيما بعد يمكن أن يكون مجموعة متنوعة من التأثيرات من تغيير الجزيئية البيولوجية ملزمة تقارب، التأثير على البروتين قابلة للطي، وتغيير نشاط القناة، واستهداف الجزيئات للتدهور والخلوية الاتجار، والحصر (استعرض في33). يتضح الدور الهام ل glycosylation في فسيولوجيا الثدييات بمئات عدة من البروتينات التي تطورت إلى بناء التنوع الكامل ل هياكل الثدييات جليكان 33. تغيير N-والمقترنة س-glycosylation أنماط الدول العديد من الأمراض بما في ذلك البروستاتا (زيادة ونقصان)، الثدي (زادت وانخفضت)، الكبد (زيادة)، والمبيض (زيادة)، البنكرياس (زيادة) وسرطان المعدة (زيادة) 55. وعلاوة على ذلك، أنه قد وجد glycosylation تاو، هونتينجتين، α-سينوكلين لتنظيم السمية لهذه البروتينات المرتبطة ب أمراض الزهايمر، هنتنغتون والرعاش 56، وكانت مجموعة من الاضطرابات الخلقية من جليكوسيلاتيون وحددت الناتجة عن العيوب الموروثة في الإنزيمات التي تتوسط glycosylation 54. وبالتالي، فهم الآثار الفيزيائية والكيميائية الحيوية والهيكلية الدقيقة ل glycosylation ينطوي على إمكانية هائلة تؤثر على فهمنا للائحة البروتين ووظيفته في الصحة والمرض.
لبنات بناء عشرة السكر مما يؤدي إلى تنوع هياكل جليكان وجدت في جليكومي الثدييات وتشمل فوكس، اللبن، الجلوكوز، N-أسيتيلجالاكتوساميني، N-أسيتيلجلوكوساميني، وحمض الغلوكورونيك، وحمض إيدورونيك، ويطلق، حمض اللعابي و xylose 33. بينما دائماً يربط N-جليكوسيليشن سكر-أسيتيلجلوكوساميني نمباشرة بالبروتين، س-جليكوسيليشن يمكن أن ينتج عن أي من N-أسيتيلجالاكوتوسي، N-أسيتيلجلوكوساميني، إكسيلوسي، فوكس، السكر أو اللبن تساهمي مرتبطة ببتيد. للبدء في فهم كيفية تأثير هذه السكريات متاخم لسطح البروتين على الخصائص الفيزيائية-الحيوية والهيكلية، ونحن تصف هنا نهجاً للموقع بشكل انتقائي إرفاق السكريات بقايا Cys عبر ثيولس هندسيا في البروتين التسلسل. وهنا، البقايا التي اندوجينوسلي الغليكوزيلاتي تحل محلها Cys وتعديلها في المختبر عن طريق اتباع نهج كيميائية بسيطة. بهذه الطريقة، يمكن تقييم مواقع glycosylation أحادية ومتعددة لندف مساهمة كل موقع محدد، فضلا عن التعديلات التراكمي قابلة للطي والاستقرار، وكذلك عموما هيكل ووظيفة البروتين.
في الآونة الأخيرة، استخدمت هذا النهج بنجاح مع أفسام منفردة ومجتمعة تقييم دور Asn131 و Asn171 ن-جليكوسيليشن مواقع 42. طفرة إلى Cys ومرفق التساهمية الجلوكوز إلى مواقع Asn131 أو Asn171 كشف انخفاض Ca2 + ملزمة تقارب وقمعت الاستقرار. عندما تم تعديل الموقعين في وقت واحد مع المرفق الجلوكوز، الانخفاضات في ملزمة تقارب وكانت potentiated الاستقرار مما يؤدي إلى تعزيز الميل أوليجوميريزيشن في المختبر. هيكلياً، أظهرت أن النهج المبينة في هذا التقرير أن التعديلات Asn131 أو Asn171 بعضها البعض التشويش اللولب α8 الأساسية الموجودة على المجال سام، متاخم لزوج EF-اليد. هذا التحليل الهيكلي يشرح كيف التعديلات الجلوكوز على السطح البروتين تؤدي إلى تغيير هيكلية متقاربة و potentiated داخل EF-واجهة اليد: سام في نهاية المطاف يزعزع البروتين ويعزز سوسي 42.
في حين يتم تعديل تطبيق هذا النهج الانتقائي موقع ساعد تلقي الضوء على كيفية أحادي القرب من سطح أفسام تأثيرات قابلة للطي، والاستقرار، والهيكل، هذا الإجراء يمكن بسهولة إرفاق أطول الكربوهيدرات المحددة للائحة، غولجي وبعد الظهر الترجمة (أي glycosylation الدول من نضج مختلفة)، قدمت هناك هي مصدر موثوق لهذه الكربوهيدرات التي تحتوي على المجموعات الوظيفية التي يمكن أن تربط ثيولس مثل MTS mts. الأفضل نظراً لتعديل ثيول عكسها باستخدام عامل تخفيض وطائفة مرجع يمكن الحصول عليها بسهولة. هذا النهج يمكن أيضا أن تتكيف مع ربط أخرى مويتيس بوستترانسلاشونال للبروتين مثل الدهون. في الوقت نفسه، هناك العديد من القيود على هذا النهج ينبغي النظر فيها. أولاً، الأسلوب يعتمد على طفرة مواقع glycosylation إلى Cys التي قد تؤثر على هيكل والاستقرار وطي حتى في حالة عدم وجود أي تعديل الجلوكوز. وبالمثل، يجب أيضا تحور بقايا Cys الأصلية في البروتين لمنع المرفقات الجلوكوز في مواقع غير الغليكوزيلاتي. بالإضافة إلى ذلك، إضافة المخلفات Cys غالباً ما يشجع تشكيل الهيئة إدراجها في البكتيريا بسبب Cys crosslinking و misfolding، مما يجعل تنقية أكثر تحديا. ومع ذلك، هذا النهج Cys crosslinking انتقائية الموقع الموضحة هنا يوفر وسيلة الخاضعة للرقابة لندف آثار هيكلية والبيوكيميائية والفيزيائية الحيوية من مواقع glycosylation محددة في التجارب التي تتطلب مستويات عالية من متجانسة من البروتين. الآثار المخلفات Cys غير أصلية في البنية الاستقرار وقابلة للطي يمكن ببساطة التحقق في حالة عدم وجود أي تعديلات بالمقارنة إلى البرية من نوع البروتين سمات 42. تؤخذ جنبا إلى جنب مع البيانات الفنية التي تم الحصول عليها في الخلايا حقيقية النواة التي تعبر عن حظر تعديل الإصدارات متحولة من البروتين (مثل Asn-إلى-علاء)، النهج الذي يوصف حاليا سوف تسفر عن رؤى جديدة في آليات هيكلية للبروتين لائحة التعديلات بوستترانسلاشونال.
Acknowledgements
أيد هذا البحث العلوم الطبيعية ومجلس البحوث الكندي الهندسية (05239 إلى P.B.S.)، والمؤسسة الكندية لصندوق بحوث الابتكار/أونتاريو (إلى P.B.S.)، ومؤسسة محاربة البروستات سرطان-ركوب تيلوس لأبي (ل P.B.S.) واونتاريو الحصول على منحة الدراسات العليا (ل Y.J.C. ونوفاسكوتيا).
Materials
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
References
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved