Method Article
靶向半胱氨酸硫用于体外重组蛋白的特异糖基化
摘要
糖化蛋白的生物化学和结构分析需要相对较大数量的均质样品。在这里, 我们提出了一种有效的化学方法的 site-specific 糖基化的重组蛋白纯化细菌的靶向活性胱氨酸硫。
摘要
基质相互作用 molecule-1 (STIM1) 是一种 I 型跨膜蛋白, 位于内质网 (ER) 和细胞膜 (PM)。ER 驻留 STIM1 调节 PM Orai1 通道的活动, 该过程称为存储操作钙 (ca2 +), 它是主要的 ca2 +信号处理程序, 它可驱动免疫应答。STIM1 经历修饰N-糖基化在两个腔 Asn 网站内的 Ca2 +传感领域的分子。然而, 直到最近, 由于无法轻易获得高水平的均质性蛋白质, 糖化 STIM1 的生物化学、生物物理和结构生物学效应都没有得到很好的理解. 在这里, 我们描述了一个体外化学方法的实现, 它将葡萄糖基附加到特定的蛋白质部位, 以了解N-糖基化对蛋白质结构和机制的潜在影响。使用溶液核磁共振波谱法, 我们评估的效率的修改, 以及结构的后果, 葡萄糖附件与单一样本。这种方法可以很容易地适应研究在自然界中发现的无数糖化蛋白。
引言
存储操作钙 (ca2 +) 条目 (SOCE) 是免疫细胞从细胞外空间进入胞的主要途径.t 淋巴细胞, t 细胞受体位于细胞膜 (PM) 结合抗原, 激活蛋白酪氨酸激酶 (在1,2,3中进行了审查。磷酸化级联导致磷脂酶γ (PLCγ) 的活化, 随后将膜醇 45--1,6-(PIP2) 的水解转化为甘油和肌醇 14, 5-trisphosphate (IP3).ip3是一个小的扩散信使, 它绑定到内质网 (er) 上的 ip3受体 (ip3R), 从而打开这个受体通道, 并允许 Ca2 +从 ER 流下来的浓度梯度。流明到胞 (在4中进行了审阅)。受体信号从 G 蛋白耦合和酪氨酸激酶受体在各种其他易激动和不可的细胞类型导致相同的生产 ip3和激活 ip3Rs。
由于 ER 的有限 Ca2 +存储容量, IP3介导的释放和胞浆 ca2 +的结果增加只是暂时的;但是, er 腔 Ca2 +的这一损耗深刻影响了基质相互作用 molecule-1 (STIM1), 一种主要在 er 膜上发现的 I 型跨膜 (TM) 蛋白, 5,6,7。STIM1 包含一个面向流明的 Ca2 +传感域由一个 EF 手对和无菌α-主题 (EFSAM) 组成。三由单 TM 域与 EFSAM 分离的胞内定向盘绕线圈域 (在8中进行了评审)。当 ER 腔 Ca2 +耗尽时, EFSAM 经历了一个不稳定耦合的齐聚, 7,9 , 这将导致 TM 和盘绕线圈域的结构重10。这些结构的变化最终导致 STIM1 在 ER pm 路口的陷印11,12,13,14通过与 pm phosphoinositides 15的交互, 16和 Orai1 子单元17,18。Orai1 蛋白质是组装成 Ca2 +通道19、20、21、22的 PM 子单元。STIM1-Orai1 交互在 ER PM 连接促进开放的 ca2 +释放激活的 ca2 + (裂纹) 通道构象, 使 ca2 +的移动到胞从高浓度的细胞外空间。在免疫细胞中, 通过裂纹通道的持续胞浆钙离子 2 +的升高, 诱发了 ca 的2 +-钙调素/磷酸依赖性磷酸的核因子的活化 T 细胞, 随后进入细胞核和开始转录调控基因促进 T 细胞激活1,3。裂纹通道激活的过程由 STIM1 23,24通过激动剂诱发 ER 腔 ca2 +耗尽和结果持续的胞浆 ca2 +提升统称为 SOCE 25。SOCE 在 T 细胞中的重要作用是显而易见的研究表明, STIM1 和 Orai1 可遗传突变会导致严重的联合免疫缺陷综合症3,19,26, 27. EFSAM 启动 SOCE 后, 传感 ER 腔 ca2 +损耗通过 ca 的损失2 +协调在规范 EF 手, 最终导致不稳定耦合 self-association 7, 28,29。
糖基化是通过 ER 和高尔基体中的各种生物合成步骤 (在30,32,33) 中对寡糖结构的共价键连接和处理, 也称为糖。在真核生物中有两种主要的糖基化类型: N-链接和O链接, 具体取决于特定的氨基酸和原子桥接连接。在N-糖基化, 糖附着在 Asn 的侧链酰胺上, 在大多数情况下, 当多肽链移动到流明34时, 在 ER 中发生起始步骤。n的第一步-糖基化是由葡萄糖 (Glc)、甘露糖 (人) 和N-乙酰 (GlcNAc) (即 Glc3人9GlcNAc2) 从 ER膜脂由 oligosaccharyltransferase 35,36。进一步的步骤, 如分裂或转移葡萄糖残留, 是催化在 ER 由特定的糖苷和转移。一些蛋白质, 离开 ER 和移动到高尔基可以进一步处理37。O-糖基化指的是添加糖, 通常对侧链羟基的 Ser 或的残留物, 这一修改完全发生在高尔基复合体33,34。有几个O-糖结构, 可以由N-乙酰, 藻, 半乳糖, 和唾液酸, 每个单糖添加顺序33。
虽然没有任何特定的序列被确定为许多类型的O-糖基化的先决条件, 但一个共同的共识序列已经与N链接的修改相关联: Asn x Ser/胱氨酸, 其中 x 可以是任何氨基酸除了 Pro 33。STIM1 EFSAM 包含其中的两个共识N-糖基化的网站: Asn131-Trp132-Thr133 和 Asn171-Thr172-Thr173。事实上, 以前的研究表明, EFSAM 可以是N-糖化在哺乳动物细胞在 Asn131 和 Asn171 38,39,40,41。然而, 以前的研究的后果, N-糖基化对 SOCE 已不, 建议抑制, 强化或没有效果, 这修饰修改 SOCE 激活38,= "xref" > 39,40,41。因此, 对 EFSAM N-糖基化的基础生物物理、生物化学和结构后果的研究对于理解这种修改的调节作用至关重要。由于在这些体外实验中对高水平的均质蛋白的要求, 采用了一种以现场选择的方法将葡萄糖基共价附着在 EFSAM 上。有趣的是, Asn131 和 Asn171 糖基化导致了在 EFSAM 核心内聚集的结构变化, 并增强了促进 STIM1-mediated SOCE 42的生物物理特性。
糖组对胱氨酸硫的化学附着已被一项开创性工作所证实, 这一研究首次证明了这种无酶方法的效用, 以了解糖基化对蛋白质功能的 site-specific 作用43,44. 最近和关于 STIM1, Asn131 和 Asn171 残留物被变异了对胱氨酸和葡萄糖-5-(methanethiosulfonate) [葡萄糖 5-(MTS)] 被用共价键连接葡萄糖到自由的硫42。在这里, 我们描述了这种方法, 不仅使用诱变, 以纳入现场特定的胱氨酸残留物的修改, 但也应用解决方案核磁共振 (NMR) 光谱学, 以快速评估的修改效率和结构由于糖基化而引起的扰动。值得注意的是, 这种通用的方法很容易适应于研究任何 recombinantly 产生的蛋白质的O或N-糖基化的影响。
研究方案
1. 聚合酶链反应 (PCR) 介导的定点诱变, 将胱氨酸纳入细菌 pET-28a 表达载体.
- 使用 0.020 (#956; g/毫升) cm -1 在 260 nm 的紫外线 (UV) 消光系数确定 pET-28a 向量 (即双绞链 DNA) 的浓度.
- 为每个胱氨酸突变合成一对互补诱变底漆, 这样 i ) 在第一个基不匹配和15核苷酸与模板互补之后, 至少有15核苷酸与模板互补。最终基不匹配, ii ) 总引物长度不超过45核苷酸, 和 iii ) 鸟嘌呤或胞嘧啶位于每个底漆的第一和最后一个核苷酸位置 (表 1)。确保使用0.025 和 #956 进行底漆合成; 摩尔刻度和墨盒净化.
- 使用高保真 DNA 聚合酶, 建立两个20和 #181; PCR 反应混合物: 一个包含前引物和第二个包含反向底漆。准备每个混合物, 以包含最终浓度的1x 和 #160;P cr 缓冲器 1.5 mM 氯化镁 2 , 0.2 毫米 dNTPs, 0.5 和 #956; M 型底漆, 0.4 和 #956; l 甲基亚砜, 1.25 ng/和 #956; l 模板 dna, 0.02 U/和 #956; 高保真 dna 聚合酶.
- 使用三步协议热循环分离的混合物:98 和 #176; c 为三十年代 (变性), 53-56 和 #176; c 为三十年代 (退火), 72 和 #176; c 为三十年代 kilobase (kb) -1 (扩展) 模板脱氧核糖核酸。重复5周期的温度程序, 并添加最后72和 #176; C 扩展步骤为 7.5 min.
- 在最初的 pcr 与前向和反向引物在分开的管子, 结合产品成一个单独管子 (即40和 #956; L 共计) 和继续 pcr 反应为另外20个周期使用相同的循环参数, 如步骤1.4 所述.
- Electrophorese 15 和 #956; PCR 反应混合物的 L 在 1% (w/v) 琼脂糖凝胶使用0.5x 三, 乙酸, 乙二胺四乙酸 (EDTA) 运行缓冲器 (泰)。作为控制, electrophorese 了一个相当数量的模板 dna 没有被放大的 pcr 和分的参考 dna 阶梯, 其中包含标记带比预期的 pcr 产品大小.
- 在120伏电泳40分钟后, 将凝胶浸入含有0.5 和 #956 的水中; 在室温下, 溴溴化物并摇动30分钟。确认的全长模板已被放大的诱变底漆作为增加相对溴溴荧光强度的放大带相比, 控制模板带在紫外线 (302 nm)。
- 如果没有明显的放大, 则在0.5 和 #176 中调整退火温度后重复 PCR; c 在 53-56 和 #176 之间递增; c 温度范围.
- 通过诱变底漆确认模板的放大后, 将剩余的 ~ 25 和 #956; PCR 反应混合物与 DpnI 限制性酶结合, 以消化甲基化模板 DNA。使用 DpnI 0.5 和 #181; l (10 单位) 每25和 #956; PCR 反应混合物和最终浓度1和 #215; DpnI 反应缓冲器。在37和 #176 孵育2.5 小时; C.
- 以下模板消化, 添加〜 5-10 和 #956; 消化混合物的 l 100 和 #181; 热休克主管 DH5 和 #945; 大肠杆菌大肠杆菌 1.75 毫升离心管中的细胞。在冰上孵育细胞 DNA 混合物60分钟.
- 热休克离心管的细胞 DNA 混合物在42和 #176; C 四十五年代在干燥热块。在冰上孵育3分钟的混合物后, 加入900和 #956; 室温 Luria Bertani 肉汤 (LB) 至细胞, 并将总细胞悬浮液转化为无菌14毫升圆底管.
- 孵育37和 #176 的细胞悬浮液; C 为90分钟, 在 190 rpm 时持续晃动.
- 随后, 将电池悬浮液转换回1.75 毫升离心管, 并在室温下 1万 x g 离心5分钟.
- 离心后, 取出900和 #956; 在其余100和 #956 中, 用温和的移重细菌细胞; l。
- 将合成的浓缩细胞悬浮液转移到含有抗生素的 LB 琼脂板上, 这是选择性的表达载体 (即60和 #956; g/mLKanamycin)。菌将悬浮液均匀地涂在琼脂板上, 在37和 #176 上孵育16小时; C.
- 第二天, 将单个菌落从板材接种到5毫升的液体 LB 中, 其中含有 antiobiotic 选择压力 (即60和 #956;在37和 #176 的夜间培养液体培养基; c. 在37和 #176 时持续晃动; c.
- 将传播质粒从 大肠杆菌中分离和纯化 使用基于碱性裂解过程的商用套件的细胞 45 。
- 确认感兴趣的突变是存在的, 并在适当的阅读框架中, 通过桑格 DNA 测序的质粒 46 .
2。BL21 和 #916 中的均匀 15 N 标记蛋白表达; E3 大肠杆菌 .
注意: 不同的重组蛋白需要不同的表达条件。以下是人类 STIM1 EFSAM 蛋白表达的优化过程.
- 将胱氨酸突变 (即 pET-28a-EFSAM) 的表达载体转换为 BL21 和 #916; E3 密码子 (+) 热休克主管细胞和板上的 LB 琼脂板包含抗生素选择压力, 如步骤 1.9-1.14) 与以下修改: 直接板150和 #956; l 分出1000和 #956; l 在 LB 琼脂板上的总细胞悬浮, 不需要用离心法将离心管中的细胞浓缩.
- 第二天, 菌将单个菌落转移到200毫升锥形烧瓶中, 其中含有20毫升的 LB 辅以适当的抗生素 (即60和 #956; pET-28a-EFSAM) 的卡那霉素。在一夜之间 (即16小时) 在37和 #176 生长这种液体发酵剂; C. 190 rpm 的恒定晃动.
- 在步骤2.2 的同一天, 在4升锥形烧瓶中, 为 15 N 标记蛋白表达 M9 培养基, 灭菌 1 l M9 缓冲盐 (即 42 mm Na 2 HPO 22 , 2 mm, 4 mm PO 8.6 , 7.4 毫米氯化钠, pH 4)。一旦冷却, 过滤 20% (w/v) d-葡萄糖的混合物, 1 米 CaCl 2 , 1 m 硫胺素, 1 M MgSO 4 , 1 毫克/毫升生物素和0.2 克/毫升 15 N NH 4 Cl 通过一个0.2 和 #956; M 无菌注射器过滤到 1 L 无菌 M9 盐溶液, 使这些成分的最终浓度是 0.2% (w/v) d-葡萄糖, 100 和 #956; m CaCl 2 , 50 和 #956; m 硫胺素, 1 毫米 MgSO 4 , 1 和 #956; g/毫升生物素和1毫克/毫升 15 N NH 4 Cl.
- 第二天, 菌将20毫升的隔夜液体发酵剂转化为50毫升的无菌锥管, 离心机在2400和 #215; g 为15分钟, 将单元格颗粒.
- 在迁 LB 培养基后, 在10毫升的 M9 极小介质中重产生的细胞团, 并将悬浮颗粒混合物转化为 M9 最低培养基的1升, 抗生素 (即60和 #956;
- 在37和 #176 中长出含有细菌起动培养物的 M9 最小培养基的1升; C 和〜 190 rpm 恒定晃动, 直到光学密度在 600 nm (OD600) 达到 ~ 0.6-0.8.
- 当到达 specfified OD600 范围时, 添加200和 #956; M 异丙和 #946;-D-1-thiogalactopyranoside (IPTG) 以诱导蛋白质表达.
- 在 IPTG 后, 继续在室温下以 190 rpm 为16小时 (即过夜) 对蛋白质表达的细胞进行孵化.
- 第二天, 用离心法采集1万、#215; g、4和 #176; C 30 min.
- 醒酒磅, 并将细胞颗粒转移到50毫升锥形管中。将小球储存在-80 和 #176; C 直到提纯.
3。从 大肠杆菌 中纯化重组蛋白.
注意: 不同的重组蛋白需要独特的纯化程序。以下是6和 #215 的协议;他标记的 EFSAM 纯化从 pET-28a 结构表达的包涵体.
- 手动质6米胍-hcl 中的冷冻细菌细胞颗粒, 20 毫米三盐酸 (pH 8) 和5毫米和 #946;-基使用机动10毫升转移吸管。在这个步骤中, 每5毫升的湿细胞颗粒中加入大约40毫升的胍-HCl.
- 在环境温度下进行90分钟的孵化, 在杂交烤箱中进行恒定旋转, 将混合物离心于 ~ 1.5万和 #215; g、8和 #176; C 为40分钟, 将不溶性细胞碎片 ( 即 #160; 颗粒) 从可溶性蛋白中分离混合物 (即上清).
- 添加750和 #181; 50% (v/v) Ni 2 + -三酸琼脂糖珠浆对澄清的裂解产物, 并在室温下孵育另90分钟, 在杂交烤箱中反转.
- 随后, 捕获6和 #215; 他的标签蛋白绑定到 Ni 2 + 通过收集在重力流蛋白纯化柱的琼脂糖珠。在移动到步骤3.5 之前, 允许裂解液完全流过该列.
- 将收集到的珠子洗涤三次, 10 毫升的6米尿素, 20 毫米的三盐酸 pH 8 和5毫米和 #946;-基。确保整个 10 ml 在随后的10毫升洗涤之前通过该列.
- 用6米尿素、20毫米三盐酸洗 pH 8、300 mm 咪唑和5毫米和 #946 等一系列2毫升馏分中的蛋白质进行分离, 基与九十年代的潜伏期之间的时间。确保整个 2 mL 在每个后续洗脱步骤之前经过该列.
- 在此阶段, 使用 Laemmli 47 的方法确认马斯亮蓝染色的十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS 页) 中的洗馏分中存在感兴趣的蛋白。通过与标准分子量标记带相比, 对蛋白质的大小、数量和纯度进行比较, 它们都小于和大于所期望的蛋白质的分子量.
- 将洗蛋白组分放入具有 3500 Da 分子量截渗的透析膜中, 并在 1 L 复用缓冲液中孵育 (20 毫米三, 300 毫米氯化钠, 1 毫米的, 5 毫米 CaCl 2 , pH 8) 在4和 #176; C 过夜, 而缓冲是由 magneti 搅拌c 搅拌器.
- 在 16 h 的复性时间后, 将每毫克蛋白质的凝血酶直接添加到透析袋中, 并在4和 #176 孵育; C 为额外的 ~ 24 h.
- 验证6和 #215 的范围; 他的标签由马斯亮-蓝色染色的〜15和 #956; 从透析袋中取出的蛋白等分电泳在变性聚丙烯酰胺凝胶 (SDS 页) 中的应用Laemmli 47 的方法。如果迁移中的 2 kDa 移位与6和 #215 的分子量相对应; 他的标签, 继续步骤 3.11;如果一小部分未消化的蛋白质仍然是可检测的马斯亮蓝染色, 添加〜 0.2 U 的凝血酶每毫克蛋白直接到透析袋和孵化4和 #176; C 为额外的〜 24 h.
- 使用尺寸排除或离子交换色谱法进一步纯化蛋白质。对于 EFSAM 的阴离子交换色谱, 从透析袋中去除蛋白质溶液, 用 1万 Da 分子量截止的超滤离心浓缩器浓缩〜10倍。随后, re-dilute 的解决方案〜20倍, 在一个无 NaCl 缓冲 (20 毫米三, 5 毫米 CaCl 2 , 1 毫米的双制式, pH 8).
- 平衡预阴离子交换柱, 在步骤3.11 中描述了10列的无 NaCl 缓冲液的容量。平衡使用缓冲区加载到口锁注射器不包含气泡, 通过推动解决方案通过该列的滴方式, 并避免注射器压力, 导致稳定的解决方案, 退出列。使用强阴离子交换器 (如交联琼脂糖与季铵功能基团). 如步骤3.12 所述,
- 将蛋白溶液稀释到不含氯化钠的缓冲液 (步骤 3.11) 上.
- 洗蛋白质和 #160; 在梯度 [即 0-60% (v/v)] 的增加 nacl 缓冲 (20 毫米三, 1 米氯化钠, 5 毫米 CaCl 2 , 1 毫米的数码, pH 8) 使用双泵快蛋白液相色谱 (FPLC) 系统。设置 FPLC 系统收集〜 1-1. 5 毫升分数和监测蛋白洗脱剖面使用 UV 280 nm 吸收率和流量0.5 毫升/分钟.
- 使用 Laemmli 47 的方法识别马斯亮蓝染色的 SDS 页凝胶中含有感兴趣蛋白和蛋白质纯度的洗脱峰和分数.
- 显示和 #62 的池分数; 95% (即以马斯亮-蓝色染色凝胶中仅显示单个蛋白带的分数) 放入透析袋中, 并按步骤3.8 中所述的透析交换到实验性缓冲中.
4。通过透析将 glucose-5-MTS 化学附着在蛋白质上.
- 在500和 #956 中溶解10毫克的化合物, 制备 n-(和 #946; d-基)-n-和 #39;-[2-methanethiosulfonyl) 乙基] 脲 (glucose-5-MTS) 的55毫米库存溶液; 100% (v/五) 亚砜的 l。储存未使用的 glucose-5-MTS 溶解在-20 和 #176 的亚砜; C.
- 透析1.5 毫升的60和 #956 的蛋白质样品进行修饰; M 蛋白为1升的修饰缓冲器, 由 20 mm 拖把、150 mm 氯化钠、5 mm CaCl 2 和 0.1 mm TCEP、pH 8.3 组成。使用透析膜的分子量截面积小于蛋白质的大小被修改 (例如, 使用 3500 da 截止为〜 17500 da EFSAM).
- 24 小时后在4和 #176; C, 将样品从透析袋中转移到离心管中。将溶解 glucose-5-MTS 加入到最后浓度为 2 mM.
- 在室温下在黑暗中孵育样品1小时。在 1 h 潜伏期, 混合的解决方案, 轻轻敲击管每10分钟.
- 随后, 在4和 #176 的透析中, 将蛋白质交换到含有 no 还原剂的最终实验缓冲液中, 如步骤4.2 或离心超滤法所述。对于超滤过程, 将1.5 毫升蛋白质样品浓缩至 #60; 0.5 毫升, 然后在同一个选矿厂用实验缓冲液稀释。重复这一浓缩-稀释步骤两次, 使总交换最小值为30和 #215; 30 和 #215; 30 = 2.7万倍。对于 EFSAM, 使用20毫米三, 150 毫米氯化钠, 5 毫米 CaCl 2 , pH 7.5 作为实验缓冲.
- 分别将步骤4.2 和4.5 中所述的透析或超滤交换样品制备为25毫米碳酸氢铵或25毫米醋酸铵。如果使用透析, 确保您至少交换三次, 以消除任何残留氯化钠和 CaCl 2 盐.
- 使用电喷雾电离质谱法确定感兴趣的蛋白质的准确质量 (即 #177; 1 Da) 48 , 49 。期望每个共价键葡萄糖加入胱氨酸硫醇通过 methanethiosulfonate 化学添加 281.3 da 到蛋白质质量 (即增加 360.4 da 为 glucose-5-MTS 和减去 79.1 da 为 CH 3 , 因此 2 离开组在共价键期间附件).
5。modif 的溶液核磁共振评价─效率和结构摄动.
- 确保修饰蛋白质的浓度为和 #62; 100 和 #956; M 在葡萄糖附着和最后的缓冲交换之后。对于 EFSAM, 估计蛋白质浓度使用紫外线消光系数在 280 nm 1.54 (毫克毫升 - 1 ) cm 1 。
- 补充蛋白质溶液与60和 #956; 44-二甲基 4-silapentane-1-磺酸 (DSS) 的匀和脉冲校准和 10% (v/v) D 2 O 为信号锁。用于高信噪比使用600和 #956; L 样品在频率匹配的5毫米核磁共振管, 插入到至少600兆赫光谱仪配备了三重共振 HCN 低温探头.
- 收集标准 1 H- 15 n HSQC 光谱作为先前详细的 50 , 51 在温度下, 1 h 和 15 N 扫描宽度, 瞬态和增量适用于特定样品的设置。对于 EFSAM 谱, 使用20和 #176; C, 256 1 H 瞬态, 64 15 n 维增量和 1 H 和 15 n 扫描宽度分别设置为8000和 1800 Hz.
- 在糖化蛋白谱获得后, 将糖 (数码化) 从1米的库存中添加到最终浓度为15毫米的核磁共振样品中。通过减少二硫化物介导的附着物, 使其从蛋白质中去除葡萄糖的基团.
- 获取第二个 1 H- 15 N HSQC 在这些减少/未修改的条件下, 提供了一个参考频谱, 以评估由葡萄糖附着引起的修改效率和结构扰动.
- 使用 NMRPipe 处理核磁共振数据, 如前文所述 52 。确保最小化处理包括数据转换、分阶段、溶剂抑制、傅里叶变换和光谱的初始显示.
- 使用卡拉 NEASY 插件 53 对修改的和降低的光谱中的酰胺峰值强度和化学位移值进行测量, 以评估修改效率。确保对胱氨酸酰胺在葡萄糖附着和还原谱中的峰值强度进行评估。如果胱氨酸酰胺不能在这两种光谱中可靠地定位, 那么就使用相邻胱氨酸的残留强度作为读数.
- 计算的效率作为酰胺的强度从胱氨酸改性光谱除以酰胺的强度从胱氨酸减少 (即电算处理) 频谱, 乘以 100:
 , 其中 I M 是胱氨酸修饰谱中的酰胺强度, i R 是胱氨酸降低光谱中酰胺的强度。或者, 对多个酰胺峰值的平均效率进行评估:
, 其中 I M 是胱氨酸修饰谱中的酰胺强度, i R 是胱氨酸降低光谱中酰胺的强度。或者, 对多个酰胺峰值的平均效率进行评估:
 , 其中 效率 i 是为各自计算的单独确定的效率残留物、 i、 和 n 是计算中使用的残滓总数.
, 其中 效率 i 是为各自计算的单独确定的效率残留物、 i、 和 n 是计算中使用的残滓总数. - 计算化学位移扰动 (CSP) 从在 15 n 和 1 H 维度中观察到的两个光谱之间的化学位移的差异, 对较大的 15 N 化学位移范围使用以下等式:
 , 其中 和 #916; H 是在质子维度和 和 #916 中的 ppm 变化; N 是氮维数的 ppm 变化.
, 其中 和 #916; H 是在质子维度和 和 #916 中的 ppm 变化; N 是氮维数的 ppm 变化.
结果
这一方法的第一步要求将候选糖基化残留物诱变为胱氨酸残留物, 可以使用 glucose-5-MTS 进行修改. EFSAM 没有内生胱氨酸残留物, 因此在诱变.然而, 本地胱氨酸残留物必须在执行所描述的化学物质之前突变为不可残留物。为了最小地影响本机结构, 我们建议对感兴趣的蛋白质进行全球序列对准, 并确定在内源胱氨酸位置最常发现的其他残留物。胱氨酸突变对其他生物体自然发生的其他残留物可能对蛋白质结构影响最小。如果内源性胱氨酸残留是严格保守的, 我们建议突变的 Ser, 这是最结构类似胱氨酸。图 1显示了一个典型的 pcr 突变凝胶, 用于评估 pcr 反应的成功, 而扩增的 dna 样本比 unamplified 模板 pET-28a dna 的控制量 several-fold 更高的强度。接下来的步骤包括模板 DNA 消化和转化为大肠杆菌的质粒修复。经过质粒在液体培养、质粒分离和基因突变的确认后, 突变的载体可用于蛋白质表达。图 2A显示了阴离子交换柱上的 EFSAM 的典型洗脱剖面相对于氯化钠浓度的增加。图 2B显示了马斯亮蓝染色的 SDS 页凝胶中 EFSAM 的纯度。
在获得纯蛋白后, 通过与游离硫醇的 MTS 反应, 通过一系列的透析步骤来附加葡萄糖基团。图 3A显示了在透析膜中用膜夹密封的小蛋白体积的典型设置的图像, 并包含在含有缓冲物的大 1 L 烧杯中。初步检查的成功的修改可以进行质谱。图 3B显示了在单胱氨酸硫醇上修饰的具有代表性的 EFSAM 的电喷雾质谱。在建立了特定蛋白质的协议之后, 可以通过一个统一的15N 标记样本来评估修改效率和结构摄动。1H-15n-HSQC 频谱是在还原剂 (图 4A) 添加之前和之后获得的。通过在协议步骤 5.8 (图 4B) 中详细介绍的修饰和还原光谱中的酰胺峰值强度的比较, 可以对修改效率进行计算。最后, 当化学转移分配是已知的蛋白质, 与结构变化相关的 csp 可以计算在步骤 5.9 (图 4C) 中详述。
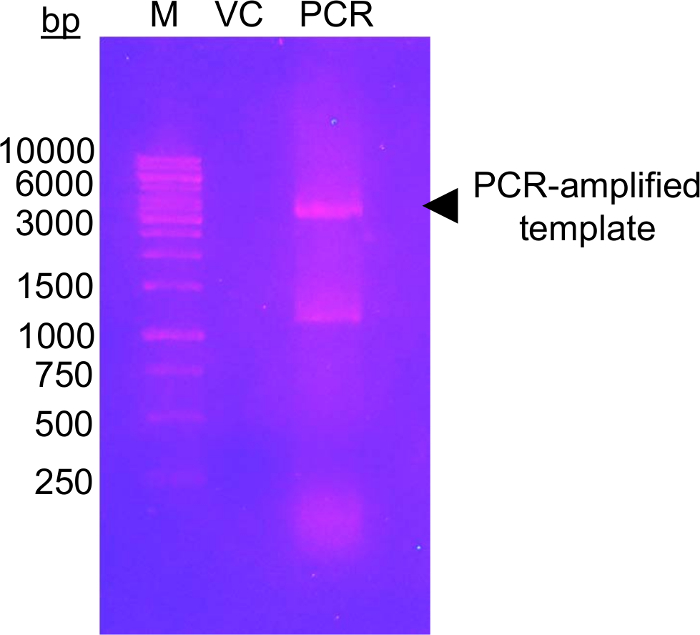
图 1: DNA 琼脂糖凝胶显示的模板载体与诱变底漆的放大检查。
图像显示 1.0% (w/v) 琼脂糖凝胶与 DNA 标记 (M), 矢量控制 (VC) 和 pcr 扩增模板 (pcr)。在0.5x 泰缓冲器中, DNA 被电泳分离为120伏, 45 分钟。共加载 0.5 ng VC, 相当于加载到 PCR 车道的模板量。该凝胶使用溴溴化物 (0.5 微克/毫升) 在紫外线照射 (302 nm) 前20分钟被染色。该凝胶显示了高水平的放大 DNA 接近预期大小的矢量 (黑色箭头)。在1000和 1500 bp 标记频段之间的 pcr 通道中的第二个波段可能代表非扩增的 pcr 产物。扩增 DNA 的强度水平必须高于 VC 强度水平才能被认为是成功的。一些其他的 DNA 染料可以被用作更少的诱变, 更安全的替代品溴溴化染色 (见例如57)。请单击此处查看此图的较大版本.
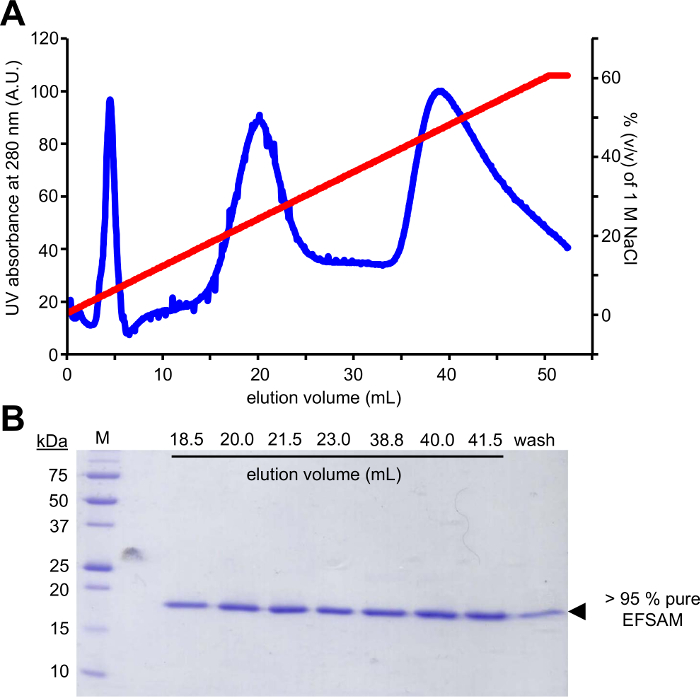
图 2: STIM1 的典型色谱纯化和纯度检查。
(A) STIM1 的阴离子交换层析洗脱剖面。经过手工结合 EF SAM 到阴离子交换柱 (Q FF) 在碱性 pH 和低氯化钠浓度与注射器, 和 AKTA FPLC (GE 保健) 是用来洗的蛋白质与 nacl 梯度。洗脱由 AKTA 使用紫外 280 nm 信号在 0-60% (v/v) 梯度 1 M 氯化钠监测。(B)马斯亮蓝染的 SDS-页凝胶的洗脱分数从 (A)。变性蛋白凝胶显示, EF-SAM elutes 在两个主要的峰值在〜250毫米和〜450毫米氯化钠。纯化协议的产生和 #62; 95% 纯 EF SAM 证明, 没有任何污染带出现在马斯亮蓝染色凝胶。请单击此处查看此图的较大版本.

图 3: 透析设置和确认体外蛋白糖化。
(A)典型的透析装置, 用于通过 MTS 反应性将葡萄糖附着在胱氨酸硫醇上的体外。该图像显示〜1.5 毫升的蛋白质包含在透析管缓冲对〜 1 L 实验缓冲区。重要的是, 缓冲区不断搅拌, 以确保完全交换。图像显示一个离心管修剪到过剩的透析管, 以防止透析袋下沉和损坏的旋转轰动酒吧。(B)修饰 Asn171Cys 蛋白的电喷雾电离质谱。质谱法是一种简便、准确的方法, 可用于评估改性程序是否成功。典型的质量色谱显示与理论和被测量的大量未修改的和修改的 Asn171Cys EF SAM 表明。样本质量的大多数对应于一个大分子, 这是在 1.3 Da 的预期理论质量葡萄糖共轭 Asn171Cys EF SAM。中的数据 (B) 从42中 replotted 并修改。请单击此处查看此图的较大版本.

图 4: 从单个核磁共振样品中对改性效率和结构摄动进行核磁共振评估。
(A)1H-15n-HSQC 葡萄糖共轭 Asn131Cys 的光谱叠加 EFSAM 前 (红色 crosspeaks) 和后 (黑色 crosspeaks) 增加15毫米的数码影像。叠加清楚地显示了一些特定于残留物的酰胺化学位移变化, 表明蛋白质和结构摄动的修饰。红色方框显示了 Asn131Cys 酰胺的位置。(B)包含 Asn131Cys 酰胺的1H-15n-HSQC 区域的缩放视图。在改进的光谱 (IM) 中, Asn131Cys 酰胺峰的强度除以所减少的 (未修改的) 频谱 (IR) 中的强度来计算效率 (如图所示)。计算几个受影响的残滓的平均效率提供了更好的估计效率, 包括错误估计。平均效率显示 Asn131Cys EFSAM 基于5残留物 (即 129-133)。(C) Asn131Cys EFSAM 蛋白的葡萄糖共轭引起的化学转移扰动的归一化。在用还原剂补充的单一样品上收集的 HSQC 实验集不仅为峰值强度分析提供了方便的修改效率估计 (如(B)所示), 而且还提供了数据评估与修改相关的结构变化。葡萄糖共轭引起最大的摄动局部近位置 131;然而, 这一分析揭示的扰动, 是意想不到的完全基于序列接近, 表明的价值在这个分析。(C) 中的数据是从42replotted 和修改的。请单击此处查看此图的较大版本.
| STIM1 变体a | 方向b | DNA 序列c | |
| Asn131Cys | 提出 | 5 "-GTCATCAGAAGTATACTGTTGGACCGTGGATGAGG-3" | |
| Asn131Cys | 反向 | 5 "-CCTCATCCACGGTCCAACAGTATACTTCTGATGAC-3" | |
| Asn171Cys | 提出 | 5 "-CCAAGGCTGGCTGTCACCTGCACCACCATGACAGGG-3" | |
| Asn171Cys | 反向 | 5 "-CCCTGTCATGGTGGT配合力GGTGACAGCCAGCCTTGG-3" | |
| a基于 NCBI 加入 AFZ76986.1 的 STIM1 氨基酸编号。 | |||
| b"反向" 底漆对应于 "正向" 引物的反向补序序列。 | |||
| c带下划线的密码子三重对应于胱氨酸突变。 | |||
表1。例子寡核苷酸 (引物) 序列为 Asn 到胱氨酸突变在 pET-28a STIM1 EFSAM 构造之内。
讨论
蛋白质糖基化是一种修饰的修饰, 糖通过与氨基酸侧链的连接, 以共价键的多肽为主。多达50% 的哺乳动物蛋白质是糖化54, 其中糖化蛋白可以有不同范围的影响, 改变生物分子结合亲和力, 影响蛋白质折叠, 改变渠道活动, 目标降解和细胞贩运的分子, 命名为少数 (在33中进行了审查)。糖基化在哺乳动物生理学中的重要作用是由数百种蛋白质进化而来的, 以构建哺乳动物糖结构的完整多样性33。改变的N-和O-糖基化模式与许多疾病状态相关, 包括前列腺 (增加和减少), 乳房 (增加和减少), 肝脏 (增加), 卵巢 (增加), 胰腺 (增加)和胃癌 (增加) 55。此外, Tau, 亨廷顿, α-核的糖基化已被发现, 以调节这些蛋白质的毒性与阿尔茨海默氏症, 亨廷顿和帕金森的疾病56, 和一组先天性疾病的糖基化已鉴定的结果由遗传缺陷的酶, 调解糖基化54。因此, 了解糖基化的精确的生物物理、生物化学和结构效应有可能极大地影响我们对蛋白质调节和在健康和疾病中的作用的理解。
十糖构建块, 导致糖结构的多样性, 发现在哺乳动物糖包括藻, 半乳糖, 葡萄糖, n-acetylgalactosamine, n-乙酰, 醛酸酸, iduronic 酸, 甘露糖,唾液酸和木糖33。虽然n-糖基化总是将一个n-乙酰糖直接链接到蛋白质, O-糖基化可以产生于任何n-acetylgalacotose, n-乙酰, 木糖, 藻,葡萄糖或半乳糖与多肽相连。为了开始了解这些糖直接毗邻蛋白质表面的影响的生物物理和结构特性, 我们在此描述的方法, 以现场选择性地附加糖的胱氨酸残留通过硫工程的蛋白质序列.在这里, 内糖化的残留物被胱氨酸和修改过的体外通过简单的化学方法取代。以这种方式, 可以评估单个和多个糖基化的站点, 以梳理每个特定站点的贡献以及对折叠和稳定性的累积修改以及蛋白质的整体结构和功能。
最近, 此方法成功地用于 EFSAM, 以单独和累计地评估 Asn131 和 Asn171 N-糖化站点42的角色。突变到胱氨酸和共价附着葡萄糖的 Asn131 或 Asn171 的网站显示了减少的 Ca2 +绑定亲和性和抑制稳定性。当两个部位同时用葡萄糖附着物进行修饰时, 结合亲和性和稳定性的降低强化导致了增强的齐聚倾向体外。在结构上, 本文所描述的方法表明, Asn131 或 Asn171 修改相互扰乱的核心α8螺旋位于 SAM 域, 紧邻 EF 手对。这一结构分析阐明了葡萄糖在蛋白质表面的修饰如何导致了在 EF 手内的强化结构变化: SAM 界面最终破坏了蛋白质并增强了 SOCE 的42。
虽然应用这一选址的方法有助于揭示如何一个单糖接近表面的 EFSAM 影响折叠, 稳定性和结构, 这个过程可以很容易地修改, 以附加更长的碳水化合物特定于 ER, 高尔基和 PM本地化 (即不同成熟度的糖基化状态), 只要有一个可靠的来源, 这些碳水化合物含有功能基团, 可以链接到硫, 如 mts. 由于硫醇的改性是可逆的, 所以使用可以很容易地获得还原剂和参考光谱。这种方法也可以用来将其他修饰基与脂类等蛋白质联系起来。同时, 这一做法有若干限制, 应予考虑。首先, 该方法依赖于糖基化部位的突变胱氨酸, 即使在没有任何葡萄糖修饰的情况下, 也会影响结构、稳定性和折叠。同样, 蛋白质中的原生胱氨酸残留也必须被突变, 以防止 non-glycosylated 部位的葡萄糖附着。此外, 由于胱氨酸交联和折叠, 添加胱氨酸残留物经常促进细菌包涵体的形成, 使纯化更具挑战性。然而, 本网站中所述的选择性胱氨酸交联方法提供了一种控制方法, 以在实验中对特定糖基化部位的结构、生物化学和生物物理效应进行梳理, 这需要高水平的均质蛋白。非本地胱氨酸残留对结构, 稳定性和折叠的影响, 可以简单地确定在没有任何修改相比, 野生型蛋白质属性42。结合在真核细胞中获得的功能性数据 (如 Asn-to-Ala), 目前所描述的方法将对蛋白质的结构机制产生新的见解。章程由修饰修改。
致谢
这项研究得到了加拿大自然科学和工程研究理事会 (05239 至 P.B.S.)、加拿大创新基金会/安大略省研究基金 (P.B.S.)、前列腺癌防治基金会--科学爸爸 (P.B.S.) 和安大略的支持。研究生奖学金 (Y.J.C. 和生理盐水)。
材料
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
参考文献
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。