Method Article
Bitki Hücresi Duvarında Lignin, Selüloz ve Hemiselülozu Görselleştirmek için Raman Görüntüleme ve Çok Değişkenli Analizin Birleştirilmesi
Bu Makalede
Özet
Bu protokol, bitki hücre duvarlarındaki lignin, selüloz ve hemiselülozun Raman görüntüleme ve çok değişkenli analizi kullanılarak görselleştirilmesi için genel bir yöntem sunmayı amaçlamaktadır.
Özet
Raman görüntüsünün bitki biyokütle uygulamasına uygulanması, sulu çözeltiler üzerinde mekansal ve kompozisyonsal bilgi sunabileceği için artmaktadır. Analiz, genellikle kapsamlı numune hazırlığı gerektirmez; Yapısal ve kimyasal bilgiler etiketsiz olarak elde edilebilir. Bununla birlikte, her Raman görüntüsü binlerce spektrum içermektedir; Gizli bilgileri ayıklarken, özellikle de benzer kimyasal yapıya sahip bileşenler için güçlükler doğar. Bu çalışma, bu sorunu çözmek için çok değişkenli bir analizi ortaya koymaktadır. Protokol, bitki hücre duvarı içerisindeki lignin, selüloz ve hemiselüloz dahil olmak üzere ana bileşenleri görselleştirmek için genel bir yöntem oluşturmaktadır. Bu protokolde, numune hazırlama, spektral edinme ve veri işleme prosedürleri anlatılmıştır. Numune hazırlama ve veri analizinde operatör becerisine oldukça bağımlıdır. Bu yaklaşımı kullanarak, uzman olmayan bir kullanıcı tarafından bir Raman araştırması yapılabilir.H kalite verisi ve bitki hücre duvar analizi için anlamlı sonuçlar.
Giriş
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
Protokol
1. Numune Hazırlama
- Bitki örneğinden küçük bir doku bloğu (yaklaşık 3 mm x 3 mm x 5 mm) kesin ( örn. Kavak kökü).
- Dokuyu 30 dakika kaynar deiyonize suya daldırın. Oda sıcaklığında (RT) 30 dakika boyunca hemen deiyonize suya aktarın. Doku, kabın altına sızana kadar bu adımı tekrarlayın; dokudaki havanın alınmış olduğunu ve dokunun yumuşadığını belirtin.
Not: Bu adımdan önce altına batan numuneler için, genellikle bu döngüyü 3-5 kez tekrarlayın. - Deiyonize suyun içindeki 20, 50, 70, 90% (h / h) miktarlardaki polietilen glikol (PEG) ve saf PEG'yi hazırlayın ve solüsyonları 65 ° C'de tutun.
- Suyu, yerinden çıkartmak ve PEG'nin sızmasına izin vermek için, dokuyu bir dizi dereceli PEG banyosunda inkübe edin.
Not: Genellikle, molekül ağırlığı 2,000 olan (PEG2000) PEG, gömme için kullanılır.- Doku g ile işleyin(A) 1 saat boyunca% 20 PEG, (b) 1.5 saat boyunca% 50 PEG, (c) 2 saat boyunca% 70 PEG, (d) 2 saat boyunca% 90 PEG, ve (E)% 10 PEG ile 10 saat.
- Kaseti 65 ° C'de fırında önceden ısıtın. Bloğu içeren PEG'yi kasete dökün ve daha sonra önceden ısıtılmış cımbız veya iğne kullanarak doku bloğunu istenen bir yere yerleştirin.
- Kaseti yavaşça soğutun ve doku kullanıma kadar oda sıcaklığında saklayın.
- Keskin bir tıraş bıçağı kullanarak küçük bir blok (yaklaşık 1 cm x 1 cm x 2 cm) içine hedef doku içeren PEG bloğu parçalayın ve mikrotom üzerine monte edin.
- PEG bloğundan ince kesitleri kesin (tipik olarak 3-10 μm).
- PEG'yi dokudan çıkartmak için, bölmeyi deiyonize su ile bir saat camında 10 kez durulayın.
- Ekstraktları çıkarmak için bölümleri toluen / etanol (2: 1, v / v) ile 6 saat bekletin. 65 mL deiyonize su, 0.5 mL asetik asit ve 0.6 g sodyum klorür karıştırılarak reaksiyon sıvısı hazırlanır.Bir kapta ritüel edin. 5 mL şişeye bir bölüm ve 3 mL reaksiyon sıvısı ekleyin. Şişenin üst kısmını vidalayın.
- Dokunun lignini çıkarmak için şişeyi 75 ° C'de 2 saat boyunca su banyosunda ısıtın. Parçayı deiyonize su ile 10 kez saat camında yıkayın.
- İşlenmemiş / tasfiye edilmemiş bölümü cam mikroskop lamı üzerine aktarın. Fırçaları veya iğneleri kullanarak bölümü dikkatle açın. Ekstra deiyonize suyu kağıttan kağıtla çıkarın.
- Kesiti D 2 O içine sokun. Numuneyi bir cam kapak folyosuyla örtün. D2O'nun buharlaşmasını önlemek için kapak kağıdını oje ile mühürle.
2. Spektral Edinme
- Konfokal Raman mikroskopunun cihaz çalıştırma yazılımını açın. Lazeri açın (dalga boyu = 532 nm), 100X mikroskop objektifli kristal silisyumun yüzeyine odaklayın ve cihazı kalibre etmek için kalibrasyon düğmesine tıklayın.
- Aleti değiştirOptik mikroskop moduna geçirin ve mikroskop lambasını açın. Mikroskop lamı, objektife bakacak şekilde kapak kaymasıyla birlikte sahneye monte edin.
- 20X mikroskop objektifle örneği inceleyin ve ilgi alanını bulun. Lamel içine daldırma yağı uygulayın ve daldırmalı mikroskop objektif (60X, sayısal diyafram NA = 1.35) geçiş yapın. Numunenin yüzeyine odaklanın.
- Cihazı, Raman test moduna getirin ve mikroskop lambasını kapatın.
- Dikdörtgen bir araç kullanarak bir haritalama alanı seçin. Elde edilen spektrumların sayısını belirlemek için adım boyutunu değiştirin.
Not: Adım boyutunun farkında olun (genellikle objektifin sayısal diyaframı ile hesaplanan spot çapından daha büyük, teorik olarak 1.22λ / NA). Bunun altındaki boyutlar aşırı örneklemeye neden olur. - Uygun bir edinim zamanında (genellikle <8 saat) en iyi sinyal-gürültü oranı (SNR) ve spektral kaliteyi elde etmek için optimum spektral parametreleri ayarlayın, depeNumunenin uygunluğuna değinerek. Genellikle, görüntüleme parametrelerini cihaz yazılımında aşağıdaki gibi girin: lazer (532 nm), filtre (100%), delik (300), yarık (100), spektrometre (1,840 cm -1 ), oluklar (1200 t), objektif 60X yağ) ve edinme süresi (2 s).
- Veri işleme öncesinde spektral verileri saklayın ve evrensel bir biçime ( ör. TXT dosyaları) dönüştürün.
3. Veri Analizi
- Spektral verileri (TXT dosyaları) veri analizi yazılımına yükleyin ( örn., Matlab). SNR'yi iyileştirmek için veri kümesindeki bir gürültü azaltma tekniği uygulayın ( örneğin, Savitzsky-Golay algoritması veya dalgacık algoritması)
- Lignin ve polisakarit görüntüleri üretmek için işlem görmemiş numuneler kullanın. Lignin görüntülemede, aromatik halka simetrik gerilme titreşiminden dolayı 1,600 cm -1 civarında spektral zirveyi göz önünde bulundurun. Polisakkarit görüntüleme (selüloz ve hemiselüloz dahil) için, spektral zirveyi aCH ve CH 2 gerilmelerinden dolayı 2,889 cm -1 yuvarlaktır.
- Selüloz ve hemiselüloz görüntüleri oluşturmak için lekeleyici örnekleri kullanın. Elde edilen spektrumlarda selüloz ve hemiselülozun spektrumlarını ayırt etmek ve dağılımlarını görüntülemek için kendinden modelleme eğrisi çözünürlüğü (SMCR) uygulayın.
- Farklı hücre duvarı katmanlarından Raman spektrumlarını ayırt etmek için elde edilen verilere temel bileşen analizi (PCA) ve kümeleme analizi uygulayın.
Sonuçlar
Şekil 1 , bir bitki hücre duvarının Raman görüntüsü için tipik bir mikro-Raman sistemine genel bir bakış sunmaktadır. Örnek olarak, kavak ( Populus nigra L.) orijinal Raman spektrumlarında belirgin taban çizgileri ve sivri uçlar bulunur ( Şekil 2a ). Raman görüntüleme veri seti (APRI) için otomatik ön işleme yöntemini yaptıktan sonra, bu iki spektral kirletici başarıyla kaldırılır ( Şekil 2b ). Kavak tipik bir Raman spektrumu Şekil 3'de gösterilmiştir ve bant atamaları Tablo 1'de listelenmiştir. Lignin'in Raman görüntüsü, aromatik halka yapısına atıf yapılan 1.550-1.650 cm " 1 arasındaki spektral bölgenin entegrasyonu ile üretilir ( Şekil 4a ). Şekil 4d , polisakaridlerin Raman görüntüsünü göstermektedir;2.989 cm " 1'de zirve entegre edilerek elde edilir. Selüloz ve hemiselülozun görüntülenmesi için, SMCR, bir dehidrasyonlu numunenin Raman görüntüleme verisi üzerinde gerçekleştirilir. Karşılık gelen spektrumlar ve görüntüler Şekil 5'te gösterilmektedir. Şekil 6 PCA ile elde edilen sonuçları ve kümeleme analizini göstermektedir.

Şekil 1: Bitki Hücresi Duvarında Raman Görüntülemesinin Bir Şeması. Kesit örneği (örnek olarak kavak), bir optik mikroskopu bir şarj kuplajlı cihaz (CCD) dedektörü ile bir Raman yüksek çözünürlüklü spektrometreye birleştiren bir mikro-Raman sistemi ile ölçülür. Parlak alan görüntüsünde, bitki hücre duvarı hücre köşesi (CC), bileşik orta lamel (CML) ve ikinci duvar (SW) içine düzenlenir. Geleneksel olarak, bir Raman görüntüsü tek pikEntegrasyon veya yoğunluk. Orijinal spektrumda iki spektrumlu kirletici madde ( örn. Taban çizgisi kaymaları ve kozmik sivri uçlar) bulunur. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
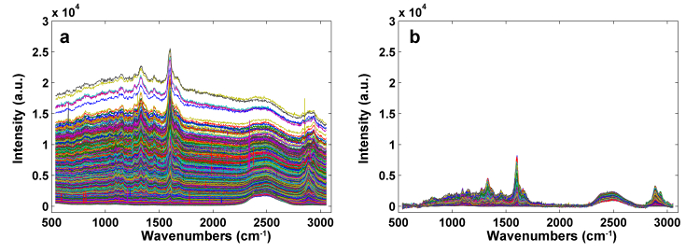
Şekil 2: APRI'den önce ( a ) ve sonra ( b ) ön işleme tabi tutulan Raman Spektrumu. İki spektral kirletici başarıyla kaldırılır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
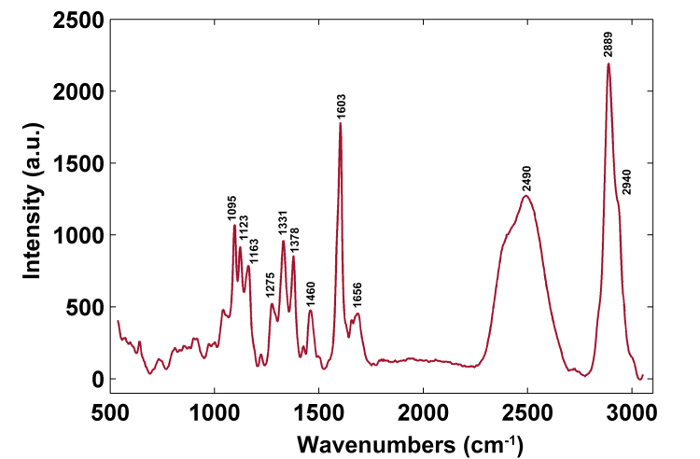
Şekil 3: Kavak Hücresi Duvarının Tipik Raman Spektrumu. Tipik Raman spektrumu ikincil duvardır. Bant atamaları Tablo 1'de gösterilmiştir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
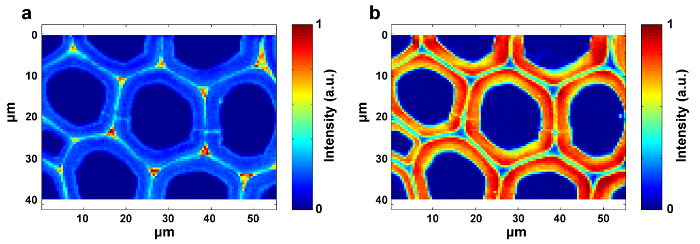
Şekil 4: Populer Hücre Duvarındaki Lignin ( a ) ve Polisakkaridlerin ( b ) Raman Görüntüleri. Lignin görüntüsü zirveyi 1,600 cm -1 civarında entegre ederek üretilir. Polisakkarit görüntü, zirveyi 2.889 cm " 1 civarında entegre ederek üretilir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 5: Kavak Hücresi Duvarındaki Selüloz ( a ) ve Hemiselülozun ( b ) Raman Görüntüleri. SMCR, bir dehidrasyonlu numunenin Raman görüntüleme verileri üzerinde gerçekleştirilir. Delignifikasyon selüloz ve hemiselülozun spektral özelliklerinin ortaya çıkmasına katkıda bulunur. Selüloz çoğunlukla SW'da yoğunlaşırken, hemiselülozun dağılımı kavak hücre duvarı boyunca hemen hemen aynıdır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
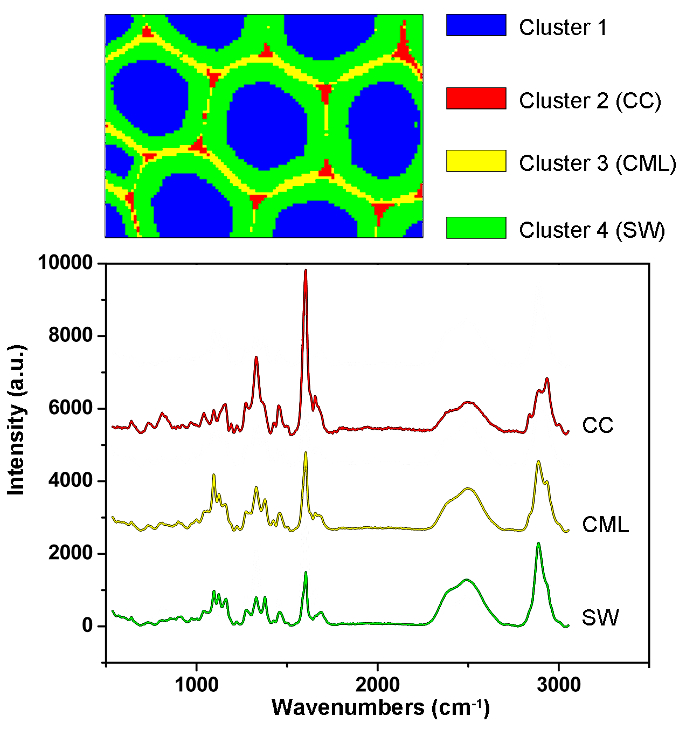
Şekil 6: Kavak Hücresi Duvarındaki Farklı Hücre Duvar Katmanlarını Otomatik Olarak Belirleme İçin PCA ve Kümeleme Analiz Sonuçları. P'yi kullanarakCA ve kümeleme analizinde, spektrumlar hücre lümenine, CC, CML ve SW'ya karşılık gelen dört kısma ayrılmıştır. Bu katmanların ortalama spektrumları aşağıda verilmiştir. Sonuçlar, ligninin CML boyunca ve CC'de yoğunlaştığı ve polisakaritlerin çoğunlukla SW'da yoğunlaştığı sonucuna vardı. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
| Wavelumbers (cm -1 ) | Bileşenler | Ödevler |
| 1095 | Selüloz, Hemiselüloz | Ağır atom CC ve CO germe titreşimi |
| 1123 | Selüloz, Hemiselüloz | Ağır atom CC ve CO germe titreşimi |
| 1163 | Selüloz, Hemiselüloz | Ağır atom CC ve CO germe titreşim artı HCC ve HCO eğilme titreşimi |
| 1275 | Lignin | Aril OH ve aril O-CH3'ün aril-O; C = O grubu guaiasil halkası |
| 1331 | Lignin, Selüloz, Hemiselüloz | HCC ve HCO eğilme titreşimi |
| 1378 | Selüloz, Hemiselüloz | HCC, HCO ve HOC eğilme titreşimi |
| 1460 | Lignin, Selüloz, Hemiselüloz | HCH ve HOC eğilme titreşimi |
| 1603 | Lignin | Aril halka germe titreşimi, simetrik titreşim |
| 1656 | Lignin | Halkalı konjuge C = C koniferil alkolün gerilme titreşimi; C = 0 koniferaldehitin gerilme titreşimi |
| 2889 | C, H | CH ve CH 2 gerilme titreşimi |
| 2940 | L, C, H | OCH 3 asimetrik titreşiminde CH gerilme titreşimi |
Tablo 1: Raman Tepe Konumları ve Bant Atamaları
Tartışmalar
Bitki hücre duvarı, hücre köşesi (CC), ikincil duvar (SW, S1, S2 ve S3 katmanları) ve bileşik orta lamel (CML, orta lamel artı birincil birincil Duvar), bu da numunenin hazırlanması sırasında düz bir yüzey elde edilmesini zorlaştırmaktadır. Bu nedenle, ahşaptan daha karmaşık bir yapıya sahip bitki örnekleri, özellikle çim, çoğunlukla ince kesit vermeye izin vermek için katılaştırılmaya ihtiyaç duyar. PEG, suda çözünür olduğu için kesme ve Raman araştırması için ideal bir sert matristir. Deiyonize suyla durulama ile kolaylıkla çıkarılabilir. Gömme işlemi için kullanılan PEG, 1.000-20.000 arasında değişen farklı moleküler ağırlıklara sahiptir. PEG'nin molekül ağırlığı ne kadar yüksekse penetrasyon kabiliyeti o kadar düşüktür. D20, lignin'in flüoresanını azaltmaya yardımcı olur ve 2,490 cm "1'de belirgin bir zirve noktasına sahiptir, ancak floresans girişimini ortadan kaldırmaz. İkiBüyük sinyaller, gerçek sinyallerle birlikte kanala dökülür: 1) örnek ve arka plan flüoresansının yanı sıra CCD'nin termal dalgalanmaları bazal sürüklenmelere neden olabilir ve 2) kozmik ışınlar hassas dedektörleri belirgin şekilde etkileyebilir, bu hassas dedektörleri belirgin şekilde etkileyebilir Spektrumları dar bant genişliği ani olarak. Bu konuları ele almak için APRI yöntemi geliştirildi 11 . APRI, spektral özellikleri kendileri kullanarak başlangıçtaki sürüklenmeleri ve kozmik sivri uçları ortadan kaldırmak için iteratif olarak tekrar ağırlıklandırılmış cezalandırılmış en küçük kareler (airPLS) ve ana bileşen analizi (PCA) içerir.
Dağılım görüntüleri elde etmek için, çok değişkenli yöntemlerle pik yoğunluk / entegrasyon ve tüm spektrum doğrusal uydurma seçilmelidir. İlki spesifik Raman zirveleri olan bileşenlere ( ör. Lignin) uygundur, ikincisi ise güçlü spektrumlu örtüşen bileşenlere ( örn., Selüloz ve hemiselüloz) uygundur. DistriLigin ve polisakkaritlerin bution görüntüleri sırasıyla 1,600 cm -1 ve 2,889 cm -1 çevresindeki spesifik zirveleri entegre ederek mevcuttur (Şekil 4). Bununla birlikte, selüloz ve hemiselüloz görüntüleri, güçlü spektrumlu örtüşme nedeniyle pik entegrasyonu ile doğrudan üretmek zordur. Çok değişkenli analiz, kıvrılmış bilgi içeriğinin, orijinal verinin sınırlı sayıdaki önemli faktörden 12 yeniden oluşturulduğu hipotezine göre sıralanmasını sağlar. Böylece, spektrumlarını ayırt etmek ve karşılık gelen Raman görüntüleri üretmek için uygulanabilir. Bitki örnekleri için ekstraktların ve lignin varlığı, selüloz ve hemiselülozun spektrumlarını yeniden oluşturma kabiliyetine müdahale eder. Görüntüleme verilerinin SMCR analizinden önce bu parazitleri gidermek gereklidir. SMCR ilk önce Lawton ve Sylvester tarafından saf bir bileşen f çözümü için geliştirilmiş çok değişkenli bir teknik olarak tanıtıldı fGörüntüleme verilerini analiz etmek için bir spektral kütüphaneye başvurmadan spektrum seti hazırlayın 13 . Spektral sınıflandırma, bitki hücre duvarının yapısal ve kimyasal özelliklerini daha iyi anlamak için önemlidir. Burada, görüntüleme verileri farklı hücre duvarı tabakalarından Raman spektrumlarını ayırt etmek için ana bileşen analizi (PCA) ve kümeleme analizine tabi tutulmuştur.
Bununla birlikte, bu tekniğin iki sınırlaması vardır. Birincisi, Raman etkisi zayıftır - tipik toplam Raman saçılım kesiti molekül başına ~ 10-29 cm2'dir ve yoğun fluoresansa 15 karşı savunmasız kalır. Arızayı düzeltmenin olası bir yolu, bölümleri olabildiğince ince bir şekilde hazırlamak ve temel düzeltme algoritması uygulayarak elde etmektir, ancak flüoresan sinyallerinin çıkarılması zordur. İkincisi, kimyasal muamele, hücrenin Raman görüntülerine erişirken önemli bir prosedürdürUloz ve hemiselülozdur ve orijinal kimyasal içeriği değiştirme riskini artırabilir. Bu nedenle, hücre duvarı yapısı işlenmemiş olanlardan çok farklı görünmeksizin, ekstraktları ve lignini mümkün olduğunca uzaklaştırmak en iyisidir.
Sonuç olarak, bu protokol bitki hücresi duvarı içerisindeki lignin, selüloz ve hemiselülozun dağılımının incelenmesi için uygundur. İstenilen bilgiyi elde etmek için Raman görüntülemenin kullanılması, numune hazırlama ve veri analizinde operatörün becerisine oldukça bağlıdır. İyi bir numune hazırlama, yüksek kaliteli Raman spektrumlarını toplamak için gereklidir. Uygun veri analizi, büyük ölçekli spektrumlara dair bilgiler sağlar ve gizli bilgileri görüntüden çıkarır. Temel bir yöntem olan bu protokol, mikro düzeyde kimyasal, fiziksel veya biyolojik arıtma sırasında ana bileşenlerin dinamik değişimlerini izlemek için kullanılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Mali destek için Çin Bilim ve Teknoloji Bakanlığı'na (2016YDF0600803) teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
Referanslar
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır