Method Article
Combinando imagem Raman e análise multivariada para visualizar Lignina, celulose e hemicelulose no muro celular da planta
Neste Artigo
Resumo
Este protocolo visa apresentar um método geral para visualizar lignina, celulose e hemicelulose em paredes celulares de plantas usando imagem de Raman e análise multivariada.
Resumo
A aplicação da imagem de Raman para planta de biomassa está aumentando porque pode oferecer informações espaciais e de composição sobre soluções aquosas. A análise geralmente não requer preparação extensiva de amostras; As informações estruturais e químicas podem ser obtidas sem rotulagem. No entanto, cada imagem Raman contém milhares de espectros; Isso levanta dificuldades ao extrair informações ocultas, especialmente para componentes com estruturas químicas semelhantes. Este trabalho apresenta uma análise multivariada para resolver esta questão. O protocolo estabelece um método geral para visualizar os principais componentes, incluindo lignina, celulose e hemicelulose dentro da parede celular da planta. Neste protocolo, são descritos os procedimentos para preparação de amostras, aquisição espectral e processamento de dados. É altamente dependente da habilidade do operador na preparação da amostra e análise de dados. Ao usar essa abordagem, uma investigação Raman pode ser realizada por um usuário não especialista para adquirirDados de qualidade h e resultados significativos para análise de parede celular vegetal.
Introdução
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
Protocolo
1. Preparação da amostra
- Corte um pequeno bloco de tecido (cerca de 3 mm x 3 mm x 5 mm) da amostra da planta ( por exemplo, uma haste de álamo).
- Mergulhe o tecido em água desionizada fervente durante 30 min. Imediatamente transferi-lo para água desionizada à temperatura ambiente (RT) durante 30 min. Repita este passo até o tecido escorrer no fundo do recipiente, indicando que o ar no tecido foi removido e que o tecido se amaciou.
Nota: Para as amostras que afundam no fundo antes desta etapa, geralmente repita este ciclo 3-5 vezes. - Prepare as alíquotas 20, 50, 70, 90% (v / v) de polietileno glicol (PEG) em água desionizada, bem como PEG puro e mantenha as soluções a 65 ° C.
- Incube o tecido em uma série de banhos graduados de PEG para deslocar a água e permitir que o PEG se infiltre.
Nota: Tipicamente, PEG com um peso molecular de 2.000 (PEG2000) é usado para incorporação.- Processar o tecido com gPEG radiado num forno de secagem da seguinte forma: (a) 20% de PEG durante 1 h, (b) 50% de PEG durante 1,5 h, (c) 70% de PEG durante 2 h, (d) 90% de PEG durante 2 h e (E) 100% de PEG por 10 h.
- Pré-aqueça uma cassete a 65 ° C no forno. Despeje o PEG que contém o bloco na cassete e, em seguida, coloque o bloco de tecido em uma posição desejada usando pinças pré-aquecidas ou agulhas.
- Lixar lentamente a cassete e armazenar o tecido à TA até o uso.
- Disseca o bloco de PEG contendo o tecido alvo em um pequeno bloco (cerca de 1 cm x 1 cm x 2 cm) usando uma lâmina afiada e montá-lo no microtomo.
- Corte seções finas do bloco PEG (tipicamente 3-10 μm).
- Enxague a seção com água desionizada em um vidro de relógio 10 vezes para remover o PEG do tecido.
- Mergulhe as secções com tolueno / etanol (2: 1, v / v) durante 6 h para remover os extrativos. Prepare o líquido de reação misturando 65 mL de água desionizada, 0,5 mL de ácido acético e 0,6 g de chlo de sódioRito em um copo. Adicione uma seção e 3 mL de líquido de reação a um frasco de 5 mL. Aperte o topo do frasco.
- Aqueça o frasco em banho-maria a 75 ° C durante 2 h para remover a lignina do tecido. Enxague a seção com água desionizada em um vidro de relógio 10 vezes.
- Transfira a seção não tratada / desligada para uma lâmina de microscópio de vidro. Desdobre a seção com cuidado usando escovas ou agulhas. Remova a água extra desionizada com papel de seda.
- Mergulhe a seção em D 2 O. Cubra a amostra com uma cobertura de vidro. Selar a tampa com esmalte para evitar a evaporação do D 2 O.
2. Aquisição espectral
- Abra o software de operação do instrumento do microscópio Raman confocal. Ligue o laser (comprimento de onda = 532 nm), foco na superfície do silício cristalino com um objetivo de microscópio 100X e clique no botão de calibração para calibrar o instrumento.
- Mude o instrumentoPara o modo microscópio óptico e acenda a lâmpada do microscópio. Monte o escorredor do microscópio no palco, com a tampa deslizante voltada para o objetivo.
- Veja a amostra com um objetivo de microscópio 20X e localize a área de interesse. Aplique óleo de imersão na lamínula e mude para o objetivo do microscópio de imersão (60X, abertura numérica NA = 1.35). Concentre-se na superfície da amostra.
- Mude o instrumento para o modo de teste Raman e desligue a lâmpada do microscópio.
- Escolha uma área de mapeamento usando uma ferramenta retangular. Altere o tamanho do passo para determinar o número de espectros obtidos.
Nota: Esteja ciente do tamanho do passo (geralmente maior do que o diâmetro do ponto calculado pela abertura numérica do objetivo, teoricamente 1,22λ / NA). Tamanhos abaixo disso resultarão em oversampling. - Defina os parâmetros espectrais ótimos para obter a melhor relação sinal-ruído (SNR) e qualidade espectral em um tempo de aquisição apropriado (geralmente <8 h), depeCom base na adequação da amostra. Em geral, insira os parâmetros de imagem no software do instrumento da seguinte forma: laser (532 nm), filtro (100%), furo (300), fenda (100), espectrômetro (1.840 cm -1 ), sulcos (1200t), objetivo ( Óleo 60X) e tempo de aquisição (2 s).
- Salve os dados espectrales antes do processamento de dados e converta-os em um formato universal ( por exemplo, arquivos TXT).
3. Análise de dados
- Carregue os dados espectrales (arquivos TXT) no software de análise de dados ( por exemplo, Matlab). Aplique uma técnica de redução de ruído no conjunto de dados para melhorar o SNR ( por exemplo, o algoritmo Savitzsky-Golay ou o algoritmo wavelet)
- Use amostras não tratadas para produzir imagens de lignina e polissacarídeos. Para a imagem de lignina, considere o pico espectral em torno de 1.600 cm -1 devido à vibração de alongamento simétrica do anel aromático. Para imagens de polissacarídeos (incluindo celulose e hemicelulose), use o pico espectral aRodada 2.889 cm -1 por causa dos trechos CH e CH 2 .
- Use amostras deslocadas para gerar imagens de celulose e hemicelulose. Execute a resolução da curva de auto-modelagem (SMCR) nos espectros adquiridos para discriminar os espectros de celulose e hemicelulose e para a imagem de suas distribuições.
- Execute análise de componentes principais (PCA) e análise de agrupamento nos dados adquiridos para distinguir os espectros Raman de camadas de parede celular diferentes.
Resultados
A Figura 1 apresenta uma visão geral de um sistema típico de micro-Raman para a imagem de Raman de uma parede celular de planta. Por exemplo, os espectros de Raman originais do álamo ( Populus nigra L.) têm derivações e espigas de linha de base significativas ( Figura 2a ). Depois de executar o método de pré-processamento automático para o conjunto de dados de imagem Raman (APRI), esses dois contaminantes espectrales são removidos com sucesso ( Figura 2b ). Um espectro Raman típico de álamo é exibido na Figura 3 , e suas atribuições de banda estão listadas na Tabela 1 . A imagem Raman da lignina é gerada pela integração da região espectral de 1.550-1.650 cm -1 , o que é atribuído à estrutura do anel aromático ( Figura 4a ). A Figura 4d exibe a imagem Raman de polissacarídeos, whIsto é conseguido integrando o pico a 2.889 cm -1 . Para imagem de celulose e hemicelulose, o SMCR é realizado nos dados de imagem Raman de uma amostra desligada. Os espectros e imagens correspondentes são mostrados na Figura 5 . A Figura 6 apresenta os resultados obtidos pela PCA e análise de agrupamento.

Figura 1: Esquema da Imagem Raman para o Mural da Planta. A amostra de seção transversal (álamo como exemplo) é medida por um sistema micro-Raman que combina um microscópio óptico com um espectrômetro Raman de alta resolução com um detector de dispositivo acoplado a carga (CCD). Na imagem de campo brilhante, a parede celular da planta é organizada no canto da célula (CC), lamela intermediária composta (CML) e parede secundária (SW). Convencionalmente, uma imagem Raman é gerada por um único picoIntegração ou intensidade. Dois contaminantes espectrales ( ou seja, derivações basais e picos cósmicos) são encontrados nos dados originais. Clique aqui para ver uma versão maior desta figura.
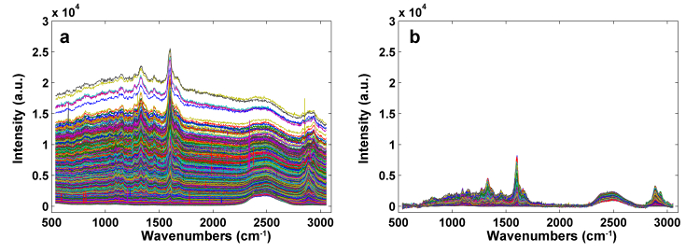
Figura 2: The Raman Spectra Before ( a ) e After ( b ) Pré-processamento por APRI. Dois contaminantes espectrales são removidos com sucesso. Clique aqui para ver uma versão maior desta figura.
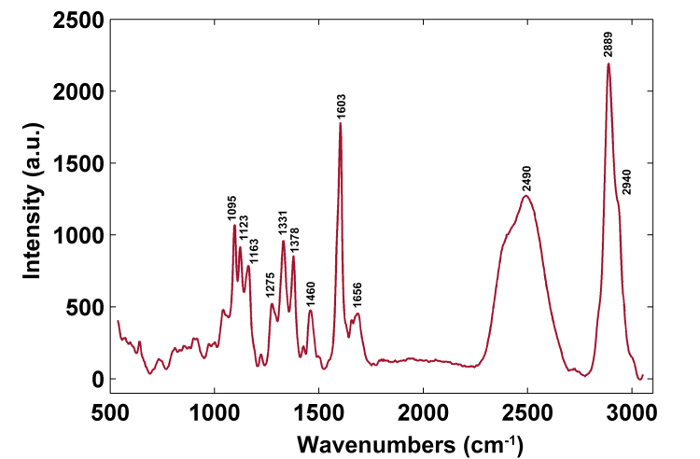
Figura 3: Um Espectro Raman típico da parede celular de álamo. Clique aqui para ver uma versão maior desta figura.
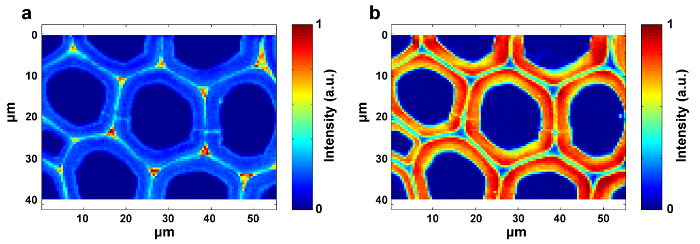
Figura 4: Imagens Raman de Lignina ( a ) e Polissacarídeos ( b ) dentro do Muro da Pilha de Álamo. A imagem de lignina é gerada integrando o pico em torno de 1.600 cm -1 . A imagem de polissacarídeo é produzida integrando o pico em torno de 2.889 cm -1 . Clique aqui para ver uma versão maior desta figura.

Figura 5: Imagens Raman de Celulose ( a ) e Hemicelulose ( b ) dentro da Parede Celular. O SMCR é realizado nos dados de imagem Raman de uma amostra desligada. A designificação contribui para a exposição das características espectrais da celulose e da hemicelulose. A celulose é concentrada principalmente no SW, enquanto a distribuição da hemicelulose é quase uniforme em toda a parede celular do álamo. Clique aqui para ver uma versão maior desta figura.
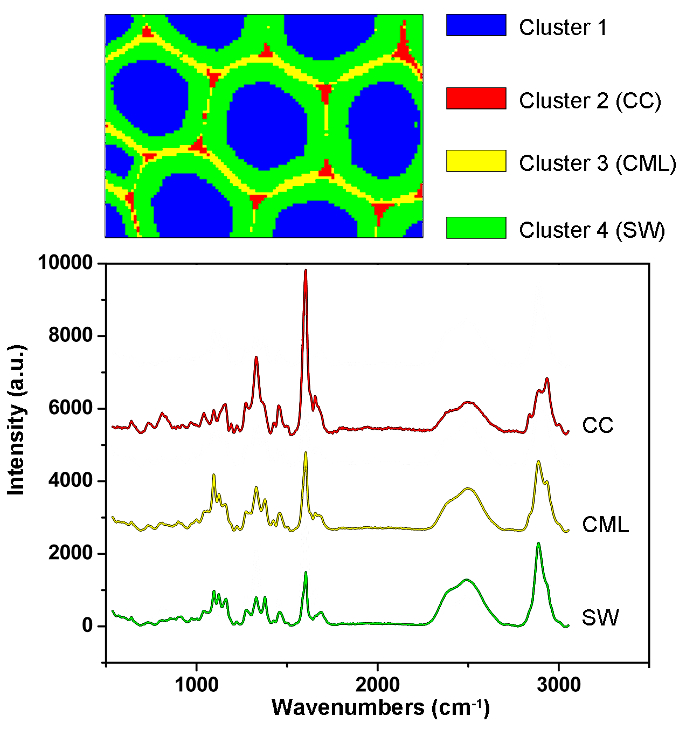
Figura 6: Resultados de Análise PCA e Clustering para Identificação Automática de Diferentes Camadas de Parede Celular no Muro da Cata de Álamo. Usando PCA e análise de agrupamento, os espectros são divididos em quatro partes correspondentes ao lúmen celular, CC, CML e SW. Os espectros médios dessas camadas são dados abaixo. Os resultados revelaram que a lignina é concentrada ao longo da CML e no CC, enquanto os polissacarídeos são concentrados principalmente no SW. Clique aqui para ver uma versão maior desta figura.
| Wavenumbers (cm -1 ) | Componentes | atribuições |
| 1.095 | Celulose, Hemicelulose | Átomo pesado CC e vibração de alongamento de CO |
| 1.123 | Celulose, Hemicelulose | Átomo pesado CC e vibração de alongamento de CO |
| 1.163 | Celulose, Hemicelulose | Átomo pesado CC e vibração de alongamento de CO mais vibração de flexão de HCC e HCO |
| 1.275 | Lignina | Aril-O de aril OH e aril O-CH3; Anel de guaiacil com grupo C = O |
| 1.331 | Lignina, Celulose, Hemicelulose | HCC e HCO flexão vibração |
| 1.378 | Celulose, Hemicelulose | HCC, HCO e vibração de flexão HOC |
| 1.460 | Lignina, Celulose, Hemicelulose | HCH e HOC vibração de flexão |
| 1.603 | Lignina | Anel de arilo vibração de alongamento, vibração simétrica |
| 1.656 | Lignina | Anel conjugado C = C vibração de estiramento de álcool coniferílico; C = O vibração de estiramento de coniferaldeído |
| 2.889 | CH | Vibração de alongamento CH e CH 2 |
| 2,940 | L, C, H | Vibração de alongamento CH em vibração assimétrica OCH 3 |
Tabela 1: Posições máximas de Raman e atribuições de banda
Discussão
A parede celular da planta é um composto que é organizado em várias camadas, incluindo o canto da célula (CC), a parede secundária (SW, com as camadas S1, S2 e S3) e a lamela intermediária composta (LMC, lamela média mais a primária adjacente Parede), o que dificulta a obtenção de uma superfície plana durante a preparação da amostra. Assim, as amostras de plantas, especialmente a grama, que tem uma estrutura mais complicada do que a madeira, muitas vezes precisam ser solidificadas para permitir a separação fina. O PEG é uma matriz rígida ideal para o corte e a investigação Raman, uma vez que é solúvel em água. Pode ser facilmente removido por enxaguamento com água desionizada. O PEG usado para incorporação tem diferentes pesos moleculares, variando de 1.000 a 20.000. Quanto maior o peso molecular do PEG, menor será a capacidade de penetração 10 . D 2 O ajudará a reduzir a fluorescência da lignina e tem um pico marcado a 2.490 cm -1 , mas não eliminará a interferência de fluorescência. DoisOs principais sinais de ruído se espalham para os canais, juntamente com os sinais reais: 1) fluorescência de amostra e de fundo, bem como flutuações térmicas do CCD, podem resultar em derivações de linha de base e 2) os raios cósmicos podem afetar de forma marcante os detectores sensíveis, que se manifestam em Espectros como picos de banda estreita. O método APRI foi desenvolvido para abordar essas questões 11 . A APRI inclui os quadradinhos penalizados (airPLS) e a análise de componentes principais (PCA), adequados e repensados de modo iterativo, para eliminar as derivações basais e os pontos cósmicos usando os próprios recursos espectrales.
Para obter imagens de distribuição, deve-se selecionar a intensidade / integração do pico e a adaptação linear por espectro completo por métodos multivariados. O primeiro é adequado para os componentes com picos Raman específicos ( por exemplo, lignina), enquanto o último é apropriado para os componentes com forte sobreposição espectral ( por exemplo, celulose e hemicelulose). A distribuiçãoAs imagens de lignina e polissacarídeos estão disponíveis integrando os picos específicos em torno de 1.600 cm -1 e 2.889 cm -1 , respectivamente (Figura 4). No entanto, as imagens de celulose e hemicelulose são difíceis de gerar diretamente pela integração do pico devido à forte sobreposição espectral. A análise multivariada permite que o conteúdo de informações enroladas seja ordenado de acordo com a hipótese de que os dados originais são reconstruídos a partir de um número limitado de fatores significativos 12 . Isso pode ser aplicado para discriminar seus espectros e produzir imagens Raman correspondentes. Para amostras de plantas, a presença de extractivos e lignina interfere na capacidade de reconstruir os espectros de celulose e hemicelulose. É necessário remover essas interferências antes da análise SMCR dos dados de imagem. O SMCR foi introduzido pela primeira vez por Lawton e Sylvester como uma técnica multivariada desenvolvida especificamente para resolver um componente puro fRom um conjunto de espectros, sem qualquer recurso a uma biblioteca espectral, para analisar os dados de imagem 13 . A classificação espectral é importante para uma maior compreensão da natureza estrutural e química da parede celular da planta. Aqui, os dados de imagem foram submetidos à análise de componentes principais (PCA) e análise de agrupamento para distinguir os espectros de Raman de diferentes camadas de parede celular 14 .
No entanto, esta técnica tem duas limitações. Primeiro, o efeito Raman é fraco - a seção transversal típica de espalhamento Raman é ~ 10 -29 cm 2 por molécula - o que o torna vulnerável a fluorescência intensa 15 . Uma possível maneira de melhorar o defeito é preparando as seções o mais finamente possível e aplicando um algoritmo de correção de linha de base, mas os sinais fluorescentes são difíceis de remover. Em segundo lugar, o tratamento químico é um procedimento significativo ao alcançar imagens Raman de célulasUlose e hemicelulose, e pode aumentar o risco de alterar o conteúdo químico original. Portanto, é melhor remover os extrativos e a lignina o máximo possível, sem que a estrutura da parede celular seja muito diferente da não tratada.
Em conclusão, este protocolo é adequado para estudar a distribuição de lignina, celulose e hemicelulose dentro da parede celular da planta. Usar a imagem de Raman para obter a informação desejada é altamente dependente da habilidade do operador na preparação da amostra e na análise de dados. A boa preparação da amostra é essencial para coletar espectros Raman de alta qualidade. A análise apropriada de dados fornece informações sobre os espectros de grande escala e extrai a informação escondida da imagem. Como método fundamental, este protocolo pode ser usado para rastrear as mudanças dinâmicas dos principais componentes durante o tratamento químico, físico ou biológico no nível micro.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Ministério da Ciência e Tecnologia da China (2016YDF0600803) o apoio financeiro.
Materiais
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
Referências
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados