Method Article
שילוב ראמאן הדמיה ניתוח רב משתנים לדמיין ליגנין, תאית, ו Hemicellulose בקיר תא צמחים
In This Article
Summary
פרוטוקול זה נועד להציג שיטה כללית לדמיין ליגנין, תאית, hemicellulose בקירות תא הצמח באמצעות הדמיה ראמאן ניתוח רב משתני.
Abstract
היישום של הדמיה ראמאן כדי ביומסה צמח גדל כי זה יכול להציע מידע מרחבי ומלחבי על פתרונות מימיים. הניתוח אינו דורש בדרך כלל הכנת מדגם נרחב; מידע מבניים וכימיים ניתן להשיג ללא תיוג. עם זאת, כל תמונה ראמאן מכיל אלפי ספקטרום; זה מעלה קשיים בעת חילוץ מידע מוסתר, במיוחד עבור רכיבים עם מבנים כימיים דומים. עבודה זו מציגה ניתוח רב משתני כדי לטפל בבעיה זו. הפרוטוקול קובע שיטה כללית לדמיין את המרכיבים העיקריים, כולל ליגנין, תאית, hemicellulose בתוך קיר התא צמחים. בפרוטוקול זה, נהלים להכנת המדגם, רכישה ספקטרלית, ועיבוד נתונים מתוארים. זה תלוי מאוד במיומנות המפעיל על הכנת המדגם וניתוח נתונים. באמצעות גישה זו, חקירה ראמאן יכול להתבצע על ידי משתמש שאינו מומחה לרכוש higנתונים באיכות h ותוצאות משמעותיות עבור ניתוח קיר התא צמחים.
Introduction
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
Protocol
1. הכנה לדוגמא
- לחתוך גוש רקמות קטן (כ 3 מ"מ x 3 מ"מ x 5 מ"מ) מן המדגם צמח ( למשל, גזע צפצפה).
- לטבול את הרקמה במים רותח deionized למשך 30 דקות. מיד להעביר אותו מים deionized בטמפרטורת החדר (RT) במשך 30 דקות. חזור על שלב זה עד שהרקמה שוקעת לתחתית המיכל, דבר המעיד על כך שהאוויר ברקמות הוסר וכי הרקמה התרככה.
הערה: עבור הדגימות כי לשקוע לתחתית לפני שלב זה, בדרך כלל לחזור על מחזור זה 3-5 פעמים. - הכן 20, 50, 70, 90% (V / V) aliquots של פוליאתילן גליקול (PEG) במים deionized, כמו גם PEG טהור, ולשמור על פתרונות ב 65 מעלות צלזיוס.
- דגירה הרקמה בסדרה של אמבטיות PEG מדורגת כדי לתפוס את המים ולאפשר PEG להסתנן.
הערה: בדרך כלל, PEG עם משקל מולקולרי 2,000 (PEG2000) משמש עבור הטבעה.- לעבד את הרקמה עם g(P) 50% PEG עבור 1.5 שעות, (c) 70% PEG עבור 2 שעות, (d) 90% PEG עבור 2 שעות, ו - (ה) 100% PEG למשך 10 שעות.
- טרום חם קלטת על 65 מעלות צלזיוס בתנור. יוצקים את PEG המכיל את הבלוק לתוך הקלטת ולאחר מכן למקם את בלוק רקמות במצב הרצוי באמצעות פינצטה מראש פינצטה או מחטים.
- לאט לאט להתקרר את הקלטת ולאחסן את הרקמה ב RT עד לשימוש.
- לנתח את גוש PEG המכיל את רקמה היעד לתוך גוש קטן (על 1 ס"מ x 1 ס"מ x 2 ס"מ) באמצעות להב סכין חד להרכיב אותו על microtome.
- גזור חלקים רזים של בלוק PEG (בדרך כלל 3-10 מיקרומטר).
- שוטפים את החלק עם מים deionized שעון זכוכית 10 פעמים כדי להסיר את PEG מן הרקמה.
- לטבול את הסעיפים עם טולואן / אתנול (2: 1, V / V) במשך 6 שעות כדי להסיר את extractives. הכן את נוזל התגובה על ידי ערבוב 65 מ"ל של מים deionized, 0.5 מ"ל של חומצה אצטית, ו -0.6 גרם של נתרן chloלטבול בכוס. הוסף סעיף אחד ו 3 מ"ל של נוזל התגובה בקבוקון 5 מ"ל. בורג על החלק העליון של הבקבוקון.
- מחממים את הבקבוקון באמבט מים על 75 מעלות צלזיוס למשך 2 שעות כדי להסיר את הליגנין של הרקמה. שוטפים את החלק עם מים deionized שעון זכוכית 10 פעמים.
- מעבירים את החלק המטופל / delignified לשקופית מיקרוסקופ זכוכית. לפתוח את הקטע בזהירות באמצעות מברשות או מחטים. הסר את המים deionized נוסף עם נייר טישו.
- לטבול את הקטע לתוך D 2 O. לכסות את המדגם עם כיסוי זכוכית להחליק. חותם את כיסוי להחליק עם לק על מנת למנוע את אידוי של D 2 O.
2. רכישת Spectral
- פתח את תוכנת ההפעלה המכשיר של מיקרוסקופ ראמאן confocal. הפעל את הלייזר (אורך גל 532 ננומטר), להתמקד על פני השטח של סיליקון גבישי עם מטרה מיקרוסקופ 100X, ולחץ על כפתור הכיול לכייל את המכשיר.
- הפעל את המכשירלמצב מיקרוסקופ אופטי ולהדליק את מנורת המיקרוסקופ. הר השקופית מיקרוסקופ על הבמה, עם כיסוי להחליק מול המטרה.
- הצג את המדגם עם מטרה מיקרוסקופ 20X ולאתר את האזור של עניין. החל שמן טבילה coverslip ולעבור למיקרוסקופ טבילה המטרה (60X, הצמצם המספרי NA = 1.35). דגש על פני השטח של המדגם.
- החלף את המכשיר למצב בדיקה ראמאן לכבות את מנורת מיקרוסקופ.
- בחר אזור מיפוי באמצעות כלי מלבני. לשנות את גודל צעד כדי לקבוע את מספר הספקטרום שהושג.
הערה: להיות מודעים לגודל צעד (בדרך כלל גדול יותר מאשר קוטר ספוט מחושב על ידי הצמצם המספרי של המטרה, תיאורטית 1.22λ / NA). הגדלים הבאים יגרמו לדגימת יתר. - קבע את הפרמטרים הספקטרליים האופטימליים כדי להשיג את יחס אות לרעש הטוב ביותר (SNR) ואיכות ספקטרלית בזמן רכישה מתאים (בדרך כלל <8 שעות),Nding על ההתאמה המדגם. באופן כללי, הקלט את פרמטרים הדמיה בתוכנת המכשיר כדלקמן: לייזר (532 ננומטר), מסנן (100%), חור (300), חריץ (100), ספקטרומטר (1,840 ס"מ -1 ), חריצים (1200t), אובייקטיבי שמן 60X), וזמן הרכישה (2 שניות).
- שמור את הנתונים ספקטרלי לפני עיבוד נתונים להמיר אותם לפורמט אוניברסלי ( למשל, קבצי TXT).
3. ניתוח נתונים
- טען את הנתונים ספקטרלי (קבצי TXT) לתוך תוכנת ניתוח נתונים ( למשל, Matlab). החלת טכניקת הפחתת רעש על הנתונים להגדיר כדי לשפר את SNR ( למשל, אלגוריתם Savitssky-Golay או אלגוריתם אדוה)
- השתמש בדגימות לא מטופלות כדי לייצר את התמונות של ליגנין ופוליסכרידים. עבור הדמיה ליגנין, שקול את שיא רפאים סביב 1,600 ס"מ -1 בשל טבעת ארומטית סימטרי מתיחה רטט. עבור הדמיה פוליסכריד (כולל תאית hemicellulose), להשתמש שיא רפאים אעגול 2,889 ס"מ -1 בגלל CH ו- CH 2 .
- השתמש דגימות delignified כדי ליצור את התמונות של תאית hemicellulose. בצע רזולוציה עצמית עקומת מודלים (SMCR) על הספקטרום רכשה להפלות את הספקטרום של תאית hemicellulose ולתדמיהם ההפצות.
- ביצוע ניתוח רכיב עיקרי (PCA) וניתוח אשכולות על הנתונים שנרכשו כדי להבדיל בין ספקטרום ראמאן מ שכבות קיר התא השונים.
תוצאות
איור 1 מציג סקירה של מערכת טיפוסי מיקרו ראמאן הדמיה ראמאן של קיר תא צמחים. כדוגמה, ספקטרום ראמאן המקורי של צפצפה ( Populus nigra L.) יש היסודות משמעותיים דוקרנים ( איור 2 א ). לאחר ביצוע שיטת עיבוד אוטומטי מראש עבור נתונים הדמיה ראמאן להגדיר (APRI), אלה שני מזהמים ספקטרליים מוסרים בהצלחה ( איור 2 ב ). ספקטרום ראמאני טיפוסי של צפצפה מוצג באיור 3 , ואת הקצאות הלהקה שלה מופיעים בטבלה 1 . תמונת ראמאן של ליגנין מופק על ידי שילוב של אזור ספקטרלי מ 1,550-1,650 ס"מ -1 , אשר מיוחסת למבנה טבעת ארומטי ( איור 4 א ). איור 4 ד מציג את תמונת ראמאן של סוכרים, WHIch מושגת על ידי שילוב הפסגה ב 2,889 ס"מ -1 . כדי תמונה תאית hemicellulose, SMCR מבוצע על נתוני הדמיה ראמאן מדגם delignified. הספקטרום והתמונות המתאימים מוצגים באיור 5 . איור 6 מציג את התוצאות שהושגו על ידי PCA ו אשכולות ניתוח.

איור 1: סכמטי של הדמיה ראמאן עבור קיר תא הצמח. מדגם חתך (צפצפה כדוגמה) נמדדת על ידי מערכת מיקרו ראמאן כי זוגות מיקרוסקופ אופטי ל ספקטרומטר ברזולוציה גבוהה ראמאן עם גלאי מכשיר מצמידים CCD. בתמונה של שדה בהיר, קיר התא צמח מאורגן בפינה התא (CC), למרכבה באמצע התיכון (CML), וקיר משני (SW). באופן קונבנציונלי, תמונה של ראמאן נוצרת על ידי שיא יחידאינטגרציה או אינטנסיביות. שני מזהמים ספקטרליים ( כלומר, סחיפות בסיסיות ודוקרנים קוסמיים) נמצאים בנתונים המקוריים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
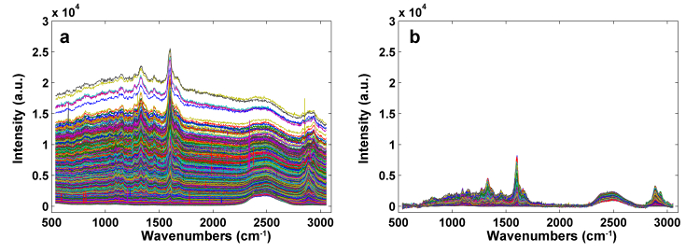
איור 2: ספקטרה ראמאן לפני ( א ) ואחרי ( ב ) עיבוד מראש על ידי APRI. שני מזהמים ספקטרליים מוסרים בהצלחה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
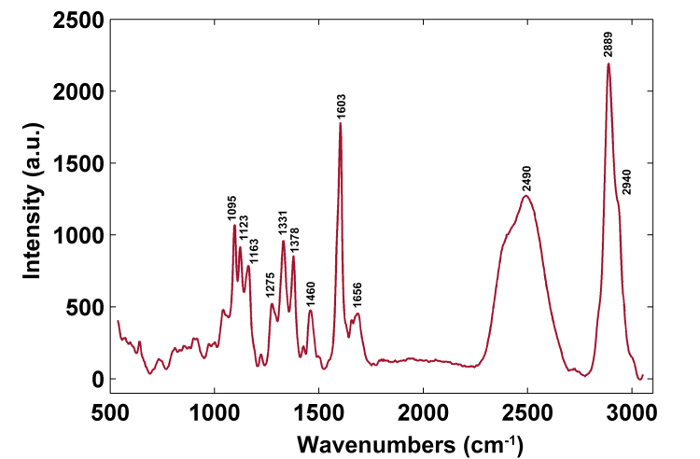
איור 3: ספקטרום ראמאן טיפוסי של קיר תא צפצפה. ספקטרום ראמאן טיפוסי הוא מהקיר המשני. הקצאות הלהקה מוצגות בטבלה 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
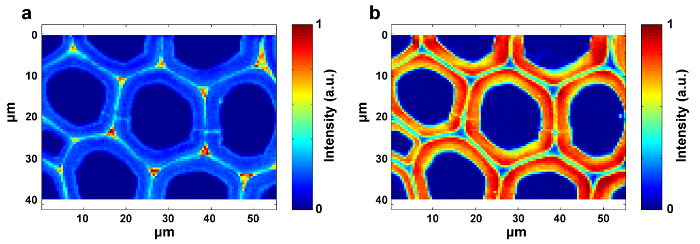
איור 4: תמונות ראמאן של ליגנין ( א ) ו סוכרים ( ב ) בתוך החומה תא צפצפה. התמונה ליגנין נוצר על ידי שילוב הפסגה בסביבות 1,600 ס"מ -1 . התמונה polysaccharide מיוצר על ידי שילוב השיא סביב 2,889 ס"מ -1 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: תמונות ראמאן של תאית ( א ) ו Hemicellulose ( ב ) בתוך החומה התא צפצפה. SMCR מבוצע על נתוני הדמיה ראמאן מדגם delignified. זיוף תורם לחשיפה של המאפיינים הספקטראליים של תאית והמיסלולוזה. תאית מרוכזת בעיקר ב SW, בעוד ההפצה של hemicellulose הוא כמעט אחיד לאורך כל התא צפצפה הקיר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
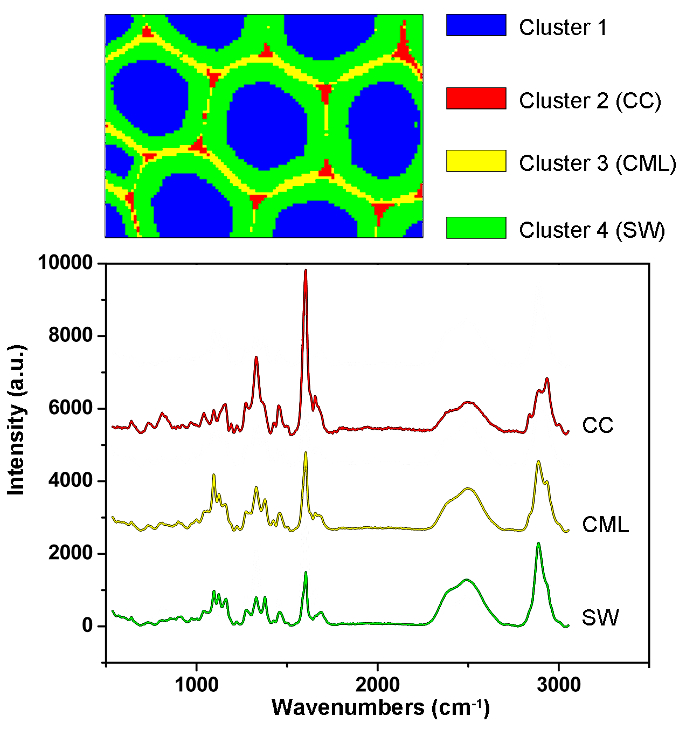
איור 6: PCA ו Clustering ניתוח תוצאות עבור זיהוי אוטומטי של תאים שונים תא קיר בקיר תא צפצפה. באמצעות PCA וניתוח אשכולות, הספקטרה מחולקים ארבעה חלקים המקביל לומן התא, CC, CML ו SW. הספקטרום הממוצע של שכבות אלה ניתנים להלן. התוצאות הראו כי ליגנין מרוכז לאורך CML ב CC, בעוד פוליסכרידים מרוכזים בעיקר SW. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| Wavenumbers (ס"מ -1 ) | רכיבים | משימות |
| 1,095 | תאית, Hemicellulose | אטום כבד CC ו- CO מתיחה רטט |
| 1,123 | תאית, Hemicellulose | אטום כבד CC ו- CO מתיחה רטט |
| 1,163 | תאית, Hemicellulose | אטום כבד CC ו- CO מתיחה רטט פלוס HCC ו HCO כיפוף רטט |
| 1,275 | עֵצָן | Aryl-O של אריל OH ו אריל O-CH3; טבעת guaiacyl עם C = O קבוצה |
| 1,331 | ליגנין, תאית, Hemicellulose | HCC ו HCO כיפוף רטט |
| 1,378 | תאית, Hemicellulose | HCC, HCO, ו HOC כיפוף רטט |
| 1,460 | ליגנין, תאית, Hemicellulose | HCH ו HOC רטט רטט |
| 1,603 | עֵצָן | אריה טבעת מתיחה רטט, רטט סימטרי |
| 1,656 | עֵצָן | טבעת מצופה C = C הרטט מתיחה של אלכוהול coniferyl; C = O מתיחות רטט של coniferaldehyde |
| 2,889 | C, H | CH ו CH 2 רטט מתיחה |
| 2,940 | L, C, H | CH רטט מתיחה OCH 3 רטט אסימטרי |
טבלה 1: תפקידי רמאן
Discussion
קיר תא הצמח הוא מורכב כי מאורגן למספר שכבות, כולל פינת התא (CC), הקיר המשני (SW, עם S1, S2, ו S3 שכבות), ו lamella תרכובת באמצע (CML, lamella באמצע בתוספת העיקרי יסודי קיר), אשר מקשה להשיג משטח שטוח במהלך הכנת המדגם. לפיכך, דגימות צמח, במיוחד הדשא, אשר יש מבנה מסובך יותר מאשר עץ, לעתים קרובות צריך להיות מוצק כדי לאפשר חתך בסדר. PEG הוא מטריצה קשה אידיאלי לחיתוך החקירה ראמאן, שכן הוא מסיס במים. זה ניתן להסיר בקלות על ידי שטיפה במים deionized. PEG המשמש להטבעה יש משקולות מולקולריות שונות, המשתנה מ 1,000-20,000. ככל שהמשקל המולקולרי של ה- PEG גבוה יותר, כך יכולת החדירה נמוכה יותר. D 2 O יעזור להפחית את הקרינה של ליגנין ויש לו שיא ניכרת ב 2,490 ס"מ -1 , אבל זה לא יבטל את ההפרעה הקרינה. שתייםאותות רעש גדולים נשפכים לערוצים, יחד עם האותות בפועל: 1) מדגם רקע הקרינה, כמו גם תנודות תרמיות של CCD, יכול לגרום לנסיפות הבסיס ו 2) קרניים קוסמיות יכול להשפיע באופן משמעותי על גלאים רגישים, אשר לידי ביטוי ב ספקטרום כמו קוצים רוחב פס צר. השיטה APRI פותחה כדי לטפל בבעיות אלה 11 . APRI כולל את ההסתגלות המתוקננת מחדש של ריבועים פחותים (airplS), וניתוח הרכיב העיקרי (PCA), במטרה למנוע את היסודות הבסיסיים ואת הקוצים הקוסמיים באמצעות התכונות הספקטראליות עצמם.
כדי להשיג תמונות הפצה, אינטנסיביות שיא / אינטגרציה שלמה ספקטרה ליניארי מתאים בשיטות רב משתנים יש לבחור. הראשון מתאים לרכיבים עם פסגות ראמאן ספציפיות ( למשל, ליגנין), בעוד האחרון מתאים לרכיבים עם חפיפה ספקטרלית חזקה ( למשל תאית hemicellulose). הדיסטריתמונות bution של ליגנין סוכרים זמינים על ידי שילוב פסגות ספציפיות סביב 1,600 ס"מ -1 ו -2,889 ס"מ -1 , בהתאמה (איור 4). עם זאת, התמונות של תאית hemicellulose קשה ליצור ישירות על ידי אינטגרציה שיא בשל חפיפה ספקטרלית חזקה. ניתוח רב משתני מאפשר למיין את תוכן המידע המפותל על פי ההשערה כי הנתונים המקוריים משוחזרים ממספר מצומצם של גורמים משמעותיים 12 . כך ניתן ליישם כדי להפלות את הספקטרום שלהם לייצר תמונות המקביל ראמאן. עבור דגימות צמחים, נוכחות של extractives ו lignin מפריע ליכולת לשחזר את הספקטרום של תאית hemicellulose. יש צורך להסיר הפרעות אלה לפני ניתוח SMCR של נתוני הדמיה. SMCR הוצג לראשונה על ידי לוטון וסילבסטר כטכניקה רב משתנית שפותחה במיוחד לפתרון רכיב טהורROM סט של ספקטרום, ללא כל חזרה לספריה ספקטרלית, לנתח את נתוני הדמיה 13 . סיווג ספקטרלי חשוב להבנה נוספת של הטבע המבני והכימי של קיר התא צמחים. כאן, הנתונים הדמיה כבר נתון ניתוח רכיב ראשי (PCA) ו אשכולות ניתוח להבחין ספקטרום ראמאן משכבות קיר תאים שונים 14 .
עם זאת, טכניקה זו יש שתי מגבלות. ראשית, אפקט ראמאן חלש - סך הכל ראמאן פיזור חתך רוחב הוא ~ 10 -29 ס"מ 2 לכל מולקולה, מה שהופך אותו פגיע לקרינה אינטנסיבית 15 . דרך אפשרית לשפר את הפגם היא על ידי הכנת החלקים בצורה דקה ככל האפשר וליישום אלגוריתם תיקון הבסיס, אך קשה להסיר אותות ניאון. שנית, טיפול כימי הוא הליך משמעותי בעת השגת תמונות ראמאן של התאUlose ו hemicellulose, וזה עלול להגביר את הסיכון של שינוי התוכן הכימי המקורי. לכן, עדיף להסיר את extractives ו lignin ככל האפשר, ללא מבנה קיר התא נראה שונה מדי מן המטופל.
לסיכום, פרוטוקול זה מתאים ללמוד את התפלגות ליגנין, תאית, hemicellulose בתוך קיר התא המפעל. באמצעות הדמיה ראמאן כדי לקבל את המידע הרצוי תלויה מאוד במיומנות המפעיל על הכנת המדגם וניתוח נתונים. הכנה מדגם טוב הוא חיוני כדי לאסוף ספקטרום ראמאן באיכות גבוהה. ניתוח נתונים מתאים מספק תובנות לתוך ספקטרה בקנה מידה גדול, מחלץ את המידע הנסתר מן התמונה. כשיטה בסיסית, פרוטוקול זה יכול לשמש כדי לעקוב אחר השינויים הדינמיים של מרכיבים מרכזיים במהלך טיפול כימי, פיזי או ביולוגי ברמת המיקרו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים למשרד המדע והטכנולוגיה של סין (2016YDF0600803) על התמיכה הכספית.
Materials
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
References
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved