Method Article
ラマンイメージングと多変量解析を組み合わせて、植物細胞壁のリグニン、セルロース、およびヘミセルロースを視覚化する
要約
このプロトコルは、ラマンイメージングおよび多変量解析を用いて、植物細胞壁のリグニン、セルロースおよびヘミセルロースを視覚化するための一般的な方法を提示することを目的とする。
要約
プラントバイオマスへのラマンイメージングの適用は、水溶液について空間的および組成的情報を提供することができるので、増加している。分析には通常、大量の試料調製は必要ありません。ラベルを付けることなく構造的および化学的情報を得ることができる。しかしながら、各ラマン像は数千のスペクトルを含む。これは、特に類似の化学構造を有する構成要素について、隠された情報を抽出する際に困難を生じさせる。この研究では、この問題に対処するために多変量解析を導入しています。このプロトコルは、植物細胞壁内のリグニン、セルロースおよびヘミセルロースを含む主成分を視覚化するための一般的な方法を確立する。このプロトコールでは、試料調製、スペクトル取得、およびデータ処理のための手順が記載されている。これは、試料調製およびデータ分析における操作者の技能に大きく依存する。このアプローチを使用することにより、非専門家によるラマン調査を行い、HIを得ることができる植物細胞壁分析のための高品質データおよび有意な結果を提供する。
概要
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
プロトコル
サンプル調製
- 植物サンプル( 例えば、ポプラステム)から小さな組織ブロック(約3mm×3mm×5mm)を切断する。
- 組織を沸騰している脱イオン水に30分間浸します。直ちに室温(RT)で30分間脱イオン水に移す。組織が容器の底に沈み、組織の空気が除去され、組織が軟化したことを示すまで、このステップを繰り返します。
注:このステップの前に下に沈むサンプルについては、このサイクルを一般に3〜5回繰り返す。 - 純粋なPEGと同様に、脱イオン水中のポリエチレングリコール(PEG)の20,50,70,90%(v / v)アリコートを調製し、溶液を65℃に保つ。
- 組織を一連の勾配付きPEG浴中でインキュベートして、水を置換し、PEGが浸潤するのを可能にする。
注:典型的には、分子量2000(PEG2000)を有するPEGが包埋に使用される。- 組織をgで処理する(a)20%PEGを1時間、(b)50%PEGを1.5時間、(c)70%PEGを2時間、(d)90%PEGを2時間、および(e)10時間100%PEG。
- カセットをオーブンで65℃に予熱します。ブロックを含むPEGをカセットに注ぎ、予め温めたピンセットまたは針を用いて組織ブロックを所望の位置に配置する。
- ゆっくりとカセットを冷却し、使用するまでRTで組織を保存する。
- シャープなカミソリの刃を使用して、標的組織を含むPEGブロックを小さなブロック(約1cm×1cm×2cm)に解剖し、ミクロトームにマウントする。
- PEGブロックから薄い切片を切り取ります(通常3〜10μm)。
- 組織からPEGを除去するために、切片を10倍の時計ガラス中の脱イオン水ですすぐ。
- セクションをトルエン/エタノール(2:1、v / v)で6時間浸して抽出物を除去する。 65mLの脱イオン水、0.5mLの酢酸、および0.6gのナトリウム塩を混合することによって反応液を調製するビーカーで儀式する。 1mLの反応液と3mLの反応液を5mLバイアルに加えます。バイアルの上にネジ止めします。
- バイアルを75℃の水浴中で2時間加熱し、組織のリグニンを除去する。ウォッシャーグラスで脱イオン水で10回洗浄します。
- 未処理/脱リグニンされた切片をガラス顕微鏡スライドに移す。ブラシや針で注意深くセクションを展開します。ティッシュペーパーで余分な脱イオン水を除去する。
- セクションをD 2 Oに浸します。ガラスカバースリップでサンプルを覆います。カバースリップをマニキュアでシールして、D 2 Oの蒸発を防ぎます。
2.スペクトル取得
- 共焦点ラマン顕微鏡の機器操作ソフトウェアを開く。レーザー(波長= 532nm)をオンにし、100倍の顕微鏡対物レンズで結晶シリコンの表面に焦点を合わせ、較正ボタンをクリックして機器を較正します。
- 楽器を切り替える光学顕微鏡モードに切り替え、顕微鏡ランプを点灯させる。ステージ上に顕微鏡スライドをマウントし、カバースリップを対物レンズに向けます。
- サンプルを20倍の顕微鏡対物レンズで見て、関心領域を探します。カバーガラスに浸漬オイルを塗布し、液浸顕微鏡の対物レンズ(60X、開口数NA = 1.35)に切り替えます。サンプルの表面に焦点を合わせます。
- 装置をラマン試験モードに切り替え、顕微鏡のランプをオフにします。
- 長方形のツールを使用してマッピング領域を選択します。ステップサイズを変更して、得られたスペクトルの数を決定する。
注:ステップサイズに注意してください(通常、対物レンズの開口数で計算されるスポット直径よりも大きく、理論上は1.22λ/ NAです)。これを下回るとオーバサンプリングが発生します。 - 最適なスペクトルパラメータを設定して、最適な信号対雑音比(SNR)とスペクトル品質を適切な取得時間(通常8時間未満)サンプルの適合性に注意してください。一般に、レーザー(532nm)、フィルター(100%)、穴(300)、スリット(100)、分光計(1,840cm -1 )、溝(1200t)、対物レンズ60Xオイル)、および獲得時間(2秒)。
- データ処理の前にスペクトルデータを保存し、ユニバーサルフォーマット( 例えば、 TXTファイル)に変換する。
3.データ分析
- スペクトル解析データ(TXTファイル)をデータ解析ソフトウェア(Matlabなど)にロードします。データセットにノイズ低減技術を適用してSNRを改善する(Savitzsky-Golayアルゴリズムやウェーブレットアルゴリズムなど)
- 未処理サンプルを使用して、リグニンおよび多糖の画像を生成する。リグニンイメージングでは、芳香環の対称伸縮振動に起因する1600cm -1付近のスペクトルピークを考慮する。多糖イメージング(セルロースおよびヘミセルロースを含む)については、スペクトルピークaCHおよびCH 2の伸張のために2,889cm -1に丸まった。
- 脱リグニンされたサンプルを使用して、セルロースおよびヘミセルロースの画像を生成する。得られたスペクトルに対してセルフモデリングカーブ分解能(SMCR)を実行して、セルロースおよびヘミセルロースのスペクトルを識別し、それらの分布を画像化する。
- 得られたデータに対して主成分分析(PCA)およびクラスタリング分析を行い、異なる細胞壁層からラマンスペクトルを区別する。
結果
図1は、植物細胞壁のラマンイメージングのための典型的なマイクロラマンシステムの概要を示す。一例として、ポプラ( Populus nigra L.)の元のラマンスペクトルは、有意なベースラインドリフトおよびスパイクを有する( 図2a )。ラマンイメージングデータセット(APRI)の自動前処理方法を実行した後、これら2つのスペクトル汚染物質は首尾よく除去される( 図2b )。ポプラの典型的なラマンスペクトルを図3に示し、そのバンド割り当てを表1に示す 。リグニンのラマン像は、芳香環構造( 図4a )に起因する1550-1,650cm -1のスペクトル領域の積分によって生成される。 図4dは、多糖類のラマン画像、whピークは2,889cm -1に積分することによって達成される。セルロースおよびヘミセルロースをイメージングするために、脱リグニンされたサンプルのラマンイメージングデータに対してSMCRが実施される。対応するスペクトルおよび画像を図5に示す。 図6は、PCAおよびクラスタリング分析によって達成された結果を示す。

図1:植物細胞壁のラマンイメージングの概略図。断面試料(一例としてポプラ)は、電荷結合素子(CCD)検出器を備えたラマン高分解能分光計に光学顕微鏡を結合するマイクロラマンシステムによって測定される。明視野画像では、細胞壁は細胞コーナー(CC)、化合物中層(CML)、および二次壁(SW)に組織化される。従来、単一ピークによってラマン像が生成されている統合または強度。元のデータには、 2つのスペクトル汚染物質( すなわち、ベースラインドリフトおよび宇宙スパイク)が見出される。 この図の拡大版を見るには、ここをクリックしてください。
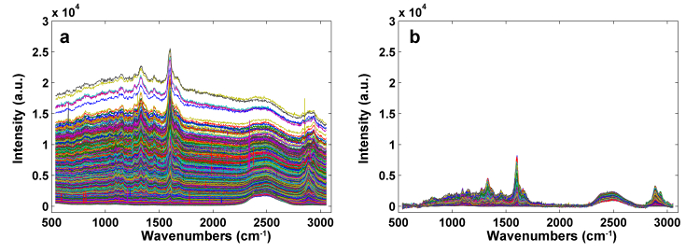
図2: APRIによる前処理( a )および後処理( b )の前処理ラマンスペクトル。 2つのスペクトル汚染物質が首尾よく除去される。 この図の拡大版を見るには、ここをクリックしてください。
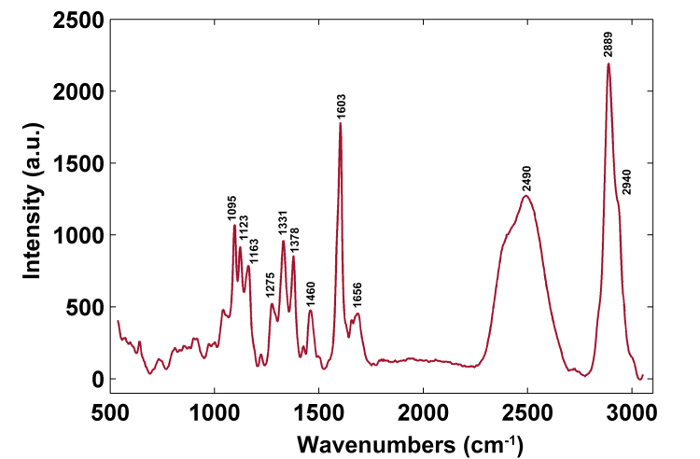
図3:ポプラセル壁の典型的なラマンスペクトル。 この図の拡大版を見るには、ここをクリックしてください。
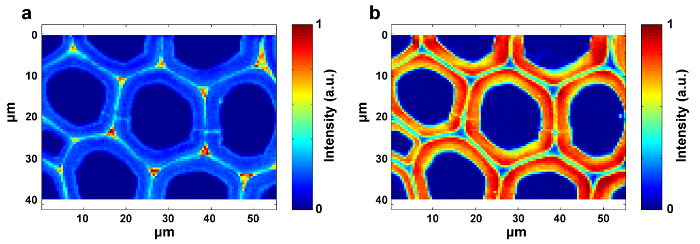
図4:ポプラ細胞壁内のリグニン( a )および多糖( b )のラマン画像。リグニン画像は、1600cm -1付近にピークを積分することによって生成される。多糖類画像は、約2,889cm -1のピークを積分することによって生成される。 この図の拡大版を見るには、ここをクリックしてください。

図5:ポプラ細胞壁内のセルロース( a )およびヘミセルロース( b )のラマン画像。 SMCRは、脱リグニンされたサンプルのラマンイメージングデータに対して実行される。脱リグニンは、セルロースおよびヘミセルロースのスペクトル特性の暴露に寄与する。セルロースは主にSWに集中しているが、ヘミセルロースの分布はポプラ細胞壁全体でほぼ均一である。 この図の拡大版を見るには、ここをクリックしてください。
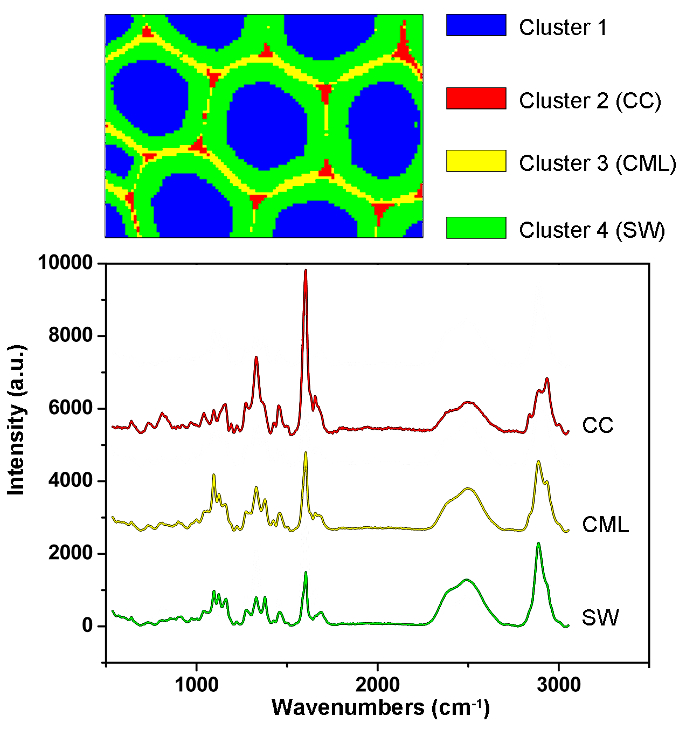
図6:ポプラセル壁の異なる細胞壁層を自動的に同定するためのPCAおよびクラスタリング分析結果。 PCAおよびクラスタリング分析では、スペクトルは、細胞管腔、CC、CMLおよびSWに対応する4つの部分に分けられる。これらの層の平均スペクトルを以下に示す。その結果、リグニンはCMLおよびCCに沿って濃縮され、多糖類はSWに集中していることが明らかになった。 この図の拡大版を見るには、ここをクリックしてください。
| 波数(cm -1 ) | コンポーネント | 割り当て |
| 1,095 | セルロース、ヘミセルロース | 重原子CCおよびCO伸縮振動 |
| 1,123 | セルロース、ヘミセルロース | 重原子CCおよびCO伸縮振動 |
| 1,163 | セルロース、ヘミセルロース/ td> | 重原子CCおよびCO伸縮振動プラスHCCおよびHCO屈曲振動 |
| 1,275 | リグニン | アリールOHおよびアリールO-CH 3のアリール-O; C = O基を有するグアヤシル環 |
| 1,331 | リグニン、セルロース、ヘミセルロース | HCCおよびHCO曲げ振動 |
| 1,378 | セルロース、ヘミセルロース | HCC、HCO、HOC曲げ振動 |
| 1,460 | リグニン、セルロース、ヘミセルロース | HCHおよびHOC曲げ振動 |
| 1,603 | リグニン | アリールリング伸縮振動、対称振動 |
| 1,656 | リグニン | コニフェリルアルコールのC = C伸縮振動。コニフェラルアルデヒドのC = O伸縮振動 |
| 2,889 | C、H | CHおよびCH 2伸縮振動 |
| 2,940 | L、C、H | OCH 3非対称振動におけるCH伸縮振動 |
表1: ラマンピーク位置とバンド割り当て
ディスカッション
植物細胞壁は、細胞コーナー(CC)、二次壁(S1、S2、およびS3層を有するSW)および化合物中間薄層(CML、中間薄層および隣接する一次層)を含むいくつかの層に組織化された複合体である壁面)であり、試料調製中に平坦な表面を得ることが困難になる。したがって、木材より複雑な構造を有する植物サンプル、特に草は、しばしば細かい切片化を可能にするために凝固する必要がある。 PEGは、水に可溶であるため、切断およびラマン検査のための理想的な硬質マトリックスである。これは、脱イオン水ですすぐことによって容易に除去することができる。包埋に使用されるPEGは、1,000~20,000の異なる分子量を有する。 PEGの分子量が高いほど浸透能力は低い10 。 D 2 Oは、リグニンの蛍光を減少させるのに役立ち、2,490cm -1に顕著なピークを有するが、蛍光干渉を排除しない。二1)サンプルとバックグラウンドの蛍光とCCDの熱変動がベースラインドリフトを引き起こす可能性があり、2)宇宙線が感度の高い検出器に著しい影響を与える可能性があります。狭帯域幅のスパイクとしてのスペクトル。これらの問題に対処するためにAPRI法が開発された11 。 APRIには、スペクトル特性自体を使用してベースラインドリフトおよび宇宙スパイクを除去するために、反復的に再加重されるペナルティド最小二乗(airPLS)および主成分分析(PCA)が含まれています。
分布画像を得るために、多変量法によるピーク強度/積分および全スペクトル直線適合を選択する必要があります。前者は、特定のラマンピーク( 例えば、リグニン)を有する成分に適しているが、後者は、強いスペクトルオーバーラップ( 例えば、セルロースおよびヘミセルロース)を有する成分に適している。ディストリビューションリグニンと多糖類のブチオンイメージは、それぞれ1600 cm -1と2,889 cm -1付近の特定のピークを積分することで得られます(図4)。しかし、セルロースおよびヘミセルロースの画像は、強いスペクトルの重なりのためにピーク積分によって直接生成することが困難である。多変量解析では、元のデータが限られた数の重要な要因から再構築されるという仮説に従って畳み込まれた情報コンテンツをソートすることができる。したがって、それらのスペクトルを識別し、対応するラマン画像を生成するために適用することができる。植物試料について、抽出物およびリグニンの存在は、セルロースおよびヘミセルロースのスペクトルを再構成する能力を妨げる。イメージングデータのSMCR分析の前に、これらの干渉を除去することが必要である。 SMCRはLawtonとSylvesterによって、純粋な成分fを分解するために特別に開発された多変量解析手法として最初に導入されましたスペクトルライブラリに頼ることなく、一連のスペクトルを用いて、画像データ13を分析する。スペクトル分類は、植物細胞壁の構造的および化学的性質をさらに理解するために重要である。ここで、撮像データは、異なる細胞壁層14からのラマンスペクトルを区別するために、主成分分析(PCA)およびクラスタリング分析を受けた。
しかし、この手法には2つの限界があります。第1に、ラマン効果は弱い - 典型的な全ラマン散乱断面積は1分子当たり約10 -29 cm 2であり 、強い蛍光に弱い。欠陥を改善する可能性のある方法は、セクションを可能な限り薄く準備し、ベースライン補正アルゴリズムを適用することですが、蛍光シグナルを除去することは困難です。第2に、化学処理は、細胞のラマン像を達成する際に重要な手順であるそれは元の化学物質の含有量を変更するリスクを増大させる可能性があります。したがって、細胞壁構造が未処理のものと大きく異なって見えることなく、抽出物およびリグニンを可能な限り除去することが最善である。
結論として、このプロトコールは植物細胞壁内のリグニン、セルロースおよびヘミセルロースの分布を研究するのに適している。所望の情報を得るためにラマンイメージングを使用することは、試料調製およびデータ分析における操作者の技能に大きく依存する。高品質のラマンスペクトルを収集するには、良好なサンプルの準備が不可欠です。適切なデータ分析は、大規模なスペクトルへの洞察を提供し、画像から隠された情報を抽出する。基本的な方法として、このプロトコルは、ミクロレベルでの化学的、物理的または生物学的処理中の主要成分の動的変化を追跡するために使用することができる。
開示事項
著者は何も開示することはない。
謝辞
私たちは財政的支援のために中国科学技術省(2016YDF0600803)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
参考文献
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved