Method Article
结合拉曼成像和多变量分析可视化植物细胞壁中的木质素,纤维素和半纤维素
摘要
该方案旨在提出使用拉曼成像和多变量分析在植物细胞壁中可视化木质素,纤维素和半纤维素的一般方法。
摘要
拉曼成像对植物生物量的应用正在增加,因为它可以提供水溶液的空间和组成信息。分析通常不需要大量样品制备;结构和化学信息可以在没有标记的情况下获得。然而,每个拉曼图像包含数千个光谱;这在提取隐藏信息时尤其是具有类似化学结构的组件提出了困难。这项工作引入了一个多变量分析来解决这个问题。该方案建立了可视化植物细胞壁内主要成分(包括木质素,纤维素和半纤维素)的一般方法。在该协议中,描述了样品制备,光谱采集和数据处理的过程。它在样品制备和数据分析方面高度依赖操作员的技能。通过使用这种方法,可以由非专业用户执行拉曼调查以获得high质量数据和植物细胞壁分析的有意义的结果。
引言
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
研究方案
样品制备
- 从植物样品( 例如,杨树茎)切下一个小的组织块(约3 mm x 3 mm x 5 mm)。
- 将组织浸入沸腾的去离子水中30分钟。立即将其在室温(RT)下转移到去离子水中30分钟。重复此步骤,直到组织沉入容器的底部,表明组织中的空气已经被去除并且组织已经软化。
注意:对于在此步骤之前沉入底部的样品,通常重复此循环3-5次。 - 在去离子水中制备20,50,70,90%(v / v)等分的聚乙二醇(PEG),以及纯PEG,并将溶液保持在65℃。
- 在一系列分级的PEG浴中孵育组织以置换水并允许PEG渗透。
注意:通常,分子量为2,000(PEG2000)的PEG用于嵌入。- 用g处理组织如下:(a)20%PEG 1小时,(b)50%PEG 1.5小时,(c)70%PEG 2小时,(d)90%PEG 2小时,和(e)100%PEG 10小时。
- 在烤箱中预热65℃的盒子。将含有块的PEG倒入盒中,然后使用预热的镊子或针将组织块放置在所需位置。
- 慢慢冷却盒子并将组织储存在室温下直至使用。
- 使用锋利的剃须刀将含有目标组织的PEG块解剖成小块(约1cm×1cm×2cm),并将其安装在切片机上。
- 从PEG块切割薄片(通常为3-10μm)。
- 用手表玻璃中的去离子水冲洗该部分10次以从组织中去除PEG。
- 将各部分用甲苯/乙醇(2:1,v / v)浸泡6小时以除去提取物。通过混合65mL去离子水,0.5mL乙酸和0.6g氯化钠来制备反应液在烧杯中举行仪式将一个部分和3 mL反应液加入到5 mL小瓶中。拧上小瓶的顶部。
- 将小瓶在75℃的水浴中加热2小时以除去组织的木质素。用去离子水冲洗表面10次。
- 将未处理/脱木质部分转移到玻璃显微镜载玻片上。用刷子或针头小心地打开部分。用薄纸去除额外的去离子水。
- 将部分浸入D 2 O.用玻璃盖板盖住样品。用指甲油密封盖子,防止D 2 O蒸发。
光谱采集
- 打开共焦拉曼显微镜的仪器操作软件。打开激光(波长= 532 nm),用100X显微镜物镜聚焦在晶体硅的表面,然后单击校准按钮校准仪器。
- 切换仪器到光学显微镜模式并打开显微镜灯。将显微镜载玻片放在舞台上,盖子面对物镜。
- 使用20X显微镜物镜查看样品,并找到感兴趣的区域。将浸油涂抹于盖玻片上并切换到浸没式显微镜物镜(60X,数值孔径NA = 1.35)。专注于样品表面。
- 将仪器切换到拉曼测试模式,然后关闭显微镜灯。
- 使用矩形工具选择一个映射区域。改变步长以确定获得的光谱数。
注意:注意步长(通常大于由物镜的数值孔径计算的光点直径;理论上大于1.22λ/ NA)。以下尺寸将导致过采样。 - 设置最佳光谱参数,以在适当的采集时间(通常<8 h)获得最佳信噪比(SNR)和光谱质量,了解样品适用性。通常,在仪器软件中输入激光(532 nm),滤光片(100%),孔(300),狭缝(100),光谱仪(1,840 cm -1 ),凹槽(1200t),物镜60X油),采集时间(2 s)。
- 在数据处理之前保存光谱数据,并将其转换为通用格式( 例如, TXT文件)。
3.数据分析
- 将光谱数据(TXT文件)加载到数据分析软件( 例如 Matlab)中。在数据集上应用降噪技术来提高SNR( 例如, Savitzsky-Golay算法或小波算法)
- 使用未处理的样品产生木质素和多糖的图像。对于木质素成像,由于芳环对称伸缩振动,考虑1,600cm -1附近的光谱峰。对于多糖成像(包括纤维素和半纤维素),使用光谱峰a圆2,889厘米-1 ,因为CH和CH 2伸展。
- 使用脱木素样品产生纤维素和半纤维素的图像。对获取的光谱进行自我建模曲线分辨率(SMCR),以区分纤维素和半纤维素的光谱并对其分布进行成像。
- 对获取的数据进行主成分分析(PCA)和聚类分析,以区分不同细胞壁层的拉曼光谱。
结果
图1给出了用于植物细胞壁的拉曼成像的典型的微拉曼系统的概述。例如,杨树( Populus nigra L.)的原始拉曼光谱具有显着的基线漂移和峰值( 图2a )。在执行拉曼成像数据集(APRI)的自动预处理方法之后,这两个光谱污染物被成功地去除( 图2b )。 图3中显示了杨树的典型拉曼光谱,其波段分配列于表1 。木质素的拉曼图像通过归结于芳环结构的1,550-1,650cm -1的光谱区域的积分而产生( 图4a )。 图4d显示了多糖的拉曼图像,通过在2,889cm -1处整合峰来实现。为了成像纤维素和半纤维素,对脱木素样品的拉曼成像数据进行SMCR。相应的光谱和图像如图5所示 。 图6显示了PCA和聚类分析实现的结果。

图1:植物细胞壁拉曼成像示意图。横截面样品(杨树为例)用微拉曼系统测量,该微拉曼系统将光学显微镜与电荷耦合器件(CCD)检测器耦合到拉曼高分辨率光谱仪。在明场图像中,植物细胞壁被组织成细胞角(CC),复合中层(CML)和次生壁(SW)。通常,单峰产生拉曼图像整合或强度。在原始数据中找到两个光谱污染物( 即基线漂移和宇宙峰值)。 请点击此处查看此图的较大版本。
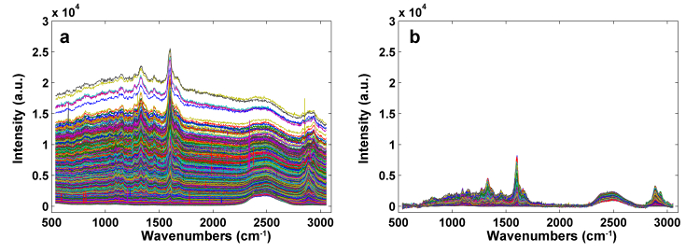
图2: APRI预处理之前( a )和之后( b )的拉曼光谱。两个光谱污染物被成功地去除。 请点击此处查看此图的较大版本。
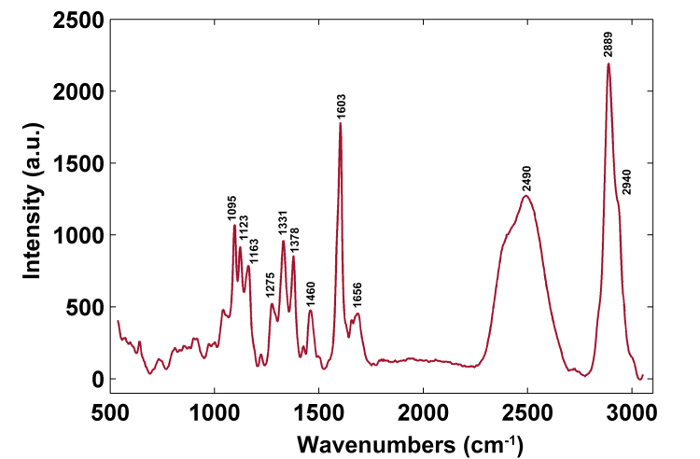
图3:杨树细胞壁的典型拉曼光谱。 请点击此处查看此图的较大版本。
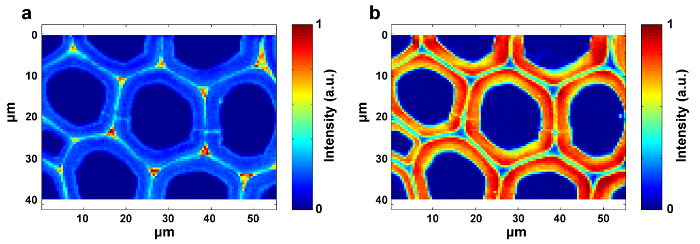
图4:杨树细胞壁内的木质素( a )和多糖( b )的拉曼图像。木质素图像通过将峰值整合在1,600cm -1附近而产生 。多糖图像通过将峰值约2,889cm -1积分而产生。 请点击此处查看此图的较大版本。

图5:杨树细胞壁中纤维素( a )和半纤维素( b )的拉曼图像。对脱木素样品的拉曼成像数据进行SMCR。脱木质素有助于暴露纤维素和半纤维素的光谱特征。纤维素主要集中在SW中,而半纤维素的分布在整个白杨细胞壁中几乎是均匀的。 请点击此处查看此图的较大版本。
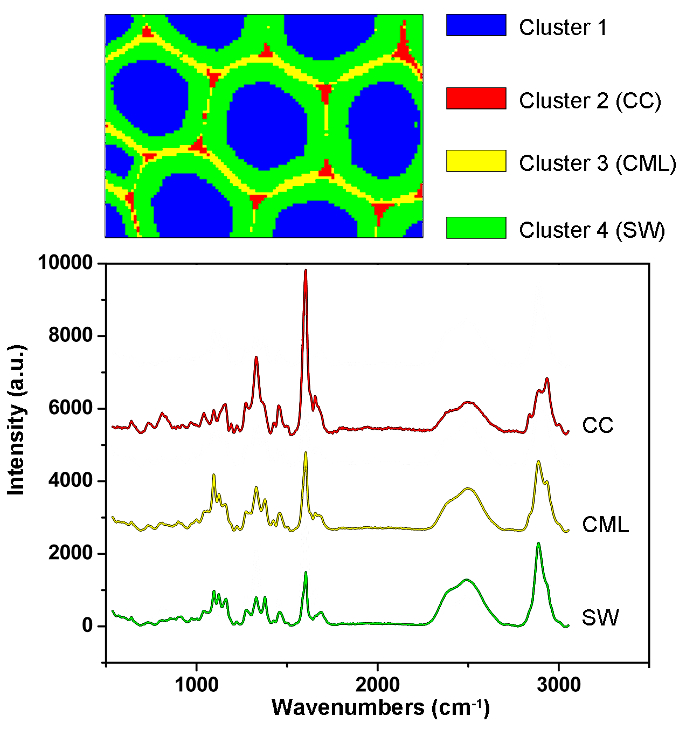
图6:用于自动识别杨树细胞壁中不同细胞壁层的PCA和聚类分析结果。通过使用PCA和聚类分析,将光谱分为对应于细胞腔,CC,CML和SW的四个部分。这些层的平均光谱如下。结果表明,木质素沿着CML和CC浓缩,而多糖主要集中在SW中。 请点击此处查看此图的较大版本。
| 波数(cm -1 ) | 组件 | 分配 |
| 1095 | 纤维素,半纤维素 | 重原子CC和CO伸缩振动 |
| 1123 | 纤维素,半纤维素 | 重原子CC和CO伸缩振动 |
| 1163 | 纤维素,半纤维素/ TD> | 重原子CC和CO伸缩振动加HCC和HCO弯曲振动 |
| 1275 | 木质素 | 芳基OH和芳基O-CH3的芳基-O;愈创木酚环C = O组 |
| 1331 | 木质素,纤维素,半纤维素 | HCC和HCO弯曲振动 |
| 1378 | 纤维素,半纤维素 | HCC,HCO和HOC弯曲振动 |
| 1460 | 木质素,纤维素,半纤维素 | HCH和HOC弯曲振动 |
| 1603 | 木质素 | 芳环伸缩振动,对称振动 |
| 1656 | 木质素 | 环共轭C = C的松柏醇的伸缩振动; C = O甲醛的伸缩振动 |
| 2889 | C,H | CH和CH 2伸缩振动 |
| 2940 | L,C,H | CH伸缩振动在OCH 3不对称振动 |
表1: 拉曼峰位置和带分配
讨论
植物细胞壁是组织成几层的复合材料,包括细胞角(CC),次生壁(SW,具有S1,S2和S3层)和复合中间片(CML,中间片加上相邻的原始细胞壁),这使得在样品制备期间难以获得平坦的表面。因此,具有比木材更复杂结构的植物样品,特别是草,通常需要被固化以允许精细切片。 PEG是一种用于切割和拉曼研究的理想硬质基质,因为它可溶于水。用去离子水漂洗可以很容易地去除。用于嵌入的PEG具有不同的分子量,从1,000-20,000变化。 PEG的分子量越高,穿透能力越低10 。 D 2 O有助于降低木质素的荧光,在2,490 cm -1处有明显的峰值,但不会消除荧光干扰。二主要噪声信号与实际信号一起溢出:1)样品和背景荧光以及CCD的热波动可能导致基线漂移,2)宇宙射线可以显着影响敏感探测器,这表现在光谱作为窄带宽尖峰。 APRI方法是为了解决这些问题而开发的。 APRI包括自适应迭代重新加权的惩罚最小二乘法(airPLS)和主成分分析(PCA),以通过使用光谱特征本身来消除基线漂移和宇宙尖峰。
为了实现分布图像,应选择峰值强度/积分和全频谱线性拟合的多变量方法。前者适用于具有特定拉曼峰( 例如木质素)的组分,而后者适用于具有强光谱重叠的组分( 如纤维素和半纤维素)。分发通过分别在1,600cm -1和2,889cm -1附近积分特定峰,可获得木质素和多糖的对比图(图4)。然而,由于强光谱重叠,纤维素和半纤维素的图像难以通过峰积分直接产生。多元分析允许根据从有限数量的重要因素12重建原始数据的假设来对卷积信息内容进行排序。因此可以应用于区分它们的光谱并产生相应的拉曼图像。对于植物样品,提取物和木质素的存在干扰了重建纤维素和半纤维素光谱的能力。在成像数据的SMCR分析之前,必须去除这些干扰。 SMCR首先由Lawton和Sylvester引入,作为专门用于解决纯组分f的多变量技术一组光谱,没有任何追求光谱库,分析成像数据13 。光谱分类对于进一步了解植物细胞壁的结构和化学性质是重要的。这里,成像数据已经经过主成分分析(PCA)和聚类分析,以区分不同细胞壁层14的拉曼光谱。
然而,这种技术有两个限制。首先,拉曼效应较弱 - 典型的总拉曼散射截面为每分子约10 -29 cm 2 ,这使其易受强烈荧光的影响15 。改善缺陷的一种可能方法是通过尽可能薄地准备这些部分并应用基线校正算法,但荧光信号难以去除。其次,化学处理是实现细胞拉曼图像的重要手段左旋和半纤维素,并且可能增加改变原始化学成分的风险。因此,最好尽可能地除去提取物和木质素,而不会使细胞壁结构与未处理的细胞壁结构看起来太不相同。
总之,该方案适用于研究植物细胞壁内木质素,纤维素和半纤维素的分布。使用拉曼成像获得所需的信息高度依赖于操作人员在样品制备和数据分析方面的技能。良好的样品制备对于收集高质量的拉曼光谱至关重要。适当的数据分析提供了对大规模光谱的深入了解,并从图像中提取隐藏的信息。作为基本方法,该方案可用于在微观级别的化学,物理或生物处理过程中追踪主要成分的动态变化。
披露声明
作者没有什么可以披露的。
致谢
我们感谢中国科技部(2016YDF0600803)的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
参考文献
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。