Method Article
Kombinieren von Raman Imaging und multivariater Analyse zur Visualisierung von Lignin, Cellulose und Hemicellulose in der Pflanzenzellwand
In diesem Artikel
Zusammenfassung
Dieses Protokoll zielt darauf ab, ein allgemeines Verfahren zur Visualisierung von Lignin, Cellulose und Hemicellulose in Pflanzenzellwänden unter Verwendung von Raman-Bildgebung und multivariater Analyse vorzustellen.
Zusammenfassung
Die Anwendung der Raman-Bildgebung zur Pflanzen-Biomasse nimmt zu, da sie räumliche und kompositorische Informationen über wässrige Lösungen anbieten kann. Die Analyse erfordert in der Regel keine umfangreiche Probenvorbereitung; Strukturelle und chemische Informationen können ohne Etikettierung erhalten werden. Jedoch enthält jedes Raman-Bild Tausende von Spektren; Dies wirft Schwierigkeiten auf, wenn man versteckte Informationen extrahiert, vor allem für Komponenten mit ähnlichen chemischen Strukturen. Diese Arbeit führt eine multivariate Analyse ein, um dieses Problem zu lösen. Das Protokoll stellt eine allgemeine Methode zur Visualisierung der Hauptkomponenten, einschließlich Lignin, Cellulose und Hemicellulose, innerhalb der Pflanzenzellwand dar. In diesem Protokoll werden Verfahren zur Probenvorbereitung, spektrale Erfassung und Datenverarbeitung beschrieben. Es ist sehr abhängig von der Bedienerfertigkeit bei der Probenvorbereitung und der Datenanalyse. Mit diesem Ansatz kann eine Raman-Untersuchung von einem nicht-spezialisierten Benutzer durchgeführt werden, um hig zu erwerbenH-Qualitätsdaten und aussagekräftige Ergebnisse für die Pflanzenzellwandanalyse.
Einleitung
Plant biomass is the most abundant renewable resource on Earth; is mainly composed of lignin, cellulose, and hemicellulose; and is considered an attractive source of bioenergy and bio-based chemicals1. Unfortunately, it can resist degradation and confer hydrolytic stability or structural robustness to the plant cell wall. Such resistance is attributable to the accessible surface area, biomass particle size, degree of polymerization, cellulose crystallinity, and protective lignin2. A comprehensive understanding of the structural and chemical nature of the plant cell wall is thus significant from the viewpoint of plant biology and chemistry, as well as from that of commercial utilization. Commonly used wet chemistry analyses, such as chromatography, mass spectrometry, and nuclear magnetic resonance spectroscopy, only provide average compositional data of the measured sample. Furthermore, these methods are invasive and destroy the original structure of the plant tissue3.
The Raman imaging technique is a powerful tool for the nondestructive visualization of spatially resolved chemical information4. It uses a laser light to cause inelastic scattering with a photon and relies on changes in polarizability arising from the molecular vibrations. In this case, water causes weak Raman scattering, which makes this approach suitable for in situ investigations of biological samples5. The application of the Raman imaging technique to the plant cell wall can elucidate the structure and composition of plant cell walls in their native state, with the resolution on the scale of the single cell and even of the cell wall layers6. A typical Raman imaging analysis of a plant cell wall generally consists of three steps: 1) sample preparation, 2) spectral acquisition, and 3) data processing.
Although one of the major advantages of Raman imaging is the ability to achieve label-free and non-destructive spectra with minimal sample preparation, physical sample sectioning is still necessary to expose the surface of interest. This process should be performed carefully to obtain a flat surface, since the technique depends on maintaining optical focus7. Spectral acquisition requires a balance between image quality and extensive acquisition times8. Data processing aims to effectively extract the chemical information from the image data, especially for the components with similar chemical structures, such as cellulose and hemicellulose. Due to the strong spectral overlap, the exact spectra are difficult to discern. In this case, multivariate analysis is a straightforward approach to effectively uncover the hiding structural and chemical information9. This work presents a general protocol describing the use of Raman imaging to visualize the main components in plant cell walls, including lignin, cellulose, and hemicellulose.
Protokoll
1. Probenvorbereitung
- Schneiden Sie einen kleinen Gewebeblock (ca. 3 mm x 3 mm x 5 mm) aus der Pflanzenprobe ( zB Pappelstiel).
- Tauchen Sie das Gewebe 30 Minuten lang in kochendes deionisiertes Wasser ein. Sofort 30 Minuten bei Raumtemperatur (RT) auf deionisiertes Wasser übertragen. Wiederholen Sie diesen Schritt, bis das Gewebe auf den Boden des Behälters sinkt, was darauf hinweist, dass die Luft im Gewebe entfernt wurde und dass sich das Gewebe erweicht hat.
Hinweis: Für die Proben, die vor diesem Schritt nach unten sinken, wiederholen Sie diesen Zyklus im Allgemeinen 3-5 mal. - Vorbereitung von 20, 50, 70, 90% (v / v) Aliquoten von Polyethylenglykol (PEG) in deionisiertem Wasser sowie reinem PEG und halten die Lösungen bei 65 ° C.
- Inkubieren Sie das Gewebe in einer Reihe von abgestuften PEG-Bädern, um das Wasser zu verdrängen und lassen Sie das PEG infiltrieren.
Hinweis: In der Regel wird PEG mit einem Molekulargewicht 2.000 (PEG2000) zum Einbetten verwendet.- Verarbeiten Sie das Gewebe mit gPEG in einem Trockenofen wie folgt: (a) 20% PEG für 1 h, (b) 50% PEG für 1,5 h, (c) 70% PEG für 2 h, (d) 90% PEG für 2 h und (E) 100% PEG für 10 h.
- Vorwärmen einer Kassette bei 65 ° C in einem Ofen. Gießen Sie den PEG mit dem Block in die Kassette und legen Sie den Gewebeblock in eine gewünschte Position mit vorgewärmten Pinzetten oder Nadeln.
- Langsam die Kassette abkühlen und das Gewebe bei RT bis zum Gebrauch aufbewahren.
- Den PEG-Block, der das Zielgewebe enthält, in einen kleinen Block (ca. 1 cm x 1 cm x 2 cm) mit einer scharfen Rasierklinge zerlegen und auf das Mikrotom aufbringen.
- Schneiden Sie dünne Abschnitte aus dem PEG-Block (typischerweise 3-10 μm).
- Spülen Sie den Abschnitt mit deionisiertem Wasser in einem Uhrglas 10 mal, um das PEG aus dem Gewebe zu entfernen.
- Tauchen Sie die Sektionen mit Toluol / Ethanol (2: 1, v / v) für 6 h ein, um die Extrakte zu entfernen. Die Reaktionsflüssigkeit wird durch Mischen von 65 ml entionisiertem Wasser, 0,5 ml Essigsäure und 0,6 g Natriumchlorid zubereitetRitus in einem Becher Einen Teil und 3 ml Reaktionsflüssigkeit in eine 5 ml Durchstechflasche geben. Schrauben Sie auf die Oberseite der Durchstechflasche.
- Die Durchstechflasche im Wasserbad bei 75 ° C für 2 h erhitzen, um das Lignin des Gewebes zu entfernen. Spülen Sie den Abschnitt mit deionisiertem Wasser in einem Uhrglas 10 mal aus.
- Den unbehandelten / delignenten Abschnitt auf einen Glasmikroskop-Objektträger übertragen. Füllen Sie den Abschnitt sorgfältig mit Pinsel oder Nadeln. Das extra entionisierte Wasser mit Seidenpapier entfernen.
- Tauchen Sie den Abschnitt in D 2 O ein. Bedecken Sie die Probe mit einem Glasdeckel. Den Deckel mit Nagellack abdichten, um die Verdampfung des D 2 O zu verhindern.
2. Spektrale Erfassung
- Öffnen Sie die Instrumentensoftware des konfokalen Raman-Mikroskops. Schalten Sie den Laser ein (Wellenlänge = 532 nm), fokussieren Sie auf die Oberfläche des kristallinen Siliziums mit einem 100fachen Mikroskopobjektiv und klicken Sie auf die Kalibriertaste, um das Instrument zu kalibrieren.
- Gerät einschaltenZum optischen Mikroskop-Modus und schalten Sie die Mikroskop-Lampe ein. Montieren Sie den Mikroskop-Objektträger auf der Bühne, wobei der Deckel dem Objektiv zugewandt ist.
- Sehen Sie die Probe mit einem 20X-Mikroskop-Objektiv an und suchen Sie den interessanten Bereich. Das Tauchöl auf das Deckglas auftragen und auf das Immersionsmikroskopobjektiv wechseln (60X, numerische Blende NA = 1.35). Konzentriere dich auf die Oberfläche der Probe.
- Schalten Sie das Gerät in den Raman-Testmodus und schalten Sie die Mikroskoplampe aus.
- Wählen Sie einen Mapping-Bereich mit einem rechteckigen Werkzeug. Ändern Sie die Schrittgröße, um die Anzahl der erhaltenen Spektren zu bestimmen.
Hinweis: Beachten Sie die Schrittweite (meist größer als der durch die numerische Apertur des Objektivs berechnete Spotdurchmesser, theoretisch 1,22λ / NA). Größen darunter führen zu Überabtastungen. - Stellen Sie die optimalen Spektralparameter ein, um das beste Signal-Rausch-Verhältnis (SNR) und die spektrale Qualität in einer geeigneten Erfassungszeit (im Allgemeinen <8 h) zu erhaltenNding auf die Eignung der Probe. Im Allgemeinen werden die Bildgebungsparameter in die Instrumentensoftware wie folgt eingegeben: Laser (532 nm), Filter (100%), Loch (300), Schlitz (100), Spektrometer (1.840 cm -1 ), Rillen (1200t), Objektiv ( 60X Öl) und Erfassungszeit (2 s).
- Speichern Sie die Spektraldaten vor der Datenverarbeitung und konvertieren sie in ein universelles Format ( zB TXT-Dateien).
3. Datenanalyse
- Laden Sie die Spektraldaten (TXT-Dateien) in die Datenanalyse-Software ( zB Matlab). Wenden Sie eine Rauschunterdrückung auf den Datensatz an, um das SNR zu verbessern ( zB der Savitzsky-Golay-Algorithmus oder der Wavelet-Algorithmus)
- Verwenden Sie unbehandelte Proben, um die Bilder von Lignin und Polysacchariden herzustellen. Für die Lignin-Bildgebung betrachten wir den spektralen Peak um 1.600 cm -1 aufgrund der aromatischen Ring-symmetrischen Streckschwingungen. Für die Polysaccharid-Bildgebung (einschließlich Cellulose und Hemicellulose) verwenden Sie den Spektralpeak aRund 2,889 cm -1 wegen der CH- und CH2-Strecken.
- Verwenden Sie delignifizierte Proben, um die Bilder von Cellulose und Hemicellulose zu erzeugen. Führen Sie eine selbstmodellierende Kurvenauflösung (SMCR) auf den erworbenen Spektren durch, um die Spektren von Cellulose und Hemicellulose zu unterscheiden und ihre Verteilungen abzubilden.
- Führen Sie die Hauptkomponentenanalyse (PCA) und die Clusteranalyse auf die erfassten Daten durch, um die Raman-Spektren von verschiedenen Zellwandschichten zu unterscheiden.
Ergebnisse
Abbildung 1 zeigt einen Überblick über ein typisches Mikro-Raman-System für die Raman-Bildgebung einer Pflanzenzellwand. Als Beispiel haben die ursprünglichen Raman-Spektren der Pappel ( Populus nigra L.) signifikante Baseline-Drifts und Spikes (Abbildung 2a ). Nach Durchführung des automatischen Vorverarbeitungsverfahrens für den Raman-Bilddatensatz (APRI) werden diese beiden spektralen Verunreinigungen erfolgreich entfernt (Abbildung 2b ). Ein typisches Raman-Spektrum von Pappel ist in Fig. 3 dargestellt, und seine Bandzuweisungen sind in Tabelle 1 aufgelistet. Das Raman-Bild von Lignin wird durch die Integration des Spektralbereichs von 1.550-1.650 cm -1 erzeugt , was der aromatischen Ringstruktur zugeschrieben wird (Abbildung 4a ). Abbildung 4d zeigt das Raman-Bild von Polysacchariden, whIch wird durch die Integration der Spitze bei 2.889 cm -1 erreicht . Um Zellulose und Hemizellulose abzubilden, wird SMCR auf den Raman-Bilddaten einer delignifizierten Probe durchgeführt. Die entsprechenden Spektren und Bilder sind in Abbildung 5 dargestellt. Abbildung 6 zeigt die durch PCA und Clustering-Analyse erzielten Ergebnisse.

Abbildung 1: Ein Schema der Raman-Bildgebung für die Pflanzenzellwand. Die Querschnittsprobe (Pappel als Beispiel) wird durch ein Mikro-Raman-System gemessen, das ein optisches Mikroskop mit einem Raman-Hochauflösungs-Spektrometer mit einem Ladungskopplungs-Detektor (CCD) koppelt. Im hellen Feldbild ist die Pflanzenzellwand in die Zellsecke (CC), die zusammengesetzte mittlere Lamelle (CML) und die sekundäre Wand (SW) organisiert. Herkömmlicherweise wird ein Raman-Bild durch Einzelspitzen erzeugtIntegration oder Intensität. Zwei spektrale Verunreinigungen ( dh Baseline Drifts und kosmische Spikes) finden sich in den Originaldaten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
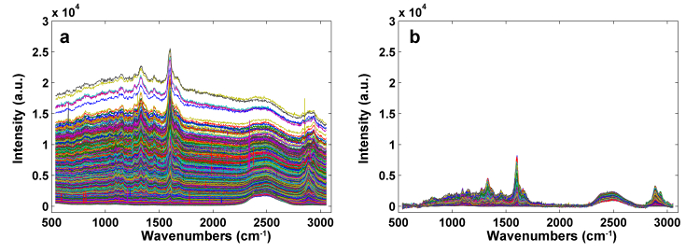
Abbildung 2: Die Raman-Spektren Vor ( a ) und nach ( b ) Vorverarbeitung durch APRI. Zwei spektrale Verunreinigungen werden erfolgreich entfernt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
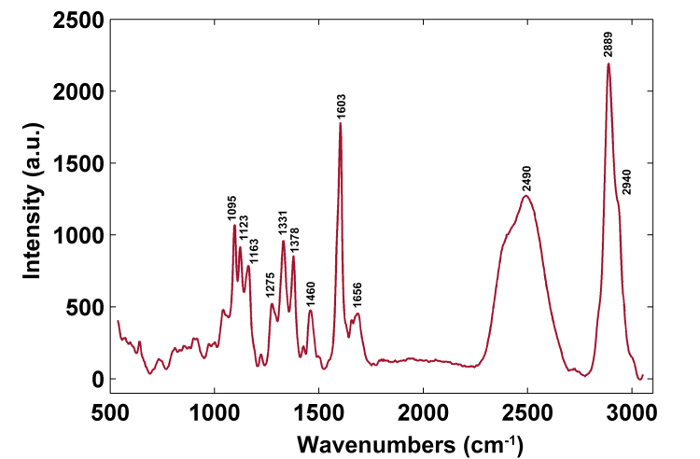
Abbildung 3: Ein typisches Raman-Spektrum der Pappel-Zellwand. Das typische Raman-Spektrum stammt aus der Sekundärwand. Die Bandzuweisungen sind in Tabelle 1 dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
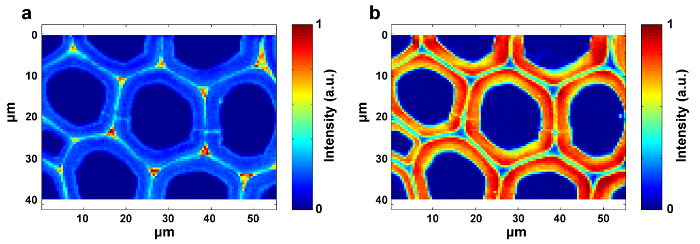
Abbildung 4: Raman Bilder von Lignin ( a ) und Polysacchariden ( b ) innerhalb der Pappel-Zellwand. Das Ligninbild wird durch die Integration des Peaks um 1.600 cm -1 erzeugt . Das Polysaccharidbild wird durch Integration des Peaks um 2.889 cm -1 erzeugt . Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5: Raman Bilder von Cellulose ( a ) und Hemicellulose ( b ) innerhalb der Pappel-Zellwand. SMCR wird auf den Raman-Bilddaten einer delignifizierten Probe durchgeführt. Die Delignifizierung trägt zur Exposition der spektralen Eigenschaften von Cellulose und Hemicellulose bei. Cellulose ist meist in der SW konzentriert, während die Verteilung der Hemicellulose nahezu gleichmäßig in der Pappelzellwand ist. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
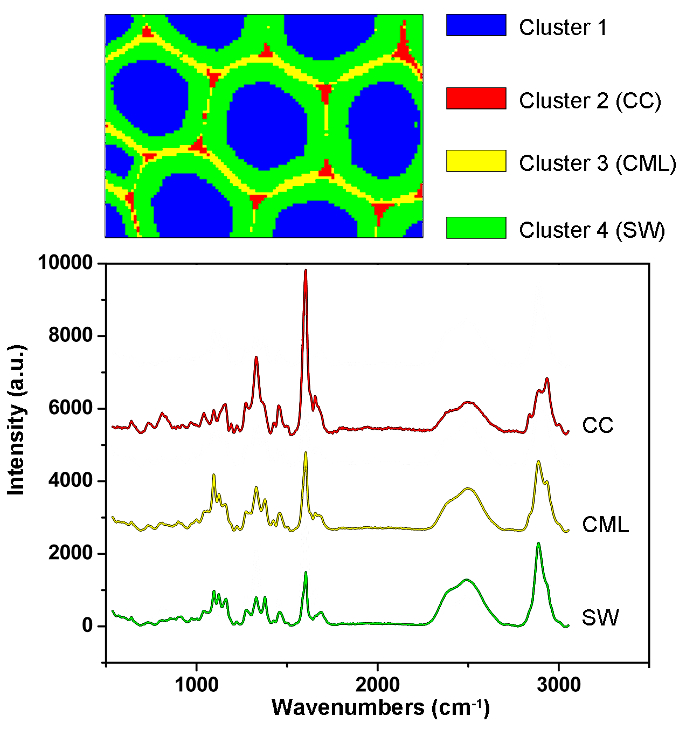
Abbildung 6: PCA- und Clustering-Analyseergebnisse zur automatischen Identifizierung verschiedener Zellwandschichten in der Pappel-Zellwand. Durch die Verwendung von PCA und Clustering-Analyse werden die Spektren in vier Teile geteilt, die dem Zelllumen, CC, CML und SW entsprechen. Die durchschnittlichen Spektren dieser Schichten sind unten angegeben. Die Ergebnisse zeigten, dass das Lignin entlang der CML und im CC konzentriert ist, während die Polysaccharide meist im SW konzentriert sind. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Wellenzahlen (cm -1 ) | Komponenten | Zuordnungen |
| 1,095 | Cellulose, Hemicellulose | Schweres Atom CC und CO Streckung Vibration |
| 1,123 | Cellulose, Hemicellulose | Schweres Atom CC und CO Streckung Vibration |
| 1,163 | Cellulose, Hemicellulose | Schweres Atom CC und CO Streckschwingung plus HCC und HCO Biege Vibration |
| 1.275 | Lignin | Aryl-O von Aryl OH und Aryl O-CH3; Guaiacylring mit C = O-Gruppe |
| 1,331 | Lignin, Cellulose, Hemicellulose | HCC und HCO Biegevibration |
| 1,378 | Cellulose, Hemicellulose | HCC, HCO und HOC Biegevibration |
| 1,460 | Lignin, Cellulose, Hemicellulose | HCH und HOC Biegevibration |
| 1,603 | Lignin | Aryl-Ring-Streckung Vibration, symmetrische Vibration |
| 1,656 | Lignin | Ring konjugierte C = C-Streckschwingung von Coniferylalkohol; C = O-Streckschwingung von Koniferaldehyd |
| 2.889 | CH | CH- und CH2-Streckschwingungen |
| 2.940 | L, C, H | CH-Streckschwingung bei OCH 3 asymmetrische Vibration |
Tabelle 1: Raman-Spitzenpositionen und Bandzuweisungen
Diskussion
Die Pflanzenzellwand ist ein Verbundwerkstoff, der in mehrere Schichten organisiert ist, darunter Zell-Ecke (CC), Sekundärwand (SW, mit den S1-, S2- und S3-Schichten) und zusammengesetzte mittlere Lamellen (CML, mittlere Lamellen plus die angrenzende Primär- Wand), was es schwierig macht, bei der Probenvorbereitung eine ebene Oberfläche zu erhalten. So müssen Pflanzenproben, vor allem Gras, die eine kompliziertere Struktur als Holz haben, oft verfestigt werden, um eine Feinschnittung zu ermöglichen. PEG ist eine ideale Hartmatrix für das Schneiden und Raman-Untersuchung, da es in Wasser löslich ist. Es kann leicht durch Spülen mit deionisiertem Wasser entfernt werden. PEG, das zum Einbetten verwendet wird, hat unterschiedliche Molekulargewichte, die von 1.000-20.000 variieren. Je höher das Molekulargewicht des PEG ist, desto geringer ist die Penetrationsfähigkeit 10 . D 2 O wird dazu beitragen, die Fluoreszenz von Lignin zu reduzieren und hat einen markanten Peak bei 2.490 cm -1 , aber es wird nicht die Fluoreszenzstörung beseitigen. ZweiHauptgeräuschsignale verschwinden in die Kanäle, zusammen mit den tatsächlichen Signalen: 1) Proben- und Hintergrundfluoreszenz sowie thermische Schwankungen von CCD können zu Baseline-Drifts führen und 2) kosmische Strahlen können die empfindlichen Detektoren, die sich manifestieren, deutlich beeinflussen Spektren als schmalbandige Spikes. Die APRI-Methode wurde entwickelt, um diese Probleme zu lösen 11 . APRI umfasst die adaptiven iterativ umgewichteten, benachteiligten kleinsten Quadrate (airPLS) und die Hauptkomponentenanalyse (PCA), um die Baseline-Drifts und kosmischen Spikes zu eliminieren, indem sie die spektralen Merkmale selbst verwenden.
Um Verteilungsbilder zu erzielen, sollten Peakintensität / Integration und Ganzspektren lineare Anpassung durch multivariate Methoden gewählt werden. Erstere eignet sich für die Komponenten mit spezifischen Raman-Peaks ( zB Lignin), während letztere für die Komponenten mit starker spektraler Überlappung ( zB Cellulose und Hemicellulose) geeignet ist. Der distriButionbilder von Lignin und Polysacchariden sind durch Integration der spezifischen Peaks um 1.600 cm -1 bzw. 2.889 cm -1 verfügbar (Abbildung 4). Allerdings sind die Bilder von Cellulose und Hemicellulose aufgrund der starken spektralen Überlappung schwer durch die Peakintegration direkt zu erzeugen. Die multivariate Analyse erlaubt es, den gefalteten Informationsinhalt nach der Hypothese zu sortieren, dass die ursprünglichen Daten aus einer begrenzten Anzahl von signifikanten Faktoren rekonstruiert werden. Es kann also angewendet werden, um ihre Spektren zu unterscheiden und entsprechende Raman-Bilder zu erzeugen. Bei Pflanzenproben stört die Anwesenheit von Extraktiven und Lignin die Fähigkeit, die Spektren von Cellulose und Hemicellulose zu rekonstruieren. Es ist notwendig, diese Interferenzen vor der SMCR-Analyse der Bildgebungsdaten zu entfernen. SMCR wurde zuerst von Lawton und Sylvester als multivariate Technik eingeführt, die speziell für die Auflösung einer reinen Komponente entwickelt wurdeEine Reihe von Spektren, ohne Rückgriff auf eine Spektralbibliothek, um die Bilddaten zu analysieren 13 . Die spektrale Klassifikation ist wichtig für das weitere Verständnis der strukturellen und chemischen Natur der Pflanzenzellwand. Hier wurden die Bildgebungsdaten einer Hauptkomponentenanalyse (PCA) und einer Clusteranalyse unterworfen, um Raman-Spektren von verschiedenen Zellwandschichten 14 zu unterscheiden.
Diese Technik hat jedoch zwei Einschränkungen. Zuerst ist der Raman-Effekt schwach - der typische Gesamt-Raman-Streuquerschnitt beträgt ~ 10 -29 cm 2 pro Molekül - was ihn anfällig für intensive Fluoreszenz macht 15 . Eine mögliche Möglichkeit, den Defekt zu verbessern, besteht darin, die Abschnitte so dünn wie möglich vorzubereiten und einen Basiskorrekturalgorithmus anzuwenden, aber Fluoreszenzsignale sind schwer zu entfernen. Zweitens ist die chemische Behandlung ein wichtiges Verfahren bei der Erzielung von Raman-Bildern der ZelleUlose und Hemicellulose, und es kann das Risiko erhöhen, den ursprünglichen chemischen Gehalt zu verändern. Daher ist es am besten, die Extrakte und Lignin so weit wie möglich zu entfernen, ohne dass die Zellwandstruktur zu unterschiedlich von der unbehandelten ist.
Abschließend eignet sich dieses Protokoll für die Untersuchung der Verteilung von Lignin, Cellulose und Hemizellulose in der Pflanzenzellwand. Die Verwendung der Raman-Bildgebung, um die gewünschte Information zu erhalten, hängt stark von der Fähigkeit des Bedieners bei der Probenvorbereitung und der Datenanalyse ab. Eine gute Probenvorbereitung ist wichtig, um hochwertige Raman-Spektren zu sammeln. Eine angemessene Datenanalyse gibt Einblicke in die großformatigen Spektren und extrahiert die versteckten Informationen aus dem Bild. Als Grundverfahren kann dieses Protokoll verwendet werden, um die dynamischen Veränderungen der Hauptkomponenten während der chemischen, physikalischen oder biologischen Behandlung auf der Mikroebene zu verfolgen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken dem chinesischen Ministerium für Wissenschaft und Technologie (2016YDF0600803) für die finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Microtome | Thermo Scientific | Microm HM430 | |
| Confocal Raman microscope | Horiba Jobin Yvon | Xplora | |
| Oven | Shanghai ZHICHENG | ZXFD-A5040 |
Referenzen
- Gonzalo, G. D., et al. Bacterial Enzymes Involved in Lignin Degradation. J. Biotechnol. 236, 110-119 (2016).
- Rosatella, A. A., Afonso, C. A. M. Chapter 2. Ionic Liquids in the Biorefinery Concept: Challenges and Perspectives. , 38-64 (2016).
- Sun, L., et al. Understanding tissue specific compositions of bioenergy feedstocks Through hyperspectral Raman imaging. Bio. 108 (2), 286-295 (2009).
- Tolstik, T., et al. Classification and prediction of HCC tissues by Raman imaging with identification of fatty acids as potential lipid biomarkers. J. Cancer. Res. Clin. Oncol. 141 (3), 407-418 (2015).
- Schrader, B. . Infrared and Raman spectroscopy: methods and applications. , (2008).
- Gierlinger, N., et al. Imaging of plant cell walls by confocal Raman microscopy. Nat. Protoc. 7 (9), 1694-1708 (2012).
- Luca, A. C. D., et al. Online fluorescence suppression in modulated Raman spectroscopy. Anal. Chem. 82 (2), 738-745 (2009).
- Schlücker, S., et al. Raman microspectroscopy: a comparison of point, line, and wide-field imaging methodologies. Anal. Chem. 75 (16), 4312-4318 (2003).
- Cooper, J. B. Chemometric analysis of Raman spectroscopic data for process control applications. Chemometr. Intell. Lab. Syst. 46 (2), 231-247 (1999).
- Cheng, H. J., Hsiau, S. S. The study of granular agglomeration mechanism. Powder Technol. 199 (3), 272-283 (2010).
- Zhang, X., et al. Method for removing spectral contaminants to improve analysis of Raman imaging data. Sci. Rep. 6, 39891 (2016).
- Shinzawa, H., et al. Multivariate data analysis for Raman spectroscopic imaging. J. Raman Spectrosc. 40 (12), 1720-1725 (2009).
- Lawton, W. H., Sylvestre, E. A. Self modeling curve resolution. Technometrics. 13, 617-633 (1971).
- Zhang, X., et al. Method for automatically identifying spectra of different wood cell wall layers in Raman imaging data set. Anal. Chem. 87 (2), 1344-1350 (2015).
- Kudelski, A. Analytical application of Raman spectroscopy. Talanta. 76 (1), 1-8 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten