Method Article
Beyin Dilimleri tüm hücre Patch-kelepçe Kayıtlar
Bu Makalede
Özet
Bu protokol tüm hücre yama-kelepçe kayıtları gerçekleştirmek için temel usul adımları açıklar. Bu teknik nöronların elektriksel davranışının çalışma sağlar ve beyin dilimleri yapıldığında, hala nispeten iyi korunmuş beyin devreleri entegre edilmiştir nöronlardan farklı nöron işlevlerinin değerlendirilmesine olanak sağlamaktadır.
Özet
Tüm hücre yama kelepçe kayıt nöron önemli bir bölümünün elektriksel özelliklerinin çalışma sağlayan bir elektrofizyolojik bir tekniktir. Bu yapılandırmada, mikropipet, daha önce kullanılan hücre içi keskin elektrot kayıt yöntemine göre daha doğru bir iyonik akım ölçümleri mevcut sızmasını önler ve böylece içerir hücre membranı ile sıkı bir temas halindedir. Klasik olarak, tam-hücre kayıt hücre kültürü modelleri, ayrışmış nöronlar, beyin dilimleri nöronlar dahil preparasyonların çeşitli üzere nöronlar üzerinde yapıldı ve sağlam anestezi ya uyanık hayvanlarda edilebilir. Özetle, bu teknik son derece uyarılabilir hücrelerin pasif ve aktif biyofiziksel özelliklerinin anlaşılması için katkıda bulunmuştur. Bu tekniğin önemli bir avantajı da manipülasyonlar (örneğin, farmakolojik, deneyci kaynaklı plastisite) belirli nöronal fonksiyonlar veya c değiştirebilir nasıl özel bilgi sağlamasıdırgerçek zamanlı olarak hannels. Buna ek olarak, plazma zarının önemli bir açıklığı iç pipet çözeltisi serbest sokulması ilaçlar, örneğin, agonistleri veya belirli bir hücre içi proteinlerin antagonistleri için araçlar temin edilmesi ve komşu hücrelerde fonksiyonlarını değiştirmeden bu hedeflerin manipüle, sitoplazma içine nüfuz sağlar. Tam hücreli kayıt üzerinde durulacak Bu makale, beyin dilimleri nöronlar üzerinde bir fizyolojik ilgili bağlamda, yani nispeten iyi korunmuş beyin devreleri, nöronların kayıt avantajı vardır bir hazırlık yapıldı. Özel olarak, uygun bir farmakoloji ile birleştirildiğinde, bu yöntem, öğrenme, ilaç kötüye kullanımı maruz kalma ve stres gibi deneyimler, herhangi bir türü aşağıdaki Meydana gelen neuroadaptations belirlenmesini sağlayan güçlü bir araçtır. Özet olarak, beyin dilimleri tam hücre patch-clamp kayıtları ex vivo preparat uzun süreli değişiklikler ölçmek için araç sağlarnöronal işlevleri bu sağlam uyanık hayvanlarda gelişmiştir.
Giriş
Patch-kelepçe tekniği, 1970'lerin sonlarında 1,2 geliştirilmiştir bir elektrofizyolojik teknik canlı dokuda tekli veya çoklu iyon kanal işlevleri çalışmak için birincil araçtır. elde edilebilir, farklı bant konfigürasyonu arasında, bütün hücre patch-clamp kayıtları nöron önemli bir bölümünün, elektrik davranış çalışma sağlar. Klasik olarak, bu teknik, ya in vitro beyin kesitleri, yeni ayrışmış nöronlar üzerinde veya hücre kültürü modelleri 3 gerçekleştirilir. Beyin dilimleri nöronlar üzerinde gerçekleştirilen, bu teknik birçok avantaj sunar. Özellikle: (I) nöronları olduğu bir dereceye kadar nispeten korunmuş beyin devrelerinde kaydedilir ve hücre kültürü preparatlara kıyasla, 3 fizyolojik olarak uygun bir ortam sağlar. Bu, akut Pharmacolog her türlü tarafından tetiklenen hücresel ve moleküler olayları erken yakalayan, hatta gerçek zamanlı olarak izleme veriyornik manipülasyonlar - in vivo koşullarında, klasik kullanılarak elde edilemez bir zamansal çözünürlüğü; görsel beyin dilimleri beyin bölgelerini tespit etmek, (ii) yeteneği, hem de floresan belirteçler zaman beyin bölgesi okudu ve özel nöronlar için yüksek bölgesel özgüllüğü 3 sağlar; (iii) (hücre içi kayıtları için keskin bir mikropipet ile membran delme aksine) plazma zarının önemli bir bölümünü açarak hücrenin hücre içi alana erişim 4. Buna karşılık, bu iç çözüm oluşturan belirli iyonların içeriği veya konsantrasyonu o kadar moleküler hedeflerin değiştirilmesi veya hücresel mekanizmaları farklı koşullar altında ele alınabilir sağlar. Örneğin, tam-hücre konfigürasyonu, herhangi bir farmakolojik madde (örneğin, antagonistler) kurulması sırasında bir kayıt mikropipet (Yama pipet) çözeltisi doğrudan sitoplazma içine nüfuz ve putat hareket edecek ekle kiKomşu hücrelerde hedef fonksiyonu değiştirmeden hücre içi hedefleri ive. Ayrıca, keskin mikropipet kayda göre, yama kelepçe elektrodun ucundaki büyük açılış alt direnci, daha az rekabet halindeki gürültü ve hücrenin 4 içine böylece daha iyi elektrik erişim sağlar. Ancak, pipet ucunda büyük açılış hücre diyaliz yol ve çalışma 5,6 altında biyolojik olayların ifadesi için kritik olabilecek hücre içi moleküler makine, böylece kaybı unutmayın. Bu durumda, sert elektrot kayıtları daha uygun olabilir. Kayıtların Bu tür ve böylece hücre içi alanı ve iç pipet çözeltisi arasında iyon değişiminin çoğu önlenmesi, tüm hücre kayıtları için kullanılan daha küçük olan bir gözenek olan mikropipetler gerektirir.
(Akut veya kronik) deneyimi herhangi bir şekilde dahil olmak üzere kötüye 11,1 ilaçlara, pozlama 7-10 öğrenme2, vb stres 13,14, spesifik beyin bölgelerinde nöronal fonksiyonu çeşitli yönlerini değiştirebilir. Bu değişiklikler genellikle (gün saat) geliştirmek için zaman gerektirdiğinden, belirli bir deneyim geçirmiş hayvanların beyin dilimleri tam hücre kayıtları araştırmacılar bu değişiklikleri tanımlamak için izin verir. Temelde, (hepsi değilse de) nöronal fonksiyonlar (örneğin, ligand-aktive iyon kanalları, voltaj kapılı iyon kanalları, nörotransmitter taşıyıcılar) ve böylece beyin devre aktivitesi ve davranış, deneyim değiştirilebilir (deneyim bağımlı katılan bileşenler çok plastisite) 10,15-17. Nöronal düzeyde, beyin devresi etkinlik sinaptik arasında sürekli etkileşim (örn glutamat iletim) ve içsel hücresel heyecanlanma faktörleri (örneğin, axosomato-dendritik iyon kanalları çıkar: potasyum, K +, sodyum Na + ve kalsiyum, Ca 2+ ). Whol kullanarak belirli koşullar altındaE-hücre patch-kenetli elektrofizyolojik teknikler, sinaptik genel içsel uyarılabilirliğinin değişikliklerden özellikle kaynaklanan sinyal değişiklik izole edilebilir.
Çoğu durumda, sinaptik uyarılma tüm hücre voltaj-kelepçe tekniği kullanılarak değerlendirilir. Bu kayıt modu α-amino-3-hidroksi-5-metil-4-isoxazolepropionic asit reseptörleri tarafından aracılık edilen, örneğin iyon akımlarının [ölçümünü (karşılaştırın AMPA reseptörleri) ve nöronal plazma zarından, N-metil-D-aspartik asit reseptörleri (NMDA reseptörleri)] bir dizi gerilim zar potansiyeli tutarak. Burada, deneyci sezyum ihtiva iç mikropipet çözümleri (Cs +), K + kanallarının geniş bir engelleyici (kilit iç uyarılma faktörler) kullanın. Tüm hücre konfigürasyonunun oluşturulmasından sonra, hücre içi boşlukta Cs + `nin difüzyon K + kanallarını bloke eder ve böylece, nispeten etkin bir alanı kelepçesi ve ön hem de izin verirdiğer ölçümler üzerinde içsel uyarılabilirlik faktörlerin etkisini havalandırın. Düzensiz şekilli hücreler (örneğin, nöronlar) ve 18,19 çardak geniş ve karmaşık dendritik özellikle nöronlar kaydederken Uzay kelepçe sorunları, yani gerilim-kelepçe zorluk tüm hücre, ortaya çıkar. somatik gerilim kelepçe kötü kontroller nöronların dendritik ağacında gerilimi nedeniyle, çalışma kapsamında dendritik elektrik sinyallerine çeşitli yönleri bir dendritik mesafe bağımlı bir şekilde bozulmuş. (Yapay beyin-omurilik sıvısı, ACSF) hücre-dışı çözelti içinde çözüldü bu pikrotoksin (y-aminobütirik asit, GABA A reseptör antagonisti) ya da kynurenic asit (glutamat reseptörlerinin birçok engelleyici) gibi farmakolojik araçlar ile birlikte, bu teknik, glutamat ölçümünü sağlar reseptör ve GABA A sırasıyla akımları R-aracılı.
Buna karşılık, iç uyarılma genellikle akım kelepçe kayıt modunda değerlendirilir.voltaj-kelepçe kayıtları aksine, bu kayıt modu nöronal plazma zarı içinden akan iyon akımlarının neden membran potansiyelleri varyasyonlarının ölçümü. Nöronlar Na + ve K + kanalları gerektiren hem aksiyon potansiyelleri oluşturmak için Tipik olarak, içsel eksitabilite değişiklik yeteneği değişiklikler ile belirlenir. Akım kelepçe kayıtları yaparken, bu nedenle, mikropipetler K + yerine Cs + içeren bir iç çözelti ile doldurulur. Glutamat ve GABA ACSF içinde çözülür A reseptör-aracılı akımları bloke farmakolojik ajanlar ile kombine, bu deney tasarımı sinaptik eksitabilite olası değişiklikleri ile kontamine olmadan nöronal ateşleme içsel faktörler (örneğin, K + kanalları) katkısı ölçülmesini sağlar faktörler.
Bu makale t gerekli temel usul adımları anlatacağızo (i) sağlıklı beyin dilimleri hazırlamak; (Ii) tüm hücre konfigürasyonu elde, ve (iii) sinaptik ve içsel heyecanlanma değerlendirmek için temel parametreleri izlemek.
Protokol
Bütün deneyler, UT Güneybatı Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır protokollere uygun olarak gerçekleştirildi ve deney hayvanları maruz kaldığı stresi, rahatsızlık ve acıya en aza indirecek şekilde seçilmiştir.
1. Çözümler
Not: Önceden mikropipet iç çözümler hazırlayın. En temel deneysel amaçlar için, çözümlerin iki tür yeterli olacaktır: Cs + tabanlı ve K + tabanlı çözümler.
- Voltaj kelepçe deneyler için kullanın Cs + tabanlı çözümler (örneğin, Cs + glukonat çözüm, Malzeme bakınız). Oda sıcaklığında hazırlayın.
- 3.54 gr CsOH (~ 2.01 ml) ile 4.62 g D-glukonik asit (~ 3,696 mi) karıştırarak 117 mM Cs-Gluconate çözüm hazırlayın.
- GKD 2 O 90 ml ilave edilir ve 30 dakika boyunca dengelenmeye bırakın.
- 0.4 mM EGTA = 15.2 mg, 2.8 mM NaCI = 16.4 mg, katı maddeler (20 mM HEPES = 0.476 g ', 5 mM tetraetilamonyum (TEA) Klorür = 83 mg) eklenmiştir.
- ~ 97 ml GKD 2 O ekleyin.
- 7.2 to 50% CsOH ile çözeltinin pH ayarlama - 7.3.
- GKD 2 O. ile gerekirse ozmolarite ve doğru kontrol
Not: iyi bir dizi ~ 280 - 285 mOsm. (- 310 mOsm, laboratuvarımızda 300 mOsm genellikle 300) 20 mOsm standart ACSF ozmolarite altında - Optimum ozmolarite 15 olmalıdır. Osmolarite çözeltiler belirli bileşimler bağlı olarak değişebilir. - -20 ° C veya altında 1.000 ul ve mağaza kısım.
- , Kısım, hazırlayın, dondurma ve kayıt günü iç çözüm ATP / GTP ekleyin.
- 10 mg GTP ile 64.63 mg ATP ekleyin ve GKD 2 O. 637,11 ul çözülür
- -20 ° C veya altında 10 ul alikotları ve mağaza hazırlayın. Deney günü, iç çözeltisi 1.000 ul, her 100x kısım karıştırın. ATP / GTP iç çözeltisine eklendiğinde, ATP / GTP degradati önlemek için buz üzerinde muhafazaüzerinde.
- Nöronal ateşleme değerlendirilebilir böylece K + iletimleri işlevsel kalır akım-gerilim ve kelepçe deneyler hem Kullan K + tabanlı çözümler (örneğin, K-Gluconate çözüm Malzemeler bakınız). Oda sıcaklığında hazırlayın.
- istenen son hacme göre olan tüm malzemeleri tartılır. çözeltisi 90 ml, 120 mM K-glukonat = 2.81 gr hazırlanması için; 20 mM KCI 0.149 g =; 10 mM HEPES = 0.238 g; 0.2 mM EGTA = 0.008 g; 2 mM MgCl2 = 0.021 gr.
- Nihai çözüm hacminin% 90 ulaşmak için yeterli GKD 2 O kullanın. Bu yeterli oda pH ve osmolarite ayarı için bırakılır sağlamalıdır.
- ekleme ve tüm malzemeyi karıştırdıktan sonra, çözelti pH ölçümü önce temiz olduğundan emin olun.
- K + hidroksit (KOH) ile 7.3 - sürekli çözelti karıştırılırken, pH'ı 7.2'ye ayarlayın.
- pH'ı ayarladıktan sonra, osmometresi ve reklamı kullanmak285 mOsm - 280 sadece osmolarite.
Not: Optimal ozmolarite 15 olmalıdır - standart ACSF ozmolarite altında 20 mOsm (genellikle 300-310 mOsm, laboratuvarımızda 300 mOsm). Osmolarite çözeltiler belirli bileşimler bağlı olarak değişebilir. - -20 ° C veya altında 1.000 ul ve mağaza kısım.
- , Kısım, hazırlayın, dondurma ve kayıt günü iç çözüm ATP / GTP ekleyin (adım 1.1.8 bakınız).
- Standart ACSF (Malzeme) 1 L hazırlayın.
Not: ilgi beyin bölgesini kaydederken rutin olarak kullanılan bir tarifi kullanabilirsiniz beyin dilimleri orta dikenli nöronların (MSNs) kaydederken bizim laboratuvarda bu tarifi kullanabilirsiniz, ancak, yemek tarifleri laboratuarlar arasında farklılık gösterebilir ve bu nedenle, biz deneyci tavsiye . - diseksiyon ACSF hazırlayın (dilimleme çözüm ~ 125 ml Not:. tam beyin batırmak gerektiği gibi kesin hacim dilimleme odasının büyüklüğüne bağlıdır) kullanılmak üzere2.8 - 2.2 adımları.
- 5 mM kynurenic asit hazırlanması dilimleme sırasında beyin daldırın için yeterli bir hacimde standart bir ACSF (glütamat reseptörü kaynaklı eksitotoksik işlemleri bloke etmek için). kynurenic asit çözülür yardımcı olmak için bir sonikatör kullanın.
Not: sonikasyon uzunluğu çözeltisi içinde katıların seviyesi ve miktarına bağlı olarak değişebilir. (- Bizim koşullarda 2 dakika civarında 1) çözümleri sürecinin sonuna kadar açık olmalıdır. - 2 ° C - sıcaklık 0 ulaşıncaya kadar bir kova buz% 95 O 2,% 5 CO 2 gazı ile köpürme sırasında soğumasını.
- 5 mM kynurenic asit hazırlanması dilimleme sırasında beyin daldırın için yeterli bir hacimde standart bir ACSF (glütamat reseptörü kaynaklı eksitotoksik işlemleri bloke etmek için). kynurenic asit çözülür yardımcı olmak için bir sonikatör kullanın.
- kayıt için ACSF hazırlayın.
- Standart ACSF 1 L alın (ya da her türlü adım 1.3 hazırlanan solüsyon kalan) hangi uygun farmakolojik ajanlar planlanan deneyler bağlı eklenebilir.
- uyarıcı post-sinaptik akımları ya potansiyelleri (EPSCs veya EPSPS), glutamat reseptör antagonistlerinin kayıt Örneğin, (kynure 100 uM pikrotoksin eklemeNIC asit, 2 mM; ya CNKX 10 uM D-APV 50 uM), sinaptik olaylardan herhangi bir etkisi olmadan nöronal ateşleme değerlendirirken önleyici sinaptik sonrası akımları ya potansiyelleri (iPSCs ya IPSPs), ve her ikisi de pikrotoksin ve glutamat reseptör antagonistlerinin kayıt bir kombinasyonu.
- Standart ACSF 1 L alın (ya da her türlü adım 1.3 hazırlanan solüsyon kalan) hangi uygun farmakolojik ajanlar planlanan deneyler bağlı eklenebilir.
2. Dilim Hazırlık
- Construct ya da bir dilim kurtarma odasına edinin.
Not: Bir kurtarma bölmesi için prensibi basittir ve laboratuarda (Şekil 1) de yapılabilir. Kısaca, bölme bir sepet ACSF yüzeyinden daha düşük bir seviyede beyin dilimleri tutmak için yerleştirilmiş olan bir kap olup. Çeşitli bilimsel şirketleri de dilim kurtarma odaları satmak.- 30 cc şırınga keserek; - (6 mm yüksekliğinde 4) (B, üstten görünüm Şekil 1A, yan görünüm) Örnek olarak, dört yüzük almak. Sonra, tutkal (örneğin, bir naylon hos kesilen ağları gergine) halkalardan biri tarafına beyin dilimleri (Şekil 1B) tutun ve birlikte halkaları yapıştırmak için.
Not: tutkal tabancası kullanılabilir. - Dört halka yapıştırılmış sonra, kurtarma beyin dilimleri (Şekil 1C ve D) oksijen kabarcıkları aktarmak için halkalar (Şekil 1A ve B) iki kavisli ikizkenar yamuk şeklindeki plastik duvar tutkal. Şekil 1 D'de gösterildiği gibi, plastik duvarlar ile aynı tarafta (burada bir gaz dispersiyon borusu), bir oksijen difüzyon sistemi yerleştirin.
- 30 cc şırınga keserek; - (6 mm yüksekliğinde 4) (B, üstten görünüm Şekil 1A, yan görünüm) Örnek olarak, dört yüzük almak. Sonra, tutkal (örneğin, bir naylon hos kesilen ağları gergine) halkalardan biri tarafına beyin dilimleri (Şekil 1B) tutun ve birlikte halkaları yapıştırmak için.
- 2 ° C - dilimleme önce oksijenat (% 95 O 2 /% 5 CO 2) ve dilimleme çözüm soğumasını 0 (adım 1.4).
- Oda sıcaklığında standart ACSF özel kurtarma odasına doldurun. ACSF iyi oksijenli emin olun - kurtarma odasında dilimleri yerleştirmeden önce (20 30 dakika, zaman odası hacmine göre değişebilir). gaz kabarcıkları direkt con gelmez emin olundilimleri ile başvurun ya da onları bozabilir.
- Çizgi vibratome buz buz tepsisi ve dilimleme odasının yarısı üçte biri batık böylece soğuk su ile doldurun. Dikkatle bir oksijen dağıtım sistemi (örneğin, gaz difüzyon taş) ve dilimleme odasında bir sıcaklık probu yani ne öğe bıçak hareketi veya dilim manipülasyon müdahale yerleştirin.
- beyin ayıklanması ve istenen beyin bölgesini diseksiyon için gerekli diseksiyon alanı ve araçları hazırlamak.
Not: Belirli bir beyin bölgesinde bağlıdır gerçekleştirilen tam diseksiyon gibi farklı beyin yapıları farklı düzlemlerde (. Örn koronal, sagital veya yatay dilim) de dilimleme gerektirecektir okudu.- Bir underpad aşağıdaki araçları yerleştirin: decapitation makas, (sıçan kafatasları için daha uygundur gibi rongeurs veya geniş bir ucu olan herhangi bir cerrahi alet,) neşter, küçük düz sivri uçlu makas, damar kanülasyon forseps, kavisli hemostatik forseps, tweezers, spatula, spatula, filtre kağıdı, Petri kabı, tek kenar jilet ve siyanoakrilat yapıştırıcı scooping.
- Sıcaklık 0 ulaştığında - 2 ° C, dilimleme odası (tampon tepsisine) için dilimleme çözüm aktarın.
- izofluran kullanarak kuruma odasında fare anestezisi. Tam miktar, kullanılan odasının boyutlarına göre değişir, ancak küçük bir ayakkabı kutusu kafes için birkaç damla kullanabilir (~ 3-4). render immobile kadar kafes içinde fare bırakın (dokunsal uyaranlara yanıt vermeyen, yaklaşık 15 sn burada tarif edilen koşullar için). kalp durunca önce (hücre canlılığını artırır), ardından hayvan derin anestezi sağlamak başını kesmek için kuyruk ve ayak tutam testleri gerçekleştirin.
Not: Uygun bir gerekçe ile, bazı laboratuvarlar hücre canlılığını mümkün eksitotoksik süreçler kadar en aza indirmek ve geliştirmek amacıyla canlı işten çıkarma gerçekleştirmek için yetki almayı. - diseksiyon.
Not: beyin olmalıdırHızla çıkarılan (<45 sn).- neşter kullanılarak kaudal rostral gelen kafatasının üstündeki yüzeysel cilt kesti.
- başın her iki tarafında saç derisini soyun.
- küçük düz sivri uçlu makas kullanarak, beyincik kaldırmak için lambdoidea'nın sütür boyunca interparietal plaka kesti. oksipitali çıkarın.
- Aynı makas kullanarak, sagital sütür kesti.
- Her parietal kemiklerin altında damar kanülasyon forseps (ya da rongeurs sıçan kafatası kırma varsa) kaydırın ve beyin maruz çekin.
- kavisli hemostatik forseps kullanarak, kırık kemikleri çıkarmak için cımbız veya damar kanülasyon forseps kullanabilir, sonra onları kırmak için frontal kemiklerin çimdik. Kes ve diseksiyon ile müdahale gibi yavaşça mümkün olduğu kadar duramateri çıkarın.
- Beynin altında spatula kaydırın ve yavaşça önceden buz gibi soğuk ACSF ile dolu dilimleme odasının (tampon tepsi) yerleştirmek için kafatasının dışında beyin çekin. beyin edelim2 dakika - 1 için soğumasını.
- , Buz ve daha fazla yüzey teması sağlamak için bazı buzlu su ile bir Petri kabı doldurarak diseksiyon platformu hazırlayın, kapağı ile örtün ve üstüne bir filtre kağıdı yerleştirin. Soğuk ACSF ile filtre kağıdı ıslatın.
- Beyin soğuduktan sonra, buz dolu Petri kabı beyin koyun ve hızlı bir şekilde dilimleme istenen düzlemini elde etmek için uygun diseksiyon.
- çekirdek accumbens (NAC) içeren sagital dilimler elde etmek için, kesme ve hala varsa koku tüberküller ve beyincik kaldırmak için bir tek kenar jilet kullanın. Ardından, 2 sagital kesim gerçekleştirmek - plakasını tutan numune üzerinde yapıştırılmış olacak düz bir yüzey elde etmek için sağ hemisfer lateral sınırından 3 mm (adım 2.8.11 bakınız).
Not: sadece 2 Kesme - her iki yarımkürede gelen NAC içeren dilimleri toplanmasını sağlayacak yarımkürede lateral sınırından 3 mm. Uygun diseksiyon bağlı olacaktırincelenmiştir beyin bölgesi üzerinde. Burada, diseksiyon yapılır, böylece NAC nöronlar sagital beyin dilimleri kaydedilebilir. - Hızla tutkal dilimleme istenen düzlemine göre plaka üzerine beyin düz kesim yüzeyini (örnek tutan plakasına uygulanan siyanoakrilat yapıştırıcı kullanarak). sagital beyin dilimleri adım 2.8.10 bkz edinin.
- Hemen yer ve beyin (güvenlik için numune plaka sabitlenir sadece bıçak yuvasını kurmak) postero-kaudal dilimlenmiş böylece dilimleme odasında plaka tutan numune sabitleyin.
- Uygun dilimleme parametreleri (: - 4, titreşim 9-10 ve dilim kalınlığı 250 mikron hız 3 Malzemelerin belirtilen vibratome için laboratuarda kullanılan parametreler) ile Vibratome ayarlayın.
- dilimleme üzerine, (oda sıcaklığında) kurtarma odasına beyin dilimleri aktarmak için plastik kesilmiş transfer pipet kullanın (adım 2.3). Kurtarma zamanlı çalışma altında nöronal türüne bağlı olarak değişebilir(Tipik olarak 30-90 dakika).
3. Kayıt Mikropipetler ve Rig Hazırlık
- İstenilen mikropipet özelliklerini elde etmek için çektirmenin kullanıcı kılavuzu belirli kurallar bakın.
Not: MSNs için, 3.2-4.0 M? Bir pipet direnç aralığı kullanın. - ACSF oksijen ve / dk 2 ml akışını ayarlamak. imkan takılı bir peristaltik pompa veya vakum hatları kullanılarak vakum ACSF.
- Perfüzyon ısıtıcı kontrolörü açın ve istenilen sıcaklığı elde etmek için sıcaklık ayarlarını (örneğin, 31,8-32,2 ° C).
Not: Sıcaklık kararlılığı odasında sabit bir ACSF seviyesi ve sabit akış hızı hem de sahip bağlıdır. Nöronların birçok biyofiziksel özellikleri yana (örneğin, giriş direnci R i, ayrıca membran direnci, Rm olarak da adlandırılır), bir sabit sıcaklık muhafaza önemlidir, sıcaklığa duyarlıdır. - compu açınter kontrollü amplifikatör, kamera, mikromanipülatör ve mikroskop arka plan ışığı. doku elektrik stimülasyonu gerektiren bir deneyi gerçekleştirmek ise, uyarıcı denetleyicisi ve izolasyon ünitesinde açın.
Not: Diğer Bazı amplifikatörler kullanımdan önce "ısınma" tavsiye üretmektedir, bu yüzden kesin bir işletim prosedürü için kılavuzuna başvurun önerilir. - Kamera yakalama, sinyal edinimi ve amplifikatör yazılımını başlatın.
- Dilim Yerleştirme ve Görselleştirme:
- plastik kesilmiş ucu transfer pipet kullanarak, yavaşça kurtarma odasından bir beyin dilim çizin.
- kayıt odasına transfer pipet yerleştirin ve yavaşça odasının alt astar lamel üzerine pipetin dilim sıkmak.
Not: Sürece hiçbir taşma meydana olduğunda, o banyoya dökülmesini kurtarma odasından bazı ACSF olması zararsızdır. - dilim s konumunu değiştirmek için forseps kullanabiliro istediğiniz alan kayıt odasının tam merkezinde yer alacaktır. mikroskop düşük güç (4X) objektif lens ve konumlandırma yardım için mercek kullanın.
- İstenen pozisyon elde edildikten sonra, odasında (aynı zamanda bir "harp" olarak da bilinir), bir dilim tutun aşağı beyin dilim yerine sabitleyin.
- yüksek güç (40X) objektif lens geçin ve iletişim odasında ACSF ile oluşana dek yavaşça indirin.
- odak noktası haline doku getirmek için ince ayar tekerleğini kullanın. ACSF ile temas halinde, dilim ezmek ve hatta ACSF kondansatöre dökmek neden olabilir odasının alt, astar kapak kayma kırabilir aşırı objektif lens düşürücü olarak mikroskop kaba ayar tekerleğini kullanabilirsiniz yok iken ve zarar.
- Odak doku düzeyinde iken, şekil için hedeflenen bölgedeki hücreler görüyoruz. Ölü hücreler Şekil 1E). Sağlıklı hücre yuvarlak, oval veya eliptik homojen yapılar (Şekil 1E) olarak görünmelidir.
- bir hedef hücre için bak. kayıt mikropipet rehberlik yardımcı olmak amacıyla bilgisayar ekranında işaretleyin. Böyle QCapture gibi yazılımları kullanarak, sol fare tıklaması tutarak hedef hücre etrafında bir kare çizin.
- yerleştirin ve kayıt mikropipet taşımak için ACSF ile temas halinde olduğu objektif lens tarafından oluşturulan koni yeterli yer olacak şekilde objektif lens kaldırın.
- Mikropipet Yerleştirme ve Konumlandırma
- 1 ml şırınga, bir ametal mikroenjektör iğne ve özel bir filtre kullanarak, adımlara bakın, planlı deney (K + tabanlı veya Cs + tabanlı iç çözüm göre önceden hazırlanmış iç çözümü ile bir mikropipet doldurun 1.1., 1.2 kompozisyon ve Malzemeleri). İç yüzden yeterli çözümü kullanınçözüm mikropipet tutucu içinde klorür kaplı gümüş tel elektrot ile temas eder.
Not: gümüş tel elektrot çamaşır suyu içinde iliklerine klorlu edilebilir. Nükleosid trifosfatlar (ATP ve GTP), kullanımdan önce, iç çözeltiye ilave edilebilir. ATP / GTP bozulmasını önlemek için buz üzerinde solüsyon içeren şırınga tutun. - Onlar mikropipet dokusunda ise çıkıp dilim belirsiz gibi mikropipet hiçbir hava kabarcığı olmadığından emin olun.
- Çözelti gümüş klorür kaplı tel elektrot ile temas böylece elektrot tutucu mikropipet yerleştirin.
- koni yıkayıcı mikropipet etrafında bir mühür oluşturacak şekilde pipet kapağını sıkın.
- pipet kir girmesini önlemek için ACSF mikropipet daldırarak önce pozitif basınç uygulayın.
- kilitli pozisyonda headstage g (oda bakan) ve mikro manipülatörü kullanıma yerleştirino batırılır hedefi merkezinin altında kabaca yani odacığa doğru aşağı uide.
- (Yüksek hızda orta ayarlı) mikromanipülatör ile mikropipet hareket ettirirken, mikropipet bulun ve XY ekseninde hücrenin konumu doğru yönlendirmek için bilgisayar ekranı kullanın.
- Bir gerilim adımı uygulayarak mikropipet direncini ölçün (örneğin, 4 mV 100 ms için) Clampex yazılımındaki "Membran Testi" kullanılarak bu tür 'hamam' modu gibi özel yazılım üzerinden manuel veya otomatik olarak yapılabilir, (aynı zamanda 4. adıma bakınız) . Hiçbir hava kabarcığı ya da başka yabancı nesnelerin mikropipet engellemek yapmak için, polietilen boru ile mikropipet tutucuya bağlı hava dolu şırıngayı (örneğin, 30 cc şırınga) ile pozitif basınç uygulayın.
- Mikropipet temizlendikten sonra, el ile veya örneğin, & # özel bir yazılım ile gerçekleştirilebilir sıfıra pipet akımı azaltmak için bir ofset voltajı gerçekleştirmek39; bilgisayar kontrollü amplifikatör komutan 'offset pipet.
Not: Bu fonksiyon banyo ve mikropipet çözümleri (yani, sıvı kavşak potansiyeli 20) arasındaki konsantrasyon farklılıklarından kaynaklanan herhangi bir gerilim telafi edecektir.
- 1 ml şırınga, bir ametal mikroenjektör iğne ve özel bir filtre kullanarak, adımlara bakın, planlı deney (K + tabanlı veya Cs + tabanlı iç çözüm göre önceden hazırlanmış iç çözümü ile bir mikropipet doldurun 1.1., 1.2 kompozisyon ve Malzemeleri). İç yüzden yeterli çözümü kullanınçözüm mikropipet tutucu içinde klorür kaplı gümüş tel elektrot ile temas eder.
4. Membran Testi
Not: Bu adım, malzemeler bahsedilen amplifikatöre için de geçerlidir.
- Bir bilgisayar kontrollü amplifikatör komutanı kullanırken, daima zar testi gerçekleştirmek için gerilim kelepçe moduna ayarlayın.
Not: Membran testi "Banyo" modunda ayarlandığında mühür oluşturulduğunda, membran testi mikropipet direnci ve mühür direnci ölçümü sağlar. - Membran rüptürü sonra, için "Hücre" modu (olarak da adlandırılır erişim direnci, R a) seri direnç (R s) böylece R i ve membran kapasitans (C p) membran testi yapabilirsiniz anahtarı (adım 5.8)elde edilmek.
5. Son Yaklaşım, Mühür oluşumu ve Tüm hücre Yapılandırma Edinme
- ince odak tekerleğini kullanarak, yavaş yavaş mikropipet düşürürken aşağı odaklanarak başlar. Her zaman ilk aşağı odaklanmak ve daha sonra odak düzlemine aşağı mikropipet indirin. Bu mikropipet ucu aniden dilim içine nüfuz sağlayacaktır.
- Mikropipet dilim yüzeyi ile temasa geldiğinde, orta-düşük moda mikromanipülatör hızını yavaşlatır.
- Yavaşça yaklaşım yolundan herhangi bir enkaz temizlemek için pipet sahibine bağlı hava dolu şırınga ile hafif pozitif basınç uygulayın.
- XYZ kontrol düğmeleri ile dönüşümlü olarak, ya da her ikisi XZ eksenleri Z ekseni topuzu dönüşü ile değiştirilir nerede (mikromanipülatör modeli izin veriyorsa) diyagonal yaklaşarak ya hücreyi yaklaşın. İkinci yöntem, doku dikey sıkıştırma önleyecektir.
Not: Burada amaçdilime az zarar verilerek hücre yaklaşmak. Mikropipet bir çukur görünür hücre (Şekil 2) (mikropipet ucu ile uygulanan pozitif basınç neden olduğu hücre yüzeyinin yuvarlak discoloring) yeterince yakın olduğunda. - Girinti (Şekil 2-1) göründüğünde, conta (Şekil 2-2) oluşturmak için pipet tutucusu emme borusuna bağlı olan tüp aracılığıyla zayıf ve kısa emiş uygulanır. membran testi izleme tutun.
Not: Bir kısmi mühür oluşturulmuştur ise (<1 GΩ), ( "gigaohm mühür" veya "gigaseal" mühür oluşumunu kolaylaştırmak ve gigaohms direnci ulaşabilir (bilgisayar kontrollü amplifikatör komutan) tutma potansiyeli düşürerek olumsuz akımları enjekte> 1 - 5 GΩ). mühür yüksek direnç (> 1 GΩ) kaydedilen sinyal, hem sınır gürültü kirliliği ve mekanik istikrara katkıda bulunacakyama. - Bir gigaseal oluşturan iken, membran rüptüre sonra ani değişiklikleri önlemek amacıyla potansiyel (V dinlenme) dinlenme fizyolojik mümkün olduğunca yakın hücrenin tutma potansiyelini getirmek için bilgisayar kontrollü amplifikatör komutanı kullanın. Örneğin, MSNs genellikle gerilim-kelepçeli -70 veya -80 mV (: -70 ile -90 mV fizyolojik V geri kalanı) yer almaktadır.
- gigaseal oluştuktan sonra, manuel veya otomatik olarak, hızlı ve yavaş kapasitansının dengelenmesi. Böyle 'Cp Hızlı' için Multiclamp komutanı, basın 'Auto' Yavaş ve 'Cp "olarak bir bilgisayar kontrollü amplifikatör komutanı kullanıyorsanız.
- Mühür istikrarlı ve 1 GΩ (ya da en az 10 enjekte - İstediğiniz membran potansiyeli hücreyi tutmak için 20 PA) üzerinde kalırsa plazma zarı yırtılmasına 5.5 gibi (Şekil 2 aynı tüp aracılığıyla kısa ve güçlü emiş uygulamak -3).
Not: Bu birkaç deneme sürebilir. İyi bir membran rüptürü w elde edilirtavuk emme yeterince güçlü rüptüre zar zar ya da hücrenin büyük bir bölümünde çizmek için (Kayıt sırasında R s bir artışa neden olabilir) mikropipet, ama zayıf yeteri kadar tıkar kalmaması yapılır. - bu yama kaybına yol açabilir olarak başarılı bir tam hücre konfigürasyonu elde edildikten sonra, düzenli olarak önemli sürüklenme için mikropipet değerlendirmek için konumu ve doğru izlenmesi. Drift genlik çeşitli faktörlere göre değişebilir, örneğin, teçhizat montaj kalitesi ve headstage çekerek kuvvetleri. İdeal olarak, sürüklenme neredeyse varolmayan olmalıdır.
- Membran testinde "Hücre" moduna geçiş yaparak, bu tür Ar i R S ve C p hücrenin farklı parametrelerini görüntülemek. Kayıt sırasında bu parametreleri izleyin.
Not: Tüm bu parametreler (bölüm 4. adımı "Membran testi" bölümüne bakınız) hücre ve hücre tipleri ilk sağlık durumunu değerlendirmeye yardımcı olabilir. - inci kezYukarıdaki adımları e tamamlanan planlama membran gerilimine (örneğin, aksiyon potansiyeli ateşleme) değişiklikleri ölçmek için (örn, EPSCs, iPSCs) akımları ölçmek veya akım kelepçe moduna geçmek için gerilim kelepçe modunda kalır. İkincisi için, istenilen membran geriliminde hücreyi tutmak için pozitif veya negatif akım enjekte (manuel rehber amplifikatör bakın bu adımı gerçekleştirmek için).
Sonuçlar
Sıcaklık, kolay deneyi tarafından kontrol edilen bir unsur, iyon kanalları ve reseptörleriyle biyofiziksel özelliklerini etkiler ve böylece sinaptik sonrası akımlar (PSC) (EPSC ve iPSCs) ve sivri ortaya çıkarmak için nöronların özelliği dalga biçimi. Şekil 3 ve Şekil 4, nöronal ateşleme üzerinde sıcaklığın etkisini sırasıyla uyarılmış EPSCs (eEPSCs) eğimini göstermektedir. Ateşleme paterni (Şekil 3) zamanlanmış ve koordineli açılması ve belirli voltaj kapılı iyon kanallarının kapatılması ile şekillenir (yani 1. başak için gecikme, numara, frekans ve aksiyon potansiyeli dalga biçimini başak) (Na +, Ca 2 + ve K +), sıcaklığa duyarlı bir işlem. ortalama başak sayısı, sıcaklık ile artar kadar 3 göstermektedir. çivi frekanslı Her ne kadar burada açıklanan deney şartlarında (MSNs kayıtları) belirtilmelidir ki,NCY subphysiological sıcaklığında (28 ° C) 'de değiştirilebilir görünmüyor, önemli ölçüde sıcaklık fizyolojik olarak ilgili seviye (32 ° C) ulaştığında artar. Şekil 4A, bir örneğini göstermektedir kadar eEPSCs eğimi, yaygın olarak kullanılan bir parametredir sinaptik gücü değerlendirmek, sıcaklıkla artar.
Tüm hücre konfigürasyonunun conta durumuna geçiş, R s bir şekilde etkin bir membran deliğinden deneyi, örneğin, kontrol edilebilir, ancak, R, yavaş yavaş, genellikle s kayıt sırasında artar. Bu kayıt esnasında pipet tıkanma çeşitli kontrol edilemeyen olaylar, örneğin, zar yeniden kapama ya da enkaz sonucu olabilir. Bu yama tehlikeye atabilir rağmen, hafif bir emme uygulayarak membran yeniden açmak için bir girişim, bazen istikrarlı R s korumaya yardımcı olabilir. Her durumda, R s değişiklikler ark olabilir, çünküçalışılan elektrik sinyali dalga ter, dikkatli izlenir ve PSC (voltaj-kelepçe mod) kaydederken. Şekil 4, özellikle gösterir olmalıdır, R s artar (Şekil 4B), glutamat reseptör-aracılı akımların amplitüdü (eEPSCs ) (Şekil 4C, D) azalır. R s değişiklikleri (örneğin, bu laboratuar)% 15'ini Genellikle, deneyci ancak bazı laboratuvarlar% 20 değişikliğinden bunu, veri atın. Bu kriter makalenin yöntem bölümünde belirtilmelidir.
Tanımlanmış bir nöron için R i sıcaklık, hücre sağlığı ve yama kalitesi dahil olmak üzere birçok faktör tarafından etkilenir. R i azaldığında Özellikle, PSC genlikleri veya nöronların kapasitesi de azalır ani oluşturmak için. Örneğin, Şekil 4E R i önemli ölçüde değişiklik yok o zaman, inci gösteriyorbaşak e numarası (Neuron 1) nispeten sabit kalması; ve Rı ı arttıkça, hem ani sayısı artar (Neuron 2). % 10 değişiklik önyargı verilerine yeterlidir Bu nedenle ve benzer R s R i dikkatle takip edilmelidir.
Yukarıda tarif edildiği gibi, Ri kayıtları sırasında kontrol edilmesi ya da sıcaklık, Rs izlemek için kritiktir ve. Örneğin, bağlı değişiklikler olabilir çalışma (PSC'ler ya da ateşleme) altında sinyal değişiklikleri (ya da bir kontrol eksikliği) Bu faktörlerin ziyade deneysel manipülasyon etkisi, örneğin, ön vs sonrası etkileri gözlenmiştir ilaç banyo uygulaması.

Şekil 1. Ismarlama Kurtarma Odası (AD) ve Sağlıklı ve Ölü Nöronlar (E) Gösterilen 400X'lik bir beyin Dilim bir resmi. AD)Özel bir kurtarma odasına yapmak için işlem adımı 2.1 tarif edilmektedir. NAC medial kabuk vs 400X sağlıklı (kırmızı oklar örneklerini gösteren bir beyin dilim MSNs) ölü nöronların (mavi oklar) E) Resim. bazı hücreler sağlıklı olduğu belirtilen, ancak onların küresel yönü (yıldız ile kırmızı oklar) istediğiniz gibi onlar kadar sağlıklı olmayabilir belirtmek unutmayın. Nihai sağlık durumu V dinlenme ve Ar dayalı olarak değerlendirilir i tam hücreli yapılandırmasını elde ettikten sonra. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Mikropipet inci yeterince yakın olduğunda. Bir gigaseal Edinip Tüm hücre Yapılandırma Kurmak Temel Usul Adımlar tasvir Şekil 2. Diyagrame hücre, plazma zarı (adım 1, Yaklaşım) 'de bir çukur oluşturmak mikropipet ve plazma membranı arasında sıkı bir kişi oluşturmak için kısa ve hafif bir emme uygulamak. Düzgün gerçekleştirildiği takdirde, iletişim güçlendirecek ve direnç artırmak ve 1 GΩ (gigaseal) veya daha fazla (adım 2, Mühür oluşumu) ulaşacak. mühür istikrarlı ve 1 GΩ üstünde sonra, plazma zarı (adım 3, Tüm hücre konfigürasyonu) yırtmak için kısa ve güçlü emiş uygulanır. tüm hücre konfigürasyonu sağlanması sitoplazma ve mikropipet iç arasındaki sürekliliği sağlayacaktır. Ayrıntılar için protokol adım 5,1-5,8 bakın. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
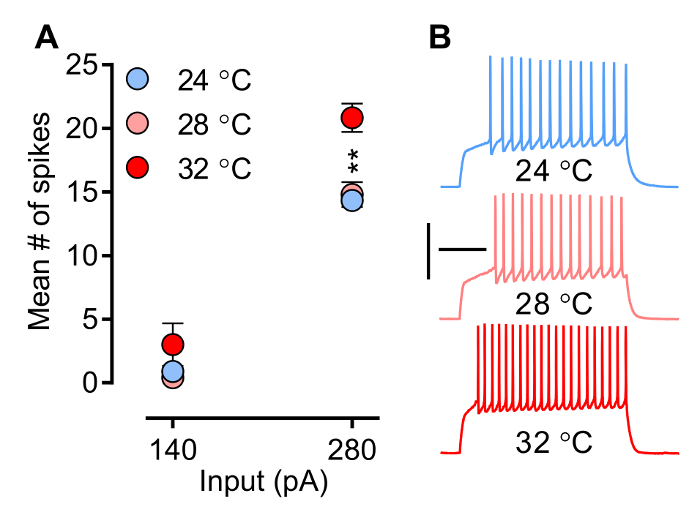
Şekil 3. Nöronal yakma (Kendinden Uyarılma) Akım-midye değerlendirilir p Modu. Burada, mevcut adımlar önceden tanımlı ve artan serisi membran gerilimi değişiklikler ortaya çıkarmak için verilir ve böylece aksiyon potansiyelleri tetikler. A) Ortalama başak sayısı NAC 280 pA sıcaklığında. B) Numune izleri ile artar üç farklı sıcaklık değerlerinde orta kabuk MSNs (; 28 ° C, n = 5; 24 ° C, n = 9 ve 32 ° C, n = 6). Kayıt odasındaki sıcaklık, doğrudan sivri uç sıklığını etkiler. Ancak, başak frekans subphysiological sıcaklıkta değiştirilemez görünmüyor, ancak sıcaklık 32 ° C, fizyolojik ilgili sıcaklığa ulaştığında, önemli ölçüde artar olduğunu unutmayın. Nöronlar -80 mV yapılmaktadır. Iki yönlü ANOVA: etkileşim, p <0.0001; Sıcaklık etkisi, p = 0.0041; Post hoc testleri: 24 ° C ve 28 ° C, her ikisi de 32 ° C ile önemli ölçüde farklıdır ** p <0.01. Veri ortalama ± SEM olarak temsil edilir. Kalibrasyon: 200 msn, 50 mV.jove.com/files/ftp_upload/54024/54024fig3large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.

Tek bir NAC kabuk MSN den eEPSC genlik Elektrik Sinyal Altında Çalışma. A) Örnek Waveform Üzerine Sıcaklığın R s ve R i Şekil 4. etkisi. 24 ila 28 ° C ve 32 ° C sıcaklığa arttırılması eEPSCs eğimini arttırır. eEPSCs eğim bu sıcaklığa bağlı sıcaklık değişiklikleri hızlı bir şekilde meydana edin. Burada, eEPSCs eğimi voltaj kelepçe modunda değerlendirilir. Kalibrasyon: 5 ms, tek NAC kabuk MSN den eEPSCs yamaç 100 pA BD) Örnek.. R s artar (B) eEPSCs eğimi R bir fonksiyonu olarak eEPSC eğimi (C). D) korelasyon analizi azaldıkças. Pearson R = -0,5717, p <0.0001. Nöronlar voltaj kelepçeli -80 mV. E'de) ani oluşturmak için nöronun yetenek R i etkisini gösteren iki nöronların izlerin Örnek bulunmaktadır. Nöronlar akım kenetlenmiş ve -80 mV düzenlenen vardır. Kalibrasyon:. 200 msn, 50 mV Bu rakamın büyük halini görmek için buraya tıklayınız.
Tartışmalar
Bu protokol beyin dilimleri nöronlarda tüm hücre yama-kelepçe deneyler temel işlemi anlatılır. Bununla birlikte, bu tekniğin karmaşık, potansiyel ve hassasiyet tam olarak bu makalede açıklanan edilemez. Burada, en temel adımları tasvir ve başarılı ve titiz bütün hücre kayıtları elde etmek için kontrol edilmelidir önemli parametreleri altını çalıştık. Daha fazla teorik öğrenme, birçok kitap ve makale beyin dilimleri 3,21-24 ve hücre canlılığı geliştirmek amacıyla 25-27 kullanılan çözümler rafine yöntemler hem tam hücreli yama-kelepçe kayıt yayınlanmıştır. rutin uygun kayıtları gerçekleştirmek için yoğun uygulama yoluyla teknik becerilerin iyileştirilmesi gerekmektedir. sinaptik fonksiyonlar ve içsel excitabi değişiklikler hakkında önemli bilgiler veren adımlar doğru uygulama söz ile Bununla birlikte, hücreler yamalı olabilir saat otopsi,vasıflı.
Genel olarak, dikkatli bir şekilde, hem ACSF ve iç mikropipet çözümleri, beyin diseksiyonu her adım hazırlamak başarılı tam hücreli yapılandırmasını elde, dilimleme ve titiz ve tarafsız verileri elde önemi yanında yoğun pratik gerektirir. Öncelikle, sağlıklı beyin dilimleri oluşturmak için kritik öneme sahiptir. Kısaca, beyin (ideal olarak <45 saniye), bir düşük sıcaklık bakım hızlı diseksiyon - dilimleme ise (0 2 ° C) ve uygun bir dilimleme çözeltiler, tüm hücre sağlığı sağlanmasında önemli bir rol oynar. Dilimleme çözümler laboratuarları ve incelenecek hücre tipine ve / veya beyin bölgesine göre arasında farklılık söz çekicidir. NAC veya dorsal striatum dilimleme, laboratuar ve diğerleri gibi sükroz bazlı çözeltiler 34 yüksek Mg2 + olarak 28-33, ancak diğer yöntemler de kullanılabilir eksitotoksik işlemleri, en aza indirmek için kesme çözüm kynurenic asiti kullanmak, / düşük Ca 2 + çözüm 35, vb. Bunlar sadece birkaç örnek ve (yaşı nedeniyle, örneğin) eksitotoksik süreçlere beyin veya beyin bölgenin hassasiyetine göre ayarlanabilir. Çözüm ve hücre canlılığı ile ilgili daha fazla bilgi edinmek için, 25-27 bakınız. Beyin-omurilik sıvısı taklit ve dilimleme sırasında meydana mümkün eksitotoksik süreçler kadar en aza indirir, böylece sonuçta, anyon, katyon ve diğer ilaç konsantrasyonu (örneğin, askorbat, glutamat reseptör antagonistleri) dilimleme çözüm oluşturur belirlenir. Bu makalede sunulan protokol NAC veya beyin dilimleri dorsal striatum MSNs kayıt yaparken rutin yazarların önceki çalışmalarda 28-31 kullanılan standart çözümler anlatılır. Bundan başka, her iki ACSF ve iç mikropipet çözümleri ozmolaritenin doğru ayarlama başarılı bir conta oluşumu ve bütün hücre Conf devamı için kritik olaniguration. içi pipet çözüm ekstrasellüler çözüm bir konsantrasyon degrade oluşturmak için, ACSF ozmolarite iç mikropipet çözümleri için daha yüksek olmalıdır. İdeal olarak, aradaki fark, 10, 30 mOsm aralığında olabilir.
Başarılı bir tam hücreli yapılandırmasını sağlanması verimli kayıtları yürütmek için önemli bir adımdır. Pipet banyosuna yerleştirilir kez İlk olarak, pipet kapasitans ayarlanabilir. Otomatik ayarlar genellikle düzgün ayarlanmış olsa da, uygun yapılmayan zaman bu hücreye zarar verebileceğinden dikkatli hücre kapasitans hızlı ve yavaş ayarlamaları kullanılması tavsiye edilir. İkinci olarak, zar zarının önemli bir açılış yol açacak rüptürü, ve böylece hücre içi ve içi mikropipet çevrenin arasında iyi bir iletişim sağlamak için gerekli kısa membran emme olduğunu. Bu, R s kayıt boyunca nispeten sabit kalır sağlayacaktır. Cs-tabanlı mikropipet çözümü kullanıyorsanız,membran istirahat potansiyeli hemen tüm hücre yapılandırma kurulması üzerine değerlendirilmelidir (adım 5.8). Gerçekten de, hücre içinde Cs + `nin difüzyon membranıdır dinlenme potansiyelinin kaybolmasına neden olur. Uygun dinlenme potansiyelini belirlemek için, sıvı kavşak potansiyeli 20 değerlendirilmelidir. Ancak, deneyci (adım 5.8 sonra) membran kırma sonra gözlenir dinlenme potansiyeli rapor ve sıvı kavşak potansiyeli ayarlamak için tercih edebilirsiniz. Her durumda, bu eşyanın yöntemi bölümünde belirtilmelidir. Tüm hücre konfigürasyonunun oluşturulmasından sonra, CP da elde edilebilir ve hücre sağlık ve / veya hücre tipi değerlendirmek için dolaylı bir parametre olarak kullanılabilir. Üçüncü olarak, kayıtlar başladı, diğer parametreler sıkı kontrol edilmelidir. Nöronal uyarılabilirliği değerlendirilirken kontrol edilmesi gereken kritik faktörler sıcaklığı, R, S ve R, I bulunmaktadır.
GibiYukarıda belirtildiği gibi, R, G ve K p hücre sağlığı ve / veya hücre tipi göstergesi olabilir. Örneğin, plazma membranı, bir yalıtkan olarak hareket birlikte membran kapasite oluşturur (hücre içi ve hücre dışı çözeltiler farklı bileşiminden elde edilen) şarj ayırır. kapasitansı yüksek membran yüzeyi (nöronal özgü) büyük. Daha sonra şaşırtıcı değil belirli nöronal tip sergi C p ve R i aynı kapsama alanında (matematiksel olarak C p ile ilgili). Rs pipet boyutuna doğrudan bağlı olan, ve bu nedenle genellikle kalite ya da zar açıklığı boyutu göstergesidir. Kısaca, tam-hücre konfigürasyonu kurulması üzerine, sitoplazma mikropipet çözeltisi ile elektriksel olarak sürekli ve dış ortama tamamen izole edilmiş hale gelir. R s (ya da Ra) Curren için direnç kaynaklıT sitoplazması pipetle akmasına. Bazı Kayıt koşullarına (örneğin, akım kelepçe modu veya voltaj kapılı iyon akımlarının gerilim-kelepçe kayıt) için, R s düzgün telafi edilmelidir (Ref bakın. 3,21-24 veya uygun R ın tazminat amplifikatör el kılavuzu) .
Şekil 4'te tarif edildiği gibi, önemli ölçüde elektrik sinyali dalga biçimi, örneğin, EPSC genlik etkileyebileceği için, Rs özellikle önemlidir. Bununla birlikte, R s dikkatli bir gözlemlenen etkilerin off-line yorumların için izlenmesi gerekir. Durumda zar, bu durumda R ın artar ve önyargı çalışma kapsamında elektrik sinyali dalga (Şekil 4B-D) mikropipet ucu tıkanma ya da zarın yeniden kapanması oluşabilir düzgün rüptüre olmamıştır. Özetle, çok sayıda sorunlar kaydederken karşılaştı olabilir ve bu genellikle üç kategoriye giren i) doku-ilişkiliÖrneğin, zayıf diseksiyonu, ACSF ozmolarite ve hipoksi uyumsuzluk hücre ölümlerini artırdı; ii) ekipman ile ilgili, örneğin, gürültü ve topraklama problemleri, sıcaklık kontrolü, dilim ve mikropipet konumlandırma, vb.; ve iii) veri yorumlama, örneğin, değişiklikler elektriksel dalga değiştiren parametrelerindeki değişiklikler (R i, R s, sıcaklık, Şekil 3 ve 4) yerine deneysel sonucu gibi verileri kutuplama istenmeyen deneysel eserler sonucu olabilir gözlenen manipülasyonlar.
Beyin dilimleri bütün hücre kayıt deneyime bağlı plastisite değerlendirmek için güçlü bir tekniktir, ancak bu yaklaşım verilerin yorumlanması sınırlar. Özellikle, bütün hücre kayıt tekniğiyle üç önemli kısıtlamaları vardır: (i) spesifik protein (örneğin, iyon kanalları) ayırt edilemez bir fonksiyonu ve ekspresyon seviyelerindeki değişiklikler; (Ii) Bunun nedeniteknik, bu gözlenmektedir iyonik akımların veya değişikliklerin doğru alt hücresel yerleşimi sağlamaz tüm zardan akımı (ya da önemli bir kısmını) değerlendirir; bazı olgular geliştirmek veya eksprese edilmesi için ve (iii) bütün hücre yapılandırmasının invaziv hücre içi moleküler makine bozulmasına ve böylece gerekli olan hücre içeriğinin diyaliz yol açar ve. Diyaliz kaçınmanın bir yolu keskin elektrot kayıtları veya delikli yama tekniği 3,21,23 kullanmaktır. Bu nistatin olarak ikinci, gözenek oluşturucu antibiyotik molekülleri ile ilgili olarak, pipet solüsyonuna ilave edilebilir. Bu gözeneklerin oluşumu hücre içinde ikinci haberci mekanizmaları bozmadan akımların kayıt sağlayacaktır. Bununla birlikte, son nanoteknoloji gelişmeler ve nanoelectrodes 36 gelişmesi nöronal kayıtları geliştirmek için güçlü araçlar sunar. Developmen altında hala nörobilim Böyle teknolojik ilerlemet ve şimdi klasik ile şimdiye kadar erişilebilir değildi alt hücresel bölmeleri içinde iyon kanallarının işlevlerini sağlam hücre içi ortam tutarak, bizim ulaşmak yani minimal invaziv ile patch-kelepçe ve hücre içi kayıtları gerçekleştirme imkanı koyarak ve araştırıyor patch-kelepçe elektrotlar 37.
Açıklamalar
yazarların hiçbiri rakip çıkarları veya çakışan çıkarları var.
Teşekkürler
Bu araştırma UT Güneybatı başlangıç fonları (SK) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
Referanslar
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. . Electrical Properties of Cells-Patch Clamp for Biologists. , (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır